Сполуки сірки. Ступені окислення сірки в з'єднаннях. Формули сполуки сірки. Сірка. Сірководень. сульфіди
Сірка, її фізичні і хімічні властивості. Біологічне значення сірки, її застосування (демеркуризацію).
Cера в природі
самородна сірка
PbS - свинцевий блиск
Cu 2 S - мідний блиск
ZnS - цинкова обманка
FeS 2 - пірит, сірчаний колчедан, котяче золото
H 2 S - сірководень (в мінеральних джерелах і природному газі)
CaSO 4 * 2H2 O- гіпс
MgSO 4 * 7H2 O - гірка сіль (англійська)
Na 2 SO 4 * 10 H 2 O - глауберової сіль (мирабилит)
Фізичні властивості
Тверда кристалічна речовина жовтого кольору, нерозчинні у воді, водою не змочується (плаває на поверхні), t ° кип = 445 ° С.
Одне з особливих фізичних властивостей сірки -флотация, Здатність дрібного порошку сірки спливати, тоді, як її великі кристали тонуть у воді. Справа в тому, що сірка не змочується водою, і її частинки тримаються на поверхні води за рахунок прилипли до них дрібних бульбашок повітря.Це властивість використовують при відділенні самородної сірки від домішок. Руду розмелюють, заливають водою, а знизу продувають повітрям, сірка спливає, а домішки залишаються на дні.аллотропия
Для сірки характерні кілька аллотропних модифікацій, але найбільш відомі видозміни:ромбическая (Кристалічна) , моноклінна (Голчаста) і пластична .
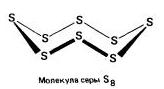
Ромбическая (a - сірка) - S 8
t ° пл. = 113 ° C; ρ = 2,07 г / см 3. Найбільш стійка модифікація.
Моноклінна (b - сірка) - S 8
темно-жовті голки,t ° пл. = 119 ° C; ρ = 1,96 г / см3. Стійка при температурі понад 96 ° С; при звичайних умовах перетворюється на ромбічну.
Пластична S n
коричнева гумоподібний (аморфна) маса. Нестійка, при затвердінні перетворюється на ромбічну.
ОТРИМАННЯ ПЛАСТИЧНОЇ сірки
Будова атома сірки
Розміщення електронів по рівням і подуровням
основний стан
1s 2 2s 2 2p 6 3s 2 3p 4
Розміщення електронів по
орбиталям (останній шар)ступінь
окисленнявалентність
В основному стані
Перше збуджений стан
Друге збуджений стан
отримання сірки
1. Промисловий метод - виплавлення з руди за допомогою водяної пари.
2. Неповне окислення сірководню (при нестачі кисню).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакція Вакенродера
2H 2 S + SO 2 = 3S + 2H 2 O
Хімічні властивості сірки
Сірка - окислювач S 0 + 2ē→ S -2 | сірка - відновник: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Взаємодія сірки зіусіма лужними і лужноземельними металами, міддю, ртуттю, сріблом без нагрівання: 2 Na + S→ Na 2 S ДОСВІД S + Hg = HgS Ртуть має високу летючість. Її пари отруйні. Ця реакція лежить в основі видалення та знешкодження ртуті, наприклад з розбитого медичного термометра. Місця, з яких не можна витягти крапельки ртуті, засипають порошком сірки. Сірка і ртуть вступають в реакцію при зіткненні. В результаті утворюється хімічно інертне і нешкідливу речовину. Цей процес називається демеркуризації 2. Взаємодія сіркиc іншими металами (крімAu, Pt) при підвищеній t °: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS ДОСВІД Cu + S t
→
CuS ДОСВІД 3. Взаємодія сірки з деякими неметалами з утворенням бінарних сполук: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Взаємодія сірки c киснем: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Взаємодія сіркиc галогенами (крім йоду): S + Cl 2→ S +2 Cl 2 ** Взаємодія сірки з кислотами - окислювачами: S + 2H 2 SO 4 (конц)→ 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Реакції диспропорціонування: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
застосування
Вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і т.д.
Домашнє завданняпараграф 21; вправи 1, 3, 4 стор. 99-100.
додаткові зхаданія
Закінчите рівняння реакцій, р асставьте коефіцієнти методом електронного балансу, вкажіть окисник, відновник.
№2. Здійсніть перетворення за схемою:
Це цікаво...
- Вміст сірки в організмі людини масою 70 кг - 140 г.
- У добу людині необхідно 1 г сірки.
- Сірої багаті горох, квасоля, вівсяні пластівці, пшениця, м'ясо, риба, плоди і сік манго.
- Сірка входить до складу гормонів, вітамінів, білків, вона є в хрящової тканини, в волоссі, нігтях. При нестачі сірки в організмі спостерігається крихкість нігтів і кісток, випадання волосся.
Слідкуйте за своїм здоров'ям!Чи знаєте ви..
- Сполуки сірки можуть служити лікарськими препаратами;
- Сірка - основа мазі для лікування грибкових захворювань шкіри, для боротьби з коростою. Тіосульфат натрію Na 2 S 2 O 3 використовується для боротьби з нею.
- Багато солі сірчаної кислоти містять кристалізаційну воду: ZnSO 4 × 7H 2 O і CuSO 4 × 5H 2 O. Їх застосовують як антисептичні засоби для обприскування рослин і протруєння зерна в боротьбі з шкідниками сільського господарства.
- Залізний купорос FeSO 4 × 7H 2 O використовують при анемії.
- BaSO 4 застосовують при рентгенографічних досліджень шлунка і кишечника.
- Алюмокалієві галун KAI (SO 4) 2 × 12H 2 O - кровоспинний засіб при порізах.
- Мінерал Na 2 SO 4 × 10H 2 O носить назву «глауберової сіль» на честь відкрив його в VIII столітті німецького хіміка Глаубера І.Р.Глаубер під час своєї подорожі раптово захворів. Він нічого не міг їсти, шлунок відмовлявся приймати їжу. Один з місцевих жителів направив його до джерела. Як тільки він випив гірку солону воду, відразу почав їсти. Глаубер досліджував цю воду, з неї викристалізувалася сіль Na 2 SO 4 × 10H 2 O. Зараз її застосовують як проносне в медицині, при фарбуванні хлопчато- паперових тканин. Сіль також знаходить застосування у виробництві скла.
- Деревій має підвищену здатність витягувати з грунту сірку і стимулювати поглинання цього елемента з сусідніми рослинами.
- Часник виділяє речовину - альбуцид, їдке з'єднання сірки. Ця речовина запобігає ракові захворювання, уповільнює старіння, попереджає серцеві захворювання.
Підгрупа халькогенов включає в себе сірку - це другий з елементів, який здатний утворювати велику кількість рудних родовищ. Сульфати, сульфіди, оксиди інші сполуки сірки є дуже широко поширеними, важливими в промисловості і природі. Тому в даній статті ми розглянемо, якими вони бувають, що собою являє сама сірка, її проста речовина.
Сірка і її характеристика
Даний елемент має таке положення в періодичній системі.
- Шоста група, головна підгрупа.
- Третій малий період.
- Атомна маса - 32,064.
- Порядковий номер - 16, протонів і електронів стільки ж, нейтронів також 16.
- Відноситься до елементів-неметалів.
- У формулах читається, як "ес", назва елемента сірка, латинське sulfur.
У природі зустрічаються чотири стабільних ізотопу з масовими числами 32,33,34 і 36. Даний елемент шостий за поширеністю в природі. Відноситься до біогенних елементів, так як входить до складу важливих органічних молекул.
Електронна будова атома
Сполуки сірки зобов'язані своєю різноманітністю особливостям електронної будови атома. Воно виражається наступною конфигурационной формулою: 1s 2 2s 2 2p 6 3s 2 3p 4.
Наведений порядок відображає лише стаціонарний стан елемента. Однак відомо, що якщо атому повідомити додаткову енергію, то можливо расспаріванія електронів на 3р і 3s-підрівні, з подальшим черговим переходом на 3d, який залишається вільним. В результаті змінюється не тільки валентність атома, але і всі можливі ступені окислення. Їх кількість значно збільшується, так само, як і число різних речовин за участю сірки.
Ступені окислення сірки в з'єднаннях
Можна виділити кілька основних варіантів даного показника. Для сірки це:
З них найбільш рідко зустрічається S +2, інші розосереджені повсюдно. Від ступеня окислення сірки в з'єднаннях залежить хімічна активність і окислювальна здатність всього речовини. Так, наприклад, з'єднання з -2 - це сульфіди. У них розглядається нами елемент типовий окислювач.
Чим вище значення ступеня окислення в з'єднанні, тим більш вираженими окислювальними здібностями буде володіти речовина. У цьому легко переконатися, якщо згадати дві основні кислоти, які утворює сірка:
- H 2 SO 3 - сірчиста;
- H 2 SO 4 - сірчана.
Відомо, що остання набагато стабільніше, сильне з'єднання, що володіє у високій концентрації дуже серйозною здатністю до окислення.
проста речовина
Як проста речовина сірка являє собою жовті красиві кристали рівною правильної видовженої форми. Хоча це лише одна з її форм, тому що існує дві основні цієї речовини. Перша, моноклінна або ромбічна - це і є жовте неспроможна розчинятися у воді, а лише в органічних розчинниках. Відрізняється крихкістю і красивою формою структури, представленої у вигляді корони. Температура плавлення - близько 110 0 С.
Якщо ж не пропустити проміжний момент при нагріванні такої модифікації, то можна вчасно виявити інший стан - пластичну сірку. Вона являє собою гумоподібний тягучий розчин коричневого кольору, який при подальшому нагріванні або різкому охолодженні знову переходить в ромбічну форму.
Якщо ж говорити про хімічно чистої сірки, отриманої шляхом багаторазових фильтраций, то вона являє собою яскраво-жовті невеликі кристалики, тендітні і зовсім нерозчинні в воді. Здатні займатися при контакті з вологою і киснем повітря. Відрізняються досить високу хімічну активність.

Знаходження в природі
У природі зустрічаються природні родовища, з яких видобуваються сполуки сірки і вона сама як проста речовина. Крім того, вона міститься:
- в мінералах, рудах і гірських породах;
- в організмі тварин, рослин і людини, так як входить до складу багатьох органічних молекул;
- в природних газах, нафти і вугіллі;
- в горючих сланцях і природних водах.
Можна назвати кілька найбагатших на сірку мінералів:
- кіновар;
- пірит;
- сфалерит;
- антимоніт;
- галенит та інші.
Велика частина одержуваної сьогодні сірки йде на сірчанокисле виробництво. Ще одна частина використовується для медичних цілей, сільського господарства, промислових процесів виробництва речовин.
Фізичні властивості
Їх можна описати кількома пунктами.
- У воді не розчинна, в сероуглероде або скипидарі - добре розчиняється.
- При тривалому терті накопичує негативний заряд.
- Температура плавлення становить 110 0 С.
- Температура кипіння 190 0 С.
- При досягненні 300 0 С переходить в рідину, легко рухлива.
- Чисте речовина здатна самозайматися горючі властивості дуже хороші.
- Сама по собі запах практично не має, однак водневі сполуки сірки видають різкий запах тухлих яєць. Так само, як і деякі газоподібні бінарні представники.
Фізичні властивості даної речовини були відомі людям з давніх-давен. Саме за свою горючість сірка і отримала таку назву. У війнах використовували задушливі і отруйні випаровування, які формуються при згорянні цього з'єднання, як зброю проти ворогів. Крім того, кислоти за участю сірки також завжди мали важливе промислове значення.

Хімічні властивості
Тема: "Сірка і її сполуки" в шкільному курсі хімії займає не один урок, а кілька. Адже їх дуже багато. Це пояснюється хімічною активністю даної речовини. Вона може проявляти як окисні властивості з більш сильними відновниками (метали, бор та інші), так і відновні з більшістю неметалів.
Однак, незважаючи на таку активність, тільки з фтором взаємодія йде при звичайних умовах. Для всіх інших потрібно нагрівання. Можна позначити кілька категорій речовин, з якими здатна взаємодіяти сірка:
- метали;
- неметали;
- луги;
- сильні окислюють кислоти - сірчана і азотна.
Сполуки сірки: різновиди
Різноманітність їх буде пояснюється неоднаковим значенням ступеня окислення основного елемента - сірки. Так, можна виділити кілька основних типів речовин за цією ознакою:
- з'єднання зі ступенем окислення -2;
Якщо ж розглядати класи, а не показник валентності, то даний елемент утворює такі молекули, як:
- кислоти;
- оксиди;
- солі;
- бінарні сполуки з неметалами (сірковуглець, хлориди);
- органічні речовини.
Тепер розглянемо основні з них і наведемо приклади.

Речовини зі ступенем окислення -2
Сполуки сірки 2 - це її конформації з металами, а також з:
- вуглецем;
- воднем;
- фосфором;
- кремнієм;
- миш'яком;
- бором.
У цих випадках вона виступає в ролі окислювача, так як всі перераховані елементи більш електропозитивні. Розглянемо особливо важливі з них.
- Сірковуглець - CS 2. Прозора рідина з характерним приємним ароматом ефіру. Є токсичним, вогненебезпечних та вибухає речовиною. Використовується як розчинник, причому для більшості видів масел, жирів, неметалів, нітрату срібла, смол і каучуків. Також є важливою частиною у виробництві штучного шовку - віскози. У промисловості синтезується у великих кількостях.
- Сірководень або сульфід водню - H 2 S. Газ, який не має забарвлення і солодкий на смак. Запах різкий, вкрай неприємний, нагадує тухле яйце. Отруйний, пригнічує дихальний центр, так як пов'язує іони міді. Тому при отруєнні їм настає задуха і смерть. Широко використовується в медицині, органічного синтезу, виробництві сірчаної кислоти, а також в якості енергетично вигідного сировини.
- Сульфіди металів знаходять широке застосування в медицині, в сернокислом виробництві, отриманні фарб, виготовленні люмінофорів і інших місцях. Загальна формула - Me x S y.

З'єднання зі ступенем окислення +4
Сполуки сірки 4 - це переважно оксид і відповідні йому солі і кислота. Всі вони є досить поширеними сполуками, що мають певне значення в промисловості. Можуть виступати і як окислювачі, але частіше виявляють відновні властивості.
Формули сполуки сірки зі ступенем окислення +4 наступні:
- оксид - сірчистий газ SO 2;
- кислота - сірчиста H 2 SO 3;
- солі мають загальну формулу Me x (SO 3) y.
Одним з найпоширеніших є або ангідрид. Він являє собою безбарвна речовина, що володіє запахом горілої сірники. У великих скупченнях формується при виверженні вулканів, його в цей момент легко визначити по запаху.
Розчиняється в воді з утворення легко розкладається кислоти - сірчистої. Поводиться, як типовий утворює солі, в які входить у вигляді сульфит-іона SO 3 2-. Цей ангідрид - основний газ, який впливає на забруднення навколишнього атмосфери. Саме він впливає на освіту У промисловості використовується в сернокислом виробництві.
З'єднання, в яких у сірки ступінь окислення +6
До таких відносяться, перш за все, сірчаний ангідрид та сірчана кислота зі своїми солями:
- сульфатами;
- гідросульфатами.
Так як атом сірки в них знаходиться в надзвичайно окислення, то і властивості цих сполук цілком зрозумілі. Вони сильні окислювачі.
Оксид сірки (VI) - сірчаний ангідрид - являє собою летючу безбарвну рідину. Характерна риса - сильна влагопоглотітельной здатність. На відкритому повітрі димить. При розчиненні в воді дає одну з найсильніших мінеральних кислот - сірчану. Концентрований розчин її є важкою маслянистої злегка жовтуватою рідиною. Якщо ж ангідрид розчинити в сірчаної кислоті, то вийде особливе з'єднання, зване олеум. Він використовується в промисловості при виробництві кислоти.
Серед солей - сульфатів - велике значення має такі сполуки, як:
- гіпс CaSO 4 · 2H 2 O;
- барит BaSO 4;
- мирабилит;
- сульфат свинцю та інші.
Вони знаходять застосування в будівництві, хімічних синтезах, медицині, виготовленні оптичних приладів і стекол і навіть харчової промисловості.
Гидросульфати знаходять широке застосування в металургії, де використовуються в якості флюсу. А також саме вони допомагають переводити багато складних оксиди в розчинні сульфатні форми, що використовується у відповідних виробництвах.
Вивчення сірки в шкільному курсі хімії
Коли найкраще відбувається засвоєння учнями знань про те, що таке сірка, які її властивості, що представляє собою з'єднання сірки? 9 клас - найкращий період. Це вже не самий початок, коли для дітей все нове і незрозуміле. Це середина у вивченні хімічної науки, коли основи, закладені раніше, допоможуть повністю вникнути в тему. Тому на розгляд даних питань виділяється саме друге півріччя випускного класу. При цьому вся тема ділиться на кілька блоків, в яких окремо варто урок "З'єднання сірки. 9 клас".
Це пояснюється їх численністю. Також окремо розглядається питання про виробництво сірчаної кислоти в промисловості. В цілому на дану тему відводиться в середньому 3 години.
А ось сірки виносяться на вивчення тільки в 10 класі, коли розглядаються питання органіки. Також порушуються вони і на біології в старших класах. Адже сірка входить до складу таких органічних молекул, як:
- тіоспирти (Меркаптани);
- білки (третинна структура, на якій відбувається формування дисульфідних містків);
- тіоальдегідів;
- тіофеноли;
- тіоефіри;
- сульфоновиє кислоти;
- сульфоксиди та інші.
Їх виділяють в особливу групу сераорганических з'єднань. Вони мають важливе значення не тільки в біологічних процесах живих істот, але і в промисловості. Наприклад, сульфоновиє кислоти - основа багатьох лікарських препаратів (аспірин, сульфаніламіди або стрептоцид).
Крім того, сірка постійний компонент таких з'єднань, як деякі:
- амінокислоти;
- ферменти;
- вітаміни;
- гормони.
При кімнатній температурі сірка вступає в реакції тільки з ртуттю. З підвищенням температури її активність значно підвищується. При нагріванні сірка безпосередньо реагує з багатьма простими речовинами, за винятком інертних газів, азоту, селену, телуру, золота, платини, іридію і йоду. Сульфіди азоту і золота отримані непрямим шляхом.
Взаємодія з металами
Сірка виявляє окисні властивості, в результаті взаємодії утворюються сульфіди:
Взаємодія з воднем відбувається при 150-200 ° С:
H 2 + S = H 2 S.
Взаємодія з киснем
Сірка горить у кисні при 280 ° С, на повітрі при 360 ° С, при цьому утворюється суміш оксидів:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Взаємодія з фосфором і вуглецем
При нагріванні без доступу повітря сірка реагує з фосфором, вуглецем, проявляючи окисні властивості:
2P + 3S = P 2 S 3;
Взаємодія з фтором
У присутності сильних окислювачів проявляє відновні властивості:
S + 3F 2 = SF 6.
Взаємодія зі складними речовинами
При взаємодії зі складними речовинами сірка поводиться як відновник:
S + 2HNO 3 = 2NO + H 2 SO 4.
реакція диспропорціонування
Сірка здатна до реакцій диспропорціонування, при взаємодії з лугом утворюються сульфіди і сульфіти:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. отримання сірки
З самородні руд
При нагріванні піриту без доступу повітря
FeS 2 = FeS + S.
Окисленням сірководню при нестачі кисню
2H 2 S + O 2 = 2S + 2H 2 O.
З газів, що відходять металургійних і коксових печей, при нагріванні в присутності каталізатора
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. сірководень
Водневе з'єднання сірки - сірководень H 2 S . Сірководень - ковалентное з'єднання. Будова молекули аналогічна будові молекули води, атом сірки знаходиться в стані sp 3-гібридизації, проте на відміну від води молекули сірководню не утворюють між собою водневих зв'язків. Атом сірки менш електронегативний, ніж атом кисню, має більший розмір і, як наслідок, меншу щільність заряду. Валентний кут HSH становить 91,1 °, довжина зв'язку H - S дорівнює 0,133 нм.
Фізичні властивості
При звичайних умовах сірководень - безбарвний газ, з сильним характерним запахом тухлих яєць. Т пл = -86 ° С, Т кип = -60 ° С, погано розчинний у воді, при 20 ° С в 100 г води розчиняється 2,58 мл H 2 S. Дуже отруйний, при вдиханні викликає параліч, що може привести до смертельного результату. У природі виділяється в складі вулканічних газів, утворюється при гнитті рослинних і тваринних організмів. Добре розчинний у воді, при розчиненні утворює слабку сірководневу кислоту.
Хімічні властивості
У водному розчині сірководень має властивості слабкої двухосновной кислоти:
H 2 S = HS - + H +;
HS - = S 2 + H +.
Сірководень горить в повітрі блакитним полум'ям. При обмеженому доступі повітря утворюється вільна сірка:
2H 2 S + O 2 = 2H 2 O + 2S.
При надмірному доступі повітря горіння сірководню призводить до утворення оксиду сірки (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SО 2.
Сірководень має відновлювальні властивості. Залежно від умов сірководень може окислюватися в водному розчині до сірки, сірчистого газу та сірчаної кислоти.
Наприклад, він знебарвлює бромную воду:
H 2 S + Br 2 = 2HBr + S.
взаємодіє з хлорним водою:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Струмінь сірководню можна підпалити, використовуючи діоксид свинцю, так як реакція супроводжується великим виділенням тепла:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Взаємодія сірководню з сірчистим газом використовується для отримання сірки з газів, що відходять металургійного і сірчанокислого виробництва:
SO 2 + 2H 2 S = 3S + 2H 2 O.
З цим процесом пов'язано освіту самородної сірки при вулканічних процесах.
При одночасному пропущенні сірчистого газу і сірководню через розчин лугу утворюється тіосульфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Сірководень при нормальних умовах являє собою безбарвний і дуже токсичний газ з характерним запахом тухлих яєць.
Для його отримання в лабораторних умовах зазвичай додають розведену соляну кислоту до сульфіду:
Інший спосіб отримання сірководню полягає в додаванні холодної води до сульфіду алюмінію:
Сірководень, отриманий таким способом, виявляється чистіше.
Сірководень - ковалентное з'єднання. Його молекули мають вигнуту структуру, подібну структурі молекул води (див. Розд. 2.2). Однак на відміну від води молекули сірководню не утворюють між собою водневих зв'язків. Справа в тому, що атом сірки менш електроотріцателен, ніж атом кисню, але має більший розмір. Тому атом сірки має набагато меншу щільність заряду, ніж атом кисню. Через відсутність водневих зв'язків сірководень має нижчу температуру кипіння, ніж вода. Відсутність водневих зв'язків в сірководні пояснює також його погану розчинність в воді.
У водному розчині сірководень має властивості слабкої двухосновной кислоти:
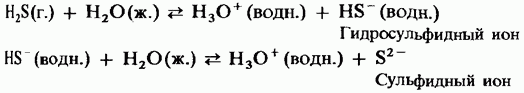
Сірководень горить в повітрі блакитним полум'ям. При обмеженому доступі повітря горіння сірководню супроводжується виділенням вільної сірки, яка конденсується на холодній поверхні судини:
При надмірному доступі повітря горіння сірководню призводить до утворення діоксиду сірки:
Сірководень має відновлювальні властивості. Наприклад, він знебарвлює бромную воду і відновлює іони до іонів
Сірководень як двухосновная кислота може утворювати два ряди солей - сульфіди і гідросульфіди (див. Вище). Сульфіди лужних металів розчиняються у воді з утворенням лужних розчинів. Це відбувається в результаті гідролізу:
Нерозчинні сульфіди інших металів можна осаджувати з водних розчинів солей цих металів, пропускаючи через розчин сірководень. Наприклад, при пропущенні сірководню через розчин, що містить іони утворюється чорний осад сульфіду
Ця реакція використовується в якості аналітичної проби на сірководень.
оксиди сірки
Сірка утворює кілька оксидів, у тому числі найбільше значення мають два: діоксид сірки і триоксид сірки
Діоксид сірки є щільним безбарвний газ з різким задушливим запахом. У лабораторних умовах його можна отримати, спалюючи сірку в повітрі або в кисні, додаючи теплий розведений розчин кислоти до якої-небудь сульфітної солі або нагріваючи концентровану сірчану кислоту з міддю:
Діоксид сірки-кислотний оксид. Він легко розчиняється у воді, утворюючи сірчистийкислоту. Ця кислота іонізується лише частково і, отже, являє собою слабку кислоту:
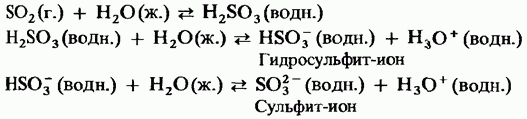
При пропущенні газоподібного діоксиду сірки через розчин гідроксиду натрію утворюється сульфіт натрію. Сульфіт натрію, реагуючи з надлишком діоксиду сірки, утворює гідросульфіт натрію Ці реакції аналогічні реакції діоксиду вуглецю з вапняною водою.
І газоподібний діоксид сірки, і його водний розчин є відновниками. Наприклад, газоподібний діоксид сірки відновлює оксид з утворенням сульфату а сірчиста кислота відновлює -іон до іона
Діоксид сірки в промислових умовах отримують при випалюванні на повітрі сірки або сульфідних руд і використовують як проміжний продукт у процесі отримання сірчаної кислоти (див. Гл. 7). Діоксид сірки застосовується в целюлозної промисловості, для відбілювання тканин, а також для обробки фруктів і овочів при тривалому зберіганні.
Діоксид сірки грає істотну роль в забрудненні атмосфери і особливо в освіті кислотних дощів. В атмосфері він окислюється до триоксиду сірки:
При нормальних умовах цей процес протікає досить повільно, але в присутності каталізатора він може значно прискорюватися, подібно до того, як це відбувається в контактному процесі отримання сірчаної кислоти. Невеликі кількості сполук заліза і марганцю, що містяться в атмосфері, мабуть, каталізують окислення діоксиду сірки. Утворений триоксид сірки реагує з вологою повітря, і тому з'являються хмари, які несуть кислотні дощі (див. Також гл. 12).
Твердий триоксид сірки є поліморфним з'єднанням. Дві його найважливіші форми Перша з них являє собою тример з циклічною структурою (рис. 15.24, а); кристали прозорі. має ациклічний полімерну структуру (рис. 15.24, б); вона існує у вигляді голчастих кристалів. Температура плавлення . У присутності вологи поступово перетворюється в Обидві форми киплять при 45 ° С. Пари триоксида сірки складаються з ізольованих симетричних плоских молекул.
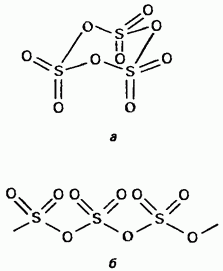
Мал. 15.24. Триоксид сірки, Ациклічна структура, б - Ациклічна структура.
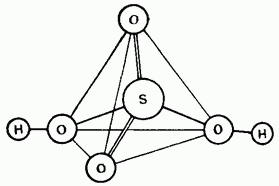
Мал. 15.25. Структура молекули сірчаної кислоти.
У лабораторних умовах триоксид сірки отримують нагріванням сульфату
Триоксид сірки має сильно виражені кислотні властивості. Він екзотермічно реагує з водою, утворюючи сірчану кислоту:
Триоксид сірки - сильний окислювач. Наприклад, він окисляє бромоводород до вільного брому.
Сірчана кислота
Сірчана кислота - безбарвна масляниста їдка рідина. Це один з найважливіших промислових хімічних продуктів. Її промислове отримання за допомогою контактного процесу і застосування описані в гл. 7.
Нерозбавлена сірчана кислота являє собою ковалентное з'єднання. Її молекули мають тетраедричну будова (рис. 15.25).
Сірчана кислота кипить і розкладається при 340 ° С, утворюючи триоксид сірки і водяної
Висока температура кипіння і велика в'язкість сірчаної кислоти, мабуть, обумовлені наявністю водневих зв'язків між атомами водню і атомами кисню сусідніх молекул.
Сірчана кислота - сильна двухосновная кислота. У воді вона повністю іонізується, утворюючи гідросульфат- і сульфат-іони:
Сірчана кислота бере участь у всіх реакціях, характерних для кислот. Вона реагує з металами, утворюючи сульфати цих металів і водень, в реакціях з карбонатами утворює сульфати, діоксид вуглецю і воду, а в реакціях з підставами і лугами утворює сульфати або гидросульфати.
Концентрована сірчана кислота дуже бурхливо реагує з водою. З цієї причини слід завжди розбавляти сірчану кислоту, наливаючи її в воду, а не навпаки. Ця кислота гігроскопічна, т. Е. Здатна поглинати вологу з повітря. Тому її використовують для осушення газів, які не реагують з нею, пропускаючи їх через сірчану кислоту. Спорідненість сірчаної кислоти до води настільки велике, що сірчана кислота може служити дегидратирующим агентом; під дією концентрованої сірчаної кислоти:
блакитні кристали пентагідрату сульфату утворюють безводний сульфат
вуглеводи, наприклад сахароза, обугливаются:
папір теж обвуглюється під дією концентрованої сірчаної кислоти, що обумовлено дією кислоти на целюлозні волокна;
етанол перетворюється в етилен:
(Дегідратація етанолу за допомогою сірчаної кислоти, що проводиться в контрольованих
умовах, призводить до утворення етоксіетан (діетилового ефіру), і ця реакція використовується для отримання етоксіетан в промислових масштабах);
суміш хлоробензола і тріхлоретаналя (хлораля) піддається дегідратації (див. розд. 16.3).
Концентрована сірчана кислота - сильний окислювач. Вона окисляє метали і неметали. наприклад
Як інші приклади, що ілюструють окисні властивості концентрованої сірчаної кислоти, вкажемо окислення іонів до іонів, а також бромід-іонів до вільного брому в наступних реакціях:
Нарешті, сірчана кислота використовується як сульфірующій агент в органічній хімії (див. Гл. 17).
Сульфати, сульфіти і Тіосполуки
Сульфат-іон має тетраедричних структуру, подібну структурі молекули сірчаної кислоти.
Солі. Сульфати утворюються в реакціях розведеної сірчаної кислоти з металами, їх оксидами, гідроксидами або карбонатами. За винятком сульфатів барію і інші сульфати розчинні у воді. Сульфат кальцію має невелику розчинність в воді. Сульфати зазвичай стійкі до нагрівання. Винятками в цьому відношенні є тільки сульфати заліза. Наприклад, сульфат при нагріванні розкладається з утворенням оксиду заліза:
Для виявлення сульфат-іонів в будь-якому розчині туди додають водний розчин хлориду барію. При наявності в досліджуваному розчині сульфат-іонів в результаті відбувається утворення білого осаду сульфату барію:
Сульфати мають багато важливих застосувань. Наприклад, сульфат магнію (англійська сіль, гірка сіль) використовується для виробництва вибухових речовин, для виготовлення сірників і вогнестійких тканин. Насичений розчин цієї солі використовується в медичній практиці як протизапальний засіб.
Тіосульфат натрію може розглядатися як аналог сульфату натрію, в якому один атом кисню заміщений на атом сірки. Серед подібних Тіосполуки слід згадати ще одне - тіоціанат калію. Він являє собою сірчаний аналог цианата калію. Тіоціанат калію можна отримати, сплавляючи ціанід калію з сіркою:
Тіоціанат калію використовується в якісному аналізі для виявлення іонів Якщо в досліджуваному розчині присутні ці іони, додавання до нього розчину тіоціанат калію призводить до появи криваво-червоного забарвлення внаслідок утворення комплексного іона
Отже, повторимо ще раз!
1. При переміщенні до нижньої частини VI категорії якості її елементів поступово змінюються від неметалічних до металевих.
2. Елементи VI групи мають здатність з'єднуватися з воднем і реакційноздатними металами, утворюючи з'єднання, в яких вони мають ступінь окислення -2.
3. Кисень має високу електронегативність і властивостями сильного окислювача.
4. Озон є ще більш сильним окислювачем, ніж кисень.
5. Кисень відіграє надзвичайно важливу роль в біологічних системах, беручи участь в процесах дихання і метаболічних процесах (обміну речовин).
6. Кисень утворює з іншими сполуками бінарні сполуки, оксиди різноманітних типів:

7. Пероксид водню є сильним окислювачем.
8. Сірка у вільному вигляді може існувати в декількох енантіотропних формах.
9. Для отримання сірки з підземних покладів застосовується процес Фраша, в якому використовується стиснене повітря і перегрітий пар.
10. Сірка утворює сполуки, в яких вона знаходиться в станах зі ступенями окислення +2, +4, +6 і -2.
11. Сірководень - слабка двухосновная кислота і відновник.
12. Газоподібний діоксид сірки і його водний розчин-відновники.
13. Триоксид сірки має сильно виражені кислотні та окисні властивості.
14. Сірчана кислота сильна двухосновная кислота, осушувач, дегідратувальний агент і сильний окислювач.
15. Молекули сірчаної кислоти і сульфат-іони мають тетраедричних структуру.