28 g silikon kislorod bilan birikganda. Silikon kislorod aralashmalari
Kremniy.Obschaya harakteristika.Osnovnoe uglerod farqli o'laroq: yo'qligi n vodorod (silaneler) bilan soedineniyah.Silitsidy.Soedineniya aloqa, Oksidlanish va gidroliz.Tetraftorid va kremniy tetraklorür, kremniy gidroliz.Geksaftorosilikaty.Kislorodnye soedineniya.Oksid (IV) .Silikagel.Kremnevaya kislota.Silikaty.Rastvorimost va gidroliz.Prirodnye minerallaridan va aluminosilikatlar tseolity.Kremniyorganicheskie soedineniya.Silikony siloksany.Ispolzovanie va tibbiyotda kremniy aralashmalar.
Silikon (Silicium), Si, davriy tizimning IV guruhining kimyoviy elementi; atom raqami 14, atom massasi 28.086. Silikon shuningdek, elektronning sp3 hibridizatsiyasini ham namoyish etadi
orbitallar. Silikon atomining tashqi elektron qatlamida 3d-
orbitallar (Si: 3s23p23d0),
Kisloroddan keyin silikon qobiqdagi eng keng tarqalgan element hisoblanadi. Erkin holatda uglerod farqli o'laroq, silikon tabiatda topilmaydi. Eng keng tarqalgan birikmalari silikon oksidi (IV) SiO2 va silikatik kislota tuzlari, silikatlardir. Er qobig'ining qobig'ini hosil qiladi. O'simliklar va hayvonlarda silikon birikmalari mavjud. kremniy kimyoviy xususiyatlari tomonidan, uglerod kabi, u bir nometall, ammo, kamroq seziladi nemetallichnost bo'lib, u katta atom radiusi ega, chunki
Silikon. deyarli barcha metallar bilan birikmalar hosil qiladi sisitsidlar (Bi, Tl, Pb, Hg bilan birikmalar topilmadi). Kimning tarkibi 250 silicides, (mesi, MeSi2, Me5Si3, Me3Si, Me2Si boshq.) Umuman klassik valencies javob bermaydi olingan. Silisidlar refrakterlik va qattiqlikda farq qiladi; buyuk amaliy ahamiyati ferrosilikon (maxsus eritmalar sm termoyadroviy yilda reductant. Ferro) va MoSi2 molibden silisitlerin bor (elektr isitgichlar, gaz maqbara qanotlari va shunga o'xshash. d.).
Silan Silisidlarga hidroklorik kislota ta'sirida silikonning eng oddiy vodorod birikmasidir sila SiH4:
Silan - o'z-o'zidan yoqib yuboradigan yoqimsiz hid bilan zaharli gazdir. havo
Ular reaktiv va kuchli kamaytiruvchi agentlar.
xona haroratida suv bilan reaksiyaga kirish:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetraflorid Silikon elementik flor bilan silikon dioksidni ftorinatsiyalash orqali ishlab chiqariladi.
florlama jarayoni 2 uchun 1-bosqich dan asosiy flor, bir ortiqcha yo'naltirish, olov reaktor ikki bosqichda amalga oshiriladi.
Texnik natija - bu silikonni yuqori hosil va mahsulot sifati bilan uzluksiz rejimda ishlab chiqarishdir.
Silikon tetraflorid SiF4 gidroflorik (gidroflorik) kislota shishasiga ta'sir qiladi:
Na2SiO3 + 6HF 2NaF + SiF4 + 3H2O
Silikon kislorod aralashmalari
Kremniyning eng muhim kislorod tarkibi - kristalli modifikatsiyalari bo'lgan silikon dioksid SiO2 (silika).
Past haroratli modifikatsiyani (1143 K ga qadar) kvarts deyiladi. Kvartsning piezoelektrik xususiyatlari mavjud. Kvartsning tabiiy navlari: toshli kristall, topaz, ametist. Silikaning navlari kalsedon, opal, agat,. jasper, qum.
Silika kimyoviy jihatdan chidamli; faqat flor, hidroflorik kislota va gidroksidi eritmalar ta'sir ko'rsatadi. U osongina stakan holatiga (kvars shisha) kiradi. Kuvarsli shisha mo'rt, juda kimyoviy va termal chidamli. Tegishli SiO2 kremniy kislotasi ma'lum tarkibga ega emas. Odatda, kremik kislota xH20-ySiO2 sifatida qayd etiladi. Olingan silikalar: H2SiO3 (H2O-SiO2) - metasilicic (Tri-oksokremnievaya), H4Si04 (2H20-Si02) - orthosilicic (Tetra-oksokremnievaya), H2Si2O5 (H2O * SiO2) - dimetakremnievaya.
Silisik kislotalar kam eruvchan moddalardir. Silikon metalloid tabiati muvofiq kam elektrolitlar deb zaif uglerod H2SiO3 N2SOz bilan solishtirganda.
Silikat kislotalarga mos keladigan tuzlar - suvda silikatlar erimaydi (gidroksidi metall silikatlardan tashqari). Eriydigan silikatlar tenglama bilan gidrolizlanadi
2SiO3 - + H20 = Si2O52- + 20H-.
Eriydigan silikatlarning konsentrlangan eritmasiga suyuq shisha deyiladi. Natriy va kaltsiyning odatiy oyna shishasi silikati Na20-CaO-6Si02 tarkibiga kiradi. Bu reaktsiya orqali olinadi
Turli xil silikatlar (aniqrog'i, koksosilikatlar) ma'lum. ma'lum bir namuna tuzilishi oksosilikatov kuzatilmoqda: barcha bir-biriga bir kislorod atomi orqali bog'langan tetrahedra Si04, iborat. eng keng tarqalgan birikmasi tarkibiy birliklar sifatida zanjirlar, bantlar, qafas va iskala (4-shakl) bilan birlashtirilishi mumkin tetrahedrons (Si2O76-), (Si3O9) 6 (Si40l2) 8-, (Si6O1812-) bor.
eng muhim tabiiy silikatlar bo'lgan, masalan, talk (3MgO * H20-4Si02) va asbest (SmgO * H2O * SiO2). SiO2 da bo'lgani kabi, shisha (amorf) holat ham silikatlarga xosdir. Shisha nazorat ostida kristalizatsiyasi bilan kristal holatini (sitals) olish mumkin. Chaqaloqlar kuchayib borishi bilan ajralib turadi.
Silikatlardan tashqari aluminosilikatlar ham tabiatda keng tarqalgan. Aluminosilikatlar - silikon atomlarining bir qismi trivalent Al bilan almashtiriladigan kvadrosikatlar kvadratchalar; Masalan, Na12 [(Si, Al) 04] 12.
Silisik kislota uchun H2SiO3 kislotasining tuzlari darhol ta'sirlanganda kolloid holat aniqlanadi. Ba'zi hollarda (masalan, qizdirilganda) kremniy kislotaning (chap) kolloid eritmalari silicik kislotaning shaffof, bir hil jelga o'xshash massa jeliga aylantirilishi mumkin. Gels SiO2 molekulalari tomonidan hosil bo'lgan keng, juda yumshoq strukturaga ega bo'lgan yuqori molekulyar birikmalardir, ularning bo'shliqlari H2O molekulalari bilan to'ldiriladi. Suvsizlashtiruvchi silika jelida silika jeli olinadi - yuqori adsorbsionlikka ega bo'lgan gözenekli bir modda.
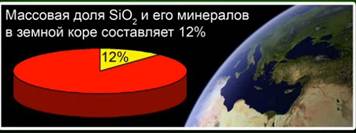
Silikon oksidi (IV) (silika) - er qobig'idagi eng keng tarqalgan birikma bo'lib, uning tarkibidagi har xil minerallarning 12% ni tashkil etadi. Kristalli va amorf silika bilan ajralib turadi. Silikon oksid (IV) uchun eng oddiy formula SiO2 bo'ladi. Atom kafesida kristallanadi.
1) kristalli kremniy - kvarts minerallari va uning navlari (tosh kristall, kalsedon, agat, jasper, chakka) shaklida; kvarts qurilish va silikat sanoati sohasida keng qo'llaniladigan kvarts qumlari asosini tashkil etadi.
2) amorf silika - SiO2 nH2O opal mineral tarkibi shaklida; amorf silikaning tuproq shakllari diatomit, Tripoli (infuzorli er); Sun'iy amorf suspenziya silika misoli natriy metasilikatidan olingan silika gelsidir:
Na2SiO3 + 2HCI = 2NaCl + H2SiO3
Silika gel ishlab chiqilgan sirtga ega, shuning uchun namlik yaxshi yetsin.
Silika gel pH\u003e 5-6 da silisli kislota (nSiO2 · mH2O) ning supersaturatsiyalangan eritmasidan hosil qilingan quritilgan jeldir. Qattiq hidrofilik sorbent.
Ishga kirishish
Ushbu gidroksidi metall silikat eritmalarini kislotalab chiqishi bilan erishiladi, keyin hosil bo'lgan jelni yuvish va quritish:
Silik kislotasi. SiO2 bir qator silisli kislotalarning anhidrididir
Kremniy kislotasi tetrahedral strukturaviy birliklardan qurilgan (har bir bunday birlikda silikon atomi tetraedrning markazida, kislorod atomlari esa tepada joylashgan). Zanjirlar bilan birikib, strukturaviy aloqalar yanada barqaror polisilikon kislotalarni hosil qiladi:
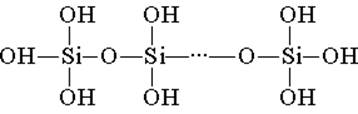
Bunday birikmaning tarkibi formuladan (H2SiO3) n bilan ifodalanishi mumkin. Biroq, kremniy kislotasi odatda H2SiO3 formulasi bilan ifodalanadi. H2SiO3 - kislota juda zaif, suvda ozgina eriydi. Isitgichda u osonlik bilan karbonat kislotasi bilan ajralib chiqadi:
Barcha silik kislotalar juda zaif (ko'mirdan zaif).
Silikatlar. Barcha silik kislotalarning tuzlari silikatlar deyiladi, ammo, odatda, o'quv adabiyotlarida silikatlar metaxialik kislota tuzlarini bildiradi. Ularning tarkibi odatda elementlarning oksidlari birikmalariga o'xshash formuladan iborat. Masalan, CaSiO3 kaltsiy silikatini CaO × SiO2 sifatida ifodalash mumkin.
R2O ning natriy yoki kaliy oksidi bo'lgan R2O × nSiO2 tarkibidagi silikatlar eriydigan shisha deb ataladi va ularning joyga jamlangan suvli eritmasiga suyuq shisha deyiladi. Eng muhimi, natriy eruvchan shisha.
Atmosferada karbonat angidrid (IV) silikat kislota tuzlaridan ajralib chiqqandan so'ng, havoda turganda silikatlarning eritmalari xiralashadi.
Silik kislotasi suvda deyarli erimaydi - bu xususiyat SiO32 ioniga sifatli reaktsiya sifatida ishlatiladi.
Silikatlar gidroksidi yoki karbonatlar bilan silika bilan eritiladi:
Sililik kislota eruvchanligi va uni tarqatish darajasi bir necha omillarga bog'liq, ularning eng muhimi silisli dioksidning o'zgarishi, uning tarqalishi darajasi va harorati. Silikatsiyani suv bilan silkitganda, eruvchanlik muvozanati bir necha soat ichida, kvarts uchun esa ko'p oylar va hatto yillar talab qilinadi.
TABIIY SILIKATLAR (tabiiy silikatlar, naturik silikatlar, F. silikatlar tabiatlari va silikatoz tabiiylari) - minerallar sinfi, silika, izo- va heteropolikkritik kislotalarning tuzlari. Tabiiy silikatlarning ulushi er qobig'ining massasining 75 foizini va minerallarning 25 foizini tashkil etadi. Tabiatda 700 dan ortiq tabiiy silikatlar ma'lum bo'lib, ular orasida eng muhim tosh hosil qiluvchi minerallar (feldspar, piroksen, amfibollar, mikroslar va boshqalar)
Aluminosilikatlar - murakkab anionlar kremniy va alyuminiy o'z ichiga olgan tabiiy va sintetik silikatlar guruhi. Murakkab anionlarga misollar: -, -, 2 -. Na +, K +, Mg2 +, Ca2 + va ba'zan Ba2 + va Li + katyonlar sifatida harakat qiladi.
Tabiiy aluminosilikatlar eng ko'p uchraydigan minerallar bo'lib, ular er qobig'ining massasining 50 foizini tashkil qiladi. Ularga feldspat (albit, ortoklaz, anortit), gil minerallar va mika kiradi.
Zeolitlar - Ular kaltsiy, natriy, kaliy, bariy va boshqa ba'zi elementlarning suvli aluminosilikatlari. Zeolitlar guruhi qirqdan ziyod minerallarni o'z ichiga oladi, bu tarkibi (ayniqsa, kristal gidratdagi suv molekulalarining soni) va fizik-kimyoviy xususiyatlar jihatidan farq qiladi. Ammo bu minerallar guruhining deyarli barcha vakillari umumiy xususiyatga ega: ular yaxshi sorbentlar, ion almashinuvi xususiyatlariga ega, individual ionlarning harakatlanishini o'zgartirishga va molekulyar elekalar sifatida ishlashga qodir. Va yaqinda bu minerallar umuman kutilmagan foydalanishni topdi - ular qishloq xo'jaligida foydalanishni boshladilar.
Organosilikon birikmalari - molekulalarda silikon va uglerod atomlari orasidagi bog'lanish mavjud. Organosilikon birikmalari ba'zan silikon deb ataladi, lotincha silikon nomidan "silikon". Yog'lar, polimerlar, kauchuklar, kauchuklar, silikon suyuqliklar va emulsiyalar ishlab chiqarish uchun organosilikon birikmalari ishlatiladi. Organosilikon birikmalari kosmetika, maishiy kimyo, bo'yoq va laklarda, deterjanlarda ishlatiladi. Umumiy organik birikmalarga asoslangan mahsulotlardan organosilon birikmalariga asoslangan mahsulotlarning o'ziga xos xususiyati, qoida tariqasida, yuqori ishlash ko'rsatkichlari va xususiyatlarini, shuningdek, insondan foydalanish xavfsizligini ta'minlaydi. Silikon polimerlarni pishirishda qoliplarni tayyorlash uchun ishlatish mumkin. Organosilikon birikmalarini va suyuqliklarni polimerizatsiya qilish odamlar uchun xavfsizdir va ekstraktsiyani talab qilmaydi.
Siloksanlar - molekula ichida o'zgaruvchan silikon va kislorod atomlarini o'z ichiga olgan aralashmalar. Eng yuqori molekulyar og'irlikdagi siloksanlar - polyorganosiloksanlar; qarang Silikon polimerlar.
Silikonlar (polyorganosiloksanlar) - oksidlangan yuqori molekulyar og'irlikdagi organosilikon birikmalari, bu erda R = organik guruh (metil, etil yoki fenil). Hozirgi vaqtda ushbu ta'rif juda kamdan-kam holatlarda saqlanib, polimer-dioksanlar (masalan, PMS turi silikon yog'lari, NGL tipidagi suv reduktsiyachilari yoki past molekulyar vazn SKTN kauchuklari) va hatto organosilikon monomerlari (turli silanlar) "silikonlar" ga qo'shilib, "silikonlar" silikon. "
Metall silikon  Kristalli silikon
Kristalli silikon
Silikon (Si). Bu kimyoviy element Yer qobig'ining tarkibiy qismlarining 1/4 qismidir. Kvarts, toshli kristall, qum, loy, granit, mika, asbest - bularning barchasi kremniyning kimyoviy birikmalari
Silikon qidiruv element (amfoterik) va metall va metall bo'lmagan xususiyatlarga ega bo'lishi mumkin. U ham metallar, ham metall bo'lmagan kimyoviy birikmalar hosil qilishi mumkin.
Sof silikon - kulrang rangli kimyoviy oddiy moddalar, qattiq, refrakter va mo'rt. Kristalli silikon Metall nashrga ega va yarimo'tkazgich sanoatida keng qo'llaniladi (yarimo'tkazgich).
Silikon kristall holatda singib ketishi mumkin ( kristalli silikon) va amorf davlatda ( amorf silikon). Kristalli silikon eritilgan metallda amorf silikon eritmasini sovutish yo'li bilan hosil bo'ladi. O'z navbatida, kristalli silikon juda mo'rt materialdir va osongina amorf kukunga aylanadi. Shunday qilib, amorf silikon kristalli silikon kristallari fragmentidir.
Erkin holatda silikon olish juda qiyin. Uning sanoat ishlab chiqarishi kimyoviy formulasi SiO2 bo'lgan kvartsni qayta tiklash bilan bog'liq, reaktsiya reaktsiyasi issiq koks (uglerod) bilan ishlab chiqariladi.
SiO 2 + C → CO 2 + Si
Laboratoriyada sof kremniy silikat qumidan metall magnezium bilan quyidagi reaksiya yordamida kamayadi:
SiO 2 + 2Mg → Si + 2MgO.
Ushbu reaksiya davomida amorf silikonning jigarrang kukunlari hosil bo'ladi. Isitish vaqtida, chang asta-sekin gidroksidi konsentrlangan eritmasi (masalan, natriy gidroksidi NaOH) bilan reaksiyaga kirishib,
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2 - hosil bo'lgan murakkab modda - suyuq shisha ham deyiladi.
Qizig'i shundaki, kremniyning kimyoviy faolligi uning kristallari hajmiga bog'liq. Ko-kristalli silikon amorfga nisbatan kimyoviy jihatdan kamroq. Ikkinchisi odatdagi haroratda hatto flor bilan osonlik bilan reaksiyaga kirishadi va 400-600 0 S haroratda mos keladigan kimyoviy birikmalar hosil qilish uchun kislorod, xlor, brom, oltingugurt bilan reaksiyaga kirishadi. Juda yuqori haroratda silikon azot va uglerod bilan reaksiyaga kiradi, bunga muvofiq nitrit va silikon karbid hosil bo'ladi.
Agar siz hidroflorik HF (hidroflorik) va azotli HNO3 kislotalari aralashmasida silikonni eritishga harakat qilsangiz, unda reaksiya davom etmaydi. Ammo, masalan, kaliy gidroksid bilan gidroksidi bilan kimyoviy reaksiya o'tkazsangiz, unda reaksiya silika kislotasining tuzi bilan sodir bo'ladi
Si + KOH → K 2 SiO 3 + H 2
Agar qoldiqli olovli qumda (qum) kaltsiylangan bo'lsa, u juda qattiq kristalli moddaga aylanadi. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - juda qattiq va refrakter moddalar. Sanoatda bu xususiyatlar tufayli katta miqdorda ishlab chiqariladi. Qizig'i shundaki, karbondosh kristalli kafes eng og'ir moddalar - olmos kafesiga o'xshash, ammo unda uglerod atomlari bir xil ravishda silikon atomlari bilan almashtiriladi.
Yuqori haroratlarda, shuningdek, kremniyli metall aralashmalarda kislotalar ta'sirida kimyoviy reaktsiyalar paytida, silan SiH 4.
Silan - bu o'z-o'zidan yoqadigan rangsiz gazdir. U silika va suv hosil qilish uchun havoda yoqib yuborishi mumkin.
SiH 4 + 2O 2 → → SiO 2 + 2H 2 O
Agar silikon oksidi SiO2 xlor oqimi ichida uglerod borligida qizdirilsa, kimyoviy reaktsiya silikon xlorid hosil bo'lishi bilan
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Silikon xlorid - bu suyuqlik, qaynash harorati 54 ° S ni tashkil qiladi. Silikon xlor ikki kislotaning eritmasi hosil bo'lganda suvda osongina eriydi: kremniy va xlorid kislota
SiCl 4 + H 2 O → H 2 SiO 3 + HCl hosil qiladi
Agar ushbu kimyoviy reaktsiya namlik havosiga tushib ketsa, ikki kislotaning shakllanishida qalin tutun paydo bo'ladi.
Silikon florid SiF 4 - gidroflorik kislotaning va silikon oksidning kimyoviy reaktsiyasi natijasida shakllangan
SiO 2 + 4HF → SiF 4 + 2H 2 O
Silikon florid "kuchli" hidli rangsiz gazdir. Silikon xlorid bilan bir qatorda, suvda bu gaz ikki kislotani hosil qiladi: silikon va gidroflorik. Qizig'i shundaki, silikon florid gidroflorik kislota bilan ta'sir qilishi mumkin heksafluorosilik kislota Kimyoviy formula H 2 SiF 6 bo'lgan. Uning tuzlari va kislota o'zi zaharli hisoblanadi.
Silikon
Asosiy metallar va nooziq metallar
Ushbu darsda siz "Silicon" mavzusini o'rganasiz. Kremniy bilan bog'liq ma'lumotlarni: uning elektron strukturasini, kremniyning tabiatda mavjudligini, silikon allotropiyasini o'rganishni, uning fizikaviy va kimyoviy xususiyatlarini tushuntirib bering. Silikon sanoat va boshqa sohalarda, qanday ishlab chiqarilganligini bilib oling. Siz kremniy, silisli kislota va uning tuzlari bilan tanishasiz - silikatlar.
Mavzu: Asosiy metallar va nodir metallar
Kurs: Silikon. Noble gazlar
Silikon er qobig'ining eng keng tarqalgan kimyoviy elementlaridan biridir. Uning tarkibi deyarli 30%. Tabiatda asosan silikon dioksid, silikatlar va aluminosilikatlarning turli shakllari mavjud.
Silikon deyarli barcha birikmalarida to'rtburchak hisoblanadi. Bunday holda, silikon atomlari hayajonli holatda bo'ladi. Shakl. 1.
Ushbu holatga kirish uchun, 3s elektronlardan biri 3p orbitallarida bo'sh joyni egallaydi. Bu holatda, er shtatidagi 2 ta singan elektronlar o'rniga qo'zg'algan holatdagi kremniy atomida 4 ta to'ldirilmagan elektronga ega bo'ladi. Birlashish mexanizmi orqali 4 kovalent aloqani hosil qiladi.


Silikon atomlari bir nechta birikmalar hosil bo'lishiga moyil bo'lmaydilar, lekin bitta-Si-O-bilan birikmalar hosil qiladi. Silikon, ugleroddan farqli o'laroq allotropiya uchun odatiy emas.
Ulardan biri allotropik modifikatsiya kristalli silikon hisoblanadibu erda har bir silikon atomining sp 3 hibridizatsiyasi mavjud. Shakl. 2, 3. Kristalli silikon qora, kulrang, metall parıltısı bo'lgan mustahkam, refrakter va bardoshli kristallik moddadir. Oddiy sharoitlarda - yarim o'tkazgich. Ba'zan amorf silikon kremniyning boshqa allotropik modifikatsiyasi sifatida ham chiqariladi. Kristalli silikondan ko'ra kimyoviy jihatdan faolroq bo'lgan quyuq jigarrang kukun. Alotropik modifikatsiya bo'ladimi - bu nuqta.
Silikonning kimyoviy xossalari
1. Halogen bilan ta'sir o'tkazish
Si + 2F 2 → SiF 4
2. Issiqlikda kremniy kislorod kuyadi, silika (IV) hosil bo'ladi.
Si + O 2 → SiO 2
3. Yuqori haroratlarda silikon azot yoki uglerod bilan ta'sir o'tkazadi.
3Si + 2N 2 → Si 3 N 4
4. Silikon kislotalarning suvli eritmalari bilan reaksiyaga kirishmaydi. Lekin u gidroksidi eritiladi.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Silikon metallar bilan birlashganda silikatlar hosil bo'ladi.
Si + 2Mg → Mg 2 Si
6. Silikon vodorod bilan bevosita ta'sir o'tkazmaydi, ammo silikatning vodorod birikmalari silikat bilan suv bilan aralashishi orqali erishiladi.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silan)
Silan tarkibida alkanlarga o'xshash, ammo ular ancha reaktivdir. Eng barqaror monosilan havoda yoqiladi.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Silikon olish
Silikon silikon oksidi (IV)
SiO 2 + 2Mg → Si + 2MgO
Yuqori safqli silikonni olish vazifalardan biri. Buning uchun texnik silikon silikon tetrakloridga o'tkaziladi. Olingan tetraklorid silanga kamayadi va sila qizdirilganda silikon va vodorodga aylanadi.
Silikon ikki oksid hosil qiladi: SiO2 - silikon oksid (IV) va SiO - silikon oksidi (II).
SiU - silikon oksidi (II) - bu kremniy oksidli (IV) silikat bilan o'zaro ta'siri natijasida hosil bo'lgan amorf tuxum jigarrang moddadir.
Si + Sion 2 → 2 Sion.
Uning barqarorligiga qaramasdan, ushbu modda deyarli qo'llanilmaydi.
SiO 2 - silikon oksidi (IV)


Ushbu modda Yer qobig'ining 12 foizini tashkil qiladi. Shakl. 4. Tosh kristallari, kvarts, ametist, sitrin, jasper, kalsedon kabi minerallar. Shakl. 5
SiO 2 - silikon oksid (IV) - molekulyar bo'lmagan strukturaning bir moddasi.
Uning kristalli panjarasi atomdir. Shakl. 6. SiO2 kristalllari kislorod atomlari bilan bog'langan tetraedr shaklida bo'ladi. (SiO2) n molekulalarining formulasi yanada to'g'ri bo'ladi. SiO 2 molekulalar strukturasining atomik strukturasi va CO 2 ni hosil qilganligi sababli ularning xususiyatlarining farqi shubhasiz. CO2 - bu gaz, SiO 2 esa suvda erimaydigan va odatiy bo'lmagan, ochiq shaffof kristalli moddadir.
Kimyoviy xossalariSiTaxminan 2
1. Silikon oksid (IV) SiO 2 kislota oksidi. U suv bilan reaksiyaga kirmaydi. SiO2 ning hidratsiyalari bilan silik kislotasi olinmaydi. Uning tuzlari, silikatlari SiO 2 ni issiq gidroli eritmalar bilan reaktsiyalash yo'li bilan olinishi mumkin.
SiO 2 + 2 NaOH Na 2 SiO 3 + H 2 O
2. gidroksidi va gidroksidi er osti metallarining karbonatlari bilan reaksiyaga kiradi.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Metallar bilan o'zaro ta'sir qiladi.
SiO 2 + 2Mg → Si + 2MgO
4. Hidroflorik kislota bilan reaksiyaga kirish.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Silisik kislota va silikatlarning kimyoviy xususiyatlari
Silisik kislota olish
Polimerik birikma sifatida silika kislotasi hosil bo'ladi. Silisik kislota formulalar -
H 2 SiO 3 (meta shakl) va H 4 SiO 4 (ortho formasi) - elementlarning nisbatlarini aks ettiradi, lekin haqiqiy kompozitsion emas. Odatdagidek, samolyotda kremniy kislotasi tarkibini shakl. 7
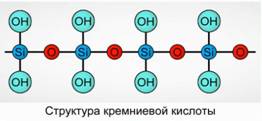
Kremniy kislotasi uchun H 2 SiO 3 formulasidan har doim foydalaniladi.
1. H 2 Sion 3 qizdirilganda parchalanadi
H 2 SiO 3 H 2 O + SiO 2 (silika jeli)
2. Gidroksidi eritmalari bilan o'zaro ta'sir qiladi
H 2 SiO 3 + 2 NaOH Na 2 SiO 3 + 2H 2 O
Silikat kislota tuzlari - silikatlar - ion birikmalariga qarang. Ular qattiq rangsiz moddalardir. Lityumdan tashqari, faqat gidroksidi metall silikatlar suvda eriydi.
1. Eriydigan silikatlar anion bilan gidrolizlanadi
Na 2 SiO 3 + H 2 O + NaHSiO 3 + NaOH
2. Eriydigan silikatlar kuchli kislotalar bilan ta'sir o'tkazadi.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2 NaCl
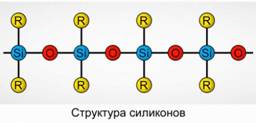
Polyorganosiloksanlar (silikonlar)
Polyorganosiloksanlar (silikonlar) kislorodli, yuqori molekulyar og'irlikdagi organosilikon birikmalardir.
R. 2 [ Sion] n
R organik guruhdir (metil, etil yoki Fanil). Siloksanlarning strukturasining asosi alternativ silikon atomlari va kislorod zanjiridir. 8-rasm. Zanjirning uzunligini va organik guruhlarni o'zgartirib, turli xil xususiyatlarga ega silikonlarni olish mumkin. Polimerizatsiya sharoitlarini o'zgartirib, turli uzunlikdagi molekulalarni olishingiz mumkin.


Qisqa zanjirband etilgan polimerlar suyuqliklar, ularning uzunligi esa qimmatbaho yog'lardir. Shakl. 9, bu ularning xususiyatlarini katta harorat oralig'ida saqlaydi
100 0 S dan + 300 0 S. Uzunroq molekulalar past haroratlarda elastikligini yo'qotmagan kauchuklarni hosil qiladi. Chirishga nisbatan yuqori qarshilikka ega, kimyoviy jihatdan inertdir. Shakl. 10. Ularni qo'llashning turli xil variantlarini keltirib chiqaradi. Ular sun'iy yurak yoki buyrak mashinalarini yaratish uchun ishlatilishi mumkin va poyabzal uchun poyabzal sifatida foydalanish mumkin. Siloksan polimerlari turli xil yumshoq to'qimalar implantlarini yaratish uchun tibbiyotda qo'llaniladi, chunki bunday polimerlar kimyoviy jihatdan inertdir va tanadan voz kechmaydi. Ular suv bilan namlangan emas. Kremlarda ishlatiladi. Ushbu kremni qo'llariga qo'llaganida u rezina qo'lqoplarni almashtiradi.
Noorganik bog'
Natriy silikat bilan to'ldirilgan shaffof bog 'ichida rangli tuzlarning kristallarini, masalan, mis sulfatini tushiring. Biroz vaqt o'tgach, erimaydigan silikatlardan iborat bo'lgan kristallardan hosil bo'lgan nozik bo'shliq quvurlar ko'rinadi. Shakl. 11

"Axmoq" moziyga erishish
Natriy silikat va tibbiy spirtning teng miqdori aralashtiriladi. Cho'kma spirtli ichimliklarni tomizmaslik uchun filtrlanadi va siqiladi. Bu mozor. Shakl. 12. U shunday nomlangan, chunki uni deraza uchun zirak sifatida ishlatish rejalashtirilgan. Ammo bunday xususiyatlarga ega bo'lganligi aniqlandi, chunki uning maqsadiga erishish mumkin emas edi. Agar to'pni siljitish va erga tashlab qo'ysangiz, u rezina to'p kabi yopiladi. Agar stolga qo'yilsa, u suyuqlik kabi tarqaladi. Qattiq jismga ursangiz, u qattiq tanaga o'xshab ketadi. Bir muncha vaqt o'tgach, spirtni quritganda, bu mozaik shunchaki qulab tushadi.
![]()
Darslarni umumlashtirish
Ushbu darsda siz "Silicon" mavzusini o'rgangansiz. Biz kremniy haqida ma'lumotni o'rganib chiqdik: uning elektron tuzilishi, kremniyning tabiatda joylashgani, kremniyning allotropiyasini o'rganish, fizikaviy va kimyoviy xususiyatlarini tushuntirish. Ular kremniyning sanoat va boshqa sohalarda qaerda ishlab chiqarilganligi, qanday ishlab chiqarilganligi haqida bilib oldilar. Siz kremniy, silisli kislota va uning tuzlari bilan uchrashdingiz - silikatlar.
Adabiyotlar ro'yxati
1. Rudzit G.E. Kimyo. Umumiy kimyo asoslari. 11-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G.E. Rudzitis, F.G. Feldman. - 14-chi kitob. - M.: Ma'naviyat, 2012.
2. Popel P.P. Kimyo: 8 ta umumta'lim maktablari uchun darslik / PP. Popel, L.S. - K .: TT "Akademiya", 2008. - 240 bet.
3. Gabrielyan O.S. Kimyo. 11-sinf. Asosiy daraja. 2-ad., Sr. - M.: Drofa, 2007. - 220 p.
Uy vazifasi
1. №№2-4 (138-modda) Rudzit G.E. Kimyo. Umumiy kimyo asoslari. 11-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G.E. Rudzitis, F.G. Feldman. - 14-chi kitob. - M.: Ma'naviyat, 2012.
2. Polyorganosiloksanlarning qo'llanilishi.
3. Kremniyning allotrop modifikatsiyasini aniqlash.
