Oltingugurt aralashmalari. Aralashmalarda oltingugurt oksidlanish darajasi. Oltingugurt birikmalarining formulalari. Oltingugurt. Vodorod sulfidi. Sulfidlar
Oltingugurt, uning jismoniy va kimyoviy xossalari. Oltingugurtning biologik qiymati, uni qo'llash (demercurizatsiya).
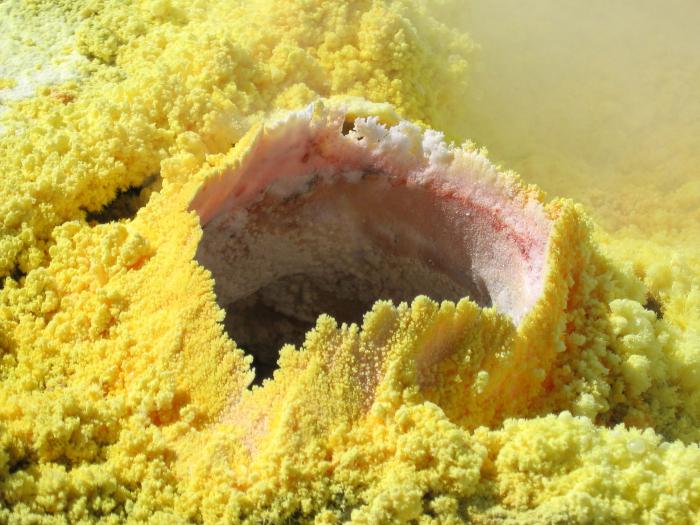
Tabiatdagi Cera
Mahalliy oltingugurt
PbS - qo'rg'oshin porlashi
Cu 2 soniya - mis yorqinligi
ZnS - Sink blende
Fes 2 - pirit, oltingugurt piriti, mushukli oltin
H 2 soniya - vodorod sulfidi (mineral manbalar va tabiiy gazda)
CaSO 4 * 2H2 O- gips
MgSO 4 * 7H2 O - achchiq tuz (inglizcha)
Na 2 SO 4 * 10 H 2 O - Glauber tuzi (mirabilite)
Jismoniy xususiyatlar
Qattiq kristalli modda sariq, suvda erimaydi, suv bilan namlanmaydi (yuzada suzadi), t ° kip = 445 ° S.
Maxsus biri jismoniy xususiyatlar oltingugurt -flotatsiya, mayda kükürt kukunlari suyuqlikning katta kristallari suvga cho'mish qobiliyati. Aslida, oltingugurt suv bilan namlanmagan va uning zarralari ularga yopishgan kichik havo kabarcıkları tufayli suv yuzasida saqlanadi.Bu xususiyat mahalliy kükürtün iflosliklardan ajratish uchun ishlatiladi. Javhara maydalab, uni suv bilan to'ldiring va havo bilan quying, oltingugurt suzadi va pastki qismida iflosliklar qoladi.Allotropiya
Oltingugurt bir nechta allotropik modifikatsiyalari bilan ajralib turadi., ammo eng mashhur o'zgartirishlar:rombik (kristalli) , monoklinik (igna) va plastik .
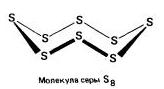
Rombik (a - oltingugurt) - S 8
t ° pl. = 113 ° S; r = 2.07 g / sm3. Eng barqaror modifikatsiya.
Monoklinik (b - oltingugurt) - S 8
quyuq sariq ignalart ° pl. = 119 ° S; r = 1.96 g / sm3. 96 darajadan yuqori haroratlarda barqaror; normal sharoitda rombikga aylanadi.
Plastik S n
jigarrang kauchuk (amorf) massa. Qattiqlashtirilgan rombga aylantirilganda, beqaror.
PLASTIK SULFURNI ISHLAB CHIQARISH
Oltingugurt atomining tuzilishi
Elektronlarni sath va pastki sathlarda joylashtirish
Erning holati
1s 2 2s 2 2p 6 3s 2 3p 4
Elektron joylashtirish
orbitallar (oxirgi qavat)Degree
oksidlanishValence
Asosiy holatda
Birinchi qiziqarli holat
Ikkinchi qiziqarli holat
Oltingugurt ishlab chiqarish
1. Sanoat usuli - suv bug'idan foydalangan holda ma'danlardan eritish.
2. Vodorod sulfidini (oksijen etishmovchiligi) to'liq bo'lmagan oksidlanish.
2H 2 S + O 2 = 2S + 2H 2 O
3. Wackenroderning reaktsiyasi
2H 2 S + SO 2 = 3S + 2H 2 O
Oltingugurt kimyoviy xossalari
Oltingugurt oksidlovchi moddadir S 0 + 2ē→ S-2 | Oltingugurt - kamaytirish agenti: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Oltingugurtning o'zaro ta'siri bilanbarcha gidroksidi va gidroksidi tuproq metallar, mis, simob, kumush isitishsiz: 2 Na + S→ Na 2 S Tajriba S + Hg = HgS Mercury yuqori volatilite bor. Uning juftlari zaharli. Bu reaktsiya simobni olib tashlash va yo'q qilish, masalan singan tibbiyot termometridan kelib chiqadi. Kristalli tomchilarni chiqarib bo'lmaydigan joylar oltingugurtli kukun bilan qoplangan. Kükürt va simob dokunulduğunda javob beradi. Natijada kimyoviy inert va zararli moddalar hosil bo'ladi. Ushbu jarayon demercurizatsiya deb ataladi. 2. Oltingugurtning o'zaro ta'siriv boshqa metallar (boshqaAu, Pt) balandligi t ° da: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS tajribasi Cu + S t
→
CuS tajriba 3. Kükürt bilan ta'sir o'tkazish ba'zi metallarning hosil bo'lishi ikkilik birikmalar: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Oltingugurt kislorod bilan o'zaro ta'siri: S + O2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Oltingugurtning o'zaro ta'siriv halogen (yoddan tashqari): S + Cl 2→ S + 2 Cl 2 ** Kükürt bilan ta'sir o'tkazish kislotalar - oksidlovchi moddalar: S + 2H 2 SO 4 (kons)→ 3S + 4O 2 + 2H 2 O S + 6HNO 3 (kons)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Noaniqlik reaktsiyasi: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
Dastur
Qishloq xo'jaligi zararkunandalariga qarshi kurashda, tibbiy maqsadlar uchun (teri kasalliklarini davolash uchun oltingugurtli malham), kükürt kislotasi olish va hokazo. Uchun kauçuğun vulkanizasyonu, ebonit olish, o'yinlarni ishlab chiqarish, bariton.
Uy vazifasi21-band; 1, 3, 4-dars 99-100 mashqlari.
Qo'shimcha kurslar
Reaktsiya tenglamalarini to'ldiring, s elektr balansi usuli bo'yicha koeffitsientlarni belgilash, oksidlovchini, kamaytiruvchi vositani aniqlang.
№2. Reformga muvofiq transformatsiyani amalga oshirish:
Bu qiziq...
- 70 kg vaznda inson organizmidagi oltingugurt miqdori - 140 g.
- Bir kunda odamga 1 g kükürt kerak.
- No'xat, loviya, jo'xori, bug'doy, go'sht, baliq, meva va mango sharbati oltingugurtga boy.
- Oltingugurt - gormonlar, vitaminlar, oqsillarning bir qismi, xaftaga to'qimasida, sochlar, mixlar. Tanada oltingugurt yo'qligi tufayli, tirnoq va suyaklarning nozikligi, sochlarning yo'qolishi kuzatiladi.
Sog'ligingizni kuzating!Bilasizmi..
- Oltingugurt birikmalari preparat sifatida xizmat qilishi mumkin;
- Oltingugurt - qo'ziqorin teri kasalliklarini davolash uchun malhamning asosidir, qoraqarag'aylarga qarshi kurash. Natriy tiosulfat Na 2 S 2 O 3 u bilan kurashish uchun ishlatilgan.
- Sülfürik kislotaning ko'p tuzlari kristalizasyon suvini o'z ichiga oladi: ZnSO 4 × 7H 2 O va CuSO 4 × 5H 2 A. Ular qishloq xo'jaligi zararkunandalariga qarshi kurashda o'simliklarning püskürtülmesi va don ekish uchun antiseptik sifatida ishlatiladi.
- FeSO temir-quyqa 4 × 7H 2 O kamqonlik uchun ishlatiladi.
- BaSO 4 oshqozon va ichakning radiologik tekshiruvi uchun ishlatiladi.
- Alyuminiy kaliy alumini KAI (SO 4) 2 × 12H 2 O - kesikli gemostatik.
- Mineral Na 2 SO 4 X 10H 2 U VIII asrda kashf etgan va uning safari davomida to'satdan kasal bo'lib qolgan germaniyalik kimyogar Glauber IR Glauber sharafiga "Glaubertning tuzi" deb nomlangan. U hech narsa yemadi, uning oshqoni ovqat bermadi. Mahalliylardan biri uni manbaga jo'natdi. Achchiq sho'r suv ichganidan keyin darhol yeydi. Glauber ushbu suvni o'rganib chiqdi, undan Na tuzi kristallandi. 2 SO 4 × 10H 2 A. Hozir u tibbiyotda, paxta matolarini bo'yashda ishlatiladi. Tuz ham shisha ishlab chiqarishda foydalanishni topadi.
- Yarrow tuproqdan oltingugurtni chiqarib tashlash qobiliyatiga ega va bu elementni qo'shni o'simliklar bilan singdirishga undaydi.
- Sarimsoq modda - albucid, kaustik oltingugurt birikmasini chiqaradi. Bu modda saratonni oldini oladi, qarishni susaytiradi, yurak kasalligini oldini oladi.
Kalsogen kichik guruhiga oltingugurt kiradi - bu ko'plab ma'dan konlarini shakllantirishga qodir elementlarning ikkinchi qismidir. Sulfatlar, sulfidlar, oksidlar va boshqa oltingugurt birikmalari sanoat va tabiat uchun juda keng tarqalgan. Shuning uchun bu maqolada biz ularning nima ekanligini, oltingugurtning o'zi, oddiy moddasi haqida fikr yuritamiz.
Oltingugurt va uning xarakteristikasi
Ushbu element davriy tizimda quyidagi pozitsiyaga ega.
- Oltinchi guruh - asosiy kichik guruh.
- Uchinchi kichik davr.
- Atom massasi 32.064.
- Tartib raqami 16, proton va elektronlar soni bir xil va 16 neytron ham bor.
- Metall bo'lmagan elementlarni bildiradi.
- Formulada «as», oltingugurt elementi, lotin oltingugurt nomi keltirilgan.
Tabiatda massa sonlari 32,33,34 va 36 bo'lgan to'rtta barqaror izotop bor. Bu element tabiatdagi oltinchi o'rinni egallaydi. Qabul qiladi ozuqa moddalari, muhim organik molekulalarning bir qismi sifatida.
Atomning elektron tuzilishi
Oltingugurt birikmalari atomlarning elektron strukturasining o'ziga xos xususiyatlariga turli xildir. Quyidagi konfiguratsiya formula bilan ifodalanadi: 1s 2 2s 2 2p 6 3s 2 3p 4.
Yuqoridagi protsedura faqat elementning harakatsiz holatini aks ettiradi. Biroq, ma'lumki, agar atom qo'shimcha energiya haqida ma'lumotga ega bo'lsa, u holda elektronlar 3p va 3s pastki sathlarida bo'linishi mumkin. Natijada, nafaqat atomning valentligi, balki barcha mumkin bo'lgan oksidlanish hollari ham o'zgaradi. Kükürtlü turli moddalar soni kabi, ularning soni sezilarli darajada ortadi.
Murakkab tarkibida oltingugurt oksidlanish darajasi
Ushbu indikator uchun bir nechta asosiy variant mavjud. Oltingugurt uchun:
Ulardan S +2 eng noyob, qolganlari hamma joyda tarqaladi. Karkatlar tarkibida oltingugurt oksidlanishining darajasi kimyoviy faollikka va barcha moddaning oksidlanish qobiliyatiga bog'liq. Misol uchun, -2 bilan birikmalar sulfidlardir. Ularda biz ko'rib chiqqan element odatda oksidlovchi moddadir.
Bu tarkibdagi oksidlanish darajasi qanchalik baland bo'lsa, moddalarning oksidlanish qobiliyati qanchalik aniqroq. Oltingugurt shakllanadigan ikki asosiy kislotani esga olsak, bu osonlik bilan ko'rinadi:
- H 2 SO 3 - sulfatli;
- H 2 SO 4 - oltingugurt.
Ma'lumki, uning tarkibida yuqori konsentratsiyali o'ta oksidlanish qobiliyatiga ega bo'lgan ancha barqaror, kuchli birikma mavjud.
Oddiy modda
Oddiy moddalar sifatida oltingugurt muntazam muntazam ravishda uzaygan shakldagi sariq rangli kristallarni ifodalaydi. Bu ikkita asosiy moddalar mavjudligi sababli, bu uning shakllaridan bittasi bo'lsa-da. Birinchisi, monoklinik yoki rombik, sariqdir, bu suvda erimaydi, faqat organik erituvchilarda. Tuproq shaklida taqdim etilgan noziklik va strukturaning go'zal shakli farq qiladi. Erish nuqtasi - taxminan 110 0 S.
Agar bunday o'zgarishni isitish vaqtini o'tkazib yubormasangiz, u holda siz boshqa vaqtni - plastik oltingugurtni aniqlashingiz mumkin. Keyinchalik isitish yoki tez sovutish bilan rezina shaklga qaytadigan jigarrang rangli rezina, yopishqoq eritma.
Agar kimyoviy jihatdan toza oltingugurt haqida gapiradigan bo'lsak, u qayta filtrlash yo'li bilan olingan bo'lsa, unda u nordon va suvda umuman erimaydigan yorqin sariq kichkina kristallardir. Havodagi namlik va kislorod bilan aloqa qilganda olov olish mumkin. Juda yuqori kimyoviy faollikda farq qiladi.

Tabiatda bo'lish
Tabiatda oltingugurt birikmalaridan olinadigan tabiiy moddalar mavjud bo'lib, ular oddiy moddalardir. Bundan tashqari, u quyidagilar:
- minerallar, javhar va jinslar;
- ko'plab organik molekulalarning bir qismi sifatida hayvonlar, o'simliklar va odamlar organizmida;
- tabiiy gazlar, neft va ko'mirlar;
- yonuvchi shales va tabiiy suvlarda.
Oltingugurtga boy minerallarning ba'zilari quyidagilardir:
- kinnabar;
- pirit;
- sfalerit;
- antimonit;
- galen va boshqalar.
Bugungi kunda ishlab chiqarilgan oltingugurtning katta qismi sulfat ishlab chiqarishga to'g'ri keladi. Yana bir qismi tibbiy maqsadlar uchun, qishloq xo'jaligi, moddalarni ishlab chiqarish uchun ishlab chiqarish jarayonlari uchun ishlatiladi.
Jismoniy xususiyatlar
Ular bir necha nuqtada tasvirlangan bo'lishi mumkin.
- Suvda, karbon disulfide yoki turpentinda erimaydi - u yaxshi eriydi.
- Uzoq ishqalanish bilan salbiy zaryad birikadi.
- Erish nuqtasi 110 0 S.
- Qaynash nuqtasi 190 0 S
- 300 0 S ga yetganda, u suyuq va osongina harakatga keladi.
- Sof moddalar yonuvchan xususiyatlarni juda yaxshi yoqib yuborishi mumkin.
- Hidning o'zi deyarli hech qanday ta'sirga ega emas, ammo oltingugurt vodorod aralashmasi chirigan tuxumlarning o'tkir hidini chiqaradi. Xuddi gazli ikki tomonlama vakillari kabi.
Ushbu moddaning fizik xususiyatlari antik davrdan beri odamlarga ma'lum. To'liq oluvchanligi uchun oltingugurt shunday nom olgan. Urushlarda dushmanlarga qarshi qurol sifatida bu aralashmaning yonishi paytida shakllangan buzoq va zaharli bug'lar ishlatilgan. Bundan tashqari, oltingugurt bilan bog'liq kislotalar ham muhim sanoat ahamiyatiga ega.

Kimyoviy xossalari
Mavzu: Maktab kimyo kursida "oltingugurt va uning birikmalari" bir dars emas, balki bir nechta. Axir, ularning ko'plari. Bu moddaning kimyoviy faoliyati bilan bog'liq. Oksidlovchi xususiyatlarni yanada kuchaytiruvchi vositalar (metallar, borlar va boshqalar) bilan namoyon qilishi va ko'plab nometall bo'lmagan moddalar bilan xususiyatlarini kamaytirish mumkin.
Biroq, bu faoliyatga qaramasdan, faqat flor bilan birga, o'zaro ta'sirlar odatdagi sharoitda davom etadi. Boshqalar esa isitish uchun kerak. Oltingugurt aralashishi mumkin bo'lgan moddalarning bir necha toifasi mavjud:
- metallar;
- metall bo'lmagan;
- gidroksidi;
- kuchli oksidlovchi kislotalar - sulfat va azot.
Oltingugurt birikmalari: navlari
Turli xilligi asosiy element - oksidlanish darajasining tengsizligi bilan izohlanadi. Shunday qilib, ushbu xususiyat uchun bir necha asosiy turdagi moddalarni tanlashingiz mumkin:
- oksidlanish holati -2;
Valentlik ko'rsatkichi emas, balki sinflarni hisoblasak, bu element shunday molekulalarni hosil qiladi:
- kislotalar;
- oksidlar;
- tuzlar;
- ikkilik bo'lmagan aralashmalari (karbon disulfid, xloridlar);
- organik moddalar.
Endi asosiy masalalarni ko'rib chiqing va misollar keltiring.

Oksidlanish holati -2
Kükürt aralashmalari 2 uning metallerle bilan bir qatorda:
- uglerod;
- vodorod;
- fosfor;
- silikon;
- arsenik;
- bor.
Bunday hollarda u oksidlovchi vosita vazifasini bajaradi, chunki yuqorida sanab o'tilgan barcha elementlar ko'proq elektropozitivdir. Ularning eng muhimlarini ko'rib chiqaylik.
- Karbon disulfid - CS 2. Eter xarakterli yoqimli xushbo'yli suyuqlik. U toksik, yong'inga va portlovchi. Solvent sifatida va ko'plab turdagi yog'lar, yog'lar, nometalllar, kumush nitrat, qatronlar va kauchuklar uchun ishlatiladi. Bu tuman - rayon ishlab chiqarishda ham muhim ahamiyatga ega. Sanoatda u ko'p miqdorda sintezlanadi.
- Vodorod sulfidi yoki vodorod sulfidi - H 2 S. Rangsiz va shirin ta'mga ega bo'lmagan gaz. Hidi o'tkir, juda yoqimsiz, chirigan tuxumni eslatadi. Zaharli, nafas olish markazini bosadi, chunki u mis ionlarini bog'laydi. Shuning uchun agar u zaharlangan bo'lsa, u nafas oladi va o'ladi. U tibbiyotda, organik sintezlarda, sulfat kislota ishlab chiqarishda, shuningdek energiyani tejovchi xom ashyo sifatida keng qo'llaniladi.
- Metall sulfidlar tibbiyotda, sulfat ishlab chiqarishda, bo'yoqlar ishlab chiqarishda, fosfor va boshqa joylarda ishlab chiqariladi. Umumiy formulalar - Me x S y.

Oksidlanish holati +4
Kükürt aralashmalari 4 asosan oksidi va unga tegishli tuzlar va kislotadir. Ularning barchasi sanoatda muayyan qiymatga ega bo'lgan juda keng tarqalgan birikmalardir. Ular oksidlovchi vositalar sifatida harakat qilishlari mumkin, lekin tez-tez kamaytiruvchi xususiyatlarni ko'rsatadi.
+4 oksidlanish holati bilan oltingugurt aralashmalari uchun formulalar quyidagicha:
- oksid - oltingugurt dioksid SO 2;
- kislota - sulfat H 2 SO 3;
- tuzlari umumiy formula Me x (SO 3) y ga ega.
Eng keng tarqalgan biri yoki anhidrit. Bu kuygan o'yinning hidi bo'lgan rangsiz modda. Vulkanlar portlashi paytida hosil bo'lgan katta klasterlarda, bu vaqtda hid bilan aniqlash oson.
Suvda osonlik bilan ajraladigan kislota, sulfat kislota hosil bo'lgan holda eritiladi. Sulfid ionlari SO 3-shaklida bo'lgan odatda, bir tuz shaklida ishlaydi. Bu anhidrit atrofdagi atmosferaning ifloslanishini ta'sir qiluvchi asosiy gazdir. Bu esa ta'limga ta'sir qiladi, sanoatda sulfat ishlab chiqarishda ishlatiladi.
Oltingugurtning +6 oksidlanish holatiga ega bo'lgan aralashmalari
Bunga, birinchi navbatda, sulfat anhidrit va sülfürik kislota o'z tuzlari bilan kiradi:
- sulfatlar;
- gidroksulfatlar.
Ularda oltingugurt atomlari juda oksidlanishganligi sababli, bu birikmalarning xususiyatlari juda ochiq. Ular kuchli oksidlovchi moddalardir.
Sülfür oksidi (VI) -sülfürik anhidrit - uchuvchi, rangsiz suyuqlik. Xarakterli xususiyat kuchli qurituvchi qobiliyatidir. Outdo smoke. Suvda eriydigan eng kuchli mineral kislotalardan biri - oltingugurt beradi. Uning konsentrlangan eritmasi og'ir yog'li, mayda sariq suyuqlikdir. Anhidrit oltingugurt kislotasida eriydi, unda oleum deb nomlangan maxsus birikma hosil bo'ladi. U kislotani ishlab chiqarish uchun sanoatda ishlatiladi.
Tuzlar orasida - sulfatlar - bu kabi aralashmalar:
- gips CaSO 4 · 2H 2 O;
- barit BaSO 4;
- mirabilit;
- qo'rg'oshin sulfati va boshqalar.
Ular qurilishda, kimyoviy sintezda, tibbiyotda, optik asboblar va ko'zoynak ishlab chiqarishda va hatto oziq-ovqat sanoatida qo'llaniladi.
Hidrosulfatlar metallurgiyada keng tarqalgan bo'lib, ular oqim sifatida ishlatiladi. Shuningdek, ular ko'plab murakkab oksidlarni tegishli sohalarda ishlatiladigan eruvchan sulfat shakllariga tarjima qilishga yordam beradi.
Maktab kimyo kursida oltingugurtni o'rganish
Talabalar oltingugurt nima ekanligini bilish uchun eng yaxshisi qachon, uning xususiyatlari qanday, oltingugurt birikmasi nima? 9-sinf - eng yaxshi davr. Bu bolalar uchun yangi va tushunarsiz bo'lgan hamma narsaning boshlanishi emas. Kimyo fanini o'rganishning o'rta nuqtasidir, agar ilgari qo'yilgan fondlar mavzuni to'liq tushunishga yordam beradi. Shuning uchun, bu masalalarni ko'rib chiqish uchun ajratilgan yuqori sinfning ikkinchi yarmi. Shu bilan birga, barcha mavzu bir necha bloklarga bo'linadi, unda "9-sinf oltingugurt aralashmalari" darsi alohida ko'rsatiladi.
Bu ularning ko'pligi bilan bog'liq. Shuningdek, sanoatda sulfat kislota ishlab chiqarish masalasi alohida ko'rib chiqildi. Odatda, bu mavzuga o'rtacha 3 soat ajratilgan.
Ammo oltingugurt faqat organik masalalar ko'rib chiqilganda 10-sinfda o'qish uchun olib chiqiladi. Ularga o'rta maktabda biologiya ham ta'sir ko'rsatadi. Axir, oltingugurt shunday organik molekulalardan tarkib topgan:
- thizpirits (tiol);
- oqsillar (tsellyuloza tuzilishi, unda disulfid ko'prigining shakllanishi);
- thioaldehitler;
- tiofenoller;
- tioesterlar;
- sülfonik kislotalar;
- sulfoksidlar va boshqalar.
Ularni organo-oltingugurtli birikmalarning maxsus guruhida ajratib turadilar. Ular nafaqat jonzotlarning biologik jarayonlarida, balki sanoatda ham muhimdir. Misol uchun, sulfonik kislotalar ko'pchilikning asosidir dorilar (aspirin, sulfanamid yoki streptotsid).
Bundan tashqari, oltingugurt moddalar kabi ba'zi tarkibiy qismlarning doimiy tarkibiy qismidir:
- aminokislotalar;
- fermentlar;
- vitaminlar;
- gormonlar.
Xona haroratida oltingugurt faqat simob bilan reaksiyaga kirishadi. Haroratning o'sishi bilan uning faoliyati sezilarli darajada oshadi. Issiqlikda oltingugurt inert gazlar, azot, selen, tellurium, oltin, platina, iridiy va yod tashqari, juda oddiy moddalar bilan to'g'ridan-to'g'ri ta'sir ko'rsatadi. Azot va oltin sulfidi bilvosita olinadi.
Metalllarning o'zaro ta'siri
Sulfat oksidlovchi xususiyatlarni namoyon qiladi, ta'sir o'tkazish natijasida sulfidlar hosil bo'ladi:
Vodorod bilan o'zaro ta'siri 150-200 ° S da sodir bo'ladi:
H 2 + S = H 2 S
Kislorod bilan o'zaro ta'siri
Oltingugurt kislorodda 280 ° S da, havoda 360 ° C da yonadi va oksidlar aralashmasi hosil bo'ladi:
S + O2 = SO2;
2S + 3O 2 = 2SO 3.
Fosfor va uglerod bilan o'zaro ta'siri
Havosiz isitilganda oltingugurt fosfor, uglerod bilan oksidlovchi xususiyatlarni ko'rsatuvchi reaksiyaga kirishadi:
2P + 3S = P 2 S 3;
Flor shovqin
Kuchli oksidlovchi moddalar mavjud bo'lganda uning xususiyatlarini kamaytiradi:
S + 3F 2 = SF 6.
Murakkab moddalar bilan o'zaro ta'siri
Murakkab moddalar bilan o'zaro aloqada bo'lganda, oltingugurtni kamaytirish vositasi sifatida harakat qiladi:
S + 2HNO 3 = 2NO + H 2 SO 4.
Noaniqlik reaktsiyasi
Oltingugurt nomutanosiblik reaktsiyalariga ega, alkali sulfidlar va sulfitlar bilan o'zaro aloqada bo'lganda:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Oltingugurt ishlab chiqarish
Mahalliy rudalardan
Piritni havo kirmasdan isitish vaqtida
FeS 2 = FeS + S
Vodorod sulfidning kislorod etishmovchiligi bilan oksidlanishi
2H 2 S + O 2 = 2S + 2H 2 O.
Metallurgik va ildiz po'latining chiqindi gazlaridan, katalizator ishtirokida qizdirilganda
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. Vodorod sulfidi
Vodorod oltingugurt aralashmasi - vodorod sulfidi H 2 S . Vodorod sulfidi - kovalent birikma. Molekulyar struktur suv molekulasining strukturasiga o'xshashdir, oltingugurt atomining sp 3 hibridizatsiyasi holatida, ammo suvdan farqli o'laroq, vodorod sulfid molekulalari o'zaro vodorod aloqalarini hosil qilmaydi. Kükürt atomining kislorod atomiga nisbatan kamroq elektronegatif bo'lishi, undan katta hajmi va buning natijasida kam zaryad zaryadidir. HSH valentlik burchagi 91.1 °, H - S munosabatlari uzunligi 0.133 nm.
Jismoniy xususiyatlar
Oddiy sharoitlarda vodorod sulfidi chiriyotgan tuxumlarning kuchli xarakterli hidiga ega rangsiz gazdir. T pl = -86 ° S ga teng T kip = -60 ° S, suvda kam 20 ° C, 2,58 ml H 2 S suvda 100 g suvda eriydi, juda toksik, nafas olganda falaj keltirib chiqaradi va bu o'limga olib kelishi mumkin. Tabiatda u o'simlik va hayvon organizmlarining parchalanishi natijasida hosil bo'lgan vulkanik gazlar tarkibida chiqariladi. Suvda eriydi, eritilgan zaif vodorod sulfid kislota hosil qiladi.
Kimyoviy xossalari
Suvli eritmada vodorod sulfidi zaif dibazik kislota xususiyatlariga ega:
H2S = HS - + H +;
HS - = S 2- + H +.
Havoda vodorod sulfidi yonishi ko'k olov. Cheklangan havo bilan erkin sulfat hosil bo'ladi:
2H 2 S + O 2 = 2H 2 O + 2S.
Haddan tashqari havoga chiqishi bilan, vodorod sulfidining yonishi oltingugurt oksidi (IV) hosil bo'lishiga olib keladi:
2H 2 S + 3O 2 = 2H 2 O + 2 SO 2.
Vodorod sulfidi kamayib boradi. Sharoitlarga qarab vodorod sulfidi suvli eritmasida oltingugurt, oltingugurt dioksidi va sulfat kislota bilan oksidlanadi.
Masalan, u brom suvini ranjitadi:
H 2 S + Br 2 = 2HBr + S
xlorli suv bilan o'zaro ta'sir qiladi:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Vodorod sulfidining oqimi qo'rg'oshinning dioksidi yordamida yoqib yuborilishi mumkin, chunki reaktsiya katta issiqlik bilan ajralib chiqadi:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Vodorod sulfidning oltingugurt dioksidi bilan o'zaro ta'siri metallurgiya va sulfat chiqindilari chiqindilaridan oltingugurt ishlab chiqarishda foydalanilgan:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Vulqon jarayonlarida mahalliy sulfat hosil bo'lishi bu jarayon bilan bog'liq.
Gidroksidi eritmasi orqali oltingugurt dioksidi va vodorod sulfidini bir vaqtning o'zida etkazib berish bilan tiosulfat hosil bo'ladi:
4SO 2 + 2H 2S + 6NaOH = 3Na2S2O3 + 5H2O.
Oddiy sharoitlarda vodorod sulfidi chirigan tuxumlarning xarakterli hidiga ega rangsiz va juda toksik gazdir.
Laboratoriyada uni olish uchun suyultirilgan xlorid kislota odatda sulfidga qo'shiladi:
Vodorod sulfidini ishlab chiqarishning yana bir yo'li - alyuminiy sulfidga sovuq suv qo'shilishi:
Shu tarzda olingan vodorod sulfidi tozalaydi.
Vodorod sulfidi - kovalent birikma. Uning molekulalari suv molekulalarining tuzilishiga o'xshash kavisli tuzilishga ega (2.2-bobga qarang). Ammo, suvdan farqli o'laroq, vodorod sulfid molekulalari bir-biri bilan vodorod aloqalarini hosil qilmaydi. Aslida, oltingugurt atomining kislorod atomiga nisbatan kamroq elektronegativligi, ammo katta hajmi bor. Shuning uchun oltingugurt atomining kislorod atomiga qaraganda ancha past zaryadli zichligi bor. Vodorod aloqalarining etishmasligi tufayli vodorod sulfidi suvdan kam qaynash nuqtasiga ega. Vodorod sulfidida vodorod aloqalarining yo'qligi ham suvdagi zaif piksellar sonini tushuntiradi.
Suvli eritmada vodorod sulfidi zaif dibazik kislota xususiyatlariga ega:
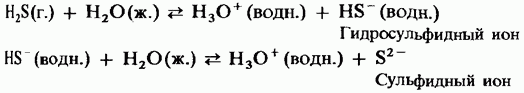
Vodorod sulfidi havoda ko'k olov bilan yoqiladi. Havoning cheklanganligi tufayli, vodorod sulfidini yoqib yuborish idishning sovuq yuzasida yengil bo'ladigan erkin sulfatning chiqishi bilan birga keladi:
Haddan tashqari havoga chiqishi bilan vodorod sulfidining yonishi oltingugurt dioksidini shakllantirishga olib keladi:
Vodorod sulfidi kamayib boradi. Misol uchun, u brom suvini ranjitadi va ionlarga ionlarni kamaytiradi.
Dibazik kislota sifatida vodorod sulfidi ikki qatorli tuzlarni hosil qiladi - sulfidlar va gidroksidlar (yuqoriga qarang). Alkali metal sulfidlari gidroksidi eritmalar hosil qilish uchun suvda eriydi. Bu gidroliz natijasida hosil bo'ladi:
Boshqa metallarning erimaydigan sulfidlari bu metallarning tuzlari suvli eritmasidan eritma orqali vodorod sulfididan o'tish orqali cho'ktirilishi mumkin. Masalan, vodorod sulfidni ionlar o'z ichiga olgan eritma orqali yuborish orqali qora sulfid cho'kma hosil bo'ladi
Bu reaksiya vodorod sulfid uchun analitik namunalar sifatida ishlatiladi.
Oltingugurt oksidi
Oltingugurt bir nechta oksidi hosil qiladi, ulardan ikkitasi eng muhim: oltingugurt dioksidi va oltingugurt trioksidi.
Oltingugurt dioksidi o'tkir, bo'g'iq hidli, qizg'in, rangsiz gazdir. Laboratoriya sharoitida u oltingugurtni havoda yoki kislorodda yondirib, ba'zi sulfit tuzlariga issiq suvli kislota eritmasini qo'shib yoki mis bilan birga konsentratsiyalangan sulfat kislota qo'shiladi:
Sülfür dioksid kislota oksidi. U suvda eriydi, sulfat kislota hosil qiladi. Ushbu kislota qisman ionlashtiriladi va shuning uchun zaif kislota:
Natriy gidroksidi eritmasi orqali oltingugurt dioksidi gazidan o'tib, natriy sulfidi hosil bo'ladi. Natriy sulfit, oltingugurt dioksidining ko'pligi bilan reaksiyaga kirib, natriy gidrosulfit hosil qiladi, bu reaktsiyalar karbonat angidridni ohak suv bilan reaktsiyaga o'xshaydi.
Ham gazsimon oltingugurt dioksidi va uning suvli eritmasi moddalarni kamaytiradi. Misol uchun, gazsimon oltingugurt dioksidi sulfat a hosil qilish uchun oksidi pasaytiradi sulfat kislota ionni ionga qaytaradi
Sanoat sharoitida oltingugurt dioksidi havodagi oltingugurt yoki sulfid rudalarini kavlab olish yo'li bilan olinadi va oltingugurt kislotasini olish jarayonida qidiruv mahsulot sifatida ishlatiladi (7-bobga qarang). Sülfür dioksid, kumaşların ağartılması uchun, shuningdek meva va sabzavotlarni uzoq muddatli saqlash paytida qayta ishlash uchun ishlatiladi.
Atmosfera ifloslanishida va ayniqsa kislota yomg'irining shakllanishida oltingugurt dioksidi muhim rol o'ynaydi. Atmosferada u oltingugurt trioksidiga oksidlanadi:
Oddiy sharoitlarda bu jarayon juda sekin o'sib boradi, ammo katalizator ishtirokida, u sulfat kislota ishlab chiqarish jarayonida bo'lgani kabi, sezilarli darajada tezlashadi. Atmosferadagi oz miqdorda temir va marganets birikmalari oltingugurt dioksidning oksidlanishini katalizatsiyalashga o'xshaydi. Natijada oltingugurt trioksidi havodagi namlik bilan reaksiyaga kirishadi va shuning uchun kislotaning yomg'irini ko'taradigan bulutlar paydo bo'ladi (12-bobga qarang).
Qattiq oltingugurt trioksidi polimorfik birikma hisoblanadi. Ularning eng muhim ikkita shakli: birinchi bo'lib tsiklik tuzilishga ega trimer (15.24, a); kristall shaffofdir. asiklik polimer tuzilishiga ega (15.24, b); u igna shaklida mavjud. Erish nuqtasi Namlik borligida, asta-sekin ikkala shaklda qaynatiladi 45 ° S da. Oltingugurt trioksidi bug'i izolyatsiya qilingan nosimmetrik tekis molekulalardan iborat.
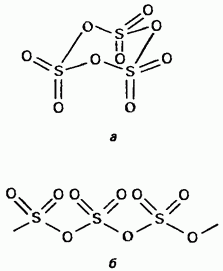
Shakl. 15.24. Oltingugurt trioksidi, a - tsiklik tuzilishi, b - asiklik tuzilish.
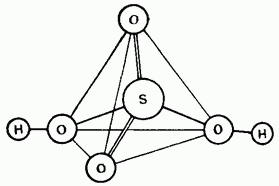
Shakl. 15.25. Sülfürik kislota molekulalarining tuzilishi.
Laboratoriya sharoitida sulfat isitgich yordamida oltingugurt trioksidi olinadi
Oltingugurt trioksidi kuchli kislotali xususiyatlarga ega. Sülfürik kislota hosil qilish uchun ekzotermik ravishda suv bilan reaksiyaga kiradi:
Oltingugurt trioksidi kuchli oksidlovchi vositadir. Masalan, vodorod bromidi erkin bromga oksidlanadi.
Sülfürik kislota
Sülfürik kislota - rangsiz yog'li kostik suyuqligi. Bu eng muhim sanoat kimyoviy mahsulotlaridan biridir. Aloqa jarayoni va uni qo'llash orqali sanoat ishlab chiqarishi Ch. 7
Kislota sulfat kislota kovalent birikma. Uning molekulalari tetraedral tuzilishga ega (15.25-rasm).
Sülfürik kislota 340 ° C'de qaynatib, parchalanib, oltingugurt trioksit va suv hosil qiladi
Yuqori qaynoq nuqtasi va oltingugurt kislotasining yuqori viskozitesi, vodorod atomlari va qo'shni molekulalarning kislorod atomlari orasidagi vodorod aloqalarining mavjudligi bilan bog'liq.
Sülfürik kislota kuchli dibazik kislota. Suvda umuman ionlashtirilib, gidroksulfat va sulfat ionlari hosil bo'ladi:
Sülfürik kislota, kislotalarning xarakterli barcha reaksiyalarida ishtirok etadi. Metalllar bilan reaksiyaga kirib, bu metallar va vodorod sulfatlarini hosil qiladi, karbonat bilan reaksiyalarda sulfatlar, karbonat angidrid va suv hosil qiladi, bazalar va gidroksimon reaktsiyalarda sulfatlar yoki gidroliferatlar shakllanadi.
Konsentrlangan sulfat kislota suv bilan juda kuchli ta'sir ko'rsatadi. Shuning uchun oltingugurt kislotasi har doim suvga to'kib tashlanishi kerak, aksincha emas. Ushbu kislota gigroskopik, ya'ni u havodan namlikni olish qobiliyatiga ega. Shuning uchun, u bilan reaksiyaga kirishmagan, ularni oltingugurt kislotasi orqali o'tadigan gazlarni quritish uchun ishlatiladi. Sülfürik kislota suvga yaqinligi shunchalik kattaki, sülfürik kislota suvsizlantiruvchi modda sifatida xizmat qilishi mumkin; konsentrlangan sulfat kislota ta'sirida:
sulfat pentahidratning ko'k kristallari suvsiz sulfat hosil qiladi
sarkoz kabi karbonhidratlar kuydiriladi:
qog'oz, shuningdek, konsentrlangan sulfat kislota ta'siri tufayli kislotaning tsellyulozali tolalar ta'siridan kelib chiqadi;
o'rganish etilene aylanadi:
(Sulfat kislota bilan o'rganish dehidratsiyasi, nazorat ostida amalga oshiriladi
sharoitlar etoksietan (dietil efir) hosil bo'lishiga olib keladi va bu reaktsiya sanoat miqyosida etoksietan ishlab chiqarish uchun ishlatiladi);
klorobenzen va trikloroethanal (xlor) aralashmasi suvsizlanadi (16.3-bandga qarang).
Konsentrlangan sulfat kislota kuchli oksidlovchi moddadir. Metall va metall bo'lmagan moddalarni oksidlaydi. Misol uchun
Joylashgan konsentrlangan sulfat kislota oksidlovchi xususiyatlarini ko'rsatadigan boshqa misollar kabi, biz quyidagi reaktsiyalarda ionlarning oksidlanishini va bromli ionlarni erkin bromga aylantiramiz:
Nihoyat, sulfat kislota organik kimyo sohasida sulfatlash vositasi sifatida ishlatiladi (17-bobga qarang).
Sulfatlar, sulfitler va tio birikmalari
Sulfat ioni sulfat kislota molekulasining tuzilishiga o'xshash tetraedral tuzilishga ega.
Tuz Sülfatlar, sulandırılmış sülfürik kislotalarning metallar, oksidi, gidroksidi yoki karbonatlar bilan reaktsiyalarida hosil bo'ladi. Bariy sulfatdan tashqari va qolgan sulfatlar suvda eriydi. Kaltsiy sulfat suvda past eruvchanlikka ega. Sulfat odatda issiqlikka chidamli bo'ladi. Faqat istisnolar temir sulfatdir. Misol uchun, sulfat temir oksidini hosil qilish uchun qizdirilganda ajraladi:
Har qanday eritmada sulfat ionlarini aniqlash uchun bariy xloridning suvli eritmasi qo'shiladi. Agar sulfat ionlari sinov eritmasida mavjud bo'lsa, natijada bariy sulfatning oq cho'kmasi shakllanadi:
Sülfatların juda muhim foydalanish bor. Misol uchun, magniy sulfati (ingliz tuzi, achchiq tuz) portlovchi moddalarni ishlab chiqarishda, matolar ishlab chiqarishda va yong'inga chidamli matolarda qo'llaniladi. Ushbu tuzning to'yingan eritmasi tibbiy amaliyotda yallig'lanishga qarshi vosita sifatida qo'llaniladi.
Natriy tiosulfat natriy sulfat analoglari sifatida qaralishi mumkin, unda bir kislorod atomining o'rnini oltingugurt atomiga almashtirish mumkin. Bunday thioso birikmalari orasida boshqasini qayd etish kerak - kaliy tiosiyanat. Kaliy siyanatning oltingugurt analojisi. Kaliy tiyosiyanat kaliy siyanidni oltingugurt bilan birlashtirib olinadi:
Kaliy tiosiyanat ionlarni aniqlash uchun sifatli analizda ishlatiladi, agar bu ionlar test eritmasida mavjud bo'lsa, kaliy tiosiyanat eritmasini qo'shib, unga murakkab ion hosil bo'lishiga qarab qon qizil rang paydo bo'lishiga olib keladi.
Shunday qilib, takrorlang!
1. VI guruhning pastki qismiga o'tishda elementlarning xossalari asta-sekin metalldan metallga o'zgaradi.
2. VI guruh elementlari vodorod va reaktiv metallar bilan birikib, ular -2-oksidlanish holatiga ega bo'lgan birikmalar hosil qilish qobiliyatiga ega.
3. Kislorod yuqori elektrodegativligi va kuchli oksidant xususiyatlariga ega.
4. Ozon kisloroddan ko'ra kuchli oksidantdir.
5. kislorod nafas olish va metabolik jarayonlar (metabolizm) jarayonlarida ishtirok etgan biologik tizimlarda juda muhim rol o'ynaydi.
6. Oxygen ikkilik birikmalar hosil qiladi, turli birikmalar bilan oksidlar boshqa birikmalar bilan:

7. Vodorod periks - kuchli oksidlovchi moddadir.
Erkin shaklda oltingugurt bir necha enantiotropik shakllarda mavjud bo'lishi mumkin.
9. Er osti konlaridan oltingugurtni olish uchun siqilgan havo va qizib ketgan bug'dan foydalanadigan Frash jarayoni qo'llaniladi.
10. Kükürt oksidlanish hollari +2, +4, +6 va -2 bo'lgan hollarda bo'lgan birikmalar hosil qiladi.
11. Vodorod sulfidi - zaif dibaz kislotasi va kamaytiruvchi agent.
12. Gazli oltingugurt dioksid va uning suvli eritma-tushiruvchi agentlari.
13. Kükürt trioksit kislota va oksitleyici xususiyatlarini qattiq turibdi.
14. Sülfürik kislota kuchli dibazik kislota, kurutucu, dehidratlayıcı modda va kuchli oksitleyici modda.
15. Sülfürik kislota molekulalari va sulfat ionlari tetrahedral tuzilishga ega.