Sio2 ning fizik xususiyatlari. Kislorodli birikmalar. Silikon (II) SiO
Silikon oksidi (II) SiO. Tabiatda, u paydo bo'lmaydi, lekin reaktsiya orqali erishish mumkin:
SiO 2 + Si → 2 SiO ni tashkil qiladi.
Oddiy bosim ostida silikon monoksitning sublimatsiya jarayoni taxminan 1200 ° Cda boshlanadi (boshlang'ich materiallar deyarli o'z-o'zidan bug'langanda). Ikkala juftlikda SiO - bu alohida birikma. Elementlarning ajratish quvvati 789 kJ / mol dir. Qattiq holatga konvertatsiya qilish faqat gaz fazasini tez sovutish ("sovutish") orqali amalga oshirilishi mumkin. Aks holda, tenglamadan ajratish vaqti bor:
2 SiO = SiO 2 + Si.
Silikon monoksit atmosfera kislorodi bilan asta-oksidlantiriladi va silika kislotasi tuzlari va vodorodni chiqarish uchun osonlikcha gidroksidi eritiladi. U kuchli ishtiyoq bilan ishqalanish orqali osongina elektrlashtiriladi.
Silikon oksidi (IV) SiO 2.Silikon oksid (IV) ga silika deyiladi. Bu qattiq refrakter moddadir. (erish nuqtasi 1700 ° S)tabiatda ikki xil shaklda keng tarqalgan: 1) kristalli silika - kvarts minerallari va uning navlari (tosh kristall, kalsedon, agat, jasper, chakka) shaklida; kvarts qurilishda va silikat sanoatida keng qo'llaniladigan kvarts qumlarning asosini tashkil etadi; 2) amorf silika - mineral opal tarkibida SiO 2 ko'rinishida nH 2 O; amorf kremniyning er shakli diatomit, tripoli (infuzorli er); Sun'iy amorf suspenziya silika misoli natriy metasilikatidan olingan silika gelsidir:
Silika jeli rivojlangan sirtga ega va shuning uchun namlikni yaxshi qabul qiladi.
1710 ° kvarts eriydi. Erigan eritmani tez sovutganda kvarts shishasi hosil bo'ladi. Issiq kvarts shishasi suvni tez sovutganda yorilishiga yo'l qo'ymaydi, shuning uchun u juda kengayish koeffitsientiga ega. Laboratoriya uskunalari va asbob-uskunalari ilmiy tadqiqotlar uchun kvarts shishasidan ishlab chiqariladi.
SiO 2 ning planar tasvirdagi tuzilishi quyidagicha ifodalanadi:
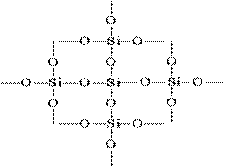
Har bir silikon atomi 4 ta kislorod atomining tetraedrida saqlanadi. Bunday holda silikon atomining markazida joylashgan va kislorod atomlari tetraedrning tepasida joylashgan. Barcha kremniy parchasini kristall deb hisoblash mumkin, uning formulasi (SiO 2) n. Bunday struktura kremniy oksidi (IV) uning yuqori qattiqligini va refrakterligini aniqlaydi.
Silikon oksidi (IV) SiO 2 ning kimyoviy xossalari kislota oksidlariga mos keladi. Qattiq gidroksidi, asosiy oksidi va karbonat bilan eritib, silisli kislota tuzlari hosil bo'ladi:
Faqat hidroflorik kislota silikon oksid (IV) bilan (shisha tortish) o'zaro ta'sir qiladi:
SiO 2 + HF → SiF 4 + H 2 O
Silikon (IV) oksidi suvda erimaydi va u bilan kimyoviy ta'sir o'tkazmaydi. Shuning uchun, masalan, gidroliz bilan bilvosita kremik kislota olinadi:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 orthosilikon kislotasi.
H 4 SiO 4 eriydi, qizdirilganda yoki tik turganda, polimerizatsiya jarayoni boshlanadi:
2H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 diorthokremnie kislota.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 tetraorotremilic kislota.
U uzukni yopadi:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 tetrametacilik kislotasi.
Bu holda silika kislotasi (tuz va kislota dastlabki eritmalarining konsentratsiyasiga qarab) suvni o'z ichiga olgan jelatinli massa shaklida va kolloid eritma shaklida (chap) shaklida olinishi mumkin. Olingan silik kislotasining tarkibi preparatning boshlang'ich materiallari va shartlariga bog'liq. Barcha silik kislotalar juda zaif (ko'mirdan zaif).
Agar eritmadagi karbon kislotasi uning tuzlaridan silika kislotasini chiqarib yuborsa, u holda kalsinlanish jarayonida teskari reaksiya paydo bo'ladi. Birinchisi, kremniy kislotaning quyi kuchliligi (ikkilamchi daraja), ikkinchisi - qizdirilganda uning past volatilitesi.
Issiq polilisil kislotalari va ularning bosqichma-bosqich dehidratsiyalashganida, ular deyarli nozik SiO 2 dan olinadi silika jeli . U suvni yaxshi absorbe qiladi, qimmatbaho elementlarning oksidlanishiga yo'l qo'ymaslik uchun uni qurilmalarga joylashtiraman.
Germaniya kichik guruh
Ge (+4) Sn (+2, +4) Pb(+2) - chidamli oksidlanish hollari
Germaniyani 1871 yilda DI Mendeleev tomonidan prognoz qilingan va 1886 yilda kashf etilgan. Kalay va qo'rg'oshin insoniyatga eng ko'p ma'lum bo'lgan elementlarga uzoq vaqt davomida ega bo'lgan: Misrliklar mil. e. Hindistonda kashfiyot taxminan 2500 yilni va miloddan avvalgi 1500 yilni tangan. e. Qadimgi Xitoyda ishlab chiqarilgan kalay qopqalari.
Qabul qilish.Germanyning tabiiy aralashmalari GeO 2 ga aylanadi va vodorod bilan kamayadi:
GeO 2 + H 2 t → G + H 2 O taxminan 1000 ° S haroratda.
Kalay tabiiy minerallardan olinadi kassiterit(SnO 2):
SnO 2 + C → Sn + CO.
Sanoat qo'rg'oshinini qisqartirish uchun eng oddiy sxema ikki ardışık reaktsiyaga asoslangan:
PbS + O 2 → SO 2 + PbO Galena(PbS) yondiriladi va ko'mir bilan kamayadi:
PbO + S → SO + Pb.
Dastur.Barcha uch element zamonaviy texnologiyalar uchun juda muhimdir. Qalin va qo'rg'oshinning ba'zi bir birikmalari ham sezilarli darajada qo'llaniladi. Qo'rg'oshin lotin mahsulotlari juda toksik.
Germuum odatda yarim o'tkazgichdir (n-turi 0,75 eV gardish kengligida) va elektrotexnikada turli xil usullarni topadi. AC rektifikatorlarini ishlab chiqarishda keng qo'llaniladi.. Ushbu dastur sof germanium va germanyum qotishmasi bilan indiy bilan aloqa qilish natijasida paydo bo'lgan unipolar o'tkazuvchanlikka asoslangan. Amaldagi (elektron oqimi) bunday o'rnatishda amalda faqat Germaniyadan qotishma, lekin aksincha emas. Germanyum rektifikatorlari juda yuqori (taxminan 98%) samaradorligi va juda katta (to'g'ri ishlashi bilan) xizmat muddati bilan ajralib turadi. Bunday rektifikatorlarning asosiy kamchiliklari ularning isitishga nisbatan yuqori sezgirligi - 70 ° Cdan yuqori bo'lib, ularning samaradorligi tezda pasayadi.
Muhim foydalanish maydoni germaniya infraqizil optikadir, chunki 2 mikrondan oshiq to'lqin uzunligi bo'lgan nurlar, amalda kechiktirmaydi. Aksincha, yorug'likda va unga yaqin (0,2-2 mikron) germanyut energiyani chuqur singdiradi. Agar porloq metall sirt (issiqlik yaxshi saqlanadi, lekin yaxshi isitilmasa) germanyum plyonka bilan qoplangan bo'lsa, unda sirt bir filmsiz ortiq ko'p qiziydi. Quyosh nurlari ta'siri ostida tayyorlangan barrelda qaynoq suv olinadi.
Kalay, asosan, paslanmadan saqlanish uchun temirni kalaylash uchun ishlatiladi. (konserva sanoati uchun qalpoq). Bunday kalay qoplamalarining qalinligi juda kichik - mikronlarning tartibida. Yupqa qatlamlar (Stannioles deb ataladi) shaklida kalay elektr sanoatida kondansatkichlarni ishlab chiqarish uchun sarflanadi . Qo'rg'oshin akkumulyator plitalari, elektr kabellari, o'q-dorilar va otishni o'rganish uchun, rentgen nurlari va g-nurlari, shuningdek, kimyo sanoati (quvurlar, va boshqalar) dan himoya qilish uchun ishlatiladi. Qalin va qo'rg'oshinning juda ko'p miqdori texnik jihatdan muhim bo'lgan bir qator alyuminiylarni ishlab chiqarishga sarflanadi.
Eng muhimi, turli bronzalar (Cu va Sn qotishmalari), rulman uchun qotishmalar (odatda Pb yoki Sn asosida ishlab chiqarilgan va shuningdek, Sb va Cu), tipografik qotishmalar (5-30% Sn, 10-20% Sb, qolganlari Pb) va odatdagi "yumshoq" lehim (30-70% Sn, 70-30% Pb). U tez-tez 90% Pb, 6% Sn, 4% Sb arzonroq qotishma bilan almashtirilishi mumkin. Muhim ahamiyatga ega bo'lgan rulmanlar uchun taxminan 98% Pb, 1% Ca, 1% Na bo'lgan qotishmalar mavjud.
Silika (silika, silika) - yuqori quvvatli, qattiqlik va refrakterliksiz rangsiz kristallardan iborat bo'lgan moddadir. Silikon dioksid kislotalarga chidamli va suv bilan ta'sir qilmaydi. Reaksiya temperatürü ortishi bilan modda alkalilerle ta'sir ko'rsatadi, hidroflorik kislota ichida eriydi, mukammal dielektrikdir.
Tabiatda silikon dioksid keng tarqatiladi: kristalli silikon oksidi jasper, agat (kristalli silikon dioksid aralashmalari), tosh kristalli (materiyaning yirik kristallari), kvarts (erkin silikon dioksid), kaltsidon, ametist, morion, topaz (rangli kristallar) silika).
Oddiy sharoitlarda (tabiiy muhit harorati va bosimida) silikon dioksid - tridimit, kvarts va kristobalitning uchta kristall modifikatsiyalari mavjud. Harorat ko'tarilsa, silikon dioksid avval koesitga, so'ngra stishovitga (meteorit kraterida 1962 yilda topilgan mineral) aylanadi. Tadqiqotlar natijalariga ko'ra, bu silikon dioksidning tirjisi bo'lgan Stisovit bo'lib, Yer mantiyasining katta qismini tashkil etadi.
Moddaning kimyoviy formulasi - SiO 2
Kremniyni tayyorlash
Silikon dioksid sanoat kvars zavodlarida kvars kontsentratini ishlab chiqaradi, u keyinchalik kimyoviy va elektron sanoatida, optika, kauchuk va bo'yoq, vernik to'ldiruvchilari, zargarlik buyumlari ishlab chiqarishda va boshqalarda ishlab chiqariladi. Qurilishda (beton, qum, tovush va issiqlik izolyatsiyasi materiallari) tabiiy kremniy dioksid, aks holda silika deb ataladi.
Silikon dioksidni sintetik usulda sintez qilish kislotalarning natriy silikatiga ta'siri, ayrim hollarda boshqa eruvchan silikatlar bo'yicha yoki kolloid silikaning ionlar ta'sirida koagulyatsiya qilish usuli bilan amalga oshiriladi. Bundan tashqari, silikon dioksidi silikon kislorodi bilan 500 ° C gacha bo'lgan haroratda oksidlanish orqali ishlab chiqariladi.
Silikon dioksidni qo'llash
Silikon tarkibidagi materiallar ham yuqori texnologiyalar sohasida, ham kundalik hayotda keng qo'llaniladi. Silikon dioksid shisha, keramika, beton buyumlar, abraziv materiallar ishlab chiqarishda, shuningdek radiotexnika, ultratovush qurilmalari, yoritgichlar va boshqalarni ishlab chiqarishda qo'llaniladi. Bir qator ingredientlar bilan birgalikda tolali optik kabellarni ishlab chiqarishda silika ishlatiladi.
Ko'kraksiz amorf silikon dioksid oziq-ovqat sanoati uchun E551 sonida ro'yxatga olingan, asosiy mahsulotni yig'ish va pishirishni oldini olish uchun qo'shimcha modda sifatida ishlatiladi. Dioksid  silikon oziq-ovqat mahsulotlari dori sanoati sohasida dori enterosorbent sifatida, tish po'stini ishlab chiqarishda ishlatiladi. Maqola chiplar, krakerlar, makkajo'xo'rlar, tezkor qahvalarda va boshqalarda mavjud.
silikon oziq-ovqat mahsulotlari dori sanoati sohasida dori enterosorbent sifatida, tish po'stini ishlab chiqarishda ishlatiladi. Maqola chiplar, krakerlar, makkajo'xo'rlar, tezkor qahvalarda va boshqalarda mavjud.
Silika zararli
Silikon dioksid moddasi miya oshqozon-ichak trakti ichidan o'tib ketganini rasmiy ravishda tasdiqladi, undan keyin u butunlay vujuddan chiqarildi. Frantsiyalik mutaxassislarning 15 yillik tadqiqotiga ko'ra, yuqori miqdorda alumina ichimlik suvi ichish Altsgeymer kasalligini 10 foizga kamaytirish xavfini kamaytiradi.
Shunday qilib, kimyoviy inert modda bo'lgan silikon dioksidning xatarlari to'g'risidagi ma'lumotlar noto'g'ri: E551 dietasi sut sog'lig'i uchun mutlaqo xavfsizdir.
Silikon oksidi SiO 2 qattiq, juda refrakter moddadir (erish nuqtasi 1700 ° C dan ortiq), u asosan kvarts minerali, shuningdek, kristobalit va tridimit shaklida topilgan tabiatda keng tarqalgan.
Odatiy haroratlarda, kvarts barqaror modifikatsiyadir, haroratning ko'tarilishi polimorfik o'zgarishlar kuzatiladi:
Monomer shaklidagi barcha modifikatsiyadagi silika mavjud emas; u har doim polimerik va tetrahedraning "kuchli" atomlarini yaratgan
(SiO2) n kristallari ichidagi har bir silikon atomi to'rtta kislorod atomi bilan tetrahedrali bo'lib, ularning har biri ko'prik hisoblanadi. Umumiy kislorod atomlari orqali turli burchaklardagi tetraedra bir-biriga bog'lab, doimiy uch o'lchovli panjarani hosil qiladi; kosmosda tetraedralarning o'zaro tuzilishi silika bir yoki bir nechta modifikatsiyasini aniqlaydi.
Silis bog'lanishining turli xil modifikatsiyalari o'zgaradi. Bu Si-O-Si burchaklarining kattaligiga va Si-O masofalariga ta'sir qiladi, masalan, kremniyning turli modifikasiyasidagi Si-O-Si munosabatlari burchagi 120 dan 180 ° gacha o'zgarib turadi. Kvarts-tridimit-kristobalit o'tishlari faqat yuqori haroratlarda yuzaga kelishi mumkin bo'lgan bog'lanishlarni parchalash va konvertatsiya qilish bilan birga keladi.
Kvarts Ko'pincha juda yaxshi shakllangan kristallar shaklida tabiatda topilgan, ba'zan sezilarli darajada. Kristalllar tetrahedradan spiral shakldagi markaziy eksa atrofida, spiral shaklida joylashtirilgan. Xuddi shu kristallda spirti yo'nalishi teskari bo'lishi mumkin. Bunday kristalllar optik izomerlerdir. Ular yorug'lik polarizatsiyasi tekisligini aylantiradilar va o'ng va chap tomondan ham bo'lishi mumkin. Bu va boshqa kristallar o'zlarining ko'zgu imidjidan mavzu sifatida farq qiladi.
Kvarts ilm-fanning turli sohalarida ishlatiladi va uning kristallari ko'pincha sun'iy ravishda yetishtiriladi. Kvartsning ayrim turlari maxsus nomlardir. Shaffof rangsiz kristallar tosh kristal deb nomlanadi. Shuningdek, kvartsning rangli navlari ham bor: gul kvarsi, binafsha (ametist), qora jigarrang (tuproqli topaz), yashil (xrizopraza) va boshqalar. Kvartsning boshqa moddalar aralashmalari bilan kristalli modifikatsiyasiga kalsedon deyiladi. Kalsedonlarning turlari agat, jasper va boshqalardir. Kristalli va rangli kvarts navlari qimmatbaho va yarim qimmatbaho toshlar sifatida ishlatiladi.
Tridimit vulkanik jinslarda uchraydi, lekin juda kam miqdorda. Ma'lum tridimit va meteorit kelib chiqishi.
Tabiatdagi kristobalit ba'zan tridimit kabi lava ichiga o'rnatilgan kichik kristall shaklida topilgan. Tridimit va kristobalit kvartsdan ko'ra ko'proq "yumshoq" strukturaga ega. Shunday qilib, kristobalit, tridimit va kvartsning zichligi 2,32 dir; Navbati bilan 2.26 va 2.65 g / sm3 ga teng.
Silikaning asta sovutish bilan eritilishi osongina amorf kvarts shishasini hosil qiladi. Shisha shakldagi silika tabiatda ham mavjud. Amorf shishaning zichligi - 2,20 g / sm3 - barcha kristall modifikatsiyalarga qaraganda past. Kvarts shishasining kengayishi uchun eng kichik harorat koeffitsienti mavjud, shuning uchun haroratning to'satdan o'zgarishiga chidamli bo'lgan laboratoriya idishlarini tayyorlash uchun ishlatiladi.
Silikaning barcha modifikatsiyalari deyarli erimaydi (25 ° C haroratda, kvartsning eruvchanligi 7, kristobalit - 12, tridimit - 16, kvarts shishasi - 83 mg / l). Shuning uchun, odatdagi sharoitlarda faqat gidroksidi eritmalar va hidroflorik kislotalar ta'sir ko'rsatadi:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O (2)
Bu oxirgi reaktsiya shishaning "o'ynashida" ishlatiladi.
Qo'shilgan silika asosiy oksidlar, gidroksidi (reaksiya (1)) va karbonatlar bilan reaksiyaga kirishadi:
SiO 2 + CaO = CaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
Reaktsiyalar (3) va (4) har xil ko'zoynaklar ishlab chiqarish, shuningdek, tsement ishlab chiqarishga asoslanadi. Shunday qilib, odatdagi shishaning tarkibi (masalan, idishlarni tayyorlash uchun oyna) NaO 2 formulasi bilan ifodalanadi. CaO. 6SiO 2. Bunday oynalar soda, qum va ohaktosh aralashmasi bilan hosil qilinadi. Jarayon 1400 ° S gacha bo'lgan haroratda amalga oshiriladi.
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
Ayni choyshab uchun odatiy bo'lmagan, "ajralmas" - pishirish paytida bariy oksidi, qo'rg'oshin, bor qo'shing. Rangli ko'zoynaklar olish uchun turli qo'shimchalar kiritiladi, masalan, kobalt oksidi Co 2 O 3 ni qo'shib ko'k rang, krom oksid Cr 2 O 3 - yashil, marganets dioksidi MnO 2 - pushti.
SiO 2 oksidi xSiO 2 ∙ yH 2 O umumiy formula bo'yicha ifodalanishi mumkin bo'lgan bir qator silisli kislotalarning anhidrididir, bu erda x va y tamsayı raqamlari: 1) x = 1, y = 1: SiO 2. H 2 Oh, ya'ni H 2 SiO 3 - meta-silikon kislotasi; 1) x = 1, y = 2: SiO 2. 2H 2 O, ya'ni. ortosilik kislotasi; 1) x = 2, y = 1: 2SiO 2. H 2 Oh, ya'ni H 2 Si 2 O 5 - bimetalik kremniy kislotasi.
Moleküllerinde bir nechta SiO2 molekulasi bo'lgan kislotalar polikilicona tegishli.
Silisik kislotalarning eng oddiy turi H 2 SiO 3, bu odatda oddiy silikon deyiladi va uning tuzlari silikatdir. Silikatlardan faqat natriy va kaliy silikatlar suvda eriydi, qolgan silikatlar esa odatiy, suvda erimaydigan moddalardir.
Silikatlarning eritmalari havoda turganda loyqalanib ketadi, chunki uning tarkibidagi CO2 o'z tarkibida silikat kislotasini chiqaradi (H 2 SiO 3 karbonat kislotasidan zaif, birinchi bosqichda H 2 SiO 3 ning ajralish sig'imi K1 = 2.2 ga tengdir.) 10 -10 ).
H 2 SiO 3 suvda deyarli erimaydi - bu xususiyat silikat ionlarini aniqlash uchun sifatli reaktsiya sifatida ishlatiladi:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Silikatlar SiO 2 ni alkalis yoki karbonatlar bilan to'ldirish orqali olinadi.
Natriy va kaliy silikatlarning konsentrlangan eritmasiga suyuq shisha deyiladi, ular yuqori darajada gidrolizlanganligi sababli kuchli gidroksidi reaktsiyaga ega:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Suyuq shisha, masalan, elim, suv o'tkazmaydigan mato ishlab chiqarish uchun ishlatiladi.
Tsement qurilishda juda ko'p ishlatiladi, bu esa suv bilan qattiq aralashtirilganda. Odatda, turli silikatlar qovurilgan va erga (-1000 ° S haroratda) ega bo'lgan katta burilish punktlarida tsement ishlab chiqariladi.
Tsementning bir nechta turlari mavjud, biroq buning shartli ravishda ikki turdagi tsementni "koagulatsiya" printsipiga ko'ra ajratish mumkin: oddiy tsement va portlend tsement. Kaltsiy silikatdan tashkil topgan an'anaviy sementni "sozlash" jarayoni havoda karbonat angidrid tufayli kaltsiy karbonat hosil bo'lishidan kelib chiqadi:
Cao. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Portlend tsementining karbonat angidridini aniqlash jarayonida ushbu jarayonda ishtirok etilmaydi va silikatning gidrolizlanishi keyinchalik erimaydigan kristalli gidratlar hosil bo'ladi.
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Karbür va silisidlar
· Karbon va silikon aralashmalari - karbidlar va silitsidlar, hisoblangan reaktsiyalarga qo'shimcha ravishda, kremniyning metall gidridlari bilan o'zaro ta'siri bilan erishiladi, masalan:
· 2CaH 2 + Si = Ca 2 Si + 2H 2.
· Bu reaktsiyalar yuqori haroratlarda sodir bo'ladi. Karbidlar orasida "metanid" va "asetilen" deb ataladi. Birinchisi, Oksidlanish holatida -4 (Be 2 C, Al 4 C 3), ikkinchisi - uglerod oksidlanish darajasi -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2) bo'lgan asetilen sanab chiqing kabi metan lotinlari hisoblanadi , CAC 2). Kumush oksidli yoki mis (I) xloridli ammiak eritmasi orqali asetilenni olish orqali kumush va mis (I) asetilitlarini osongina olish mumkin. Metanidlarning ko'pchiligi va asetilidlar suv bilan (ayniqsa, kislotalar bilan) faol reaksiyaga kirishib, tegishli uglevodorodlarni chiqaradilar:
· CaS 2 + 2H 2 O = Ca (OH) 2 + S 2 H 2,
Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C2H 2.
Karbidlardan farqli o'laroq, gidroksidi yoki gidroksidi er osti metallerinin silikatlari faqat suv va kislotalar bilan ta'sir o'tkazadi, bu oddiy silanon monosilan eng oddiy vodorod birikmasini ishlab chiqaradi,
· Ca 2 Si + 4HCl = 2CaCl2 + SiH 4.
· Silan rangsiz gazdir, u o'zida o'z-o'zidan havoga alangalanuvchi, SiO2 va suvga yonib ketadigan, mog'or hidiga ega:
SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Alkalis silanani tenglamadan osonlikcha ajratadi:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Suv ham silanni hidrolizlaydi, lekin juda sekin:
SiH 4 + 2H 2 O = SiO 2 + 4H 2.
· Havoga chiqishsiz 400 ° Cdan yuqori qizdirilganda silan silikon va vodorodga aylanadi (silikon ishlab chiqarish usullaridan biri):
SiH 4 = Si + 2H 2.
· Monosilan, disilan Si 2H 6, trizilan Si 3H 8, tetrasilan Si 4H 10 va hokazo. Bundan tashqari, ma'lum. Alohida holatda aralashmalar faqat Si 6H 14 ga qadar ajratilgan. Bu barcha birikmalar soddalashtirilgan silan seriyasiga tegishli bo'lib, ularning umumiy formulasi Si nH 2 n + 2 ga to'g'ri keladi. Alkanlarga o'xshab, silanlar rangsiz, homolog seriyaning dastlabki a'zolari odatdagidek gazlardir, quyida esa suyuqliklar mavjud. Silan va uglevodorodlarning kimyoviy faolligi har xil: etarlicha inert alkanlardan farqli o'laroq, sila barcha reaktiv hisoblanadi. Bu uglerodga nisbatan vodorod uchun past kremniyga yaqinligi va kislorod uchun silikonning juda yuqori yaqinligiga bog'liq. Bundan tashqari, Si-Si obligatsiyalari S-S munosabatlariga qaraganda kamroq bardoshli. C - H rishtalarining farqli o'laroq, Si - H munosabatlari ko'proq ion xususiyatiga ega.
· Si-E va CE aloqalarining energiyasi.
Si-Si rishtalarining past kuchlanishi homolog silanlarning seriyasining cheklanganligi bilan bog'liq.
Karbidlar va silikitsitlar orasida maxsus joy SiC karbonundasi bilan ishg'ol qilinadi, u ham silikon karbid, ham uglerod silikitsidi deb ataladi. Karborundning olmosga o'xshash tuzilishi tufayli yuqori erish nuqtasi bor; uning qattiqligi olmosga yaqin. Kimyoviy jihatdan SiC juda barqaror.
· Kolloid eritmalar kontseptsiyasi
Tabiatda va texnologiyada dispersli tizimlar tez-tez uchraydigan moddalar ichida bir zarraga teng ravishda taqsimlanadi.
Tarqalgan tizimlarda tarqalgan faza - nozik ajratilgan modda va tarqaladigan muhit - tarqalgan fazaning taqsimlangan bir hil moddasi. Dispers tizimlari orasida oddiy (to'g'ri) eritmalar, kolloid eritmalar, shuningdek, suspenziya va emulsiyalar mavjud. Ular bir-biridan birinchi navbatda zarracha kattaliklarida, ya'ni tarqalish darajasi (parchalanish) darajasida farqlanadi.
1 nm dan kichik zarracha hajmi bo'lgan tizimlar eritmik molekulalar yoki ionlardan tashkil topgan haqiqiy echimlardir. Ular bir fazali tizim sifatida qaralishi kerak. Zarrachalar 100 nm dan kattaroq tizimlar qo'pol dispersli tizimlar - süspansiyonlar va emülsiyonlardır.
Ketganlar distillangan faza qattiq bo'lgan va tarqaladigan vositaning suyuqligi bo'lgan va tarqalgan suyuqlikda amaliy deyarli çözünmeyen tarqalgan tizimlar.
Emulsiyalar tarqalgan faza va dispersiya vositasi o'zaro taqsimlanmagan suyuqlik bo'lgan tarqalgan tizimlardir. Emulsiyaning namunasi - bu sut, ularda mayda kichik yog'lar suyuqlikda suzadi.
Soqchilar va emulsiyalar bifazik tizimlardir.
Kolloid eritmalar dispersli muhit va dispersli fazadan tashkil topgan ikki fazali tizimlarga juda o'xshashdir va ularning zarrachalarining lineer o'lchamlari 1 dan 100 nm oralig'ida yotadi. Ko'rib turganimizdek, zarracha hajmi bo'yicha kolloid eritmalar haqiqiy echimlar va suspenziya va emulsiyalar o'rtasida oraliqdir. Kolloid zarralar odatda ko'p sonli molekulalardan yoki ionlardan iborat.
Kolloid eritmalar ham chap deb ataladi. Ular dispersiyon va kondensatsiya usullari bilan olinadi. Dispersing ko'pincha maxsus "kolloid tegirmonlari" yordamida amalga oshiriladi. Kondensatsiya uslubida kolloid zarralar atomlar yoki molekulalarni agregatlarga birlashtirib hosil bo'ladilar. Ko'pgina kimyoviy reaktsiyalar jarayonida kondensatsiya hosil bo'ladi va juda tarqoq tizimlar shakllanadi (yog'ingarchilik, gidroliz, oksidlanish-qaytarilish reaktsiyasi va boshqalar).
1 nm - nanometr (1 nm = 10 -9 m).
Haqiqiy echimlardan farqli o'laroq, sinxronlar Tyndall ta'siri, ya'ni kolloid zarrachalar tomonidan nurning tarqalishi bilan tavsiflanadi. Engil konus yorug'lik nuridan paydo bo'lganida, u qorong'i xonada ko'rinadi. 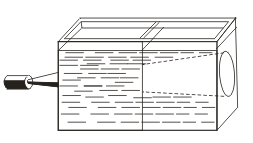 . Shunday qilib, siz ushbu yechimning kolloid yoki haqiqiyligini bilishingiz mumkin.
. Shunday qilib, siz ushbu yechimning kolloid yoki haqiqiyligini bilishingiz mumkin.
Sollarning muhim xislatlaridan biri shundaki, zarralar bir xil belgilarda elektr tokini bor. Shuning uchun ular katta zarrachalarga qo'shilmaydi va cho'ktirmaydi. Shu bilan birga ba'zi sollarning zarralari, masalan, metallar, sulfidlar, silisli va kalay kislotalari salbiy zaryadga ega, boshqalar, masalan, gidroksidlar, metall oksidi, musbat zaryadga ega. Zaryadning paydo bo'lishi kolloid zarrachalar bilan eritmadan ionlarning adsorbsiyasi bilan izohlanadi.
Chapni cho'ktirish uchun uning zarralari katta agregatlarga qo'shilishi kerak. Zarralarning katta agregatlarga birikmasi koagulyatsiya deb ataladi va ularning tortishish kuchi ostida cho'kindi jinslarga sedimentatsiya deb ataladi.
Odatda koagulyatsiya chapga qo'shilganda sodir bo'ladi: 1) elektrolitlar, 2) zarralari zaryadli zaryadga ega bo'lgan yana bir chap va 3) qizdirilganda.
