Kremniyning strukturasi sxemasi. Elektron qobiq tuzilishi
Atom qurilishi PS ning pozitsiyasi: III davr; IV guruh - etakchi; Yadro zaryadlari: +14 Si; Atomning tuzilishi: p = 14, e = 14, n = = 14 Elektron formula: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
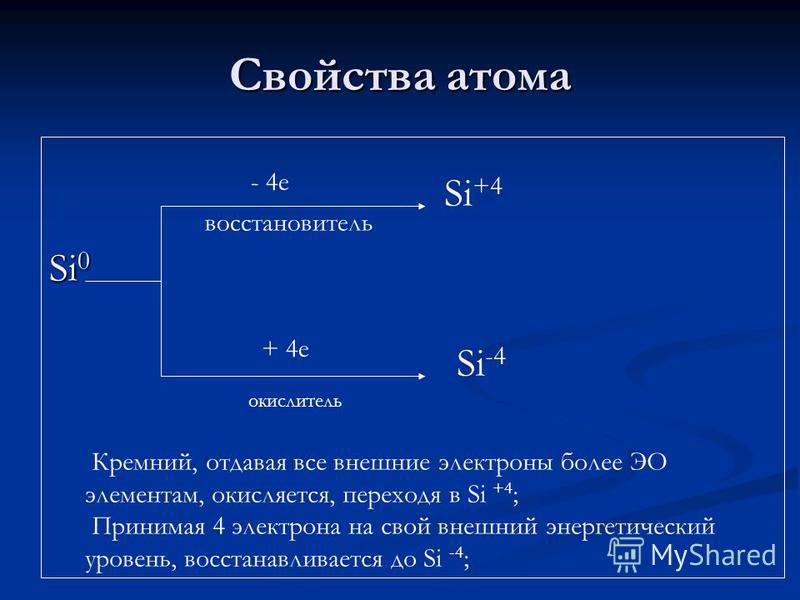
Atomik xususiyatlar Si + 4 Si oksidlovchi Si + 4 Si-4 silikon, barcha tashqi elektronlarni ko'proq EO elementlariga beradi, Si + 4 ga o'tish orqali oksidlanadi; Tashqi energiya darajasiga 4 ta elektronni Si-4 ga tushiradi;

Silikon silikonning fizik xususiyatlari metall bo'lmagan, kristallik va amorf holatda mavjud. Kristalli silikon metall nashrida bo'lgan, juda qattiq, lekin mo'rt bo'lgan kulrang-temir moddadir. Amorf silikon - jigarrang kukun. p = 2.33 g / sm3; t pl. = C; T kip. = C;

Silikonning kristalli tuzilishi A kristalli kremniy kristalli kubik yuzga joylashgan olmos turi hisoblanadi. Biroq, Si - Si orasidagi uzun ulanish uzunligi tufayli, silikonun qattiqligi olmosdan ancha past bo'ladi. Silikon nafaqat kırılgan, faqat S

Elektrofizik xususiyatlari Elemental silikon Elemental silikon odatda yarim o'tkazgichdir. odatda yarim Supero'tkazuvchilar. Kristalli silikonning elektrofizik xususiyatlari uning tarkibidagi izsiz aralashmalardan katta ta'sir ko'rsatadi. Silikonning yagona kristallarini teshik o'tkazuvchanligi bilan ta'minlash uchun 3-guruh bor elementlari, alyuminiy, galli va indiy elementlarning qo'shimchalari 5-guruh fosfor, arsenik yoki antimon elementlarining elektron o'tkazuvchanligi bilan kremniyga kiritiladi.


Flint Flint, bu Flint, bu yomon va juda yomon va juda bardoshli tosh, bardoshli tosh, tosh asrning tosh boshlanishiga zamin yaratdi - asr - chinni ishlaydigan asboblar asri. flint vositalari. Ikkita sabab bor: - silikonning tarqalishi va mavjudligi; - silikonning tarqalishi va mavjudligi; - yong'in paytida o'tkir qirralarning hosil qilish qobiliyati; - yong'in paytida o'tkir qirralarning hosil qilish qobiliyati;




Bilasizmi ... Kremniyni sof shaklda olish usuli Nikolay Nikolayich Beketov tomonidan ishlab chiqilgan. Rossiyada ishlab chiqarilgan silikon zavodlarida ishlab chiqariladi: Kamensk - Uralskiy (Sverdlovsk oblasti), Kamensk - Uralskiy (Sverdlovsk viloyati) Shelekh (Irkutsk oblasti). Shelekh (Irkutsk viloyati).

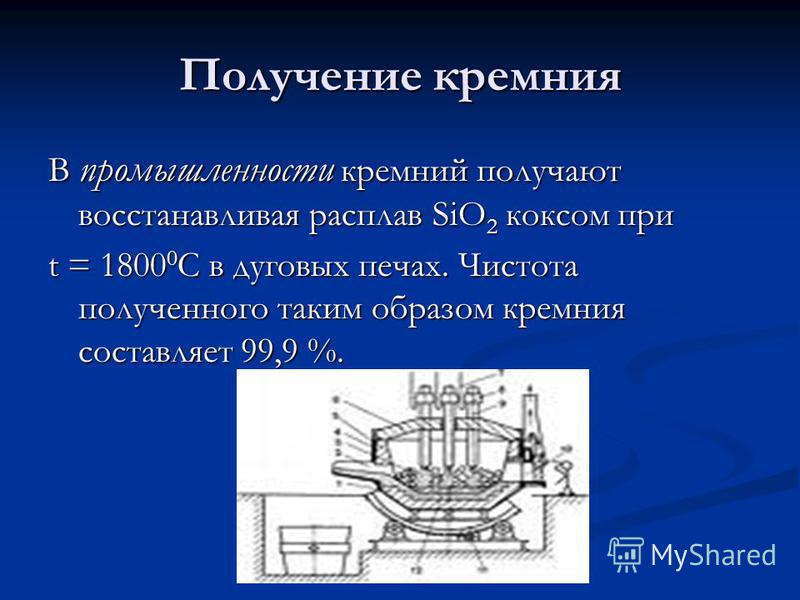
Kremniy ishlab chiqarish Sektorda kremniy oksidli pechlarda SiO2 eritmasini t = C da koks bilan kamaytirish orqali olinadi. Shu tarzda qo'lga kiritilgan silikonning tozaligi 99,9% ni tashkil qiladi.
Silikon olish Laboratoriyani ishlab chiqarish usuli: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Silikonning kimyoviy xususiyatlari 400 ° C ga qizdirilganda silikon kislorod bilan reaksiyaga kirib, silikon dioksidi hosil qiladi: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
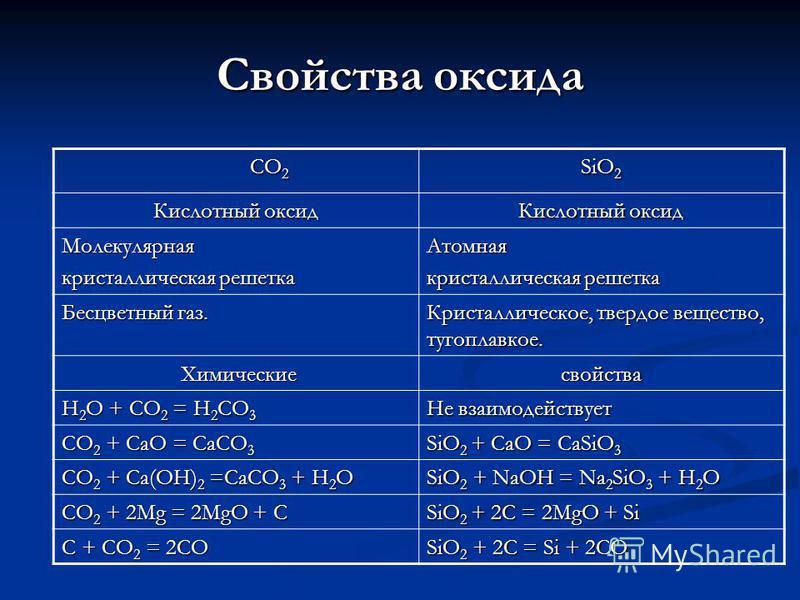
CO 2 CO 2 SiO 2 oksidining oksidli oksidli xususiyatlari. Molekulyar kristalli kafes. Atom. Rangsiz gaz. Kristal, qattiq, refrakter. Kimyoviy kimyoviy xossalari H 2 O + CO 2 = H 2 CO 3 CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 CaCO 3 + H 2 O SiO 2 + NaOH Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO2 + 2C = 2MgO + Si C + CO2 = 2CO SiO2 + 2C = Si + 2CO
Kislotalarning xossalari H 2 CO 3 H 2 SiO 3 Dibazik, kislorodli, zaif, zaif uchish. Dibaz, kislorodli, zaif, suvda erimaydigan. Qabul qilish: CO 2 + H 2 O = H 2 CO 3 Qabul qilish: SiO 2 + H 2 O = Stabil emas, nozik, tik turgan yoki qizdirilganda parchalanmaydi: H 2 CO 3 = CO 2 + H 2 O Saf shaklida tanlanmaydi, chunki isitish vaqtida parchalanadi: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Minor gaz evolyutsiyasi __________

Silisik kislota karbon kislotalari - karbonatlar; - uglevodorodlar; - silikatlar; - silikatlar; Karbonatlar tuzlarning barcha xususiyatlariga ega, kuchli elektrolitlar bo'lib, ionlarga butunlay ajraladi (suvda eruvchan). Faqat gidroksidi metall tuzlari eriydi, boshqalari erimaydigan yoki tuzlar hosil qilmaydi (Al +3, Cr +3, Ag +).
![]()



Biologik rol SiO 2 eng muhim silikon birikmasi o'simlik va hayvonot hayoti uchun juda muhimdir. Unga, g'azabga, g'azabga minan, unga rahmat, qamish, qamish va otliqlar hanjar kabi mustahkam turishadi. va horsetaklar siqib kabi qattiq turishadi. Sharp seda bargi barglari Sharp kabi kesilgan barglar, pichoq kabi kesilgan yaproqlar, o'rilgan pichoqdagi pichoqlar, yamalgan maydonda hashoratlar igna singari poxol bo'lib, ignalar kabi tayoqchalar sopi va shunga o'xshash go'shtning somoni shunchalik kuchliki, ular bu qadar kuchli emas Yomg'irdan yomg'irdan va dalalarda shamol maydonidan yomg'irdan va shamoldan o'tish uchun dalalarga yo'l qo'ymang


Silikon inson organizmida doimo mavjud bo'lgan iz element hisoblanadi. Uning eng katta miqdori limfa tugunlarida, aortaning birikma to'qimasida, traxeya, soch va terida mavjud. Epiteliya hujayralarini qurish uchun silikon kerak. Silikon inson organizmida doimo mavjud bo'lgan iz element hisoblanadi. Uning eng katta miqdori limfa tugunlarida, aortaning birikma to'qimasida, traxeya, soch va terida mavjud. Epiteliya hujayralarini qurish uchun silikon kerak. Suyak mineralizatsiyasi jarayonida silikon muhim rol o'ynaydi; arterial devorning moslashuvchanligini saqlab qolish uchun zarur bo'lgan, immunitet tizimiga ijobiy ta'sir ko'rsatadi va inson tanasining to'qimalarida qarish jarayonini sekinlashtiradi. Qondagi silikonning o'rtacha miqdori 8.25 mg / sutka. Yoshi vujudga keladigan darajada kamayadi, shuning uchun keksa odamlarda silikon ehtiyoji ortib bormoqda. Kalsiy, kaltsiy, magniy, marganets va kaliyning mavjudligi silikonning absorbsiyasini yaxshilang. Suyak mineralizatsiyasi jarayonida silikon muhim rol o'ynaydi; arterial devorning moslashuvchanligini saqlab qolish uchun zarur bo'lgan, immunitet tizimiga ijobiy ta'sir ko'rsatadi va inson tanasining to'qimalarida qarish jarayonini sekinlashtiradi. Qondagi silikonning o'rtacha miqdori 8.25 mg / sutka. Yoshi vujudga keladigan darajada kamayadi, shuning uchun keksa odamlarda silikon ehtiyoji ortib bormoqda. Kalsiy, kaltsiy, magniy, marganets va kaliyning mavjudligi silikonning absorbsiyasini yaxshilang.

Kremniyning biologik ahamiyati pastroq tirik organizmlarning tarkibiga - diatoms va radiolokionlar - kremniyadan yaratilgan bejirim go'zallik skeletlari yaratadigan jonli materiyaning eng nozik burmalari tarkibiga kiradi. Silikon, shuningdek, pastki tirik organizmlarning tarkibiy qismidir - diatomlar va radiolokanlar - bu ularning silliq skeletlari ajoyib go'zalligini yaratadigan jonli materiyaning eng nozik qismlari. Diatoms Radiolaria Self-control 1. Periodik tizimda kremniyning o'rni qanday: a) 2 davr, 4 og. b) 3 davr, 3 gr. bo'limiga qarang. v) 3 davr, 4 gr. 2-qism, 4 gr. b) 3 davr, 3 gr. bo'limiga qarang. v) 3 davr, 4 gr. bo'limiga qarang. 2. Silikon qafas: a) ionli; b) atomik; c) molekulyar; a) ionli; b) atomik; c) molekulyar; 3. Kremniyning tabiatda tarqalishiga ko'ra ... element: a) birinchi; b) ikkinchi; v) uchinchi; a) birinchi; b) ikkinchi; v) uchinchi; 4. Silikon quyidagilarni amalga oshiradi: a) metallar, vodorod, halogen; a) metallar, vodorod, halogen; b) alkalilerda osongina eruvchan metallar, halogen; b) alkalilerda osongina eruvchan metallar, halogen; v) oksidlar, kislotalar, nometalllar. v) oksidlar, kislotalar, nometalllar. 5. Silisik kislota tuzlari: a) silisidlar; b) hidrosilikatlar; c) silikatlar; a) silisidlar; b) hidrosilikatlar; c) silikatlar;

Silikon.
Silikon - kimyoviy elementlarning davriy tizimining 3-davridagi guruh IV-IV kichik guruhining elementi DI Mendeleyev, Atom soni 14, atom massasi: 28.0855. Tarkibida odatda +4 (valentlik IV) oksidlanish darajasi va juda kamdan-kam +3, +2 va +1 (o'z navbatida III, II, va I) valentlik namoyon bo'ladi. Davriy jadvalda Mendeleev silikon IVA guruhida joylashgan (A-bu asosiy kichik guruh ekanligini ko'rsatadi) (uglerod guruhida), uchinchi davrda. Nemetall . Belgilar bilan belgilanadi Si(lat Silikoniy). Erkin formada - qora jigarrang yoki ochiq rangli, yaltiroq, metall niqobli material. Qatlam tarkibi: kub, olmos.
Asosiy davlat: + 14 Si 14 ga 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Jismoniy xususiyatlar.
Kristalli silikon temir parıltısı bo'lgan quyuq kulrang modda. Kremniyning tuzilishi olmos tarkibiga o'xshash. Uning kristalli qismida har bir atom to'rtta tetraedral tomonidan o'ralgan va ular bilan olmosdagi uglerod atomlari orasidagi juda zaif bo'lgan kovalent birikma bilan bog'langan. Oddiy sharoitlarda ham, kremniy kristallida kovalent bog'larning ayrimlari yo'q qilinadi. Shuning uchun, u erkin elektrlarga ega, ular kichik elektr o'tkazuvchanligiga olib keladi. Yoritish va isitish vaqtida singan bog'lanish sonini oshiradi, ya'ni erkin elektronlar soni ortadi va elektr o'tkazuvchanligi oshadi. Shuning uchun silikon yarim Supero'tkazuvchilar xususiyatlarini tushuntirishi kerak.
Silikon juda nozik, uning zichligi 2,33 g / sm3 ni tashkil qiladi. Ko'mir kabi, refrakter moddalarni nazarda tutadi.
Silikon uch barqaror izotoplardan tashkil topgan: 2814Si (92.27%), 2914Si (4.68%) va 3014Si (3.05%).
3. Tabiatda bo'lish.
Tabiatda ko'pincha silikon formada bo'ladi silika - silikon dioksid (IV) SiO2 (er qobig'ining massasining taxminan 12%) ga asoslangan birikmalar. Kremniy dioksiddan hosil bo'lgan asosiy minerallar va jinslar qum (daryo va kvarts), kvarts va kvartsit, shag'aldalar va dala shpati hisoblanadi. Tabiiy silikatlar kompleks tarkibiy va tuzilishga ega. Ba'zi tabiiy silikatlar tarkibiga quyidagilar kiradi:
u feldispat K 2 O × Al 2 O 3 × 6SiO 2,
asbest 3MgO × 2SiO 2 × 2H 2 O,
u mika K 2 O x 3Al 2 O 3 x 6SiO 2 x 2H 2 O,
ü kaolinit 3Al 2 O 3 x 2SiO 2 x 2H 2 O.
Silikon birikmalarining ikkinchi eng keng tarqalgan guruhi silikatlar va aluminosilikatlar
Onalik shaklida sof kremniyni topishning yagona dalillari qayd etilgan.
4. Kremniy va uning birikmalari kimyoviy xossalari.
Kimyoviy xususiyatlarga ko'ra, silikon, uglerod kabi u metall bo'lmagan, ammo uning metall bo'lmaganligi kamroq aniqlanadi, chunki u katta atom radiusiga ega. Kremniy atomlari tashqi energiya darajasida 4 elektronga ega bo'lgani uchun ham -4 va +4 ning oksidlanish holati silikonga (oksidlanish darajasi +2 bo'lgan joyda ma'lum bo'lgan silikon birikma) ma'lum.
Oddiy sharoitlarda silikon juda harakatsizdir, bu uning kristalli kafesinin kuchi bilan tushuntirilishi kerak. Bu to'g'ridan-to'g'ri ta'sir qiladi flor:
Kislotalar (hidroflorik HF va azotli HNO 3 aralashmasidan tashqari)silikon harakat qilmaydi. Ammo, u gidroksidi gidroksidlarda eriydi va silikat va vodorod hosil qiladi:
Kremniy, kristal va amorf ikki xil alotropik modifikatsiyadan amorf silikon kimyoviy jihatdan faolroqdir. U bilan javob beradi kislorod bilan qizdirilganda, SiO 2 ni hosil qiladi:
shuningdek, hamma bilan birga halogenMasalan:
![]()
Yuqori haroratda silikon ulanadi uglerod bilanKarbonundni shakllantirish SiC:
Karborundda olmosga o'xshash kristalli latta bor, unda har bir silikon atomi to'rtta uglerod atomlari bilan va u bilan kesishadi va kovalent aloqalar juda olmos kabi. Shuning uchun qattiqlikda olmos yaqin. Taşlama toshlari va silliqlash g'ildiraklari silikon karbiddan tayyorlanadi.
Magniy silikat. Faol metallar bilan reaksiyalarda, shakllanish jarayonida yuzaga keladi silisidlar, Silikon oksidlovchi moddalar vazifasini bajaradi:
Yuqori haroratlarda silikon oksidlaridan ko'plab metallarni qayta tiklaydi. (!!!)
Silan Silikatlar bo'yicha gidroksidi kislotaning ta'siri ostida, eng oddiy vodorod silikon birikmasi silan SiH 4 bo'ladi:
Silan - yoqimsiz xushbo'y hidli zaharli gaz, havoda o'zini tutatuvchi (!!!):
Silikon oksidi (IV).Silikon oksid (IV) ham deyiladi silika. Bu qattiq refrakter moddadir. (erish nuqtasi 1700 ° S) tabiatda ikki xil shaklda keng tarqalgan:
1) kristalli silika - kvarts minerallari va uning navlari (tosh kristall, kalsedon, agat, jasper, chakka) shaklida; kvarts qurilishda va silikat sanoatida keng qo'llaniladigan kvarts qumlarning asosini tashkil etadi;
2) amorf silika - SiO 2 x opal mineral birikmasi shaklida n H 2 O; amorf kremniyning er shakli diatomit, tripoli (infuzorli er); sun'iy amorf suspenziya silika misoli natriy metasilikatidan olingan silika gelsidir:
Silika jeli rivojlangan sirtga ega va shuning uchun namlikni yaxshi qabul qiladi. .
1710 ° kvarts eriydi. Eritilgan massaning tez sovishi bilan hosil bo'ladi kvars shisha . Issiq kvarts shishasi suvni tez sovutganda yorilishiga yo'l qo'ymaydi, shuning uchun u juda kengayish koeffitsientiga ega. Laboratoriya uskunalari va asbob-uskunalari ilmiy tadqiqotlar uchun kvarts shishasidan ishlab chiqariladi.
Silikon oksid (IV) SO 2 ning eng oddiy formulasi uglerod monoksit (IV) CO 2 ning formulasiga o'xshaydi. Ayni paytda, ularning fizik xususiyatlari juda farq qiladi (SiO 2 - qattiq, CO 2 - gaz). Bu farq kristalli lattalarning tuzilishiga bog'liq. C0 2 molekulalar qobig'ida, SiO 2 - atomda kristallanadi. SiO 2 ning planar tasvirdagi tuzilishi quyidagicha ifodalanadi:
Kuchli CO2 tarkibidagi uglerod atomining koordinatsiya sonining miqdori 2, SiO 2 da silikon 4 ga teng. Har bir silikon atomi 4 kislorod atomining tetraedrli qismiga qo'shiladi. Shu bilan birga, silikon atomi markazda, kislorod atomlari esa tetraedrning tepasida joylashgan. . Barcha kremniy parchasini kristall deb hisoblash mumkin, uning formulasi (SiO 2) n. Ushbu silikon oksidi (IV) tuzilishi uning yuqori qattiqligini va refrakterligini aniqlaydi .
Silikon oksidi (IV) SiO 2 ning kimyoviy xossalari kislota oksidlariga mos keladi. Qattiq gidroksidi, asosiy oksidi va karbonat bilan eritib, silisli kislota tuzlari hosil bo'ladi:
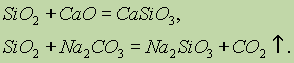
Faqat hidroflorik kislota silikon oksidi (IV) bilan o'zaro ta'sir qiladi:
Bu reaksiya shisha idishga ishlatiladi. .
Silikon (IV) suvda erimaydi va u bilan kimyoviy ta'sir o'tkazmaydi. (!!!) Shuning uchun kremniy kislotasi kaliy yoki natriy silikat eritmasi bilan kislota bilan harakat qilib bilvosita olinadi:
Bu holda silika kislotasi (tuz va kislota dastlabki eritmalarining konsentratsiyasiga qarab) suvni o'z ichiga olgan jelatinli massa shaklida va kolloid eritma shaklida (chap) shaklida olinishi mumkin.
Silik kislotasi. SiO 2 tarkibiy qismini umumiy formula bilan ifodalash mumkin bo'lgan bir qator silisli kislotalarning anhidrididir: xSiO 2 × yH 2 O, bu erda x va y - tamsayılar:
1) x = 1, y = 1: SiO 2 × H 2 O, ya'ni H 2 SiO 3 - metasilik kislota;
2) x = 1, y = 2: SiO 2 × 2H 2 O, ya'ni H 4 SiO 4 - ortosilik kislotasi;
3) x = 2, y = 1: 2SiO 2 × H 2 O, ya'ni H 2 Si 2 O 5 - bimetakritik kislota.
Kremniy kislotasi tetrahedral strukturalardan tashkil topgan (har bir bunday birlikda silikon atomi tetraedrning markazida, tepada esa kislorod atomlari mavjud). Zanjirlar bilan birikib, strukturaviy aloqalar yanada barqaror polisilikon kislotalarni hosil qiladi:
Bunday birikmalarning tarkibi quyidagi formulada (H 2 SiO 3) n bilan ifodalanishi mumkin. Ammo, odatda, kremik kislota H 2 SiO 3 formulasi bilan ifodalanadi. H 2 SiO 3 - kislota juda zaif, suvda ozgina eriydi. Issiqlik vaqtida osonlik bilan karbonat kislotasi singari ajralib chiqadi:
Barcha silik kislotalar juda zaif (ko'mirdan zaif).
Silikatlar. Barcha silisli kislotalarning tuzlari deyiladisilikatlar, odatda, o'quv adabiyotlarida silikatlar metaxil kislotasining tuzlarini nazarda tutadi. Ularning tarkibi odatda elementlarning oksidlari birikmalariga o'xshash formuladan iborat. Masalan, CaSiO 3 kaltsiy silikatini quyidagicha ifodalash mumkin: CaO × SiO 2.
R2O × nSiO2 birikmasining silikatlari, bu erda R 2 O - natriy yoki kaliy oksidi , deyiladi eruvchan shisha , a ularning konsentrlangan suvli eritmalari - suyuq shisha . Natriy soda shisha muhim ahamiyatga ega..
Atmosferada karbonat angidrid (IV) silikat kislota tuzlaridan ajralib chiqqandan so'ng, havoda turganda silikatlarning eritmalari xiralashadi.
Silik kislotasi suvda deyarli erimaydi - bu xususiyat ion SiO 3 2 ga sifatli reaktsiya sifatida ishlatiladi.
Silikatlar gidroksidi yoki karbonatlar bilan silika bilan eritiladi:
5. SiO3 ionining kashfiyoti. 2. (Men hech narsani topa olmayapman ...)
6. Tuproqni shakllantirish va o'rmon xo'jaligida silikon birikmalarining o'rni.
Magmatik tog 'jinslari tarkibida juda barqarordir va asosan silikon, alyuminiy, temir, alkalis, magniy va kaltsiyning tarkibiy qismlarini o'z ichiga oladi. Si0 2 tarkibiga ko'ra, magmatik tog 'jinslari to'rt guruhga bo'lingan: kislotali (65%), o'rta (52-65%), asosiy (40-52%) va ultrabazik (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Kislota magmatik tog 'jinslari- granitlar, pegmatitlar, riyolitlar, dasit va boshqalar - odatda kvarts, dala shpati va mika kristallari bilan nur va jigarrang rangga ega. Ularda SiO2 tarkibida yuqori miqdorda kaliy va natriy bor (65% dan ortiq). Shu bilan birga, ozgina temir, kaltsiy va magniy esa juda kam. Misol uchun, granitlarda kislotali magmatik tog' jinslari er qobiqning dastlabki bosqichlarida dastlabki materialning shag'alligi, sopoliqligi bilan ajralib turadi. Nozik sharoitlarda namlangach, osonlik bilan gidroksidi-tuproq elementlarini yo'qotadi, buning oqibatida bunday havorali substratlarga (tsellyuloza tolalari) tuproq juda zaif va uncha samarasiz.
Asosiy magmatik tog 'jinslari -bazalt, gabbro va boshqalar, odatda qora (qora) rangga ega. Ular kislotali jinslar bilan taqqoslaganda SiO2 tarkibida pastroq bo'ladi. Asosiy magmatik tog 'jinslari temir, marganets, krom, kobalt, sink, titanium, nikel va mis birikmalariga nisbatan ancha boy. O'zlarining atmosfera yog'inlari mahsuloti tezda loy xarakteriga ega bo'lib, uzoq vaqt ishqorli va neytral reaktsiyani saqlab turadi va gumus va gil minerallarning miqdori oshishi bilan ajralib turadi. Bunday jinslardagi tuproq unumdorroqdir.
Kislotali va asosiy turlarga qo'shimcha ravishda ko'pincha topiladi o'tish davri tipidagi magmatik jinslar(O'rta) - diorit guruhining intruziv jinslari va ularning ta'sir ko'rsatuvchi hamkorlari - andezitlari. Shunga ko'ra, bu tog 'jinslar tuproqlari kislotali yoki asosiy tog' jinslariga o'xshash xususiyatlarga ega bo'ladi. Juda kam tarqalgan ultrabazik jinslar:eng past SiO2 tarkibiga ega bo'lgan peridotitlar va pikritlar.
Metamorfik jinslar -massiv kristalli va cho'kindi jinslar orasidagi Dalgalanish, yuqori bosim va harorat ostida cho'zilib ketgan cho'kindi jinslar gnayslar, serpantinitlar, marmar, kvartsitlar, slanetsni hosil qiladilar. Gneisslar granitlarga xos tarkibida juda o'xshash. Ushbu tog' jinslarida hosil bo'lgan tuproqlar kislotali magmatik tog' jinslaridagi tuproqlarga o'xshash xususiyatlarga ega.
Xlor.
1. DI Mendeleyev stolidagi alyuminiyning holati. Atomning tuzilishi, oksidlanish darajasi namoyon bo'ladi.
Xlor - VII guruhning asosiy kichik guruhining uchinchi qismi, atomik raqami 17 bo'lgan element. Bu "Cl" ("Chlorum") belgisi bilan ifodalanadi. Kimyoviy faol metall bo'lmagan . Halojen guruhiga kiritilgan .
Oddiy sharoitlarda oddiy modda xlor - zaharli gaz sarimsoq-yashil rang kuchli havo hidli, havodan og'irroqdir . Diatomik xlor molekulasi (formulalar Cl 2).
Asosiy davlat: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. San'at. -1 +1 +3 +5 +7.
Elektron qatlamining tuzilishi.
Xlor atomining valentlik darajasida o'z ichiga oladi 1 takrorlanmagan elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, shuning uchun xlor atomi uchun 1 ga teng qiymat juda barqarordir. Bo'shashmagan d-pastki orbitali xlor atomida mavjudligi sababli, xlor atomi boshqa darajadagi oksidlanishni namoyon qilishi mumkin. Atomning hayajonlangan holatlarini shakllantirish sxemasi:
Xlor aralashmalari, shuningdek xlor atomining rasmiy ravishda 4 va 6-valentlarni, masalan, ClO2 va Cl2O6 ni ko'rsatishi bilan ma'lum. Biroq, bu moddalar radikallardir, ya'ni ular bitta to'ldirilmagan elektronga ega.
2. Jismoniy xususiyatlar.
Oddiy sharoitlarda xlor sarg'ish-yashil gazdir. Uning ayrim fizik xususiyatlari quyida keltirilgan.
Zichlik: 3.214 g / l, suzuvchi - -35 ° S da - 1.557, televizor. -105 0 S - 1,9 g / sm 3 ga teng.
Erish nuqtasi: 172.2 K
Qaynash nuqtasi: 238.6 K
Issiqlik termoyati: 6,41 kJ / mol
Bug'lanishning issiqligi: 20.41 kJ / mol.
Xlor gazi suyultirish uchun nisbatan oson. 0,8 MPa (8 atmosfera) bosimi bilan boshlangan xlor xona haroratida allaqachon suyuq bo'ladi. -34 ° C haroratda sovutilganda, xlor normal atmosfera bosimida ham suyuq bo'ladi. Suyuq xlor - juda yuqori korroziy ta'sirga ega bo'lgan sariq-yashil suyuqlik (molekulalarning yuqori konsentratsiyasi tufayli). Bosimning kuchayishi bilan siz 7,6 MPa kritik bosim ostida +144 ° S (muhim harorat) haroratgacha suyuq xlor mavjudligiga erishishingiz mumkin. Elektr o'tkazuvchanligi jihatidan suyuq xlor eng kuchli izolyatorlar orasida uchraydi: distillangan suvga qaraganda deyarli bir milliard marta yomon oqadi va kumushdan 10 barobar ko'proq yomonroqdir. Xlordagi ovoz tezligi havoga nisbatan bir yarim marotaba kamroqdir.
3. Tabiatda bo'lish.
Tabiatda ikkita izotop xlor 35 Cl va 37 Cl mavjud. Xlor er qobig'ining eng keng tarqalgan halogenidir. . Xlor juda faol - bu davriy tizimning deyarli barcha elementlari bilan bevosita bog'lanadi. Shuning uchun tabiatda u minerallar tarkibidagi birikmalar shaklida topilgan:
ü halit NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl2 · 6H2O,
u karnallit KCl · MgCl 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Xlorning eng katta zaxiralari tuzlar, suvlar, dengizlar va okeanlarda (dengiz suvidagi tarkib 19 g / l) tashkil topgan. Xlor, er qobig'idagi atomlarning umumiy sonining 0,024 foizini tashkil qiladi; clarke raqami (bu tizimning umumiy massasiga nisbatan Yer qobig'ida, gidrosferada, Yerda, kosmik jismlarda, geokimyoviy yoki kosmokimyoviy tizimlarda va boshqalarda kimyoviy elementlarning o'rtacha tarkibini ifodalovchi raqamlar% yoki g / kg bilan ifodalanadi). xlor - 0,017% ga teng. Inson tanasida og'irligi bo'yicha 0,25% xlor ionlari mavjud. Odamlar va hayvonlarda xlor asosan hujayralararo suyuqliklarda (qonni o'z ichiga oladi) topilgan va osmotik jarayonlarni tartibga solishda, shuningdek, asab hujayralarining ishlashi bilan bog'liq jarayonlarda muhim rol o'ynaydi.
4. Xlor va uning birikmalari kimyoviy xossalari. Xlor olish.
Kremniy atomining tuzilishi. Si. +14. Qiziqarli holat. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
"Silicon" taqdimotining 3-rasmida "kremniy" mavzusidagi kimyo saboqlariOlchamlari: 960 x 720 piksel, format: jpg. Kimyo darsini bepul tasvirni yuklab olish uchun rasmga o'ng tugmasini bosing va "Rasmni saqlash ..." tugmasini bosing. Darslardagi rasmni namoyish qilish uchun siz zip-arxivdagi barcha rasmlar bilan "Silicon.ppt" bepul taqdimotini yuklab olishingiz mumkin. Arxiv o'lchami - 562 KB.
Taqdimotni yuklab olingSilikon
"Silisyum va uning birikmalari" - Atomlarning tuzilishi va xususiyatlari. Yarimo'tkazgich. (Si) = 1415 ° C, t eritmasi (olmos) = 3730 ° C. Silikon olish. Kremniyni kashf qilish. O'simliklar va hayvonlar tarkibiga kiritilgan. Silikonning fizik xususiyatlari. Demak, g'isht keramika, qadimiy yunon amforatining g'isht va parchalari ham seramika hisoblanadi. Maqsadlar: Kremniyning kimyoviy xususiyatlari.
"Kremniy birikmalari" - silikon va uning birikmalari. SiO2 ning kimyoviy xossalari. Silan Silisik kislota olish. Silikon xususiyatlari. Silikon oksidi. Tabiiy silikatlar. Oksidlanish holati Rhinestone Topaz. Laboratoriyada silikon olish. Tabiatda bo'lish. Kristall lattalar. Kremniyni kashf qilish. Ametist. Silikon olish.
"Silisyum izotoplar" - silikon izotoplarining ajratilishi. Polikristalli silikon ishlab chiqarish. Monoizotopik silikondan foydalanish istiqbollari. Kvarts pichoqdan bitta kristalli o'sishda izotopik eritma. Yagona kristalli urug 'ishlab chiqarish. Raman bantining maksimal miqdorini atom massasiga bog'lash.
"Silicon Lesson" - Jonli va noaniq tabiatdagi eng muhim kimyoviy elementlarning qaysi biri? Uglerod va silikon oksidlari. Maqola shaffof. Metall bo'lmagan va metall xususiyatlarini namoyon qilish. Fikrni jamlab. Yakuniy sinov. Uglerod va silikon gidroksidlarining oksidi? Aniqlash holati: a) suyuqlik, b) gaz, v) qattiq.
"Silicon" - Silikon oddiy moddadir. Jismoniy xususiyatlar. Silikon oksidi (IV). Silikatlar Tirik organizmlar uchun ma'no. Metalllarning o'zaro ta'siri. Metall bo'lmagan metallar bilan o'zaro ta'siri. Silikon karbid. Tabiatda silikon. Silikon. Silikat sanoati mahsulotlari. Tabiiy kremniy birikmalaridan biri silikatlardir.
"Karbon va silikon" - silikon oksidi (IV). Asosiy subgroup IV guruhining elementlari. Toksiklik. 7. Uglerod haqida qiziqarli. Silikatlar. Sensorga suring. Olmos eng tabiiy tabiiy. Kimyoviy xossalari Atmosferadagi 99% dan ortiq uglerod dioksid shaklida bo'ladi. Karbidlar. 6. Ilova. Qattiq moddalar orasida eng yumshoqlardan biri.
Jami 6 ta prezentatsiya mavjud.
