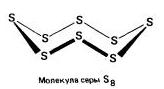
Kükürt bileşikleri. Bileşiklerdeki kükürt oksidasyon derecesi. Sülfür bileşiklerinin formülleri. Kükürt. Hidrojen sülfit. sülfürler
Kükürt, fiziksel ve kimyasal özellikler. Sülfürün biyolojik değeri, uygulaması (toz haline getirme).
Doğada Cera
Yerli kükürt
PbS - kurşun parlaklığı
Cu 2 s - bakır parlatıcı
ZnS - çinko blende
FeS 2 - pirit, kükürt pirit, kedi altın
'H 2 s - hidrojen sülfit (mineral kaynaklarda ve doğal gazda)
CaSO 4 * 2H2 O- alçı taşı
MgSO 4 * 7H2 O - acı tuz (ingilizce)
Na2S04 * 10 H20 - Glauber tuzu (mirabilit)
Fiziksel özellikleri
Katı kristalli madde sarıdır, suda çözünmez, suyla ıslamaz (yüzeyde yüzer), t ° kip = 445 ° С.
Özel biri fiziksel özellikler kükürt -yüzdürmeince kükürt tozunun suda yüzebilme kabiliyeti, daha sonra büyük kristalleri suda batarken. Gerçek şu ki, kükürt su ile ıslatılmamıştır ve parçacıkları bunlara yapışan küçük hava kabarcıkları nedeniyle suyun yüzeyinde tutulmaktadır.Bu özellik, doğal kükürtün safsızlıklardan ayrılmasında kullanılır. Cevheri öğütün, suyla doldurun ve alttan hava ile üfleyin, kükürt yüzer ve kirlilikler altta kalır.allotropi
Kükürt birkaç allotropik modifikasyonla karakterizedir., ancak en ünlü değişiklikler:eşkenar dörtgen şeklinde (Kristal) , monoklinik (İğne) ve plastik .
Rombik (a - kükürt) - S 8
t ° pl. = 113 ° C; ρ = 2.07 g / cm3. En kararlı değişiklik.
Monoklinik (b - kükürt) - S 8
koyu sarı iğnelert ° pl. = 119 ° C; ρ = 1.96 g / cm3. 96 ° C'nin üzerindeki sıcaklıklarda kararlıdır; normal şartlar altında eşkenar dörtgen haline gelir.
plastik S n
kahverengi lastikimsi (amorf) kütle. Kararsız, katılaşınca eşkenar dörtgen haline gelir.
PLASTİK SÜLFÜR ÜRETİMİ
Kükürt atomunun yapısı
Elektronları seviyelere ve alt seviyelere göre yerleştirme
Zemin devlet
1s 2 2s 2 2p 6 3s 2 3p 4
Elektron yerleşimi tarafından
yörüngeler (son katman)derecesi
oksidasyondeğerlik
Temel durumda
İlk heyecanlı devlet
İkinci heyecanlı devlet
Kükürt üretimi
1. Endüstriyel yöntem - su buharı kullanarak cevherden eritme.
2. Hidrojen sülfitin tam oksidasyonu (oksijen eksikliği ile).
2H2S + O2 = 2S + 2H2O
3. Wackenroder'in Tepkisi
2H2S + S02 = 3S + 2H20
Sülfür Kimyasal Özellikleri
Kükürt oksitleyici bir maddedir S 0 + 2ē→ S -2 | kükürt - indirgeyici ajan: S - 4ē→ S + 4; S - 6ē→ S +6 |
1. Kükürtün etkileşimi iletüm alkali ve alkali toprak metalleri, bakır, cıva, gümüş ısıtma olmadan: 2 Na + S→ Na2S DENEYİM S + Hg = HgS Merkür'ün yüksek uçuculuğu vardır. Onun çiftleri zehirli. Bu reaksiyon, örneğin, kırılmış bir tıbbi termometreden merkürün çıkarılması ve atılmasının temelini oluşturur. Merkür damlacıklarını çıkarmanın mümkün olmadığı yerler kükürt tozu ile kaplanmıştır. Kükürt ve cıva dokunduğunda reaksiyona girer. Sonuç olarak, kimyasal olarak inert ve zararsız bir madde oluşur. Bu işleme medeniyet denir. 2. Kükürtün etkileşimic diğer metaller (hariçAu, Pt) yükseltilmiş t ° de: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS DENEYİMİ Cu + S t
→
CuS DENEYİMİ 3. Kükürt ile etkileşimi oluşturmak için bazı metal olmayanlar ikili bileşikler: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Sülfürün oksijenle etkileşimi: S + O 2 t ° → S + 4 02 2 S + 3 02 t °; nk → 2 S + 6 O 3 2. Kükürtün etkileşimic halojenler (iyot hariç): S + Cl 2→ S +2 Cl2 ** Kükürt ile etkileşimi asitler - oksitleyici ajanlar: S + 2H2S04 (kons)→ 3S + 4 O 2 + 2 H 2 O S + 6HNO 3 (kons)→ H2S +6O4 + 6NO2 + 2H2O ** Orantısızlık Tepkileri: 4. 3 S 0 + 6 KOH→ K 2 S + 4 O 3 + 2 K 2 S -2 + 3 H 2 O |
uygulama
Kauçuğun vulkanizasyonu, ebonit elde edilmesi, kibrit üretimi, barut, tarım zararlılarına karşı mücadelede, tıbbi amaçlar için (cilt hastalıklarının tedavisi için kükürt merhemleri), sülfürik asit elde etmek, vb.
ödevparagraf 21; 1, 3, 4 s. 99-100.
Ek İstekler
Reaksiyon denklemlerini tamamlayın, p katsayıları elektronik denge yöntemiyle düzenleyin, oksitleyici, indirgeyici, belirtin.
№2. Dönüşümü şemaya göre yapın:
Bu ilginç ...
- İnsan vücudundaki kükürt içeriği 70 kg - 140 gr.
- Bir kişinin günde 1 g kükürt ihtiyacı vardır.
- Bezelye, fasulye, yulaf ezmesi, buğday, et, balık, meyve ve mango suyu kükürt bakımından zengindir.
- Kükürt hormonların, vitaminlerin, proteinlerin bir parçasıdır, kıkırdak dokusunda, saçta, tırnaklardadır. Vücuttaki kükürt eksikliği ile tırnaklarda ve kemiklerde kırılganlık, saç dökülmesi vardır.
Sağlığına dikkat et!Biliyor musun ..
- Sülfür bileşikleri ilaç olarak kullanılabilir;
- Kükürt - mantar cilt hastalıklarının tedavisi için merhem temeli, uyuz ile mücadele. Sodyum tiyosülfat Na 2 S 2 O 3 onunla savaşmak için kullanılır.
- Birçok sülfürik asit tuzu kristallendirme suyu içerir: ZnSO 4 × 7H20 ve CuS04 × 5H2 C. Bitkileri püskürtmek ve zirai haşerelere karşı mücadelede tahılları süslemek için antiseptik olarak kullanılırlar.
- Demir vitriol FeSO 4 × 7H 2 Anemi için O kullanılır.
- BaSO 4 mide ve bağırsakların radyografik muayenesinde kullanılır.
- Aluminyum potasyum alum KAI (SO 4) 2x12H2 O - kesikli hemostatik.
- Mineralli Na 2S04 × 10H2 O, VIII. Yüzyılda keşfeden ve aniden yolculuğu sırasında hastalanan Alman kimyager Glauber I.R.'nin onuruna “Glauber tuzu” olarak adlandırılır. Hiçbir şey yiyemedi, midesi yemek yemeyi reddetti. Yerlilerden biri onu kaynağa gönderdi. Acı tuzlu suyu içtiği anda hemen yemeye başladı. Glauber bu suyu araştırdı, Na tuzu kristallendi. 2 S04 × 10H 2 C. Şimdi tıpta pamuklu kumaşların boyanmasında müshil olarak kullanılır. Tuz ayrıca cam üretiminde kullanım alanı bulur.
- Civanperçemi, topraktan sülfür elde etme ve komşu bitkilerle bu elementin emilimini uyarma kabiliyetinde artışa sahiptir.
- Sarımsak bir madde serbest bırakır - albucide, kostik kükürt bileşiği. Bu madde kanseri önler, yaşlanmayı yavaşlatır, kalp hastalıklarını önler.
Kalkojen alt grubu, kükürt içerir - bu, çok sayıda cevher yatağı oluşturabilen elementlerin ikincisidir. Sülfatlar, sülfitler, oksitler ve diğer kükürt bileşikleri endüstride ve doğada önemli olan çok yaygındır. Bu nedenle, bu makalede onların ne olduğunu, kükürtün ne olduğunu, onun basit maddesini ele alıyoruz.
Kükürt ve karakteristik özellikleri
Bu element periyodik sistemde aşağıdaki pozisyona sahiptir.
- Altıncı grup, ana alt grup.
- Üçüncü küçük dönem.
- Atom kütlesi 32.064'tür.
- Sıra numarası 16, çok sayıda proton ve elektron var ve ayrıca 16 nötron var.
- Metal olmayan elementleri ifade eder.
- Formül "es", kükürt elementi, Latin kükürt adını okur.
Doğada, kütle sayıları 32, 33, 34 ve 36 olan dört sabit izotop vardır. Bu element, doğada en bol bulunan altıncı maddedir. İle ilgili biyojenik elemanları, önemli organik moleküllerin bir parçası olarak.
Atomun elektronik yapısı
Kükürt bileşikleri, çeşitliliğini atomun elektronik yapısının özelliklerine borçludur. Aşağıdaki yapılandırma formülü ile ifade edilir: 1s 2 2s 2 2p 6 3s 2 3p 4.
Yukarıdaki prosedür, elemanın sadece durağan durumunu yansıtır. Bununla birlikte, eğer bir atom ek enerjiden haberdar edilirse, elektronların 3p ve 3s alt seviyelerinde parçalanabileceği ve ardından 3d'ye geçecek olan serbest kaldığı bilinmektedir. Sonuç olarak, yalnızca atomun değerliği değil, tüm olası oksidasyon durumları da değişir. Kükürtlü farklı maddelerin sayısı gibi bunların sayıları da önemli ölçüde artar.
Bileşiklerde kükürt oksidasyon dereceleri
Bu gösterge için birkaç ana seçenek vardır. Kükürt için:
Bunlardan S +2 çok nadir görülür, gerisi her yere dağılmıştır. Bileşiklerdeki sülfürün oksidasyon derecesi kimyasal aktiviteye ve tüm maddenin oksidatif kabiliyetine bağlıdır. Örneğin, -2'ye sahip bileşikler sülfürlerdir. Onlarda, bizim tarafımızdan ele alınan element tipik bir oksitleyici ajandır.
Bileşikteki oksidasyon derecesi ne kadar yüksekse, maddenin oksitlenme kabiliyeti o kadar belirgindir. Sülfürün oluşturduğu iki temel asidi hatırlarsak bu kolayca görülür:
- H2S03 - kükürtlü;
- H2S04 - kükürt.
İkincisinin yüksek konsantrasyonda çok ciddi bir oksidasyon kabiliyetine sahip olduğu çok daha kararlı, güçlü bir bileşik olduğu bilinmektedir.
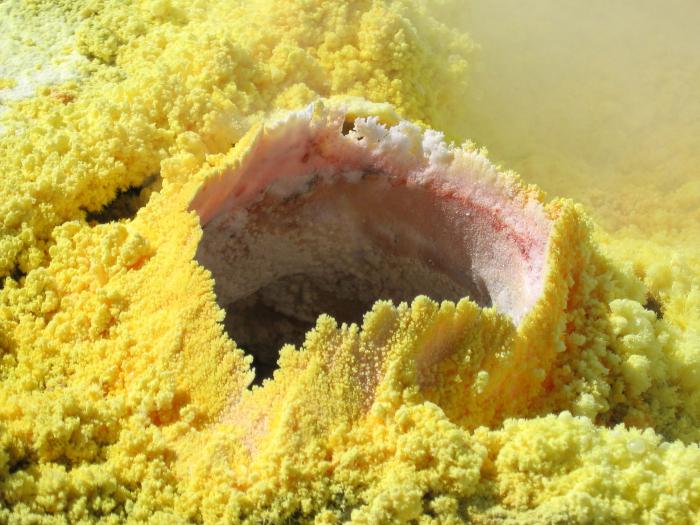
Basit bir madde
Basit bir madde olarak, kükürt düzenli düzenli uzatılmış bir şekle sahip sarı güzel kristalleri temsil eder. Bu, sadece formlarından biri olmasına rağmen, iki ana madde var. Birincisi, monoklinik veya eşkenar dörtgen, suda çözülemeyen sarıdır, sadece organik çözücülerde. Kırılganlıkta ve yapının güzel bir formunda farklıdır, taç şeklindedir. Erime noktası - yaklaşık 110 0 С.
Bu tür bir modifikasyonu ısıtırken ortadaki zamanı kaçırmazsanız, zaman içindeki başka bir durumu tespit edebilirsiniz - plastik kükürt. Kahverengi renkte, daha fazla ısıtma veya hızlı soğutma sonrasında tekrar eşkenar dörtgen bir forma dönüşen, yapışkan, yapışkan bir çözeltidir.
Tekrarlanan filtrasyonla elde edilen kimyasal olarak saf kükürt hakkında konuşursak, o zaman kırılgan ve suda tamamen çözünmeyen parlak sarı küçük kristaller. Havadaki nem ve oksijen ile temasında tutuşabilir. Oldukça yüksek kimyasal aktivitede farklılık gösterir.

Doğada olmak
Doğada, kükürt bileşiklerinin özütlendiği doğal çökeltiler vardır ve bunun kendisi de basit bir madde olarak bulunur. Buna ek olarak, içerdiği:
- minerallerde, cevherlerde ve kayalarda;
- birçok organik molekülün bir parçası olarak hayvanlar, bitkiler ve insan vücudunda;
- doğal gazlarda, petrol ve kömürde;
- yanıcı şeyllerde ve doğal sularda.
Kükürt bakımından zengin minerallerden bazıları:
- zinober;
- pirit;
- sfalerit;
- antimonit;
- galena ve diğerleri.
Bugün üretilen kükürtün çoğu sülfat üretimine gidiyor. Diğer bir kısım, tıbbi amaçlar, tarım, maddelerin üretimi için endüstriyel işlemler için kullanılır.
Fiziksel özellikleri
Birkaç noktadan tanımlanabilirler.
- Suda, karbon disülfür veya terebentin içerisinde çözünmez - iyi çözülür.
- Uzun sürtünme ile negatif yük birikir.
- Erime noktası 110 0 С.
- Kaynama noktası 190 0 C.
- 300 0 C'ye ulaşıldığında sıvı kolayca taşınabilir.
- Saf madde yanıcı özellikleri çok iyi ateşleyebilir.
- Kokunun kendisi neredeyse hiç etkiye sahip değildir, ancak kükürtün hidrojen bileşikleri çürük yumurtaların keskin bir kokusunu yayar. Tıpkı gazlı ikili temsilciler gibi.
Söz konusu maddenin fiziksel özellikleri, antik çağlardan beri insanlar tarafından bilinmektedir. Yanıcı olması için tam da kükürtün böyle bir isim almış olması. Savaşlarda, bu bileşiğin yanması sırasında oluşan boğucu ve zehirli dumanları düşmanlara karşı bir silah olarak kullandılar. Ek olarak, kükürt içeren asitlerin de her zaman önemli bir endüstriyel önemi vardır.

Kimyasal özellikleri
Konu: Bir okul kimya dersinde "Sülfür ve bileşikleri" bir ders değil, birkaç ders alır. Sonuçta, çoğu. Bu, maddenin kimyasal aktivitesinden kaynaklanmaktadır. Hem güçlü indirgeyici ajanlarla (metaller, bor vb.) Oksitleyici özellikler sergiler, hem de çoğu metalik olmayan indirgeyici özellikler gösterir.
Bununla birlikte, bu aktiviteye rağmen, sadece florinle etkileşim normal koşullar altında ilerler. Diğerleri ısıtmaya ihtiyaç duyar. Sülfürün etkileşime girebileceği birkaç madde kategorisi vardır:
- metaller;
- olmayan metaller;
- alkaliler;
- güçlü oksitleyici asitler - sülfürik ve nitrik.
Sülfür bileşikleri: çeşitleri
Çeşitlilik, ana element olan oksidasyon derecesinin eşitsiz değeri ile açıklanacaktır - kükürt. Böylece, bu özellik için birkaç ana madde türü seçebilirsiniz:
- yükseltgenme durumu -2 olan bileşikler;
Sınıfları göz önünde bulundurarak değerlik göstergesi olarak düşünürsek, bu unsur aşağıdaki gibi molekülleri oluşturur:
- asit;
- oksitler;
- tuzu;
- metal olmayan ikili bileşikler (karbon disülfür, klorürler);
- organik madde
Şimdi ana olanları düşünün ve örnekler verin.

Yükseltgenme durumu olan maddeler -2
Kükürt bileşikleri 2, metallerin yanı sıra aşağıdakilerle de uyumludur:
- c;
- hidrojendir;
- fosfor;
- silikon;
- arsenik;
- bor.
Bu durumlarda, listelenen tüm elementler daha elektropozitif olduğundan, bir oksitleyici ajan görevi görür. Bunlardan en önemlilerini düşünün.
- Karbon disülfür - CS 2. Karakteristik hoş bir eter aroması ile berrak sıvı. Toksik, yanıcı ve patlayıcıdır. Bir çözücü olarak ve çoğu tür yağ, yağ, metal olmayan, gümüş nitrat, reçineler ve lastiklerde kullanılır. Ayrıca rayon - rayon üretiminde de önemli bir yer tutmaktadır. Endüstride büyük miktarlarda sentezlenir.
- Hidrojen sülfit veya hidrojen sülfit - H2S Rengi ve tatlı tadı olmayan gaz. Koku keskin, son derece nahoş, çürük bir yumurta hatırlatıyor. Zehirli, bakır iyonlarını bağladığı için solunum merkezini sıkar. Bu nedenle, onları zehirlerken, boğulma ve ölüm meydana gelir. Tıpta, organik sentezlerde, sülfürik asit üretiminde ve ayrıca enerji tasarruflu bir hammadde olarak yaygın şekilde kullanılır.
- Metal sülfitler, tıpta, sülfat üretiminde, boya üretiminde, fosfor üretiminde ve diğer yerlerde yaygın olarak kullanılır. Genel formül Me x S y'dir.

Oksidasyon durumuna sahip bileşikler +4
Kükürt bileşikleri 4, esas olarak oksit ve karşılık gelen tuzlar ve asittir. Hepsi, endüstride belirli bir değeri olan oldukça yaygın bileşiklerdir. Oksitleyici ajanlar olarak işlev görebilirler, ancak daha sıklıkla indirgeyici özellikler gösterirler.
+ 4 oksidasyon durumuna sahip sülfür bileşikleri için formüller aşağıdaki gibidir:
- oksit - kükürt dioksit S02;
- asit - sülfürlü H2S03;
- tuzları genel formül Me x (S03) y'dir.
En yaygın olanlardan biri veya anhidrittir. Yanmış bir kibrit kokusuyla renksiz bir maddedir. Volkanların püskürmesi sırasında oluşan büyük kümelerde, şu anda koku ile tespit etmek kolaydır.
Kolayca ayrışabilen bir asit, sülfürik asit oluşumu ile suda çözülür. Tipik bir tuz formu gibi davranır, bu bir sülfit iyonu S03 şeklindedir. Bu anhidrit, çevredeki atmosferin kirlenmesini etkileyen ana gazdır. Eğitimi etkileyen budur Endüstride sülfat üretiminde kullanılır.
Sülfürün +6 oksidasyon durumuna sahip olduğu bileşikler
Bunlar, hepsinden önemlisi, tuzlarıyla birlikte sülfürik anhidrit ve sülfürik asiti içerir:
- sülfatlar;
- hidrojen sülfat.
İçlerindeki kükürt atomu yüksek oranda oksitlendiğinden, bu bileşiklerin özellikleri oldukça açıklanabilir. Onlar güçlü oksitleyici ajanlardır.
Sülfür oksit (VI) - sülfürik anhidrit - uçucu, renksiz bir sıvıdır. Karakteristik bir özellik, güçlü bir kurutucu özelliktir. Açık havada sigara içiyor. Suda çözündüğü zaman en güçlü mineral asitlerden birini verir - sülfürik. Konsantre çözeltisi ağır yağlı, hafif sarımsı bir sıvıdır. Eğer anhidrit sülfürik asit içinde eritilirse, oleum adı verilen özel bir bileşik elde edilir. Endüstride asit üretimi için kullanılır.
Tuzlar arasında - sülfatlar - gibi bileşikler:
- alçı CaS04 · 2H20;
- barit BaS04;
- tuzları;
- kurşun sülfat ve diğerleri.
İnşaatta, kimyasal sentezde, ilaçta, optik cihazların ve camların imalatında ve hatta gıda endüstrisinde kullanılırlar.
Hidrosülfatlar metalurjide, akı olarak kullanıldığı yerlerde yaygın olarak kullanılır. Ayrıca birçok karmaşık oksidin, ilgili endüstrilerde kullanılan çözünür sülfat formlarına dönüştürülmesine yardımcı olurlar.
Okul kimya dersinde kükürt çalışması
Öğrencilerin kükürtün ne olduğunu, özelliklerinin neler olduğunu, bir kükürt bileşiğinin ne olduğunu öğrenmeleri en iyisidir? 9. sınıf - en iyi dönem. Bu, çocuklar için yeni ve anlaşılmaz olan her şey olduğunda başlangıç değildir. Bu, daha önce atılan temellerin konuyu tam olarak anlamalarına yardımcı olacağı kimya bilimi çalışmasındaki orta noktadır. Bu nedenle, bu konuların değerlendirilmesi için tahsis edilen kıdemli sınıfın ikinci yarısıdır. Aynı zamanda, tüm konu “Sülfür bileşikleri. Sınıf 9” dersinin ayrı ayrı durduğu birkaç bloğa bölünmüştür.
Bu, çokluklarından kaynaklanmaktadır. Ayrıca endüstride sülfürik asit üretimi konusuna da değinildi. Genel olarak, bu konuya ortalama 3 saat ayrılmıştır.
Ancak organik meseleler göz önüne alındığında, sadece 10. sınıfta çalışmak üzere kükürt alınır. Ayrıca lisede biyolojiden de etkilenirler. Sonuçta, kükürt aşağıdaki gibi organik moleküllerin bir parçasıdır:
- thirpirits (tiyoller);
- proteinler (üzerinde disülfit köprülerinin oluştuğu üçüncül yapı);
- tiyoaldehitlerin;
- tiyofenoller;
- tiyoesterler;
- sülfonik asitler;
- sülfoksitler ve diğerleri.
Özel bir organo-kükürt bileşikleri grubunda ayırt edilirler. Sadece canlıların biyolojik süreçlerinde değil, endüstride de önemlidirler. Örneğin, sülfonik asitler birçoğunun temelidir ilaçlar (aspirin, sülfonamid veya streptosit).
Ek olarak, kükürt, aşağıdakiler gibi bileşiklerin kalıcı bir bileşenidir:
- amino asitler;
- enzimler;
- vitaminler;
- hormonları.
Oda sıcaklığında, kükürt yalnızca cıva ile reaksiyona girer. Artan sıcaklıkla, aktivitesi önemli ölçüde artar. Kükürt ısıtıldığında inert gazlar, azot, selenyum, tellür, altın, platin, iridyum ve iyot hariç birçok basit maddeyle doğrudan reaksiyona girer. Azot ve altın sülfürler dolaylı olarak elde edilir.
Metallerle etkileşim
Kükürt oksitleyici özellikler sergiler, etkileşimin bir sonucu olarak, sülfitler oluşur:
Hidrojen ile etkileşim 150–200 ° C de gerçekleşir:
H2 + S = H2S
Oksijen ile etkileşim
Sülfür 280 ° C'de oksijende, 360 ° C'de havada yanar ve bir oksit karışımı oluşur:
S + 02 = S02;
2S + 3O2 = 2S03.
Fosfor ve karbon ile etkileşim
Hava olmadan ısıtıldığında, kükürt oksidatif özellikler gösteren fosfor, karbon ile reaksiyona girer:
2P + 3S = P2S3;
Flor Etkileşimi
Güçlü oksitleyici ajanların varlığında, indirgeyici özellikler sergiler:
S + 3F2 = SF6.
Karmaşık maddelerle etkileşim
Karmaşık maddelerle etkileşime girdiğinde, kükürt bir indirgeyici madde olarak davranır:
S + 2HNO3 = 2NO + H2S04.
Orantısızlık Reaksiyonu
Alkali sülfitler ve sülfitlerle etkileşime girdiğinde kükürt orantısızlaşma reaksiyonları yapabilir:
3S + 6KOH = K2S +4O3 + 2K2S2 + 3H2O
1.7. Kükürt üretimi
Yerli cevherlerden
Hava erişimi olmayan pirit ısıtırken
FeS 2 = FeS + S
Hidrojen sülfitin oksidasyonu ile oksidasyonu
2H2S + O2 = 2S + 2H2O
Metalurji ve kok fırından çıkan atık gazlar, bir katalizör varlığında ısıtıldığında
H2S + S02 = 2H20 + 3S.
1.8. Hidrojen sülfit
Hidrojen Kükürt Bileşiği - hidrojen sülfür 'H 2 S . Hidrojen sülfit, kovalent bir bileşiktir. Molekülün yapısı, su molekülünün yapısına benzer, kükürt atomu sp3 hibridizasyonu halindedir, ancak sudan farklı olarak, hidrojen sülfür molekülleri kendi aralarında hidrojen bağları oluşturmaz. Kükürt atomu, oksijen atomundan daha az elektronegatiftir, daha büyük bir boyuta sahiptir ve sonuç olarak daha düşük bir yük yoğunluğuna sahiptir. HSH değerlik açısı 91.1 °, H - S bağ uzunluğu 0.133 nm'dir.
Fiziksel özellikleri
Normal koşullar altında, hidrojen sülfit renksiz bir gazdır ve çürük yumurtaların güçlü bir karakteristik kokusuna sahiptir. T pl = -86 ° C T kip = -60 ° C, suda az çözünür, 20 ° C'de, 2.58 ml H2S, 100 g suda çözünür, çok toksik, solunduğunda ölümcül olabilir, felç olur. Doğada, bitki ve hayvan organizmalarının çürümesi ile oluşan volkanik gazların bileşiminde salınır. Çözündürüldüğünde zayıf bir hidrojen sülfür asidi oluşturduğu zaman suda çözünür.
Kimyasal özellikleri
Sulu çözeltide, hidrojen sülfit zayıf bir dibazik asidin özelliklerine sahiptir:
H2S = HS - + H +;
HS - = S 2- + H +.
Havada yanan hidrojen sülfit Mavi alev Sınırlı hava erişimi ile serbest kükürt oluşur:
2H2S + 02 = 2H2O + 2S.
Aşırı hava erişimiyle, hidrojen sülfitin yanması, sülfür oksit (IV) oluşumuna yol açar:
2H2S + 3O2 = 2H2O + 2S02.
Hidrojen sülfit azaltma özelliklerine sahiptir. Koşullara bağlı olarak, hidrojen sülfit sulu çözeltide sülfür, sülfür dioksit ve sülfürik aside oksitlenebilir.
Örneğin, brom suyunu renklendirir:
H2S + Br2 = 2HBr + S
klorlu su ile etkileşime girer:
H2S + 4Cl2 + 4H2O = H2S04 + 8HCl.
Reaksiyona büyük bir ısı salımı eşlik ettiği için kurşun dioksit kullanılarak bir hidrojen sülfit jeti ateşlenebilir:
3PbO2 + 4H2S = 3PbS + S02 + 4H2O
Hidrojen sülfitin kükürt dioksit ile etkileşimi metalurji ve sülfat üretiminin atık gazlarından sülfür üretmek için kullanılır:
S02 + 2H2S = 3S + 2H2O
Volkanik işlemlerde doğal kükürt oluşumu bu işlem ile ilişkilidir.
Alkali çözeltiden eşzamanlı olarak kükürt dioksit ve hidrojen sülfür geçişi ile tiyosülfat oluşur:
4S02 + 2H2S + 6NaOH = 3Na2S203 + 5H2O
Normal koşullar altında hidrojen sülfit, çürük yumurtaların karakteristik bir kokusuna sahip renksiz ve çok toksik bir gazdır.
Laboratuvarda elde etmek için, seyreltilmiş hidroklorik asit genellikle sülfite eklenir:
Hidrojen sülfit üretmenin bir başka yolu alüminyum sülfite soğuk su eklemektir:
Bu şekilde elde edilen hidrojen sülfit daha temizdir.
Hidrojen sülfit, kovalent bir bileşiktir. Molekülleri, su moleküllerinin yapısına benzer kavisli bir yapıya sahiptir (bkz. Bölüm 2.2). Bununla birlikte, sudan farklı olarak, hidrojen sülfit molekülleri birbirleriyle hidrojen bağları oluşturmazlar. Gerçek şu ki, kükürt atomu oksijen atomundan daha az elektronegatifdir, fakat daha büyük bir boyuta sahiptir. Bu nedenle, kükürt atomu oksijen atomundan çok daha düşük bir yük yoğunluğuna sahiptir. Hidrojen bağı olmadığından, hidrojen sülfit sudan daha düşük bir kaynama noktasına sahiptir. Hidrojen sülfit içindeki hidrojen bağlarının yokluğu, sudaki zayıf çözünürlüğünü de açıklar.
Sulu çözeltide, hidrojen sülfit zayıf bir dibazik asidin özelliklerine sahiptir:
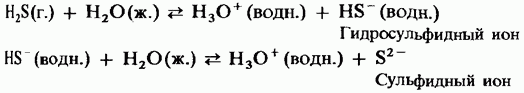
Hidrojen sülfit havada mavi bir alevle yanar. Sınırlı hava erişimi ile, hidrojen sülfitin yanmasına, geminin soğuk yüzeyi üzerinde yoğunlaşan serbest sülfür salınımı eşlik eder:
Aşırı hava erişimiyle, hidrojen sülfitin yanması, sülfür dioksit oluşumuna yol açar:
Hidrojen sülfit azaltma özelliklerine sahiptir. Örneğin brom suyunu renklendirir ve iyonları iyonlara indirger.
Bir dibazik asit olarak hidrojen sülfit iki sıra tuz oluşturabilir - sülfitler ve hidrosülfitler (yukarıya bakın). Alkali metal sülfitler, alkali çözeltiler oluşturmak için suda çözülür. Bu, hidrolizin bir sonucu olarak ortaya çıkar:
Diğer metallerin çözünmeyen sülfürleri, bu metallerin sulu çözeltilerinden, hidrojen sülfit çözeltiden geçerek çökeltilebilir. Örneğin, iyonları içeren bir çözeltiden hidrojen sülfit geçirilerek siyah sülfit çökeltisi oluşur.
Bu reaksiyon hidrojen sülfit için analitik bir örnek olarak kullanılır.
Kükürt oksitler
Kükürt, ikisi en önemli olan birkaç oksit oluşturur: kükürt dioksit ve kükürt trioksit.
Kükürt dioksit keskin, boğucu bir kokuya sahip, yoğun, renksiz bir gazdır. Laboratuar koşulları altında, havada veya oksijende kükürt yakılarak, bazı sülfit tuzlarına ılık seyreltik bir asit çözeltisi ilave edilerek veya konsantre sülfürik asidi bakırla ısıtmak suretiyle elde edilebilir:
Sülfür dioksit asit oksit. Suda kolayca çözülür, sülfürik asit oluşturur. Bu asit sadece kısmen iyonlaştırılmıştır ve bu nedenle zayıf bir asittir:
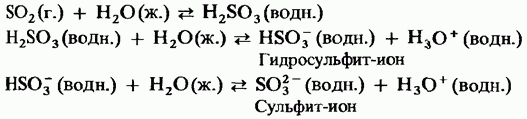
Sülfür dioksit gazı sodyum hidroksit çözeltisinden geçirilerek sodyum sülfit oluşur. Sodyum sülfit, fazla sülfür dioksit ile reaksiyona girerek sodyum hidrosülfit oluşturur, bu reaksiyonlar karbon dioksitin kireç suyu ile reaksiyonuna benzerdir.
Hem gaz halinde kükürt dioksit hem de sulu çözeltisi indirgeyici ajanlardır. Örneğin, gaz halinde kükürt dioksit, oksidi sülfat oluşturmak için oksidi azaltır. sülfürik asit iyonu iyona geri yükler
Endüstriyel koşullarda kükürt dioksit, havada kükürt veya sülfür cevherlerinin kavrulmasıyla elde edilir ve kükürtik asit elde edilmesinde ara ürün olarak kullanılır (bakınız Bölüm 7). Kağıt hamuru endüstrisinde, kumaşların ağartılmasında ve ayrıca uzun süreli depolamada meyve ve sebzelerin işlenmesinde kükürt dioksit kullanılmaktadır.
Sülfür dioksit atmosferik kirlenmede ve özellikle asit yağmuru oluşumunda önemli bir rol oynar. Atmosferde, kükürt trioksitine oksitlenir:
Normal koşullar altında, bu işlem oldukça yavaş ilerler, ancak bir katalizör varlığında, tıpkı sülfürik asit üretimi için temas sürecinde olduğu gibi, önemli ölçüde hızlandırılabilir. Atmosferdeki az miktarda demir ve manganez bileşikleri kükürt dioksitin oksidasyonunu katalize ediyor gibi görünmektedir. Elde edilen kükürt trioksit havadaki nem ile reaksiyona girer ve bu nedenle asit yağmuru taşıyan bulutlar belirir (bakınız bölüm 12).
Katı kükürt trioksit bir polimorfik bileşiktir. En önemli iki şekli: Bunlardan ilki döngüsel yapıya sahip bir trimerdir (Şekil 15.24, a); kristaller şeffaftır. asiklik bir polimer yapıya sahiptir (Şekil 15.24, b); iğneler şeklinde var. Erime noktası Nemin varlığında, yavaş yavaş 45 ° C'de kaynayan Her iki forma dönüşür Kükürt trioksit buharı, izole simetrik düz moleküllerden oluşur.
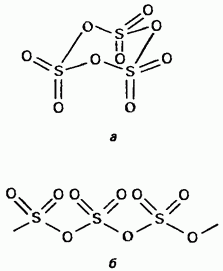
Şek. 15.24. Kükürt trioksit, a - siklik yapı, b - asiklik yapı.
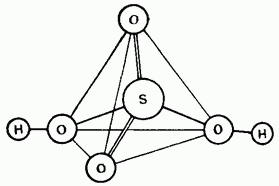
Şek. 15,25. Sülfürik asit molekülünün yapısı.
Laboratuvar koşullarında kükürt trioksit, sülfat ısıtılarak elde edilir
Kükürt trioksit güçlü asidik özelliklere sahiptir. Sülfürik asit oluşturmak için ekzotermik su ile reaksiyona girer:
Kükürt trioksit güçlü bir oksitleyici ajandır. Örneğin, hidrojen bromürü serbest bromine okside eder.
Sülfürik asit
Sülfürik asit - renksiz yağlı kostik sıvı. En önemli endüstriyel kimyasal ürünlerden biridir. Kontak işlemi ve uygulamasını kullanarak endüstriyel üretimi Ch. 7.
Seyreltilmemiş sülfürik asit kovalent bir bileşiktir. Molekülleri dört yüzlü bir yapıya sahiptir (Şekil 15.25).
Sülfürik asit kaynar ve 340 ° C'de ayrışarak sülfür trioksit ve su oluşturur.
Yüksek kaynama noktası ve yüksek sülfürik asit viskozitesi, görünüşe göre, komşu moleküllerin hidrojen atomları ve oksijen atomları arasındaki hidrojen bağlarının varlığından kaynaklanmaktadır.
Sülfürik asit, güçlü bir dibazik asittir. Suda, tamamen iyonize edilir, hidrosülfat ve sülfat iyonları oluşur:
Sülfürik asit, asitlerin karakteristik tüm reaksiyonlarında yer alır. Metallerle reaksiyona girerek, bu metallerin ve hidrojenin sülfatlarını oluşturur, karbonatlarla reaksiyonlarda sülfatlar, karbon dioksit ve su ile ve bazlarla ve alkalilerle reaksiyonlarda sülfatlar veya hidrosülfatlar oluşturur.
Konsantre sülfürik asit suyla çok şiddetli reaksiyon verir. Bu nedenle, sülfürik asit daima suya dökülerek seyreltilmelidir, bunun tersi olmaz. Bu asit higroskopiktir, yani havadan nemi emebilmektedir. Bu nedenle, reaksiyona girmeyen, sülfürik asit içinden geçen gazları kurutmak için kullanılır. Sülfürik asidin suya afinitesi o kadar büyüktür ki, sülfürik asit bir dehidrasyon ajanı olarak görev yapabilir; konsantre sülfürik asit etkisinde:
mavi sülfat pentahidrat kristalleri susuz sülfat oluşturur
sukroz gibi karbonhidratlar kömürleşmişlerdir:
kağıt ayrıca, asidin selüloz elyafları üzerindeki etkisinden dolayı konsantre sülfürik asidin etkisiyle de kömürlenir;
etanol etilene dönüştürülür:
(Sülfürik asit ile etanol dehidrasyon, kontrollü olarak yapılan
koşullar, etoksietan (dietil eter) oluşumuna yol açar ve bu reaksiyon, endüstriyel ölçekte etoksietan üretmek için kullanılır);
bir klorobenzen ve trikloroethanal (kloral) karışımı kurutulur (bkz. bölüm 16.3).
Konsantre sülfürik asit güçlü bir oksitleyici ajandır. Metalleri ve metal olmayanları okside eder. Örneğin
Konsantre sülfürik asidin oksidatif özelliklerini gösteren diğer örnekler olarak, aşağıdaki reaksiyonlarda iyonların iyonlara, bromür iyonların serbest bromlara oksidasyonunu gösteririz:
Son olarak, sülfürik asit organik kimyada bir sülfatlama ajanı olarak kullanılır (bkz. Bölüm 17).
Sülfatlar, sülfitler ve tiyo bileşikleri
Sülfat iyonu, sülfürik asit molekülünün yapısına benzer bir dörtyüzlü yapıya sahiptir.
Tuz. Sülfatlar seyreltik sülfürik asidin metallerle, bunların oksitleriyle, hidroksitleriyle veya karbonatlarıyla reaksiyonlarında oluşur. Baryum sülfat ve kalan sülfatlar hariç suda çözünür. Kalsiyum sülfat, suda düşük bir çözünürlüğe sahiptir. Sülfatlar genellikle ısıya dayanıklıdır. Tek istisnalar demir sülfatlardır. Örneğin, sülfat, demir oksit oluşturmak üzere ısıtıldığında ayrışır:
Herhangi bir çözeltideki sülfat iyonlarını tespit etmek için, buraya sulu bir baryum klorür çözeltisi eklenir. Test çözeltisinde sülfat iyonları mevcutsa, sonuç olarak beyaz bir baryum sülfat çökeltisi oluşur:
Sülfatların birçok önemli kullanımları vardır. Örneğin, magnezyum sülfat (İngiliz tuzu, acı tuz), patlayıcıların üretiminde, kibrit ve yanmaz kumaşların üretiminde kullanılır. Bu tuzun doymuş bir çözeltisi, tıbbi uygulamada bir anti-enflamatuar madde olarak kullanılır.
Sodyum tiyosülfat, bir oksijen atomunun bir sülfür atomu ile değiştirildiği bir sodyum sülfat analoğu olarak düşünülebilir. Potasyum tiyosiyanat - Bu tür tiyoso bileşikler arasında başka bir şeyden söz edilmelidir. Potasyum siyanatın bir kükürt benzeridir. Potasyum tiyosiyanat, potasyum siyanürün kükürt ile kaynaştırılmasıyla elde edilebilir:
Potasyum tiyosiyanat, iyonları tespit etmek için nitel analizde kullanılır, eğer bu iyonlar test çözeltisinde bulunursa, buna bir potasyum tiyosiyanat çözeltisi eklenmesi, kompleks bir iyon oluşumuna bağlı olarak kan kırmızısının renginin ortaya çıkmasına neden olur.
Öyleyse tekrar et!
1. VI grubunun altına doğru hareket ederken, elemanlarının özellikleri giderek metalik olmayandan metalik olarak değişir.
2. Grup VI'nın elemanları, hidrojenle ve reaktif metallerle birleşerek kabiliyetini 2'ye yükseltdikleri bileşikler oluştururlar.
3. Oksijen yüksek elektronegatifliğe ve güçlü bir oksidan özelliğine sahiptir.
4. Ozon, oksijenden daha güçlü bir oksidandır.
5. Oksijen, biyolojik sistemlerde, solunum ve metabolik süreçlere (metabolizma) katılan son derece önemli bir rol oynar.
6. Oksijen ikili bileşikler oluşturur, diğer bileşiklerle birlikte çeşitli tiplerdeki oksitler:

7. Hidrojen peroksit güçlü bir oksitleyici ajandır.
8. Serbest formdaki kükürt birkaç enantiyotropik formda bulunabilir.
9. Yeraltı birikintilerinden kükürt elde etmek için basınçlı hava ve aşırı ısıtılmış buhar kullanan Frash işlemi kullanılır.
10. Sülfür oksidasyon durumlarında +2, +4, +6 ve -2 olan durumlarda bileşikleri oluşturur.
11. Hidrojen sülfit - zayıf dibazik asit ve indirgeyici madde.
12. Gazlı kükürt dioksit ve sulu çözelti indirgeyici ajanları.
13. Sülfür trioksit, belirgin biçimde asit ve oksitleyici özelliklere sahiptir.
14. Sülfürik asit, güçlü bir dibazik asit, kurutucu, kurutucu madde ve güçlü bir oksitleyici maddedir.
15. Sülfürik asit molekülleri ve sülfat iyonları dörtgen bir yapıya sahiptir.