Ekvivalentne reakcije, ki označujejo moč razredčene klorovodikove kisline. Seznam izpitov za prehrano iz discipline
Počorninja površine starih slik, naslikanih z olynyi farbs, v skladišče, ki vključujejo svinčev bilil (PbCO3), povezane z navedbami železovega svinčevega sulfida (II) skozi pojav vode v ozračju. Če površino prekrijete z vodnim peroksidom, se reakcija vzpostavi s svinčevim (II) sulfatom v beli barvi:
PbS + 4H2O2 = PbSO4 + 4H2O.
Na tak način obnoviti stare slike, ki jih je naslikal olyinyi farbs.
Zasosuvannya kisnyu in sirki
Območje shranjevanja hrane predstavlja dojenček 61.
dovolite vikoristovuvati yogo za okužbo piti vodo da tuje industrijske odpadne vode; kot razkužilo v medicini. Zaradi izliva bo zmagal ozon.
Vina za proizvodnjo alkoholne kisline, pripravo sirnikov, bengalski ogenj, boj s šolarji države Silskoy in pomoč otrokom z boleznimi. Syrka poznati shranjevanje gumijev, barvnikov in pigmentov, kosovnih vlaken, luminoforov in v.
Majhna. 61. Zasosuvannya sisnyu

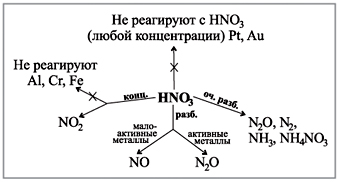
Za kislost ob polčasu so najbolj značilni oksidacijski koraki –2, žveplovi atomi, selen in teluru so oksidirani koraki –2, +2, +4 in +6.
Oksidacija moči in kislosti se kaže v njihovih reakcijah s kovinami, vodo in dejanji, nekovinami.
Napajanje in napajanje
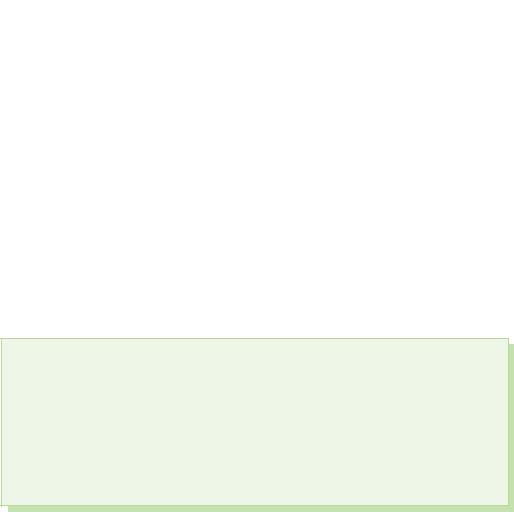
1. Shranjujte formule spoluk kisnyu s kalієm, kaltsієm in alumіnієm. Predstavite korake oksidiranega elementa kože in ga označite za dan.
2. Zaščitite večino syrka z aluminijevim sulfidom.
3. Ime "poljub" - oksigenij pomeni "scho roozhuє kislina". Zapisati kemične formule vіdomih kisline za vas, v skladišče, ki položiti element. Poimenujte kisline.
4. Katere alotropne modifikacije poznate? Kaj smrdi iz ene vrste ene stvari?
5. Kisen, ki ga ljudje vdihnejo, se izgubi s hemoglobinom v krvi. Navidezno je masa hemoglobina 1 g podana s prostornino (n.u.) 1,35 cm 3. Namesto hemoglobina v krvi zdravih ljudi 140 g / dm3. Zagalni volumen krvi - 6 dm3. Zaščitite kemijo kislosti, saj ste lahko odvisni od krvi ljudi.
6. Visnaznit masni delež klorovodikove kisline v območju, odrezan pri odvajanju vode v prostornini (n.u.) 8,96 dm 3 v vodi z masoyu 500 g.
7. Razstavte uspešnost v ofenzivnih shemah oksidno-bazične reakcije:
a) H2 S + Cl2 + H2 O → H2 SO4 + HCl; b) H2 S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
Imeti kožne reakcije, da oksidirajo in prevladujejo.
§ 39. Kisnevmіsnі spoluki sіrki
Imeti s'єdnannyakh s sirka viyavlyaє stopnja oksidacije+4 і +6.
Serca (IV) oksid. Čista kislina
Sivi oksid (IV) - SO2 (čisti plin) - je plin brez jedka z ostrim značilnim vonjem, ki se pojavi med vročo vodo:
S + O2 = t SO2.

Nekateri od tistih, ki so našli zastoj, so bili privezani na zakamnjene mastne žile, ki so lahko pekle. Jak pisanje antičnega zgodovinarja Plinija starejšega iz 1. stoletja do zvoka. Se pravi, "vonji ognja ognja lahko ohranijo vse vrste čarov in odženejo vsako nečisto silo." Dezinfekcijska in baktericidna moč serumskega (IV) oksida bo naenkrat postala zlobna. Belkast plin se porabi v procesu predelave zelenjave, sadja in sadja, da se prepreči njihovo gnitje.
Izpust čistega plina v bližini vode (do 40 volumnov SO2 na 1 prostornino vode) - nestiyka, dvojna osnova sirkova kislina yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
Čista kislina je šibka kislina, v vodnih razlikah je pogosto ločena od navedb hidrosulfitnih in sulfitnih ionov:
H + + HSO -, | - H + + SO 2–. |
||||
Čista kislina je kemična moč, zagalna za kisline: interakcija z osnovnimi oksidi, bazami, vstop v reakcijsko izmenjavo s solmi nižjih kislin, zokrem, vitisnya iz soli, šibka kislina:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Serkijev oksid (VI)
Prisoten je oksid Serca (VI), oksidacijski serum (IV) oksid je prisoten v prisotnosti katalizatorja pri temperaturah blizu 500 C:
t, mačka.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Za ekstravagantne ume je serkijski oksid (VI) SO3 pust vir vode, ki se pri temperaturah pod 17 °C spremeni v kristalno besedo. To je tipičen kisli oksid, ki v povezavi z vodo pretvori močno kislo kislino:
SO3 + H2O = H2SO4.
Sirčanska kislina
Grafična formula je model molekule žveplove kisline in je usmerjena na malo 62.
Majhna. 62. Grafična formula in model molekule klorovodikove kisline
Imeti vprašanja vzreje sirchanova kislina je močan elektrolit,
і njen disoсіatsіyu se vrti takole:
H2 SO4 → 2Н + + SO4 2–.
Fizikalna moč klorovodikove kisline
Сірчана kislina - pomembna (moč 1,83 g / cm3), oljnata, brez hlevov, brez vonja. Vaughn bo šel v vodo v kakršnih koli pogledih.
Postopek določanja H2SO4 s kemično količino 1 mol se preloži na količino 92 kJ toplote, ki jo lahko prilagodimo vrednostim toplotnih učinkov v kemijskih reakcijah. Vizualizacija velike količine toplote med interakcijo klorovodikove kisline in vode je dokaz vzpostavitve mikrosfer z dvema besedama hidratov tipa H2SO4 n H2O.
Na primer, H2SO4 · H2O; H2S04 2H2O; H2SO4 3H2O itd.
nova kislina in voda omogočata, da se uporablja kot močno sredstvo za prenašanje vode, na primer za sušenje plinov.
Razvoj vsote v primeru diseminacije klorovodikove kisline v vodi je mogoče nadzorovati v obliki briketov. Spomni se nate kislini ne morete dodati vode
lot, čemur sledi neprekinjeno mešanje raztopine, vlijemo kislino v vodo.
Vesele oblasti citronska kislina. Sulfati
Sulfati. Razredčena sirhanova kislina vse je značilno za kisline moči: izmenjava s kovinami, ki stojijo med sredino aktivnosti in vodo; s bazični amfoterni oksidi, s baze in soli. Na splošno obstajajo soli: srednji - sulfat, na primer K 2 SO 4 і kislina -
hidrosulfat, na primer KHSO4.
Večino sulfatov in hidrosulfatov voda dobro odstrani, veliko jih je odobrenih kristali... Deyakі kristalne sulfatne soli klorovodikove kisline in se imenujejo vitriol: citrusni vitriol CuSO4 ∙ 5H2 O, beli vitriol FeSO4 ∙ 7H2 O in in.
Za kvarjenje organske kisline in soli na nivoju vode je mogoče razviti različne soli:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
Kot rezultat reakcije bo prišlo do obleganja sulfatnega barija.
Laboratorijski pregled 6
Predpis kemijskih organov za razredčeno sirhanojsko kislino
Uporabiti je treba pet epruvet: kovina (cink ali celo kovina na merilniku vibracij), bazični oksid, natrijev hidroksid, natrijev karbonat, natrijev klorid. Natrijevemu hidroksidu dajte kapljico fenolftaleina in ji dajte kapljico. V kožno epruveto nalijemo 1-2 cm3 razredčenega sirupa. (Uvaga! Reakcija z glavnim oksidom je v nasprotju s pravilom, da pospešimo preobremenitev za polovico alkohola.)
Kaj počneš? Kateri znaki kažejo na prekoračitev kemičnih reakcij? Skladiščenje kemijskih reakcij v molekularnem in ionskem pogledu. Kaj pa oksidativno-vidnovne reakcije, ki ste jih izvedli? Zapomniti si kemično moč razredčene sirhanojske kisline.
Koncentrirana sirhanova kislina je močan oksidant, ni razredčen. Z interakcijo koncentrirane sirhanojske kisline
kovine ni videti.
Z kovine, ki stojijo poleg aktivnosti vode (razen zlata in platine), reakcija proti odobrenemu oksidu serkijeve (IV) SO 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2 O.
Pri reakciji s kovinami, ki so v območju aktivnosti do vode, se koncentracija kisline lahko koncentrira v vodni oksid (IV) SO2, voda S ali voda H2 S je prevladujoča oblika aktivnosti kovine in potek reakcije. Na primer:
4Zn + 5H2 SO4 (fin) = t 4ZnSO4 + H2 S + 4H2 O.
Nagadaєmo, scho zalizo, aluminij in deyakі іnshi so vrgli zlobne ume na pašo s koncentrirano sirchansko kislino.
Koncentrirana sirhanska kislina je dobra za interakcijo s preprostimi besedami z nekovinami, na primer s syrkoy:
S + 2H2SO4 = t3SO2 + 2H2O.
Oksidacijsko bagato zlaganje organski spoluks, sirchan acid obgorta papir, tkanina, les, odyag that shkiru. To se zgodi s koncentrirano sirchan kislino treba.
Koncentrirana sirhanova kislina je uporabna za odstranjevanje hlapnih kislin in soli. Na primer:
NaCl (TV) + H2SO4 (konc.) = t NaНSO4 + HCl.
V Republiki Bilorus sirchan kislino krožijo DDV "Gomel Khimichny Plant", DDV "Grodno Azot".
Območja pitja kisline
Vonj je predstavljen malemu 63.
Majhna. 63. Stagnacija citronske kisline
Sirčana kislina H2 SO4 - je pomembna, brez oljnatega ridina brez vonja.
Sirhanova kislina se razredči skupaj s kovinami, ki stojijo med aktivnostjo in vodo; s kovinski oksidi; osnove; iz soli.
Pri interakciji s koncentrirano kislino in kovinami vode ni mogoče videti.
Za kvarjenje organske kisline in soli na vodnem nivoju je zlobno oblikovati soli barija.
Napajanje in napajanje
1. Zapišite formule za okside in kisle kisline žvepla. Pokažite jim stopnjo oksidacije atomov vode.
2. Poiščite maso sirkija, ki se zažge v kislem, saj na gori vidite 29,69 kJ toplote. Ali ste ga dobili s sirasto količino oksida sirke (VI)? Toplotni učinek reakcije gašenja postane 296,9 kJ / mol.
3. Jedka tabela soli, kislin in baz v vodi, dodamo 2 enaki reakciji razredčene klorovodikove kisline in soli. Zapišite ime
v molekularni in ionski viglyad.
4. Maso zaščitimo s tisto kemično količino sulfatne palice, ki nastane pri razredčenju s klorovodikovo kislino za raztopino nitrata, s palico 200 g, masni delež Ba (NO 3) 2 za vsako cesto 10%.
5. Prosimo, glejte besedilo odstavka na podlagi reakcije, ki označuje kemično moč koncentrirane klorovodikove kisline. Začnite faze oksidacije atomov vode v državi. V kožni reakciji je oksidant.
6. Yaky volumen koncentrirane klorovodikove kisline (= 1,83 g/cm 3) z masnim deležem H2SO4 98%, potrebna raztopina za maso 6,4 r?
7. Povečajte učinkovitost shem za začetek oksidativno-glavnih reakcij:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2 S + HClO → K2SO4 + HCl.
V kožni reakciji je oksidant.
§ 40. Razumevanje načina kemične reakcije izdelka
Kemija, shranjena v skladu z zakonom ohranjanja mase govora, omogoča izvajanje razrahunki, zokryuvat massu, obsyag chihichnuyu produkta reakcije. V praksi je veliko reakcij obrnjenih, del govora je vpleten v rezultat izhlapevanja, raztopine ali odobritve stranskih produktov. Za ta reakcijski produkt je treba trditi, da je manjši, malo je videti, preden se razvije enaka reakcija. V takem rangu, če teoretično sprejmemo težo produkta za enako reakcijo ali če je kemična količina produkta 100%, potem bo v realnem procesu do produkta manjša od 100%.
Začetek reakcije na produkt reakcije je črka grške abecede (tsya) in se pojavlja v delih iste.
Vrsta produkta kemične reakcije je vrednost, ki je draga za produkt (volumen, kemična količina) izdelka, ki je dejansko odrezan na produkt (za izdelek, kemična količina), izračunana za reakcijo
V vseh primerih bo znano, da je najpomembnejši produkt kemične reakcije. Na primer, ko je vidomo, za reakcijo oksidiranega oksida serkije (IV) v oksid serka (VI)
2SO2 + O2 2SO3
vikhid postane 80 % (ali 0,8), kar pomeni približno sivi oksid (IV) s težo 64 g (prostornina 22,4 dm3, kemična količina 1 mol) in sprejemljiv sivi oksid (VI) z teža ne 80 g (prostornina 22,4 dm3, kemična količina 1 mol) in masa 80 g ∙ 0,8 = 64 g (prostornina 17,9 dm3, kemična količina
Od velikosti blaga do procesa v resničnem svetu je treba uvesti dodatne operacije in operacije.
Sliko pritrditve rožnega venca je enostavno videti iz koncepta "prehod do produkta reakcije".
zaloga 1. Zaradi soljenja sive lužnice z maso 48 g se odstrani žveplov oksid (IV) s prostornino 28,6 dm3. Vizualizirajte reakcijski produkt.
m (S) = 48 g | 1. Vizualno sirasto število semen, |
||||
V praktično (SO2) = 28,6 dm3 | vstopil v reakcijo: | ||||
gospa) | |||||
(SO2) =? | n (S) | ||||
GOSPA) | 32 g/mol |
||||
2. Skladiščna reakcija serka (IV) oksida: S + O2 = SO2.
3. Poznamo teoretično količino serkijevega oksida (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Razumevanje vnosa produkta kemične reakcije |
4. Poznamo teoretično analizo serki oksida (IV):
V teor (SO2) = n teor (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Rozrakhumo vikhid na reakcijski produkt:
Odgovor: Odziv na zdravilo je 85%.
Dodatek 2. Določite maso FeS2, ki je potrebna za odstranitev serki (IV) oksida s prostornino 8,96 dm3, tako da reakcijski produkt postane 90 %.
V (SO2) = 8,96 dm3 | 1.Vizualno pomembna teoretična izmenjava serkijevega oksida (IV): |
|||||||||||
(SO2) = 90 % | V praksa | V praksa | ||||||||||
m (FeS2) =? | Teorija zvezd V = | |||||||||||
V teor | ||||||||||||
Vteor (SO2) = | V praksa (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Poznamo teoretično kemično količino sivega oksida (IV): |
||||||||||||
n teorija (SO 2) | V teorija (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3 / mol |
||||||||||||
3. Stopnja reakcije na serkijev oksid (IV) in kemična količina pirita, ki je potrebna za dajanje vipala:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Glede na težo pirita, ki je potrebna za vipal: m (FeS2) = 0,2 mol · 120 g / mol = 24 g.
Predlog: za opazovanje oksida sirke (IV) je potrebno vzeti maso 24 g.

Vrsta produkta kemične reakcije je vrednost, ki je draga za izdelek (kostnica, kemična količina) od dejansko rezanega izdelka do izdelka (izcedka, kemični produkt), izračunanega za reakcijo. Obrnite se v delih odinitsi chi vidsotkah.
Napajanje in napajanje
1. Zakaj bi moral praktičen odziv na reakcijski produkt imenovati manj, teoretično nižje zavarovalno kritje za enak odziv?
2. Pri reakciji vode s kemično količino vode, 1 mol, se voda nastavi v kemično količino 0,85 mola. Vizualizirajte reakcijski produkt.
3. Kot rezultat interakcije klorida z maso 200 g iz klorovodikove kisline, obarjanje sulfata z maso 100 g.
4. Poiščite prostornino (n.u.) in kemično količino sivega oksida (IV), ki jo določimo z zgorelim semenom 64 g, saj je reakcijski produkt 75 %.
5. Izračunajte maso zgorele vode, če je količina sivega (IV) oksida prirezana s prostornino (n.u.) 89,6 dm 3 bi moralo postati 80 % teoretično možnega.
6. Navidez vikhid oksid serkija (VI), odrezan med oksidiranim serkijskim oksidom (IV),
cesta 85 %. S pomočjo mase, volumna (n.o.) in kemične količine serkijevega oksida (IV), ki je vstopil v reakcijo, ko se serkijev oksid (VI) odstrani s prostornino (n.u.) 2,24 dm3.
7. Najprej začnemo z masnim deležem soli v roschini, odrezanem pri destilaciji iz mase 3,2 g, v sirupastih kislinah z maso 192 g, če reakcijski produkt postane 85 %.
§ 41. Dušik in fosfor
Dušik N in fosfor P gnijeta v periodičnem sistemu skupine VA. V celotno skupino periodičnih sistemov so uvedeni Mis'yak As, surma Sb in bizmut Bi. Dušik in fosfor ê z nekovinami prineseta mish'yak in surma k kovinam, smut pa k kovinam.
Budova atomív ta stopnja oksidacije
Atomski elementi skupine VA imajo po 5 elektronov za najpomembnejšo energijsko raven;
7 N ↓ | 15P ↓ |
Zavdannya.
- Chim viklikana je taka sprememba? S kakšno močjo je treba dikromat vsaditi v kromovo vsoto za posodo?
- V epruveto vlijemo 5-6 kapljic kalcijevega dikromata in 3 kapljice klorovodikove kisline. V kaliyu dodajte 2 kapljici jodida in namesto epruvet dodajte 10 kapljic vode. Majhen del s peresom prenesite v epruveto, namesto da bi dodali kapljico škroba. Chi zm_nilosya zabarvlennya škrob? Za kaj? Rivnyannya OVR in vzvnyannya elektronska metoda.
- Začetna značilnost elementa 15 R. Moč alotropnih modifikacij fosforja. Izmenjava fosforja s preprostimi in zložljivimi besedami.
V lekarnah stagnira živosrebrov (II) oksid kot nižji antiseptik za kuhanje mazila, kako pridobiti veliko razredčenega natrijevega hidroksida na osnovi živosrebrovih soli.
Zavdannya.
1. Napiši specifično reakcijo na živosrebrov (II) oksid. Pojasnite, zakaj je treba izvajati operacije na temryavi?
3. Osnovni zakoni kemije.
Vikoristannya spoluk cink v medicini temelji na tej kiselkasti, antiseptični zasnovi. 0,25% razchin cinkov sulfat vykorytutsya za pripravo kapljic za oko naenkrat z 2% borove kisline.
Zavdannya.
- Pripravimo 0,25 % raztopino cinkovega sulfata s prostornino 100 ml (ρ = 1,02 g / ml).
- Zd_ysniti revizija
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Kovalentna povezava, viznennya, glej, mehanizem osvetlitve, moč. Valence. Faza je oksidirana.
· Farmacevt za kontrolo kakovosti zdravila zaliza z metodo permanganatometrije.
Zavdannya.
1. Zapisati enak odgovor in izobraževanje z elektronsko metodo.
2. Izračunajte, kolikšen volumen 0,5 % - stopa (ρ = 1,004 g / ml) velikosti natrijevega hidroksida je potreben za reakcijo z 0,1 M raztopino klorida (III) prostornine 20 ml.
3. Periodični zakon, ki periodični sistem ob luči dneva o Budovi atoma.
· Zalizo, obnovljen, ki v nasprotju z njim notranje stagnira, vendar se vidi iz hiš sulfidov medi, vugile, kremenčeve kisline, mis'yakuja.
Zavdannya.
1. Predlagajte način, kako se znebiti hiše. Obruntovati vidpovid.
3. Glavna vrsta kemičnega zvoka. Narava oddaja vesel zvok.
· Za organizem permanganata z zrni, їkh zeshkozhennya izvesti 3% vodno raztopino H 2 Pro 2 s kislo kislino.
Zavdannya.
1. Napišite običajno reakcijo. Stopnja odziva po elektronski metodi
- Oxydi, viznachennya, klasifikacija, nomenklatura, moč in metode obsedenosti.
· Število besed v pripravku izvedemo z metodo permanganatometrije, uporabili bomo Fe2 + za oksidacijo v Fe3 +. Izbor obnovljivih soli se uporablja za ekstrakcijo količine natrijevega permanganata med segrevanjem in pri ohlajanju.
Zavdannya.
1. Zapisati standardne reakcije, ki so v osnovi osnovne definicije.
2. Pripravite 200 ml 0,1 n KMnO 4 (faktor enakovrednosti za pripravek).
3. Kisline, viznachennya, klasifikacija, nomenklatura, moč, načini obsedenosti.
· Farmakopejsko pripravo nitrata medija je treba opustiti z ofenzivnim rangom: raztopino mineralno-medijske zlitine iz razredčitve dušikove kisline, da očistimo odstranitev nitrata iz hiš, jo oborimo s klorovodikovo kislino. Obleganje se posledično vnese s cinkom v kislem okolju, v sredini pa ne iz hiš, spet v dušikovi kislini.
Zavdannya.
- Napišite vrstico pogostih reakcij.
- Identifikacija pozitivnih reakcij na Cl-, Br-, J anion na osnovi srednjega nitrata, kar je osnova za potrditev veljavnosti pripravkov v kloridih, jodidih, bromidih v kalorijah.
- Predstavitev, viznachennya, klasifikacija, nomenklatura, moč, načini obsedenosti.
9. Nitrat medija stagnira v primeru erozije, zavojev, stanja konjunktivitisa v viglyadah 2,5 in 10% vodne raztopine.
Zavdannya.
- Pripravimo 2 % velikosti AgNO 3 po prostornini 50 ml (ρ = 1,015 g/ml). Koliko misli je bilo posvečenih razliki?
- Zd_ysniti revizija
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, klasifikacija, nomenklatura, moč, načini obsedenosti.
· Farmacevt bi moral opraviti identifikacijo farmakopejskega pripravka s sulfatno ploščico.
Zavdannya.
1. Kako uporabljam vikorist sulfat v medicini? Zakaj je treba sulfatne barije zliti z natrijevim karbonatom pred izvedbo identifikacijskih reakcij? Dokaz za potrditev podobnih reakcij.
2. Vikonacija reakcij identifikacije soli BaSO4, CaSO4, Na2SO4.
3. Kompleks spoluks, viznachennya, budova za A. Vernerja, narava kemije, klasifikacija, nomenklatura, disociacija. Stagnacija kompleksnih rešitev v medicinski in kemični analizi.
· Farmacevt s koncentrirano raztopino amiakuja, ki omogoča grobo uničenje tehnologije varnosti – vodenje robotov na viteško glavo brez povečanega vleka.
Zavdannya.
- Kakšno dediščino lahko naredite, ko delate s koncentrirano paleto amiakujev, ne da bi se dotaknili tehnologije varnosti? Yak pershu zdravniško pomoč je treba plačati, ko se amiak odstrani v parih.
- Zdіsniti tako prenova.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
Zapisati pravilne reakcije za molekularni in ionski pogled ter za OVR - nivo metode elektronskega ravnotežja.
- Kinetika kemije. Hitrost kemičnih reakcij. Infuzija fleksibilnih faktorjev na hitrost kemičnih reakcij.
· Dušik v zdravilu zastaja v količini amoniaka v vodi, amonijevih soli, dušikovega oksida in natrijevega nitrita.
Zavdannya.
- Kaj bom naredil s poklonom dušiku? Napišite formule danih govorov in enakovrednih reakcij, ki označujejo glavno moč.
- V kislo sredino napišite reakcijo rіvnyannya med natrijevim nitratom in kalcijevim permanganatom. Prepoznaj reakcijo po reakcijski metodi
- Brez pogajanj in volkodlaki kemijske reakcije... Khimichna Rivnovaga. Mac zakon za enako pomembne sisteme. Rivnovagi konstanta. Le Chatelovo načelo.
· Farmacevt bi moral opraviti identifikacijo soli z natrijevim sulfatom, natrijevim kloridom, natrijevim hidrokarbonatom.
Zavdannya.
- Viconatie reakcije na ion SO 4 2-, Cl-, HCO 3-.
- Rosrahuvati, količina gramov v kristaliničnem hidratu Na 2 SO 4 · 10H 2 O je potrebna, da farmacevt odstrani količino vode v količini 500 g in odstrani 5 % količine Na 2 SO 4?
- Reakcije, ki vodijo oksidacijo. Glavne določbe elektronske teorije oksidativno-vitalnih reakcij. Nayvazhivіshі oksidativne in vodilne figure. Zrivnyannya oksidno-vidnovnykh reakcije z metodo elektronskega ravnovesja in z ionsko-elektronsko metodo.
Kaliєva sіl sіrchanoіy kislina in oblačenje veliko tujih pripravkov za telo (ksenobiotiki) - likuvalna zdravila Ta presnova temelji na izjavah nekega nepametnega govora – konjugatov, saj se zlahka prenese v telo.
Zavdannya.
- Otrimatyvu sіl sіl sіlchanojska kislina na običajen način, vikoryuchi na mizi reagenta. Napišite vrstico pogostih reakcij.
- Obseg molekularnih reakcij, ki se vrtijo s tako hitrim íonny іvnyаnnya:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Disperzijski sistemi, poimenovanje, razvrstitev. Suspenzije, aerosoli, emulzije. Vikoristannya grobo razpršeni sistemi v medicini in farmaciji.
Farmacevt mora odstraniti 5 % raztopino sirhanojske kisline.
Zavdannya.
- Kakšno je oksidativno zdravje aniona SO 4 2 v koncentraciji kisline? Zapišite pravilne reakcije, da označite moč razredčene in koncentrirane kisline.
- Pripravite 5 % jakosti sirhanojske kisline, mayuchi 50 ml sirhanojske kisline in masni delež H 2 SO 4 30 %.
- Kolosalne razlike, klasifikacija, poimenovanje, molekularno-kinetični ta optična moč, zavrnitev. Stabilnost ogromnih razlik. Koagulacija. Peptizacija. Budova micel. Dializ.
· Сірка, scho za vstop v skladišče aminokislin, za oksidacijo v organizmu. S celotno endogeno sirchan kislino skrbi za usodo tujih otrobov spoluch - fenol, krezol, indol.
Zavdannya.
- Opiši moč kisle kisline in preglasi pravila robotike s kislinami.
- Rosrahuvati, ki je prostornina sirhanojske kisline z masnim deležem H 2 SO 4 25% in zgoščena 1,18 g / ml, je treba vzeti za nevtralizacijo kalcijevega hidroksida, prostornina 50 ml, z masnim deležem KOH 12% in debel 1,1 g / ml.
- Resnica odločitve, vrednost, glavno razumevanje, dan do procesa odločitve. Difuzija. Osmoza. Osmotski primež.
· V industrijskih območjih, kjer je veliko vode, ni lahko dobiti kislinskih plošč.
Zavdannya.
- Shho je zraven skladišče kemije kislinske plošče na območjih qikh? Yak vin se pretvarjati? Napišite preprosto reakcijo.
- Molekularne in hitre ravni hidrolize zgodnjih soli:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Sirvododen za vstop v naravo veliko število stvari za razvoj bioloških procesov in potekajo v promineralnih vodah.
Zavdannya.
- Moč moči.
- Zd_ysniti revizija:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Napišite preprosto reakcijo na molekularni in ionski pregledovalnik.
- Disociacija kislin, baz, soli, vode. Kislinsko-bazični rivnovaga in razchiny. Ionny dobutok vodi, pH-raztopine.
· Uradno zdravilo sirki є sirka, prevlečeno z (Sulphur praecipitafum).
Zavdannya.
- Opiši moč vina in alotropne modifikacije olja.
- Zd_ysniti revizija:
Zr_vnyati reakcije po metodi elektronskega ravnovesja.
- Hidroliza. Občutljivost na proces hidrolize. Hidroliza različnih vrst soli. Korak do hidrolize. Infuzija novih dejavnikov v faze hidrolize.
Farmacevt bo izvedel identifikacijsko reakcijo 3% raztopine peroksid peroksida: do 1 ml razredčene klorovodikove kisline, 1 ml razredčene klorovodikove kisline, 1 ml etra in 0,5 ml raztopine kalcijevega dikromata. koncentracija koncentracije klorovodikove kisline v kislini 6
Zavdannya.
- Viconatijeva reakcija identifikacije vodnega peroksida.
- Napisati standard za prepoznavanje razlike med vodnim peroksidom in zdravjem z uporabo metode elektronskega ravnotežja.
- Splošne značilnosti elementov glavne pidskupine VII skupine in spoluka. Medicina- biološko smiselna halogen
· Kisen je farmacevtski izdelek, ki ga opisuje GF. Yogo zasosovyut za vdihavanje za različne vrste kisle lakote.
20. Zavdanja.
- Zapiši pravilne reakcije za odkrivanje CO, 2, NO, NO2.
- Zapisati reakcije r_vnyannya, ki so v osnovi laboratorijske metode zavračanja kislosti. Stopnje indukcije reakcij po metodi elektronskega ravnovesja
- Klor, klor voda, klorovodikova kislina, klorid. Fizikalna in kemična moč klora in druge polovice. Medicinski in biološki pomen halogenov.
· Farmacevtska revizija zdravil na osnovi natrijevega klorida, natrijevega bromida in natrijevega jodida.
Zavdannya.
- Za kakršne koli namene je možna uporaba soli v farmaciji in medicini.
- Vykonati yakіsnі reakcije na anionske Cl-, Br-, J-.
- Fizikalna in kemična moč kislega klora. Otrimannya. Zasosuvannya.
· Ena od industrijskih metod odstranjevanja joda za farmacevtske izdelke je proces opazovanja joda iz vrtalnih voda. Yodidi, v bližini vrtalnih voda, oksidira po shemi:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Zavdanja.
- Pripravki z jodom iz jaka in kako se zatakniti v medicini.
- Naučiti se reakcije, postaviti temelje za obsedenost z jodom z metodo napivreakcij.
- Zagalna značilnost halkogena. Moč je kisla, da jogo spoluk. Medicinski in biološki pomen
· Farmacevt viznacha referenčna zdravila v natrijevem kloridu, kalciju in kalciju.
Zavdannya.
- Za vse namene, vikorist in farmacevtski pripravki.
- Viconati reakcij identifikacije danih soli.
- Spoluki kisnem z vodo. Fizikalne in kemijske lastnosti vode. Peroksidna voda, energija, shranjevanje v medicini. Pomen vode v življenju organizmov.
· Halogeni Zi spoluk s hipokloriti kislega lišaja postajajo zanimivi za medicino, saj se razkužujejo.
Zavdannya.
- Ali temelji na moči hipokloritov? Napišite vrstico pogostih reakcij.
- Rosrahuvati, je treba vzeti nekaj gramov klorove vapne, da odstranimo 2 litra aktivnega klora.
- Sirka in njen spoluki. Alotropija vinske sirke. Fizikalna in kemična moč vode, vode, vode, kisline in soli.
· V primeru pomanjkanja kislosti brozge soka je potrebno uporabiti interno razredčeno klorovodikovo kislino.
Zavdannya.
- Ponovno preberite osnovna pravila robota s kislinami.
- Rosrahuvati, v steklenici 36,5 % raztopine (ρ = 1,19 g / ml) klorovodikove kisline, za pripravo pa je potrebno vzeti 100 ml. 8,2 % (ρ = 1,040 g/ml) kisline.
- Fizikalne in kemijske moči vodnih oksidov, deviške kisline in organske kisline. Sulfiti. Sulfati. Moč, posest, posest.
· Lekarna ima eno izmed standardnih raztopin ê raztopin, kjer se lahko izda 33% kalcijevega acetata, ki ga lahko doziramo z raztopino 30% kalcijevega karbonata - na osnovi organske kisline.
Zavdannya.
1. Napiši enako reakcijo na molekularni in ionski gledalec.
- Glavne značilnosti elementov glavne skupine skupine V. Moč dušika. Vrednost dušika v življenju organizmov.
· Predpisovanje razlik v govoru, ki je močna baza in šibka kislina. Za naročilo stabilizatorja GFH yak se dobavi 0,1 n raztopine natrijevega klorida z velikostjo 4 ml na 1 liter raztopine.
Zavdannya.
- Napiši primer reakcije na hidrolizo soli CH3COONa.
- Rosrahuvati, nekaj gramov NaOH je treba upoštevati, obrezati s 500 ml velikosti 0,1n. Pripravite široko paleto rešitev za varnostno tehnologijo.
- Amiak. Sol amoniak. Moč. Stagnacija v medicini in farmaciji.
· Farmacevt je pripravil recept za mazilo: 1 g kalcijevega karbonata in 0,5 g natrijevega tetraborata v 70 ml destilirane vode, 10 g stearinske fuzije s 15 g vazelin olia in tanek curek med mešanjem vrtnice v topel karbonat z vodo. ...
Zavdannya.
- Koliko besed ste posvojili v preteklosti? Yake srednji človek, da se pretvarja za kaj? Dokaz za potrditev podobnih reakcij.
- Pripravite tehno-kemične vagi za robote. Upoštevajte 1 g kalorij karbonata na tehno-kemičnih teresah.
- Oksid v dušik. Dušikova kislina in soli. Fizikalni in kemični organi. Medicinska in biološka vrednost z dušikom
Za izpiranje praznih ust in žrela mora farmacevt pripraviti 0,05% permanganat v prostornini 200 ml.
Zavdannya.
- Na kakšni moči permanganirati cali runtuet yogo politično delovanje? Yaki spolukyu mangan stagnira v za pitne namene?
- Količino KMnO 4 gramov je treba uporabiti za odstranitev 200 ml 0,05 % KMnO 4 (ρ = 0,9994 g / ml). Pokažite tehniko pridobivanja danega razpona.
- Budova molekule dušikove kisline. Fizikalna in kemična moč dušikove kisline in soli. Mediko - biološka vrednost dušika in spoluka.
Farmacevtski izdelki imajo živosrebrov (II) oksid, ki je škodljiv kot antiseptik in oddaja natrijev hidroksid v obliki razredčenih soli živega srebra (II).
Zavdannya.
1. Napiši specifično reakcijo na živosrebrov (II) oksid. Kakšne reakcije je treba izvesti pri temryavi?
3. Osnovni zakoni kemije.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Nadkromna kislina, ki jo najdemo hkrati, H 2 CrO 6 je ena izmed modrih barv. Sinergija polnjenja kisline in podpore pripravku Н2О2.
Zavdannya.
- Zrіvnyati tsyu reakcija z elektronsko metodo.
- Kakšna vrsta kroma lahko povzroči oksidativno moč in kaj z njim?
- Moč fosforja, fosforjevih oksidov in fosforjevih kislin ter njihova posest. Medicinska in biološka vrednost fosforja
· Povzetek magnezijevega oksida (85 %) in magnezijevega peroksida (15 %) je s pripravkom, imenujemo ga "magnezijev peroksid", ki se uporablja za stagnacijo v primeru klobasnih črevesnih izcedkov.
Zavdannya.
- Pojasnite antacidno in baktericidno zdravilo. Dokaz za potrditev podobnih reakcij.
- Rosrahuvati, nekaj gramov MgO in MgO 2 morate vzeti za pripravo 100 g tega pripravka. Respect 10 g magnezijevega oksida na tehno-kemične tereze.
- Splošne značilnosti elementov IV skupine glavne pidskupine. Budova, Fizična moč alotrop v ogljiku. Vesela moč močne osebe v premogu.
· Izperite natrijev hidrokarbonat (pitnoy soda), da stoji na viglyadi sperite, sperite z ognjenimi očmi, sluznicami lupine zgornjih dichny plemičev.
Zavdannya.
- Ali je antiseptik za moč natrijevega hidrokarbonata? Dokaz za potrditev podobnih reakcij. Kaj lahko uporabimo kot antiseptik z natrijevim tetraboratom Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Pripravimo 5 % raztopino NaHCO 3 prostornine 50 ml (= 1,036 g/ml).
- Budova molekul, fizikalna in kemijska moč kislinskega spoluka v premogu. Mediko - biološki pomen v premogu, ki spoluk.
V antacidnih pripravkih, ki se maščujejo natrijevemu hidrokarbonatu, je vicoristov v primeru zgodnje bolezni, ki jo nadzira kislost, tobto. acidoza.
Zavdannya.
- Na kateri moči cene soli naj uporabljamo antacidna zdravila? Dokaz za potrditev podobnih reakcij. Kakšen govor lahko kupite za svoje cilje?
- Zd_ysniti revizija:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Napišite preprosto reakcijo na molekularni in ionski pregledovalnik.
Viconatijeva reakcija Na 2 CO 3 → NaCl → NaNO 3.
- Silicij, ki yogo spoluky, pozna naravo, zavračanje, fizično in kemično moč. Mediko - biološki, kar pomeni silicij.
· 2,5 % raztopina NaCl se uporablja interno za izpiranje suspenzije, ko se odstrani AgNO 3.
Zavdannya.
1. Zakaj naj uporabim raztopino NaCl? Dokaz za potrditev podobnih reakcij.
3. Splošne značilnosti elementov glavne skupine tretje skupine. Moč je dolgočasna ta yogo spoluk. Medicinski in biološki pomen v medicini.
· Za vzrejo redkih lykarskih oblik, znakov za in'єкцій, ін'кцій, vikoristovyut іzotonіchny rozchin.
Zavdannya.
1. Kakšna je tudi izotonična razlika? Zakaj se imenuje izotoničen?
3. Alumіnіy da yogo spoluky, moč, zavrnitev. Medicinski in biološki pomen aluminija.
· 3% vodna raztopina peroksida vode zasosovyat yak zovn_shn_y baktericidni zasib.
Zavdannya.
1. Na podlagi česa je baktericiden in krvno-spinalni za vodni peroksid. Na kakšne tuje obiske morate biti pozorni, ko potujete?
2. Rosrahuvati, ml. Pergidrol (30 % vodna raztopina N 2 Pro 2, ρ = 1,1 g / ml) je treba vzeti za odstranitev 500 ml 3 % raztopine (ρ = 1,005 g / ml). Pripravite širok nabor rešitev za izpolnjevanje varnostne tehnologije.
3. Kovine glavne pidskupine ІІ skupine. Zagalna značilnost, zavrnitev, fizična in kemična moč. Sol kalcija in magnezija. Trdota vode. Usunennya zhorstkosti vodi. Medicinski in biološki pomen elementov glavne skupine II.
· Trenutna farmacevtska industrija proizvodnje zdravil z agregatom, vrsta dispergiranih sistemov, način vnosa v organizem.
Zavdannya.
1. Kateri sistemi se imenujejo razpršeni?
Kako razvrstiti razpršene sisteme?
Ali razpršeni sistemi viglyadi vsebujejo droge? Prinesi posebne zadnjice.
- Otrimati pasji hidrosol z uporabo metode zamenjave razchinnika.
- Pomembne značilnosti tujih kovin, posest, fizična in kemična moč. Naivazhlivіshі poluchny metalіv. Medicinska in biološka vrednost kovine
Na viglyadі vodni razchinіv іznіh govorov, začnite postajati stagnirani rіdki lykarski formi, scho lahko spet spremenim razliko.
Zavdannya.
- Spravzhn_ razchini, razchinn_st, hujskanje, nerazdejanje, prenaseljenost razchini. Kakšne birokrate imajo?
- Pripravite 5 % nivoja CuSO 4 po prostornini 100 ml (ρ = 1,051 g / ml) s citrusovim vitriolom CuSO 4 ∙ 5H 2 O
- Začetna značilnost je d - elementi. Kovinska bitna pidskupina I skupina in їkh spoluk. Medicinski in biološki pomen.
· Rusija ima električno predelavo sokov in sveže zelene in ustvarjalne siruvine z nizkim sokom: jagodičja, sadja, korenovk zelenjave, majhnih organizmov zelenjave, s pomočjo videza sokov (notranji naravni). Notranji vmist je ogromna razlika opeke, nukleinska kislina, v ogljikovih hidratih, taninih
Zavdannya.
1. Ali vas imenujejo "kolosalni"? Yak smrad razvrstiti? Ponovno preberite moč ogromnih razlik. Kateri proces je v osnovi vizije sokov iz rastočega siruvina?
2. Otrimirajte hidrosol s hidroksidom fiziološke raztopine (III) po metodi hidrolize FeCl 3. Napišite diagram brstov.
- Kovine so bitne iz druge skupine, karakterizacija, fizikalna, fizikalna in kemična moč. Medicinski in biološki pomen.
Pri pripravi tablet na osnovi izvlečka baldrijanove korenine ni priporočljivo uporabljati magnezijevega karbonata kot osnovnega napovnuvača, ker je možno povzročiti nevtralizacijo izovalerinske kisline in ekstrahirati valtrat do kislega
Zavdannya.
1. Pojasni manifestacijo moči magnezijevega karbonata. Napišite preprosto reakcijo na molekularni in ionski pregledovalnik. Kako lahko zmagam pri pripravi tablet z izvlečkom baldrijana?
2. Zd_ysniti revizija:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Napišite preprosto reakcijo na molekularni in ionski pregledovalnik.
3. Splošne značilnosti elementov VI, VII skupin sekundarnih pidskupin. Oksidativna moč kroma, mangana in spoluka. Medicinski in biološki pomen.
· Zrіdzheniy v plinu ogljikove kisline vikoristoyuyut v farmacevtski virobniztvі za viluchennya biološko aktiven govor IZ lіkarskoy roslinnoy syruvin.
Zavdannya.
- Pri kakšni moči v ogljikovem dioksidu se plin razgrajuje v tsikh namene?
- Zd_ysniti revizija:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Reakcije na izmenjavo informacij z molekularnim in ionskim gledalcem.
- Splošne značilnosti elementov VIII skupine so bitne skupine pid. Moč duše je tisti yogo spoluk. Medicinski in biološki pomen.
Seznam izpitov za prehrano iz discipline
Osnovno razumevanje zakonov kemije. Srečen rojstni dan atomu.
Periodični zakon in periodični sistem D.I. Mendelejev v luči atoma.
Viznachennya, glej, razmišljaj o naravi kemičnega zvoka.
Vrednost, mehanizem osvetlitve, moč kovalentne povezave. Valence. Faza je oksidirana.
Oxydis: poimenovanje, klasifikacija, nomenklatura, moč in metode obsedenosti.
Kisline: viznachennya, klasifikacija, nomenklatura, moč in metode posesti.
Prijave: vize, klasifikacija, nomenklatura, moč in metode obsedenosti.
Soli: poimenovanje, klasifikacija, nomenklatura, moč in metode obsedenosti.
Kompleksni spoluks: viznachennya, budova za Wernerja, tipi, nomenklatura.
Hitrost kemičnih reakcij. Uradniki, scho vbrizgajo občutek kemijske reakcije.
Nereverzibilne in reverzibilne kemične reakcije. Khimichna Rivnovaga. Načelo M. Chatela. Rivnovagi konstanta.
Oksidativno-indikativne reakcije: vrednost, osnovno razumevanje, vsakodnevna oksidacija in obnova, nove oksidacijske in svinčene reakcije.
Disperzijski sistemi: poimenovanje, razvrstitev. Grobo razpršeni sistemi: suspenzije, aerosoli, emulzije.
Kolosalne razlike: vrednost, moč, obsedenost, budova micel.
Resnične odločitve: vrednost, osnovno razumevanje, vsakodnevni proces reševanja. Difuzija. Osmoza. Osmotski primež.
Glavne določbe teorije električne disociacije. Mehanizem električne disociacije. Korak je konstanta disociacije.
Disociacija kislin, baz, soli. Disociacija vode in pH raztopin.
Pomanjkanje hidrolize. Hidroliza različnih vrst soli. Korak do hidrolize.
Primarne značilnosti elementov glavne skupine VII skupine. Medicinski in biološki pomen halogenov
Klor, klor voda in klorovodikova kislina. Zavrnitev, moč. kloridi.
Kisnevi spoluki klor.
Zagalna značilnost halkogena. Kisen da jogo spoluki. Medicinski in biološki pomen
Vlastivosti spoluk kisle vode (voda, vodni peroksid). Zastosuvannya N 2 Pro 2 iz medi. Vrednost pogona.
Syrka. Alotropija vinske sirke. Vesele avtoritete sveta. Sirvoden. Vodovodikova kislina in soli.
Fizikalna in kemijska moč vodnih oksidov, čistih in čistih kislin, soli čistih in čistih kislin in drugih.
Glavne značilnosti elementov glavne skupine skupine V. Dušik enake moči.
Moč amoniaka in amoniakovih soli. Stagnacija v medicini in farmaciji.
Oksid v dušik. Dušikova kislina in soli. Fizična in kemična moč, shranjevanje.
Fizikalna in kemična moč dušikove kisline. nitrati. Mediko - biološka vrednost dušika in spoluka.
Značilnosti fosforja elementa 15 R. Vilny: alotropija, fizikalna in kemična moč, posest.
Fosfin. Fosforjev oksid in fosforjeva kislina: moč, posest. Medicinska in biološka vrednost fosforja
Splošne značilnosti elementov IV skupine glavne pidskupine. V premogu: fizična moč alotropov v premogu, kemična moč.
Kisnevy spoluky v premogu: budova molekule, fizikalne in kemične moči. Mediko-biološki pomen v premogu, ki spoluk.
Silicij, ki spoluky: poznavanje narave, zavračanje, fizična in kemična moč. Mediko - biološki, kar pomeni silicij.
Glavna skupina tretje skupine: glavne značilnosti elementov. Meja tega yogo spoluky: zavrnitev, fizična in kemična moč, shranjevanje v medicini.
Aluminij in yogo spoluky: obsedenost, fizična in kemična moč. Medicinski in biološki pomen aluminija.
Kovine glavne pidskupine II skupine: karakterizacija, obsedenost, fizikalna in kemična moč. Sol kalcija in magnezija. Trdota vode. Usunennya zhorstkosti vodi. Medicinski in biološki pomen elementov glavne skupine II.
Vrgle so luže: karakterizacija, posest, moč, navazhliv spoluks. Medicinski in biološki pomen.
Karakterizacija d-elementov je začetna. Kovinska bitna pidskupina I skupina. Podnannya mіdі, sіbla. Medicinski in biološki pomen.
Kovine druge skupine: karakterizacija Budovia, fizikalna in kemična moč. Medicinski in biološki pomen.
Sekundarne skupine VI, VII skupin: značilne značilnosti elementov skupine, moč kroma, mangana in njihovega spoluka. Medicinski in biološki pomen.
Označevanje skupine VIII: splošne značilnosti elementov skupine, moč te skupine. Medicinski in biološki pomen.
Ustatkuvannya. Na kožni mizi pred znanstveniki je učni načrt, diagram interakcije dušikove kisline s kovinami, nabor reagentov, test priloženega materiala.
Oksid v dušik
Vchitel.Uganite, da napišete formulo za dušikove okside. Ali okside imenujemo solotvorni ali neslani? Za kaj?
Znanstveniki samostojno zapišejo formule petih dušikovih oksidov, jih poimenujejo, ugibajo kisle kisline, pomešane z dušikom, in oblikujejo obliko med oksidi in kislinami. Eden od učenjakov bo zapisal odmerek (tabela).
Tabela
Zamenjava dušikovih oksidov, kislin in soli
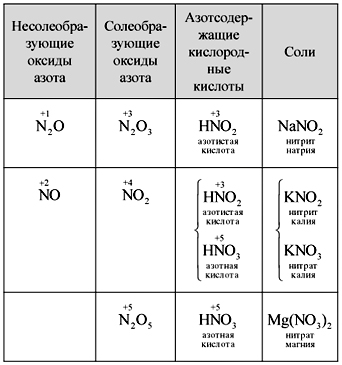
Predstavitev informacij:
interakcija dušikovega (IV) oksida z vodo
Vchitel. Imeti plovilo s NE 2 Obstaja plima vode in plima vode, namesto vip testa lakmusa.
Kdo sposterіgaєmo? Rosehin chervonin skozi dve kislini, v redu je.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Korak oksidacije dušika NE 2 vrata +4, tobto. zmagal industrijski mіzh +3 і +5, kot v primeru togosti, se dušikov (IV) oksid prevede v obliko dveh kislin - dušika in dušika.
Skladišče ta budova molekul
Vchitel.Če želite zapisati molekulsko formulo dušikove kisline, izračunajte molekulsko maso in označite stopnjo oksidiranih elementov. Shranite strukturne in elektronske formule.
Znanstveniki oblikujejo takšne formule (slika 1).
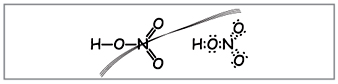
Vchitel.Glede na število formul je mogoče deset elektronov oviti okoli dušika, ki ne more biti rdeč, ker Dušik se nahaja v drugem obdobju in kolikor je mogoče na zadnji krogli v novejšem morda ne bo več elektronike. Superlativnost je asimilirana, kot da bi se prepustila, a med atomom dušika in enim od atomov v kislini se za mehanizmom darovalec-akceptor vzpostavi kovalentna vez(slika 2).
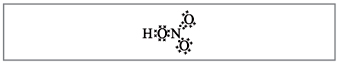
Majhna. 2. Elektronska formula dušikove kisline.
Elektron in atom dušika, označena s črnimi pikami
Strukturno formulo dušikove kisline je mogoče sklepati na naslednji način(slika 3) :
Majhna. 3. Strukturna formula dušikove kisline
(donorsko-akceptorski pas indikacij z udarcem)
Vendar pa je prejšnja pot prinesla, da je podveza enakomerno razdeljena med dva atoma kisnyja. Stopnja oksidiranega dušika v dušikovi kislini je draga +5, valenca (zversko spoštovanje) pa je draga, več kot izbira elektronskih stav.
Fizična moč dušikove kisline
Vchitel.Tukaj je steklenica razredčene te koncentrirane dušikove kisline. Opišite fizične moči, ki so.
Znanstveniki opisujejo dušikovo kislino jak ridina, ki je pomembna za vodo, žvečljive barve, z ostrim vonjem. Razchin dušikova kislina brez barve in vonja.
Vchitel. Dodam, temperatura vrelišča dušikove kisline +83 ° C, temperatura zmrzovanja –41 ° W, tobto. za duhovite ume tse ridin. Ostrega vonja in tistih, ki, ko ga vzamete ven, pojasnjujejo, da je kislina koncentrirana v majhni količini svetlobe ali pa se pri segrevanju pogosto zruši.
Kemija kislinske moči
Vchitel. Uganete, s kakšnimi stavki se zamenjajo kisline?(Znanstveno ime.)
Preden začnete z reagenti, prerokujte seznam reakcij in zapišite svoja opozorila (reakcije zapisovanja povpraševanja pri luči TED).
In zdaj se hranimo s posebnimi močmi dušikove kisline.
Bili smo polirani, toda kislina v primeru zbergannі zhovtіє zdaj izvajamo kemično reakcijo:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Znanstveno za samostojno beleženje elektronskega ravnovesja reakcije.)
"Buri plin"(ŠT. 2) farbu kislina.
Zlasti kislina se reducira v kovine. Veste, da so metali vodo iz razgradnje kisline, vendar je niso izgubili med interakcijo z dušikovo kislino.
Čudite se diagramu, ki ga imate na zabavi, prikazano je, kako se vidijo plini med reakcijo kisline in koncentracije s kovinami.(Robot z diagramom.)
Predstavitev informacij:
interakcija koncentrirane dušikove kisline z middy
Še bolj učinkovit je prikaz reakcije dušikove kisline (konc.) s prahom gojišča ali pa z dodatkom puščice z majhnimi koščki medu:
Znanstveno za samostojno beleženje elektronskega ravnovesja reakcije:
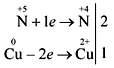
Obsedenost s kislino
Vchitel. Lekcija bo nerazumljiva, saj prehrana dušikove kisline ni vidna.
Laboratorijska metoda: diya koncentrirane klorovodikove kisline na nitratu (slika 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Pri promislovosti kisline v bazični posesti na amičen način.
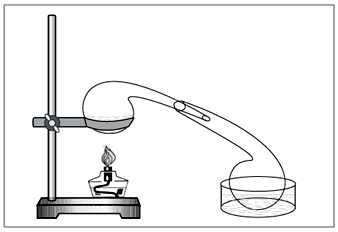
Majhna. 5. Za odstranjevanje dušikove kisline v laboratoriju
ročno izbrane vikoristovuvati staromodne kemične jedi - retorto
Metoda vzdrževanja kisline z dušikom in kislino pri temperaturah do 2000 ° C (električni lok) ni posebej razširjena.
V Rusiji je bila zgodovina odstranjevanja dušikove kisline povezana z imeni kemika-tehnologa Ivana Ivanoviča Andreeva (1880-1919).
Vin pri 1915 str. Z odprtjem prve naprave za kisanje z amoniakom in realizacijo metod razgradnje v tovarniškem obsegu leta 1917 p. Prvi gradbeni obrat v bližini Donecka.
Celotna metoda vključuje nekaj korakov.
1) Priprava izobraževalnih in družabnih dogodkov.
2) Oksidacija amiaku kisnem povitrya na platinastih cittsi:
4NH3 + 5O2 = 4NO + 6H2O.
3) Nadalje oksidirano v dušikov oksid (II) v dušikov oksid (IV):
2NO + O2 = 2NO2.
4) Določanje dušikovega (IV) oksida iz vode in vsebnosti kisline:
3NO2 + H2O = 2HNO3 + NO.
Postopek je enostavno izvesti v prisotnosti kisline, ves dušikov (IV) oksid se pretvori v dušikovo kislino.
5) Zaključki faze odstranjevanja dušikove kisline - čiščenje plinov, kot je atmosfera, iz oksida v dušik. Skladišče plinov cich: do 98% dušika, 2-5% kisline in 0,02-0,15% dušikovih oksidov. (Dušik se jemlje iz vira amoniaka, vzetega za oksidacijo amoniaka.) Če je dušikovih oksidov v teh plinih več kot 0,02 %, potem je to posebej izvedeno za njihovo katalitsko posodobitev v dušik, s čimer je malo velikih težav .
Zapisano po vseh omenjenih postih prehrane: in kaj potrebujemo kislino?
Sesanje kisline
Vchitel.Dušikova kislina nadomestna za virobrytvu: dušik dober, in na prvem mestu sol aminske kisline (kako її obsedejo?); vibuhovski govori (zakaj?); barvniki; nіtratіv, o tem, kako biti na ofenzivni ravni.
Zapiralni material
Frontalna izkušnja za razred
- Zakaj je raven oksidiranega dušika v dušikovi kislini +5 in valenca chotiri?
- Ali dušikova kislina ne vstopi v reakcijo s svetlimi kovinami?
- Morate dobiti klorovodikovo in dušikovo kislino, na mizi so tri kovine - med, aluminij in cink. Kako to misliš?
Test
1. možnost
1. Kakšno število številk je povezanih s porazdelitvijo elektronov za energijske ravni v atomu dušika?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Dokončajte praktičnost praktičnih reakcij:
1) HNO 3 (roza) + Cu ...;
2) Zn + HNO 3 (konc.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3….
3. Praviloma uvedite eno od stopenj procesa obljube dušikova kislina.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Negativni koraki oksidacije se kažejo z dušikom na dnu:
1) N2O; 2) NE; 3) NE 2; 4) Na 3 N.
5. Interakcija medenih ostružkov s koncentrirano dušikovo kislino za proizvodnjo do odobritve:
1) NE 2; 2) NE; 3) N 2; 4) NH 3.
2. možnost
1. Valenčna vrednost dušika je ena:
1) 1; 2) 2; 3) 5; 4) 4.
2. Zapišite možno interakcijo koncentrirane dušikove kisline z napredujočimi kovinami: natrijem, aluminijem, cinkom, zalizo, kromom.
3. Vibriranje govora, kot je syruvinoy za dušikovo kislino:
1) dušik in voda;
2) amіak, včasih tista voda;
3) nitrat.
4. Koncentrirana dušikova kislina ne reagira z:
1) plin ogljikov dioksid;
2) klorovodikova kislina;
3) v premogu;
4) hidroksidna palica.
5. Pri interakciji celo razredčene kisline in magnezija se je treba pretvarjati:
1) NE 2; 2) NE; 3) N20; 4) NH 4 NO 3.
Pričevanja 1. možnost. 1 – 4;
3 – 1; 4 – 4; 5 – 1. 2. možnost. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Trivneviy zalik spinner 11 razred
Tema: " KOVINE "
Obrazec lekcije: zalik
Tsil: ponovno preveriti znanje štipendij na temo: »Nekovine«; javne informacije o velike moči nekovine in spoluk; spodbujati oblikovanje znanja o nestandardnih in življenjskih situacijah, iz nadomestnih in diferenciranih podjetij.
Zavdannya:
1. Revidirati javno domeno in zapreti znanje študij o nekovinah in їkh spoluksih; vzeti razvoj z vidika zavajajoče logike in volodje kemije; prehod iz formalno-logičnega sprejemanja gradiva s strani tistih v figurativno logično sporočilo s pomočjo naprednih, izvedljivih in nestandardnih zgradb.
2. Razvinuvichki s previdnostjo, odkrivanje pomilostitev, oživljanje tovarne, vivinya, ki vidi smut, lovljenje dejstev, wowing, logično je za zlobne misli in robote; vchiti rozmіrkovuvati, robiti pripuschennya, napoved.
3. Sprejmite oblikovanje glavnih vizualnih idej s kognitivno dejavnostjo in ustvarjalno neodvisnostjo znanstvenikov.
4. Vihovuvati vmіnnya pratsyuvati samonadzor iz samonadzora. Pokažite povezave tistim, ki živijo v življenju. Vihovuvati znanstveni svitoglyad na podlagi medsebojnega povezovanja pooblastil, ki bodo budovi.
Ravnanje s temi reagenti: epruvete, alkoholne svetilke, epruvete, sirniki in raschini: ; ;
; ;
;
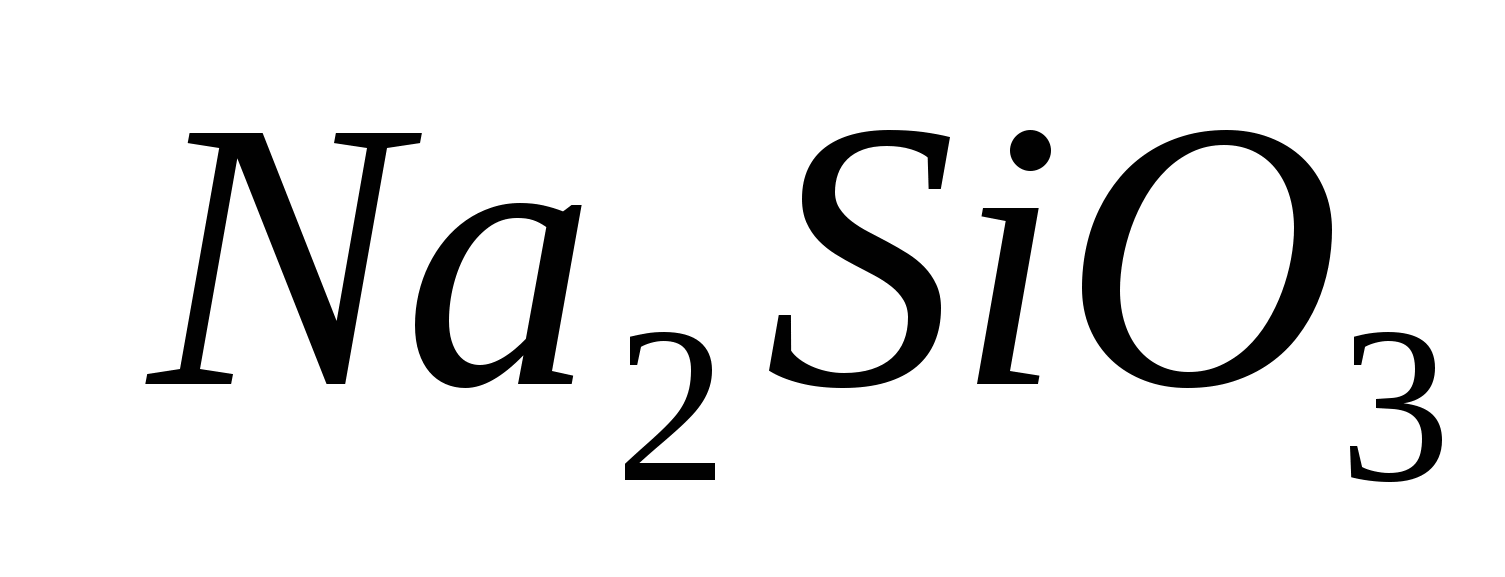 .
.
Priprava pred vhodom.
Učitelj je pripravil tri stopnje zložljivosti začetnih vrst: test, teoretična prehrana, razumevanje in razvoj besed.
Učitelj vas je pripravljen izobraževati, ker boste revidirali ekipo.
Za 1 - 2 dni se v pisarno pošlje informativni list.
List poti je viden koži. Shema robotov na stopnicah je prikazana na listih poti.
LIST POTI.
F.І. učenjak
Poimenujte korak
Urnik etap
Registrska številka
Podpis razveljavitve
Problem Rozrakhunkov
Rosp_znavannya
Reinkarnacija
Pojdi na lekcijo.
Znanstveniki vstopijo v razred z listi poti, 5 praznimi listi, s peresom in gredo na korak, vrednosti za številko 1. Znanstveniki poberejo znanje o zložljivosti in se vrnejo k novi črki, če spiš, na odru "označevanja besed".
Na robotu je kožna stopnja uvedena 7 - 8 peres, ki pretvorijo vistavlya v tračni list rivn, št.
Ocena je prikazana kot aritmetična sredina vseh stopenj.
DODATNIK
"Prepoznavanje govorov"
1 rіven
1. Prepričajte se, da je Ion čist 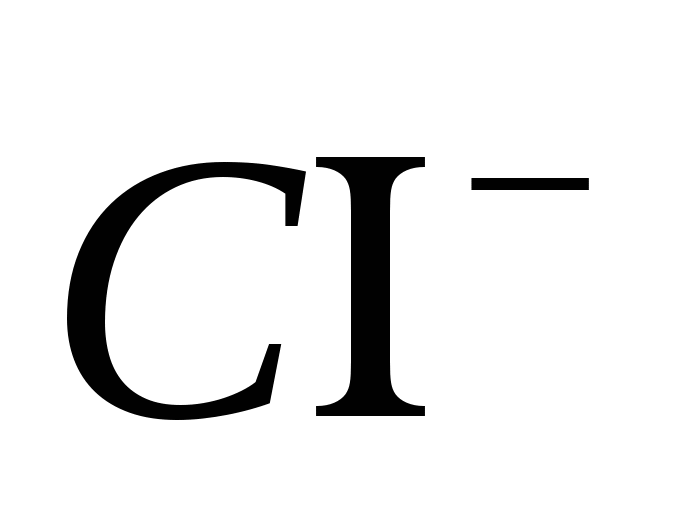
2. Prepričajte se, da je Ion čist 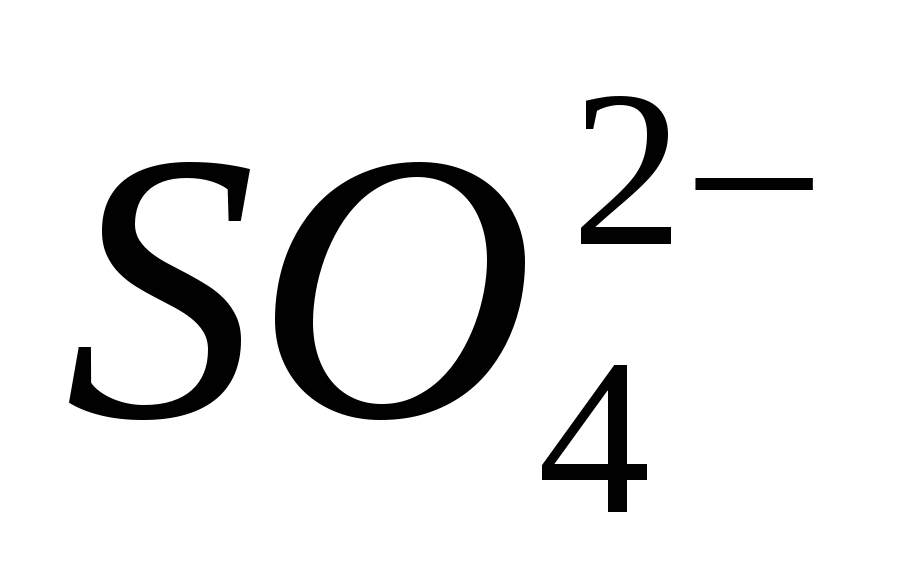
3. Prepričajte se, da je Ion čist 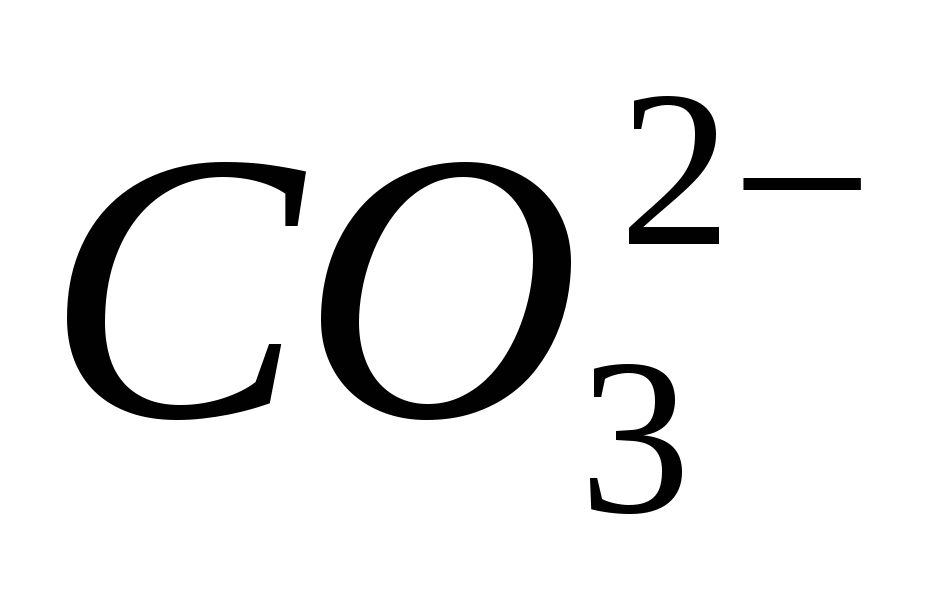
4. Pojasnite 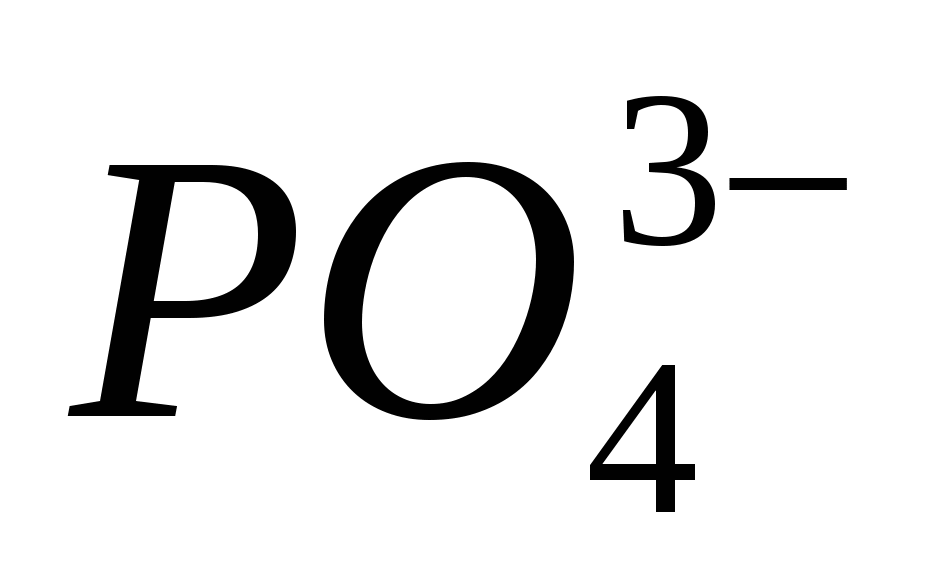
5. Prepričajte se, da je Ion čist 
2 rіven
1. Določite razlike za enim reagentom:
2. Določite razlike za enim reagentom:
3. Določite razlike za enim reagentom:
4. Določite razlike za enim reagentom: 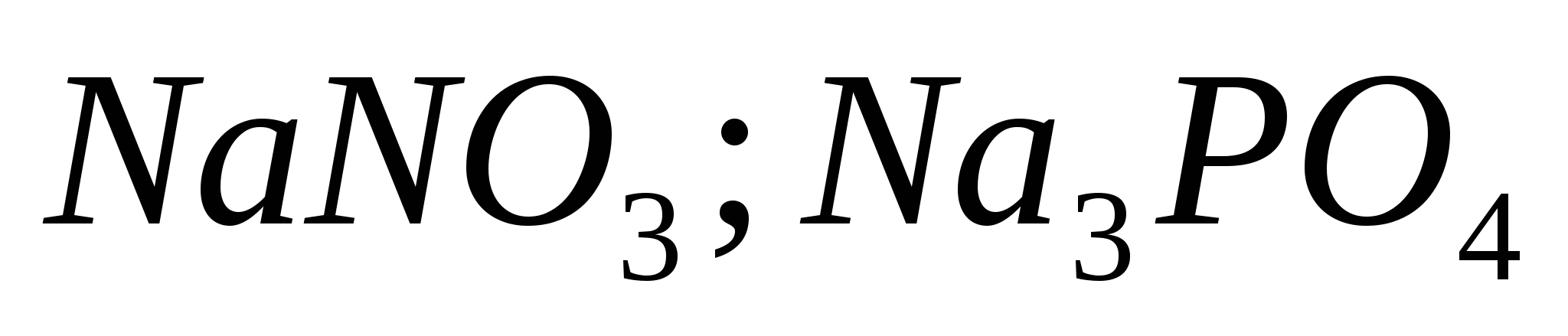 ;
;
5. Določite razlike za enim reagentom:
3 rіven
1. Zasnova brez dodatnih reagentov za odobritev:
2. Zasnova brez dodatnih reagentov za odobritev:
3. Zasnova brez dodatnih reagentov za odobritev:
4. Zasnova brez dodatnih reagentov za odobritev:
5. Zasnova brez dodatnih reagentov za odobritev:
Tapnite "Revizija govora"
1 rіven
1. Dokončajte standardne reakcije
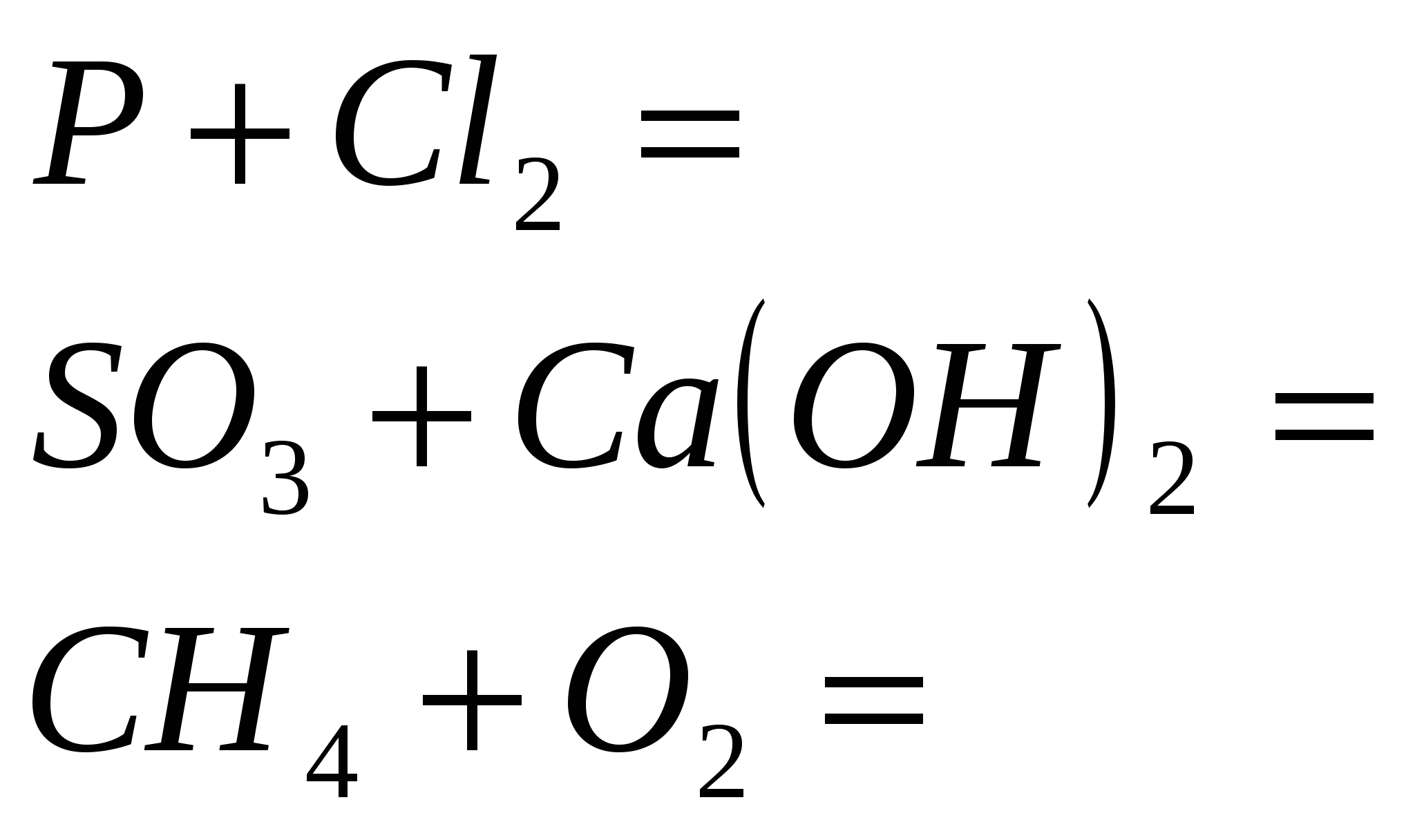
2. Za dokončanje rutinskih reakcij
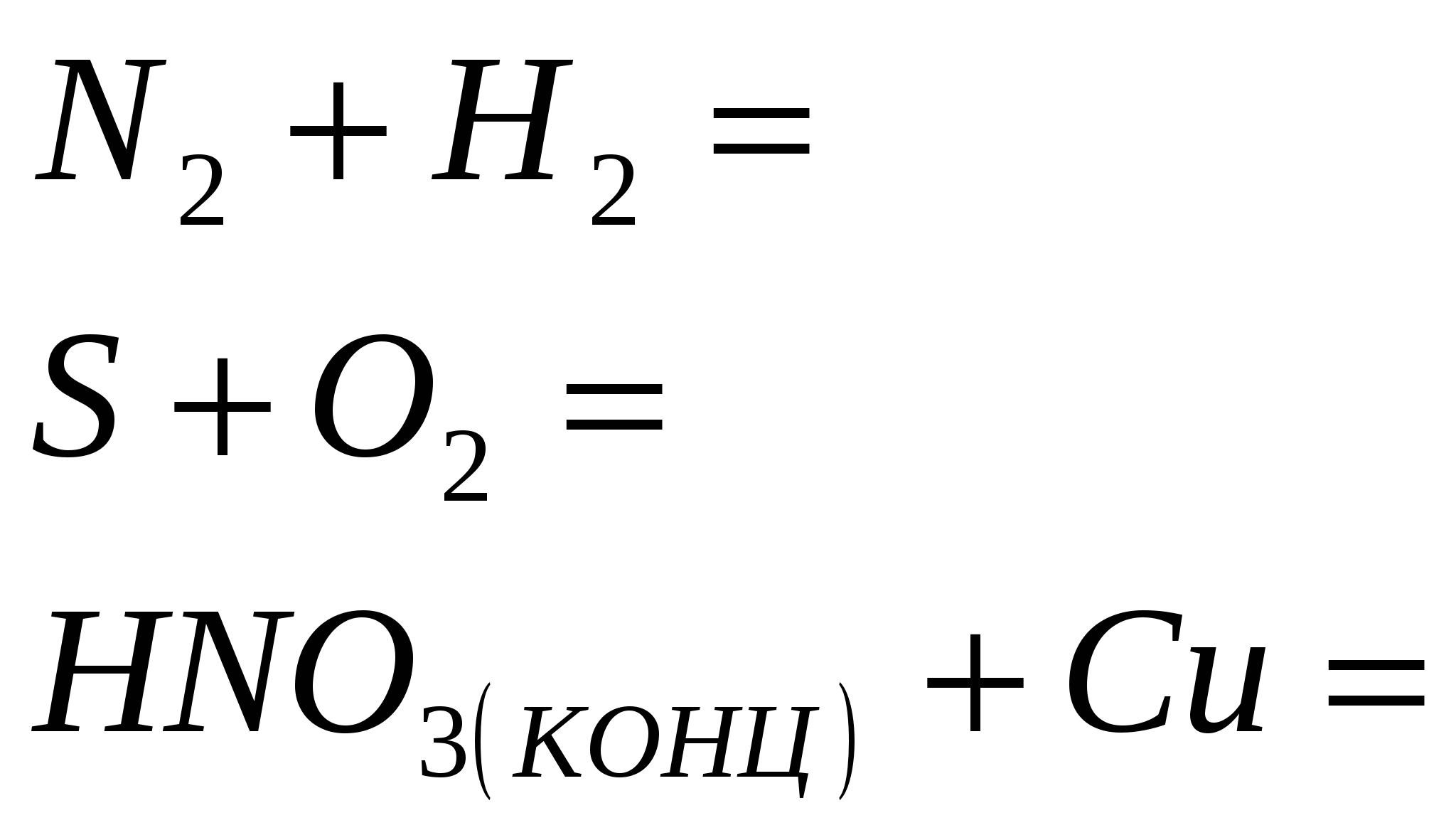
3. Dokončajte standardne reakcije
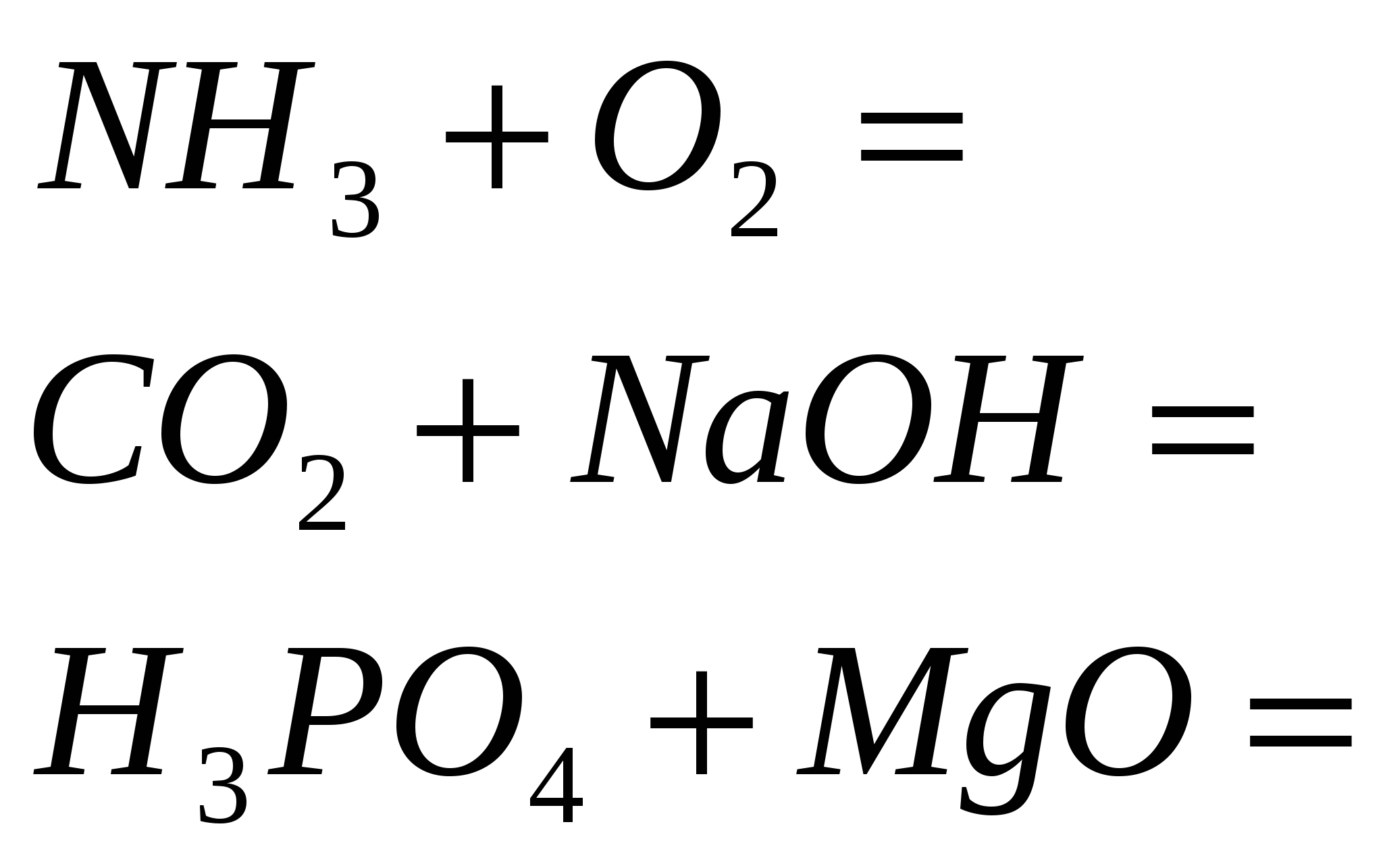
4. Dokončajte standardne reakcije
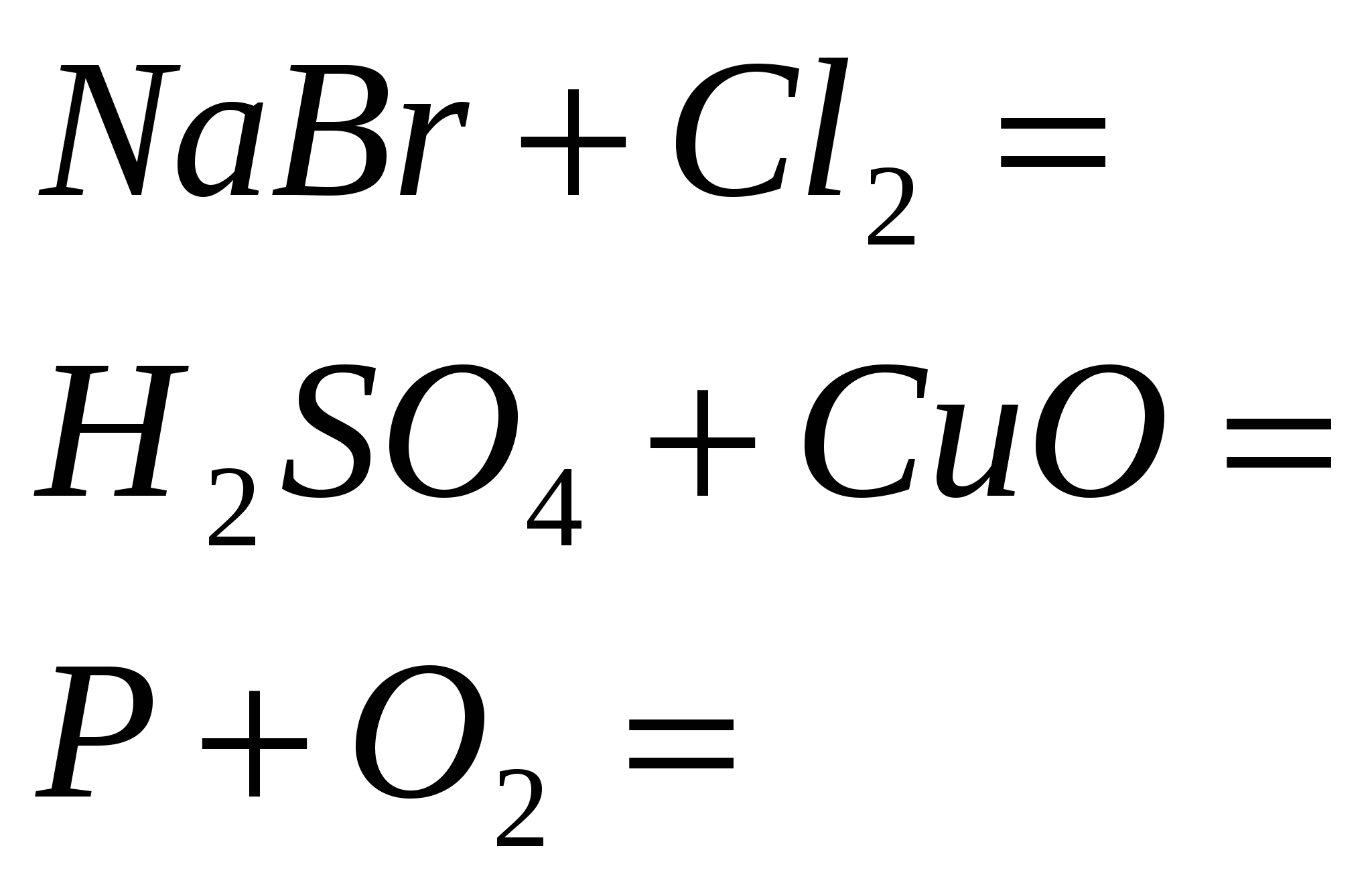
5. Dokončajte standardne reakcije
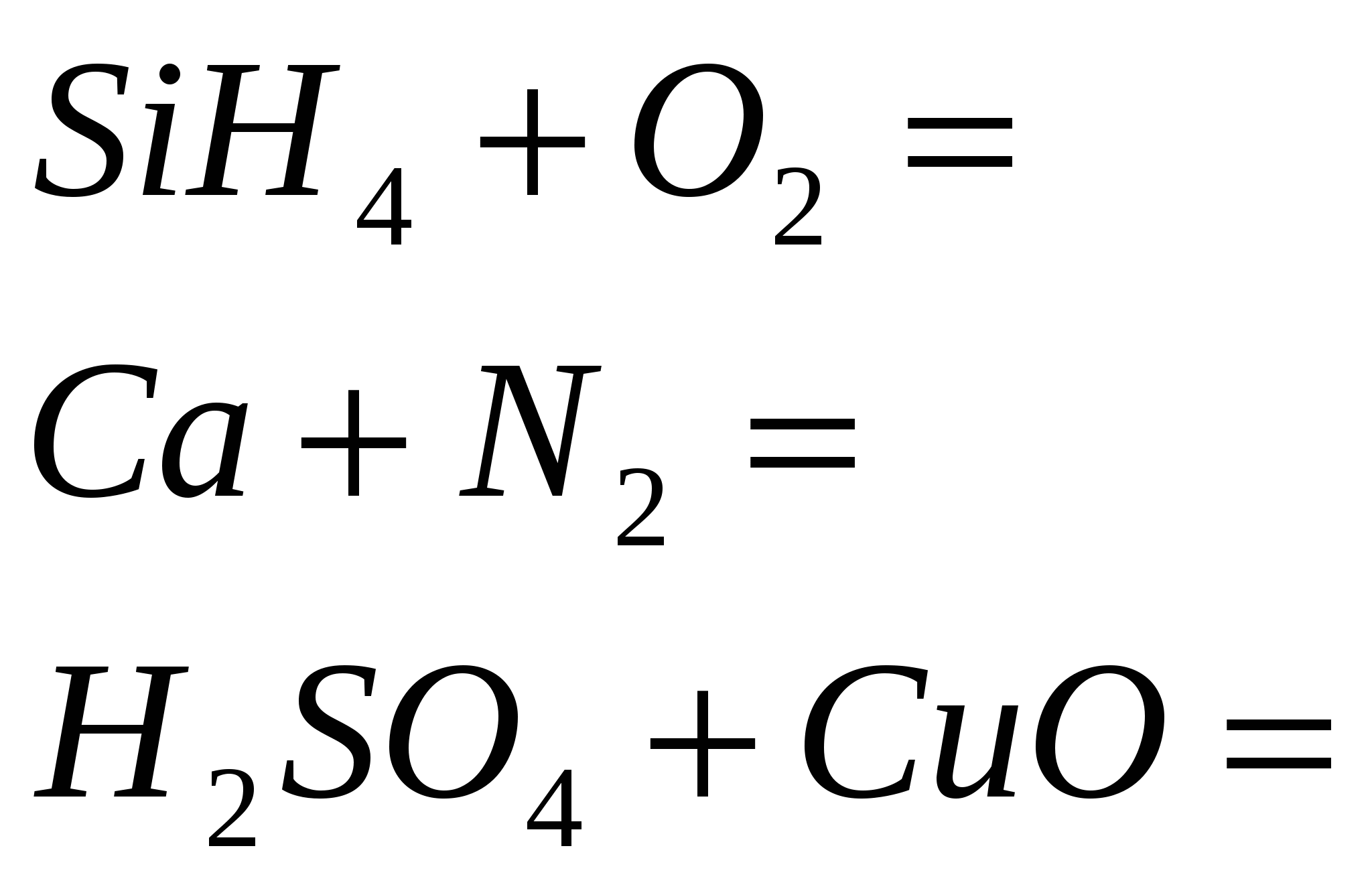
2 rіven
Zdіysnіt revizija:
3rіven
Zdіysnіt revizija:
3.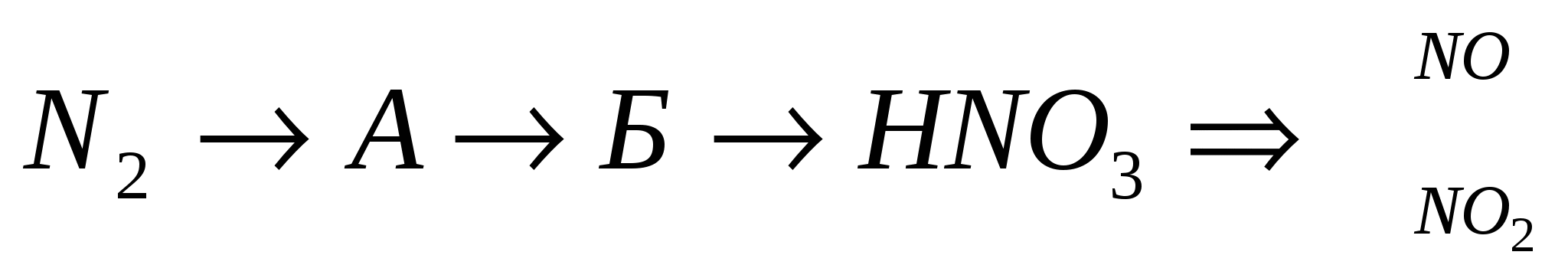
korak "Test"
1. možnost
a) O, b) S, c) Cl, d) C, e) Si.
a) 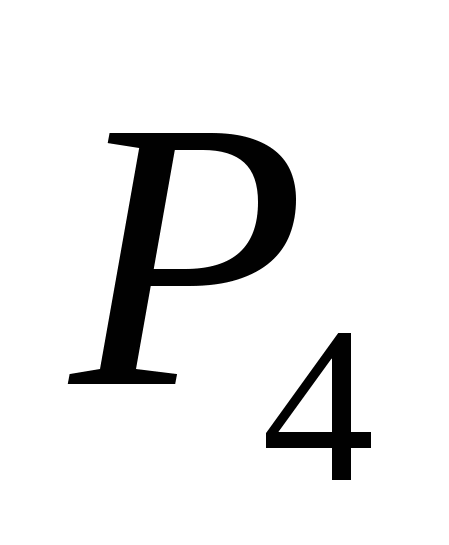 , b) C, c)
, b) C, c) 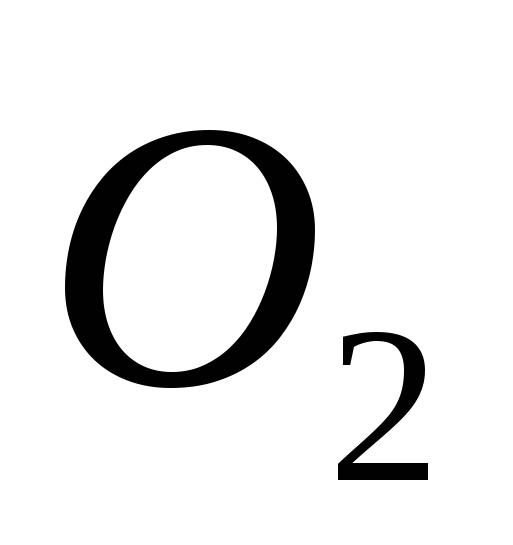 , G)
, G) 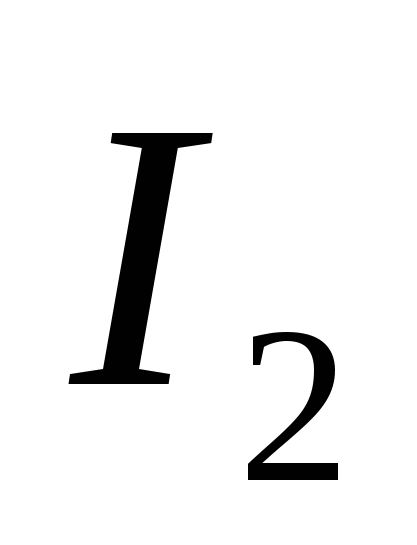 e)
e) 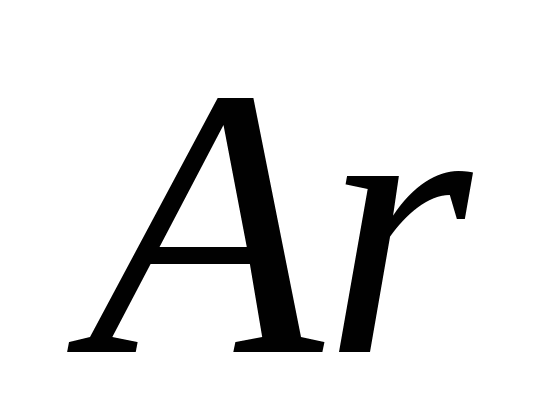 .
.
a)  , b)
, b) 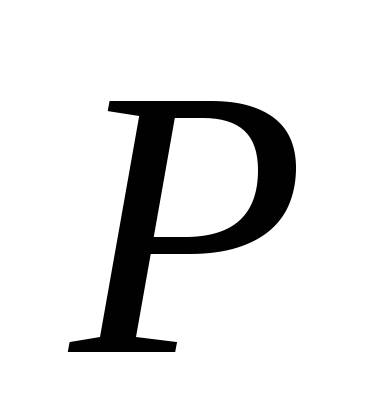 , v)
, v)  , G)
, G)  e)
e)  .
.
4. Elektronska formula elementa. Yogo flying vodna spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Rastna sila halogenovodičnih kislin v seriji:
a) ![]()
b) 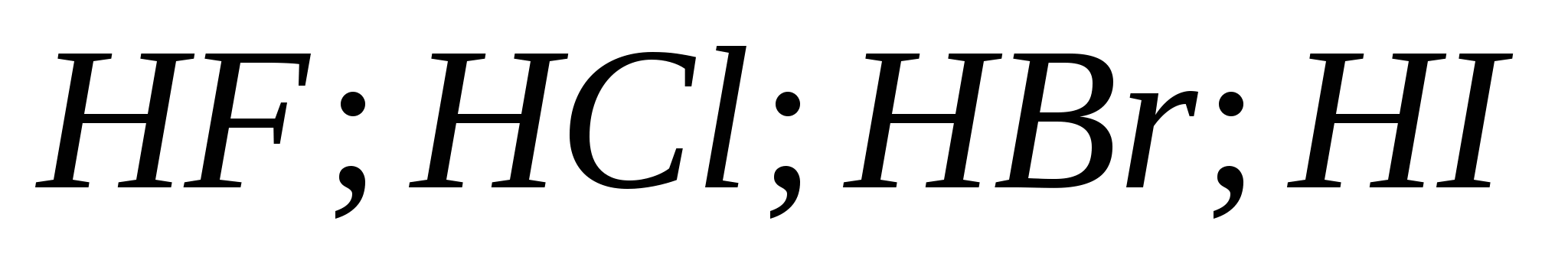
v) 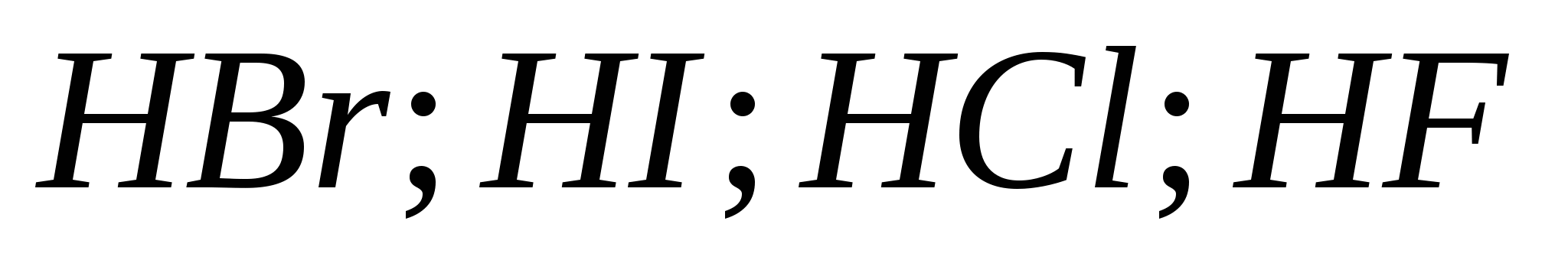
G) 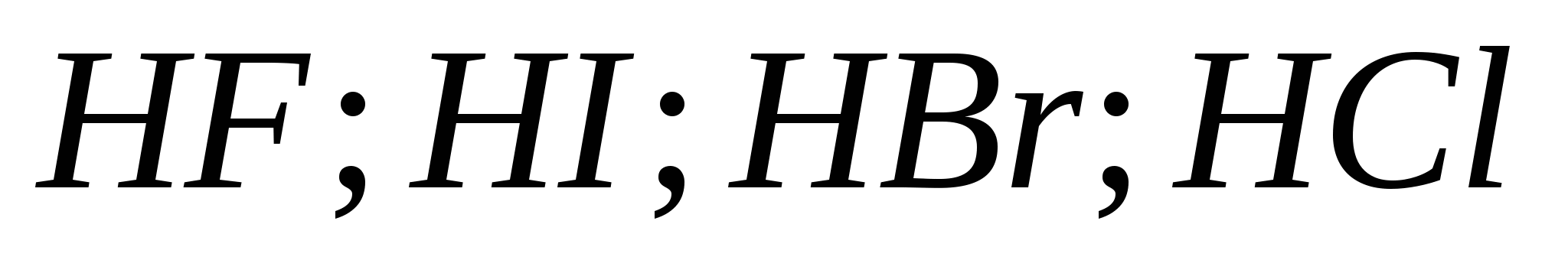
6. Od halogenov pred boyovyh diakhom se je zataknil govor:
a) fluor; b) klor; c) jod; d) brom.
7. Razredčena sirhanova kislina za oksidacijsko moč za razvoj atomov:
a)  , b)
, b)  , v)
, v)  .
.
8. Dušikov oksid V se lahko kombinira:
a) 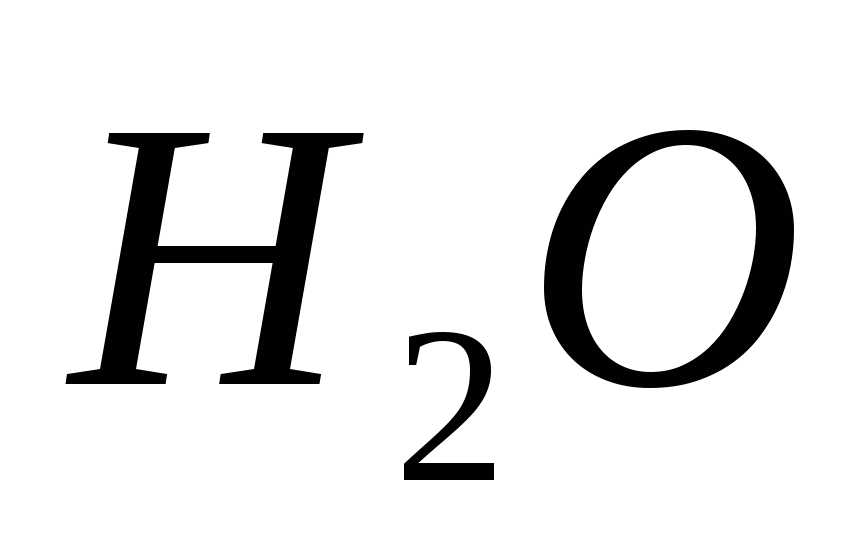 , b)
, b) 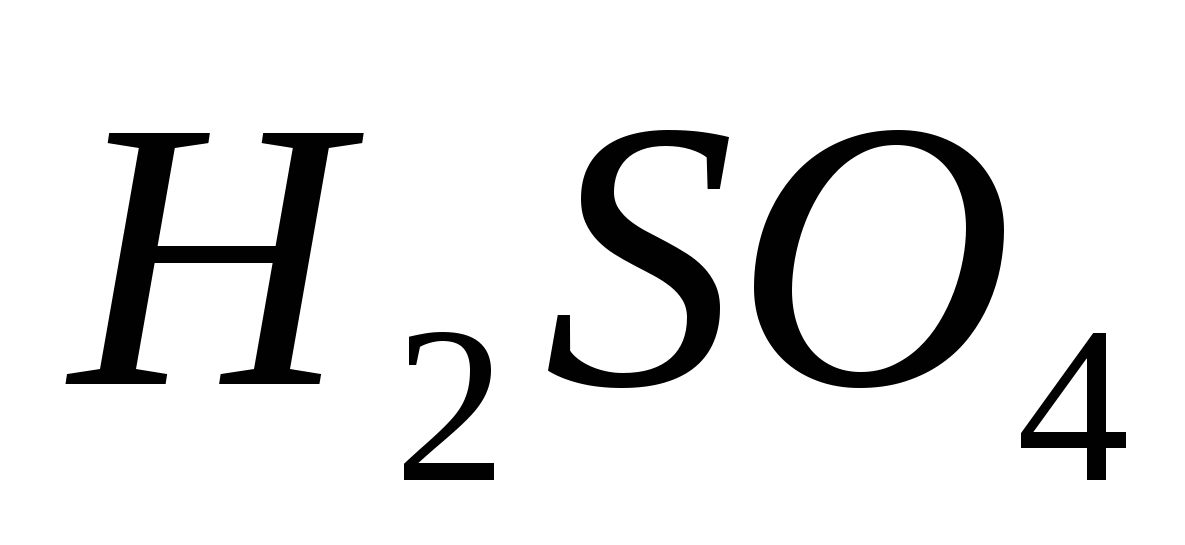 , v)
, v)  , G)
, G) 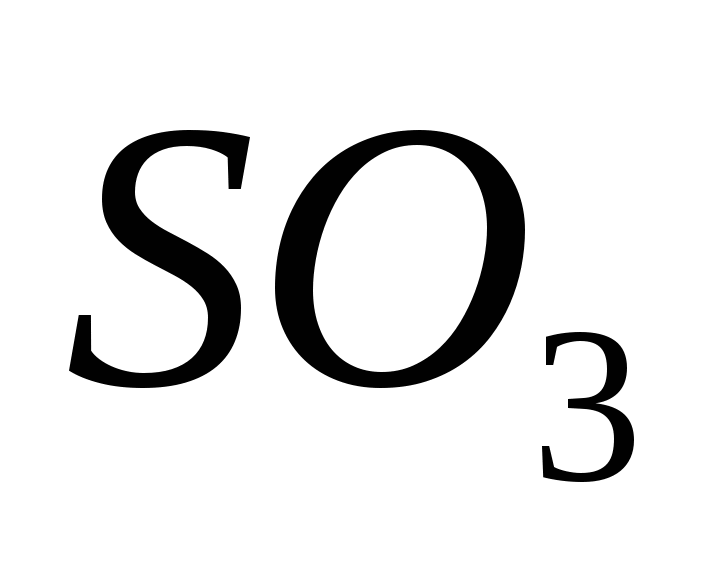 e)
e) 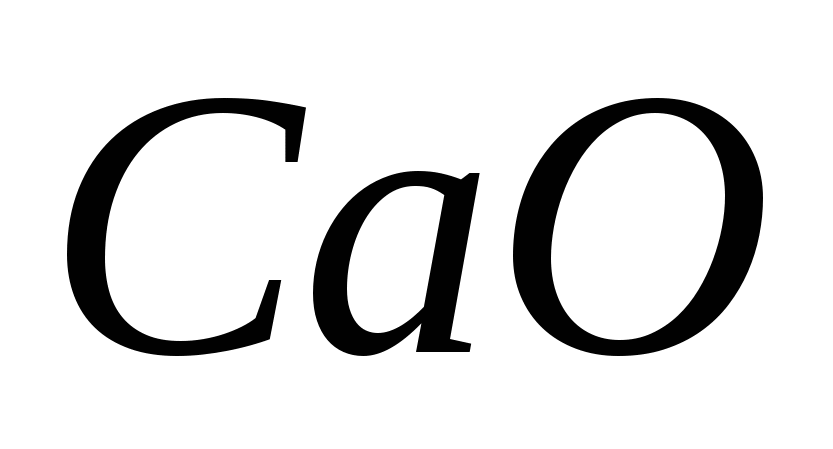 .
.
9. Odziv: pripeljati takšne oblasti v Ameriko:
a) oksidativno, b) enojna, c) kislina, d) bazična.
10. Moč kislin v vrsti
a) spremeniti, b) rasti, c) spremeniti veliko, nato spremeniti; d) kapljica padanja, odraščanja, e) nespremembe.
2. možnost
Atomske kristalne milosti so lahko preprosti govori, odobreni:
a)  , b)
, b)  , v)
, v) 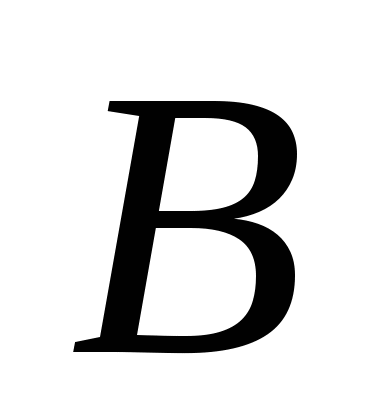 , G)
, G) 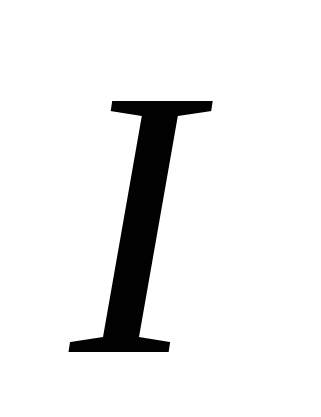 e)
e)  .
.
2. Plin za normalne misli je:
a)  , b)
, b) 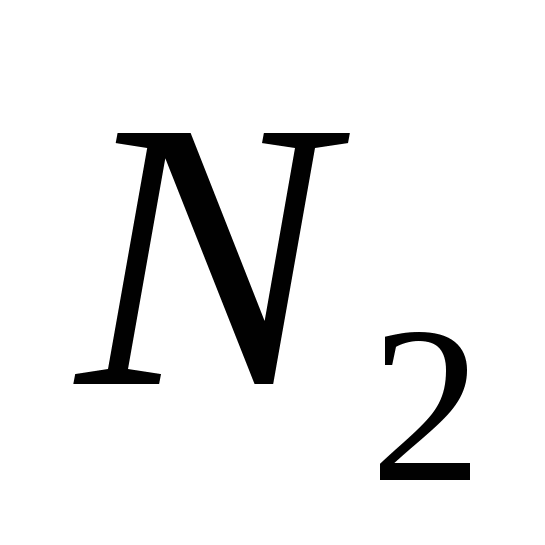 , v)
, v) 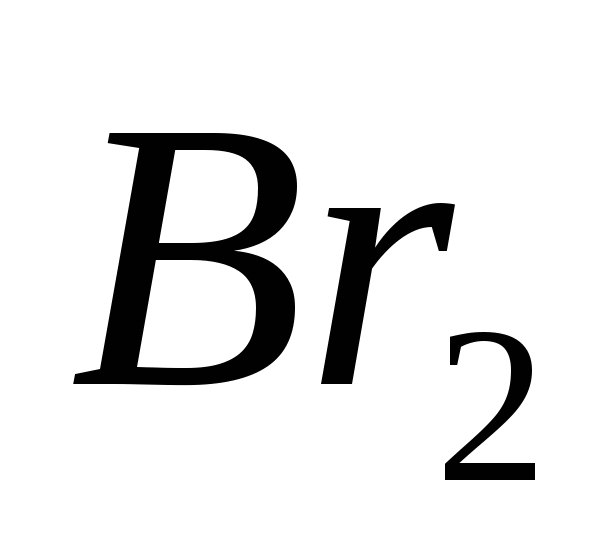 , G)
, G)  e)
e) 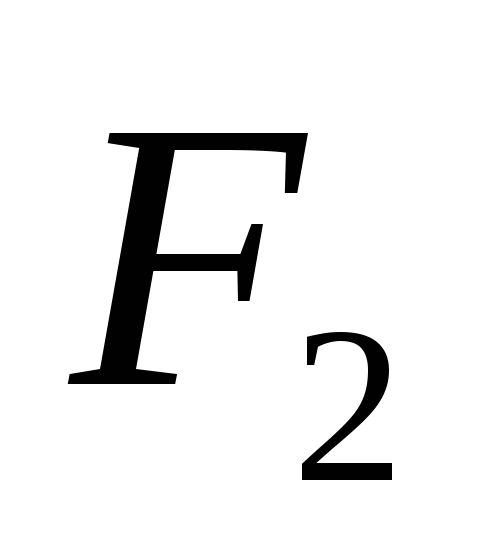 .
.
3. Alotropne modifikacije vzpostavljajo naslednje elemente:
a)  , b)
, b)  , v)
, v)  , G)
, G) 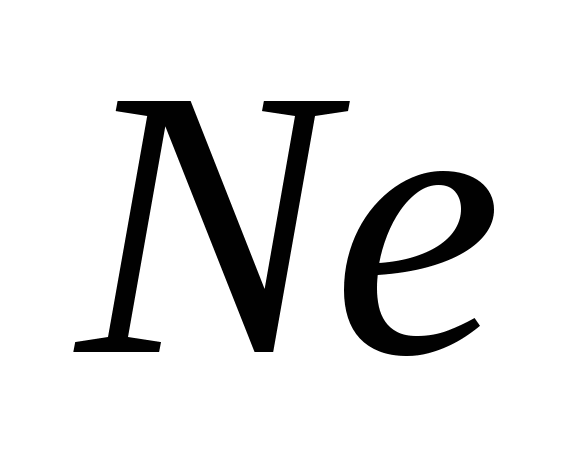 e)
e)  ,
,
4. Elektronska formula elementa. Yogo flying vodna spoluk:
a) 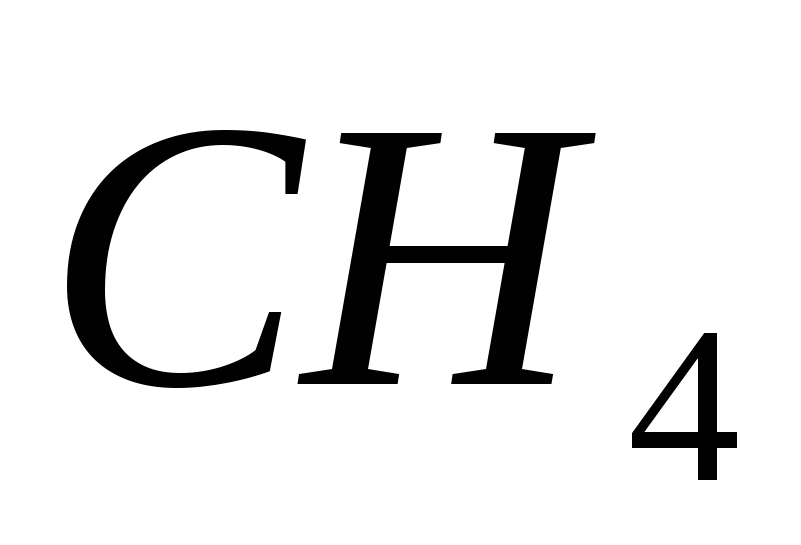 , b)
, b) 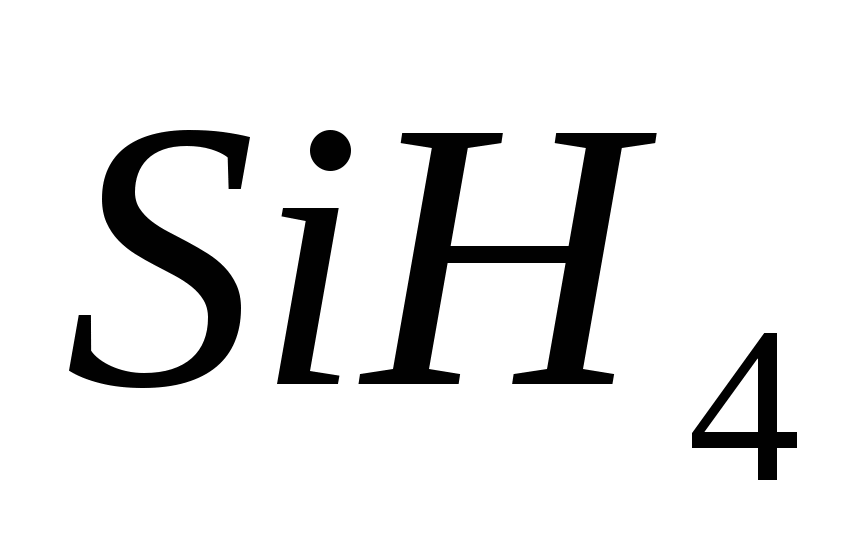 , v)
, v)  , G)
, G) 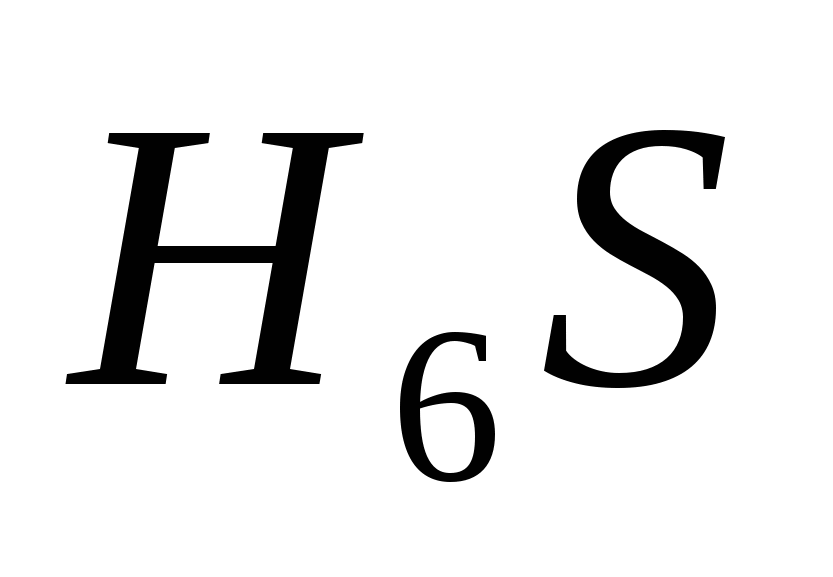 e)
e)  .
.
5. Glavna moč poletnih vodnih poti se spreminja v naslednjem vrstnem redu:
a) 
b) 
v) 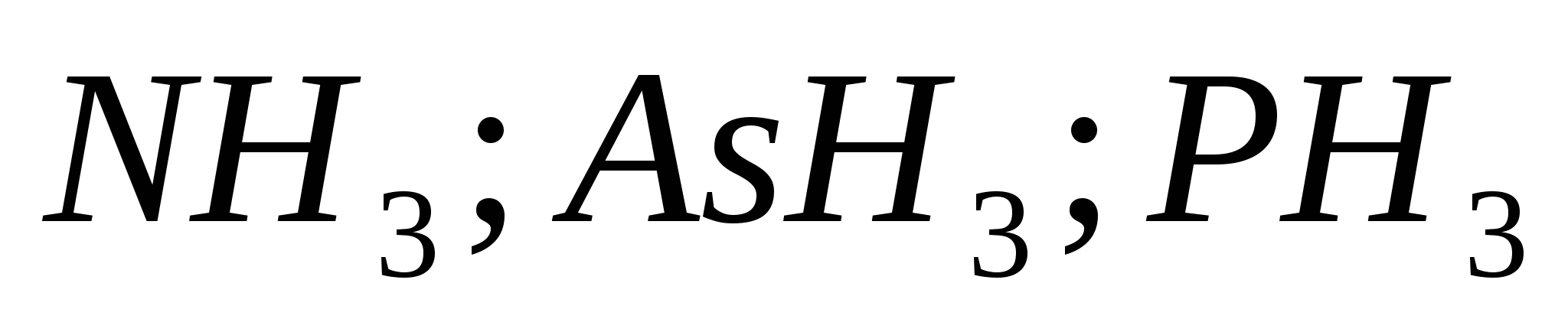
G) 
6. Za oprijem klora lahko uporabite koncentrirane raztopine:
a)  , b)
, b) 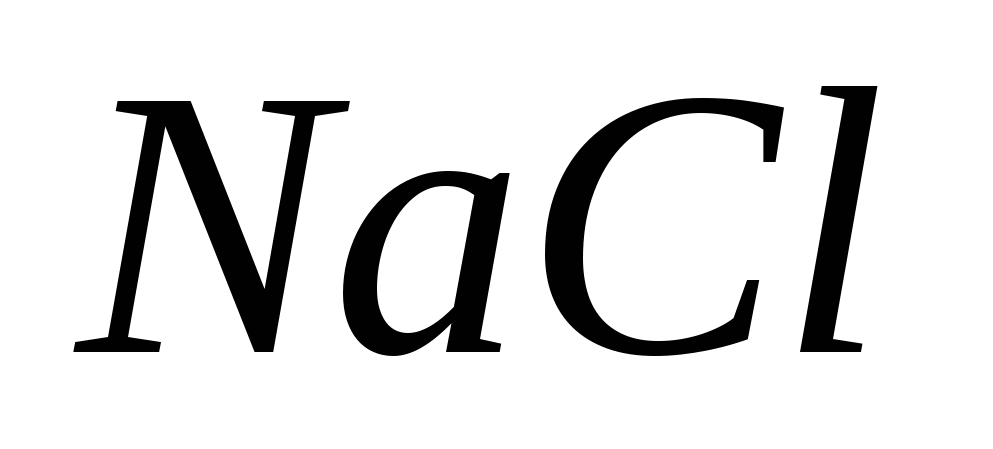 , v)
, v)  , G)
, G)  .
.
7. Koncentrirana sirchanova kislina je oksidacijska moč za rakhunok atomov:
a)  , b)
, b)  , v)
, v)  .
.
OPOMBA: 9-10 pravilnih pogledov - "5"; 7-8- "4"; 5-6- "3"; manj kot 5-2
ETAP "Teorija"
I ryven (na "3")
Zapišite tipične reakcije, da označite moč razredčene klorovodikove kisline.
Zapišite specifične reakcije, s katerimi označite moč serky oksida (VI).
Zapišite tipične reakcije, da označite moč natrijeve kisline.
Zapišite ustrezne reakcije, da označite moč fosforjevega (V) oksida.
Zapišite reakcionarne odzive, ki so značilni za moč Amerike.
II ryven (na "4")
Zapišite formule nekovinskih poletnih izvirov vode v drugem obdobju. Pojasnite, kako in zakaj pride do spremembe moči kisline.
Zapišite formule za druge nekovinske okside v tretji fazi. Pojasnite, kako in zakaj pride do spremembe moči kisline.
Zapišite formule najbolj kislih elementov v III obdobju. Pojasnite, kako in zakaj pride do spremembe moči kisline.
Zapišite formule hlapnih nekovin na vodni osnovi VI pidgroup. Pojasnite, kako in zakaj pride do spremembe moči kisline.
Zapišite formule najbolj kislih kislin elementov skupine VA pid. Pojasnite, kako in zakaj pride do spremembe moči kisline.
III stopnja (na "5")
Določite kisle in kisle lastnosti klorovodikove in dušikove kisline. Prosimo, potrdite preproste reakcije.
Določite oksidativno in kislinsko moč sivega oksida (IV) in oksida v ogljiku (IV). Prosimo, potrdite preproste reakcije.
Spremenite oksidativno in kislo moč vode in fluoridne vode. Prosimo, potrdite preproste reakcije.
Določite kislost koncentrirane in razredčene dušikove kisline. Prosimo, potrdite preproste reakcije.
Določite kislost oksida v ogljiku (II) in oksida v ogljiku (IV). Prosimo, potrdite preproste reakcije.
ETAP "Problem Rozrakhunkova"
I ryven (na "3")
II ryven (na "4")
Z interakcijo 37 g kalcijevega hidroksida z amonijevim sulfatom odstranimo 15 g amoniaka. Izračunajte masni del vhodnega amiak%.
Ko spalyuvanny v kislem 62 g fosforja, se odstrani 130 g fosforjevega (V) oksida. Izračunajte masni delež vnosa v fosforjev oksid (V)%.
Koliko gramov 10 % natrijevega hidroksida potrebujete za nevtralizacijo 8,96 litra klorove vode?
Filtre z litri v ogljikovem dioksidu lahko obrežete v 10 kg pakiranja vapnjaka in odstranite 20 % hišic.
Koliko gramov obleganja pripraviti za pretok 11,2 litra ogljikovega dioksida skozi 900 g 10-odstotnega hidroksida?
III stopnja (na "5")
Kakšen volumen 80% dušikove kisline (pl. 1,46 g / ml) je potreben za "razchinennya" 32 g medu?
Yaka masa bo potrebna za reakcijo s preveč koncentrirano dušikovo kislino za odstranitev 4 l (n.u.) dušikovega (IV) oksida;
Ko se "razbije" v koncentraciji klorovodikove kisline, 20 g zlitine zlate s 4,2 l (n.u.) sivog oksida (IV). Visnite masni delež v % zlitine.
Vsoto plina v kloru in prostornine 1 l smo spustili skozi raztopino kalcijevega jodida. V tsomu sem videl 5,08 r joda. Poiščite delež (%) klorovega plina v zlobni vsoti.
Količino silicija in vugile z maso 10 g smo prelili na preveč koncentriran obseg natrijevega hidroksida. Kot rezultat reakcije smo videli 5,6 litra vode (n.o.). Visnite masni delež silicija (%) pri tsіy sumіshі.
