Pri povezovanju 28 g silicija s kisikom. Silicijeve kisikove spojine
Glavna razlika od ogljika: odsotnost p vezav v spojinah, silicidi, spojine z vodikom (silani), oksidacija in hidroliza, tetrafluorid in silicijev tetraklorid, hidroliza, heksafluorosilikati, kisikove spojine, silicijev oksid, silikagel. Silikati, topnost in hidroliza, naravni silikati in aluminosilikati, zeoliti, organske silicijeve spojine, silikoni in siloksani, uporaba silicijevih spojin v medicini.
Silicij (lat. Silicium), Si, kemični element skupine IV periodičnega sistema; atomsko število 14, atomska masa 28.086. Silicon tudi sp3 hibridizacijo elektronskih
orbitale. Na zunanji elektronski plasti silicijevega atoma je valenca 3d-
orbitale (Si: 3s23p23d0),
Silicij po kisiku je najpogostejši element v skorji. Za razliko od ogljika v prostem stanju, silicija ni v naravi. Najpogostejše spojine so silicijev oksid (IV) SiO2 in soli silicijeve kisline, silikati. Oblikujejo lupino zemeljske skorje. Silicijeve spojine najdemo v rastlinah in živalih. Po kemijskih lastnostih je silicij, kot ogljik, nekovinski, vendar je njegova nekovinska sestava manj izrazita, saj ima večji atomski polmer.
Silicij. tvori spojine s skoraj vsemi kovinami - z icicidi (ni bilo najdenih spojin samo z Bi, Tl, Pb, Hg). Dobili smo več kot 250 silicidov, katerih sestava (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si itd.) Običajno ne ustreza klasičnim valencam. Silikidi se razlikujejo v refraktornosti in trdoti; Največji praktični pomen imajo ferosilicij (redukcijsko sredstvo pri taljenju posebnih zlitin, glej Ferroalloys) in molibdenov silicid MoSi2 (grelci električnih peči, lopatice plinskih turbin itd.).
Silane Pod delovanjem klorovodikove kisline na silicide je najpreprostejša vodikova spojina silicija silan SiH4:
Silan je strupen plin z neprijetnim vonjem, ki se spontano vname. zraku
So reaktivni in so močni reducenti.
reagirajo z vodo pri sobni temperaturi:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluorid Silicij nastane s fluoriranjem silicijevega dioksida z elementarnim fluorom.
Proces fluoriranja se izvaja v dveh fazah v plamenskem reaktorju, ki usmerja presežek elementarnega fluora iz prve faze v 2. stopnjo.
Tehnični rezultat je proizvodnja silicija v neprekinjenem načinu z visokim izkoristkom in kakovostjo izdelkov.
Silicijev tetrafluorid SiF4 nastane zaradi delovanja fluoridne (fluoridne) kisline na steklu:
Na2Si03 + 6HF2NaF + SiF4 + 3H2O
Silicijeve kisikove spojine
Najpomembnejša kisikova spojina silicija je silicijev dioksid SiO2 (silicijev dioksid), ki ima več kristalnih modifikacij.
Sprememba pri nizkih temperaturah (do 1143 K) se imenuje kvarc. Kvarc ima piezoelektrične lastnosti. Naravne sorte kremena: rock kristal, topaz, ametist. Sorte silicijevega dioksida so kalcedon, opal, ahat. jaspis, pesek.
Kremen je kemično odporen; prizadenejo ga le raztopine fluora, fluorovodikove kisline in alkalije. Lahko gre v stekleno stanje (kremenovo steklo). Kremenovo steklo je krhko, zelo kemično in toplotno odporno. Ustrezna silikonska kislina SiO2 nima posebne sestave. Značilno je, da je silicijeva kislina zapisana kot xH2O-ySiO2. Izbrane so bile silicijeve kisline: H2SiO3 (H2O-SiO2) - meta-silicij (tri-okso-silikon), H4Si04 (2H20-Si02) - orto-silicij (tetra-okso-silikon), H2Si2O5 (H2O * SiO2) - dimetični silicij.
Silikatne kisline so slabo topne snovi. V skladu z manjšo metaloidno naravo silicija v primerjavi z ogljikom je H2SiO3 kot elektrolit šibkejši kot H2CO3.
Silikati v vodi v silikatnih kislinah so netopni (razen silikatov alkalijskih kovin). Topne silikate hidroliziramo z enačbo
2SiO3 - + H20 = Si2O52- + 20H-.
Koncentrirane raztopine topnih silikatov se imenujejo tekoče steklo. Običajni stekleni silikat iz natrijevega in kalcijevega stekla je sestavljen iz Na20-CaO-6Si02. Dobimo ga z reakcijo
Znana je široka paleta silikatov (natančneje oksosilikatov). V strukturi oksosilikatov opazimo določeno pravilnost: vse so sestavljene iz tetraedrov Si04, ki so med seboj povezane preko kisikovega atoma. Najpogostejše kombinacije tetraedrov so (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), ki se lahko kot strukturne enote združijo v verige, trakove, mreže in okostja (slika 4).
Najpomembnejši naravni silikati so npr. Smukec (3MgO * H20-4Si02) in azbest (SmgO * H2O * SiO2). Kot pri Si02 je za silikate značilno steklasto (amorfno) stanje. S kontrolirano kristalizacijo stekla je možno pridobiti finokristalno stanje (sitale). Sitalli so označeni z večjo močjo.
Poleg silikatov so aluminosilikati v naravi zelo razširjeni. Aluminosilikati - okvirni oksosilikati, pri katerih je del silicijevih atomov nadomeščen s trivalentnim Al; npr. Na12 [(Si, Al) 04] 12.
Za silicijevo kislino je značilno koloidno stanje, kadar soli kisline H2SiO3 niso takoj prizadete. Koloidne raztopine silicijeve kisline (solov) pod določenimi pogoji (npr. Pri segrevanju) lahko pretvorimo v transparenten, homogen gel-podoben masni gel iz silicijeve kisline. Geli so visoko-molekularne spojine s prostorsko, zelo ohlapno strukturo, ki jo tvorijo molekule SiO2, katerih praznine so napolnjene z molekulami H2O. Pri dehidriranju silikagela dobimo silikagel - porozni produkt z visoko adsorpcijsko zmogljivostjo.
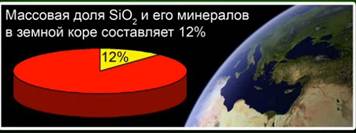
Silicijev oksid (IV) (silicijev dioksid) - najpogostejša spojina v zemeljski skorji, ki predstavlja 12% svoje mase v obliki različnih mineralov. Razlikovati med kristaliničnim in amorfnim silicijevim dioksidom. Najenostavnejša formula za silicijev oksid (IV) je SiO2. Kristalizira se v atomski rešetki.
1) Kristalni silicijev dioksid - v obliki minerala kvarca in njegovih sort (kamniti kristali, kalcedona, ahat, jaspis, kremen); kremen oblikuje osnovo kremenovega peska, ki se pogosto uporablja v gradbeništvu in v silikatni industriji.
2) amorfni silicijev dioksid - v obliki opalnega mineralnega sestavka SiO2 nH2O; zemeljske oblike amorfnega silicijevega dioksida so diatomit, Tripoli (infuzorijska zemlja); Primer umetnega amorfnega brezvodnega silicijevega dioksida je silikagel, ki ga dobimo iz natrijevega metasilikata:
Na2Si03 + 2HCl = 2NaCl + H2SiO3
Silikagel ima razvito površino, zato dobro vpija vlago.
Silikagel je posušen gel, ki se tvori iz prenasičenih raztopin silicijeve kisline (nSiO2 · mH2O) pri pH\u003e 5-6. Trdni hidrofilni sorbent.
Pridobivanje
Dobimo ga s nakisanjem raztopin alkalijskih silikata, čemur sledi izpiranje in sušenje nastalega gela:
Silicic acid. SiO2 je anhidrid številnih silicijevih kislin
Silikatna kislina je zgrajena iz tetraedričnih strukturnih enot (v vsaki taki enoti je atom silicija v središču tetraedra, kisikovi atomi pa so na vrhu). Strukturne povezave, ki se združujejo v verige, tvorijo bolj stabilne polisilicijeve kisline:
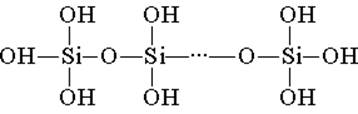
Sestavo take spojine lahko izrazimo s formulo (H2SiO3) n. Silikatno kislino navadno predstavlja formula H2SiO3. H2SiO3 - kislina je zelo šibka, malo topna v vodi. Pri segrevanju se zlahka razgradi na enak način kot ogljikova kislina:
Vse silicijeve kisline so zelo šibke (šibkejše od premoga).
Silikati. Soli vseh silicijevih kislin se imenujejo silikati, čeprav praviloma v izobraževalni literaturi silikati pomenijo soli metacilne kisline. Njihova sestava je navadno predstavljena s formulo v obliki spojin oksidov elementov. Na primer, kalcijev silikat CaSiO3 lahko izrazimo kot: CaO x Si02.
Silikati v sestavi R2O × nSiO2, kjer je R2O natrijev ali kalijev oksid, se imenujejo topno steklo, njihove koncentrirane vodne raztopine pa se imenujejo tekoče steklo. Najpomembnejše je natrijevo topno steklo.
Ko stojijo na zraku, raztopine silikatov postanejo motne, ker ogljikov dioksid (IV) v zraku iz nje izloča silicijevo kislino:
Silikatna kislina je praktično netopna v vodi - ta lastnost se uporablja kot kvalitativna reakcija na ion SiO32-.
Silikati se pridobijo s taljenjem kremena z alkalijami ali karbonati: \\ t
Topnost silicijeve kisline hitrost raztapljanja pa je odvisna od več dejavnikov, od katerih je najpomembnejša modifikacija prevzetega silicijevega dioksida, njegova stopnja disperzije in temperatura. Pri stresanju silikagela z vodo se ravnovesje topnosti vzpostavi v nekaj urah, v primeru kvarca pa je potrebnih več mesecev in celo let.
NARAVNI SILIKATI (iz latinščine. silex, rod. silicis - kremen * a. naravni silikati; N. naturliche Silikate; naravi silikatov; silikatos naturales) - razred mineralov, soli silicijeve, izo- in heteropolikarminske kisline. Delež naravnih silikatov predstavlja do 75% mase zemeljske skorje in približno 25% mineralnih vrst. V naravi je znanih več kot 700 naravnih silikatov, vključno z najpomembnejšimi minerali, ki tvorijo kamen (feldspati, pirokseni, amfiboli, stožci itd.)
Aluminosilikati - skupina naravnih in sintetičnih silikatov, katerih kompleksni anioni vsebujejo silicij in aluminij. Primeri kompleksnih anionov: -, -, 2 -. Na +, K +, Mg2 +, Ca2 + in včasih Ba2 + in Li + delujejo kot kationi.
Naravni aluminosilikati so najpogostejši minerali, ki predstavljajo do 50% mase zemeljske skorje. Mednje spadajo glinenice (albit, ortoklaz, anortit), glinasti minerali in sljuda.
Zeoliti - To so vodni aluminosilikati kalcija, natrija, kalija, barija in nekaterih drugih elementov. Skupina zeolitov vključuje več kot štirideset mineralov, ki se razlikujejo po sestavi (zlasti po številu vodnih molekul v kristaliničnem hidratu) in seveda v fizikalnih in kemijskih lastnostih. Toda skoraj vsi predstavniki te skupine mineralov imajo skupno značilnost - so dobri sorbenti, imajo lastnosti ionske izmenjave, lahko spremenijo mobilnost posameznih ionov in delujejo kot molekularna sita. Razmeroma pred kratkim so ti minerali ugotovili popolnoma nepričakovano uporabo - začeli so se uporabljati v kmetijstvu.
Organosilicijeve spojine - spojine, v katerih molekule je vez med atomi silicija in ogljika. Organosilicijeve spojine se včasih imenujejo silikoni, od latinskega silicijskega imena "silicij". Organosilicijeve spojine se uporabljajo za proizvodnjo maziv, polimerov, gume, gume, silikonskih tekočin in emulzij. Organosilicijeve spojine se uporabljajo v kozmetiki, gospodinjskih kemikalijah, barvah in lakih, detergentih. Značilnost proizvodov, ki temeljijo na organosilicijevih spojinah, iz izdelkov na osnovi skupnih organskih spojin so praviloma višje karakteristike in lastnosti delovanja ter varnost človeške uporabe. Silikonski polimeri se lahko uporabljajo za izdelavo kalupov pri kuhanju. Polimerizacija organosilicijevih spojin in tesnil je varna za ljudi in ne zahteva ekstrakcije.
Siloksani - spojine, ki vsebujejo izmenične silicijeve in kisikove atome v molekuli. Najvišji imajo siloksane z visoko molekulsko maso - poliorganosiloksani; glej Silikonski polimeri.
Silikoni (poliorganosiloksani) - oksigenirane organosilicijeve spojine z visoko molekulsko maso s kemijsko formulo n, kjer je R = organska skupina (metil, etil ali fenil). Zdaj je ta definicija zelo redko upoštevana, in poliorganosiloksani (npr. Silikonska olja PMS tipa, vodoodbojna sredstva tipa NGL ali SKTN gume z nizko molekulsko maso) in celo organosilicijevi monomeri (različni silani) so prav tako združeni v "silikone", pri čemer se razlika med silikoni in silikon. "
Kovinski silicij  Kristalni silicij
Kristalni silicij
Silicij (Si). Ta kemični element je 1/4 sestave zemeljske skorje. Quartz, rock kristal, pesek, glina, granit, sljuda, azbest - vse to kemične spojine silicija
Silicij je vmesni element (amfoterni) in ima lahko kovinske in nekovinske lastnosti. Lahko tvorijo kemične spojine, tako s kovinami kot z nekovinami.
Čisti silicij - kemično preprosta siva siva barva, trda, ognjevzdržna in krhka. Kristalni silicij Ima kovinski lesk in se pogosto uporablja v polprevodniški industriji (je polprevodnik).
Silicij se lahko raztegne kot v kristalnem stanju ( kristalni silicij) in v amorfnem stanju ( amorfni silicij). Kristalni silicij nastane s hlajenjem raztopine amorfnega silicija v staljeni kovini. Po drugi strani je kristalni silicij zelo krhek material in ga zlahka zdrobimo v amorfni prah. Tako amorfni silicij je fragment kristalov kristalnega silicija.
V prostem stanju je silicija težko pridobiti. Njegova industrijska proizvodnja je povezana z obnavljanjem kremena, katerega kemijska formula je SiO2, reakcija redukcije pa nastane v vročem koksu (ogljik).
SiO2 + C → CO 2 + Si
V laboratoriju se čisti silicij reducira iz kremenčevega peska s kovinskim magnezijem z naslednjo reakcijo:
SiO2 + 2Mg → Si + 2MgO.
Med to reakcijo nastane rjavi prah amorfnega silicija. Po segrevanju lahko prah počasi reagira s koncentriranimi raztopinami alkalij (npr. Natrijev hidroksid NaOH).
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - nastala kompleksna snov - imenovana tudi tekoče steklo.
Zanimivo je, da je kemijska aktivnost silicija odvisna od velikosti njegovih kristalov. Kokristalni silicij je manj kemično aktiven kot amorfni. Slednji se preprosto odzove s fluorom tudi pri običajni temperaturi in pri temperaturi 400 - 600 ° C reagira s kisikom, klorom, bromom, žveplom in oblikuje ustrezne kemične spojine. Pri zelo visokih temperaturah silicij reagira z dušikom in ogljikom, tako da tvori nitrid in silicijev karbid.
Če poskušate raztopiti silicij v mešanici fluoridnih HF (fluoridnih) in dušikovih HNO 3 kislin, potem reakcija ne bo nadaljevala. Če pa izvedemo kemično reakcijo z alkalijo, na primer s kalijevim hidroksidom, bo reakcija potekala z nastajanjem soli silicijeve kisline.
Si + KOH → K 2 SiO 3 + H 2
Če žarimo v kremenu peči (pesek) s koksom, se izkaže zelo trdna kristalinična snov. Karborund SiC
Si02 + 3C → SiC + 2CO
Karborund - zelo trda in ognjevzdržna snov. V industriji se zaradi teh lastnosti proizvaja v velikih količinah. Zanimivo je, da je karborundska kristalna rešetka podobna rešetki najtežje snovi - diamant, v njej pa so posamezni atomi ogljika enakomerno nadomeščeni z atomi silicija.
Pri visokih temperaturah, kot tudi med kemičnimi reakcijami pod vplivom kislin na spojine kovin s silicijem, silan SiH 4.
Silane - je samovžigni brezbarvni plin. Lahko se vžge v zraku, da tvori kremen in vodo.
SiH4 + 20 2\u003e → Si02 + 2H2O
Če se silicijev oksid SiO2 segreje v prisotnosti ogljika v toku klora, pride do kemične reakcije z nastajanjem silicijevega klorida.
Si02 + 2C + 2Cl2 → SiCl4 + 2CO
Silicijev klorid - je tekočina, katere vrelišče je le 54 0 C. Silicijev klorid se z lahkoto raztopi v vodi z nastankom raztopine dveh kislin: silicijeve in klorovodikove.
SiCl4 + H20 → H2Si03 + HCl
Če se ta kemijska reakcija odvija v atmosferi vlažnega zraka, se pri nastajanju dveh kislin pojavi debel dim.
Silicijev fluorid SiF 4 - nastane kot posledica kemijske reakcije fluorovodikove kisline in silicijevega oksida
Si02 + 4HF → SiF4 + 2H2O
Silicijev fluorid je brezbarvni plin z "močnim" vonjem. Poleg silicijevega klorida v vodi ta plin tvori dve kislini: silicij in fluorovodik. Zanimivo pa je, da silicijev fluorid lahko nastane v interakciji s fluorovodikovo kislino heksafluorosilična kislina katerih kemična formula je H 2 SiF 6. Njegove soli in sama kislina so strupene.
Silicij
Navadne kovine in nekovine
V tej lekciji boste preučili temo "Silicon". Razmislite o informacijah o siliciju: njena elektronska struktura, kjer je silicij v naravi, preučuje alotropijo silicija, razloži njene fizikalne in kemijske lastnosti. Naučite se, kje se silicij uporablja v industriji in na drugih področjih, kako se proizvaja. Spoznali boste silicijev dioksid, silicijevo kislino in njene soli - silikate.
Vsebina: Navadne kovine in nekovine
Lekcija: silicij. Plemeniti plini
Silicij je eden najpogostejših kemičnih elementov v zemeljski skorji. Vsebina je skoraj 30%. V naravi se večinoma nahaja v obliki različnih oblik silicijevega dioksida, silikatov in aluminosilikatov.
Silicij je tetravalenten v skoraj vseh njegovih spojinah. V tem primeru so atomi silicija v vzbujenem stanju. Sl. 1.
Če želite iti v to stanje, eden od 3s elektronov zasede prosto mesto na 3p orbitali. V tem primeru namesto dveh neparnih elektronov v osnovnem stanju, bo silicijev atom v vzbujenem stanju imel 4 neparne elektrone. Z izmenjalnim mehanizmom bo lahko oblikoval 4 kovalentne vezi.


Atomi silicija niso nagnjeni k nastajanju večkratnih vezi, ampak tvorijo spojine z enojnimi vezmi Si-O-. Silicij, za razliko od ogljika, ni tipičen za alotropijo.
Eden od alotropna modifikacija je kristalni silicijpri čemer je vsak silicijev atom v sp3 hibridizaciji. Sl. 2, 3. Kristalni silicij je trdna, ognjevzdržna in trajna kristalinična snov temno sive barve s kovinskim sijajem. Pod normalnimi pogoji - polprevodnik. Včasih se amorfni silicij oddaja tudi kot druga alotropna modifikacija silicija. Gre za temno rjavi prah, ki je bolj kemično aktiven kot kristalni silicij. Ali je to alotropna sprememba, je sporno vprašanje.
Kemijske lastnosti silicija
1. Interakcija s halogeni
Si + 2F 2 → SiF 4
2. Pri segrevanju silicijev oksid v kisiku nastane silicijev dioksid (IV).
Si + O2 → SiO2
3. Pri visokih temperaturah silicij komunicira z dušikom ali ogljikom.
3Si + 2N 2 → Si 3 N 4
4. Silicij ne reagira z vodnimi raztopinami kislin. Toda raztopi se v alkalijah.
Si + 2NaOH + H20 → Na2Si03 + 2H2
5. Ko se silicij zliva s kovinami, se tvorijo silicidi.
Si + 2Mg → Mg 2 Si
6. Silicij neposredno ne vpliva na vodik, toda vodikove spojine silicija se lahko pridobijo z medsebojnim delovanjem silicidov z vodo.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silan)
Silani so po strukturi podobni alkanom, vendar so znatno reaktivni. Najbolj stabilen monosilan je vnetljiv na zraku.
SiH4 + 2O2 → Si02 + 2H2O
Pridobivanje silicija
Silicij dobimo z redukcijo iz silicijevega oksida (IV).
SiO2 + 2Mg → Si + 2MgO
Ena od nalog je pridobivanje silicija visoke čistosti. V ta namen se tehnični silicij prenese v silicijev tetraklorid. Nastali tetraklorid se reducira v silan, silan pa se razgradi v silicij in vodik pri segrevanju.
Silicij lahko tvori dva oksida: SiO2 - silicijev oksid (IV) in SiO - silicijev oksid (II).
SiO - silicijev oksid (II) - gre za amorfno temno rjavo snov, ki nastane z medsebojnim delovanjem silicija s silicijevim oksidom (IV).
Si + Sio 2 → 2 Sio.
Kljub svoji stabilnosti se ta snov skoraj nikoli ne uporablja.
SiO 2 - silicijev oksid (IV)


Ta snov predstavlja 12% zemeljske skorje. Sl. 4. Predstavljajo ga minerali, kot so rock kristal, kremen, ametist, citrin, jaspis, kalcedon. Sl. 5
SiO2 - silicijev oksid (IV) - snov nemolekularne strukture.
Njegova kristalna rešetka je atomska. Sl. 6. Kristali SiO 2 imajo obliko tetraedra, ki je med seboj povezan s kisikovimi atomi. Formulacija molekule (SiO2) n bi bila bolj pravilna. Ker SiO2 tvori snov atomske strukture in CO 2 - molekularne strukture, je razlika v njihovih lastnostih očitna. CO 2 je plin, SiO2 pa je trdna prosojna kristalinična snov, netopna v vodi in neodzivna.
Kemijske lastnostiSiPribližno 2
1. Silicijev oksid (IV) Si02 je kislinski oksid. Ne reagira z vodo. Silikatne kisline ni mogoče dobiti s hidracijo SiO 2. Njegove soli, silikati, lahko dobimo z reakcijo Si02 z vročimi alkalijskimi raztopinami.
Si02 + 2NaOH Na2Si03 + H20
2. reagira s karbonati alkalijskih in zemeljsko alkalijskih kovin.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Vzajemno delovanje s kovinami.
SiO2 + 2Mg → Si + 2MgO
4. Reakcija s fluorovodikovo kislino.
Si02 + 4HF → SiF4 + 2H2O
SiF 4 + 2HF → H 2
Kemijske lastnosti silicijeve kisline in silikatov
Pridobivanje silicijeve kisline
Silikatna kislina se obori kot polimerna spojina. Formule silicijeve kisline -
H 2 SiO 3 (meta oblika) in H 4 SiO 4 (orto oblika) - odražata razmerje elementov, ne pa resnične sestave. Običajno je sestava silicijeve kisline na ravnini prikazana kot sl. 7
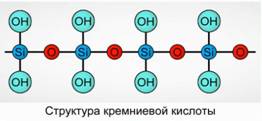
Za silicijevo kislino se vedno uporablja formula H 2 SiO 3.
1. H 2 Sio 3 razgradi pri segrevanju
H 2 SiO 3 H 2 O + SiO 2 (silikagel)
2. Deluje z alkalnimi raztopinami
H2Si03 + 2NaOH Na2Si03 + 2H20
Soli silicijeve kisline - silikati - se nanašajo na ionske spojine. To so trdne brezbarvne snovi. V vodi so topni samo silikati alkalijskih kovin, razen litija.
1. Topne silikate hidroliziramo z anionom
Na2Si03 + H20O NaHSio 3 + NaOH
2. Topni silikati vplivajo na močne kisline.
Na2SiO3 + 2HCl → H 2 SiO 3 + 2NaCl
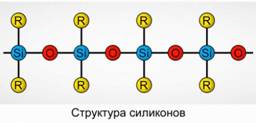
Poliorganosiloksani (silikoni)
Poliorganosiloksani (silikoni) so oksidirane organosilicijeve spojine z visoko molekulsko maso.
R 2 [ Sio] n
R je organska skupina (metil, etil ali fenil). Osnova strukture siloksanov je veriga izmeničnih silicijevih atomov in kisika. Sl.8. S spreminjanjem dolžine verige in organskih skupin lahko dobimo silikone z različnimi lastnostmi. S spreminjanjem pogojev polimerizacije lahko dobimo molekule različnih dolžin.


Kratko verižni polimeri so tekočine, daljši pa dragocena maziva. Sl. 9, ki ohranjajo svoje lastnosti v velikem temperaturnem razponu od. \\ T
100 0 С do + 300 0 С. Daljše molekule tvorijo gumo, ki pri nizkih temperaturah ne izgubi svoje elastičnosti. Imajo visoko odpornost na drobljenje, so kemijsko inertni. Sl. 10. Povzroča različne variante njihove uporabe. Uporabljajo se lahko za izdelavo strojev za umetno srce ali ledvice in se lahko uporabljajo kot čevlji za čevlje. Polimeri siloksana se uporabljajo v medicini za ustvarjanje različnih implantatov mehkih tkiv, saj so ti polimeri kemično inertni in jih telo ne zavrača. Ni navlažena z vodo. Uporablja se v kremah. Ko nanese kremo na roke, bo zamenjal gumijaste rokavice.
Anorganski vrt
V prozorno čašo, napolnjeno z natrijevim silikatom, potopimo kristale barvnih soli, na primer bakrovega sulfata. Po določenem času lahko opazimo, da so iz kristalov oblikovane tanke votle cevi, ki so sestavljene iz netopnih silikatov. Sl. 11

Dobiti "neumni" kit
Enake količine natrijevega silikata in medicinskega alkohola so pomešane. Oborino filtriramo in stisnemo, da se alkohol ne kaplja. To je kiti. Sl. 12. Imenovan je zato, ker je bilo načrtovano, da ga uporabimo kot kiti za okna. Vendar se je izkazalo, da ima take lastnosti, da ga ni mogoče uporabiti za predvideni namen. Če zavrtite žogo in jo vrgnete na tla, se bo odbijala kot gumijasta žoga. Če se da na mizo, se bo razširila kot tekočina. Če udarite trden predmet, se bo zdrobil kot trdno telo. Čez nekaj časa, ko se alkohol posuši, se bo kiti le še razpadel.
![]()
Povzetek lekcije
V tej lekciji ste preučevali temo "silicij". Preučili smo informacije o siliciju: njegova elektronska struktura, kjer se silicij nahaja v naravi, je proučila alotropijo silicija, pojasnila njene fizikalne in kemijske lastnosti. Spoznali so, kje se silicij uporablja v industriji in na drugih področjih, kako se proizvaja. Srečali ste se s kremenico, silicijevo kislino in njenimi solmi - silikati.
Reference
1. Rudzitis G.E. Kemija. Osnove splošne kemije. 11. razred: učbenik za izobraževalne ustanove: osnovna raven / G.E. Rudzitis, F.G. Feldman. - 14. izd. - M: Razsvetljenje, 2012.
2. Popel P.P. Kemija: 8 cl .: Učbenik za srednje šole / PP. Popel, L.S. - K.: ИЦ "Akademija", 2008. - 240 str .: Ill.
3. Gabrielyan O.S. Kemija. 11. razred. Osnovna raven. 2nd ed., Sr. - M.: Drofa, 2007. - 220 str.
Domača naloga
1. №№2-4 (str. 138) Rudzitis G.E. Kemija. Osnove splošne kemije. 11. razred: učbenik za izobraževalne ustanove: osnovna raven / G.E. Rudzitis, F.G. Feldman. - 14. izd. - M: Razsvetljenje, 2012.
2. Kakšne so uporabe poliorganosiloksanov.
3. Primerjajte lastnosti alotropnih modifikacij silicija.
