Când se conectează 28 g de siliciu cu oxigen. Compuși de oxigen de siliciu
Kremniy.Obschaya harakteristika.Osnovnoe Spre deosebire de carbon: absenta n comunicare soedineniyah.Silitsidy.Soedineniya cu hidrogen (silani), oxidarea și gidroliz.Tetraftorid și tetraclorură de siliciu, siliciu gidroliz.Geksaftorosilikaty.Kislorodnye soedineniya.Oksid (IV) .Silikagel.Kremnevaya silicați kislota.Silikaty.Rastvorimost și gidroliz.Prirodnye și aluminosilicați tseolity.Kremniyorganicheskie soedineniya.Silikony siloksany.Ispolzovanie și compuși de siliciu în medicină.
siliciu (lat. Silicium), Si, element chimic din grupa IV a sistemului periodic; atomic numărul 14, masa atomică 28.086. Siliconul prezintă, de asemenea, hibridizarea sp3 a electronicii
orbitali. Pe stratul de electroni exterior al atomului de siliciu există valența 3d-
orbitale (Si: 3s23p23d0),
Siliciul după oxigen este cel mai frecvent element din crustă. Spre deosebire de carbonul în stare liberă, siliconul nu se găsește în natură. Compușii cei mai obișnuiți sunt silicați de oxid de siliciu (IV) SiO2 și săruri de acid silicic, silicați. Ele formează coaja crustei pământului. Compușii de siliciu se găsesc în plante și animale. Prin proprietățile chimice, siliciul, ca de exemplu carbonul, este nemetalic, dar nemetalitatea sa este mai puțin pronunțată, având o rază atomică mai mare
Silicon. formează compuși cu aproape toate metalele - cu ilitsidy (nu s-au găsit compuși numai cu Bi, Tl, Pb, Hg). Au fost obținute mai mult de 250 de siliciuri, a căror compoziție (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si etc.), de obicei, nu corespunde valențelor clasice. Silicidele diferă prin refractare și duritate; cea mai mare importanță practică sunt ferosiliciu (reducătorul în topirea aliajelor speciale cm. feroaliaje) și MoSi2 siliciură de molibden (încălzitoare electrice, palete de turbine cu gaz și altele similare. d.).
Silan. Sub acțiunea acidului clorhidric pe silicide, cel mai simplu compus hidrogenic de siliciu este silanul SiH4:
Silanul este un gaz otrăvitor cu miros neplăcut care se aprinde spontan. aerul
Ele sunt reactive și sunt agenți reducători puternici.
reacționează cu apa atunci când temperatura camerei:
SiH4 + 2H20 -\u003e Si02 + 4H2,:
tetrafluorura Siliconul este produs prin fluorurarea dioxidului de siliciu cu fluor elementar.
Procesul de fluorurare se desfășoară în două etape într-un reactor cu flacără, direcționând excesul de fluor elementar din etapa I spre faza a doua.
Rezultatul tehnic este producția de siliciu în mod continuu cu randament ridicat și calitate a produsului.
Tetrafluorură de siliciu SiF4 se formează prin acțiunea acidului fluorhidric (fluorhidric) pe sticlă:
Na2Si03 + 6HF®2NaF + SiF4 + 3H20
Compuși de oxigen de siliciu
Cel mai important compus oxigenic din siliciu este dioxidul de siliciu SiO2 (silice), care are câteva modificări cristaline.
Modificarea la temperaturi joase (până la 1143 K) se numește cuarț. Cuarțul are proprietăți piezoelectrice. Soiuri naturale de cuart: cristal de rock, topaz, ametist. Soiurile de silice sunt calcedon, opal, agat,. jasper, nisip.
Siliciul este rezistent chimic; este afectată numai de fluor, acid fluorhidric și soluții alcaline. Se dă cu ușurință într-o stare sticloasă (sticlă de cuarț). Sticla de cuarț este rezistentă, foarte chimică și termică. Acidul silicic SiO2 corespunzător nu are o compoziție specifică. În mod tipic, acidul silicic este înregistrat ca xH20-ySi02. Silicele Obținute: H2SiO3 (H2O-SiO2) - metasilicic (tri-oksokremnievaya), H4Si04 (2H20-Si02) - orthosilicic (tetra-oksokremnievaya), H2Si2O5 (H2O * SiO2) - dimetakremnievaya.
Acizii siliciici sunt substanțe slab solubile. În concordanță cu natura mai puțin metaloidală a siliciului în comparație cu carbonul, H2SiO3 ca electrolit este mai slab decât H2CO3.
Corespunzător sărurilor de siliciu - silicații din apă sunt insolubili (cu excepția silicaturilor de metale alcaline). Silicatele solubile sunt hidrolizate de ecuație
2Si03 - + H20 = Si2O52- + 20H-.
Soluțiile concentrate de silicate solubile sunt denumite sticlă lichidă. Sodatul obișnuit de silicat de sticlă de sodiu și calciu are o compoziție de Na20-CaO-6Si02. Se obține prin reacție
Este cunoscută o mare varietate de silicați (mai exact oxosilicați). O anumită regularitate este observată în structura oxosilicatelor: toate constau în tetraedru Si04, care sunt conectați unul la celălalt printr-un atom de oxigen. Cele mai frecvente combinații sunt tetraedre (Si2O76-), (Si3O9) 6- (Si40l2) 8- (Si6O1812-), care ca și unitățile structurale pot fi combinate în lanțuri, benzi, ochiuri și schele (Figura 4).
Cele mai importante silicate naturale sunt, de exemplu, talcul (3MgO * H20-4Si02) și azbestul (SmgO * H2O * SiO2). Ca și în cazul SiO2, starea sticloasă (amorfă) este caracteristică silicaților. Cu cristalizarea controlată a sticlei, este posibil să se obțină o stare fin cristalină (sitalls). Sitalele se caracterizează prin creșterea rezistenței.
Pe lângă silicații, aluminosilicații sunt larg răspândiți în natură. Aluminosilicați - oxosilicați de cadru, în care o parte din atomii de siliciu este înlocuită cu Al trivalent; de exemplu Na12 [(Si, Al) 04] 12.
Pentru acidul silicic, o stare coloidală este caracteristică atunci când sărurile acidului H2SiO3 nu sunt afectate imediat. soluții de dioxid de siliciu coloidal (coloizilor) în anumite condiții (de exemplu, prin încălzire) poate fi transformată într-un, omogen pe bază de gelatină în masă gel transparent de acid silicic. Gelele sunt compuși cu înaltă moleculară cu o structură spațială, foarte liberă, formată din molecule de SiO2, golurile cărora sunt umplute cu molecule de H2O. La deshidratarea silicagelului se obține silicagel - un produs poros cu o capacitate mare de adsorbție.
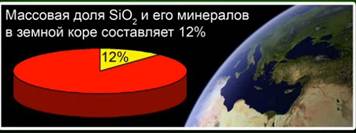
Oxidul de siliciu (IV) (silice) - cel mai obișnuit compus din scoarța pământului, care reprezintă 12% din masa sa sub formă de diferite minerale. Distinge între silicea cristalină și amorfă. Formula cea mai simplă pentru oxidul de siliciu (IV) este SiO2. Se cristalizează în rețeaua atomică.
1) dioxid de siliciu cristalin - sub formă de cuarț minerale și soiurile sale (cristal de rocă, calcedonie, agat, jasp, silex); cuarțul formează baza nisipurilor de cuart utilizate pe scară largă în construcții și în industria silicatului.
2) silice amorfă - sub formă de compoziție minerală opală Si02 nH20; formele pământești de silice amorfă sunt diatomite, Tripoli (pământ infuzional); Un exemplu de silice artificială amorfă anhidră este silica gel, care este obținut din metasilicat de sodiu:
Na2Si03 + 2HCI = 2NaCI + H2Si03
Silicagelul are o suprafață dezvoltată, de aceea absoarbe bine umiditatea.
Silicagel este un gel uscat format din soluții suprasaturate de acid silicic (nSiO2 · mH2O) la pH\u003e 5-6. Solvent hidrofil solid.
recepție
Se obține prin acidularea soluțiilor de silicat de metal alcalin, urmată de spălarea și uscarea gelului format:
Acid silicic. SiO2 este anhidrida unui număr de acizi siliciici
Acidul silicic este construit din unități structurale tetraedrice (în fiecare astfel de legătură atomul de siliciu este în centrul unui tetraedru și sunt dispuse la nodurile de atomi de oxigen). Legăturile structurale, unite în lanțuri, formează acizi polistilici mai stabili:
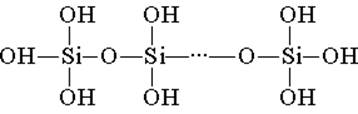
Compoziția unui astfel de compus poate fi exprimată prin formula (H2Si03) n. Cu toate acestea, acidul silicic este reprezentat de obicei prin formula H2SiO3. H2SiO3 - acidul este foarte slab, puțin solubil în apă. Când se încălzește, se descompune cu ușurință, cum ar fi acidul carbonic:
Toți acizii siliciici sunt foarte slabi (mai slabi decât cărbunele).
silicați. Sărurile tuturor acizilor siliciui se numesc silicați, deși, de regulă, în literatura de specialitate, silicații implică săruri ale acidului metacilicic. Compoziția lor este, de obicei, reprezentată de formula sub formă de compuși ai oxizilor elementelor. De exemplu, silicatul de calciu CaSiO3 poate fi exprimat ca: CaO × SiO2.
Silicații cu compoziție R2OxnSiO2, în care R2O este oxizi de sodiu sau potasiu, se numesc sticlă solubilă, iar soluțiile apoase concentrate se numesc sticlă lichidă. Cel mai important este sticla solubilă în sodiu.
Când stau în aer, soluțiile de silicate cresc tulbure, deoarece dioxidul de carbon (IV) în aer deplasează acidul silicic din sărurile sale:
Acidul silicic este practic insolubil în apă - această proprietate este utilizată ca o reacție calitativă la ionul de SiO32-.
Silicatele se obțin prin topirea silicei cu alcalii sau carbonați:
Soluția acidului silicic iar viteza dizolvării sale depinde de câțiva factori, dintre care cele mai importante sunt modificarea dioxidului de siliciu, gradul de dispersie și temperatura acestuia. Când se agită gelul de silice cu apă, echilibrul de solubilitate se stabilește în câteva ore, în cazul cuarțului, sunt necesare multe luni și chiar ani.
SILICATE NATURALE (Din latină silex, decesele din genul silicis - flint * un silicați naturali; ... N Natürliche Silikate; f silicații naturels; ... Si silicatos NATURALES) - clasa de minerale, sărurile de siliciu, izo- și acizi geteropolikremnievyh. Ponderea silicatelor naturale reprezintă până la 75% din masa crustă a pământului și aproximativ 25% din speciile minerale. În natură, mai mult de 700 de silicați naturali sunt cunoscuți, incluzând cele mai importante minerale formate de rocă (feldspați, piroxeni, amfibule, micaze etc.)
aluminosilicați - un grup de silicați naturali și sintetici, ai căror anioni complecși conțin siliciu și aluminiu. Exemple de anioni complexi: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, și uneori Ba2 + și Li + acționează ca cationi.
Aluminosilicatele naturale sunt cele mai comune minerale, acestea reprezentând până la 50% din masa crustă a pământului. Acestea includ feldspați (albită, ortoclază, anorțiță), minerale din argilă și mica.
zeoliți - Acestea sunt aluminosilicați apoși de calciu, sodiu, potasiu, bariu și alte elemente. Grupul de zeoliți include mai mult de patruzeci de minerale, care diferă în compoziție (în special în numărul de molecule de apă din hidratul cristalin) și, bineînțeles, în proprietățile fizice și chimice. Dar aproape toți reprezentanții acestui grup de minerale au proprietate comună - sunt sorbenți buni, posedă proprietăți de schimb ionic, pot schimba mobilitatea ionilor individuali și pot funcționa ca site moleculare. Și relativ recent, aceste minerale au găsit o utilizare total neașteptată - au început să fie utilizate în agricultură.
Compuși organosilici - compuși în ale căror molecule există o legătură între atomi de siliciu și atomi de carbon. Compușii organosiliciui sunt uneori denumiți siliconi, din siliconul latin denumit "silicon". Compușii organosilicieni sunt utilizați pentru a produce lubrifianți, polimeri, cauciucuri, cauciucuri, fluide de silicon și emulsii. Compuși organosilicieni sunt utilizați în cosmetice, produse chimice de uz casnic, vopsele și lacuri, detergenți. Caracteristică distinctivă produsele pe bază de compuși organo-siliciu din produse bazate pe compuși organici obișnuiți sunt, de regulă, performanțe și caracteristici mai ridicate, precum și siguranța utilizării umane. Polimerii polimerici pot fi utilizați pentru prepararea mucegaiurilor în gătit. Polimerizarea compușilor organo-siliciu și a substanțelor de etanșare este sigură pentru oameni și nu necesită extracție.
siloxan - compușii care conțin atomi de siliciu și oxigen alternativi într-o moleculă. Cele mai mari au siloxani cu greutate moleculară ridicată - poliorganosiloxani; consultați polimeri de silicon.
siliconi (poliorganosiloxani) - compuși organo-siliciu cu greutate moleculară mare oxigenată cu formula chimică n, unde R = gruparea organică (metil, etil sau fenil). Acum, aceasta aderă definiție deja extrem de rare, iar în „Silicones“ sunt combinate ca poliorganosiloxani (de exemplu, uleiuri de silicon, cum ar fi ICP, tip hidrofug a LGN sau cu greutate moleculară mică, cauciucuri SKTN) si chiar monomeri organosiliconice (diferiți silani), estompează distincția dintre termenii „silicon“ și " silicon. "
Siliciu metalic  Cristal Silicon
Cristal Silicon
siliciu (Si). Acest element chimic este de 1/4 din compoziția crustei pământului. Cuarț, cristal de rocă, nisip, lut, granit, mica, azbest - toate acestea compuși chimici de siliciu
Siliconul este un element intermediar (amfoteric) și poate prezenta atât proprietăți metalice, cât și nemetalice. Poate forma compuși chimici, atât cu metale, cât și nemetale.
Pur siliciu - o substanță chimică simplă de culoare gri, dură, refractară și fragilă. Cristal Silicon Are un luciu metalic și este utilizat pe scară largă în industria semiconductorilor (este un semiconductor).
Siliciul se poate întinde ca într-o stare cristalină ( siliciu cristalin) și în stare amorfă ( siliciu amorf). Siliciul cristalin este format prin răcirea unei soluții de siliciu amorf într-un metal topit. La rândul său, siliciul cristalin este un material foarte fragil și ușor de strivit într-o pulbere amorfă. Astfel, siliciu amorf este un fragment de cristale de siliciu cristalin.
În stare liberă, siliciul este destul de dificil de obținut. Producția sa industrială este asociată cu recuperarea cuarțului, formula chimică care - SiO 2, reacția de reducere este produsă de cocsul fierbinte (carbon).
SiO2 + C → C02 + Si
În laborator, siliciul pur este redus de la nisipul de siliciu cu magneziu metalic utilizând următoarea reacție:
Si02 + 2Mg - Si + 2MgO.
În timpul acestei reacții, se formează o pulbere brună de siliciu amorf. Când se încălzește, pulberea poate reacționa încet cu soluții concentrate de alcalii (de exemplu, hidroxid de sodiu NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - substanța complexă rezultată - denumită și sticlă lichidă.
Este interesant faptul că activitatea chimică a siliciului depinde de dimensiunea cristalelor sale. Silicul co-cristalin este mai puțin activ chimic decât amorf. Acesta din urmă reacționează ușor cu fluor chiar și la temperatura obișnuită și la o temperatură de 400 - 600 ° C reacționează cu oxigenul, clorul, bromul, sulful pentru a forma compușii chimici corespunzători. La temperaturi foarte ridicate, siliciul reacționează cu azot și carbon pentru a forma, respectiv, nitrura și carbură de siliciu.
Dacă încercați să dizolvați siliciul într-un amestec de HF fluorhidric (fluorhidric) și acizi HNO3 nitrici, atunci reacția nu va continua. Dar dacă efectuați o reacție chimică cu un alcalin, de exemplu, cu hidroxid de potasiu, atunci reacția va avea loc cu formarea unei sări de acid silicic
Si + KOH → K2SiO3 + H2
Dacă se calcinează în cuptor silice (nisip) cu cocs, se dovedește o substanță cristalină foarte solidă. carborundum SiC
SiO2 + 3C-SiC + 2CO
carborundum - substanță foarte tare și refractară. În industrie, este produs în cantități mari datorită acestor proprietăți. Interesant este faptul că rețeaua cristalină carborundum este similară cu cea a celei mai dense substanțe - diamant, dar atomii individuali de carbon sunt înlocuiți uniform cu atomi de siliciu.
La temperaturi ridicate, precum și în timpul reacțiilor chimice sub acțiunea acizilor pe compușii metalici cu siliciu, silan SiH4.
Cilan - este un gaz incolor de auto-aprindere. Se poate aprinde în aer pentru a forma silice și apă.
SiH4 + 2O2\u003e → Si02 + 2H20
Dacă oxidul de siliciu Si02 este încălzit în prezența carbonului într-un curent de clor, are loc o reacție chimică cu formarea de clorură de siliciu
SiO2 + 2C + 2CI2-\u003e SiCl4 + 2CO
Clorura de siliciu - este un lichid, a cărui temperatură de fierbere este de numai 54 ° C. Clorura de siliciu este ușor dizolvată în apă cu formarea unei soluții de doi acizi: siliciu și clorhidric
SiCl4 + H20 - H2SiO3 + HCI
Dacă această reacție chimică are loc într-o atmosferă cu aer umed, în timpul formării a doi acizi va apărea un fum gros.
Oxid de siliciu SiF 4 - format ca urmare a reacției chimice a acidului fluorhidric și a oxidului de siliciu
SiO2 + 4HF - SiF4 + 2H20
Fluorura de siliciu este un gaz incolor cu un miros "puternic". Ca și clorura de siliciu, în apă acest gaz formează doi acizi: siliciu și hidrofluoric. Dar, interesant, fluorura de siliciu poate interacționa cu acidul fluorhidric pentru a forma acidul hexafluorosilicic a cărui formulă chimică este H 2 SiF 6. Sărurile sale și acidul în sine sunt otrăvitoare.
siliciu
Metale comune și nemetale
În această lecție veți studia subiectul "Silicon". Luați în considerare informații despre siliciu: structura sa electronică, în cazul în care siliciul este în natură, studiați alotropia siliciului, explicați-i fizicul și chimice. Aflați unde se utilizează siliciul în industrie și alte domenii, cum este produs. Veți cunoaște silicatul, acidul silicic și sărurile sale - silicați.
Subiect: Metale comune și nemetale
Lecție: Silicon. Gaze nobile
Siliconul este unul dintre cele mai comune elemente chimice din scoarța pământului. Conținutul său este de aproape 30%. În natură, se găsește în principal sub formă de diferite forme de dioxid de siliciu, silicați și aluminosilicați.
Siliconul este tetravalent în aproape toți compușii săi. În acest caz, atomii de siliciu sunt în stare excitat. Fig. 1.
Pentru a intra în această stare, unul dintre electronii 3s ocupă un loc vacant pe orbitele 3p. În acest caz, în loc de doi electroni nepartiți în starea de bază, atomul de siliciu în stare excitat va avea 4 electroni nepartiți. El va putea forma 4 legături covalente prin mecanismul de schimb.


Atomii de siliciu nu sunt predispuși la formarea legăturilor multiple, ci formează compuși cu legături simple - Si-O-. Silicul, spre deosebire de carbon, nu este tipic alotropiei.
Unul dintre ele modificarea alotropică este siliciul cristalinîn care fiecare atom de siliciu este în hibridizarea sp3. Fig. 2, 3. Siliciul cristalin este o substanță cristalină solidă, refractară și durabilă, gri închis, cu un luciu metalic. În condiții normale - un semiconductor. Uneori, siliciul amorf este, de asemenea, emis ca o altă modificare alotropică a siliciului. Este o pulbere maro închis, mai activă din punct de vedere chimic decât siliciul cristalin. Indiferent dacă este vorba de o modificare alotropică, este un punct de interes.
Proprietăți chimice ale siliciului
1. Interacțiunea cu halogeni
Si + 2F2 - SiF4
2. Când se încălzește, siliciul arde în oxigen, se formează silice (IV).
Si + O2 → SiO2
3. La temperaturi ridicate, siliciul interacționează cu azot sau carbon.
3Si + 2N2 -\u003e Si3N4
4. Siliconul nu reacționează cu soluțiile apoase de acizi. Dar se dizolvă în alcalii.
Si + 2NaOH + H20 - Na2Si03 + 2H2
5. Când siliciul este topit cu metale, se formează silicide.
Si + 2 Mg → Mg2Si
6. Siliconul nu interacționează direct cu hidrogenul, dar compușii de hidrogen ai siliciului pot fi obținuți prin interacțiunea silicidelor cu apa.
Mg2Si + 4H20 - 2Mg (OH) 2 + SiH4 (silan)
Silanele sunt structurate în mod similar cu alcani, dar sunt considerabil reactive. Cel mai stabil monosilan este inflamabil în aer.
SiH4 + 2O2 → Si02 + 2H20
Obținerea siliciului
Siliconul este obținut prin reducerea oxidului de siliciu (IV)
Si02 + 2Mg - Si + 2MgO
Una dintre sarcinile este de a obține siliciu de înaltă puritate. În acest scop, siliciul tehnic este transferat în tetraclorură de siliciu. Tetraclorura rezultată este redusă la silan, iar silanul se descompune în siliciu și hidrogen când este încălzit.
Siliconul este capabil să formeze doi oxizi: SiO 2 - oxid de siliciu (IV) și SiO - oxid de siliciu (II).
siO - oxid de siliciu (II) - aceasta este o substanță amorfă de culoare maro închis, care este formată prin interacțiunea siliciului cu oxidul de siliciu (IV)
si + dioxid de siliciu 2 → 2 dioxid de siliciu.
În ciuda stabilității sale, această substanță este aproape niciodată utilizată.
siO 2 - oxid de siliciu (IV)


Această substanță reprezintă 12% din scoarța pământului. Fig. 4. Este reprezentat de minerale precum cristalul, cuartul, ametistul, citrina, jaspisul, calcedonia. Fig. 5.
SiO 2 - oxid de siliciu (IV) - o substanță cu structură non-moleculară.
Câmpul său de cristal este atomic. Fig. 6. Cristalele de SiO2 au forma unui tetraedru, care sunt interconectate de atomii de oxigen. Formula moleculei (SiO2) n ar fi mai corectă. Din moment ce SiO 2 formează o substanță a structurii atomice și CO 2 - cu o structură moleculară, diferența în proprietățile lor este evidentă. C02 este un gaz, iar Si02 este o substanță solidă cristalină transparentă, insolubilă în apă și refractară.
Proprietăți chimicesiAproape 2
1. Oxidul de siliciu (IV) Si02 este un oxid acid. Nu reacționează cu apa. Acidul silicic nu poate fi obținut prin hidratarea SiO2. Sărurile sale, silicații, pot fi obținute prin reacția Si02 cu soluții calde alcaline.
Si02 + 2NaOH Na2Si03 + H20
2. Reacționează cu carbonați de metale alcaline și alcalino-pământoase.
CaCO 3 + SiO 2 CaSiO 3 + C02
3. Interacționează cu metalele.
Si02 + 2Mg - Si + 2MgO
4. Reacția cu acid fluorhidric.
SiO2 + 4HF - SiF4 + 2H20
SiF4 + 2HF-H2
Proprietati chimice ale acidului silicic si silicatilor
Obținerea acidului silicic
Acidul silicic precipită ca un compus polimeric. Formule de acid silicic -
H 2 SiO 3 (meta form) și H 4 SiO 4 (forma orto) - reflectă raportul elementelor, dar nu și compoziția adevărată. În mod convențional, în plan, compoziția acidului silicic este reprezentată în fig. 7.
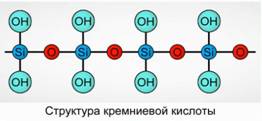
Pentru acidul silicic, se folosește întotdeauna formula H 2 SiO 3.
1. H 2 dioxid de siliciu 3 se descompune când este încălzit
H2SiO3H2O + Si02 (silicagel)
2. Interacționează cu soluții alcaline
H 2 SiO 3 + 2NaOH Na 2SiO 3 + 2H 2O
Săruri de acid silicic - silicați - se referă la compușii ionici. Acestea sunt substanțe solide incolore. Numai silicații metalului alcalin, cu excepția litiului, sunt solubili în apă.
1. Solicații solubili sunt hidrolizați cu anion
Na2SiO3 + H20 NaHS03 + NaOH
2. Silicatele solubile interacționează cu acizii puternici.
Na2SiO3 + 2HCI -\u003e H2SiO3 ↓ + 2NaCl
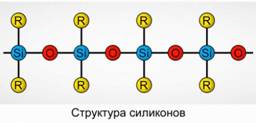
Poliorganosiloxani (siliconi)
Polinorganosiloxanii (siliconii) sunt compuși oxigenați cu compuși organo-siliciu cu greutate moleculară mare.
R 2 [ dioxid de siliciu] n
R este o grupare organică (metil, etil sau fenil). Baza structurii siloxanelor este un lanț de atomi de siliciu alternând și oxigen. Figura 8. Prin modificarea lungimii lanțului și a grupărilor organice, pot fi obținute siliconi cu proprietăți diferite. Prin schimbarea condițiilor de polimerizare, puteți obține molecule de diferite lungimi.


Polimerii cu lanț scurt sunt lichide, iar cele mai lungi sunt lubrifianți valoroși. Fig. 9, care își păstrează proprietățile într-un interval de temperatură uriaș de la
100 ° C până la + 300 ° C. Moleculele mai lungi formează cauciucuri care nu își pierd elasticitatea la temperaturi scăzute. Au rezistență mare la uzură, sunt inerte chimic. Fig. 10. Cauzează diferite variante ale aplicării lor. Acestea pot fi folosite pentru a crea mașini artificiale de inimă sau rinichi și pot fi folosite ca încălțăminte pentru încălțăminte. Polimerii siloxanici sunt utilizați în medicină pentru a crea diferite implanturi de țesut moale, deoarece astfel de polimeri sunt inerți chimic și nu sunt respinși de organism. Nu sunt umezite cu apă. Se utilizează în creme. Când aplicați această cremă pe mâini, va înlocui mănușile de cauciuc.
Grădină anorganică
Într-un pahar transparent, umplut cu silicat de sodiu, se înmoaie cristalele de săruri colorate, de exemplu, sulfatul de cupru. După un timp, se poate observa că tuburile subțiri formate din cristale, care constau din silicați insolubili. Fig. 11.

Obtinerea chitului "prost"
Cantitate egale de silicat de sodiu și alcool medicinal sunt amestecate. Precipitatul este filtrat și presat, pentru a nu picura alcoolul. Acesta este chit. Fig. 12. Se numește așa pentru că era planificat să o folosească ca un chit pentru ferestre. Dar sa dovedit că are proprietăți care nu puteau fi folosite în scopul propus. Dacă rotiți mingea și aruncați-o pe podea, aceasta va sări ca o minge de cauciuc. Dacă se pune pe masă, se va răspândi ca un lichid. Dacă atingi un obiect solid, se va sfărâma ca un corp solid. După un timp, când alcoolul se usucă, acest chit se va sfărâma.
![]()
Rezumând lecția
În această lecție ați studiat tema "Silicon". Am examinat informații despre siliciu: structura sa electronică, în care siliciul este localizat în natură, a studiat alotropia siliciului, și-a explicat proprietățile fizice și chimice. Ei au aflat de unde se utilizează siliciul în industrie și în alte domenii, cum este produs. Ați întâlnit cu silice, acid silicic și sărurile sale - silicați.
Referințe
1. Rudzitis G.E. Chimie. Bazele chimiei generale. Gradul 11: manual pentru instituțiile de învățământ: nivel de bază / G.E. Rudzitis, F.G. Feldman. - ed. - M .: Iluminarea, 2012.
2. Popel P.P. Chimie: 8 cl .: Manual pentru școli secundare / PP. Popel, L.S. - К.: ИЦ "Academia", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. Chimie. Clasa a XI-a. Nivelul de bază. Al doilea ed., Sr. - M .: Drofa, 2007. - 220 p.
teme pentru acasă
1. №№2-4 (p. 138) Rudzitis G.E. Chimie. Bazele chimiei generale. Gradul 11: manual pentru instituțiile de învățământ: nivel de bază / G.E. Rudzitis, F.G. Feldman. - ed. - M .: Iluminarea, 2012.
2. Care sunt aplicațiile polinorganosiloxanelor.
3. Comparați proprietățile modificărilor alotropice ale siliciului.
