Serii genetice de exemple non-metale. Relația genetică între clasele de substanțe - Hipermarketul de cunoștințe
Există o legătură genetică între substanțe simple, oxizi, baze, acizi și săruri, și anume posibilitatea tranziției reciproce (transformare).
De exemplu, o substanță simplă - calciul ca urmare a interacțiunii cu oxigenul se transformă într-un oxid: 2Ca + O2 = 2CaO.
Oxidul de calciu, atunci când interacționează cu apa, formează hidroxid de calciu CaO + H 2 O = Ca (OH) 2 și acesta din urmă, atunci când interacționează cu acidul, se transformă într-o sare: Ca (OH) 2 + H2S04 = CaSO4 + 2H2O.
Aceste transformări pot fi reprezentate prin schema:
Ca → CaO → Ca (OH) 2 → CaS04
O schemă similară poate fi scrisă și pentru metale nemetalice, de exemplu sulf:
S → SO3 → H2SO4 → CaS04
Deci, aceeași sare se obține în diferite moduri.
Este de asemenea posibilă trecerea inversă de la sare la alte clase de compuși anorganici și substanțe simple:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO4 + 2NaOH = Cu (OH) 2 + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H2 = Cu + H20 (reducerea cuprului)
O relație similară între clasele de compuși anorganici, bazată pe producerea substanțelor dintr-o clasă din substanțele altui, se numește genetică.
Proprietățile compușilor complexi se reflectă în schema genetică a principalelor clase de compuși anorganici (vezi figura). Aceasta reflectă etapele de dezvoltare a materiei anorganice de-a lungul a două linii principale, de la metale tipice până la nemetale tipice cu proprietăți opuse.
Metalele a căror proprietate chimică a unui atom este capacitatea de donare a electronilor și a nemetalilor, a căror proprietate chimică principală este capacitatea atomilor lor de a atașa electroni opuși unul altuia în proprietăți. Cu complicația compoziției substanțelor, aceste tendințe opuse continuă să apară.
Metalele tipice și elementele de tranziție în cea mai mică stare de oxidare formează oxizii de bază, în timp ce nemetalele tipice și elementele de tranziție în starea de oxidare ridicată formează oxizii opuși ai acidului.
Substanțe simple
amfoter
Nemetale
Oxizi de bază
amfoter
acid
motive
amfoter
hidroxizi
Schema genetică a principalelor clase de compuși anorganici
Cu o complicație suplimentară a compoziției substanțelor, se formează hidroxizi, oxizii de bază corespunzători bazei și oxizii de acid corespunzători acidului. Bazele opuse în proprietăți și acid reacționează activ unul cu celălalt, formând săruri. Interacțiunea dintre opuși este forța motrice a reacției. Prin urmare, oxizi, baze și acizi bazici și acizi interacționează activ unul cu celălalt, și doi oxizi acide sau doi oxizi de bază nu interacționează, deoarece proprietățile lor sunt apropiate.
Astfel, proprietățile unui compus complex sunt determinate pe baza proprietăților elementelor sale constituente. Principalele legi ale schimbării acestor proprietăți sunt rezumate în următoarele aplicații (Tabelul 6).
1. În perioadele cu o creștere a numărului de secvență, proprietățile elementelor se schimbă de la metal la nonmetal. Numărul de electroni la nivel extern crește, gradul de oxidare a elementului crește, raza atomului și ionului scade, energia de ionizare și afinitatea pentru creșterea electronului. În concordanță cu aceasta, descrescămintele de bază și proprietățile acide ale oxizilor și hidroxidurilor cresc.
2. În principalele subgrupe, proprietățile de bază ale oxizilor și hidroxidurilor cresc odată cu creșterea numărului atomic. Pentru elementele grupurilor laterale cu o creștere a numărului de secvență, este caracteristică o schimbare mai complexă a proprietăților. În primul rând, proprietățile metalice sunt îmbunătățite și apoi reduse.
3. Metalele active corespund oxizilor și hidroxidelor cu proprietăți de bază puternic pronunțate. Cele mai active metale sunt alcaline și alcalino-pământoase. Ele formează oxizi solubili în apă și baze solubile solubile - alcalii.
4. Metalele puțin active (toate, dar alcaline și alcalino-pământoase) formează baze slabe care sunt dificil de dizolvat în apă:
Cu (OH) 2, Fe (OH) 3.
5. Oxizii și hidroxizii cu proprietăți acide puternic pronunțate corespund nemetalilor activi.
6. Metalele amfoterice formează oxizi și hidroxizi amfoterici.
7. Dacă un element prezintă grade diferite de oxidare, atunci oxizi și hidroxizi cu proprietăți diferite corespund acestuia.
Subiect: CONEXIUNEA GENETICĂ ÎNTRE METELE și nemetalele și compușii lor. Clasa a IX-a
Obiective: educaționale: consolidarea conceptului de "serie genetică", "conexiune genetică"; învață cum să se facă serii genetice de elemente (metale și nemetale), pentru a forma ecuațiile de reacție corespunzătoare seriei genetice; verificați modul în care sunt învățate cunoștințele chimice oxizi, acizi, săruri, baze; dezvoltarea: pentru a dezvolta abilitatea de a analiza, compara, rezuma și trage concluzii, alcătui ecuațiile reacțiilor chimice; educațional: pentru a promova formarea unei viziuni asupra lumii științifice.
Oferirea de clase: tabelele "Sistem periodic", "Tabelul de solubilitate", "Seria de activitate a metalelor", instrucțiuni pentru studenți, sarcini de testare a cunoștințelor.
Progres: 1) Org. momentul
2) Verificați d / s
3) Studiați materialul nou
4) Fixare
5) D / C
1) Org. momentul. Bine ai venit.
2) Verificați d / s.
Conexiunile genetice sunt conexiuni între diferite clase pe baza interconversiilor lor.
Cunoscând clasele de substanțe anorganice, este posibil să se completeze seria genetică de metale și nemetale. Baza acestor serii este același element.
Printre metale există două tipuri de rânduri:
1
. O serie genetică în care alcalii acționează ca bază. Această serie poate fi reprezentată utilizând următoarele transformări:metal → oxid de bază → alcalin → sare
De exemplu, K → K
2 O → KOH → KCI2
. Seria genetică, în cazul în care baza este o bază insolubilă, atunci seria poate fi reprezentată ca un lanț de transformări:metal → oxid de bază → sare → bază insolubilă →
→oxid de bază → metal
De exemplu, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO - Cu
1
. Seria genetică de nemetale, în care acidul solubil acționează ca o legătură în serie. Lanțul transformărilor poate fi reprezentat după cum urmează:non-metal → acid acid → acid solubil → sare
De exemplu, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Seria genetică de nemetale, în care acidul insolubil acționează ca o legătură în serie:non-metal → oxid acid → sare → acid →
→oxid de acid → nemetalic
De exemplu
si→ dioxid de siliciu 2 → na 2 dioxid de siliciu 3 → H 2 dioxid de siliciu 3 → dioxid de siliciu 2 → si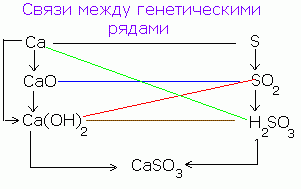
Conversație frontală la:
Ce este o conexiune genetică? Legăturile genetice sunt conexiuni între diferite clase pe baza interconversiilor lor. Ce este o serie genetică?
Serii genetice - o serie de substanțe - reprezentanți ai diferitelor clase, care sunt compuși ai unui element chimic, legați prin interconversiuni și reflectând transformările acestor substanțe. Baza acestor serii este același element.
Ce tipuri de serii genetice pot fi distinse? Printre metale se pot distinge două tipuri de serii:
a) O serie genetică în care alcalii acționează ca bază. Această serie poate fi reprezentată utilizând următoarele transformări:
metal → oxid de bază → alcalin → sare
de exemplu, seria genetică de potasiu K → K
2 O → KOH → KCIb) Seria genetică, în care baza este o bază insolubilă, atunci seria poate fi reprezentată ca un lanț de transformări:
metal → oxid de bază → sare → bază insolubilă → oxid de bază → metal
de exemplu: Cu → CuO → CuCI
2 → Cu (OH) 2 → CuO - CuPrintre nemetale se pot distinge două tipuri de rânduri:
a) Seria genetică a nemetalelor, în care acidul solubil acționează ca o legătură în serie. Lanțul transformărilor poate fi reprezentat după cum urmează: nemetal → acid acid → acid solubil → sare.
De exemplu: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) rândul genetic de nemetale, în care acidul insolubil: nemetalic → oxid acid → sare → acid → acid acid → nemetal acționează ca o legătură în seria
De exemplu: Si → SiO
2 → Na 2 dioxid de siliciu 3 → H 2 dioxid de siliciu 3 → SiO 2 → SiExecutarea sarcinilor pentru opțiuni:
1. Alegeți formulele de oxid din versiunea dvs., explicați-vă alegerea, bazată pe cunoașterea caracteristicilor compoziției acestei clase de compuși. Sună-i.
2. În coloana formulă a variantei dvs., găsiți formulele de acid și explicați-vă alegerea pe baza analizei compoziției acestor compuși.
3. Determinați valențele reziduurilor acide din compoziția acidă.
4. Selectați formule de sare și denumiți-le.
5. Completați formulele de săruri care pot fi formate cu magneziu și acizi din varianta dumneavoastră. Scrie-le jos, numeste-le.
6. În coloana formulă a variației dvs., găsiți formulele de bază și explicați alegerea dvs. pe baza analizei compoziției acestor compuși.
7. În varianta dvs., alegeți formulele de substanțe cu care poate reacționa o soluție de acid ortofosforic (clorhidric, sulfuric). Faceți ecuațiile de reacție corespunzătoare.
9. Între formulele opțiunii dvs., selectați formule de substanțe care pot interacționa între ele. Faceți ecuațiile de reacție corespunzătoare.
10. Faceți un lanț de legături genetice de compuși anorganici, care vor include o substanță, a cărei formulă este dată în versiunea dumneavoastră la numărul unu.
Opțiunea 1
Opțiunea 2
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
LiOH
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaCl
2HCI
H
2 CO 3H
2 SO 4CuSO
4Din aceste substanțe face o linie genetică folosind toate formulele. Scrieți ecuațiile de reacție cu care puteți realiza acest lanț de transformări:
I opțiune: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opțiune:na 2 SO 4, NaOH, na, na 2 O 2 , na 2 O4) Fixare1.
Al→ Al 2 O 3 → AICb 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu - CuO - CuCI
2 → Cu (OH) 2 → CuO - Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Temă la domiciliu:
schimba o trecere treptată de la calciu la carbonat de calciu și pregătește un raport privind utilizarea oricărei săruri în medicină (folosind literatura suplimentară).

Printre metale se pot distinge două tipuri de rânduri: 1. Serii genetice, în care alcalii acționează ca bază. Această serie poate fi reprezentată de următoarele transformări: metal - oxid de bază - sare alcalină, de exemplu, seria genetică de potasiu K - K 2 O - KOH - KCl.

2. O serie genetică, în care o bază insolubilă acționează ca bază, apoi seria poate fi reprezentată ca un lanț de transformări: metal - oxid bazic - bază insolubilă în sare - oxid de bază - metal. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu serii genetice de cupru "Cu este o serie genetică de cupru"\u003e "title =" (! LANG: 2. Seria genetică, unde baza este o bază insolubilă, apoi seria poate fi reprezentată ca un lanț al transformărilor: bază de metal - oxid - baza insolubilă în sare - oxidul principal este metalul. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. O serie genetică, în care o bază insolubilă acționează ca bază, apoi seria poate fi reprezentată ca un lanț de transformări: metal - oxid bazic - bază insolubilă în sare - oxid de bază - metal. Cu - CuO - CuCI2 - Cu (OH) 2 - CuO -\u003e"> !}
Printre nemetale se pot distinge două tipuri de rânduri: 1. Seria genetică de nemetale, în care acidul solubil acționează ca o legătură în serie. Lanțul transformărilor poate fi reprezentat după cum urmează: acid nemodificat - oxid acid - acid solubil - -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Domeniul genetic al fosforului

Există o legătură genetică între clasele de compuși anorganici. Din substanțe simple puteți obține complex și invers. Din compușii unei clase, puteți obține compuși dintr-o altă clasă.
Relația genetică simplificată între clasele de compuși anorganici poate fi reprezentată de următoarea schemă:
Secvența unor astfel de transformări pentru nemetale poate fi reprezentată prin următoarea schemă: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Pentru metalele tipice puteți face următorul lanț de transformări:
Ba → BaO → Ba (OH) 2 → BaS04
Pentru metalele ale căror oxizi și hidroxizi sunt amfometrice (semimetale) se pot efectua următoarele transformări:
Al → Al2O3 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al 2 O 3.
Legături între clase:
1. Metale, nemetale→ sare.
Cu interacțiunea directă dintre metale și nemetale, se formează săruri ale acizilor fără oxigen (halogenuri, sulfuri):
2Na + C1 2 = 2NaCl
Acești compuși sunt stabili și nu se descompun atunci când sunt încălziți.
2. Oxizi de bază, oxizi de acizi→ sare.
CaO + C02 = CaC03;
Na20 + SO3 = Na2S04.
3. Baze, acizi→ sare.
Se efectuează printr-o reacție de neutralizare:
2NaOH + H2S04 = Na2S04 + 2H20,
HE - + H + → H20;
Mg (OH) 2 + 2HCI = MgCl2 + 2H20,
Mg (OH) 2 + 2H + - Mg2 + + 2H20.
4. Metale→ oxizi de bază.
Majoritatea metalelor interacționează cu oxigenul pentru a forma oxizi:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A1 2 O3.
Aurul, argintul, platina și alte metale nobile nu interacționează cu oxigenul, oxizii unor astfel de metale sunt obținuți indirect.
5. nemetale→ acid oxizi.
Nemetalele (cu excepția halogentelor și gazelor nobile) interacționează cu oxigenul, formând oxizi:
4P + 5O2 = 2P205;
S + O2 = S02.
6. Oxizi de bază→ de bază.
Interacțiunea directă cu apa poate fi obținută numai din hidroxizi ai metalelor alcaline și alcalino-pământoase (alcaline):
Na20 + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
Motivele rămase sunt obținute indirect.
7. Oxizi acide→ Acid.
Acidul oxizi reacționează cu apă pentru a forma acizii corespunzători:
SO3 + H20 = H2S04;
P205 + 3H20 = 2H3P04.
Excepția este SiO 2, care nu reacționează cu apa.
8. Baze, oxizi de acizi→ sare.
Alcalinele interacționează cu oxizi acide pentru a forma săruri:
2NaOH + SO3 = Na2S04 + H20,
2OH - + SO3 = SO4 2 + H20;
Ca (OH) 2 + CO 2 = CaC03 ↓ + H20,
Ca 2+ + 2OH - + CO 2 -\u003e CaCO 3 ↓ + H 2 O.
9. Acide, oxizi de bază→ sare.
Oxizii metalici se dizolvă în acizi, formând săruri:
CuO + H2S04 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HS1 = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Motive→ oxizi de bază.
Bazele insolubile și LiOH se descompun atunci când sunt încălzite:
2LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Acizi→ acid oxizi.
Unii acizi care conțin oxigen instabili se descompun atunci când sunt încălziți (H 2 SiO 3) și chiar fără încălzire (H 2 CO 3, HCIO). În același timp, un număr de acizi sunt rezistenți la încălzire (H 2 SO 4, H 3 PO 4).
H2Si03 = H20 + Si02;
H 2 CO 3 = H 2 O + C02.
12. Oxizi de metale→ metale.
Unele oxizi de metale grele se pot descompune la metal și oxigen:
2HgO = 2Hg + 02.
De asemenea, metalele sunt obținute din oxizii corespunzători cu ajutorul agenților reducători:
3MnO2 + 4Al = 3Mn + 2Al2O3;
Fe2O3 + 3H2 = 2Fe + 3H20.
13. Oxizi de acid→ nemetale.
Majoritatea oxizilor nemetalici nu se descompun atunci când sunt încălziți. Non-metal și oxigen descompun doar unele oxizi instabili (oxizi de halogen).
Unele nemetale sunt obținute prin reducerea de la oxizii corespunzători:
Si02 + 2Mg = 2MgO + Si.
14. Săruri, baze → baze.
Bazele insolubile sunt obținute prin acțiunea alcalinilor pe soluțiile de acizi corespunzători:
CuSO4 + 2NaOH = Cu (OH) 2 ↓ + Na2S04,
Cu2 + + 2OH - → Cu (OH) 2 ↓;
FeCI2 + 2KOH = Fe (OH) 2 ↓ + 2 KCI,
Fe2 + + 2OH - = Fe (OH) 2 ↓.
15. Săruri, acizi → acizi.
Sărurile solubile reacționează cu acizii (în conformitate cu seriile de presiune) dacă rezultatul este acid slab sau volatil:
Na2Si03 + 2HCI = 2NaCI + H2Si03 ↓,
SiO3 2 + 2H + H 2 SiO 3 ↓;
NaCI (s) + H2S04 (k) = NaHS04 + HCI.
16. Sare→ oxizi de bază, oxizi de acizi.
Sărurile unor acizi care conțin oxigen (nitrați, carbonați) se descompun atunci când sunt încălzite:
CaCO3 = CaO + C02;
2Cu (N03) 2 = 2CuO + 4NO2 + 02.
EXERCIȚIILE PENTRU LUCRĂRI INDEPENDENTE PE TEMA "CONEXIUNEA GENETICĂ ÎNTRE CLASELE COMPUȘILOR ANORGANICE"
1. Denumiți substanțele enumerate mai jos, distribuiți-le în clasele de compuși anorganici: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O7, Fe (OH) 2, P205, HF, Mn02.
2. Din ce substanțe enumerate mai jos este posibil să se obțină într-o singură etapă hidroxid (acid sau bază): oxid de fier (P), oxid de bariu, oxid de bariu, oxid de azot (V), oxid de siliciu, , potasiu, carbonat de magneziu.
3. Din lista de mai sus notați formulele de substanțe legate de: 1) oxizi; 2) motivele; 3) acizi; 4) săruri:
C02, NaOH, HCI, S03, CuS04, NaN03, KCI, H2S04, Ca (OH) 2, P205, HN03, Al (OH) 3.
4. Denumiți substanțele: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba ) 2, CO, HI. Indicați la ce clasă aparțin fiecare substanță.
5. Scrieți formulele moleculare ale următoarelor substanțe și indicați din ce clasă aparțin fiecare substanță:
1) hidroxicarbonat de cupru (II);
2) oxid de azot (V);
3) hidroxid de nichel (II);
4) acid fosfat de bariu;
5) acid percloric;
6) hidroxid de crom (III);
7) clorat de potasiu;
8) acidul hidrogen sulfurat;
9) zincat de sodiu.
6. Dați exemple de reacții ale legăturii dintre:
1) substanțe simple-nemetale;
2) substanță și oxid simplu;
3) oxizi;
4) substanțe complexe care nu sunt oxizi;
5) metal și nemetal;
6) trei substanțe.
7. Care dintre următoarele substanțe poate reacționa:
1) monoxid de carbon (IV): HCI, 02, N02, KOH, H20;
2) oxid de magneziu: Ba (OH) 2, HCI, C02, 02, HN03;
3) hidroxid de fier (II): KCI, HCI, KOH, 02, H20, HNO3;
4) acid clorhidric: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Este posibilă interacțiunea dintre următoarele substanțe?
1) monoxid de carbon (IV) și hidroxid de potasiu;
2) hidrosulfat de potasiu și hidroxid de calciu;
3) fosfat de calciu și acid sulfuric;
4) hidroxid de calciu și oxid de sulf (IV);
5) acid sulfuric și hidroxid de potasiu;
6) bicarbonat de calciu și acid fosforic;
7) silice și acid sulfuric;
8) oxid de zinc și oxid de fosfor (V).
Scrieți ecuațiile reacțiilor posibile, specificați condițiile în care acestea apar. Dacă reacțiile pot duce la diferite substanțe, atunci indicați ce diferență în condițiile de punere în aplicare a acestora.
9. Dați ecuațiile reacțiilor pentru obținerea următoarelor substanțe: ortofosfat de sodiu (4 căi), sulfat de potasiu (7 căi), hidroxid de zinc.
10. Una dintre metodele de producere a sodei (carbonat de sodiu) este acțiunea apei și a monoxidului de carbon (IV) asupra aluminatului de sodiu. Realizați ecuațiile de reacție.
11. Schimbarea coeficienților, scrierea produselor de reacție:
1) MgO + 2H2S04-
2) 2S02 + Ba (OH) 2-
3) 3N2O5 + 2Al (OH) 3-
4) P205 + 4NaOH →
5) P205 + 6NaOH →
6) P2O5 + 2NaOH →
12. Faceți ecuațiile de reacție pentru a primi diferite tipuri de săruri:
1) SO2 + Ba (OH) 2 (săruri medii și acide),
2) A1 2O 3 + H 2 O + HNO 3 (sare medie, săruri bazice),
3) Na2O + H2S (mediu și săruri acide),
4) S03 + Sa (OH) 2 (săruri medii și bazice),
5) CaO + H20 + P205- (sare bazică, săruri acide).
13. Completați ecuațiile de reacție:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr2O3 + H2S04 → AlOHSO4 + NaOH →
Cr2O3 + NaOH → CaC03 + C02 + H20
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCI →
Mn2O7 + KOH → ZnS + H2S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCI →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H 2 SO 4 (insuficient) →
AlCl 3 + NaOH (deficit) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (exces) →
AlCl3 + NaOH (exces) → Ca (AI02) 2 + HCI (exces) →
14. Scrieți ecuațiile de reacție cu care puteți efectua următoarele transformări:
1) Cu - CuO - CuSO4 - Cu (OH) 2 - CuCl2 - Cu (NO3) 2
2) Zn → ZnO → ZnS04 → Zn (OH) 2 → Na2ZnO2 → ZnCl2
3) Р → Р 2 О 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg - MgO - MgCl2 - Mg (OH) 2 - Mg (HSO4) 2 - MgS04
5) Ca → CaO → Ca (OH) 2 → CaC03 → Ca (HCO3) 2 → C02
6) Cr → Cr2 (SO4) 3 → Cr (OH) 3 → NaCrO2 → Cr2O3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS - CuO - CuSO4 - Cu (OH) 2 - CuO - Cu
9) Al → Al2O3 → Al2 (SO4) 3 → Al (HSO4) 3 → Al (OH) 3 → K
10) S → SO2 → SO3 → NaHSO4 → Na2S04 → BaS04
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnS04 → ZnCI2 → Zn (OH) 2 → Na2 → Zn (N03) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO3) 2 → Ca (NO3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO3) 2
15) CuO - CuCl2 - Cu (NO3) 2 - CuO - CuSO4 - Cu
16) CaO → Ca (OH) 2 → Ca (NO3) 2 → Ca (NO2) 2 → HNO2 → NaNO2
17) MgO - MgS04 - MgCI2 - Mg (NO3) 2 - Mg (OH) 2 - MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaS04
21) PbO → Pb (NO3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnS04 → Zn (OH) 2 → Na2ZnO2 → Zn (OH) 2 → K 2
23) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnS04 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO3) 2
25) AlCl3 → Al (NO3) 3 → Al (OH) 3 → NaAlO 2 → AlCl 3 → Al
26) Pb (NO3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2SO 4 → KCI → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO3) 2 → CuS04 → CuCI2 → Cu (NO3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCI2 → Ca (NO3) 2 → CaSO4
31) Cu → Cu (NO3) 2 → Cu (OH) 2 → CuSO4 → Al2 (SO4) 3 → A1C1 3
32) Mg - MgS04 - MgCl2 - MgOH - Mg (OH) 2 - MgOHNO3
33) CuS04 → CuCI2 → ZnCI2 → Zn (OH) 2 → Na2Zn02 → Zn (OH) 2
34) Hg (N03) 2 - Al (NO3) 3 - Al2O3 - NaAl02 - Al (OH) 3 - AlOHCI2
35) ZnS04 → Zn (OH) 2 → ZnCl2 → AlCl3 → Al (OH) 3 → Al203
36) CuCI2 → Cu (OH) 2 → CuS04 → ZnS04 → Zn (OH) 2 → Na2ZnO2
37) Fe (NO3) 3 → FeOH (NO3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO3) 3 → Fe
38) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 - MgS04 - MgCl2 - Mg (NO3) 2 - Mg (OH) 2 - MgO
40) sulfat de aluminiu → clorură de aluminiu → nitrat de aluminiu → oxid de aluminiu → aluminat de potasiu → hidroxid de aluminiu → hidroxid de aluminiu → clorură de aluminiu.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO3 - Ba (HCO3) 2 - BaCO3 - (BaOH) 2C03 - BaO - BaS04
43) Cu - CuSO 4 - (CuOH) 2SO 4 - Cu (OH) 2 - Cu (HSO 4) 2 - CuSO 4
44) bariu → hidroxid de bariu → bicarbonat de bariu → clorură de bariu → carbonat de bariu → clorură de bariu → hidroxid de bariu
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr2O3 → CrCl3 → Cr (OH) 3 → Na3 → Cr2 (SO4) 3 → CrCl3
48) K → KOH → KCI → KOH → K 2SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) C → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S - S02 - K2SO3 - KHSO3 - K2SO3
53) Cu - Cu (OH) 2 - Cu (NO3) 2 - CuO - Cu
54) P 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe - FeCl2 - Fe (OH) 2 - FeSO4 - Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO3) 2 → ZnO
57) CuS → S02 → KHSO3 → CaSO3 → SO2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHC03 - Na2C03 - NaCI - NaHS04 - Na2S04
62) K → KOH → KCI → KNO3 → K2S04 → KCI
63) NaCI → Na → NaOH → Na2S04 → NaCI
64) Al-\u003e AlCl3 → Al (OH) 3 → Al2O3 → Al (OH) 3
65) CuO -\u003e Cu - CuCl2 - CuS04 - CuS
66) Fe - FeSO4 - Fe (OH) 2 - Fe - Fe (OH) 3
67) Fe - Fe (OH) 2 - FeCl2 - Fe (NO3) 2 - Fe
68) Fe (NO3) 3 → Fe2O3 → FeCl3 → Fe (NO3) 3 → Fe
69) CuO - CuS04 - Cu (OH) 2 - CuO - Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (N03) 2
71) Mg - Mg (OH) 2 - MgS04 - MgC03 - Mg (HCO3) 2
72) CaO → Ca (OH) 2 → CaCI2 → CaCO3 → C02
73) CaCO3 → Ca (HCO3) 2 → CaCl2 → Ca (NO3) 2 → O2
74) FeS → Fe2O3 → Fe (OH) 3 → Fe2 (SO4) 3 → FeCl3
75) KS1 → K2S04 → KOH → K2C03 → KOH
76) CuS - CuO - Cu (OH) 2 - CuS04 - Cu
77) Fe - Fe (OH) 3 - Fe (NO3) 3 - FeCl3 - Fe2 (SO4) 3
78) CuSO4 -\u003e CuO - Cu (NO3) 2 - CuO - CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al - Al (OH) 3 - A1 2 (SO 4) 3 - A1 2 O 3 → Al (OH) 3
81) CaCI2 → CaCO3 → Ca (HCO3) 2 → CaCO3 → CaSiO3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCI → HCI → CaCI2 → Ca (NO3) 2
84) Na2S03-\u003e SO2 → H2S04 → HCI → FeCl2
85) C → Na2CO3 → CaCO3 → CaSiO3 → H2SiO3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCI → CuCI2 → Cl2 → HCI → H2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4Ci → NH3 · H20-\u003e NH4HCO3 → NH3
91) NH4Ci -\u003e KCI -\u003e HCI -\u003e CuCI2 - Cu (OH) 2
92) NH3 - NH4H2P04 - (NH4) 2HP04 - NH3 - NH4N03
93) KOH → KHCO3 → K2CO3 → CO2 → Ca (HCO3) 2
94) Na - NaOH - NaHC03 - Na2S04 - NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KCI → K 2SO 4 → KNO 3 → KHSO 4
97) FeSO4 → FeS → SO2 → KHSO3 → K2S04
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO3 → CaSiO3 → Ca (NO3) 2 → O 2
102) Cu - Cu (OH) 2 - Cu - CuS04 - CuCI2
103) H 2 S → SO 2 → ZnS04 → ZnS → ZnO
104) Cl2 → NaCI → HCI → CuCI2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnS04 → Zn (NO3) 2 → ZnO → Zn (OH) 2
109) H3P04 - NH4H2P04 - (NH4) 2HP04 - Na3P04 - Ca3 (PO4) 2
110) CaC03 - Na2C03 - Na3P04 - NaH2P04 - Ca3 (PO4) 2
111) CaCl2 → CaSO3 → Ca (OH) 2 → CaCI2 → Ca (NO3) 2
112) NaOH - Na2C03 - NaHS04 - NaN03 - NaHS04
113) Na2Si03 → Na2C03 → Na2S04 → NaCI → Na2S04
114) KNO 3 - KHSO 4 - K 2 SO 4 - KCl - Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCI2 → Cu (NO3) 2 → N02 → HNO3
117) Ca (NO3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuS04 → Cu - CuS - CuO - CuCI2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO3) 3
121) S - S03 - H 2 SO 4 - KHSO 4 - BaS 4
122) N2O5 → HNO3 → Cu (NO3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCI2
125) NH3 · H20 - NH4 C1 - NH3 - NH4 HCO3 - (NH4) 2CO3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO2 → Ca (HSO3) 2 → CaCI2 → Ca (OH) 2 → Ca (HCO3) 2
128) NH 3 · H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 - Fe - FeCl3 - Fe (NO3) 3 - Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na2Zn02 → Zn
132) Zn → ZnO → Na2ZnO2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K2 ZnO2 → ZnS04 → K2 → Zn (NO3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → AlCl 3 → Al (OH) 3
137) Al2O3 → KAlO2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Fie → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EXPERIENȚELE EXPERIMENTALE PRIVIND SUBIECTUL "CLASELE DE BAZĂ A COMPUȘILOR ANORGANICE"
EXPERIENTA 1.Reacții de neutralizare.
a) Interacțiunea dintre un acid puternic și o bază puternică.
Se toarnă 5 ml de soluție de acid clorhidric 2N într-o placă de porțelan și se adaugă, prin picurare, 2 n soluție de hidroxid de sodiu. Se amestecă soluția cu o tijă de sticlă și se testează efectul asupra lamei, transferând o picătură de soluție în testul de turnătorie. Este necesar să se realizeze o reacție neutră (hârtia albastră și roșie nu își schimbă culoarea). Se evaporă soluția rezultată până la uscare. Ce sa format? Scrieți ecuațiile reacției moleculare și ionice.
b) Interacțiunea dintre un acid slab și o bază puternică.
Se toarnă într-o eprubetă 2 ml de soluție 2N de alcalină și se adaugă o soluție de acid acetic până când soluția este neutră. Scrieți ecuațiile reacției moleculare și ionice. Explicați de ce reacția ionică de echilibru, în care participă un electrolit slab (acid acetic), se îndreaptă către formarea moleculelor de apă.
EXPERIENTA 2. Hidroxizi amfoterici.
Din reactivii disponibili în laborator, se obține un precipitat de hidroxid de zinc. Se agită precipitatul obținut și se toarnă mici cantități în 2 tuburi. Într-una din tuburi se adaugă o soluție de acid clorhidric, în cealaltă - o soluție de hidroxid de sodiu (exces). Ce se observă? Scrieți ecuațiile reacțiilor corespunzătoare în formă moleculară și ionică.
EXPERIENTA 3.Proprietăți chimice ale sărurilor.
a) Interacțiunea soluțiilor de sare cu formarea unei substanțe puțin solubile.
Se toarnă 2 ml de soluție de carbonat de sodiu în tub și se adaugă soluție de clorură de bariu până când apare un precipitat alb. Scrieți ecuația reacției chimice în formă ionică și moleculară. Precipitatul este împărțit în două părți. Se toarnă soluția de acid sulfuric într-una din tuburi, iar hidroxidul de sodiu în cealaltă. Faceți o concluzie cu privire la solubilitatea precipitatului în acizi și baze.
b) Interacțiunea soluției de sare cu acizi pentru a forma un compus volatil.
Se toarnă 2 ml de soluție de carbonat de sodiu în tub și se adaugă un volum mic de soluție de acid clorhidric. Ce se observă? Scrieți ecuațiile reacției chimice în formă ionică și moleculară.
c) interacțiunea soluțiilor de sare cu alcalii cu formarea unui compus volatil.
Se toarnă o soluție mică de sare de amoniu în tub, se adaugă 1-2 ml de soluție de hidroxid de sodiu și se încălzește la fierbere. Într-un tub de testare cu amestecul de reacție pentru a face un test de litmus roșu umed. Ce se observă? Oferiți o explicație. Scrieți ecuațiile de reacție.
g ) Interacțiunile sărurilor cu metale mai active decât metalul care face parte din sare.
Curățați unghiul de fier (oțel) cu un șmirghel fin. Apoi, dip-o în soluție de sulfat de cupru. După ceva timp, observați eliberarea de cupru pe suprafața unghiei. Scrieți ecuația reacției corespunzătoare în formă ionică și moleculară.
EXPERIENTA 4.Obținerea de săruri de bază și acide.
a) Prepararea hidroxicarbonatului de plumb.
Se adaugă un pic de oxid de plumb (II) la soluția de acetat de plumb (II) și se fierbe amestecul timp de câteva minute. Soluția răcită este drenată din precipitat și un curent de dioxid de carbon este trecut prin ea. Ce se observă? Se filtrează precipitatul și se usucă între foile de hârtie de filtru. Se indică culoarea și natura precipitatului rezultat de hidroxicarbonat de plumb. Scrieți ecuațiile de reacție. Faceți o formulă grafică a sarei obținute.
b) Prepararea bicarbonatului de magneziu.
La o soluție foarte diluată de sare de magneziu se adaugă o mică soluție de carbonat de sodiu. Ce substanță precipită? Soluție saturată cu precipitat cu dioxid de carbon. Observați dizolvarea treptată a precipitatului. De ce se întâmplă acest lucru? Scrieți ecuațiile de reacție.
EXPERIENTA 5.Obținerea de săruri complexe.
a) Formarea compușilor cu cationi complexe.
Se adaugă o soluție de amoniac prin picurare într-un tub cu 2-3 ml de soluție de clorură de cupru (II) până când se formează un precipitat de hidroxid de cupru (II) și apoi se adaugă un exces de soluție de amoniac pentru a dizolva precipitatul. Comparați culoarea ionilor Cu 2+ cu culoarea soluției rezultate. Ce ioni sunt prezente în soluție? Scrieți ecuația de reacție pentru obținerea unui compus complex.
b) Formarea compușilor cu un anion complex.
La o soluție de azotat de mercur (II) de 1-2 ml se adaugă, în picături, o soluție diluată de iodură de potasiu pentru a forma un precipitat de HgI2. Apoi, se toarnă un exces de soluție de iodură de potasiu până când precipitatul se dizolvă. Scrieți reacțiile de obținere a unei sări complexe.
EXPERIENTA 6.Prepararea sărurilor duble (aluminiu de potasiu).
Se cântăresc 7,5 g de Al2 (SO4) 3,18H2O și se dizolvă în 50 ml de apă, luând un vas de porțelan suficient de mare pentru acest scop. Se calculează ecuația de reacție și se cântărește masa de sulfat de potasiu necesară pentru reacție. Se prepară o soluție fierbinte saturată de sulfat de potasiu și se toarnă într-un vas de porțelan cu o soluție de sulfat de aluminiu cu agitare. Observați după un timp precipitarea cristalelor de aluminiu de potasiu. După răcire și cristalizare, se toarnă lichidul mamă, se usucă cristalele de aluminiu între foile de hârtie de filtru și se cântăresc cristalele rezultate. Calculați procentajul de randament.
SARCINI DE SARCINI
1. Prin trecerea unui exces de hidrogen sulfurat prin 16 g de soluție de sulfat de cupru (II) s-au obținut 1,92 g de precipitat. Găsiți fracția de masă a sulfatului de cupru în soluția utilizată și volumul de hidrogen sulfurat consumat.
2. Pentru precipitarea completă a cuprului sub formă de sulfură din 291 cm3 de soluție de sulfat de cupru (II) cu o fracție de masă de 10%, s-a utilizat gaz obținut prin reacția a 17,6 g de sulfură de fier (II) cu un exces de acid clorhidric. Găsiți densitatea soluției inițiale de sulfat de cupru.
3. Gazul eliberat în timpul interacțiunii soluției K2S cu acid sulfuric diluat este trecut printr-un exces de soluție de nitrat de plumb (II). Precipitatul rezultat are o masă de 71,7 g. Găsiți volumul soluției reacționate de acid sulfuric, dacă densitatea sa este de 1,176 g / cm3, iar fracția de masă este de 25%.
4. La o soluție conținând 8 g de sulfat de cupru (II) s-a adăugat o soluție conținând 4,68 g de sulfură de sodiu. Precipitatul a fost filtrat, filtratul a fost evaporat. Determinați masa substanțelor din filtrat după evaporare și masa precipitatului de sulfură de cupru.
5. O parte din sulfura de fier (II) a fost tratată cu un exces de acid clorhidric. Gazul rezultat în reacție cu 12,5 cm3 soluție de NaOH cu o fracție de masă de 25% și o densitate de 1,28 g / cm3 a format o sare acidă. Găsiți masa sulfurii de fier originale.
6. Sulfura de fier (II) cântărind 176 g a fost tratată cu un exces de acid clorhidric și gazul rezultat a fost ars în exces de aer. Ce volum de soluție KOH cu o fracție de masă de 40% și o densitate de 1,4 g / cm3 este necesar pentru a neutraliza complet gazul produs în timpul arderii?
7. La prăjirea a 100 g de pirită tehnică, se obține un gaz neutralizat complet cu 400 cm3 soluție de NaOH cu o fracție de masă de 25% și o densitate de 1,28 g / cm3. Determinați fracțiunea de masă a impurităților în pirită.
8. La 2 g de amestec de fier, oxid de fier (II) și oxid de fier (III) s-au adăugat 16 cm3 soluție HCI cu o fracție de masă de 20% și o densitate de 1,09 g / cm3. Pentru a neutraliza excesul de acid, a fost nevoie de 10,8 cm3 de soluție de NaOH cu o fracție de masă de 10% densitate de 1,05 g / cm3. Găsiți masele substanțelor din amestec dacă volumul de hidrogen eliberat este de 224 cm3 (NU).
9. Există un amestec de Ca (OH) 2, CaC03 și BaS04 cu o masă de 10,5 g. Când amestecul a fost tratat cu un exces de acid clorhidric, s-au eliberat 672 cm3 (UI) de gaz și s-au reacționat 71,2 g de acid cu o masă pondere de 10%. Determinați masa substanțelor din amestec.
10. Există un amestec de clorură de bariu, carbonat de calciu și bicarbonat de sodiu. Când se dizolvă 10 g din acest amestec în apă, reziduul insolubil este egal cu 3,5 g. Când se calcinează 20 g din amestecul inițial, masa se scade cu 5,2 g. Se găsesc fracțiile de masă ale substanțelor din amestecul inițial.
11. Există o soluție care conține atât acid sulfuric, cât și acid azotic. Pentru a neutraliza complet 10 g din această soluție, se consumă 12,5 cm3 de soluție KOH cu o fracție de masă de 19% și o densitate de 1,18 g / cm3. Când se adaugă un exces de clorură de bariu la 20 g din același amestec de soluție acidă, se scot 4,66 g de precipitat. Găsiți fracțiile de masă ale acizilor din amestec.
12. Toți acidul clorhidric obținut din 100 g dintr-un amestec de KCI și KNO3 au fost dizolvați în 71,8 cm3 de apă. Când se calcinează 100 g din același amestec de săruri, rămân 93,6 g de reziduu solid. Găsiți fracția de masă de acid clorhidric în apă.
13. Prin trecerea a 2 m 3 de aer (NU) printr-o soluție de Ca (OH) 2, s-au obținut 3 g de precipitat de sare de acid carbonic. Găsiți volumul și fracțiunea de masă a CO 2 în aer.
14. Dioxidul de carbon este trecut printr-o suspensie care conține 50 g CaC03. Reacția a dus la 8,96 dm 3 gaz (NU). Care este masa de CaCO 3 rămasă în faza solidă?
15. Atunci când se adaugă apă la CaO, masa sa a crescut cu 30%. Ce parte din CaO (în masă%) a fost stinsă?
16. Oxidul de plumb (II) cântărind 18,47 g a fost încălzit într-un curent de hidrogen. După reacție, masa plumbului rezultat și oxidul nereacționat au fost de 18,07 g. Care este masa de oxid de plumb care nu a reacționat?
17. Monoxidul de carbon este trecut prin oxidul de fier (III) atunci când este încălzit. Masa reziduului solid după reacție este de 2 g mai mică decât masa inițială de oxid de fier. Ce volum de CO a făcut reacția (este oxidul redus complet)?
18. Există 8,96 dm3 (NU) dintr-un amestec de N2, CO2 și SO2 cu o densitate relativă de hidrogen 25. După trecerea printr-un exces de soluție de KOH, volumul amestecului a scăzut de 4 ori. Găsiți cantitățile de gaze din amestecul original.
19. În două pahare există 100 g de soluție HCI cu o fracție de masă de 2,5%. Într-un singur pahar s-au adăugat 10 g CaC03, în cealaltă - 8,4 g de MgCO3. Cum va diferi masa de ochelari dupa reactie?
20. Ce volum (NU) de dioxid de sulf trebuie trecut prin 200 cm3 dintr-o soluție cu o fracțiune de masă 0,1% NaOH și o densitate de 1 g / cm3 pentru a obține o sare acidă?
21. Care este cantitatea maximă (dioxid de carbon) de dioxid de carbon care poate absorbi 25 cm3 dintr-o soluție cu o fracție de masă 25% NaOH și o densitate de 1,1 g / cm3?
22. Care este volumul minim al soluției cu o fracțiune de masă de 20% KOH și o densitate de 1,19 g / cm3 care poate absorbi tot dioxidul de carbon produs cu reducerea completă a 23,2 g magnetit cu monoxid de carbon?
23. Care este masa minimă de KOH care trebuie să reacționeze cu 24,5 g de acid ortofosforic, astfel încât numai produsul fosfat de potasiu dihidrogenat?
24. Care este masa minimă de Ca (OH) 2 pentru a se adăuga la 16 g de soluție de bicarbonat de calciu cu o fracție de masă de 5% sare pentru a obține o sare medie?
25. Ce masă de fosfat acid de potasiu trebuie adăugată la o soluție care conține 12,25 g de H3PO4 astfel încât soluția să conțină numai fosfat de potasiu dihidrogenat?
26. Soluția conține 56,1 g dintr-un amestec de carbonați de calciu și magneziu în suspensie. Pentru a le transforma în hidrocarburi, ei au cheltuit tot dioxidul de carbon produs prin arderea a 7 dm3 (NU) de etan. Găsiți masa de carbonat de calciu din amestecul inițial.
27. Pentru a converti 9,5 g dintr-un amestec de fosfat de hidrogen și dihidrogen sodic într-o sare medie, este necesară o cantitate de 10 cm3 dintr-o soluție cu o fracție de masă de NaOH de 27,7% și o densitate de 1,3 g / cm3. Găsiți masa de fosfat acid în amestec.
28. Prin trecerea dioxidului de carbon printr-o soluție conținând 6 g de NaOH, s-au obținut 9,5 g dintr-un amestec de săruri de acid și mediu. Găsiți cantitatea de dioxid de carbon consumată.
După trecerea a 11,2 dm 3 (NU) C02 prin soluția KOH s-au obținut 57,6 g dintr-un amestec de săruri de acid și mediu. Găsiți masa de sare medie.
30. Ce masă de acid ortofosforic trebuie neutralizată pentru a se obține 1,2 g dihidro- și 4,26 g fosfat acid de sodiu?
31. La soluția de acid sulfuric s-a adăugat NaOH pentru a se obține 3,6 g de hidro-sulfat și 2,84 g de sulfat de sodiu. Determinați cantitățile chimice de acid și de alcalii care au reacționat.
32. După trecerea acidului clorhidric în 200 cm3 de soluție de NaOH cu o fracție de masă de 10% și o densitate de 1,1 g / cm3, fracția de masă de NaOH din soluția rezultată a scăzut la jumătate. Se determină fracția de masă de NaCl din soluția rezultată.
33. Dizolvarea a 14,4 g dintr-un amestec de cupru și oxidul său (II) a consumat 48,5 g dintr-o soluție cu o fracție de masă HNO3 de 80%. Găsiți fracțiunile de masă de cupru și oxid din amestecul inițial.
34. Masa de oxid de sodiu de 6,2 g s-a dizolvat în 100 cm3 de apă și s-a obținut soluția nr. 1. Apoi s-a adăugat acid clorhidric cu o fracție de masă de 10% până când mediul a devenit neutru și s-a obținut soluția nr. :
1) fracțiile de masă ale substanțelor din soluțiile nr. 1, 2;
2) masa soluției de HC1, care a dus la neutralizarea soluției numărul 1.
35. 3 g de zinc interacționează cu 18,69 cm3 soluție de HCI cu o fracție de masă de 14,6% și o densitate de 1,07 g / cm3. Când este încălzit, gazul rezultat este trecut peste CuO fierbinte, cântărind 4 g. Care este masa cuprului obținută?
36. Gazul eliberat după tratarea hidrură de calciu cu exces de apă, ratat peste FeO. Ca rezultat, masa de oxid a scăzut cu 8 g. Găsiți masa de CaH2 tratată cu apă.
37. În timpul calcinării probei de CaCO 3, masa sa a scăzut cu 35,2%. Produsele de reacție solide au fost dizolvate într-un exces de acid clorhidric pentru a se obține 0,112 dm3 (NU) de gaz. Se determină masa probei originale de carbonat de calciu.
38. Nitratul de cupru a fost descompus și oxidul de cupru (II) rezultat a fost complet redus cu hidrogen. Produsele rezultate au trecut printr-un tub cu P205, iar masa tubului după aceea a crescut cu 3,6 g. Care este volumul minim de acid sulfuric cu o fracție de masă de 88% și o densitate de 1,87 g / cm3 necesară pentru dizolvarea obținută în experiment cupru și ce este masa de sare descompusă?
39. După absorbția oxidului de azot (IV) printr-un exces de soluție de KOH în frig în absența oxigenului, s-au obținut 40,4 g de KNO3. Ce substanță este încă formată și care este masa ei?
40. Pentru a neutraliza 400 g dintr-o soluție care conține clorhidrat și acid sulfuric, a consumat 287 cm3 de soluție de hidroxid de sodiu cu o fracție de masă de 10% și o densitate de 1,115 g / cm3. Dacă se adaugă o soluție în exces de clorură de bariu la 100 g din soluția inițială, se scade 5,825 g de precipitat. Determinați fracțiile de masă ale acizilor din soluția inițială.
41. După trecerea dioxidului de carbon printr-o soluție de hidroxid de sodiu, s-au obținut 13,7 g de amestec de săruri cu mediu și săruri acide. Pentru a le transforma în clorură de sodiu, sunt necesare 75 g de acid clorhidric cu o fracție de masă de HCI de 10%. Găsiți volumul de dioxid de carbon absorbit.
42. Un amestec de acizi clorhidric și sulfuric cu o masă totală de 600 g de soluție cu aceleași fracțiuni de masă de acizi a fost tratat cu un exces de bicarbonat de sodiu și s-a obținut 32,1 dm3 de gaz (N o). Găsiți fracțiunea de masă a acizilor din amestecul inițial.
43. Pentru a neutraliza 1 dm3 de soluție de NaOH, s-au consumat 66,66 cm3 de soluție HNO3 cu o fracție de masă de 63% și o densitate de 1,5 g / cm3. Ce volum de soluție de acid sulfuric cu o fracție de masă de 24,5% și o densitate de 1,2 g / cm3 ar fi necesar pentru neutralizarea aceleiași cantități de alcalii?
44. În ce raport de volum trebuie să luați o soluție de acid sulfuric cu o fracție de masă de 5% și o densitate de 1,03 g / cm3 și o soluție de hidroxid de bariu cu o fracție de masă de 5% și o densitate de 1,1 g / cm3 pentru neutralizare completă? Imaginați răspunsul ca fiind coeficientul volumului soluției alcaline pe soluția acidă.
45. Se calculează cantitatea minimă de soluție de amoniac la o densitate de 0,9 g / cm3 și o fracție de masă de 25%, care este necesară pentru absorbția completă a dioxidului de carbon produs prin descompunerea calcar natural de 0,5 kg, cu o fracție de masă de carbonat de calciu de 92%.
46. Pentru conversia completă a 2,92 g dintr-un amestec de hidroxid de sodiu și carbonat de sodiu în clorură este necesară 1,344 dm3 de acid clorhidric (NU). Găsiți masa de carbonat de sodiu în amestec.
47. La 25 g de soluție de sulfat de cupru (II) cu o fracție de masă de 16% s-a adăugat o cantitate de soluție de hidroxid de sodiu cu o fracție de masă de 16%. Precipitatul format a fost filtrat, după care filtratul a fost alcalin. Pentru a neutraliza complet filtratul, au fost necesare 25 cm3 dintr-o soluție de acid sulfuric cu o concentrație molară de 0,1 mol / dm3 a soluției. Se calculează masa soluției de hidroxid de sodiu adăugată.
48. Substanța obținută prin reducerea completă a CuO cu o masă de 15,8 g de hidrogen cu un volum de 11,2 dm3 (NU) a fost dizolvată prin încălzire în acid sulfuric concentrat. Care este volumul de gaz (NU) eliberat ca urmare a reacției?
49. Pentru neutralizarea completă a 50 cm3 de acid clorhidric cu o fracție masică de HCI de 20% și o densitate de 1,10 g / cm3, s-a utilizat o soluție de hidroxid de potasiu cu o fracție de masă de KOH de 20%. Care este cantitatea chimică de apă conținută în soluția rezultată?
50. Gazul obținut prin trecerea unui exces de CO2 peste 0,84 g cărbune fierbinte este trimis la reacție cu 14,0 g oxid de cupru încălzit. Ce volum de soluție de acid azotic cu o fracție de masă de 63% și o densitate de 1,4 g / cm3 este necesar pentru a dizolva complet substanța obținută în ultima reacție?
51. Când se calcinează până la greutatea constantă a azotatului de cupru (II), greutatea sării scade cu 6,5 g. Ce greutate de sare a fost descompusă?
52. Când s-a utilizat un exces de acid clorhidric, s-a eliberat 6,72 dm3 (NW) de gaz pe un amestec de aluminiu cu un metal monovalent necunoscut și masa amestecului a fost redusă la jumătate. Când se tratează reziduul cu acid azotic diluat, se eliberează 0,373 dm3 (NU) NO. Identificați metalul necunoscut.
53. Masa probei de cretă este de 105 g, iar cantitatea chimică a elementului oxigen din compoziția sa este de 1 mol. Se determină fracția de masă a CaCO3 din probele de cretă (oxigenul este inclus numai în compoziția carbonatului de calciu).
54. În interacțiunea oxidului de sulf (VI) cu apă, s-a obținut o soluție cu o fracție de masă de acid sulfuric de 25%. Când a fost adăugat un exces de Ba (OH) 2 la această soluție, a fost depus un precipitat de 29,13 g. Ce mase de SO3 și H20 au fost cheltuite pentru formarea unei soluții de acid?
55. Când s-a trecut SO2 prin 200 g dintr-o soluție cu o fracție de masă de NaOH de 16%, s-a format un amestec de săruri, incluzând 41,6 g de sare acidă. Care este masa de sulf conținând 4,5% impurități în greutate, a fost utilizată pentru a obține S02- Care este greutatea sarei medii?
56. Interacțiunea cu 80 g de soluție de Ca (N03) 2 a făcut 50 g de soluție de Na2C03. Precipitarea a fost separată, în timp ce se prelucrează cu un exces de acid clorhidric, s-a eliberat gaz de 2,24 dm3 (NU). Care sunt fracțiile de masă ale sărurilor în soluțiile inițiale? Care este fracția de masă a azotatului de sodiu din soluție după separarea precipitatului?
57. Când zincul interacționează cu acidul sulfuric, se formează 10 dm 3 (NU) dintr-un amestec de SO2 și H2S cu o densitate relativă de argon de 1,51. Care este cantitatea chimică de zinc dizolvată? Care este fracțiunea de masă a SO 2 în amestecul de gaze?
58. O probă dintr-un amestec de rumeguș de zinc și aluminiu cu o masă totală de 11 g a fost dizolvată într-un exces de soluție alcalină. Determinați volumul (NU) gazului eliberat, dacă fracțiunea de masă a zincului din amestec este de 30%.
59. Hidroxidul de sodiu, care cântărește 4,0 g, a fost aliat cu hidroxid de aluminiu cu o greutate de 9,8 g. Se calculează masa metalealuminatului de sodiu obținut.
60. Atunci când se prelucrează 10 g de amestec de cupru și aluminiu cu acid azotic concentrat la temperatura camerei eliberat 2.24 dm 3 gaz (NU). Ce volum (NU) de gaz se va elibera atunci când se prelucrează aceeași masă de amestec cu un exces de soluție de KOH?
61. Un aliaj de cupru și aluminiu cântărind 20 g a fost tratat cu un exces de alcaline, reziduul insolubil a fost dizolvat în acid azotic concentrat. Sarea obținută a fost izolată, calcinată până la greutate constantă și s-au obținut 8 g de reziduu solid. Determinați volumul de soluție uzată de NaOH cu o fracție de masă de 40% și o densitate de 1,4 g / cm3).
62. Un amestec de aluminiu și oxid de metal (II) (oxid ne-amfoteric) cântărind 39 g a fost tratat cu un exces de soluție de KOH, gazul emis a fost ars pentru a se obține 27 g de apă. Reziduul nedizolvat a fost complet dizolvat în 25,2 cm3 dintr-o soluție cu o fracție de masă de HCI de 36,5% și o densitate de 1,19 g / cm3). Determinați oxidul.
63. Un amestec de așchii de zinc și cupru a fost tratat cu un exces de soluție de KOH, în timp ce un gaz de 2,24 dm3 (NU) a fost eliberat. Pentru clorinarea completă a aceleiași probe de metal, s-a cerut clor cu un volum de 8,96 dm 3 (NU). Se calculează fracțiunea de masă a zincului din probă.
64. Un amestec de rumeguș de fier, aluminiu și magneziu cu o masă de 49 g a fost tratat cu H 2 SO 4 în exces, obținându-se astfel 1,95 moli de gaz. O altă porțiune a aceluiași amestec de 4,9 g a fost tratată cu un exces de soluție alcalină, obținându-se 1,68 dm3 (NU) de gaz. Găsiți masa de metale în amestec.
65. Care este masa sedimentelor formate la fuziunea soluțiilor care conțin 10 g de NaOH și 13,6 g de ZnCl2?
66. Există două porțiuni ale amestecului de Al, Mg, Fe, Zn, aceleași în compoziție molară, fiecare cântărind 7,4 g. O porțiune a fost dizolvată în acid clorhidric și s-au obținut 3,584 dm3 gaz (NU), cealaltă în soluție alcalină și A primit 2,016 dm 3 gaz (NU). Se știe că în ambele amestecuri există 3 atomi de Zn per atom de A1. Găsiți masa de metale în amestec.
67. Un amestec de cupru, magneziu și aluminiu cântărind 1 g a fost tratat cu un exces de acid clorhidric. Soluția s-a filtrat, un exces de soluție de NaOH s-a adăugat la filtrat. Precipitatul a fost separat și calcinat până la o masă constantă de 0,2 g. Reziduul, care a fost dizolvat după tratarea cu acid clorhidric, a fost calcinat în aer și s-au obținut 0,8 g substanță neagră. Găsiți fracțiunea de masă din aluminiu în amestec.
68. Atunci când este încălzit într-un curent de oxigen din aliaj de zinc, magneziu și amestecul de masă de cupru a crescut la 9,6, produsul este parțial solubil în alcalii, în care nevoia de dizolvare de 40 cm3 soluție cu KOH fracțiune de masă de 40% și o densitate de 1,4 g / cm 3. Pentru reacția cu aceeași porțiune din aliaj, este necesar 0,7 moli HCI. Găsiți cantități chimice de metale în aliaj.
69. Un aliaj de cupru și zinc cântărind 5 g a fost tratat cu un exces de soluție de NaOH. Apoi, reziduul solid a fost separat și tratat cu HNO3 concentrat, s-a izolat sarea astfel obținută, s-a calcinat până la greutate constantă și s-au obținut 2,5 g de reziduu solid. Determinați masa metalelor din aliaj.
70. Un aliaj de cupru și aluminiu, cântărind 12,8 g, a fost tratat cu un exces de acid clorhidric. Reziduul nedizolvat a fost dizolvat în acid azotic concentrat, soluția rezultată a fost evaporată, reziduul uscat a fost calcinat la greutate constantă și s-au obținut 4 g de solid. Determinați fracțiunea de masă a cuprului din aliaj.
71. În ce raport de masă ar trebui să se ia două porțiuni de A1, astfel încât atunci când se adaugă la soluția de alcaline și cealaltă la cantități egale de hidrogen sunt eliberate în acid clorhidric?
72. Atunci când se prelucrează un amestec de oxid de aluminiu și de cupru (II) cu un exces de soluție de KOH, se eliberează 6,72 dm3 (NU) gaz și prin dizolvarea aceleiași porțiuni a amestecului în HNO3 concentrat la temperatura camerei se obțin 75,2 g de sare. Găsiți masa amestecului inițial de substanțe.
73. Ce masă de oxid de cupru (II) poate fi restabilită prin hidrogen obținut prin reacția unui exces de aluminiu cu 139,87 cm3 dintr-o soluție cu NaOH 40% și o densitate de 1,43 g / cm3.
74. Cu oxidarea completă a 7,83 g din aliajul a două metale s-au format 14,23 g de oxizi, în timpul căruia un exces de alcalii a rămas nedizolvat 4,03 g de sediment. Determinați compoziția calitativă a metalelor care formează aliajul, dacă cationii lor au o stare de oxidare de +2 și +3 și raportul molar dintre oxizi este 1: 1 (presupuneți că oxidul de metal cu starea de oxidare +3 are proprietăți amfoterice).
75. Au fost dizolvate două porții de aluminiu, având aceeași masă: una într-o soluție de hidroxid de potasiu, cealaltă în acid clorhidric. Cum se corelează volumul de gaze evoluate (nos) între ele?
76. Un aliaj de cupru cu aluminiu cântărind 1.000 g a fost tratat cu un exces de soluție alcalină, precipitatul nedizolvat a fost dizolvat în acid azotic, apoi soluția a fost evaporată, reziduul a fost calcinat până la o greutate constantă. Masa noului reziduu este de 0,398 g. Care sunt masele de metale din aliaj?
77. Un aliaj de zinc și cupru cântărind 20 g a fost tratat cu un exces de soluție de NaOH cu o fracție de masă de 30% și o densitate de 1,33 g / cm3. Reziduul solid a fost izolat și tratat cu un exces de soluție concentrată de HN03. Sarea formată în timpul acestui proces a fost izolată și calcinată până la o greutate constantă. Masa reziduului solid a fost de 10,016 g. Se calculează fracțiile de masă ale metalelor din aliaj și volumul de soluție alcalină consumată.
78. Un aliaj de cupru și aluminiu cântărind 2 g a fost tratat cu un exces de soluție alcalină. Reziduul a fost filtrat, spălat, dizolvat în HNO3, soluția a fost evaporată și calcinată până la o greutate constantă. Masa reziduului după calcinare a fost de 0,736 g. Se calculează fracțiile de masă ale metalelor din aliaj.
79. Clorurarea unui amestec de fier, cupru și aluminiu necesită 8,96 dm3 de clor (NU), iar interacțiunea aceleiași probe cu acid clorhidric necesită 5,6 dm 3 (NU). Când se interacționează cu aceeași masă a unui amestec de metale cu alcalii, se eliberează 1,68 dm 3 (NU) de gaz. Găsiți cantități chimice de metale în amestec.
80. Hidrura de potasiu cântărind 5,0 g s-a dizolvat în apă cu un volum de 80 cm3 și s-a adăugat aluminiu cu greutatea de 0,81 g la soluția rezultată. Se găsesc fracțiile de masă ale substanțelor din soluția rezultată cu o precizie de până la o mie de procente.
LISTA LITERATURII
1. Barannik, V.P. Nomenclatorul modern rus al compușilor anorganici / V.P. Barannik // Jurnalul Societatii Americane de Chimie. DI Mendeleev. - 1983. - Vol. XXVIII. - p. 9-16.
2. Wroblewski, A.I. Simulator de chimie / A.I. Wroblewski. - ediția a doua, Pererab. și adăugați. - Minsk: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Sarcini și exerciții în chimia generală: studii. manual pentru universități / ed. VA Rabinovich și H.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Sarcini în chimia generală și anorganică: studii. manual pentru elevii de nivel superior. Proc. instituții / R.A. Lidin, V.A. Lapte, L.L. Andreev; prin ed. RA Lidin. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. Fundamentele nomenclaturii substanțelor anorganice / R.A. Lidin [și colab.]; prin ed. BD Stepin. - M .: Chemistry, 1983. - 112 p.
6. Stepin, B.D. Aplicarea regulilor IUPAC privind nomenclatorul compușilor anorganici în rusă / B.D. Stepin, R.A. Lidin // Jurnalul Societății Chimice din Uniune. DI Mendeleev. - 1983. - Vol. XXVIII. - p. 17-20.
| Introducere .............................................................................. Reguli generale pentru gama de substanțe anorganice ............ .. Oxizi ....................................... ... Oxizi de bază .................................................................. ... Oxizi de acid ....................................... ............................ Oxizi amfoterici ............................................................... .. Obținerea oxizilor .................................................................. Exerciții pentru lucrul independent pe Subiectul "Oxizi" ................................................................... Acide ............................................................................... Exerciții de lucru independent pe tema "Acizi" .................................................................. Motive ............................................................ ......... .. Exerciții de lucru independent pe tema "Fundații" ................................................................ Sare ..................................................................................... Exerciții pentru lucrul independent pe tema "Săruri" .......................................................... Relația genetică între clasele de compuși anorganici ....................................... ............... .. Exerciții de lucru independent pe tema "Legătura genetică între clasele de compuși anorganici" ...................................................... Experimente experimentale pe tema "Clasele principale de compuși anorganici ............... ......... .. Sarcinile de decontare ..................................................................... Referințe ................... |
învățământ: pentru a stabili conceptul de "serie genetică", "conexiune genetică"; învață cum să se facă serii genetice de elemente (metale și nemetale), pentru a forma ecuațiile de reacție corespunzătoare seriei genetice; verificați cum se asimilează cunoașterea proprietăților chimice ale oxizilor, acizilor, sărurilor, bazelor;
în curs de dezvoltare: dezvoltă abilitatea de a analiza, compara, rezuma și trage concluzii, alcătui ecuațiile reacțiilor chimice;
de învățământ : să promoveze formarea unei viziuni asupra lumii științifice.
2. Furnizarea de clase: tabelele "Sistem periodic", "tabelul de solubilități", "seria de activități metalice", instrucțiuni pentru studenți, sarcini de testare a cunoștințelor.
3. Ordin de executare:
3.1. Anchetă frontală.
3.2. Soluția de sarcini.
3.3. Efectuați lucrări de verificare a opțiunilor.
4. Structura raportului:
4.1. Scrieți tema și obiectivele lecției practice.
4.2. Înregistrați rezolvarea problemelor.
4.3. Rezolvați-vă propria versiune a muncii independente, decizia de a scrie într-un notebook și a le transmite profesorului pentru examinare.
Progresul muncii
1. Conversație frontală la:
Ce este o conexiune genetică?
Conexiuni genetice - acestea sunt conexiuni între diferite clase bazate pe interconversiile lor.
Ce este o serie genetică?
Rândul genetic - o serie de substanțe - reprezentanți ai diferitelor clase, care sunt compuși ai unui element chimic, legați prin interconversiuni și reflectând transformările acestor substanțe. Baza acestor serii este același element.
Ce tipuri de serii genetice sunt de obicei alocate?
Printre metale există două tipuri de rânduri:
a) O serie genetică în care alcalii acționează ca bază. Această serie poate fi reprezentată utilizând următoarele transformări:
metal → oxid de bază → alcalin → sare
de exemplu, seria genetică de potasiu K → K 2 O → KOH → KCl
b) Seria genetică, în care baza este o bază insolubilă, atunci seria poate fi reprezentată ca un lanț de transformări:
metal → oxid de bază → sare → bază insolubilă → oxid de bază → metal
de exemplu: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Printre nemetale se pot distinge două tipuri de rânduri:
a) Seria genetică a nemetalelor, în care acidul solubil acționează ca o legătură în serie. Lanțul transformărilor poate fi reprezentat după cum urmează: nemetal → acid acid → acid solubil → sare.
De exemplu: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) rândul genetic de nemetale, în care acidul insolubil: nemetalic → oxid acid → sare → acid → acid acid → nemetal acționează ca o legătură în seria
De exemplu: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Executarea sarcinilor pentru opțiuni:
| Opțiunea 1 | Opțiunea 2 |
|
I: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
Opțiunea II: Na2S04, NaOH, Na, Na2O2, Na20
Tema: schimba o trecere treptată de la calciu la carbonat de calciu și pregătește un raport privind utilizarea oricărei săruri în medicină (folosind literatura suplimentară).
Instrucțiuni pentru lecția practică
Relația genetică între principalele clase de substanțe anorganice.
obiective: pentru a stabili conceptul de "serie genetică", "conexiune genetică"; să învețe să facă serii genetice de elemente (metale și nemetale), pentru a alcătui ecuațiile de reacție corespunzătoare seriei genetice; repetați proprietățile oxizilor, acizilor, sărurilor, bazelor.
Progresul muncii
Scrieți definițiile conceptelor:
Relația genetică - __________________________________________
Genetic rând - ___________________________________________
O serie genetică de metale în care alcalii acționează ca bază. pot fi reprezentate în general: metal → oxid de bază → alcalin → sare. Faceți această serie folosind potasiu. Scrieți ecuațiile reacțiilor, cu ajutorul cărora puteți realiza acest lanț de transformări.
Seria genetică de nemetale, în care acidul solubil acționează ca o legătură în serie pot fi reprezentate după cum urmează: nemetalic → acid acid → acid solubil → sare. Faceți această serie utilizând fosfor. Scrieți ecuațiile reacțiilor, cu ajutorul cărora puteți realiza acest lanț de transformări.
Linia genetică, unde baza este baza insolubilă poate fi reprezentat de lanțul de transformări: metal → oxid de bază → sare → bază insolubilă → oxid de bază → metal. Construiți această serie utilizând cupru. Scrieți ecuațiile reacțiilor, cu ajutorul cărora puteți realiza acest lanț de transformări.
Seria genetică de nemetale, în care acidul insolubil acționează ca o legătură în serie poate fi reprezentat de lanțul de transformări: nemetalic → oxid acid → sare → acid → oxid acid → ne-metal. Construiți această serie utilizând siliciu. Scrieți ecuațiile reacțiilor, cu ajutorul cărora puteți realiza acest lanț de transformări.
Efectuați sarcini pentru opțiuni:
| Opțiunea 1 | Opțiunea 2 |
|
1. Alegeți formulele de oxid din versiunea dvs., explicați-vă alegerea, bazată pe cunoașterea caracteristicilor compoziției acestei clase de compuși. Sună-i.
2. În coloana formulă a variantei dvs., găsiți formulele de acid și explicați-vă alegerea pe baza analizei compoziției acestor compuși.
3. Determinați valențele reziduurilor acide din compoziția acidă.
4. Selectați formule de sare și denumiți-le.
5. Completați formulele de săruri care pot fi formate cu magneziu și acizi din varianta dumneavoastră. Scrie-le jos, numeste-le.
6. În coloana formulă a variației dvs., găsiți formulele de bază și explicați alegerea dvs. pe baza analizei compoziției acestor compuși.
7. În varianta dvs., alegeți formulele de substanțe cu care poate reacționa o soluție de acid ortofosforic (clorhidric, sulfuric). Faceți ecuațiile de reacție corespunzătoare.
9. Între formulele opțiunii dvs., selectați formule de substanțe care pot interacționa între ele. Faceți ecuațiile de reacție corespunzătoare.
10. Faceți un lanț de legături genetice de compuși anorganici, care vor include o substanță, a cărei formulă este dată în versiunea dumneavoastră la numărul unu.
Din aceste substanțe face o linie genetică folosind toate formulele. Scrieți ecuațiile de reacție cu care puteți realiza acest lanț de transformări:
eu opțiune: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IIopțiune: Na2S04, NaOH, Na, Na2O2, Na20
Tema: schimba o trecere treptată de la calciu la carbonat de calciu și pregătește un raport privind utilizarea oricărei săruri în medicină (folosind literatura suplimentară).
