Reacții egale care caracterizează puterea acidului sulfuric dizolvat. Lista meselor de examen de la discipline
Înnegrirea suprafeței picturilor vechi, scrise cu farb de măsline, în depozitul cărora pătrunde alb de plumb (PbCO3), este legată de soluții de sulfură de plumb negru (II) prin prezența unei ape circulante în atmosferă. Dacă apa este colorată cu peroxid, atunci se observă reacția soluției de sulfat de plumb (II) cu o culoare albă:
PbS + 4H2O2 = PbS04 + 4H2O.
În acest fel, ei restaurează picturi vechi înnegrite, pictate cu farb de măsline.
Zastosuvannya acru și sirki
Zonele stosuvannya kisnya sunt reprezentate de un mic 61.
permite vicoristovuvati yogo pentru infecție bând apă izvorul acela de ape uzate industriale; ca dezinfectant zasib în medicină. Ozonul este victorios și iac vidbіlyuyuchiy zasib.
Syrka vicorist pentru producerea de acid sulfuric, prepararea syrnikiv, incendii bengale, lupta împotriva shkidniks de stat puternic și pentru a insufla exaltarea unor astfel de boli. Serka știu zastosuvannya în timpul producției de gumă, barniki și pigmenți, fibre bucăți, luminofori și altele.
Mal. 61. Sărut

Pentru acru din scaune, care sunt printre cele mai mici elemente, etapa de oxidare -2 este cea mai caracteristică, atomii de sulf, seleniu și teluriu prezintă stadiul de oxidare -2, +2, +4 și +6.
Oxizii cu puterea acrișoarelor și vârtejurilor se manifestă în reacțiile lor cu metale, apă și alte nemetale.
Cerere și sarcină
1. Pliați formulele cu aciditate cu potasiu, calciu și aluminiu. Indicați stadiul de oxidare a elementului de piele și denumiți boala.
2. Fracția de masă Razrahuyte de sirka în sulfură de aluminiu.
3. Numele „kysen” - oxigenul înseamnă „care generează acizi”. Scrie formule chimice să vă aducă acizi, în depozitul cărora să depuneți elementul. Denumiți acizi.
4. Știți ce fel de modificări alotropice de acru și acru? De ce miroase unul câte unul?
5. Kisen, care este inhalat de o ființă umană, se ridică din hemoglobina sângelui. Se pare că masa de hemoglobină 1 g vine cu un volum (n.a.) 1,35 cm3 3 . Cantitatea de hemoglobină din sângele persoanelor sănătoase este de 140 g/dm3. Volumul total de sânge este de 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlіkіst acru, tu mаzhe opinetytsya în sângele oamenilor.
6. Desemnați fracția de masă a acidului sirkovodnoy din interval, scoasă în cazul volumului sirvodnya separat (n.a.) 8,96 dm 3 în apă cu o masă de 500 g.
7. Extindeți coeficienții în schemele ofensive reacții proeminente de oxid:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
La reacția pielii indică un agent oxidant.
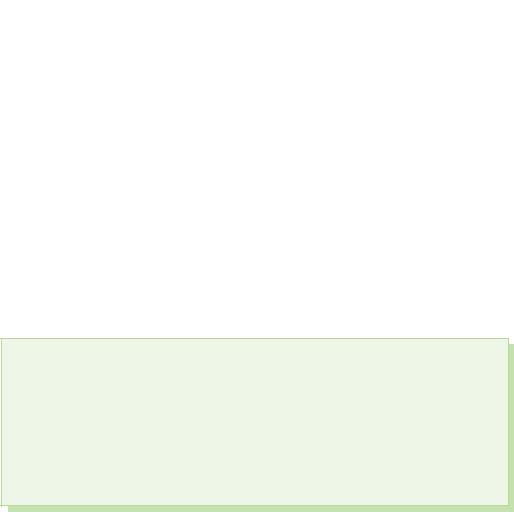
§ 39. Kisnevmisnі spoluki sirka
La z'ednannyah cu sirka acru arată stadiul de oxidare+4 și +6.
Oxid de Sirka(IV). Acid sulfuric
Oxidul (IV) - SO2 (gaz de sirhistie) - este un gaz fără butoi cu un miros caracteristic ascuțit, care iese atunci când aerul este fierbinte:
S + O2 = tSO2.

Unul dintre cele mai recente zastosuvan ai sirka a fost legat de fumigația sirka a vieții, care ar trebui să ardă. După cum a scris istoricul antic Pliniu Sr. în secolul I î.Hr. e., „mirosurile vetrei sirka pot proteja împotriva tot felul de farmece și pot alunga toate spiritele rele”. Puterea dezinfectantă și bactericidă a oxidului de sulf (IV) indirect și contagioasă. Gazul de sulf este alimentat în timpul procesării legumelor, fructelor și fructelor pentru a preveni putrezirea acestora.
Eliberare de gaz sulfuric în apropierea apei (până la 40 de volume de SO2 per 1 volum de apă) - fără colorare, cu bază dublă acid sulfuric disponibil numai în retail:
SO2 + H2O H2SO3.
Acidul sulfuros este un acid slab, în soluții apoase se disociază în etape adesea cu soluții de ioni hidrosulfit și sulfit:
H+ + HSO – , | – H+ + SO2–. |
||||
Acidul sulfuros prezintă dominanță chimică, sulfuros pentru acizi: interacționează cu oxizi bazici, baze, reacționează cu schimbul de săruri ale altor acizi, zocrema, acid carbonic slab vâscos din săruri:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Oxid de Sirka(VI).
Oxidul (VI) posedă oxid oxidant (IV) în prezența unui catalizator la o temperatură de aproximativ 500 C:
t, pisica.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
Pentru mințile cele mai remarcabile, oxidul de sulf (VI) SO3 este un acid fără bar, care la temperaturi sub 17 ° C se transformă în vorbire cristalină albă. Ce oxid de acid tipic, care interacționează cu apa, producând acid sulfuric puternic:
SO3 + H2O = H2SO4.
Acid sircanic
Formula grafică și modelul moleculei de acid sulfuric sunt îndreptate către micul 62.
Mal. 62. Formula grafică și modelul moleculei de acid sulfuric
La cercuri de reproducere acid sulfuricє electrolit puternic,
і disocierea її se exprimă după cum urmează:
H2 SO4 → 2Н+ + SO4 2– .
Puterea fizică a acidului sulfuric
Acid sulfuric - vază (tărie 1,83 g/cm3), uleios, inodor, pământ sterp. Ea va merge la apă într-un fel de sticle de apă.
Procesul de distribuire a H2SO4 la o cantitate chimică de 1 mol este însoțit de 92 kJ de căldură, care poate fi comparată cu mărimile efectelor termice în reacțiile chimice. Vederea unei cantități mari de căldură cu interacțiunea acidului sulfuric cu apa este o dovadă a înființării mugurilor de minerale între două râuri de hidratare de tip H2 SO4 n H2 O.
De exemplu, H2S04H20; H2S042H20; H2 SO4 3H2 O și așa mai departe.
fără ї acizi și hidrați nu permit vâscozitatea її ca agent puternic hidrofug, de exemplu, pentru uscarea gazelor.
Stropirea sumishi cu acid sulfuric variabil în apă poate fi însoțită de pulverizare. Amintește-ți ce nu puteți turna apă până la acru
Lotі, alunecat cu remixare neîntreruptă, se toarnă acid în apă.
Putere chimică acid sulfuric. Sulfati
Sulfati. Acid sulfuric dizolvat dezvăluie toate trăsăturile caracteristice ale acizilor dominanti: interacțiunea cu metalele, care ar trebui să fie active până la o zi; cu oxizi bazici si amfoteri, cu baze si saruri. ale căror săruri sunt decantate: mijloc - sulfat, de exemplu K 2 SO 4 i acrișor -
hidrosulfat, de exemplu KНSO4.
Majoritatea sulfaților și hidrosulfaților se disting bine prin apă, bogată în ei cristalin. Deyakі sărurile cristaline ale acidului sulfuric și se numesc vitriol: midny vitriol CuSO4 ∙5H2 O, flod vitriol FeSO4 ∙7H2 O și în.
Pentru manifestarea acidă a acidului sulfuric și a sărurilor її în trandafiri de apă, se folosesc săruri de bariu:
Ba(NO3)2 + Na2S04 = BaS04 ↓ + 2NaN03;
Ba2+ + SO4 2– = BaSO4 ↓.
Ca rezultat al reacției, se stabilește o precipitare albă de sulfat de bariu.
Certificat de laborator 6
Urmărirea puterilor chimice ale acidului sulfuric diluat
În trecut, ar trebui plasate cinci eprubete: metal (zinc sau alt metal la alegerea cititorului), oxid bazic, hidroxid de sodiu, carbonat de sodiu, clorură de bariu. Adăugați câteva picături de fenolftaleină la cantitatea de hidroxid de sodiu și modificați doza. Adăugați 1-2 cm3 de acid sulfuric diluat în eprubeta cutanată. (Atenție! Pe măsură ce reacția cu oxidul bazic decurge corect, grăbiți încălzirea cu jumătate de baie de alcool.)
Ce pazesti? Care sunt semnele de spus despre depășirea reacțiilor chimice? Pentru a stoca reacții chimice egale în formă moleculară și ionică. Ce fel de reacție ați purtat? Pentru a colecta visnovok despre puterea chimică a acidului sulfuric dizolvat.
Acid sulfuric concentratє agent oxidant puternic, mai mic diluat. Când interacționează cu acid sulfuric concentrat
apa nu se vede cu metale.
W metale, care stau lângă activitatea după apă (crim aur și platină), reacția continuă cu oxidul dizolvat de sulf (IV) SO 2 :
Cu + 2H2 SO4(conc) = t CuSO4 + SO2 + 2H2 O.
În reacția cu metalele, care sunt în domeniul de activitate până la apă, acidul sulfuric concentrat poate fi redus la oxid de sulf (IV) SO2, sulf S sau apa H2 S se depune în activitatea metalului și a minții în timpul reacţie. De exemplu:
4Zn + 5H2SO4(kineți) = t 4ZnSO4 + H2S+ 4H2O.
Să presupunem că e frig, aluminiu și alți diaconi, pentru cele mai mari minți, trec prin acid sulfuric concentrat.
Acidul sulfuric este concentrat în interacțiune cu nemetale simple ale vorbirii, de exemplu cu sulful:
S + 2H2SO4 = t3SO2 + 2H2O.
Oxidante bogat pliabil muguri organici, acidul sulfuric arde hârtie, pânză, lemn, haine și shkir. Prin urmare, aveți grijă la acid sulfuric concentrat.
Acidul sulfuric este concentrat pentru a elimina alți acizi volatili și sărurile acestora. De exemplu:
NaCl (tv) + H2SO4 (conc) = t NaНSO4 + HCl.
În Republica Belarus, acidul sirian este vibrat de BAT „Uzina chimică Gomel”, BAT „Grodno Azot”.
Zone de stagnare a acidului sulfuric
Mirosurile îl prezintă pe micuț 63.
Mal. 63. Staza acidului sulfuric
Acidul sulfuric H2SO4 este o patrie inodoră, uleioasă și uleioasă.
Acidul sulfuric este dizolvat în interacțiune cu metalele, astfel încât să poată fi activ până la o zi; cu oxizi metalici; cu elementele de bază; din săruri.
Odată cu interacțiunea acidului sulfuric concentrat cu metalele, apa nu se vede.
Pentru manifestarea acidă a acidului sulfuric și a sărurilor її în trandafiri de apă, se folosesc săruri de bariu.
Cerere și sarcină
1. Scrieți formulele pentru oxizii și acizii cisnici. Indicați gradul de oxidare al atomilor sirka din ei.
2. Vznachete masu s_rki, scho ars în acru, yakshcho la corn s-au văzut 29,69 kJ de căldură. Cu ce cantitate chimică de oxid de sulf (VI) se depune? Efectul termic al reacției aerului cald devine 296,9 kJ/mol.
3. Koristuyuchis masa rozchinnosti săruri, acizi și baze în apă, depozitați 2 reacții egale acid sulfuric diluat cu săruri. Scrieți o potrivire
v aspect molecular și ionic.
4. Razrahuyte masa și cantitatea chimică de sulfat de bariu, care este utilizat atunci când este diluat cu acid sulfuric pe baza de azotat de bariu cu masa de 200 g, fracțiune de masă de Ba (NO 3 )2 au un cost de 10%.
5. Copiați din textul paragrafului reacții egale, care caracterizează puterea chimică a acidului sulfuric concentrat. Desemnați gradul de oxidare al atomilor din sirka în її spolukah. Reacția pielii prezintă un agent oxidant.
6. Orice volum de acid sulfuric concentrat (= 1,83 g/cm 3) cu o fracție de masă de H2 SO4 98% din distribuția necesară a mediei masei 6,4 r?
7. Setați coeficienții pentru schemele de egalizare a reacțiilor oxidativ-oxidative de debut:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2S + HClO → K2SO4 + HCl.
Reacția pielii prezintă un agent oxidant.
§ 40. Înțelegerea rezultatului unui produs de reacție chimică
Chemіchnі vnyannya, pliat conform legii de conservare a maselor de discursuri, permite efectuarea rozrahunki, zokrema pentru a număra masu, pentru a determina cantitatea chimică a produsului reacției. În practică, o mulțime de reacții se desfășoară invers, o parte din vorbire este folosită ca urmare a evaporării, separării sau adoptării subproduselor. La acel produs, reacția ar trebui să fie mai mică, mai mică, ar fi mai puțin probabil să se întâmple până când reacția este uniformă. În acest fel, dacă teoretic este acceptat ca fără risc pentru reacția egală a masei, sau cantitatea chimică a produsului este de 100%, atunci în procesul real producția produsului va fi mai mică de 100%.
Este indicat în produsul reacției prin litera alfabetului grecesc (tsya) și apare în părți ale unui singur chi în sute de locuri.
Excesul de reacție chimică la produs - valoarea care se adaugă la cantitatea de greutate (volum, cantitatea chimică) eliminată efectiv din produs la greutatea (obsyagu, cantitatea chimică) a produsului, calculată pentru reacția egală:
În toate aceste variații, veți găsi aceeași valoare pentru rezultatul produsului reacției chimice. De exemplu, ca de obicei, pentru reacția de oxidare a oxidului de sulf (IV) la oxidul de sulf (VI)
2SO2 + O2 2SO3
va deveni 80% (sau 0,8), tse înseamnă că cu oxid de sulf (IV) greutate 64 g (volum 22,4 dm3, cantitate chimică 1 mol) volum 22,4 dm3, cantitate chimică 1 mol) și masă 80 g ∙ 0,8 = 64 g (volum 17,9 dm3, cantitate chimică
De la mărimea producției de mărfuri până la procesul real de producție, grăbiți-vă la vysnovok despre povnotі perevorennya syrovini, vitratah energії, necesitatea de a introduce operațiuni suplimentare și în.
Să aruncăm o privire la câteva exemple de rozrahunkiv din conceptul de „din produsul reacției”.
fundul 1. Ca urmare a opărării sirka cu o masă de 48 g, oxidul de sirka(IV) a fost îndepărtat cu un volum (n.a.) de 28,6 dm3. Determinați expirarea produsului de reacție.
m(S) = 48 g | 1. Cantitate semnificativ chimică de sirka, |
||||
V practica (SO2) = 28,6 dm3 | a reactionat: | ||||
Domnișoară) | |||||
(SO2)=? | n(S) | ||||
DOMNIȘOARĂ) | 32 g/mol |
||||
2. Reacție comparativ egală cu oxidul de sulf (IV): S + O2 = SO2.
3. Cunoaștem cantitatea teoretică de oxid de sulf (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Înțelegerea produsului unei reacții chimice |
4. Cunoaștem valoarea teoretică a oxidului de sulf(IV):
V teor (SO2) = n teor (SO2) V m = 1,5 mol 22,4 mol/dm3 = 33,6 dm3.
5. Razrahuymo din produsul de reacție:
Vidpovіd: vyhіd la reacția medicamentului dorіvnyuє 85%.
Exemplul 2. Alegeți masa de pirit FeS2, care este necesară pentru vipalitate pentru a prelua oxidul (IV) cu un volum (n.a.) de 8,96 dm3, astfel încât producția de produs de reacție să devină 90%.
V(SO2) = 8,96 dm3 | 1. Valoarea semnificativă teoretică a oxidului de sulf(IV): |
|||||||||||
(SO2) = 90% | V practic | V practic | ||||||||||
m (FeS2) =? | Teoria Stelelor V = | |||||||||||
V teor | ||||||||||||
Vtheor (SO2) = | V practic (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Cunoaștem cantitatea chimică teoretică de oxid de sulf (IV): |
||||||||||||
n teor(SO 2) | V teor(SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Comparativ egal cu reacția oxidului de sulf(IV) și cantitatea chimică de pirita, care este necesară pentru vipal:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Semnificativ masu pirita, care este necesar pentru a da vipal: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Indicație: pentru deținerea de oxid de sulf (IV) este necesară pirita cu masa de 24 g.

Excesul de reacție chimică la produs - valoarea care crește cantitatea de greutate (obsyagu, cantitatea chimică) efectiv luată din produs la masa (obsyagu, cantitatea chimică) a produsului, calculată pentru reacții egale. Apare în părți de unu și câteva sute.
Cerere și sarcină
1. De ce producția practică a produsului de reacție sună mai puțin, mai scăzut teoretic pentru reacția egală?
2. În reacția Sirka cu un calcul chimic apos de 1 mol, sirkovodny a fost dizolvat într-un calcul chimic de 0,85 mol. Determinați expirarea produsului de reacție.
3. Ca urmare, interacțiunea clorurii de bariu cu o masă de 200 g din acid sulfuric a precipitat sulfatul de bariu cu o masă de 100 g. Se descompune produsul reacției.
4. Să se determine volumul (n.a.) din acea cantitate chimică de oxid de sulf(IV), care, fiind dizolvată la arderea sulfului, cu o greutate de 64 g, ceea ce înseamnă că produsul reacției este cu 75% mai sănătos.
5. Calculați masa sirka arsă, precum și omiteți oxidul de sirka (IV) în volum (n.a.) 89,6 dm3 3 să devină 80% din posibilul teoretic.
6. Aparent, scho a exudat la oxidul de sulf (VI), care a fost îndepărtat în timpul oxidării oxidului de sulf (IV),
mai scump 85%. Se determină masa, volumul (n.a.) și cantitatea chimică de oxid de sulf(IV), care, intrând în reacție, îndepărtând astfel oxidul de sulf(VI) în volum (n.a.) 2,24 dm3.
7. Alegeți o fracție de masă de sare din diferență, luată din amestecul cu o masă de 3,2 g din acid sulfuric, masa de 192 g, astfel încât randamentul produsului de reacție să devină 85%.
§ 41. Azot si fosfor
Azotul N și fosforul P sunt amestecați în grupa VA a sistemului periodic. Mish'yak As, antimoniul Sb și bismutul Bi pot fi văzute înaintea grupului sistemului periodic. Azotul și fosforul sunt nemetale, mish'yak și antimoniul sunt aduse la napіvmetalіv, iar vismuth se află la metale.
Atomi Budova care stadiul de oxidare
Atomii elementelor grupului VA au câte 5 electroni la nivelul de energie exterior, configurația electronică a nivelului lor de energie exterior ns 2 np 3 de exemplu: azot - 2s 2 2p 3 fosfor - 3s 2 3p 3.
7N↓ | 15p↓ |
Administrator.
- De ce este viklikana o astfel de schimbare? Pe ce stăpânire a dicromatului se bazează viața sumishi de crom pentru ustensile de mănuși?
- Se toarnă 5-6 picături de dicromat de potasiu și 3 picături de acid sulfuric într-o eprubetă. Se adaugă 2 picături de iodură de potasiu și se diluează eprubeta cu 10 picături de apă. Transferați cu o pipetă într-o altă eprubetă o parte din ea și adăugați o picătură de amidon. Ce s-a schimbat pentru amidon? De ce? Plierea OVR și zvnyati prin metoda electronic-ionică.
- Caracteristica semnificativă a elementului 15 R. Dominanța modificărilor alotropice la fosfor. Interacțiunea fosforului cu discursuri simple și pliante.
În produse farmaceutice, oxidul de mercur (II) este zastosovuetsya ca un zasib antiseptic inferior pentru preparare unguente pentru ochi, Yake ține o diluție a hidroxidului de sodiu divorțat pe o sare de mercur comercială.
Administrator.
1. Scrieți o reacție adecvată la oxidul de mercur (II). Explicați de ce este necesar să efectuați operații pe întuneric?
3. Legile de bază ale chimiei.
Vikoristannya cu zinc în medicină se bazează pe tartă de yoga, acțiune antiseptică. Sulfatul de zinc 0,25% este vicoros pentru prepararea picăturilor oftalmice împreună cu acid boric 2%.
Administrator.
- Se prepară soluție de sulfat de zinc 0,25% într-un volum de 100 ml (ρ = 1,02 g/ml).
- Creați o transformare
Zn→ZnCl2 →ZnSO4 →Zn(NO3)2 →Zn(OH)2 →Na2 →NaCl
- Legătură covalentă, numire, vezi tu, mecanismul de iluminare, putere. Valenţă. Etapa de oxidare.
· Farmacistul trebuie să controleze vâscozitatea preparatului salin prin metoda permanganatometriei.
Administrator.
1. Scrieți o reacție similară și o comparație folosind metoda electronic-ionică.
2. Calculați cantitatea de 0,5% (ρ = 1,004 g/ml) cantitate de hidroxid de sodiu necesară pentru reacția cu 0,1 M cantitate de clorură (III) cantitate de 20 ml.
3. Dreptul periodic sistem periodic la lumina vchennya despre viața atomului.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє dar vilno vіd vіd domіshok sulfіdіv midi, vugіllya, acid silicic, mish'yaku.
Administrator.
1. Solicitați o modalitate de a securiza intrarea în casă. Obguruntuvati vіdpovіd.
3. Tipul principal de legătură chimică. Natura va face o legătură chimică.
· Pentru corpul de permanganat cu vidre, їx zneshkodzhennya se efectuează cu o soluție apoasă 3% de acid ocular acidulat H 2 Pro 2.
Administrator.
1. Scrieți un răspuns similar. Investigați reacția prin metoda electron-ion
- Oksidi, numire, clasificare, nomenclatură, autoritate și metode de posesie.
· Analiza vorbirii în prepararea salivei se realizează prin metoda permanganatometriei, bazată pe capacitatea Fe2+ de a fi oxidat la Fe3+. Partea inferioară a aerului inhalat este separată de acidul sulfuric în timpul încălzirii și după răcire, titrată cu permanganat de potasiu 0,1 N.
Administrator.
1. Scrieți reacțiile egale, care stau la baza definiției.
2. Se prepară 200 ml de KMnO 4 0,1 N (factorul de echivalență depinde de reacție).
3. Aciditate, denumire, clasificare, nomenclatură, autoritate, modalități de deținere.
· Azotat de medicament din farmacopee a fost scos de următorul rang: aliajul de cupru-argint se separă de acidul azotic, pentru a purifica îndepărtarea azotatului din case, se precipită cu acid clorhidric. Asediul, care este viishov, este restabilit cu zinc în mediu acru, și zvârlit, zvilnene în case, re-pulverizat în acid azotic.
Administrator.
- Scrieți reacțiile rіvnyannya іdpovіdnyh.
- Vikonaty yakіsnі reacții la Cl-, Br-, J anion cu o varietate de nitrat srіbla, scho să se afle în baza confirmării corectitudinii preparatelor de cloruri, ioduri, bromuri de potasiu.
- Fundamentarea, desemnarea, clasificarea, nomenclatura, autoritatea, metodele de posesie.
9. Nitrat srіbla zastosovuєtsya zvnіshno la erosіyah, vyrazki, conjunctivită gostroma în viglyadі 2,5 și 10% rezerva de apa.
Administrator.
- Se prepară soluție de AgNO3 2% cu un volum de 50 ml (ρ= 1,015 g/ml). Ce fel de minți sunt necesare pentru a avea grijă de acest rozchin?
- Creați o transformare
Ag→AgNO3 →AgCl→ AgNO3 →Ag
- Sare, denumire, clasificare, nomenclatură, autoritate, metode de posesie.
· Farmacistul trebuie să efectueze identificarea medicamentului farmacopeic sulfat de bariu.
Administrator.
1. Care este metoda sulfatului de bariu în medicină? De ce sulfatul de bariu este aliat cu carbonat de sodiu înainte de reacțiile de identificare? Vidpovіd confirmat prin reacții egale.
2. Reacții Viconati și identificarea sărurilor BaSO4, CaSO4, Na2SO4.
3. Spoluky cuprinzător, denumire, budov pentru A. Werner, natura legăturii chimice, clasificare, nomenclatură, disociere. Zastosuvannya complex spoluk în medicină și analiză chimică.
· Un farmacist, când lucrează cu o concentrație de amoniac, a permis o deteriorare gravă a echipamentului de siguranță - a efectuat lucrările la dulapul pătat fără tracțiune crescută.
Administrator.
- Care sunt consecințele care pot fi utilizate atunci când se lucrează cu concentrație de amoniac fără echipament de siguranță suplimentar? Asistența medicală Yaku Pershu este necesar să se aplice în cazul vaporilor otrăviți de amoniac.
- Creați o astfel de transformare.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg(NO 3) 2 → NO 2
Scrieți ecuația reacțiilor pentru aspectul molecular și ionic, iar pentru OVR - căutați prin metoda echilibrului electronic.
- Cinetica chimică. Viteza reacției chimice. Impactul diverșilor factori asupra vitezei reacțiilor chimice.
· Zі spoluk azot în medicina zastosovuyutsya amoniac în apă, sare, amoniu, oxid de dinazot și nitrit de sodiu.
Administrator.
- Care este metoda de a da biruitor la azot? Scrieți formulele acestor discursuri și reacții egale care caracterizează principalele puteri.
- Scrieți reacția egală a azotatului de sodiu cu permanganatul de potasiu în mediul acid. Investigați reacția prin metoda nap_reactions
- Nereversibile și vârcolaci reacții chimice. Zelos chimic. Legea maselor pentru sisteme egale. Constante de capital propriu. Principiul lui Le Chatelier.
· Farmacistul trebuie să efectueze identificarea sărurilor de sulfat de sodiu, clorură de sodiu, bicarbonat de sodiu.
Administrator.
- Vikonaty akіsnі reacții la ionii SO 4 2-, Cl-, HCO 3-.
- Razrahuvat, skіlki gram_v cristalohidrat Na 2 SO 4 10H 2 O este necesar ca farmacistul să bea în apă cu o masă de 500 g, să ia 5% Na 2 SO 4 ?
- Reacții oxid-apă. Principalele prevederi ale teoriei electronice a reacțiilor de promovare a oxidării. Cei mai importanți oxidanți și ghidaje. Zrivnyannya reacții oxid-apă prin metoda echilibrului electronic și metoda ion-electronica.
Potasiul acidului sulfuric pare să fie bogat în medicamente străine organismului (xenobiotice) - preparate medicinale acei metaboliți cu soluțiile unor mici discursuri - conjugați, care sunt ușor excretați din organism.
Administrator.
- Eliminați puterea de potasiu a acidului sulfuric într-un mod diferit, indirect pe masa reactivă. Scrieți reacțiile rіvnyannya іdpovіdnyh.
- Adunați egalitățile moleculare ale reacțiilor care sunt exprimate prin astfel de egalități ionice rapide:
S2- + H2S → 2HS -
S2- + 2H + → H2S
HS - + OH - → S2– + H2O
· Sisteme de dispersie, desemnare, clasificare. Suspensii, aerosoli, emulsii. Selectarea sistemelor grosiere dispersate în medicină și farmacie.
Farmacistul trebuie să ia acid sulfuric 5%.
Administrator.
- Care este depozitul proprietății de oxidare a anionului SO 4 2 în concentrația de acid? Scrieți ecuația reacțiilor care caracterizează puterea acidului dizolvat și concentrat.
- Se prepară soluție de acid sulfuric 5% prin spălarea a 50 ml de acid sulfuric cu o fracție de masă de H 2 SO 4 30%.
- Koloidni razchini, clasificare, denumire, cinetică moleculară acea putere optică, otrimannya. Stabilitatea coloanelor. Coagulare. Peptizare. Micelul Budova. Dializă.
· Sirka, care intră în depozitul de aminoacizi, este oxidată în organisme. În cazul acidului sulfuric endogen, acesta ia parte la sporii exogeni - fenol, crezol și indol.
Administrator.
- Descrie puterea acidului sulfuric și depășește regulile de lucru cu acizi.
- Pentru dizolvare, ce volum de acid sulfuric cu o fracție de masă de H 2 SO 4 25% și o grosime de 1,18 g / ml trebuie luat pentru neutralizare cu hidroxid de potasiu, un volum de 50 ml, cu o fracție de masă de KOH 12% şi o grosime de 1,1 g/ml
- Adevărata diferență, desemnare, înțelegere de bază, esența procesului de diferențiere. Difuzie. Osmoză. Menghină osmotică.
· În zonele industriale, unde există multă vugillya, lemnele acide cad adesea.
Administrator.
- cu ce esti depozit chimic acid dosch în apropierea zonelor tsikh? Cum faci vin? Scrieți reacții egale.
- Îndoiți ionii moleculari și pe termen scurt egal cu hidroliza sărurilor în avans:
K2S, Na2SO4, Na2SO3, Al2(SO4)3, Cr2S3
Circumnavigația este stabilită în natură în numere mari pentru procesele biochimice rahunok și răzbunare în ape minerale pro sirchanih.
Administrator.
- Puterea zilei.
- Creați o transformare:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Scrieți ecuația reacțiilor pentru aspectul molecular și ionic.
- Disocierea acizilor, bazelor, sărurilor, apei. Acid-bază egală în rozchinah. Apa Ionny dobutok, determinantă a pH-ului.
· Preparat medicinal oficial al unui sirka є sirka, căptușit cu (Sulphur praecipitafum).
Administrator.
- Descrieți puterea Sirka liberă și modificările alotropice ale Sirka.
- Creați o transformare:
Reacții Zrivnyati prin metoda echilibrului electronic.
- Hidroliză. Esența procesului de hidroliză. Hidroliza diferitelor tipuri de săruri. Hidroliza în etape. Aflux de diverși factori în stadiul de hidroliză.
· Farmacistul conduce reacția de identificare a soluției de peroxid de apă 3%: până la 1 ml de soluție finală, se adaugă 1 ml de acid sulfuric diluat, 1 ml de eter și 0,5 ml de dicromat de potasiu, ca urmare, bila de eterul se transformă într-o culoare albastră în prezența acidului 6
Administrator.
- Reacția Vikonaty identifică peroxidul vodny.
- Scrieți o identificare egală a peroxidului de apă și a echilibrului prin metoda balanței electronice.
- Caracteristica caracteristică a elementelor subgrupului cap al grupei VII și a jumătății acestora. Medical semnificație biologică halogeni.
· Kisen este un preparat farmaceutic și descrieri în GF. Yogo zastosovuyut pentru inhalare pentru diferite tipuri de foamete de acid.
20. Manager.
- Scrieți reacțiile egale ale caselor relevate CO, 2, NO, NO2.
- Scrieți reacțiile egale, care stau la baza metodei de laborator pentru îndepărtarea acidului. Inducerea reacției prin metoda echilibrului electronic
- Clor, apă cu clor, acid clorhidric, clorură. Puterea fizică și chimică a clorului și a yogo spoluk. Semnificația medico-biologică a halogenilor.
· Un farmacist analizează validitatea medicamentelor pe bază de clorură de sodiu, bromură de sodiu și iodură de sodiu.
Administrator.
- În astfel de scopuri, sărurile vicoase sunt folosite în farmacie și medicină.
- Vikonaty akіsnі reacții la anioni Cl-, Br-, J-.
- Puterea fizică și chimică a clorului acru. Otrimannya. Zastosuvannya.
· Una dintre metodele industriale de extragere a iodului în scop farmaceutic este procesul de obţinere a iodului din apele de foraj. Iodura, care se află în apropierea apelor de foraj, este oxidată conform schemei:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Manager.
- Cum se prepară iodul și cum se utilizează în medicină.
- Investigați reacția care stă la baza obsesie pentru iod prin metoda de reacție.
- O caracteristică critică a calcogenilor. Puterea acru și yogo jumătate. Semnificația medico-biologică a acrișului.
· Farmacistul determină corectitudinea preparatelor din cloruri de sodiu, potasiu și calciu.
Administrator.
- În astfel de scopuri, vicoriştii sunt utilizaţi în preparatele farmaceutice.
- Reacții Vikonati _identificarea acestor săruri.
- Jumătate acru cu apă. Puterile fizice si chimice ale apei. Peroxid de apă, dominanță, congestie în medicină. Semnificația apei în viața organismelor.
· Zі spoluk halogenіv z acru mai puțin hipoclorit pentru a deveni de interes pentru medicină ca dezinfectant.
Administrator.
- Pe ce putere a hipocloriților se întemeiază ziua dezinfectării? Scrieți reacțiile rіvnyannya іdpovіdnyh.
- Razrahuvati, baia de clor skіlki gramіv trebuie luată pentru otrimannya 2 litri de clor activ.
- Sirka și її de la podea. Alotropia sirka liberă. Puterea fizică și chimică a Sirka, Sirkovodnya, Sirkovodnya acid și її săruri.
· În caz de aciditate insuficientă a sucului de coajă, se prescrie acid clorhidric diluat intern.
Administrator.
- Enumerați regulile generale de lucru cu acizi.
- Razrahuvat, skіlki ml de 36,5% - o varietate (ρ = 1,19 g / ml) de acid clorhidric și este necesar să se ia pentru prepararea a 100 ml. 8,2% - oh (ρ=1,040 g/ml) acid.
- Puterea fizică și chimică a oxizilor de sulf, acid sulfuric, acid sulfuric. sulfit. Sulfati. Putere, obsesie, zastosuvannya.
· În farmacie, una dintre dimensiunile standard este 33% acetat de potasiu, care este o modalitate de distribuire a carbonatului de potasiu în 30% - acid octic.
Administrator.
1. Scrieți ecuația reacției pentru aspectul molecular și ionic.
- Caracteristica semnificativă a elementelor subgrupului cap al grupei V. Dominanța azotului liber. Valoarea azotului în viața organismelor.
· Prescripții ale discursurilor, care sunt baze tari și acizi slabi. Pentru aplicarea GFH ca stabilizator, se adaugă 0,1 n de soluție de hidroxid de sodiu la 4 ml per 1 litru de produs.
Administrator.
- Scrieți ecuația pentru reacția de hidroliză a sării CH3COONa.
- Razrahuvat, skіlki gramіv NaOH este necesar să se apeleze, să ia 500 ml 0.1n dimensiune. Pregătiți toate modelele pentru cea mai recentă tehnologie de siguranță.
- amoniac. Sare de amoniu. putere. Zastosuvannya în medicină și farmacie.
· Un farmacist pregătește un unguent pentru o rețetă: 1 g de carbonat de potasiu și 0,5 g de tetraborat de sodiu se amestecă în 70 ml de apă distilată, 10 g de stearina se aliază cu 15 g de ulei de vaselină și se adaugă cu un jet subțire la amestecare. cu apă caldă pentru carbonatare. .
Administrator.
- Ce fel de discursuri sunt stabilite în urma cărora zmishuvannya? De parcă mijlocul este așezat și de ce? Vidpovіd confirmat prin reacții egale.
- Pregătirea vag tehno-chimic pentru roboți. Luați 1 g de carbonat de potasiu pe locurile tehno-chimice.
- Oxizi de azot. Acid azot și săruri її. Puterile fizice si chimice. Semnificația medico-biologică a azotului
· Este necesar ca un farmacist să pregătească 0,05% permanganat de potasiu într-un volum de 200 ml pentru clătirea gurii și gâtului goale.
Administrator.
- Cu ce autoritate are permanganatul de potasiu înrădăcinat în yogo likuvalna diya? Yakі spoluky mangan zastosovuetsya în scopuri jubile?
- Este necesar să adăugați câteva grame de KMnO 4 pentru a comanda 200 ml de 0,05% KMnO 4 (ρ = 0,9994 g / ml.). Demonstrați tehnica de pregătire a acestui design.
- Molecule Budov de acid azotic. Puterea fizică și chimică a acidului azotic și a sărurilor її. Semnificația medico-biologică a azotului și її spoluk.
· În produse farmaceutice, oxidul de mercur (II), care este vicoros ca zasib antiseptic, este decuplat de hidroxidul de sodiu pe o sare comercială de mercur (II).
Administrator.
1. Scrieți o reacție adecvată la oxidul de mercur (II). De ce trebuie efectuate reacțiile la pitici?
3. Legile de bază ale chimiei.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Acidul percromic, care se dizolvă cu cioma, H 2 CrO 6 este culoarea albastră. Contaminarea cu acid albastru confirmă eficacitatea preparării H2O2.
Administrator.
- Reacția Zrivnyati tsyu printr-o metodă electronică-ionică.
- Yakі spoluky cromul arată putere oxidativă, iar yakі - vodnovlyuvalnі?
- Dominanța fosfinei, oxizilor de fosfor și acizilor fosforici, deținerea lor. Semnificația medico-biologică a fosforului
· Sumish oxid de magneziu (85%) și peroxid de magneziu (15%) - un medicament cunoscut sub numele de "peroxid de magneziu", care zastosovuyut în tulburări mucoase-intestinale.
Administrator.
- Explicați medicamentul antiacid și bactericid. Vidpovіd confirmat prin reacții egale.
- Razrahuvat, skilki grame de MgO și MgO 2 trebuie să luați pentru a prepara 100 g din acest medicament. Apelați teres tehno-chimic 10 g de oxid de magneziu.
- Caracteristica caracteristică a elementelor grupei IV a subgrupului principal. Budova, Puterea fizică alotropi în cărbune. Puterea chimică a cărbunelui liber.
· Se descompune bicarbonatul de sodiu (sodă de băut) la zastosovat la vederea clătirii, clătirea cu afecțiuni inflamatorii ale ochilor, mucoaselor tractului respirator superior.
Administrator.
- Pe ce putere are bicarbonatul de sodiu acțiunea antiseptică? Vidpovіd confirmat prin reacții egale. Poți vicora ca antiseptic zasib tetraborat de sodiu Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Se prepară 5% NaHC03 în volum 50 ml (= 1,036 g/ml).
- Molecule Budov, puteri fizice și chimice ale acru din cărbune. Semnificația medico-biologică a carbonului și a yoga.
· Preparate antiacide, care răzbune bicarbonatul de sodiu, vicariat în cazul diverselor boli, care sunt însoțite de aciditate crescută, tobto. acidoza.
Administrator.
- Pe ce putere a sării funcționează preparatele antiacide? Vidpovіd confirmat prin reacții egale. Pot fi folosite și alte discursuri în aceste scopuri?
- Creați o transformare:
NaOH→NaHCO3 →Na2CO3 →NaCl→NaNO3
Scrieți ecuația reacțiilor pentru aspectul molecular și ionic.
Reacții Viconati Na 2 CO 3 →NaCl→NaNO 3.
- Siliciu și jumătate de yogo, cunoașterea naturii, otrimannya, puterea fizică și chimică. Semnificația medico-biologică a siliciului.
· Soluția de NaCl 2,5% este administrată intern pentru spălarea scurgerii atunci când AgNO 3 este contaminat.
Administrator.
1. Pe ce se bazează NaCl? Vidpovіd confirmat prin reacții egale.
3. Caracteristica principală a elementelor subgrupului principal al grupei III. Pădure puternică și yogo spoluk. Semnificația medico-biologică în medicină.
· Pentru dezvoltarea formelor medicinale rare, recunoscute pentru injectare, soiuri izotonice vicario.
Administrator.
1. Ce este o varietate izotonică? De ce se numește yoga izotonic?
3. Aluminiu și yoga de la podea, dominație, otrimannya. Semnificația medicală și biologică a aluminiului.
· 3% soluție apoasă de peroxid de apă zastosovuyut ca un zasib bactericid eficient.
Administrator.
1. Care este baza apei bactericide și a peroxidului spinal din sânge. Ce intrări străine sunt necesare pentru a fi tăiate atunci când se lucrează cu perhidrol?
2. Razrahuvati, skilki ml. perhidrol (soluție apoasă 30% de H 2 Pro 2, ρ = 1,1 g / ml) trebuie luat pentru a lua 500 ml de soluție 3% (ρ = 1,005 g / ml). Pentru a pregăti tsey rozchin z dotrimannym tekhnіki bezpeka.
3. Metale din subgrupul cap al grupei II. Zagalna caracteristică, otrimannya, putere fizică și chimică. Săruri de calciu și magneziu. Duritatea apei. Usunennia zhorstkostі apă. Semnificația medico-biologică a elementelor din subgrupa principală a grupei II.
· Industria farmaceutică modernă produce preparate medicinale în funcție de tabăra agregată, tipul sistemelor dispersate, modalitatea de introducere în organism.
Administrator.
1. Ce sisteme se numesc dispersate?
Cum sunt clasificate sistemele dispersate?
Arată ca sistemele dispersate eliberează preparate medicinale? Furnizați exemple specifice.
- Îndepărtați hidrosolul de colofoniu prin înlocuirea vânzătorului.
- Caracteristica caracteristică a metalelor băltoase, obsesie, putere fizică și chimică. Cele mai importante părți ale metalelor lunare. Semnificația medico-biologică a metalelor din bălți
· La vederea diferențelor de apă în diferite discursuri, zastosovuyutsya rіdkі forme medicinale, care pot fi reciproc reciproc.
Administrator.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Ce fel de grefieri pot pune mâna pe discursuri?
- Se prepară 5% CuSO 4 cu un volum de 100 ml (ρ = 1,051 g / ml) cu vitriol albastru CuSO 4 ∙ 5H 2 O
- Caracteristica caracteristică a elementelor d. Metalele subgrupurilor laterale ale primului grup și spoluk. Semnificație medicală și biologică.
· În Rusia, există o electro-procesare a sucului și a plantelor proaspete cu conținut scăzut de suc și a sirovinei sălbatice: fructe de pădure, fructe, culturi de rădăcină de legume, diferite organe de creaturi cu metoda de a vedea sucurile (amestecate intern) într-un aspect nativ. Spațiul interior este o coloană de albi, acizi nucleici, carbohidrați, taninuri
Administrator.
1. Ce fel de diferențe se numesc modele columnare? Cum sunt clasificate mirosurile? Enumerați puterile coloanelor. Ce proces stă la baza vederii sucurilor din sirovina plină de rouă?
2. Se îndepărtează hidroxidul de soluție salină (III) prin hidroliza FeCl 3. Scrieți schema miceliului.
- Metale din subgrupele secundare din grupa II, caracteristici generale, budova, putere fizică și chimică. Semnificație medicală și biologică.
· La prepararea tabletelor pe bază de extract de rădăcină de valeriană, nu se recomandă utilizarea vicoristatului de carbonat de magneziu ca principal rapel, deoarece poate provoca neutralizarea acidului izovalerianic și ruynuvannya valtrativ - rechovina, chiar mai sensibil la infuzia de pajiști.
Administrator.
1. Explicați manifestarea puterii bălții la carbonatul de magneziu. Scrieți ecuația reacției pentru aspectul molecular și ionic. Ce mementouri poate fi folosit vicorist pentru prepararea tabletelor cu extract de valeriană?
2. Creați o transformare:
MgO→MgCl2 →MgSO4 →Mg(OH)2 →MgOHCI
Scrieți ecuația reacțiilor pentru aspectul molecular și ionic.
3. Caracteristicile generale ale elementelor grupelor VI, VII ale subgrupurilor laterale. Dominanța de oxid de crom, mangan și părți ale acestora. Semnificație medicală și biologică.
· Utilizarea gazului vicos de dioxid de carbon în producția farmaceutică pentru extragerea discursurilor biologic active din sirovina medicinală.
Administrator.
- Pe ce stăpâniri în acidul carbonic se află susținerea yoga în aceste scopuri?
- Creați o transformare:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Scrieți reacțiile de schimb ionic în formă moleculară și ionică.
- Caracterizarea caracteristică a elementelor grupei a VIII-a a subgrupului secundar. Stăpânirea sălii și yogo spoluk. Semnificație medicală și biologică.
Lista meselor de examen de la discipline
Concepte de bază și legile chimiei. O astfel de setare a vieții atomului.
Legea periodică și sistemul periodic D.I. Mendeliev la lumina vieții atomului.
Numiți, vedeți, înțelegeți, luminați, natura legăturii chimice.
Numire, mecanism de iluminare, puterea legăturii covalente. Valenţă. Etapa de oxidare.
Oksidi: numire, clasificare, nomenclatură, putere și metode de posesie.
Acizi: denumire, clasificare, nomenclatură, putere și metode de posesie.
Fundament: numire, clasificare, nomenclatură, putere și modalități de posesie.
Săruri: denumire, clasificare, nomenclatură, autoritate și metode de deținere.
Complex spoluky: numire, budova după Werner, tipi, nomenclatură.
Viteza reacției chimice. Oficiali, scho vplyvayut swidk_st reacție chimică.
Reacții chimice ireversibile și reversibile. Zelos chimic. Principiul lui M. Chatelier. Constante de capital propriu.
Reacții oxid-oxidante: cele mai importante, conceptele principale, ziua oxidării și reînnoirii, cei mai importanți agenți oxidanți și liderii reacției.
Sisteme de dispersie: desemnare, clasificare. Sisteme grosiere: suspensii, aerosoli, emulsii.
Koloidni razchiny: vyznachennya, stăpânire, obsesie, budova mycel.
Adevărate diferențe: desemnare, înțelegere de bază, esența procesului de diferențiere. Difuzie. Osmoză. Menghină osmotică.
Principalele prevederi ale teoriei disocierii electrice. Mecanismul de disociere electrică. Pas acea constantă de disociere.
Disocierea acizilor, bazelor, sărurilor. Disocierea diferenței de pH.
Esența hidrolizei. Hidroliza diferitelor tipuri de săruri. Hidroliza în etape.
Caracterizarea caracteristică a elementelor subgrupului principal al grupei VII. Semnificația medico-biologică a halogenilor
Clor, apă cu clor și acid clorhidric. Otrimanya, stăpânire. Clorură.
Kisnevі spoluki clor.
O caracteristică critică a calcogenilor. Kisen ta yogo la jumătatea drumului. Semnificația medico-biologică a acrișului.
Dominanța este pe jumătate acidă cu apa (apă, peroxid de apă). Zastosuvannya H 2 Pro 2 în medicină. Valoarea plumbului.
Sirka. Alotropia sirka liberă. Chimia puterii lumii. Circumnavigaţie. Acidul Serkovodny și sărurile її.
Puterea fizică și chimică a oxizilor de sulf, acizilor sulfuric și sulfuric, sărurilor acidului sulfuric, acizilor sulfuric, stagnarea acestora.
Trăsătura caracteristică a elementelor subgrupului principal al grupului V. Azot și putere.
Dominanța amoniacului și a sărurilor de amoniu. Zastosuvannya în medicină și farmacie.
Oxizi de azot. Acid azot și săruri її. Putere fizică și chimică, stosuvannya.
Puterea fizică și chimică a acidului azotic. nu cheltui. Semnificația medico-biologică a azotului și її spoluk.
Caracteristicile elementului 15 R. Fosfor ticălos: alotropie, putere fizică și chimică, obsesie.
fosfină. Oxizii de fosfor și acid fosforic: putere, obsesie. Semnificația medico-biologică a fosforului
Caracteristica caracteristică a elementelor grupei IV a subgrupului principal. Vuglets: Budova și dominanță fizică, alotropie vugletsyu, dominanță chimică.
Kisnevі spoluky vugletsiu: molecule Budova, dominanță fizică și chimică. Semnificația medico-biologică a cărbunelui și yoga spoluk.
Jumătate de silicon și yogo: cunoașterea naturii, bărbăția, puterea fizică și chimică. Semnificația medico-biologică a siliciului.
Subgrupul principal al grupului ІІІ: principala caracteristică a elementelor. Bor și yoga din lateral: otrimannya, putere fizică și chimică, zastosuvannya în medicină.
Fundaluri din aluminiu și yoga: obsesie, putere fizică și chimică. Semnificația medicală și biologică a aluminiului.
Metale din subgrupul principal al grupei a 2-a: caracteristici carismatice, obsesie, putere fizică și chimică. Săruri de calciu și magneziu. Duritatea apei. Usunennia zhorstkostі apă. Semnificația medico-biologică a elementelor din subgrupa principală a grupei II.
Luzhnі a aruncat: caracteristică caritabilă, obsesie, stăpânire, spoluhia cea mai importantă. Semnificație medicală și biologică.
Caracterizarea caracteristică a elementelor d. Metale din subgrupul secundar al grupului I. Pojdnannya midi, sribla. Semnificație medicală și biologică.
Metalele subgrupurilor laterale ale grupului II: o caracteristică critică a vieții, a puterii fizice și chimice. Semnificație medicală și biologică.
Subgrupurile laterale VI, VII ale grupului: caracteristica caracteristică a elementelor subgrupului, dominanța cromului, manganului și jumătatea acestora. Semnificație medicală și biologică.
Un subgrup al grupului VIII: o caracteristică generală a elementelor subgrupului, puterea sălii și yogo spoluk. Semnificație medicală și biologică.
Așezarea. Pe masa de piele în fața elevilor există un plan de lecție, o schemă pentru interacțiunea acidului azotic cu metalele, un set de reactivi și teste pentru fixarea materialului răsucit.
Oxizi de azot
Profesor.Ghiciți și scrieți formula pentru oxizii de azot. Yaki oksi se numesc salin, yaki - non-salin? De ce?
Învățați să scrieți în mod independent formulele a cinci oxizi de azot, să le denumiți, să determinați ceața de azot a acizilor kisnevy și să stabiliți reactivitatea dintre oxizi și acizi. Unul dintre elevi este scris pe dosh (tabel).
masa
Setarea oxizilor de azot, acizilor și sărurilor
Certificat demonstrativ:
interacțiunea oxidului de azot (IV) cu apa
Profesor. La vas NU 2 adaugati putina apa si amestecati, apoi incercati sa indepartati petele cu turnesol.
Ce este păzit? Rozchin chervonіє prin doi acizi care s-au stabilit.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Etapa de oxidare a azotului NU 2 mult noroc +4, atunci. este intermediar între +3 și +5, iac în rozchini stiykish, că oxidul de azot (IV) are doi acizi - azot nitric.
Depozit că molecula de Budova
Profesor.Scrieți formula moleculară a acidului azotic pe tablă, calculați greutatea moleculară și gradul de oxidare al elementelor. Îndoiți formulele structurale și electronice.
Învață să creezi astfel de formule (Fig. 1).
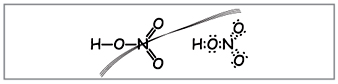
Profesor.Aparent, până la aceste formule, zece electroni sunt înfășurați în jurul azotului, dar nu îl puteți folosi, pentru că. azotul se găsește într-o altă perioadă, iar pe cât posibil pe bila exterioară, în cea nouă, poate fi mai puțin decât cei mai înalți electroni. Această superficialitate este stabilită, deci să presupunem că între atomul de azot și un atom se stabilește o legătură covalentă în spatele mecanismului donor-acceptor.(Fig. 2).
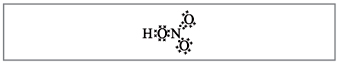
Mal. 2. Formula electronică a acidului azotic.
Electronii atomului de azot sunt marcați cu puncte negre
Aceeași formulă structurală a acidului azotic poate fi reprezentată după cum urmează(Fig. 3) :
Mal. 3. Formula structurală a acidului azotic
(conexiunea donor-acceptator a indicațiilor cu o săgeată)
Cu toate acestea, pe ultima cale sa adus că legătura de bază este împărțită egal între doi atomi de aciditate. Gradul de oxidare la azot în acidul azotic este de +5, iar valența (respectarea dezvăluie) este mai mult de jumătate, mai mult de jumătate din pariul electronic mare.
Puterea fizică a acidului azotic
Profesor.Înainte sunt sticle de acid azotic diluat și concentrat. Descrie puterile fizice pe care le poți prezice.
Învață să descrii acidul azotic ca sursă de importanță pentru apă, de culoare gălbuie, cu miros înțepător. Acid azotic Roschin fără culoare și inodor.
Profesor. Voi adăuga că punctul de fierbere al acidului azotic este de +83 ° C, punctul de îngheț este -41 ° C, tobto. pentru marile minți ale patriei. Un miros ascuțit și cele care, atunci când sunt salvate, nu se vor arde, se explică prin faptul că acidul este concentrat, este slab rezistent și este ușor, sau când este încălzit, se extinde adesea.
Puterea chimică a acidului
Profesor. Ghiciți ce fel de discursuri să interacționați cu acizii?(Învață să numești.)
Înainte de a reacționa, încercați să enumerați reacțiile și notați-vă avertismentele (reacțiile ar trebui notate în lumina TED).
Și acum suntem sălbatici față de puterile specifice ale acidului azotic.
Am spus că acidul, atunci când este salvat, este acum adus de reacția chimică:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Studiul înregistrează în mod independent balanța electronică a reacției.)
„Gazul îngropat”, care se vede(NO2) farbuy acid.
Este deosebit de necesar să se efectueze acid prin aducerea acestuia la metal. Știți că obișnuiau să scoată apa din diverși acizi, dar atunci când interacționează cu acidul azotic, acesta nu este îndepărtat.
Privește diagrama de pe birou, care arată cum se văd gazele în reacția acizilor de diferite concentrații cu metalele.(Robot cu o diagramă.)
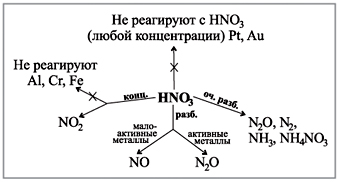
Certificat demonstrativ:
interacțiunea acidului azotic concentrat cu hidromel
Și mai eficientă este demonstrarea reacției acidului azotic (conc.) cu pulbere midi sau bucăți de miere tăiate fin:
Învață să înregistrezi independent balanța electronică a reacției:
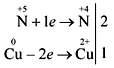
Posesie de acid
Profesor. Lecția va fi de neînțeles, de parcă nu am putea vedea posesia nutrițională de acid azotic.
Metoda de laborator: diya acid sulfuric concentrat pe nitrat (Fig. 5).
NaN03+H2S04=NaHS04+HNO3.
În industrie acidul se obține în principal prin metoda amoniacului.
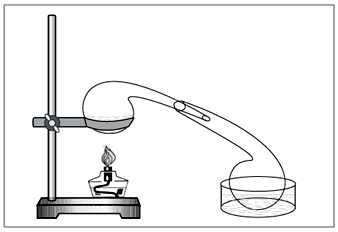
Mal. 5. Pentru retragerea acidului azotic în laborator dos
sticlă chimică veche bătută manual - o replică
Metoda de a conține acid cu azot și acid la o temperatură de peste 2000 ° C (arc electric) nu a îndepărtat nicio expansiune specială.
În Rusia, istoria introducerii acidului azotic este asociată cu numele chimistului-tehnolog Ivan Ivanovich Andreev (1880–1919).
Vin și 1915 creând prima instalație de reducere a acidului cu amoniac și implementarea metodei de expansiune la scara fabricii în 1917. Prima fabrică a buv zbudovaniya lângă Donețk.
Această metodă include câțiva pași.
1) Prepararea sumish-ului de amoniac-pulbere.
2) Oxidarea amoniacului este din nou acidă pe o foaie de platină:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Oxidare suplimentară la oxid de azot (II) la oxid de azot (IV):
2NO + O2 = 2NO2.
4) Determinarea oxidului de azot (IV) în acid apos:
3NO2+H2O=2HNO3+NO.
Deoarece se face o distincție în prezența acidului, tot oxidul de azot (IV) este transformat în acid azotic.
5) Etapa finală în îndepărtarea acidului azotic este purificarea gazelor, cum ar fi atmosfera, și a oxizilor de azot. Depozitarea gazelor: până la 98% azot, 2-5% acid și 0,02-0,15% oxizi de azot. (Azotul este folosit în primul rând, luat pentru oxidarea amoniacului.) Dacă oxizii de azot din aceste gaze sunt mai mari de 0,02%, atunci regenerarea catalitică a acestora la azot se efectuează în mod special, deoarece cantități atât de mici din acești oxizi conduc la un mediu mare. Probleme.
După tot ce s-a spus, postul este nutrițional: avem nevoie de acid acum?
Stagnarea acidului
Profesor.Acidul azotic al vicoristului este folosit pentru fermentație: dobriv nitric și azotat amino în prima linie (cum îl obțineți?); discursuri vibuhov (de ce?); barvnikov; nitrativ, despre yakі timetsya la lecția care urmează.
Atașat la material
Experiență de clasă frontală
– De ce este rata de oxidare a azotului din acidul azotic +5 și valența chotiri?
- Cu ce metale nu intră acidul azotic în reacție?
- Trebuie să știi acidul clorhidric și acidul azotic, sunt trei metale pe masă - cupru, aluminiu și aur. Cum dai vina si de ce?
Test
Opțiunea 1
1. Ce serie de numere arată diferența dintre electroni pentru energie egală în atomii de azot?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Finalizați egalizarea reacțiilor practice:
1) HNO 3 (rozb.) + Cu …;
2) Zn + HNO3 (conc.) ...;
3) HN03 + MgC03...;
4) CuO + KNO 3 ... .
3. Spune-mi cum să ilustrez una dintre etapele procesului productie industriala acid azotic.
1) 4NH3 + 5O2 = 4NO + 6H20;
2) 5HNO3 + 3P + 2H20 = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Starea de oxidare negativă se manifestă prin azot în următoarele:
1) N20; 2) NU; 3) NO2; 4) Na3N.
5. Interacțiunile așchiilor de cupru cu acid azotic concentrat pentru a se produce până la stingere:
1) NO2; 2) NU; 3) Nr. 2; 4) NH3.
Opțiunea 2
1. Valoarea celei mai mari valențe pentru azot este una:
1) 1; 2) 2; 3) 5; 4) 4.
2. Puteți nota combinația de acid azotic concentrat cu metale ofensive: sodiu, aluminiu, zinc, fier, crom.
3. Alegeți vorbirea, cum ar fi sirovina pentru extracția acidului azotic:
1) azot și apă;
2) amoniac, apă repetată;
3) cheltuiesc.
4. Acidul azotic concentrat nu reacționează cu:
1) dioxid de carbon;
2) acid clorhidric;
3) cărbune;
4) hidroxid de bariu.
5. Odată cu interacțiunea acidului diluat cu magneziul, se stabilește:
1) NO2; 2) NU; 3) N20; 4) NH4NO3.
Vіdpovіdі pe teste Opțiunea 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opțiunea 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Placa turnantă Tririvny Zalik clasa 11
Subiect: " NEMETAL"
Formularul lecției: hol
Tsіl: treceți în revistă cunoștințele dobândite de elevi pe tema: „Nemetals”; invata despre de mare putere nemetal care їх spoluk; pentru a continua să modeleze abilitățile de cunoaștere stosuvannya în situații non-standard și de viață, în victoriile sarcinilor individuale și diferențiate.
administrator:
1. Verificați cunoștințele și consolidați cunoștințele oamenilor de știință despre non-aruncătorii din acea jumătate; accepta logic dezvoltarea gandirii mentale si libertatea minei chimice; trecerea de la adoptarea formal - logică a materialului de către cei la ideea logică figurat cu ajutorul unor sarcini diferite, fezabile și nestandardizate.
2. Pentru a dezvolta obiceiurile de precauție, manifestarea iertărilor, prețuirea zilei, vminnya pentru a vedea smuțul, pentru a justifica faptele care sunt răsucite, pentru a exprima în mod logic gândurile și robiti visnovka; citește rozіrkovuvati, robiti dezamăgit, prezice.
3. Adopta modelarea ideilor principale de vedere a luminii prin activitatea educațională și creativitatea încrederii în sine a elevilor.
4. Vikhovuvati vminnya pratsyuvati independent de zastosuvannyam, acel control reciproc. Arată zv'yazok de către cei care trăiesc toată viața. Vihovuvati svetoglyad științific pe baza autorității vzaimozv'yazku și a vieții.
Deținând acel reactiv: eprubete, lămpi cu alcool, eprubete, syrniki și alte tipuri: ; ;
; ;
;
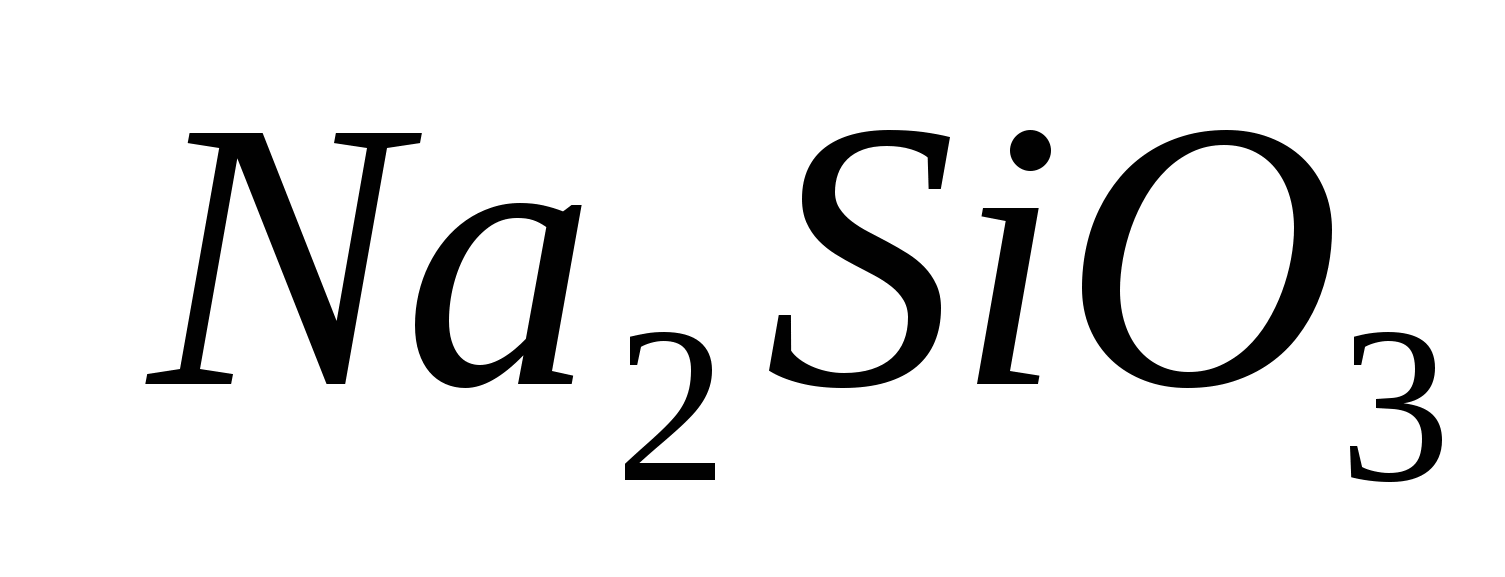 .
.
Pregătirea pentru sală.
Profesorul pregătește sarcina a trei pliuri egale ale speciilor ofensive: test, nutriție teoretică, yakіsnі și rozrahunkovі zavdannya, zavdannya pentru transformarea discursurilor.
Profesorul pregătește elevii, cum revizuiesc sarcina.
Pentru zilele de 1 - 2 ale lunii se afiseaza la birou o fisa informativa pana la usa.
Foaia de traseu este vizibilă pe piele. Negrumul lucrării la etape se arată pe foile de traseu.
FIȘĂ DE RUTA.
F.I. învăţare
Numirea scenei
Numărul de etape
număr de ordine
Semnătura recenzentului
problema lui Rosarakhun
Recunoaştere
Reîncarnare
Lecția ascunsă.
Învață să intri în clasă cu foi de traseu, 5 foi albe, cu un pix și mergi la scenă, desemnări pentru Nr. 1. Învață să jefuiești sarcina de pliere egală și garanți pentru noua literă chi us, la etapa de „ recunoașterea discursurilor” trece experimentul.
Pe stadiul de piele se adaugă 7 - 8 penne, se reverifică, se pun în foaia de traseu rіven, nr.
Scorul este stabilit ca medie aritmetică a tuturor etapelor.
PLUS
„Recunoașterea discursurilor”
1 rіven
1. Aduceți prezența ionului 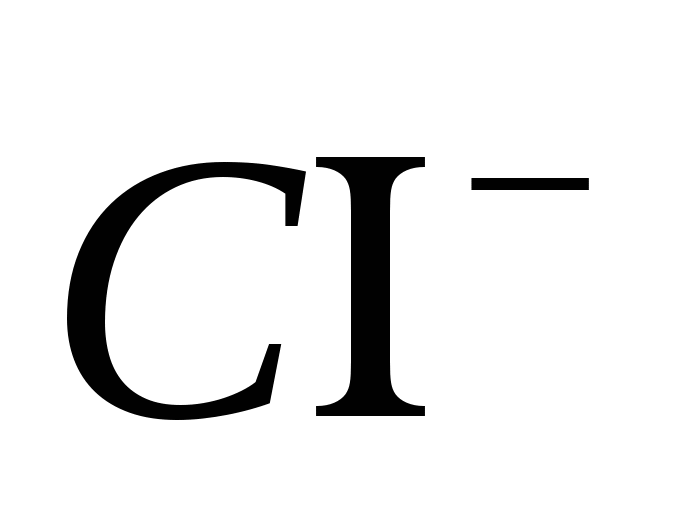
2. Aduceți prezența ionului 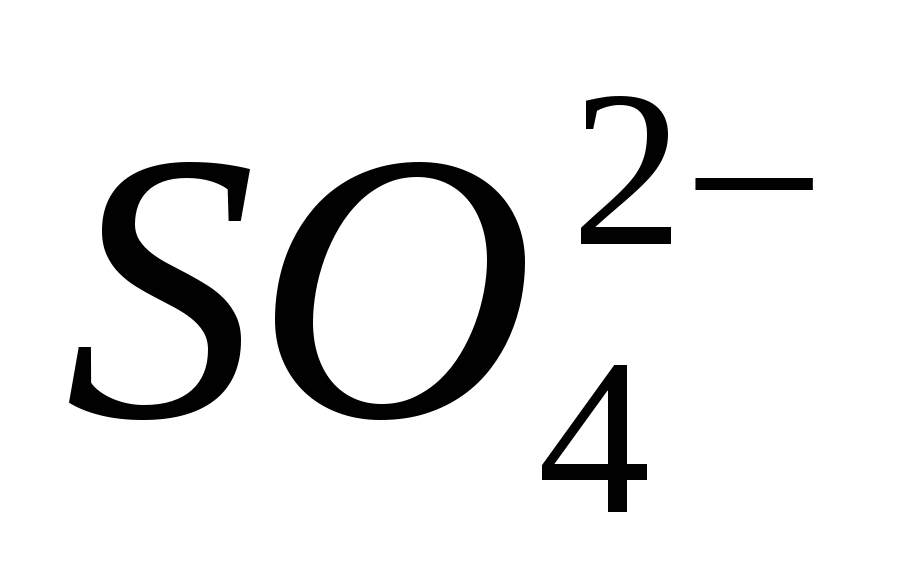
3. Aduceți prezența ionului 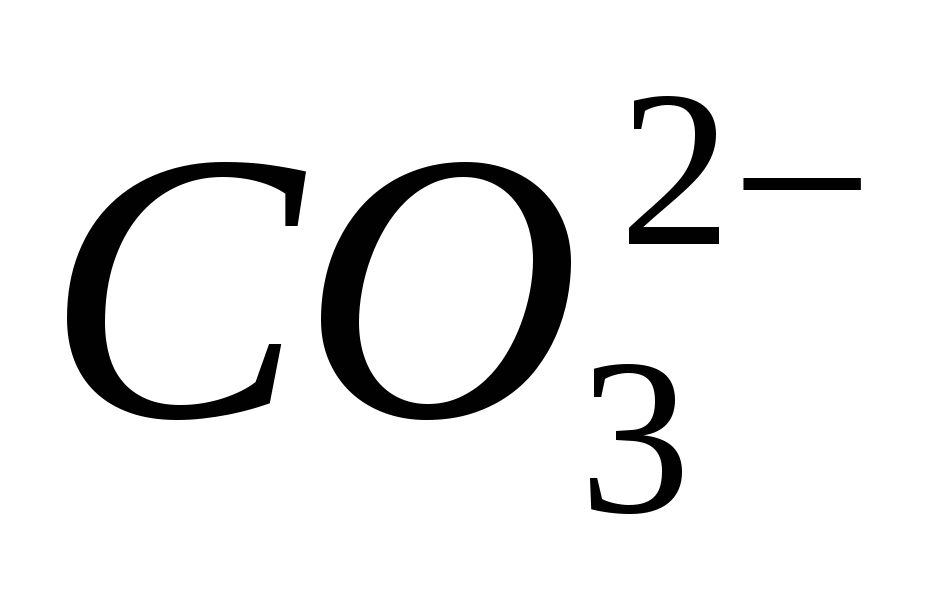
4. Aduceți prezența ionului 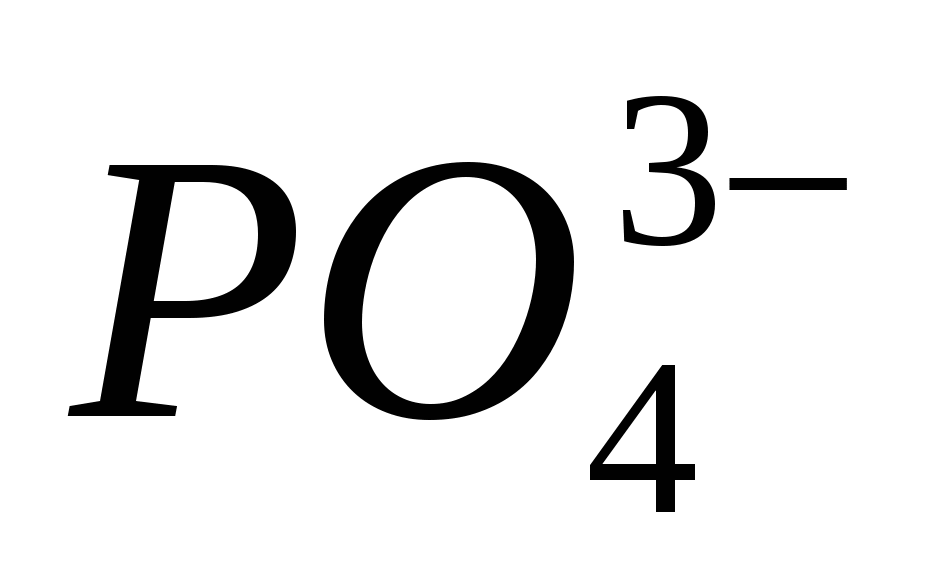
5. Aduceți prezența ionului 
2 rіven
1. Recunoașteți diferența pentru ajutorul unui reactiv:
2. Recunoașteți diferența pentru ajutorul unui reactiv:
3. Recunoașteți diferența pentru ajutorul unui reactiv:
4. Recunoașteți diferența pentru ajutorul unui reactiv: 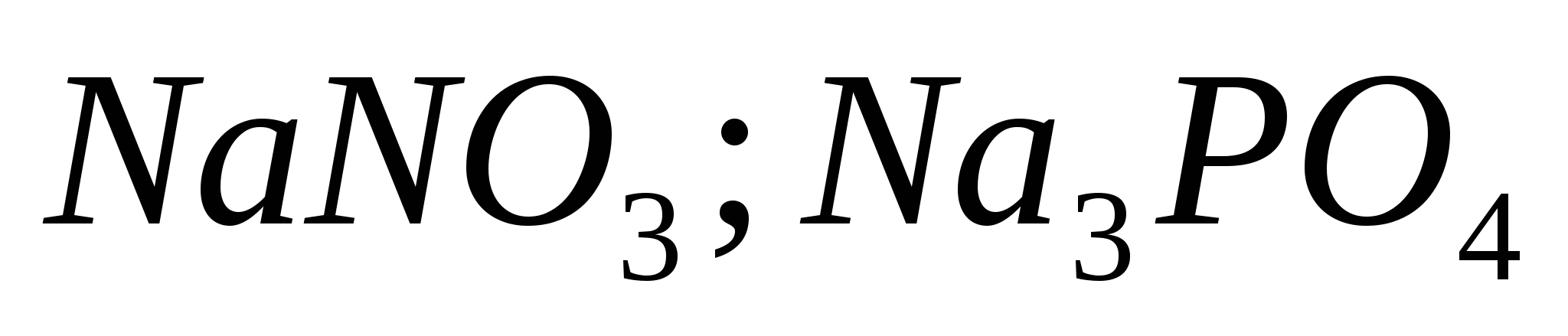 ;
;
5. Recunoașteți diferența pentru ajutorul unui reactiv:
3 rіven
1. Recunoaștere fără reactivi aditivi:
2. Recunoaștere fără reactivi aditivi:
3. Recunoaștere fără reactivi aditivi:
4. Recunoaștere fără reactivi aditivi:
5. Recunoaștere fără reactivi aditivi:
Etapa „Conversia discursurilor”
1 rіven
1. Opriți reacția
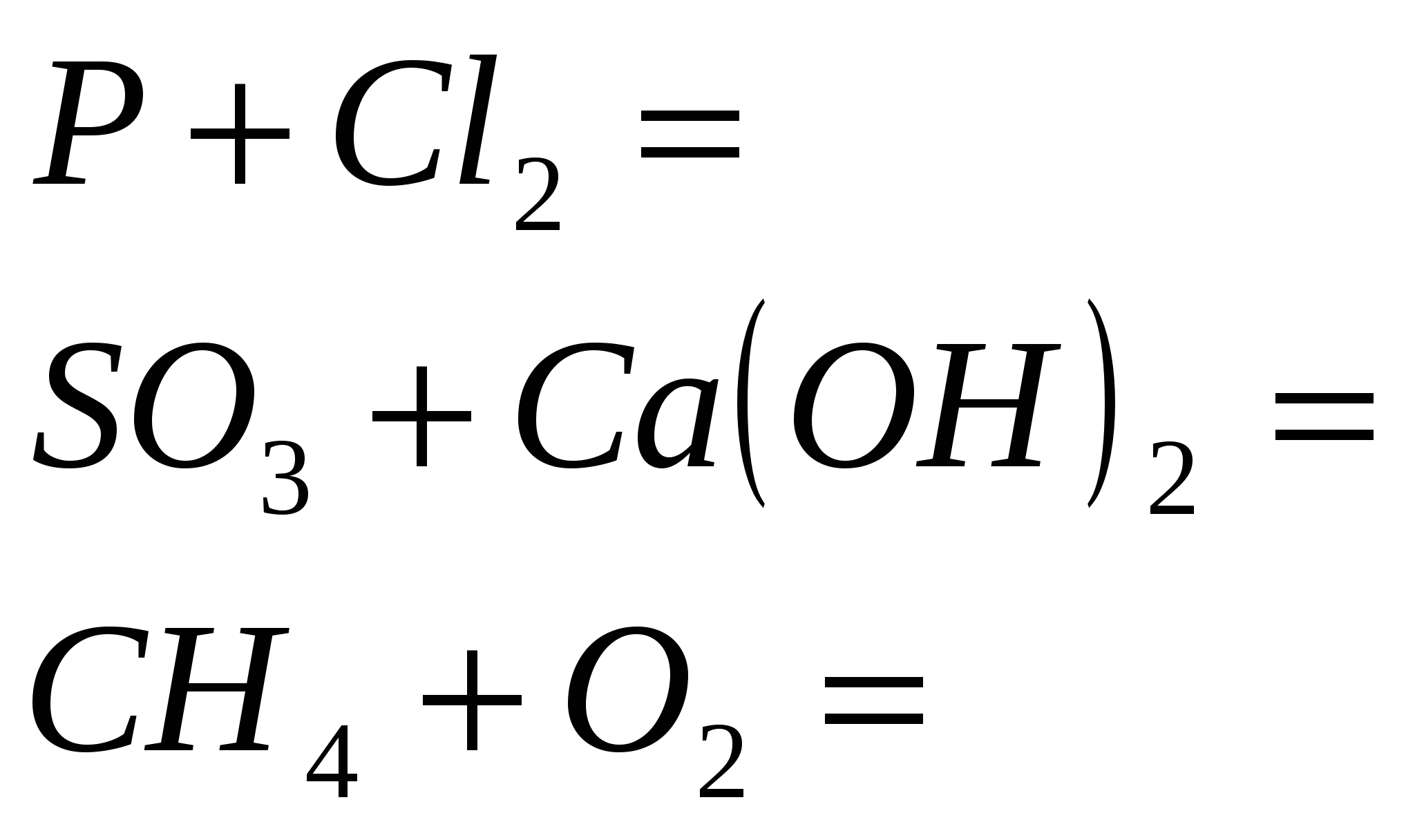
2. Încheiați reacția
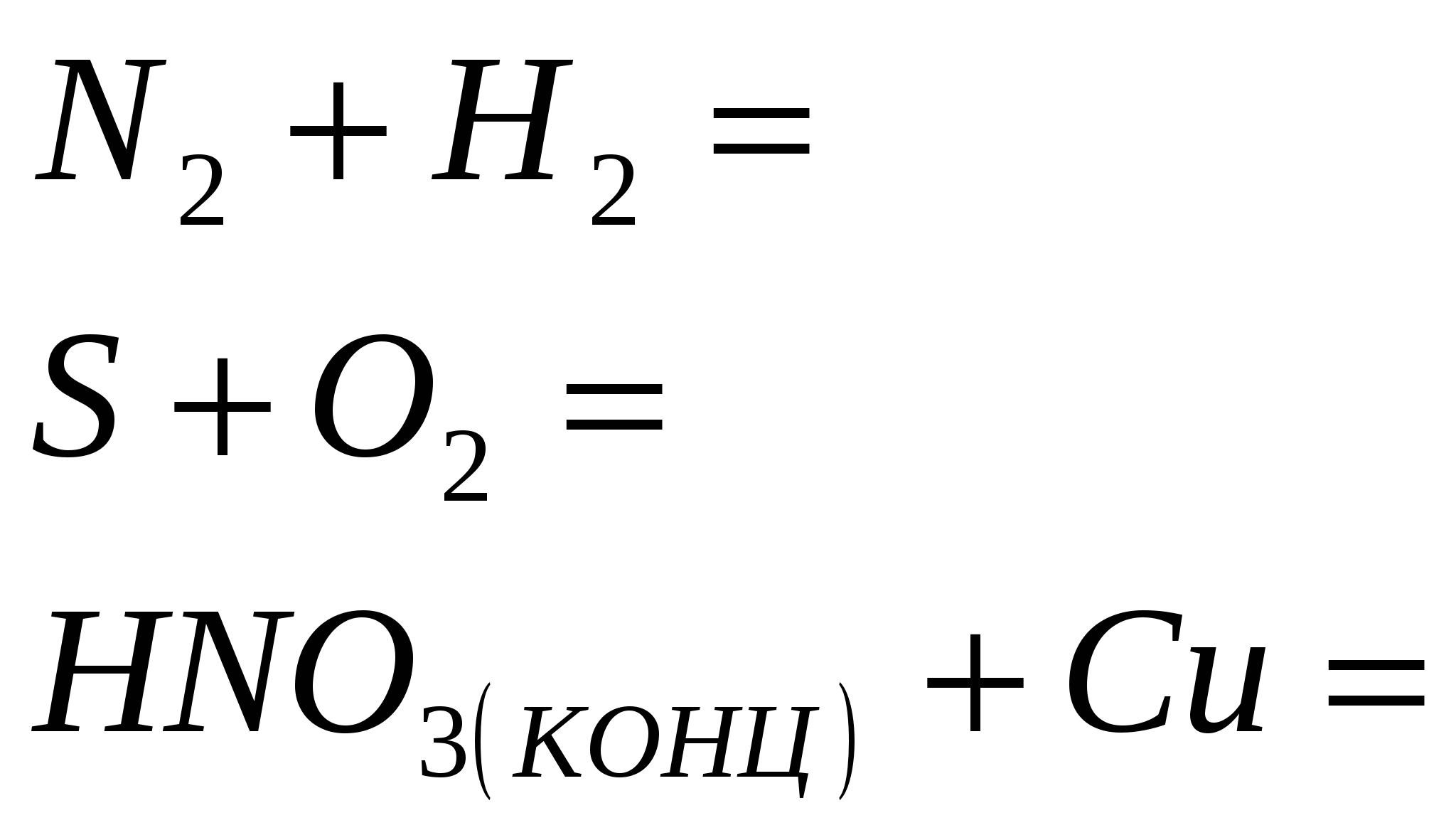
3. Terminați reacția
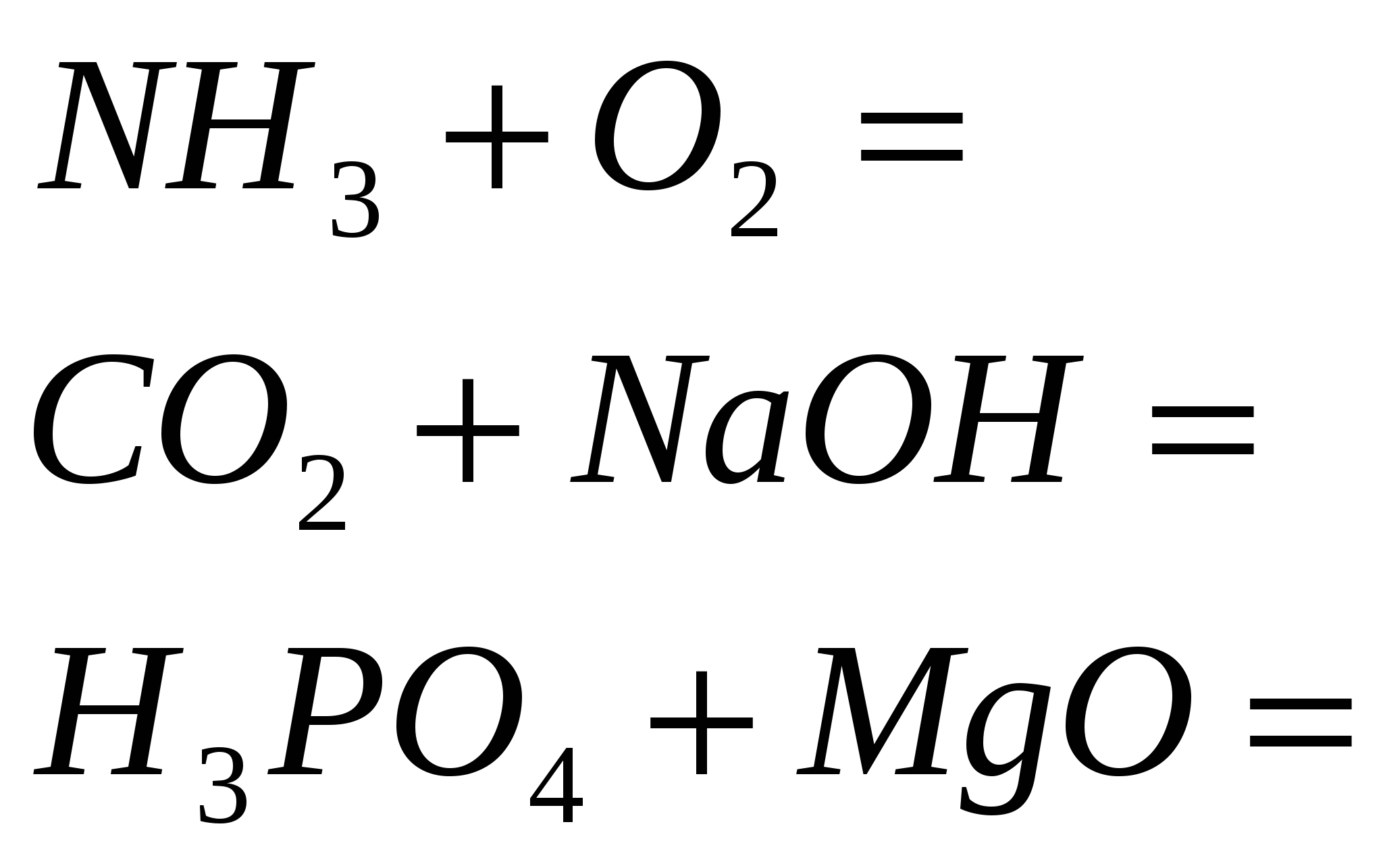
4. Terminați reacția
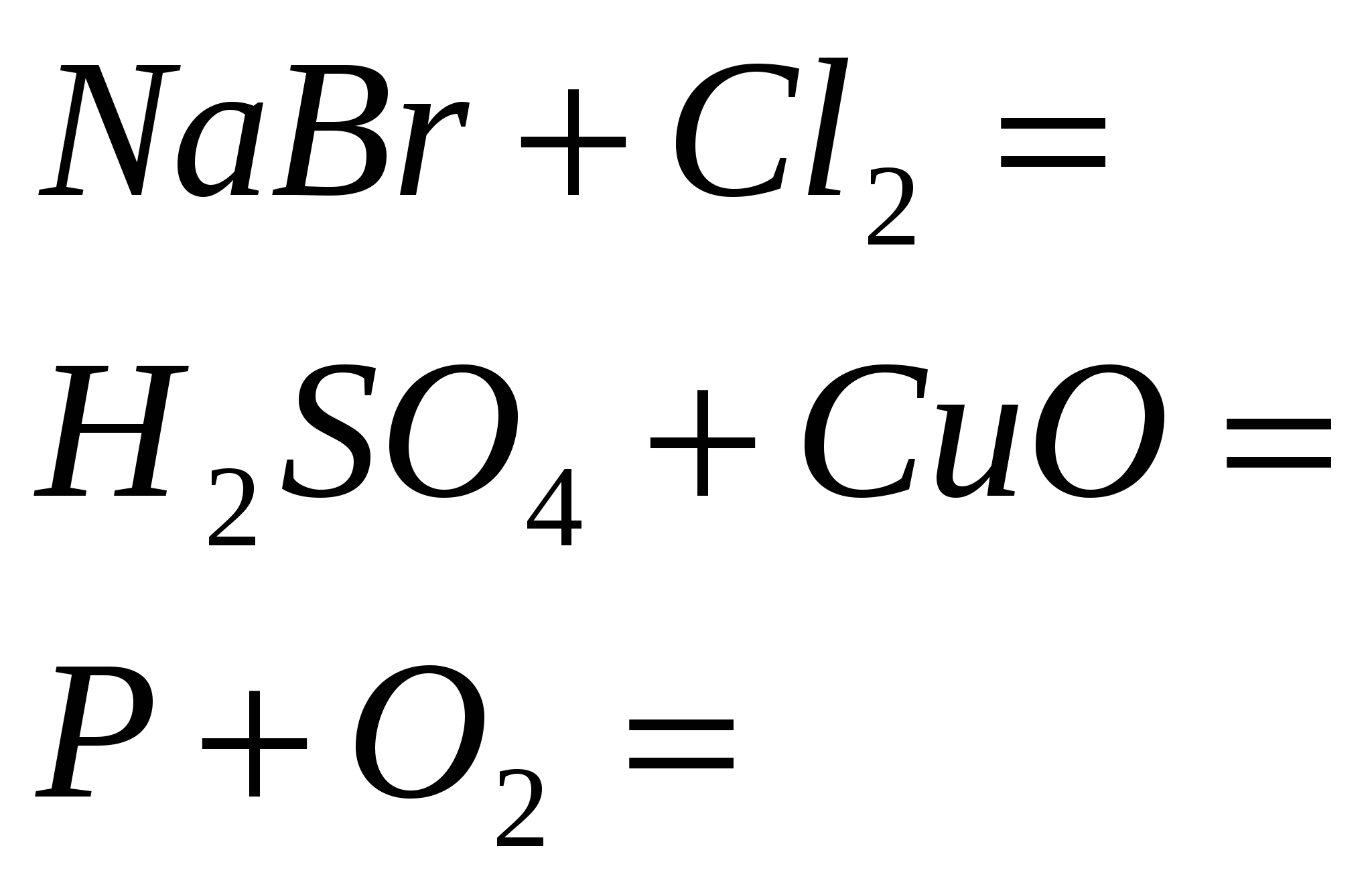
5. Terminați reacția
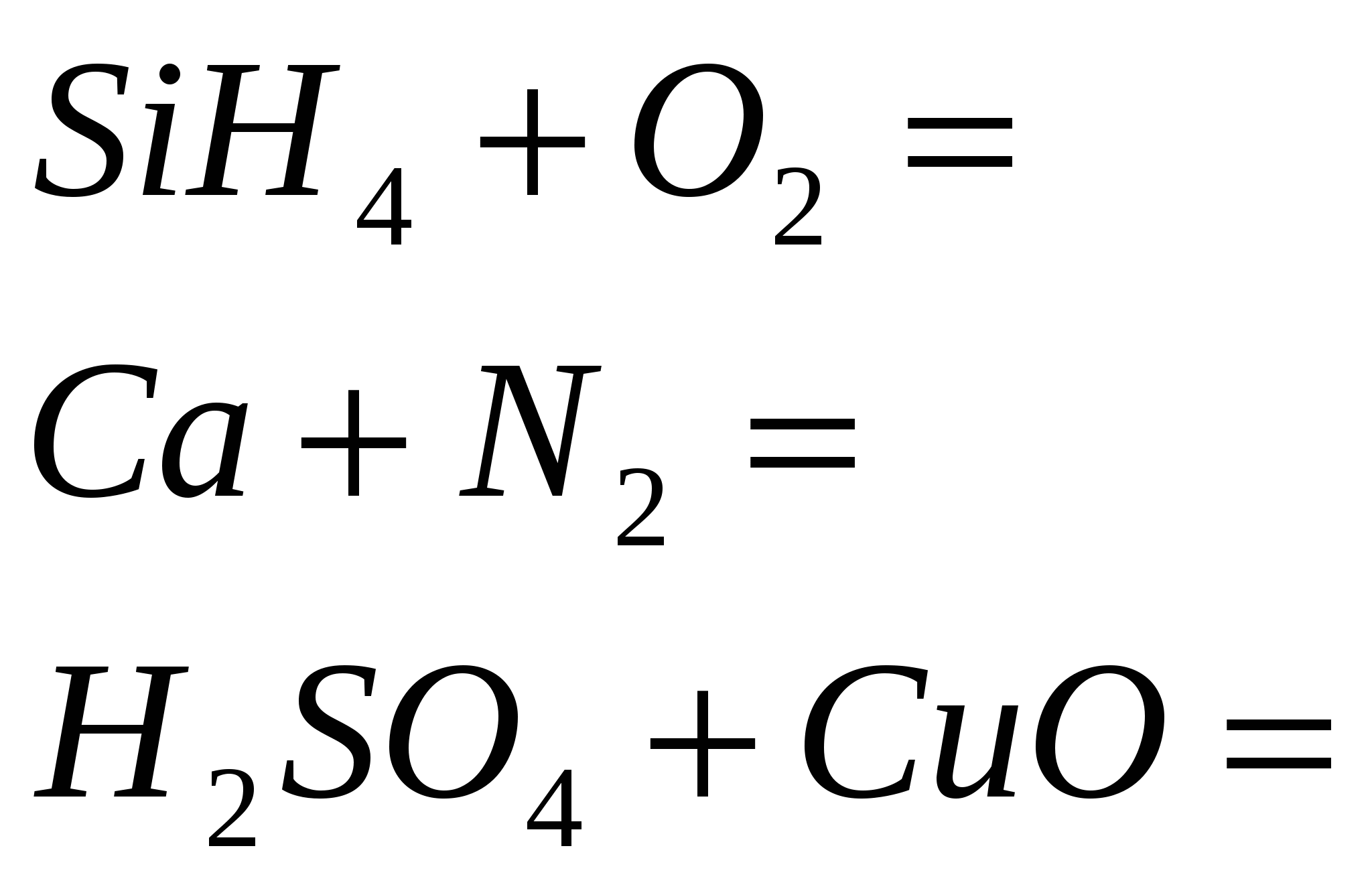
2 rіven
Creați o transformare:
3rіven
Creați o transformare:
3.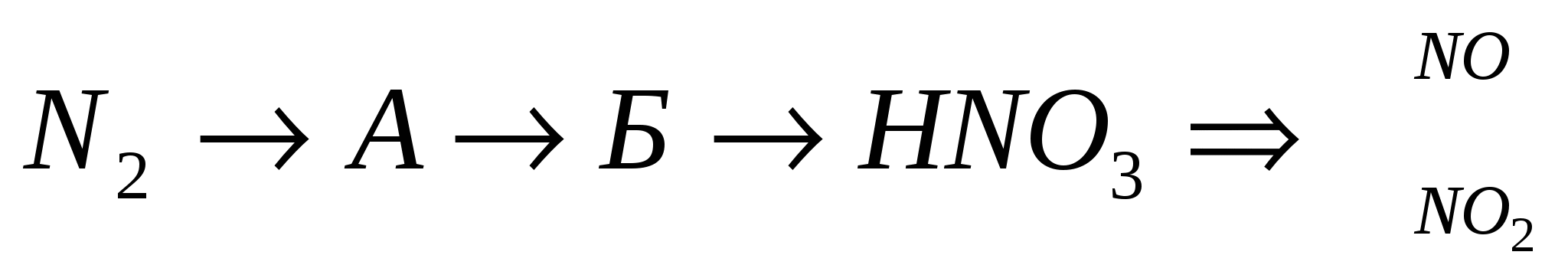
Etapa „Test”
Opțiunea 1
a) O, b) S, c) Cl, d) C, e) Si.
A) 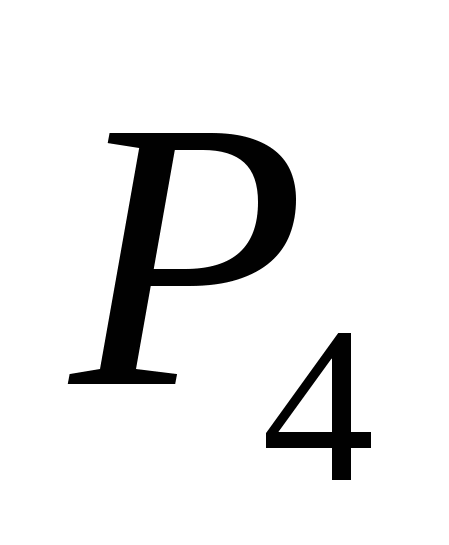 , b) C , c)
, b) C , c) 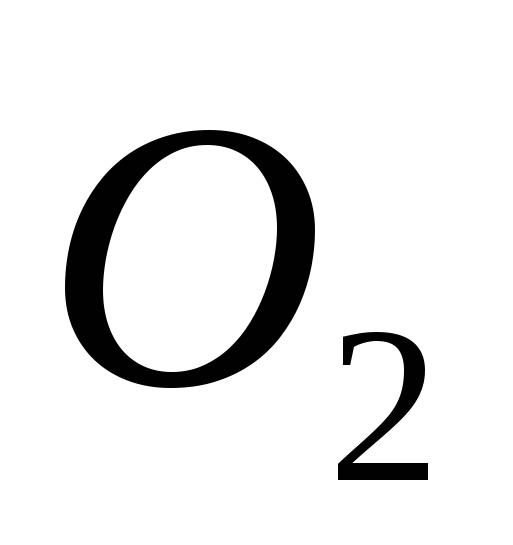 , G)
, G) 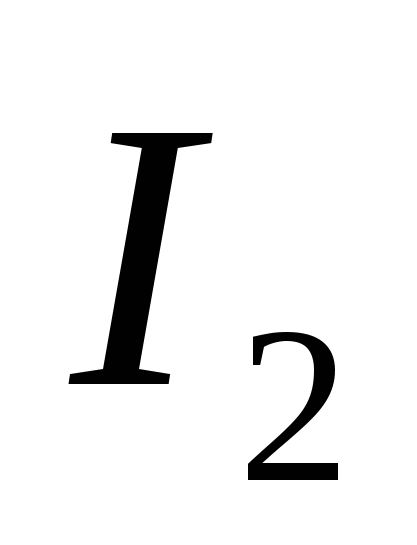 e)
e) 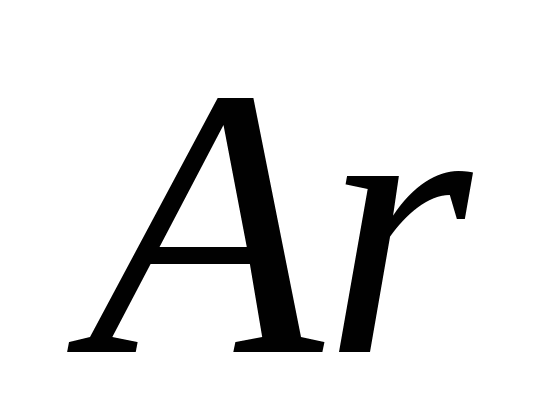 .
.
A)  , b)
, b) 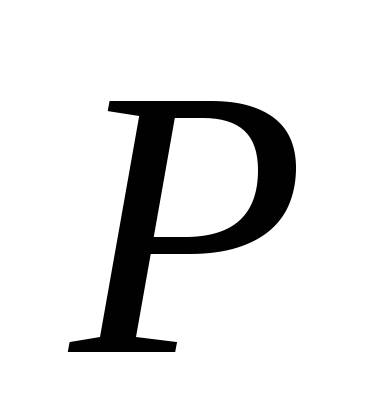 , v)
, v)  , G)
, G)  e)
e)  .
.
4. Formula electronică a elementului. Yogo flying vodnev spoluk:
A)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Puterea acizilor hidrohalici crește la rând:
A) ![]()
b) 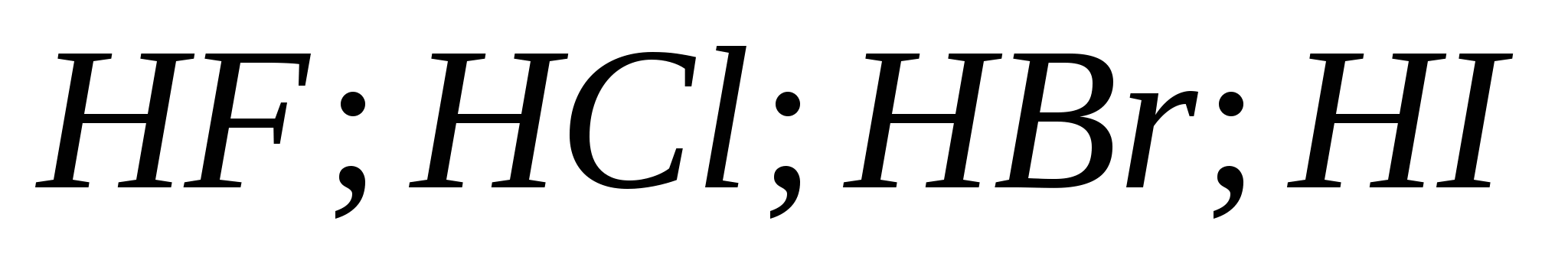
v) 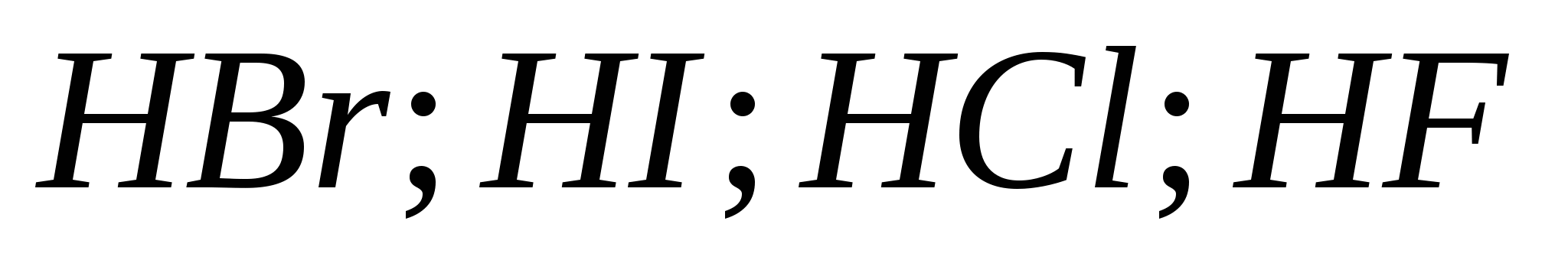
G) 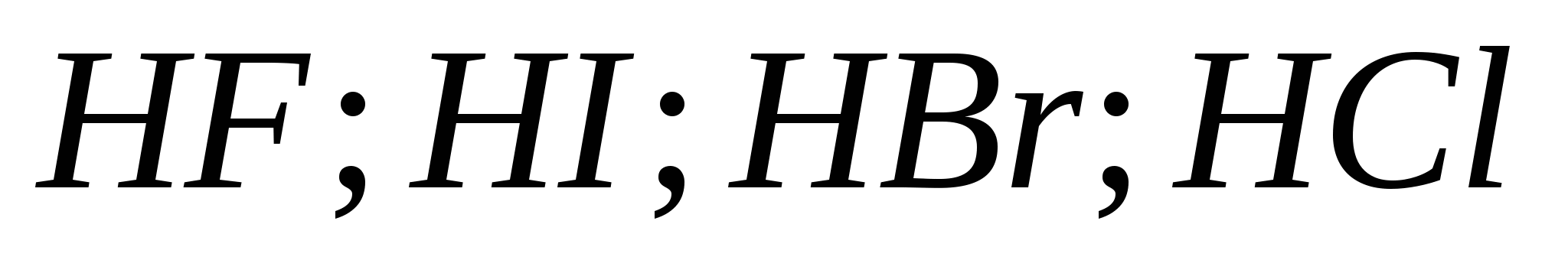
6. Din halogeni, vorbirea a fost blocată în copiii luptători:
a) fluor; b) clor; c) iod; d) brom.
7. Acidul sulfuric spart prezintă putere de oxidare pentru raportul de atomi:
A)  , b)
, b)  , v)
, v)  .
.
8. Oxidul de azot V poate fi combinat:
A) 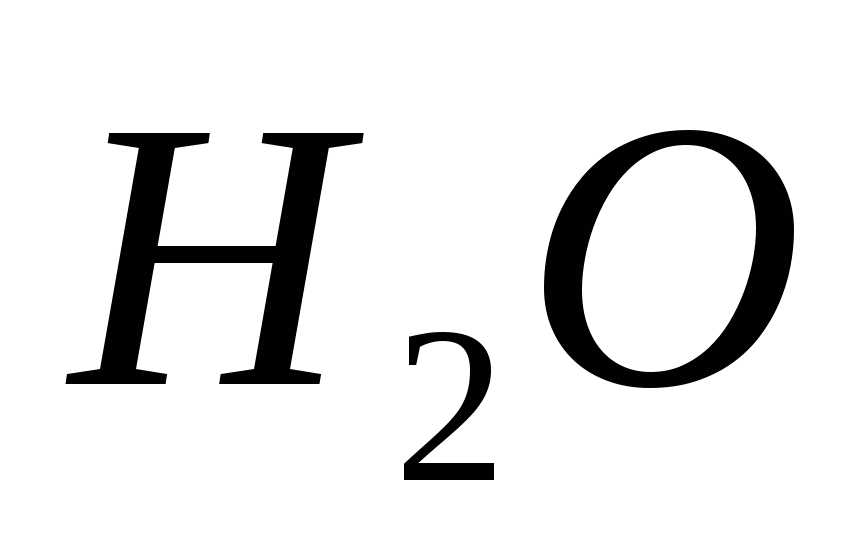 , b)
, b) 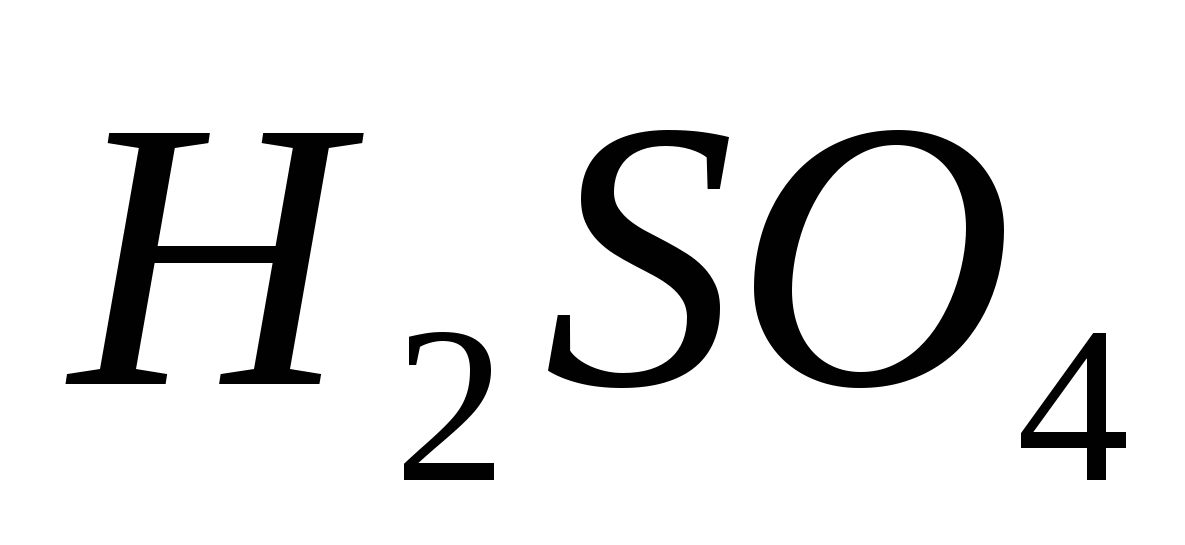 , v)
, v)  , G)
, G) 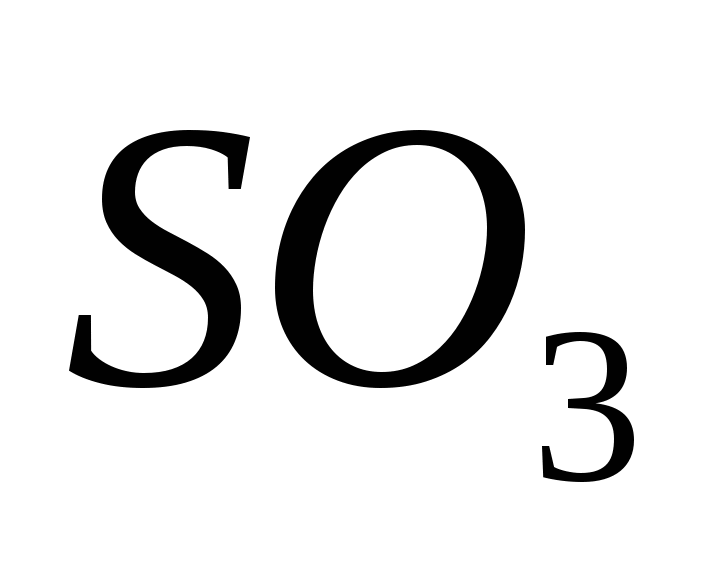 e)
e)  .
.
9. Reacție: aduceți o astfel de putere amoniacului:
a) oxidant, b) redundant, c) acid, d) bazic.
10. Forța acizilor la rând
a) se schimbă, b) se mărește, c) se mărește treptat, apoi se schimbă; d) să cadă încet, apoi să crească, e) să nu se schimbe.
Opțiunea 2
Atomic cristal grati mum discursuri simple, aprobate:
A)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Gaze pentru scurgeri normale є:
A)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e) 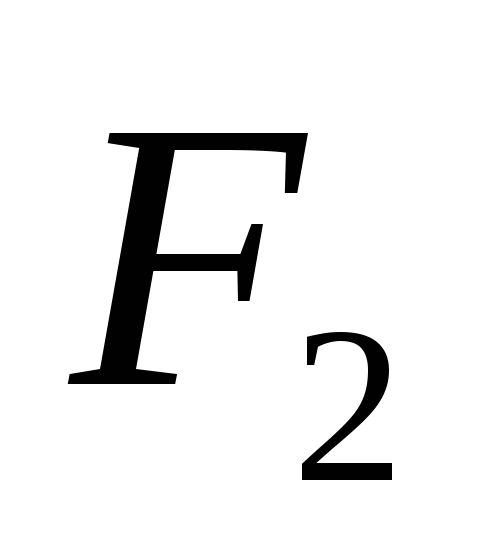 .
.
3. Modificările alotropice alcătuiesc următoarele elemente:
A) 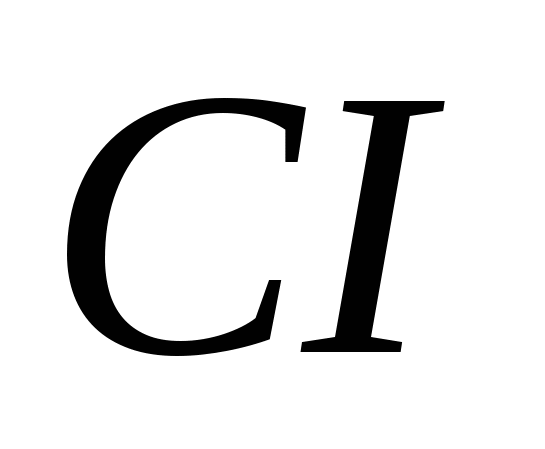 , b)
, b) 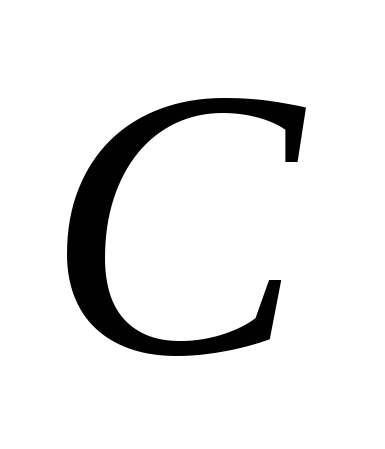 , v)
, v) 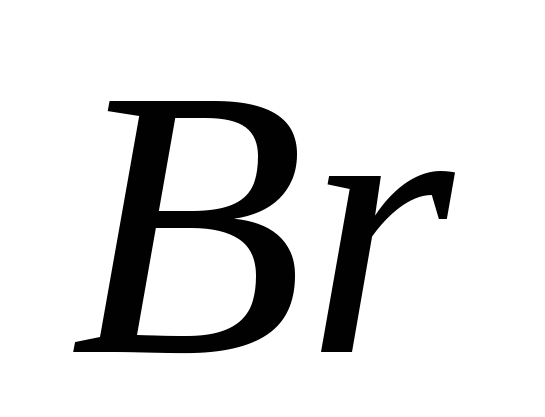 , G)
, G) 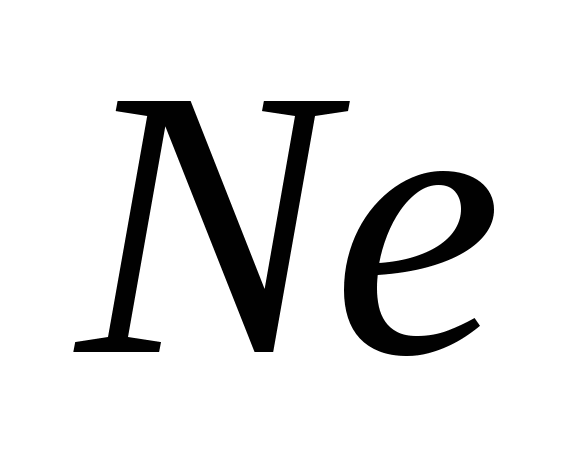 e)
e)  ,
,
4. Formula electronică a elementului. Yogo flying vodnev spoluk:
A) 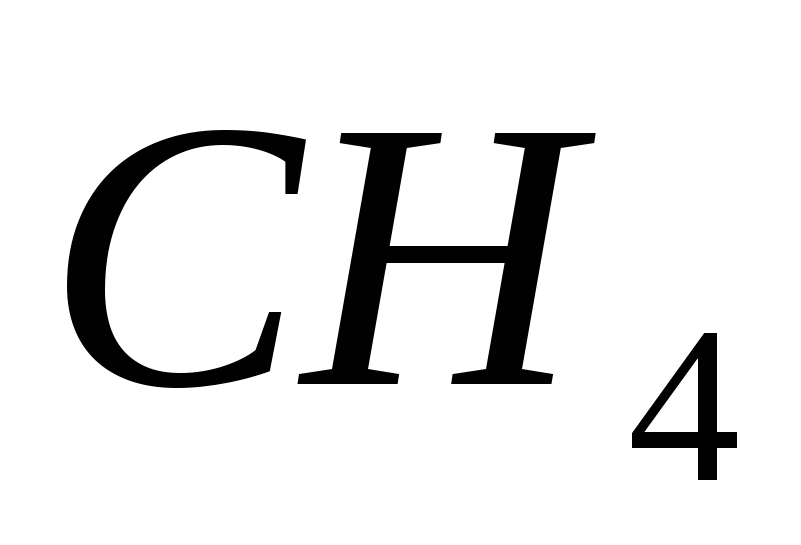 , b)
, b) 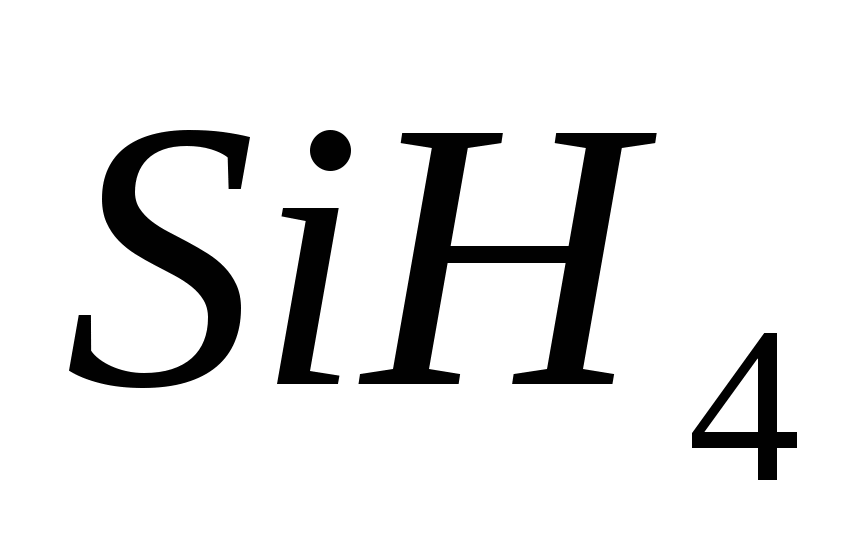 , v)
, v)  , G)
, G) 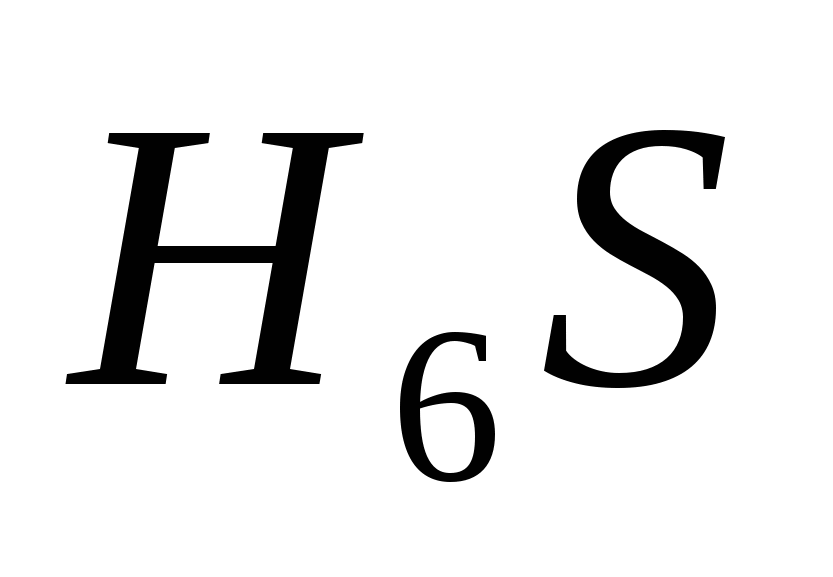 e)
e)  .
.
5. Puterea principală a apelor de vară se schimbă în seria:
A) 
b) 
v) 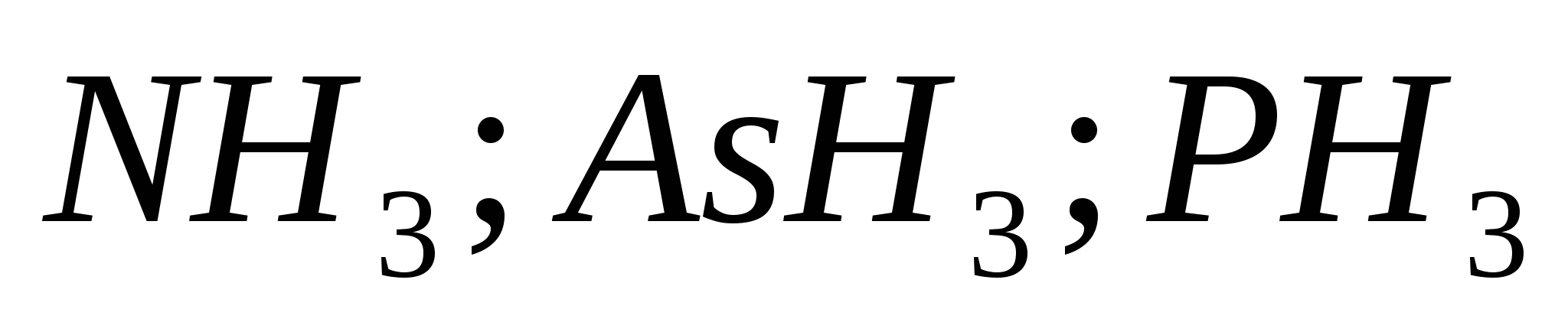
G) 
6. Pentru clorul de ghiveci, puteți vicora diferite concentrații:
A)  , b)
, b) 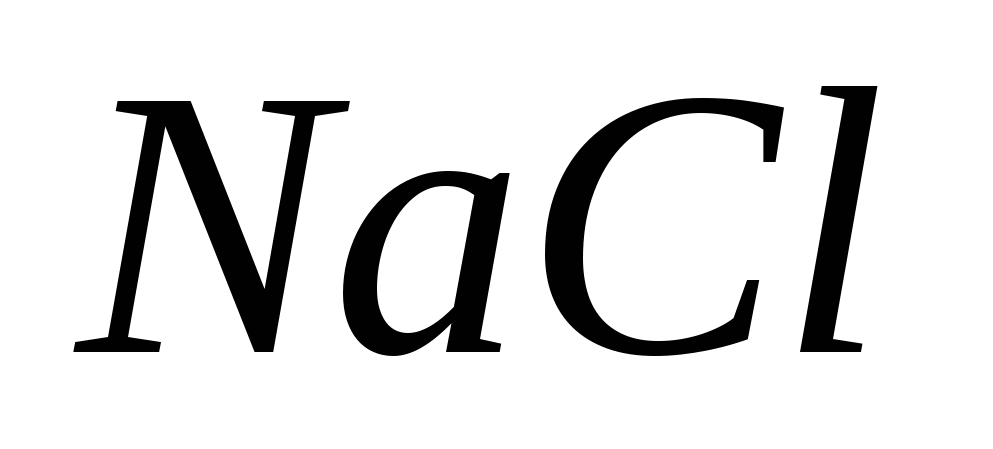 , v)
, v)  , G)
, G)  .
.
7. Acidul sulfuric concentrat prezintă putere de oxidare pentru gama de atomi:
A)  , b)
, b)  , v)
, v)  .
.
NOTĂ: 9-10 răspunsuri corecte - „5”; 7-8-"4"; 5-6-"3"; mai putin de 5-2
Etapa „Teorie”
am rіven (pe "3")
Scrieți nivelul reacțiilor care caracterizează puterea acidului sulfuric diluat.
Scrieți viteza de reacție care caracterizează puterea oxidului de sulf (VI).
Scrieți ecuația reacțiilor care caracterizează puterea acidului clorhidric.
Scrieți ecuația reacțiilor care caracterizează puterea oxidului de fosfor (V).
Scrieți reacții egale care caracterizează puterea amoniacului.
II rіven (pe "4")
Notează formulele apelor de vară ale nemetalelor în perioada II. Explicați cum și de ce se schimbă aceste puteri acide.
Notați formulele celor mai mari oxizi de nemetale din perioada a III-a. Explicați cum și de ce se schimbă aceste puteri acide.
Notează formulele celor mai importanți acizi ai elementelor din perioada a III-a. Explicați cum și de ce se schimbă aceste puteri acide.
Notați formulele apelor volatile ale nemetalelor din subgrupa VI. Explicați cum și de ce se schimbă aceste puteri acide.
Scrieți formulele celor mai importanți acizi ai elementelor subgrupei VA. Explicați cum și de ce se schimbă aceste puteri acide.
III rіven (pe "5")
Echilibrează puterea oxidantă și acidă a acidului sulfuric și azotic. Vidpovid confirmă cu reacții egale.
Echilibrează puterea oxidantă și acidă a oxidului de sulf (IV) și a oxidului de carbon (IV). Vidpovid confirmă cu reacții egale.
Echilibrează puterea oxidantă și acidă a apei și a fluorhidrurii. Vidpovid confirmă cu reacții egale.
Echilibrează puterea oxidantă și acidă a acidului azotic concentrat și diluat. Vidpovid confirmă cu reacții egale.
Echivalează puterea oxidantă și acidă a oxidului de carbon (II) și a oxidului de carbon (IV). Vidpovid confirmă cu reacții egale.
Etapa „sarcina lui Rozrahun”
am rіven (pe "3")
II rіven (pe "4")
La interacțiunea cu 37 g de hidroxid de calciu cu sulfat de amoniu, s-au îndepărtat 15 g de amoniac. Calculați fracția de masă a amoniacului produs.
Când spalyuvanni în acru 62 g de fosfor, 130 g de oxid de fosfor (V) au fost luate. Calculați fracția de masă a producției de oxid de fosfor (V).
De câte grame de hidroxid de sodiu 10% aveți nevoie pentru a neutraliza 8,96 litri de apă cu clor?
Câțiva litri de dioxid de carbon pot fi folosiți pentru a stoca 10 kg de vape, care vor acoperi 20% din case.
Câte grame de asediu sunt stabilite pentru trecerea a 11,2 litri de dioxid de carbon prin 900 g de hidroxid de bariu 10%?
III rіven (pe "5")
Ce volum de acid azotic 80% (pl. 1,46 g/ml) este necesar pentru „distribuirea” a 32 g midi?
Cât de multă masă midi va fi necesară pentru ca reacția cu acid azotic prea concentrat să ia 4 litri (N.O.) de oxid azotic (IV), astfel încât fracția de volum a producției de yoga să devină 96%?
Când s-a „variat” concentrația de acid sulfuric în 20 g de aliaj de aur, s-au observat 4,2 l (n.o.) de oxid de sulf (IV). Specificați fracția de masă în % midi pentru acest aliaj.
Prin distribuția de iodură de potasiu au fost trecute gaze sumish de clor și apă cu un volum de 1 litru. Am văzut 5,08 r de iod. Determinați fracția de volum (%) a clorului gazos din suma de evacuare.
Siliciul Sumish și vugillya cu o masă de 10 g au fost prelucrate cu o soluție de hidroxid de sodiu prea concentrată. După reacție, s-au observat 5,6 litri de apă (n.s.). Desemnați fracția de masă a siliciului (%) pentru această sumă.
