Siarka. Siarkowodór i siarczki
4.doc
240Siarka. Siarkowodór, siarczki, wodorosiarczki. Tlenki siarki (IV) i (VI). Kwas siarkowy i kwas siarkowy i ich sole. Estry kwasu siarkowego. Tiosiarczan sodu
4.1. Siarka
Siarka jest jednym z niewielu pierwiastków chemicznych stosowanych przez ludzi od kilku tysięcy lat. Jest szeroko rozpowszechniony w naturze i występuje zarówno w stanie wolnym (siarka rodzima), jak iw związkach. Minerały zawierające siarkę można podzielić na dwie grupy - siarczki (piryty, błyskotki, manekiny) i siarczany. Natywna siarka występuje w dużych ilościach we Włoszech (wyspa Sycylia) iw USA. W WNP złoża siarki rodzimej występują w rejonie Wołgi, w państwach Azji Środkowej, na Krymie iw innych obszarach.
Minerały pierwszej grupy obejmują połysk ołowiu PbS, połysk miedzi Cu 2 S, połysk srebra - Ag 2 S, zaczep cynku - ZnS, zaczep kadmu - CdS, piryt lub piryt żelaza - FeS 2, chalkopiryt - CuFeS 2, cynobr - HgS.
Minerały drugiej grupy obejmują gips CaSO4 2H2O, mirabilit (sól Glaubera) - Na2SO4 10H2O i kizerit - MgSO4 H2O.
Siarka występuje u zwierząt i roślin, jako część cząsteczek białka. Organiczne związki siarki znajdują się w ropie naftowej.
Pierwsze
1. Gdy siarkę otrzymuje się ze związków naturalnych, na przykład z siarki pirytowej, ogrzewa się ją do wysokich temperatur. Piryt siarkowy rozkłada się tworząc siarczek żelaza (II) i siarkę:
2. Siarka może być otrzymana przez utlenianie siarkowodoru przez brak tlenu w reakcji:
2H2SO2 = 2S 2H2O
3. Obecnie odzysk siarki przez redukcję dwutlenku siarki SO 2 jest powszechnym produktem ubocznym w wytopie metali z rud siarki:
SO2C = CO2S
4. Gazy odlotowe z pieców metalurgicznych i koksowniczych zawierają mieszaninę dwutlenku siarki i siarkowodoru. Ta mieszanina jest przepuszczana w wysokiej temperaturze nad katalizatorem:
H2SSO2 = 2H203S
^ Właściwości fizyczne
Siarka jest twardym, kruchym cytrynowo-żółtym kolorem. Jest praktycznie nierozpuszczalny w wodzie, ale dobrze rozpuszczalny w anilinie CS2 w dwusiarczku węgla i niektórych innych rozpuszczalnikach.
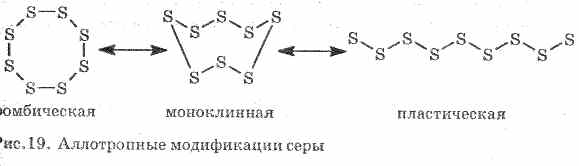
Słabe przewodzi ciepło i prąd elektryczny. Siarka tworzy kilka modyfikacji alotropowych:
1 . ^ Siarka rombowa (najbardziej stabilny), kryształy mają postać oktaedry.
Gdy siarka jest podgrzewana, zmienia się jej kolor i lepkość: najpierw powstaje jasnożółty, a następnie wraz ze wzrostem temperatury ciemnieje i staje się tak lepka, że nie wypływa z rury, przy dalszym ogrzewaniu lepkość ponownie spada, a przy 444, 6 ° С siarki wrze .
2. ^ Siarka jednoskośna - modyfikacja w postaci ciemnożółtych igieł, uzyskanych przez powolne chłodzenie stopionej siarki.
3. Plastikowa siarkapowstaje, gdy siarka ogrzana do wrzenia wlewa się do zimnej wody. Łatwo rozciągnięty jak guma (patrz rys. 19).
Naturalna siarka składa się z mieszaniny czterech stabilnych izotopów: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Właściwości chemiczne
Atom siarki, o niepełnym poziomie energii zewnętrznej, może dołączyć dwa elektrony i wykazywać stopień
Utlenianie -2. Siarka wykazuje taki stopień utlenienia w związkach z metalami i wodorem (Na2S, H2S). Gdy odrzut lub wyczerpanie elektronów do atomu pierwiastka bardziej elektroujemnego, stopień utlenienia siarki może wynosić 2, 4, 6.
Siarka jest stosunkowo obojętna na zimno, ale wraz ze wzrostem temperatury jej reaktywność wzrasta. 1. W przypadku metali siarka wykazuje właściwości utleniające. Gdy te reakcje tworzą siarczki (ze złotem, platyną i irydem nie reagują): Fe S = FeS
2. W normalnych warunkach siarka nie reaguje z wodorem, aw temperaturze 150–200 ° C zachodzi odwracalna reakcja:
3. W reakcjach z metalami i wodorem siarka zachowuje się jak typowy środek utleniający, aw obecności silnych środków utleniających wykazuje właściwości redukujące.
S 3F 2 = SF 6 (nie reaguje z jodem)
4. Spalanie siarki w tlenie odbywa się w 280 ° C, a w powietrzu w 360 ° C. Tworzy to mieszaninę SO 2 i SO 3:
S02 = SO2 2S 3O 2 = 2SO 3
5. Po podgrzaniu bez powietrza siarka łączy się bezpośrednio z fosforem, węglem, wykazując właściwości utleniające:
2P 3S = P 2 S 3 2S C = CS 2
6. Podczas interakcji z substancjami złożonymi siarka zachowuje się głównie jako czynnik redukujący:
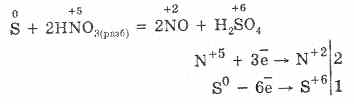
7. Siarka jest zdolna do reakcji dysproporcjonalnych. Tak więc, gdy gotuje się proszek siarki z alkaliami, powstają siarczyny i siarczki:
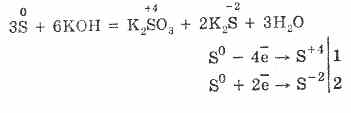
Aplikacja
Siarka jest szeroko stosowana w przemyśle i rolnictwie. Około połowa jego produkcji zużywana jest do produkcji kwasu siarkowego. Siarka jest używana do wulkanizacji gumy: w tym przypadku guma jest przekształcana w gumę.
W postaci siarki (drobny proszek) siarka jest używana do zwalczania chorób winnicy i bawełny. Służy do uzyskiwania prochu strzelniczego, zapałek, świetlistych kompozycji. W medycynie przygotowana maść siarkowa do leczenia chorób skóry.
4.2. Siarkowodór, siarczki, wodorosiarczki
Siarkowodór jest analogiem wody. Jego formuła elektroniczna
Pokazuje, że dwa p-elektrony na zewnętrznym poziomie atomu siarki biorą udział w tworzeniu wiązań H-S-H. Cząsteczka H 2 S ma kształt kanciasty, więc jest polarna.
^ Bycie w naturze
Siarkowodór występuje w przyrodzie w gazach wulkanicznych oraz w wodach niektórych źródeł mineralnych, takich jak Pyatigorsk, Matsesta. Powstaje w wyniku rozkładu substancji organicznych zawierających siarkę z różnych pozostałości zwierzęcych i roślinnych. Tłumaczy to charakterystyczny nieprzyjemny zapach ścieków, szamba i wysypisk śmieci.
Pierwsze
1. Siarkowodór można otrzymać przez bezpośrednie połączenie siarki z wodorem przez ogrzewanie:
2. Ale zwykle uzyskuje się go przez działanie rozcieńczonego kwasu solnego lub siarkowego na siarczek żelaza (III):
2HCl FeS = FeCl 2H 2 S 2H FeS = Fe 2 H 2 S Reakcja ta jest często przeprowadzana w aparacie Kipp.
^ Właściwości fizyczne
W normalnych warunkach siarkowodór jest bezbarwnym gazem o silnym charakterystycznym zapachu zgniłych jaj. Bardzo trujący, wdychanie wiąże się z hemoglobiną, powodując paraliż, co jest niezdrowe.
Ko prowadzi do śmierci. W niskich stężeniach, mniej niebezpieczne. Konieczna jest praca z nim w szafach wydechowych lub hermetycznie zamkniętych urządzeniach. Dopuszczalna zawartość H2S w pomieszczeniach produkcyjnych wynosi 0,01 mg na 1 litr powietrza.
Siarkowodór jest stosunkowo dobrze rozpuszczalny w wodzie (w 20 ° C 2,5 objętości siarkowodoru rozpuszczają się w 1 objętości wody).
Roztwór siarkowodoru w wodzie nazywany jest siarkowodorem lub kwasem siarkowodoru (wykrywa właściwości słabego kwasu).
^ Właściwości chemiczne
1, Po silnym ogrzaniu siarkowodór prawie całkowicie rozkłada się, tworząc siarkę i wodór.
2. Gazowy siarkowodór spala się w powietrzu niebieskim płomieniem, tworząc tlenek siarki (IV) i wodę:
2H2S3O2 = 2SO 2 2H 2O
Przy braku tlenu powstaje siarka i woda: 2H 2 S O 2 = 2 S 2 H 2 O
3. Siarkowodór jest dość silnym środkiem redukującym. Ta ważna właściwość chemiczna może być wyjaśniona w następujący sposób. W roztworze H2S stosunkowo łatwo jest oddać elektrony cząsteczkom tlenu z powietrza:
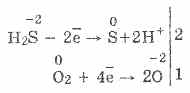
Jednocześnie tlen w powietrzu utlenia siarkowodór do siarki, co powoduje, że siarkowodór jest mętny:
2H2S2 = 2S2H2O
Tłumaczy to fakt, że siarkowodór nie gromadzi się w bardzo dużych ilościach w naturze, gdy materia organiczna rozpada się - tlen z powietrza utlenia go do wolnej siarki.
4, siarkowodór reaguje energicznie z roztworami halogenowymi, na przykład:
H2SI2 = 2HI S Siarka jest uwalniana i roztwór jodu staje się odbarwiony.
5. Różne utleniacze reagują energicznie z siarkowodorem: pod działaniem kwasu azotowego tworzy się wolna siarka.
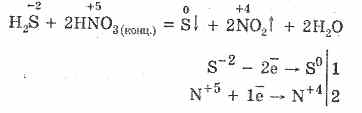
6. Roztwór siarkowodoru jest kwaśny z powodu dysocjacji:
H 2 SH HS - HS - H S -2
Pierwszy etap zwykle przeważa. Jest to bardzo słaby kwas: słabszy niż kwas węglowy, który zwykle wypiera H2S z siarczków.
Siarczki i wodorosiarczki
Kwas fluorowodorowy, jako dwuzasadowy, tworzy dwa rzędy soli:
Środkowe siarczki (Na2S);
Kwaśne wodorosiarczki (NaHS).
Sole te można otrzymać: przez oddziaływanie wodorotlenków z siarkowodorem: 2 NaOHH 2 S = Na 2 S 2H 2 O
Bezpośrednia interakcja siarki z metalami:
Reakcja wymiany soli z H2S lub między solami:
Pb (NO 3) 2 Na 2 S = PbS 2 2 NaNO 3
CuSO4H2S = CuSH2SO4 Cu2H2S = CuS 2H
Siarkowodory są prawie całkowicie rozpuszczalne w wodzie.
Siarczki metali alkalicznych i ziem alkalicznych są również łatwo rozpuszczalne w wodzie, bezbarwne.
Siarczki metali ciężkich są praktycznie nierozpuszczalne lub słabo rozpuszczalne w wodzie (FeS, MnS, ZnS); Niektóre z nich nie rozpuszczają się w rozcieńczonych kwasach (CuS, PbS, HgS).
Jako sole słabego kwasu, siarczki w roztworach wodnych są silnie hydrolizowane. Na przykład, siarczki metali alkalicznych, gdy są rozpuszczone w wodzie, mają odczyn alkaliczny:
Na 2 S НОНNaHS NaOH
Wszystkie siarczki, takie jak sam siarkowodór, są energicznymi środkami redukującymi:
3PbS -2 8HN 5O3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
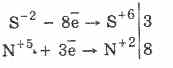
Niektóre siarczki mają charakterystyczny kolor: CuS i PbS - czarny, CdS - żółty, ZnS - biały, MnS - różowy, SnS - brązowy, Al 2 S 3 - pomarańczowy. Analiza jakościowa kationów opiera się na różnych rozpuszczalnościach siarczków i różnych kolorach wielu z nich.
^ 4.3. Tlenek siarki (IV) i kwas siarkowy
Tlenek siarki (IV) lub dwutlenek siarki w normalnych warunkach jest bezbarwnym gazem o ostrym duszącym zapachu. Po ochłodzeniu do -10 ° C, skrapla się do bezbarwnej cieczy.
Pierwsze
1. W warunkach laboratoryjnych tlenek siarki (IV) otrzymuje się z soli kwasu siarkowego przez działanie na nie silnych kwasów:
Na2SO3H2SO4 = Na2SO4 SO2 H2O2NaHSO3H2SO4 = Na2SO4 2SO 2 2H 2O 2HSO - 3 2H = 2 SO 2 2H 2O
2. Dwutlenek siarki powstaje również w wyniku oddziaływania stężonego kwasu siarkowego podczas ogrzewania z metalami o niskiej aktywności:
Cu 2H 2SO 4 = CuSO 4 SO 2 2 H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2 H 2 O
3. Tlenek siarki (IV) powstaje także w przypadku spalania siarki w powietrzu lub w powietrzu:
4. W warunkach przemysłowych SO 2 otrzymuje się przez prażenie pirytu za pomocą FeS 2 lub rud siarki metali nieżelaznych (blacha cynkowa ZnS, ołów ołowiowy PbS itp.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Wzór strukturalny cząsteczki SO 2:
Cztery atomy siarki i cztery elektrony z dwóch atomów tlenu biorą udział w tworzeniu wiązań w cząsteczce SO 2. Wzajemne odpychanie wiążących się par elektronów i samotna para elektronów siarki nadają cząsteczce kształt kanciasty.
Właściwości chemiczne
1. Tlenek siarki (IV) wykazuje wszystkie właściwości tlenków kwasów:
Interakcja z wodą
Interakcja z alkaliami
Interakcja z podstawowymi tlenkami.
2. Tlenek siarki (IV) charakteryzuje się właściwościami redukującymi:
S 4 O 2 O 0 2 2 S 6 O -2 3 (w obecności katalizatora po podgrzaniu)
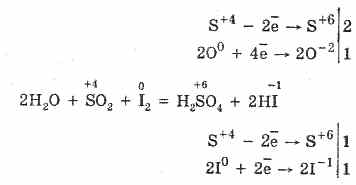
Ale w obecności silnych środków redukujących SO2 zachowuje się jak środek utleniający:
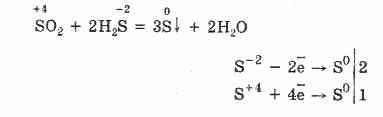
Dwoistość redoks tlenku siarki (IV) tłumaczy się tym, że siarka ma stopień utlenienia równy 4, a zatem, oddając 2 elektrony, może zostać utleniona do S6, a przez pobranie 4 elektronów może zostać zredukowana do S °. Przejaw tych lub innych właściwości zależy od charakteru składnika reaktywnego.
Tlenek siarki (IV) jest wysoce rozpuszczalny w wodzie (40 objętości SO2 rozpuszcza się w 1 objętości w 20 ° C). W tym przypadku powstaje kwas siarkawy występujący tylko w roztworze wodnym:
SO2H2 ОH2SO3
Reakcja jest odwracalna. W roztworze wodnym tlenek siarki (IV) i kwas siarkowy znajdują się w równowadze chemicznej, którą można przesunąć. Z wiązaniem H2SO3 (neutralizacja kwasu
Ty) reakcja przebiega w kierunku tworzenia się kwasu siarkowego; podczas usuwania SO2 (przedmuchiwanie roztworem azotu lub ogrzewania) reakcja przebiega w kierunku materiałów wyjściowych. Roztwór kwasu siarkowego zawsze zawiera tlenek siarki (IV), który nadaje mu ostry zapach.
Kwas siarkowy ma wszystkie właściwości kwasów. W rozwiązaniu dysocjuje w krokach:
H2SO3 H HSO - 3 HSO - 3 HSO 2- 3
Niestabilny termicznie, niestabilny. Kwas siarkowy, jako dwuzasadowy, tworzy dwa rodzaje soli:
Środkowo-siarczyny (Na2SO3);
Kwaśny wodorosiarczyn (NaHSO 3).
Siarczyny powstają, gdy alkalia są całkowicie neutralizowane przez kwas:
H2SO3 2NaOH = Na2SO3 2H2O
Wodorosiarczyny otrzymuje się z brakiem alkaliów:
H2SO3 NaOH = NaHSO3H20
Kwas siarkowy i jego sole mają zarówno właściwości utleniające, jak i redukujące, co jest determinowane przez naturę partnera reakcji.
1. Tak więc pod działaniem siarczynów tlenu utlenia się do siarczanów:
2Na 2S 4O 3 O 0 2 = 2Na 2 S 6 O -2 4
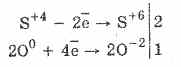
Utlenianie kwasem siarkowym za pomocą nadmanganianu bromu i potasu przebiega jeszcze łatwiej:
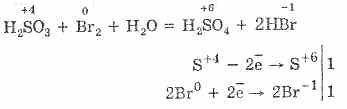
5H2S4O3 2KMn 7O4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3 H 2 O
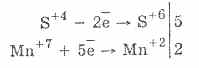
2. W obecności bardziej energicznych środków redukujących siarczyny wykazują właściwości utleniające:
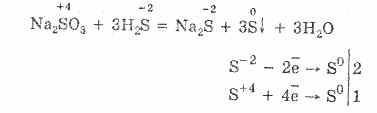
Prawie wszystkie siarczyny i siarczyny metali alkalicznych rozpuszczają się z soli kwasu siarkowego.
3. Ponieważ H 2 SO 3 jest słabym kwasem, działanie kwasów na siarczyny i wodorosiarczyny powoduje uwalnianie SO 2. Ta metoda jest zwykle stosowana przy uzyskiwaniu SO 2 w warunkach laboratoryjnych:
NaHSO3H2SO4 = Na2SO4SO2 H2O
4. Rozpuszczalne w wodzie siarczyny łatwo ulegają hydrolizie, w wyniku czego stężenie jonów OH - wzrasta w roztworze:
Na2SO3NNaHSO3 NaOH
Aplikacja
Tlenek siarki (IV) i kwas siarkowy odbarwiają wiele barwników, tworząc z nimi bezbarwne związki. Ten ostatni może się ponownie rozkładać po podgrzaniu lub w świetle, w wyniku czego kolor zostaje przywrócony. Dlatego efekt wybielania SO2 i H2SO3 różni się od efektu wybielania chloru. Zwykle rtęć siarki (IV) wybiela wełnę, jedwab i słomę.
Tlenek siarki (IV) zabija wiele mikroorganizmów. Dlatego, aby zniszczyć grzyby pleśniowe, odkażają surowe piwnice, piwnice, beczki na wino itp. Stosuje się je również do transportu i przechowywania owoców i jagód. W dużych ilościach do produkcji kwasu siarkowego stosuje się tlenek siarki IV).
Ważnym zastosowaniem jest roztwór wodorosiarczynu wapnia CaHSO 3 (ługu siarczynowego), który jest stosowany do obróbki drewna i masy papierniczej.
^ 4.4. Tlenek siarki (VI). Kwas siarkowy
Tlenek siarki (VI) (patrz tab. 20) jest bezbarwną cieczą, która zestala się w temperaturze 16,8 ° C do stałej masy krystalicznej. Bardzo silnie absorbuje wilgoć, tworząc kwas siarkowy: SO3H2O = H2SO4
Tabela 20. Właściwości tlenków siarki
Rozpuszczaniu tlenków siarki (VI) w wodzie towarzyszy uwolnienie znacznej ilości ciepła.
Tlenek siarki (VI) jest bardzo dobrze rozpuszczalny w stężonym kwasie siarkowym. Roztwór SO 3 w bezwodnym kwasie nazywa się oleum. Oleum może zawierać do 70% SO 3.
Pierwsze
1. Tlenek siarki (VI) otrzymuje się przez utlenianie dwutlenku siarki tlenem w obecności katalizatorów w temperaturze 450 ° C (patrz Produkcja kwasu siarkowego):
2SO 2O 2 = 2SO 3
2. Innym sposobem utleniania SO 2 do SO 3 jest użycie tlenku azotu (IV) jako środka utleniającego:
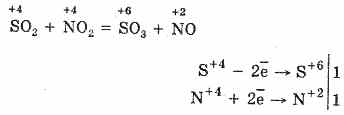
Powstały tlenek azotu (II), gdy oddziałuje z tlenem atmosferycznym łatwo i szybko zamienia się w tlenek azotu (IV): 2NO O 2 = 2 NO 2
Które mogą być ponownie wykorzystane w utlenianiu SO2. Dlatego NO2 działa jako nośnik tlenu. Ta metoda utleniania SO2 do SO3 nazywana jest azotawą. Cząsteczka SO 3 ma kształt trójkąta, w centrum którego
Atom siarki znajduje się:
Taka struktura jest wynikiem wzajemnego odpychania wiążących się par elektronów. Atom siarki dostarczył sześć zewnętrznych elektronów do ich utworzenia.
Właściwości chemiczne
1. SO 3 - typowy tlenek kwasu.
2. Tlenek siarki (VI) ma właściwości silnego środka utleniającego.
Aplikacja
Tlenek siarki (VI) stosuje się do produkcji kwasu siarkowego. Najważniejsza jest metoda kontaktu
Kwas siarkowy. Dzięki tej metodzie możesz uzyskać H 2 SO 4 o dowolnej koncentracji, a także oleum. Proces składa się z trzech etapów: uzyskanie SO 2; utlenianie SO2 do SO3; uzyskiwanie H2SO4.
SO 2 otrzymuje się przez spalanie pirytu FeS 2 w specjalnych piecach: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Aby przyspieszyć prażenie, piryt jest wstępnie zmielony, a aby uzyskać pełniejsze spalanie siarki, wstrzykuje się znacznie więcej powietrza (tlenu) niż jest to wymagane w reakcji. Gaz opuszczający piec składa się z tlenku siarki (IV), tlenu, azotu, związków arsenu (z zanieczyszczeń w pirytach) i pary wodnej. Nazywa się gazem do pieczenia.
Gaz prażący ulega dokładnemu oczyszczeniu, ponieważ nawet niewielka zawartość związków arsenu, a także kurzu i wilgoci zatruwa katalizator. Gaz jest oczyszczany ze związków arsenu i pyłu, przepuszczany przez specjalne elektrofiltry i wieżę myjącą; wilgoć jest absorbowana przez stężony kwas siarkowy w wieży suszącej. Oczyszczony gaz zawierający tlen jest ogrzewany w wymienniku ciepła do 450 ° C i wchodzi do aparatu kontaktowego. Wewnątrz aparatu kontaktowego znajdują się półki kratowe wypełnione katalizatorem.
Wcześniej jako katalizator stosowano drobno pokruszoną metaliczną platynę. Następnie został zastąpiony przez związki wanadu - tlenek wanadu (V) V 2 O 5 lub siarczan wanadylu VOSO 4, który jest tańszy niż platyna i wolniej zatruty.
Reakcja utleniania SO 2 do SO 3 jest odwracalna:
2SO 2O 2 2SO 3
Wzrost zawartości tlenu w gazie kalcynacyjnym zwiększa wydajność tlenku siarki (VI): w temperaturze 450 ° C zwykle osiąga 95% lub więcej.
Utworzony tlenek siarki (VI) jest następnie podawany metodą przeciwprądową do wieży absorpcyjnej, gdzie jest absorbowany przez stężony kwas siarkowy. W miarę nasycania pierwsze formy bezwodnego kwasu siarkowego, a następnie oleum. W przyszłości oleum jest rozcieńczane do 98% kwasu siarkowego i dostarczane do konsumentów.
Wzór strukturalny kwasu siarkowego:
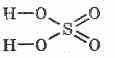
^ Właściwości fizyczne
Kwas siarkowy jest ciężką, bezbarwną, oleistą cieczą, która krystalizuje w temperaturze 10,4 ° C, prawie dwukrotnie ( = 1,83 g / cm 3) jest cięższy niż woda, bezwonny, nielotny. Wyjątkowo higroskopijny. Wilgoć wchłania się wraz z uwalnianiem dużych ilości ciepła, dzięki czemu nie można wlewać wody do stężonego kwasu siarkowego - będzie rozpryskiwać kwas. Za
Kwas siarkowy należy dodawać do wody małymi porcjami.
Bezwodny kwas siarkowy rozpuszcza do 70% tlenku siarki (VI). Po ogrzaniu usuwa SO3, aż powstanie roztwór o udziale masowym H2SO4 98,3%. Bezwodny H2S04 prawie nie przewodzi prądu elektrycznego.
^ Właściwości chemiczne
1. Miesza się z wodą w dowolnych proporcjach i tworzy hydraty o różnym składzie:
H 2 SO 4 H 2 O, H 2 SO 4 2 H 2 O, H 2 SO 4 3 H 2 O, H 2 SO 4 4 H 2 O, H 2 SO 4 6,5 H 2 O
2. Stężony kwas siarkowy karbonizuje materię organiczną - cukier, papier, drewno, włókno, odbierając im elementy wody:
C12H22O11H2SO4 = 12 CH2SO4 11H2O
Utworzony węgiel częściowo oddziałuje z kwasem:
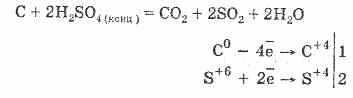
Odwadnianie gazu polega na absorpcji wody przez kwas siarkowy.
Jako silny nielotny kwas H 2 SO 4 wypiera inne kwasy z suchych soli:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Jednakże, jeśli H2SO4 jest dodawany do roztworów soli, nie zachodzi wypieranie kwasu.
H 2 SO 4 - mocny kwas dwuzasadowy: H2SO4 H HSO - 4 HSO - 4 H SO 2- 4
Posiada wszystkie właściwości nielotnych mocnych kwasów.
Rozcieńczony kwas siarkowy charakteryzuje się wszystkimi właściwościami kwasów nieutleniających. Mianowicie: oddziałuje z metalami znajdującymi się w szeregu elektrochemicznym napięcia metali aż do wodoru:
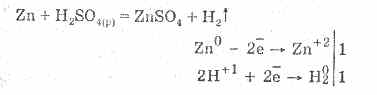
Oddziaływanie z metalami wynika z redukcji jonów wodorowych.
6. Stężony kwas siarkowy jest energetycznym środkiem utleniającym. Po podgrzaniu utlenia większość metali, w tym metali w szeregu elektrochemicznym naprężeń po wodorze, nie reaguje tylko z platyną i złotem. W zależności od aktywności metalu produktami redukcji mogą być S -2, S ° i S 4.
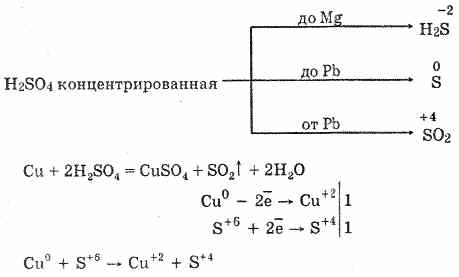
W zimnym stężonym kwasie siarkowym nie oddziałuje z tak silnymi metalami jak aluminium, żelazo i chrom. Wynika to z pasywacji metali. Ta funkcja jest szeroko stosowana, gdy jest transportowana w żelaznym pojemniku.
Jednak po podgrzaniu:
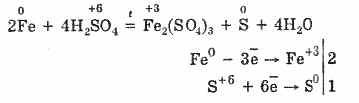
Tak więc stężony kwas siarkowy oddziałuje z metalami dzięki redukcji atomów tworzących kwas.
Jakościową reakcją na jon siarczanowy SO 2-4 jest utworzenie białego krystalicznego osadu BaSO 4, nierozpuszczalnego w wodzie i kwasach:
SO 2- 4 Ba 2 BaSO 4
Aplikacja
Kwas siarkowy jest najważniejszym produktem głównego przemysłu chemicznego zajmującego się produkcją
Kwasy organiczne, zasady, sole, nawozy mineralne i chlor.
Dla różnych zastosowań kwas siarkowy zajmuje pierwsze miejsce wśród kwasów. Największa jej ilość jest konsumowana w celu uzyskania fosforanów i nawozów azotowych. Kwas siarkowy jest nielotny i służy do wytwarzania innych kwasów - chlorowodorowego, fluorowodorowego, fosforowego i octowego.
Wiele z nich dotyczy oczyszczania produktów naftowych - benzyny, nafty, olejów smarowych - ze szkodliwych zanieczyszczeń. W inżynierii mechanicznej kwas siarkowy oczyszcza powierzchnię metalu z tlenków przed powlekaniem (niklowanie, chromowanie itp.). Kwas siarkowy jest stosowany w produkcji materiałów wybuchowych, sztucznych włókien, barwników, tworzyw sztucznych i wielu innych. Służy do napełniania baterii.
Ważne są sole kwasu siarkowego.
^ Siarczan soduNa2SO4 krystalizuje z wodnych roztworów w postaci hydratu Na2SO4 10H2O, zwanego solą Glaubera. Jest stosowany w medycynie jako środek przeczyszczający. Bezwodny siarczan sodu jest stosowany w produkcji sody i szkła.
^ Siarczan amonu(NH 4) 2 SO 4 - nawóz azotowy.
Siarczan potasuK 2 SO 4 - nawóz potażowy.
Siarczan wapnia CaSO4 występuje w naturze jako minerał gipsowy CaSO 4 2H 2 O. Po ogrzaniu do 150 ° C traci część wody i przechodzi do hydratu 2CaSO4H2O, zwanego spalonym gipsem lub alabastru. Po zmieszaniu z wodą na pastowatą masę, alabaster po pewnym czasie twardnieje, zmieniając się w CaSO 4 2H 2 O. Gips jest szeroko stosowany w budownictwie (tynk).
^ Siarczan magnezuMgSO4 znajduje się w wodzie morskiej, powodując jego gorzki smak. Krystaliczny hydrat, nazywany gorzką solą, jest stosowany jako środek przeczyszczający.
Vitriol- nazwa techniczna krystalicznych hydratów siarczanów metali Fe, Cu, Zn, Ni, Co (sole odwodnione nie są substancjami szklistymi). Siarczan miedziCuSO 4 5H 2 O to niebieska substancja toksyczna. Rośliny opryskuje się rozcieńczonym roztworem, a nasiona wysiewa się przed siewem. Witriol żelazaFeSO 4 7H 2 O jest jasnozieloną substancją. Służy do zwalczania szkodników roślin, farb, farb mineralnych itp. Siarczan cynkuZnSO 4 7H 2 O jest stosowany w produkcji atramentów mineralnych, w sittoprechatanii, medycynie.
^ 4.5. Estry kwasu siarkowego. Tiosiarczan sodu
Estry kwasu siarkowego obejmują siarczany dialkilu (RO 2) SO 2. Są to ciecze wysokowrzące; mniej rozpuszczalny w wodzie; w obecności alkaliów powstaje alkohol i sole kwasu siarkowego. Niższe siarczany dialkilu są środkami alkilującymi.
Siarczan dietylu(C2H5) 2SO4. Temperatura topnienia -26 ° C, temperatura wrzenia 210 ° C, rozpuszczalna w alkoholach, nierozpuszczalna w wodzie. Otrzymywany w reakcji kwasu siarkowego z etanolem. Jest środkiem etylującym w syntezie organicznej. Wnika w skórę.
Siarczan dimetylu(CH 3) 2 SO 4. Temperatura topnienia -26,8 ° C, temperatura wrzenia 188,5 ° C. Rozpuszczalny w alkoholach, zły - w wodzie. Reaguje z amoniakiem przy braku rozpuszczalnika (z wybuchem); Siarka niektórych związków aromatycznych, takich jak estry fenolowe. Otrzymuje się go przez oddziaływanie 60% oleum z metanolem w 150 ° C. Jest to czynnik metylujący w syntezie organicznej. Rakotwórczy, wpływa na oczy, skórę, narządy oddechowe.
^ Tiosiarczan sodu Na2S2O3
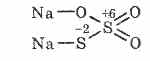
Sól kwasu tiosiarkowego, w której dwa atomy siarki mają różne stopnie utlenienia: 6 i -2. Substancja krystaliczna, dobrze rozpuszczalna w wodzie. Dostępny w postaci krystalicznego Na 2 S 2 O 3 5H 2 O, powszechnie nazywanego podsiarczynem. Otrzymywany przez oddziaływanie siarczynu sodu z siarką podczas wrzenia:
Na2SO3S = Na2S2O3
Podobnie jak kwas tiosiarkowy, jest silnym czynnikiem redukującym, łatwo ulega utlenieniu przez chlor do kwasu siarkowego:
Na2S2O3 4Cl2 5H2O = 2H2SO4 2NaCl 6HCl
Zastosowanie tiosiarczanu sodu do absorpcji chloru (w pierwszych maskach gazowych) opierało się na tej reakcji.
Nieco inne utlenianie występuje w słabych środkach utleniających tiosiarczan sodu. Tworzy to sole kwasu tetrationowego, na przykład:
2Na2S2O3I2 = Na2S4O6 2NaI
Tiosiarczan sodu jest produktem ubocznym w produkcji NaHSO 3, barwników siarkowych, w oczyszczaniu gazów przemysłowych z siarki. Służy do usuwania śladów chloru po wybielaniu tkanin, ekstrakcji srebra z rud; to utrwalacz w fotografii, odczynnik w jodometrii, antidotum na zatrucie związkami arsenu, rtęć, środek przeciwzapalny.
Siarka pierwiastek chemiczny znajduje się w grupie VIA, okres 3 PSCE. Na zewnętrznej warstwie elektronowej atomu siarki znajduje się 6 elektronów. Pokazując właściwości środka utleniającego w tworzeniu substancji z metalami i wodorem, siarka uzyskuje stopień utlenienia -2 (zajmuje 2 elektrony).
W składzie związków zawierających tlen siarka wykazuje stopień utlenienia +4 i +6. Zatem siarka charakteryzuje się stopniami utlenienia -2; 0; +4; +6.
W naturze siarka znajduje się w swoim stanie naturalnym iw składzie minerałów. Na przykład siarka zawiera połysk ołowiu (głównym składnikiem jest siarczek ołowiu PbS) i połysk miedzi (głównym składnikiem jest siarczek miedzi Cu 2 S).
Siarka tworzy kilka prostych substancji - modyfikacje alotropowe. Siarka rombowa jest najbardziej stabilna w temperaturze pokojowej (rys. 1). Substancja ta składa się z cząsteczek S 8. Siarka rombowa jest żółta i topi się w temperaturze + 112,8 ° C.
Rys. 1. Rombowa modyfikacja siarki
Po podgrzaniu rombowa siarka stopniowo zamienia się w lepką ciemnobrązową masę. To kolejna alotropowa modyfikacja siarki - plastikowej siarki. Siarka z tworzywa sztucznego składa się z liniowych cząsteczek siarki Sn.
Siarka w reakcjach chemicznych z metalami i wodorem odgrywa rolę środka utleniającego. Stopień utlenienia zmniejsza się z 0 do -2. W reakcji z tlenem siarka działa jako czynnik redukujący, zwiększając stopień utlenienia z 0 do +4.
Rozważ przykłady interakcji z udziałem siarki.
Gdy siarka oddziałuje z wodorem, powstaje siarkowodór:
Gdy cynk oddziałuje z siarką, powstaje siarczek cynku:
Siarka spala się tlenem z utworzeniem tlenku siarki (IV) (ryc. 2):

Rys. 2. Spalanie siarki w tlenie
Rozważ właściwości związków siarki ze stopniem utlenienia „-2”. Takie związki obejmują siarkowodór i siarczki - sole kwasu siarkowodoru.
Siarkowodór jest gazem o zapachu zgniłych jaj. Pali się w powietrzu. Ponadto, przy braku i nadmiarze tlenu, spalanie przebiega inaczej.
W nadmiarze tlenu siarkowodór spala się tworząc tlenek siarki (IV) i wodę:
2H2S + 302 = 2SO 2 + 2H 2 O.
Przy braku tlenu, niepełne spalanie siarkowodoru następuje z uwolnieniem siarki: 2H 2 S + O 2 = 2S + 2 H 2 O.
Siarkowodór jest wysoce rozpuszczalny w wodzie. Powstały roztwór jest słabym kwasem siarkowodoru. Sole siarczkowe wodoru są nazywane siarczkami. Kwas fluorowodorowy i rozpuszczalne w wodzie siarczki wchodzą w reakcje wymiany.
Oddziaływanie kwasu siarkowodoru i chlorku miedzi (II) tworzy nierozpuszczalny siarczek miedzi (II) i kwas chlorowodorowy: H2S + CuCl2 = CuS + 2HCl.
Gdy siarczek potasu oddziałuje z azotanem cynku, powstają osady siarczku cynku i azotan potasu: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Referencje
- Orzhekovsky P.A. Zbiór zadań i ćwiczeń z chemii: 9 klasa: do podręcznika P.A. Orzhekovsky i inni. „Chemia. Klasa 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel - M.: AST: Astrel, 2007. (str. 91-97)
- Orzhekovsky P.A. Chemia: 9 klasa: studia. dla ogólnego obrazu. instytucja / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Chemia: 9 klasa: studia ogólne. instytucja / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Szałaszow. - M.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Chemia: neorgan. chemia Organy Chemia: studia. na 9 cl. / G.E. Rudzitis, F.G. Feldman. - M.: Edukacja, Moscow Textbooks OJSC, 2009.
- Chomczenko I.D. Zbiór zadań i ćwiczeń w chemii dla liceum. - M.: RIA „Nowa fala”: Wydawca Umerenkov, 2008.
- Encyklopedia dla dzieci. Tom 17. Chemia / Rozdział. wyd. V.A. Volodin, Ved. naukowy wyd. I. Leenson. - M.: Avanta +, 2003.
- Pojedynczy zbiór cyfrowych zasobów edukacyjnych (doświadczenia wideo na ten temat) ().
- Elektroniczna wersja czasopisma „Chemistry and Life” ().
Praca domowa
- c. 136 nr 3; str. 140 № 2-4 z podręcznika P.A. Orzhekovsky „Chemia: 9 klasa” / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Szałaszow. - M.: Astrel, 2013.
Siarczki (z lat. siarki, siarki - siarki)
związki siarki z pierwiastkami bardziej elektropozytywnymi; można uznać za sole kwasu siarkowodoru (patrz Kwas siarkowodórowy) H 2 S. Istnieją dwie serie C: średnia (normalna) wzoru ogólnego M 2 S i kwas (wodorosiarczki) o wzorze ogólnym MHS, gdzie M jest metalem jednowartościowym. C. metale alkaliczne są bezbarwne, rozpuszczalne w wodzie. Ich roztwory wodne są wysoce zhydrolizowane i alkaliczne. Pod działaniem rozcieńczonych kwasów emituje H 2 S. C. metale ziem alkalicznych są bezbarwne, słabo rozpuszczalne w wodzie. H 2 S jest emitowany w wilgotnym powietrzu, inne właściwości są podobne do S. metali alkalicznych. Zarówno te, jak i inne S. łatwo ulegają utlenieniu do siarczanów. C. metale ciężkie są praktycznie nierozpuszczalne w wodzie. Prawie wszystkie są czarne lub czarno-brązowe (z wyjątkiem białego ZnS, różowawego MnS, żółtego CdS, pomarańczowo-czerwonego Sb 2 S 3, żółtego SnS 2). Nierównomierny stosunek C do kwasów i C. amoniowy jest stosowany w analizie chemicznej. I.K. Malina.
Wielka sowiecka encyklopedia. - M.: Encyklopedia sowiecka. 1969-1978 .
Zobacz, co „Siarczki” znajdują się w innych słownikach:
Związki siarki z metalami i niektórymi niemetalami. Siarczki metali są solami kwasu siarkowodoru H2S: medium (na przykład Na2S) i kwaśnym lub wodorosiarczkami (NaHS). Przez spalanie naturalnych siarczków otrzymuje się metale nieżelazne i SO2. Siarczki fosforu i ... ... Wielki słownik encyklopedyczny
Nowoczesna encyklopedia
Siarczki - SIARKI, nieorganiczne siarczki związków siarki z metalami i niektórymi niemetalami. Zawarte w rudach siarczkowych; stosowany jako luminofory (na przykład CdS, ZnS). Siarczek molibdenu, stałe smary tytanowe. Siarczki fosforu ... ... Ilustrowany słownik encyklopedyczny
- (nowy łac., z łac. siarkowej siarki). Związki pewnego ciała z siarką, odpowiadające tlenkom lub kwasom. Słownik wyrazów obcych zawartych w języku rosyjskim. Chudinov, AN, 1910. SULFIDES Novolatinsk., Od Lat. siarka, siarka. Połączenie ... ... Słownik wyrazów obcych języka rosyjskiego
1. Naturalne związki siarki metali i niektórych niemetali. W substancji chemicznej są uważane za sole kwasu siarkowodoru H2S. Szereg pierwiastków tworzy polisulfidy z siarką, które są solami kwasu polisiarkowego H2Sx. Główny ... ... Encyklopedia geologiczna
Siarczki - - związki siarki z metalami i niektórymi niemetalami; siarczki metali sole siarkowodoru kwas H2S. [Słownik terminologiczny dla betonu i betonu zbrojonego. FSUE „SIC„ Budowa ”NIIZHB i A. A. Gvozdeva stacja metra, Moskwa, 2007. 110 str.] ...… Encyklopedia terminów, definicji i objaśnień materiałów budowlanych
SULFY, s, u siarczek, mąż (spec.) Związki chemiczne siarki z metalami i niektórymi niemetalami. Organiczny z Naturalne. | przym siarczek, och, och. Słownik Ozhegova. S.I. Ozhegov, N.Yu. Shvedov. 1949 1992 ... Słownik Ozhegova
Siarczki, R2S (rodnik aromatyczny R), najłatwiej uzyskać, dodając kroplami roztwór soli diazowych do 60 70 ... Encyklopedia Brockhaus i Efron
SIARKI - (1) w chemii nieorganicznej, takie związki pierwiastków z siarką, w których atomy siarki mają stopień utlenienia 2. W chemii. są uważane za sole słabego kwasu siarkowodoru (wodny roztwór H2S). Wiele S. jest naturalnych ... ... Wielka Encyklopedia Politechniczna
Och; mn (jednostki siarczkowe i; m.). [od lat. siarka siarkowa] Chem. Związki siarki z metalami i niektórymi niemetalami. C. tytan. Organiczny z Naturalne. (klasa minerałów). Ide Siarczek, th, oh. Z mieszanymi mieszankami. Z rudy rudy. * * * Siarczki związków siarki ... Słownik encyklopedyczny
- (z łacińskiej siarki siarki) klasa związków chemicznych, które są związkami metali (jak również pewna liczba niemetali B, Si, P, As) z siarką (S), gdzie ma stopień utlenienia −2. Można uznać za sole siarkowodoru ... ... Wikipedia
Książki
- Złoża uranu, takie jak niezgodność w fanerozoiku, Andrei Borisovich Khalezov. Cechy złóż uranu w strukturach rzeki paleo-doliny na powierzchniach nieporozumień strukturalnych i stratygraficznych rozpatrywane są na przykładzie trzech regionów regionu Uralu o różnych…
Siarka - Element trzeciego okresu i grupa VIA układu okresowego, numer seryjny 16, dotyczy chalkogeny. Formuła elektronowa atomu [10 Ne] 3s 2 3p 4, charakterystyczne stany utleniania 0, ‑II, + IV i + VI, stan S VI jest uważany za stabilny.
Skala utleniania siarki:
Elektroujemność siarki wynosi 2,60, charakteryzuje się właściwościami niemetalicznymi. W związkach wodoru i tlenu jest zawarty w różnych anionach, tworzy kwasy zawierające tlen i ich sole, związki binarne.
W naturze - piętnasty pierwiastek chemiczny (siódmy wśród niemetali). Znajduje się w formie bezpłatnej (natywnej) i pokrewnej. Istotny element dla organizmów wyższych.
Siarka S. Prosta substancja. Krystaliczny żółty (α-rombowy i β-monokliniczny,
w 95,5 ° C) lub bezpostaciowe (tworzywo sztuczne). W miejscach sieci występują cząsteczki S 8 (nieplanowe cykle typu „korony”), amorficzna siarka składa się z łańcuchów S n. Substancja o niskiej temperaturze topnienia, lepkość cieczy przechodzi przez maksimum w 200 ° C (szczelina cząsteczek S 8, przeplot łańcuchów S n) W parze - cząsteczki S 8, S 6, S 4, S 2. W 1500 ° C pojawia się monoatomowa siarka (w równaniach chemicznych dla uproszczenia każda siarka jest reprezentowana jako S).
Siarka nie rozpuszcza się w wodzie iw normalnych warunkach nie reaguje z nią, jest dobrze rozpuszczalna w dwusiarczku węgla CS 2.
Siarka, zwłaszcza sproszkowana, ma wysoką aktywność po podgrzaniu. Reaguje jako środek utleniający na metale i niemetale:
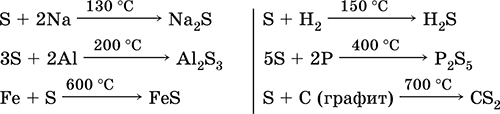
co z środek redukujący - z fluorem, tlenem i kwasami (przy gotowaniu):
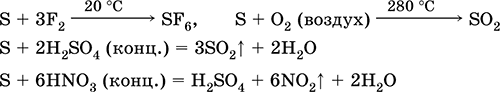
Siarka ulega dysmutacji w roztworach alkalicznych:
3S 0 + 6 KOH (stęż.) = 2 K 2 S ‑ II + K 2 S IV O 3 + 3 H 2 O
W wysokich temperaturach (400 ° C) siarka wypiera jod z jodowodoru:
S + 2NH (g) = I 2 + H 2 S,
ale w rozwiązaniu reakcja jest odwrotna:
I 2 + H 2 S (p) = 2 HI + S ↓
Pierwsze: w przemysł wytopiony z naturalnych złóż rodzimej siarki (z użyciem pary wodnej), uwalniany podczas odsiarczania produktów zgazowania węgla.
Siarka jest wykorzystywana do syntezy dwusiarczku węgla, kwasu siarkowego, siarkowych (kadziowych) barwników, w wulkanizacji gumy, jako środek ochrony roślin przed mączniakiem prawdziwym i do leczenia chorób skóry.
Siarkowodór H 2 S. Kwas wolny od tlenu. Bezbarwny gaz o duszącym zapachu, cięższy od powietrza. Cząsteczka ma strukturę podwójnie niekompletnego czworościanu [:: S (H) 2]
(sp 3 - hybrydyzacja, kąt H - S - H jest daleki od tetraedrycznego). Niestabilny po podgrzaniu powyżej 400 ° C Jest słabo rozpuszczalny w wodzie (2,6 l / 1 l H2O w 20 ° C), nasycony roztwór jest dziesiętny (0,1 M, „siarkowodór”). Bardzo słaby kwas w roztworze praktycznie nie dysocjuje w drugim etapie do S 2-jonów (maksymalne stężenie S 2 -1 jest równe 10–13 mol / l). Stojąc w powietrzu roztwór staje się mętny (inhibitor - sacharoza). Jest neutralizowany przez alkalia, a nie całkowicie - przez hydrat amoniaku. Silny środek redukujący. Wchodzi w reakcje wymiany jonowej. Środek siarczkujący, wytrąca się z roztworu różnokolorowych siarczków o bardzo niskiej rozpuszczalności.
Reakcje jakościowe - sedymentacja siarczków, a także niepełne spalanie H2S z utworzeniem żółtego osadu siarki na zimnym przedmiocie wprowadzonym do płomienia (porcelanowa łopatka). Produkt uboczny rafinacji ropy naftowej, gazu ziemnego i gazu koksowniczego.
Jest on stosowany w produkcji związków siarki, związków nieorganicznych i organicznych zawierających siarkę jako odczynnik analityczny. Niezwykle trujący. Równania najważniejszych reakcji:
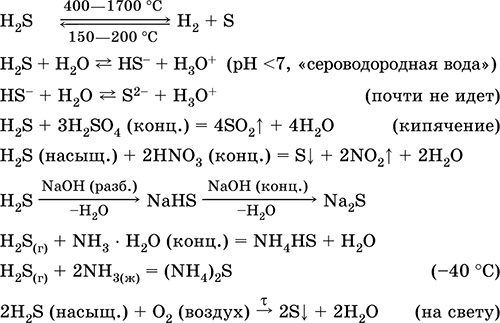

Pierwsze: w przemysł - bezpośrednia synteza:
H 2 + S = H 2 S(150–200 ° C)
lub przez ogrzewanie siarki parafiną;
w laboratoria - wypieranie siarczków przez silne kwasy
FeS + 2NCl (stęż.) = FeCl2 + H 2 S
lub całkowita hydroliza związków binarnych:
Al2S3 + 6H2O = 2Al (OH) 3 ↓ + 3 H 2 S
Siarczek sodu Na 2 S. Sól beztlenowa. Biały, bardzo higroskopijny. Topi się bez rozkładu, stabilny termicznie. Jest dobrze rozpuszczalny w wodzie, hydrolizowany przez anion, tworzy wysoce alkaliczny ośrodek w roztworze. Stojąc w powietrzu roztwór staje się mętny (siarka koloidalna) i zmienia kolor na żółty (barwnik polisulfidowy). Typowy środek redukujący. Dołącza siarkę. Wchodzi w reakcje wymiany jonowej.
Reakcje jakościowe na jonie S 2–– osadzanie się różnokolorowych siarczków metali, z których MnS, FeS, ZnS rozkładają się na HCl (s).
Jest stosowany do produkcji barwników siarkowych i celulozy, do usuwania włosów skór podczas garbowania skóry, jako odczynnik w chemii analitycznej.
Równania najważniejszych reakcji:
Na2S + 2NCl (rozkład) = 2NaCl + H2S
Na2S + 3H2SO4 (stęż.) = SO2 + S ↓ + 2H2O + 2NaHSO4 (do 50 ° C)
Na2S + 4HNO3 (stęż.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na2S + H2S (sat.) = 2NaHS
Na2S (t) + 2O 2 = Na2SO4 (powyżej 400 ° C)
Na2S + 4H2O2 (stęż.) = Na2SO4 + 4H2O
S 2– + M 2+ = MnS (cielesny) ↓; FeS (czarny) ↓; ZnS (biały) ↓
S 2– + 2Ag + = Ag 2 S (czarny) ↓
S 2– + M 2+ = CdS (żółty) ↓; PbS, CuS, HgS (czarny) ↓
3S 2 + 2Bi 3+ = Bi 2 S 3 (corr. - czarny) ↓
3S 2 + + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Pierwsze w przemysł - kalcynacja minerału mirabilit Na2SO4 10H2O w obecności środków redukujących:
Na2SO4 + 4H2 = Na2S + 4H2O (500 ° C, kat. Fe2O3)
Na2SO4 + 4C (koks) = Na2S + 4CO (800–1000 ° C)
Na2SO4 + 4CO = Na2S + 4СO 2 (600–700 ° C)
Siarczek glinu Al 2 S 3. Sól beztlenowa. Białe, wiązanie Al-S jest głównie kowalencyjne. Topi się bez rozkładu pod nadmiernym ciśnieniem N 2, łatwo ulega sublimacji. Jest utleniany w powietrzu po kalcynowaniu. W pełni zhydrolizowany wodą nie wytrąca się z roztworu. Rozkładany przez silne kwasy. Jest stosowany jako stałe źródło czystego siarkowodoru. Równania najważniejszych reakcji:
Al 2 S 3 + 6 H 2 O = 2 Al (OH) 3 ↓ + 3 H 2 S (czysty)
Al2S3 + 6NCl (rozkład) = 2AlCl3 + 3H2S
Al2S3 + 24HNO3 (stężony) = Al2 (SO4) 3 + 24NO 2 + 12H 2O (100 ° C)
2Al2S3 + 9O2 (powietrze) = 2Al2O3 + 6SO2 (700–800 ° C)
Pierwsze: oddziaływanie aluminium ze stopioną siarką przy braku tlenu i wilgoci:
2Al + 3S = AL 2 S 3(150–200 ° C)
Siarczek żelaza (II) FeS. Sól beztlenowa. Czarny i szary z zielonym odcieniem, ogniotrwały, rozkłada się po podgrzaniu w próżni. W stanie mokrym jest wrażliwy na tlen w powietrzu. Nierozpuszczalny w wodzie. Nie wytrąca się po nasyceniu roztworów soli żelaza (II) siarkowodorem. Rozkładany przez kwasy. Jest stosowany jako surowiec do produkcji żelaza, stałego źródła siarkowodoru.
Związek kompozycji żelaza (III) Fe 2 S 3 nie jest znany (nie otrzymano).
Równania najważniejszych reakcji:
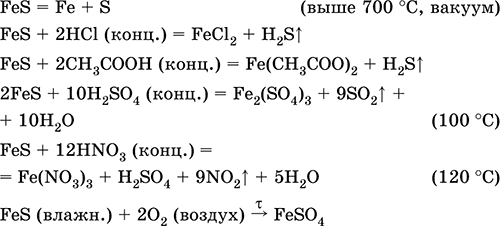
Odbieranie:
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2 H 2 S = 9 Fes + 3H 2 O (700-1000 ° C)
FeCl2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Cl + H 2 S
Dwusiarczek żelaza FeS 2. Połączenie binarne. Ma strukturę jonową Fe 2+ (–S - S–) 2‑. Ciemnożółty, stabilny termicznie, rozkłada się podczas zapłonu. Nierozpuszczalny w wodzie, nie reaguje z rozcieńczonymi kwasami, zasadami. Jest rozkładany przez środki utleniające kwas, prażony w powietrzu. Jest stosowany jako surowiec do produkcji żelaza, siarki i kwasu siarkowego, katalizatora w syntezie organicznej. W naturze - minerały rudne piryt i markazyt.
Równania najważniejszych reakcji:
FeS 2 = FeS + S (powyżej 1170 ° C, próżnia)
2FeS2 + 14H2SO4 (stęż., Góry) = Fe2 (SO4) 3 + 15SO 2 + 14 H 2 O
FeS 2 + 18HNO 3 (stęż.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15 NO 2 + 7 H 2 O
4FeS2 + 11O2 (powietrze) = 8SO 2 + 2Fe 2O 3 (800 ° C, prażenie)
Wodorosiarczek amonu NH 4 HS. Sól kwasowa wolna od tlenu. Biały, topiony pod ciśnieniem. Wyjątkowo lotny, niestabilny termicznie. Utlenia się na powietrzu. Jest dobrze rozpuszczalny w wodzie, hydrolizowany przez kation i anion (przeważa), tworzy środowisko alkaliczne. Roztwór zmienia kolor na żółty w powietrzu. Jest rozkładany przez kwasy, w nasyconym roztworze dodaje siarkę. Alkali nie są neutralizowane, środkowa sól (NH 4) 2 S nie istnieje w roztworze (warunki otrzymania soli środkowej znajdują się w nagłówku „H 2 S”). Jest on wykorzystywany jako komponent twórców zdjęć, jako odczynnik analityczny (odpylacz siarczkowy).
Równania najważniejszych reakcji:
NH 4 HS = NH 3 + H 2 S (powyżej 20 ° C)
NH4 HS + HCl (dec.) = NH4Cl + H2S
NH 4 HS + 3HNO 3 (stęż.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2 H 2 O
2NH4 HS (nasyc. H2S) + 2CuSO4 = (NH4) 2SO4 + H2SO4 + 2CuS ↓
Pierwsze: nasycenie stężonego roztworu NH 3 siarkowodorem:
NH3H2O (stęż.) + H2S (g) = NH 4 HS + H2O
W chemii analitycznej roztwór zawierający równe ilości NH4 HS i NH3H2O jest konwencjonalnie uważany za roztwór (NH4) 2S, a wzór soli średniej stosuje się do pisania równań reakcji, chociaż siarczek amonu jest całkowicie hydrolizowany w wodzie do NH 4 HS i NH 3 H 2 O.
Dwutlenek siarki. Siarczyny
Dwutlenek siarki SO 2. Tlenek kwasu. Bezbarwny gaz o ostrym zapachu. Cząsteczka ma strukturę niekompletnego trójkąta [: S (O) 2] (sp 2 - hybrydyzacja), zawiera σ, π - wiązania S = O. Łatwo skroplony, stabilny termicznie. Jest rozpuszczalny w wodzie (~ 40 l / 1 l H2O w 20 ° C). Tworzy polihydrat o właściwościach słabego kwasu, produkty dysocjacji - jony HSO 3 - i SO 3 2−. Ion HSO 3 - ma dwie formy tautomeryczne - symetryczny (niekwaśny) o strukturze czworościanu (sp 3 - hybrydyzacja), która dominuje w mieszaninie, i asymetryczny (kwaśny) o strukturze niekompletnego czworościanu [: S (O) 2 (OH)] (sp 3 - hybrydyzacja). Jon SO 3 2 - jest także czworościenny [: S (O) 3].
Reaguje z alkaliami, hydrat amoniaku. Typowy środek redukujący, słaby środek utleniający.
Reakcja jakościowa - odbarwienie żółto-brązowej „wody jodowej”. Pośredni w produkcji siarczynów i kwasu siarkowego.
Służy do wybielania wełny, jedwabiu i słomy, konserwowania i przechowywania owoców, jako środek dezynfekujący, przeciwutleniacz, płyn chłodzący. Trujący.
Związek H2SO3 (kwas siarkowy) nie jest znany (nie istnieje).
Równania najważniejszych reakcji:
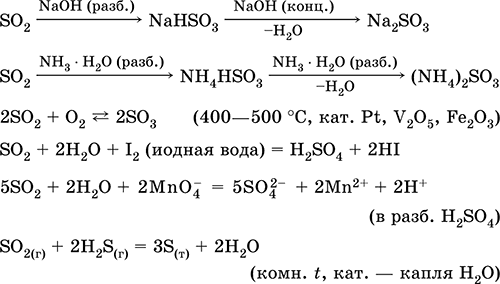
Rozpuszczanie w wodzie i właściwości kwasowe:
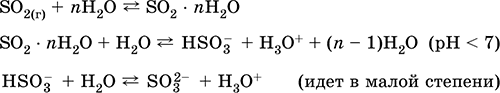
Pierwsze: w przemyśle - spalanie siarki w powietrzu wzbogaconym tlenem, aw mniejszym stopniu prażenie rud siarczkowych (SO 2 - gaz towarzyszący podczas prażenia pirytu):
S + O 2 = SO 2(280–360 ° C)
4FeS2 + 11O2 = 2Fe2O3 + 8 SO 2(800 ° C, pieczenie)
w laboratorium - wypieranie siarczynów kwasem siarkowym:
BaSO3 (t) + H2SO4 (stęż.) = BaSO4 ↓ + SO2 + H2O
Siarczyn sodu Na2SO3. Solanka Biały Po ogrzaniu w powietrzu rozkłada się bez stopienia, topi się pod nadciśnieniem argonu. W stanie mokrym iw roztworze wrażliwym na tlen w powietrzu. Jest rozpuszczalny w wodzie, hydrolizowany przez anion. Rozkładany przez kwasy. Typowy środek redukujący.
Reakcja jakościowa na jonie SO 3 2– - tworzenie się białego osadu siarczynu baru, który przenosi się do roztworu z mocnymi kwasami (HCl, HNO 3).
Jest stosowany jako odczynnik w chemii analitycznej, składnik rozwiązań fotograficznych, neutralizator chloru w wybielaniu tkanin.
Równania najważniejszych reakcji:
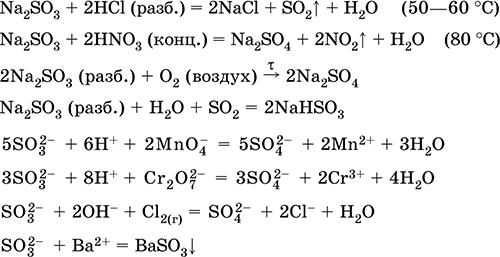
Odbieranie:
Na2CO3 (stężony) + SO2 = Na2SO3 + CO 2
Kwas siarkowy. Siarczany
Kwas siarkowy H2SO4. Kwas oksowy. Bezbarwna ciecz, bardzo lepka (oleista), bardzo higroskopijna. Cząsteczka ma zniekształconą, tetraedryczną strukturę (hybrydyzacja sp 3 г yb), zawiera kowalencyjne σ - wiązania S - OH i σπ - wiązania S = O. Jon SO 4 2 - ma poprawnie - czworościenną strukturę. Ma szeroki zakres temperatur w stanie ciekłym (~ 300 stopni). Po ogrzaniu powyżej 296 ° C częściowo rozkłada się. Jest destylowany jako mieszanina azeotropowa z wodą (ułamek masowy kwasu wynosi 98,3%, temperatura wrzenia 296–340 ° C), rozkłada się całkowicie z silniejszym ogrzewaniem. Nieograniczone mieszanki z wodą (z mocnym exo-Effect). Silny kwas w roztworze, zobojętniony alkaliami i hydratem amoniaku. Przekształca metale w siarczany (z nadmiarem stężonego kwasu w normalnych warunkach, tworzą się rozpuszczalne wodorosiarczany), ale metale Be, Bi, Co, Fe, Mg i Nb są pasywowane w stężonym kwasie i nie reagują z nim. Reaguje z tlenkami i wodorotlenkami zasadowymi, rozkłada sole słabych kwasów. Słaby utleniacz w rozcieńczonym roztworze (ze względu na H I), silny - w stężonym roztworze (ze względu na S VI). Dobrze rozpuszcza SO 3 i reaguje z nim (powstaje ciężka oleista ciecz - oleum zawiera H2S2O7).
Reakcja jakościowa na SO 4 2 - jon - wytrącanie białego siarczanu baru BaSO 4 (osad nie jest przekształcany w roztwór kwasu solnego i azotowego, w przeciwieństwie do białego osadu BaSO 3).
Stosuje się go do produkcji siarczanów i innych związków siarki, nawozów mineralnych, materiałów wybuchowych, barwników i leków, w syntezie organicznej, do „otwierania” (pierwszy etap przetwarzania) ważnych przemysłowo rud i minerałów, rafinacji produktów naftowych, elektrolizy wody, elektrolitu ołowiowego . Trujący, powoduje oparzenia skóry. Równania najważniejszych reakcji:
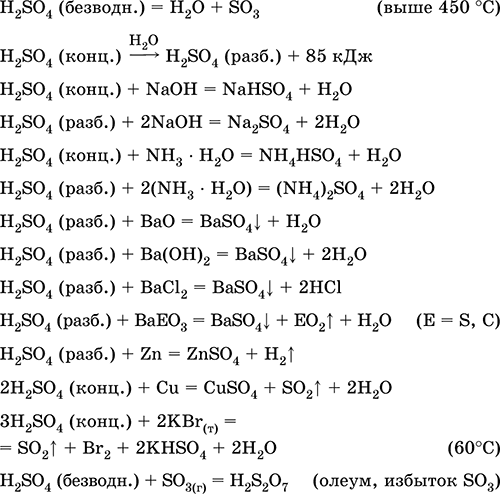
Pierwsze w przemysł:
a) synteza SO 2 z siarki, rud siarczkowych, siarkowodoru i rud siarczanowych:
S + O 2 (powietrze) = SO 2(280–360 ° C)
4FeS2 + 11O2 (powietrze) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, prażenie)
2H2S + 3O2 (g) = 2 SO 2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (koks) = CaO + SO 2 + CO (1300–1500 ° C)
b) konwersja SO 2 do SO 3 w aparacie kontaktowym:
c) synteza stężonego i bezwodnego kwasu siarkowego:
H20 (Coll. H 2 SO 4) + SO 3 = H2SO4(conc., anhyd.)
(absorpcja SO3 przez czystą wodę przy wytwarzaniu H2SO4 nie jest przeprowadzana z powodu silnego ogrzewania mieszaniny i odwrotnego rozkładu H2SO4, patrz powyżej);
d) synteza oleum - mieszanina bezwodnego H2SO4, kwasu disarowego H2S2O7 i nadmiaru SO3. Rozpuszczony SO 3 zapewnia bezwodność oleum (H 2 SO 4 powstaje natychmiast po dostaniu się wody), co pozwala bezpiecznie transportować go w stalowych zbiornikach.
Siarczan sodu Na2SO4. Solanka Biała, higroskopijna. Topi się i wrze bez rozkładu. Tworzy krystaliczny hydrat (minerał mirabilit) łatwo tracić wodę; nazwa techniczna Sól Glaubera. Jest rozpuszczalny w wodzie, nie ulega hydrolizie. Reaguje z H2SO4 (stęż.), SO 3. Odtworzony przez wodór, koks po podgrzaniu. Wchodzi w reakcje wymiany jonowej.
Stosowany jest do produkcji szkła, celulozy i farb mineralnych, jako lek. Zawarte w solance słonych jezior, w szczególności w Zatoce Kara-Bogaz-Gol Morza Kaspijskiego.
Równania najważniejszych reakcji:
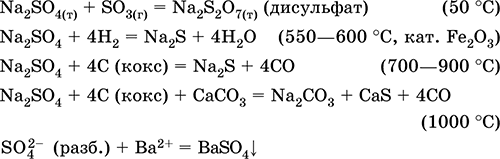
Wodorosiarczan potasu KHSO 4. Kwaśna sól oksolowa. Biała, higroskopijna, ale nie tworzy krystalicznych hydratów. Po podgrzaniu topi się i rozkłada. Jest dobrze rozpuszczalny w wodzie, anion ulega dysocjacji w roztworze, środowisko roztworu jest silnie kwaśne. Jest neutralizowany przez alkalia.
Jest stosowany jako składnik topników w metalurgii, integralna część nawozów mineralnych.
Równania najważniejszych reakcji:
2KHSO4 = K2SO4 + H2SO4 (do 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO4 (rozcieńcz.) + KOH (stęż.) = K2SO4 + H2O KHSO4 + KCl = K2SO4 + HCl (450–700 ° C)
6KHSO4 + M2O3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350–500 ° C, M = Al, Cr)
Pierwsze: obróbka siarczanu potasu w zimnym (z ponad 60%) kwasem siarkowym
K2SO4 + H2SO4 (stęż.) = 2 KHSO 4
Siarczan wapnia CaSO 4. Solanka Biały, bardzo higroskopijny, ogniotrwały, rozkłada się po kalcynowaniu. Naturalny CaSO 4 występuje w postaci bardzo pospolitego minerału gips CaSO 4 2H 2 O. W temperaturze 130 ° C gips traci część wody i wchodzi do niej spalony tynk2CaSO 4 H 2 O (nazwa techniczna alabaster). W pełni odwodniony gips (200 ° C) reaguje na minerał anhydrytCaSO 4. Jest słabo rozpuszczalny w wodzie (0,206 g / 100 g H2O w 20 ° C), rozpuszczalność zmniejsza się po podgrzaniu. Reaguje z H2SO4 (stęż.). Odzyskany przez koks podczas syntezy. Określa większość „stałej” twardości słodkiej wody (więcej szczegółów, patrz 9.2).
Równania najważniejszych reakcji: 100–128 ° C
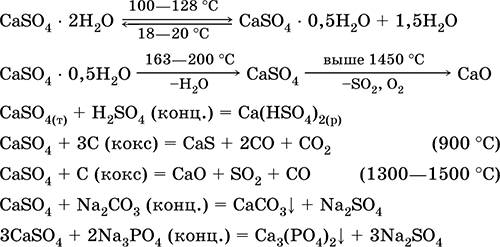
Jest stosowany jako surowiec do produkcji SO 2, H 2 SO 4 i (NH 4) 2 SO 4, jako topnik w metalurgii, wypełniacz papierowy. Zaprawa wiążąca została przygotowana z „wypalonych” gipsów szybciej niż mieszanina na bazie Ca (OH) 2. Utwardzanie zapewnia wiązanie wody, tworzenie gipsu w postaci masy kamiennej. Spalony gips służy do wykonywania odlewów gipsowych, form i produktów architektonicznych i dekoracyjnych, ścian działowych i paneli oraz podłóg kamiennych.
Siarczan glinowo-potasowy KAl (SO 4) 2. Podwójna sól oksolowa. Biała, higroskopijna. Z silnym ciepłem rozkłada się. Tworzy krystaliczny hydrat - ałun glinowo-potasowy. Umiarkowanie rozpuszczalny w wodzie, hydrolizowany przez kation glinu. Reaguje z alkaliami, hydrat amoniaku.
Jest stosowany jako zaprawa w tkaninach barwiących, skóra garbująca, koagulant w oczyszczaniu wody słodkiej, składnik kompozycji zaklejających papier oraz zewnętrzny środek hemostatyczny w medycynie i kosmetologii. Powstaje w wyniku ko-krystalizacji siarczanów glinu i potasu.
Równania najważniejszych reakcji:
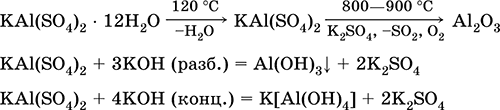
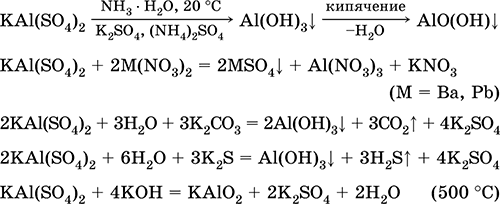
Siarczan chromu (III) - KCr potasu (SO 4) 2. Podwójna sól oksolowa. Czerwony (ciemnofioletowy hydrat, nazwa techniczna ałun potasowy). Po podgrzaniu rozkłada się bez stopienia. Jest łatwo rozpuszczalny w wodzie (szaro-niebieski kolor roztworu odpowiada aquacomplex 3+), jest hydrolizowany przez kation chromu (III). Reaguje z alkaliami, hydrat amoniaku. Słaby utleniacz i środek redukujący. Wchodzi w reakcje wymiany jonowej.
Reakcje jakościowe do jonów Cr 3+ - redukcja do Cr 2+ lub utlenianie do żółtego CrO 4 2‑.
Jest stosowany jako garbnik do skóry, zaprawa do farbowania tkanin, odczynnik na fotografii. Powstaje przez ko-krystalizację chromu (III) i siarczanów potasu. Równania najważniejszych reakcji:
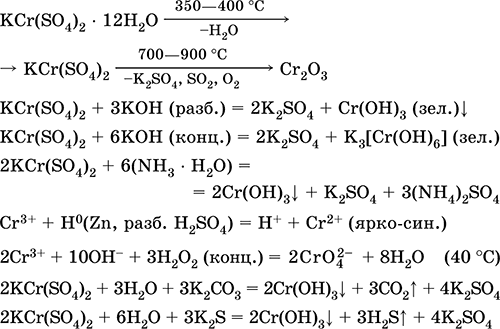
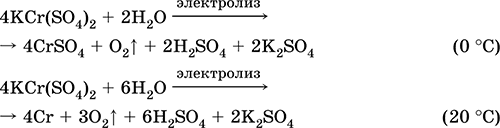
Siarczan manganu (II) MnSO 4. Solanka Biała, po wyprażeniu, topi się i rozkłada. Wodzian krystaliczny MnSO 4 5H 2 O - czerwony - różowy, nazwa techniczna witriol manganu. Jest rozpuszczalny w wodzie, jasnoróżowy (prawie bezbarwny) kolor roztworu odpowiada aquacomplex 2+; hydrolizowany przez kation. Reaguje z alkaliami, hydrat amoniaku. Słaby środek redukujący reaguje z typowymi (silnymi) środkami utleniającymi.
Reakcje jakościowe do jonu Mn 2+ - przewodzenie jonem MnO 4 i zanik fioletowego koloru tego ostatniego, utlenianie Mn 2+ do MnO 4 i pojawienie się fioletowego koloru.
Służy do uzyskiwania Mn, MnO 2 i innych związków manganu, jako mikroelementów i odczynników analitycznych.
Równania najważniejszych reakcji:
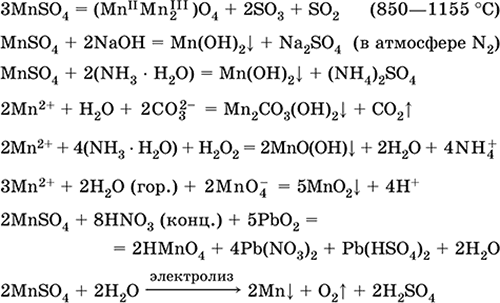
Odbieranie:
2MnO2 + 2H2SO4 (stęż.) = 2 MnSO 4 + O 2 + 2 H 2 O (100 ° C)
Siarczan żelaza (II) FeSO4. Solanka Biały (hydrat jasnozielony, nazwa techniczna witriol żelaza),higroskopijny. Rozkłada się po podgrzaniu. Jest rozpuszczalny w wodzie, w niewielkim stopniu hydrolizowany przez kation. Jest szybko utleniany w roztworze przez tlen w powietrzu (roztwór zmienia barwę na żółtą i staje się mętny). Reaguje z utleniaczami kwasowymi, zasadami, hydratem amoniaku. Typowy środek redukujący.
Stosowany jest jako składnik farb mineralnych, elektrolitów w galwanotechnice, środkach do konserwacji drewna, fungicydów, leków przeciw anemii. W laboratorium częściej przyjmuje się podwójną sól Fe (NH 4) 2 (SO 4) 2 6 H 2 O ( salt mora) bardziej odporny na powietrze.
Równania najważniejszych reakcji:
![]()
Odbieranie:
Fe + H2SO4 (dec.) = FeSO 4+ H 2
FeCO3 + H2SO4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. Niemetale z grupy VA
Azot Amoniak
Azot - element 2. okresu i grupa VA - układ okresowy, numer seryjny 7. Formuła elektronów atomowych [2 He] 2s 2 2p 3, charakterystyczne stany utleniania 0, –III, + III i + V, rzadziej + II, + IV i inne; Stan N v jest uważany za stosunkowo stabilny.
Skala utleniania azotu:
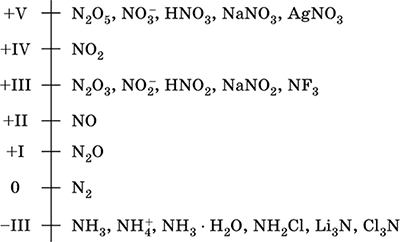
Azot ma wysoką elektroujemność (3,07), trzeci po F i O. Pokazuje typowe właściwości niemetaliczne (kwasowe). Tworzy różne kwasy zawierające tlen, sole i związki dwuskładnikowe, a także kation amonowy NH 4 + i jego sole.
W naturze - siedemnasty pierwiastek chemiczny (dziewiąty wśród niemetali). Istotny element dla wszystkich organizmów.
Azot N 2. Prosta substancja. Składa się z niepolarnych molekuł o bardzo stabilnym σππ - wiązaniu N ≡ N, co wyjaśnia chemiczną obojętność azotu w normalnych warunkach. Bezbarwny, bezwonny gaz, który skrapla się w bezbarwną ciecz (w przeciwieństwie do O 2).
Główny składnik powietrza: 78,09% objętościowych, 75,52% wagowych. Z ciekłego powietrza azot wrze w obecności tlenu O 2. Jest słabo rozpuszczalny w wodzie (15,4 ml / 1 l H2O w 20 ° C), rozpuszczalność azotu jest mniejsza niż rozpuszczalność tlenu.
W temperaturze pokojowej N 2 reaguje tylko z litem (w wilgotnej atmosferze), tworząc azotek litu Li 3 N, azotki innych pierwiastków są syntetyzowane z silnym ogrzewaniem:
N2 + 3Mg = Mg3N2 (800 ° C)
W wyładowaniu elektrycznym N 2 reaguje z fluorem iw bardzo małym stopniu z tlenem:
Odwracalna reakcja na wytwarzanie amoniaku zachodzi w temperaturze 500 ° C, pod ciśnieniem do 350 atm i koniecznie w obecności katalizatora (Fe / F 2 O 3 / FeO w laboratorium Pt):
Zgodnie z zasadą Le Chateliera wzrost wydajności amoniaku powinien nastąpić wraz ze wzrostem ciśnienia i spadkiem temperatury. Szybkość reakcji w niskich temperaturach jest jednak bardzo niska, więc proces prowadzi się w temperaturze 450–500 ° C, uzyskując 15% wydajności amoniaku. Nieprzereagowany N2 i H2 powracają do reaktora, zwiększając tym samym stopień reakcji.
Azot jest chemicznie pasywny w odniesieniu do kwasów i zasad, nie wspiera spalania.
Pierwsze w przemysł - frakcjonowana destylacja ciekłego powietrza lub usuwanie tlenu z powietrza za pomocą środków chemicznych, na przykład przez reakcję 2C (koks) + O2 = 2CO przez ogrzewanie. W takich przypadkach wytwarzany jest azot, który zawiera również zanieczyszczenia gazów szlachetnych (głównie argonu).
W laboratoria małe ilości chemicznie czystego azotu można uzyskać przez reakcję kombinacji z umiarkowanym ogrzewaniem:
N ‑ III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH4CI (p) + KNO 2 (p) = N 2 0 + KCl + 2 H 2 O (100 ° C)
Jest on stosowany do syntezy amoniaku, kwasu azotowego i innych produktów zawierających azot, jako środowisko obojętne dla procesów chemicznych i metalurgicznych oraz przechowywania substancji łatwopalnych.
Amoniak NH 3. Związek binarny, stopień utlenienia azotu to - III. Bezbarwny gaz o ostrym charakterystycznym zapachu. Cząsteczka ma strukturę niekompletnego czworościanu [: N (H) 3)] (sp 3 гиб-hybrydyzacja). Obecność azotu w cząsteczce NH 3 pary donorów elektronów w orbitalu hybrydowym sp 3 powoduje charakterystyczną reakcję addycji kationu wodorowego z utworzeniem kationu amoniak NH 4 +. Skroplony pod ciśnieniem w temperaturze pokojowej. W stanie ciekłym związany jest z wiązaniami wodorowymi. Niestabilny termicznie. Jest rozpuszczalny w wodzie (ponad 700 l / 1 l H2O w 20 ° C); proporcja w nasyconym roztworze wynosi = 34% masowych i = 99% objętościowych, pH = 11,8.
Wysoce reaktywny, podatny na reakcje addycyjne. Powstaje tlen, reaguje z kwasami. Wykazuje właściwości redukujące (z powodu N-III) i utleniające (z powodu H I). Suszony tylko z tlenkiem wapnia.
Reakcje jakościowe - powstawanie białego „dymu” w kontakcie z gazowym HCl, czernienie papieru zwilżonego roztworem Hg 2 (NO 3) 2.
Produkt pośredni w syntezie HNO 3 i soli amonowych. Używany do produkcji sody, nawozów azotowych, barwników, materiałów wybuchowych; ciekły amoniak jest czynnikiem chłodzącym. Trujący.
Równania najważniejszych reakcji:
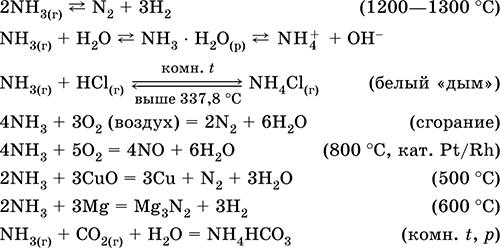
Pierwsze: w laboratoria - wypieranie amoniaku z soli amonowych podczas ogrzewania wapnem sodowanym (NaOH + CaO):
lub gotowanie wodnego roztworu amoniaku, a następnie suszenie gazu.
W przemysł amoniak jest syntetyzowany z azotu (patrz) z wodorem. Produkowany przez przemysł w postaci upłynnionej lub w postaci stężonego roztworu wodnego pod nazwą techniczną woda amoniakalna.
Wodzian amoniaku NH 3 H 2 O. Związek międzycząsteczkowy. Białe, w sieci krystalicznej, są molekuły NH 3 i H 2 O, związane słabym wiązaniem wodorowym H 3 N ... HON. Obecny w wodnym roztworze amoniaku, słabej zasady (produkty dysocjacji - kation NH 4 - i anion OH -). Kation amonowy ma regularnie π-tetraedryczną strukturę (sp 3 - hybrydyzacja). Niestabilny termicznie, całkowicie rozłożony przez gotowanie roztworu. Neutralizowany przez silne kwasy. Pokazuje właściwości redukujące (dzięki N III) w stężonym roztworze. Wchodzi w reakcję wymiany jonowej i kompleksowania.
Reakcja jakościowa - powstawanie białego „dymu” w kontakcie z gazowym HCl.
Służy do tworzenia słabego środowiska zasadowego w roztworze podczas wytrącania wodorotlenków amfoterycznych.
1M roztwór amoniaku zawiera głównie hydrat NH3H2O i tylko 0,4% jonów NH4 + i OH- (z powodu dysocjacji hydratu); zatem, jonowy „wodorotlenek amonu NH4OH” praktycznie nie jest zawarty w roztworze, nie ma takiego związku w stałym hydracie. Równania najważniejszych reakcji:
NH3H2O (stężony) = NH3 + H2O (wrzenie z NaOH)
NH3H2O + HCl (dec.) = NH4Cl + H2O
3 (NH3H2O) (stęż.) + CrCl3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH3H2O) (stęż.) +Br2 (p) = N2 + 6NH 4 Br + 8H2O (40–50 ° C)
2 (NH3H2O) (stęż.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4 H 2 O + 2 KON
4 (NH3H2O) (stęż.) + Ag 2 O = 2OH + 3H2O
4 (NH3H2O) (stęż.) + Cu (OH) 2 + (OH) 2 + 4H2O
6 (NH3H2O) (stęż.) + NiCl2 = Cl2 + 6H2O
Często nazywa się rozcieńczony roztwór amoniaku (3–10% - czas) ciekły amoniak (nazwa została wymyślona przez alchemików) i stężony roztwór (18,5–25%) woda amoniakalna (produkowane przez przemysł).
