Równe reakcje charakteryzujące moc rozpuszczonego kwasu siarkowego. Lista posiłków egzaminacyjnych z dyscyplin
Czernienie powierzchni starych obrazów pisanych oliwnymi farbami, do których magazynu wchodzi biel ołowiana (PbCO3), wiąże się z roztworami czarnego siarczku ołowiu (II) poprzez obecność cyrkulującej wody w atmosferze. Jeśli woda jest zabarwiona nadtlenkiem, obserwuje się reakcję roztworu siarczanu ołowiu (II) o białym kolorze:
PbS + 4H2O2 = PbSO4 + 4H2O.
W ten sposób przywracają poczerniałe stare malowidła, malowane oliwkowymi farbami.
Zastosuvannya kwaśny i sirki
Obszary stosuvannya kisnya są reprezentowane przez niewielką liczbę 61.
pozwól vicoristovuvati yogo na infekcję woda pitna to źródło ścieków przemysłowych; jako środek dezynfekujący zasib w medycynie. Ozon zwycięża i jaka vidbіlyuyuchiy zasib.
Syrka vicorist do produkcji kwasu siarkowego, przygotowania syrnikowa, bengalskich ogni, walki ze szkidnikami silnego państwa i zaszczepienia egzaltacji takich dolegliwości. Serka zna zastosuvannya podczas produkcji gumy, barników i pigmentów, włókien kawałkowych, luminoforów i innych.
Mal. 61. Całowanie

Dla kwasowości w kale, które należą do najmniejszych pierwiastków, najbardziej charakterystyczny jest stopień utlenienia -2, atomy siarki, selenu i teluru wykazują stopień utlenienia -2, +2, +4 i +6.
Tlenki mocy kwaśnych i wirów przejawiają się w ich reakcjach z metalami, wodą i innymi niemetalami.
Zapytanie i zadanie
1. Składaj formuły o kwasowości z potasem, wapniem i glinem. Wskaż etap utleniania elementu skóry i nazwij chorobę.
2. Udział masowy Razrahuyte sirka w siarczku glinu.
3. Nazwa „kysen” - tlen oznacza „który wytwarza kwasy”. Zanotować wzory chemiczne przynieś ci kwasy, do magazynu, w którym możesz odłożyć pierwiastek. Nazwij kwasy.
4. Czy wiesz, jakie alotropowe modyfikacje kwaśnego i kwaśnego? Dlaczego śmierdzą jeden po drugim?
5. Kisen, który jest wdychany przez człowieka, powstaje z hemoglobiny krwi. Wydaje się, że masa hemoglobiny 1 g odpowiada objętości (n.a.) 1,35 cm3 3 . Ilość hemoglobiny we krwi zdrowych ludzi wynosi 140 g/dm3. Całkowita objętość krwi wynosi 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlіkіst kwaśny, ty mazhe opinetytsya we krwi ludzi.
6. Wyznaczyć ułamek masowy kwasu sirkovodnoy w zakresie, pobrany w przypadku oddzielnej objętości sirvodnya (b.d.) 8,96 dm 3 w wodzie o masie 500 g.
7. Rozwiń współczynniki w schematach ofensywnych reakcje z wyeksponowanymi tlenkami:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2S + Br2 → S + HBr;
c) H2S + O2 → S + H2O.
Na reakcja skórna wskazuje na środek utleniający.
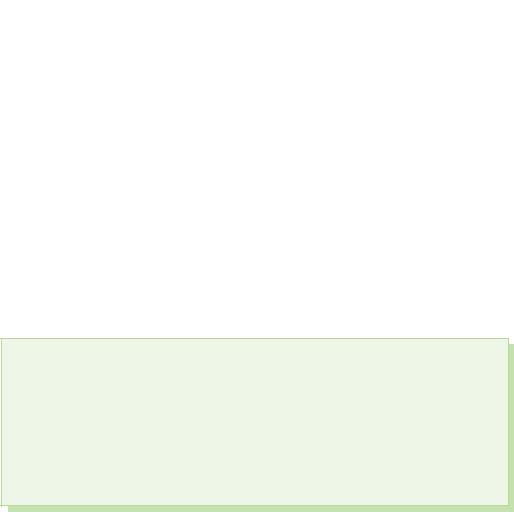
§ 39. Kisnevmisnі spoluki sirka
Na z'ednannyah z kwaśną sirka pokazuje etap utleniania+4 i +6.
Tlenek Sirka(IV). Kwas Siarkowy
Tlenek (IV) - SO2 (gaz syrchisty) - jest gazem bezbeczkowym o ostrym charakterystycznym zapachu, który wydobywa się, gdy powietrze jest gorące:
S + O2 = tSO2.

Jeden z ostatnich zastosuvanów sirka był związany z fumigacją sirka życia, które powinno spalić. Jak pisał starożytny historyk Pliniusz senior w I wieku p.n.e. e. „zapachy paleniska sirka mogą chronić przed wszelkiego rodzaju urokami i odpędzać wszelkie złe duchy”. Dezynfekujące i bakteriobójcze działanie tlenku siarki (IV) zastępcze i zakaźne. Gaz siarkowy jest podsycany podczas przetwarzania warzyw, owoców i owoców, aby zapobiec ich gniciu.
Uwalnianie gazu siarkowego w pobliżu wody (do 40 objętości SO2 na 1 objętość wody) - nieplamiący, dwuzasadowy Kwas Siarkowy dostępne tylko w sprzedaży detalicznej:
SO2 + H2O H2 SO3.
Kwas siarkowy jest słabym kwasem, w roztworach wodnych dysocjuje etapami często z roztworami jonów podsiarczynowych i siarczynowych:
H+ + HSO – , | – H+ + SO2–. |
||||
Kwas siarkawy wykazuje przewagę chemiczną, siarkawy dla kwasów: oddziałuje z zasadowymi tlenkami, zasadami, reaguje z wymianą soli z innymi kwasami, zocrema, lepki słaby kwas węglowy z soli:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Tlenek Sirka(VI)
Tlenek (VI) posiada, utleniający tlenek (IV) w obecności katalizatora w temperaturze około 500 C:
t, kat.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
Dla najwybitniejszych umysłów tlenek siarki (VI) SO3 to bezbarwny kwas, który w temperaturze poniżej 17°C zamienia się w białą, krystaliczną mowę. Ce typowy tlenek kwasowy, który oddziałuje z wodą, tworząc mocny kwas siarkowy:
SO3 + H2O = H2SO4.
Kwas sirchanowy
Wzór graficzny i model cząsteczki kwasu siarkowego wskazano na małą 62.
Mal. 62. Wzór graficzny i model cząsteczki kwasu siarkowego
Na kręgi hodowlane Kwas Siarkowyє mocny elektrolit,
і її dysocjacja wyraża się w następujący sposób:
H2 SO4 → 2Н+ + SO4 2– .
Siła fizyczna kwasu siarkowego
Kwas siarkowy - waza (wytrzymałość 1,83 g/cm3), oleista, bezwonna, jałowa ziemia. Pójdzie do wody w jakichś butelkach z wodą.
Procesowi rozprowadzania H2 SO4 do chemicznej ilości 1 mola towarzyszy 92 kJ ciepła, co można porównać z wielkościami efektów termicznych w reakcjach chemicznych. Widząc dużą ilość ciepła z interakcją kwasu siarkowego z wodą, świadczy o tworzeniu się kiełków mineralnych między dwiema rzekami uwodnienia typu H2 SO4 n H2 O.
Na przykład H2SO4H2O; H2SO4 2H2O; H2 SO4 3H2O i tak dalej.
żadne ї kwasy i hydraty nie pozwalają na lepkość її jako silny środek hydrofobowy, na przykład do suszenia gazów.
Posypaniu sumishi różnymi kwasami siarkowymi w wodzie może towarzyszyć opryskiwanie. Pamiętaj co nie możesz wlać wody do kwaśnej
Lotі, przesuwany z nieprzerwanym remiksowaniem, wlać kwas do wody.
Moc chemiczna Kwas Siarkowy. Sulfati
Sulfati. Rozpuszczony kwas siarkowy ujawnia wszystkie charakterystyczne cechy kwasów dominujących: oddziaływanie z metalami, które powinny być aktywne do dnia; z tlenkami zasadowymi i amfoterycznymi, z zasadami i solami. Czyje sole są ustalone: środkowy - siarczan, na przykład K 2 SO 4 i kwaśny -
hydrosiarczan, na przykład KНSO4.
Większość siarczanów i wodorosiarczanów wyróżnia bogata w nie woda krystaliczny. Deyakі krystaliczne sole kwasu siarkowego i nazywane są witriolem: midny witriol CuSO4 ∙5H2 O, powodzi witriol FeSO4 ∙7H2 O i in.
Do kwaśnej manifestacji kwasu siarkowego i soli її w różach wodnych stosuje się sole baru:
Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
W wyniku reakcji ustaliło się białe wytrącanie siarczanu baru.
Certyfikat laboratoryjny 6
Monitorowanie mocy chemicznych rozcieńczonego kwasu siarkowego
Dawniej należy umieścić pięć probówek: metal (cynk lub inny metal do wyboru czytelnika), tlenek zasadowy, wodorotlenek sodu, węglan sodu, chlorek baru. Dodaj kilka kropli fenoloftaleiny do ilości wodorotlenku sodu i zmień dawkę. Do probówki skórnej dodać 1-2 cm3 rozcieńczonego kwasu siarkowego. (Uwaga! Ponieważ reakcja z zasadowym tlenkiem przebiega prawidłowo, przyspiesz ogrzewanie o pół kąpieli alkoholowej.)
Czego strzeżesz? Jakie są oznaki wygaśnięcia reakcji chemicznych? Przechowywanie równych reakcji chemicznych w formie molekularnej i jonowej. Jaką reakcję przeprowadziłeś? Aby zebrać visnovok o mocy chemicznej rozpuszczonego kwasu siarkowego.
Stężony kwas siarkowyє silny środek utleniający, niższy rozcieńczony. Podczas interakcji ze stężonym kwasem siarkowym
wody nie widać z metalami.
W metale, które stoją obok aktywności po wodzie (szkarłatne złoto i platyna), reakcja przebiega z rozpuszczonym tlenkiem siarki (IV) SO 2 :
Cu + 2H2SO4(stęż.) = t CuSO4 + SO2 + 2H2O.
W reakcji z metalami, które znajdują się w zakresie aktywności do wody, stężony kwas siarkowy może zostać zredukowany do tlenku siarki (IV) SO2, siarka S lub woda H2 S osadza się w aktywności metalu i umysłu podczas reakcja. Na przykład:
4Zn + 5H2SO4(kinety) = t 4ZnSO4 + H2S+ 4H2O.
Załóżmy, że jest zimno, aluminium i inni diakoni, dla największych umysłów, przechodzą przez stężony kwas siarkowy.
Kwas siarkowy jest skoncentrowany w interakcji z prostymi niemetalami mowy, na przykład z siarką:
S + 2H2SO4 = t3SO2 + 2H2O.
Utleniający bogato składany organiczne kiełki kwas siarkowy spala papier, tkaniny, drewno, ubrania i szkir. Dlatego uważaj na stężony kwas siarkowy.
Kwas siarkowy jest zagęszczany w celu usunięcia innych lotnych kwasów i ich soli. Na przykład:
NaCl (tv) + H2SO4 (stęż.) = t NaНSO4 + HCl.
W Republice Białorusi kwas syryjski jest wibrowany przez BAT „Gomel Chemical Plant”, BAT „Grodno Azot”.
Obszary stagnacji kwasu siarkowego
Smród przedstawia malucha 63.
Mal. 63. Zastój kwasu siarkowego
Kwas siarkowy H2 SO4 jest bezwonną, oleistą, oleistą ojczyzną.
Kwas siarkowy rozpuszcza się w interakcji z metalami, dzięki czemu może być aktywny do jednego dnia; z tlenkami metali; z podstawami; z soli.
Przy interakcji stężonego kwasu siarkowego z metalami nie widać wody.
Do kwasowej manifestacji kwasu siarkowego i soli її w różach wodnych stosuje się sole baru.
Zapytanie i zadanie
1. Zapisz formuły swoich tlenków i kwasów cycynowych. Wskaż stopień utlenienia zawartych w nich atomów sirka.
2. Vznachete masu s_rki, scho spalił się na kwaśno, yakshcho na rogu zauważono 29,69 kJ ciepła. Jaka jest chemiczna ilość rozliczanego tlenku siarki (VI)? Efekt termiczny reakcji gorącego powietrza wynosi 296,9 kJ/mol.
3. Koristuyuchis tabeli rozchinnosti sole, kwasy i zasady w wodzie, przechowuj 2 równe reakcje rozcieńczony kwas siarkowy z solami. Napisz mecz
v wygląd molekularny i jonowy.
4. Razrahuyte to masa i ilość chemiczna siarczanu baru, którą stosuje się po rozcieńczeniu kwasem siarkowym na bazie azotanu baru o masie 200 g, ułamek masowy Ba (NO 3 )2 kosztują 10%.
5. Skopiuj z tekstu paragrafu reakcje równoważne, które charakteryzują moc chemiczną stężonego kwasu siarkowego. Wyznacz stopień utlenienia atomów w sirka w її spolukah. Reakcja skórna wykazuje działanie utleniające.
6. Dowolna objętość stężonego kwasu siarkowego (= 1,83 g/cm 3) z udziałem masowym H2 SO4 98% wymaganego rozkładu średniej masy 6,4 r?
7. Ustaw współczynniki dla schematów wyrównywania rozpoczynających się reakcji utleniająco-utleniających:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2S + HClO → K2SO4 + HCl.
Reakcja skórna wykazuje działanie utleniające.
§ 40. Zrozumienie wyjścia produktu reakcji chemicznej
Chemіchnі vnyannya, złożony zgodnie z prawem zachowania mas przemówień, pozwala przeprowadzić rozrahunki, zokrema, aby policzyć masu, w celu określenia chemicznej ilości produktu reakcji. W praktyce wiele reakcji przebiega odwrotnie, część mowy jest wykorzystywana w wyniku parowania, separacji lub adopcji produktów ubocznych. Z tym produktem reakcja powinna być mniejsza, niższa, byłoby mniej prawdopodobne, dopóki reakcja nie będzie równomierna. W ten sposób, jeśli teoretycznie zaakceptowany jako wolny od ryzyka dla równej reakcji masy, lub ilość chemiczna produktu wynosi 100%, to w rzeczywistym procesie wydajność produktu będzie mniejsza niż 100%.
Jest to wskazane w produkcie reakcji literą alfabetu greckiego (tsya) i pojawia się w częściach pojedynczego chi w setkach miejsc.
Nadmiar reakcji chemicznej na produkt - wartość, która dodaje ilość masy (objętość, ilość chemiczna) faktycznie usuniętej z produktu do masy (obsyagu, ilość chemiczna) produktu, obliczona dla równej reakcji:
We wszystkich tych wariantach znajdziesz tę samą wartość dla wyjścia produktu reakcji chemicznej. Na przykład, jak zwykle, do reakcji utleniania tlenku siarki (IV) do tlenku siarki (VI)
2SO2 + O2 2SO3
stało się 80% (lub 0,8), tse oznacza, że z tlenkiem siarki(IV) o masie 64 g (objętość 22,4 dm3, ilość chemiczna 1 mol) objętość 22,4 dm3, ilość chemiczna 1 mol) i masa 80 g ∙ 0,8 = 64 g (objętość 17,9 dm3, ilość chemiczna
Od wielkości produkcji towarów do rzeczywistego procesu produkcji, pęd do vysnovok o povnotі perevorennya syrovini, vitratah energії, potrzebie wprowadzenia dodatkowych operacji i w.
Rzućmy okiem na kilka przykładów rozrahunkiv z pojęcia „z produktu reakcji”.
tyłek 1. W wyniku poparzenia sirka o masie 48 g usunięto tlenek sirka(IV) o objętości (n.d.) 28,6 dm3. Określ termin ważności produktu reakcji.
m(S) = 48 g | 1. Znacznie chemiczna ilość sirka, |
||||
praktyka V (SO2) = 28,6 dm3 | zareagował: | ||||
SM) | |||||
(SO2)=? | n(S) | ||||
SM) | 32 g/mol |
||||
2. Stosunkowo równa reakcja z tlenkiem siarki (IV): S + O2 = SO2.
3. Znamy teoretyczną ilość tlenku siarki (IV):
1 mol S - 1 mol SO2;
1,5 mola S-1,5 mola SO2.
Zrozumienie produktu reakcji chemicznej |
4. Znamy teoretyczną wartość tlenku siarki(IV):
V teorie (SO2) = n teorie (SO2) V m = 1,5 mol 22,4 mol/dm3 = 33,6 dm3.
5. Razrahuymo z produktu reakcji:
Vidpovіd: vyhіd do reakcji na lek dorіvnyuє 85%.
Przykład 2. Wybierz masę pirytu FeS2, niezbędną do żywotności w celu pobrania tlenku (IV) o objętości (n.a.) 8,96 dm3, tak aby wydajność produktu reakcji wynosiła 90%.
V(SO2) = 8,96 dm3 | 1. Istotnie teoretyczna wartość tlenku siarki(IV): |
|||||||||||
(SO2) = 90% | V praktyczne | V praktyczne | ||||||||||
m (FeS2) =? | Teoria gwiazd V = | |||||||||||
V teoria | ||||||||||||
Vteor (SO2) = | V praktyczny (SO 2) | 8,96 dm3 | 9,56 dm3. |
||||||||||
2. Znamy teoretyczną ilość chemiczną tlenku siarki (IV): |
||||||||||||
n teoria(SO 2) | Teoria V(SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Stosunkowo równa reakcji tlenku siarki(IV) i chemicznej ilości pirytu niezbędnej do vipalu:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Istotnie piryt masu, który jest niezbędny do uzyskania vipalu: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Wskazanie: do posiadania tlenku siarki (IV) wymagany jest piryt o masie 24 g.

Nadmiar reakcji chemicznej na produkt - wartość zwiększająca ilość masy (obsyagu, ilość chemiczna) faktycznie odprowadzonego z produktu do masy (obsyagu, ilość chemiczna) produktu, obliczona dla równych reakcji. Pojawia się w częściach sto i kilkuset.
Zapytanie i zadanie
1. Dlaczego praktyczna wydajność produktu reakcji wydaje się mniej, teoretycznie niższa dla równej reakcji?
2. W reakcji sirka z wodnym rachunkiem chemicznym 1 mola sirkovodny rozpuszczono w rachunku chemicznym 0,85 mola. Określ termin ważności produktu reakcji.
3. W rezultacie oddziaływanie chlorku baru o masie 200 g z wytrąconego kwasem siarkowym siarczanu baru o masie 100 g. Rozkładać produkt reakcji.
4. Określ objętość (n.a.) tej chemicznej ilości tlenku siarki(IV), który po rozpuszczeniu podczas spalania siarki ma masę 64 g, co oznacza, że produkt reakcji jest o 75% zdrowszy.
5. Oblicz masę spalonej sirki, a także pomiń objętościowo tlenek sirka (IV) (b.d.) 89,6 dm3 3, aby stać się 80% teoretycznie możliwych.
6. Podobno scho wydzielał się do tlenku siarki (VI), który został usunięty podczas utleniania tlenku siarki (IV),
droższe 85%. Określić masę, objętość (n.a.) i ilość chemiczną tlenku siarki(IV), który wszedł w reakcję, usuwając w ten sposób objętościowo tlenek siarki(VI) (n.a.) 2,24 dm3.
7. Z różnicy wybrać ułamek masowy soli, pobranej z mieszaniny o masie 3,2 g z kwasu siarkowego, o masie 192 g, tak aby wydajność produktu reakcji wynosiła 85%.
§ 41. Azot i fosfor
Azot N i fosfor P mieszają się w grupie VA układu okresowego. Mish'yak As, antymon Sb i bizmut Bi można zobaczyć przed grupą układu okresowego. Azot i fosfor są niemetalami, mish'yak i antymon są doprowadzane do napіvmetalіv, a wismuth kłamie metalom.
Atomy Budowy na tym etapie utleniania
Atomy pierwiastków grupy VA mają po 5 elektronów na zewnętrznym poziomie energii, konfiguracja elektronowa ich zewnętrznego poziomu energii ns 2 np 3 na przykład: azot - 2s 2 2p 3 fosfor - 3s 2 3p 3.
7N↓ | 15p↓ |
Menedżer.
- Dlaczego viklikana jest taką zmianą? Na jakiej dominacji dwuchromianu opiera się chromowe sumishi na przybory kuchenne?
- Do probówki wlać 5-6 kropli dwuchromianu potasu i 3 krople kwasu siarkowego. Dodaj 2 krople jodku potasu i rozcieńcz probówkę 10 kroplami wody. Przenieść jej część pipetą do innej probówki i dodać kroplę skrobi. Co się zmieniło w skrobi? Czemu? Składanie OVR i zvnyati metodą elektroniczno-jonową.
- Istotna charakterystyka pierwiastka 15 R. Dominacja modyfikacji alotropowych do fosforu. Interakcja fosforu z prostymi i składanymi przemówieniami.
W farmaceutykach tlenek rtęci (II) jest zastosovuetsya jako niższy antyseptyczny zasib do przygotowania maści do oczu, yake trzyma rozcieńczenie rozwiedzionego wodorotlenku sodu na komercyjnej soli rtęci.
Menedżer.
1. Napisz odpowiednią reakcję na tlenek rtęci (II). Wyjaśnij, dlaczego konieczne jest wykonywanie operacji na ciemności?
3. Podstawowe prawa chemii.
Vikoristannya z cynkiem w medycynie opiera się na tarcie jogi, działaniu antyseptycznym. 0,25% siarczan cynku jest skuteczny do przygotowania kropli do oczu razem z 2% kwasem borowym.
Menedżer.
- Przygotować 0,25% roztwór siarczanu cynku w objętości 100 ml (ρ = 1,02 g/ml).
- Utwórz transformację
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Związek kowalencyjny, nominacja, widzisz, mechanizm oświecenia, władza. Wartościowość. Etap utleniania.
· Farmaceuta powinien kontrolować lepkość roztworu soli metodą permanganatometrii.
Menedżer.
1. Napisz podobną reakcję i porównanie metodą elektronowo-jonową.
2. Oblicz ilość 0,5% (ρ = 1,004 g/ml) wodorotlenku sodu potrzebnego do reakcji z 0,1 M ilością chlorku (III) 20 ml.
3. Prawo okresowe układ okresowy w świetle vchennya o życiu atomu.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє ale vilno vіd domіshok sulfіdіv midi, vugіllya, kwas krzemowy, mish'yaku.
Menedżer.
1. Poproś o sposób na zabezpieczenie wejścia do domu. Obguruntuvati vіdpovіd.
3. Główny rodzaj wiązania chemicznego. Natura stworzy związek chemiczny.
· W przypadku ciała nadmanganianu z wydrą їx zneshkodzhennya przeprowadza się za pomocą 3% wodnego roztworu zakwaszonego kwasu ocznego H 2 Pro 2 .
Menedżer.
1. Napisz podobną odpowiedź. Zbadaj reakcję metodą elektronowo-jonową
- Oksidi, mianowanie, klasyfikacja, nazewnictwo, autorytet i sposoby posiadania.
· Analiza mowy w preparacie śliny przeprowadzana jest metodą permanganatometrii, opartą na zdolności utlenienia Fe2+ do Fe3+. Dolna część wdychanego powietrza jest oddzielana od kwasu siarkowego podczas ogrzewania i po schłodzeniu, miareczkowana 0,1 N nadmanganianem potasu.
Menedżer.
1. Napisz równe reakcje, które są podstawą definicji.
2. Przygotować 200 ml 0,1 N KMnO 4 (współczynnik równoważności zależy od reakcji).
3. Kwasowość, wyznanie, klasyfikacja, nazewnictwo, autorytet, sposoby posiadania.
· Azotan farmakopealny leku został odsunięty o kolejny stopień: stop miedzi i srebra oddzielany jest od kwasu azotowego, w celu oczyszczenia usuwania azotanów z domów, jest wytrącany kwasem solnym. Oblężenie, które jest wiszowem, jest przywracane cynkiem w kwaśnym środowisku i wysychane, zwilnene w domach, ponownie spryskiwane kwasem azotowym.
Menedżer.
- Napisz reakcje rіvnyannya іdpovіdnyh.
- Reakcje Vikonaty yakіsnі na anion Cl-, Br-, J z różnymi azotanami srіbla, scho, aby leżeć w oparciu o potwierdzenie poprawności preparatów chlorków, jodków, bromków potasu.
- Uzasadniaj, wyznaczaj, klasyfikuj, nazewnictwo, autorytet, metody posiadania.
9. Azotan srіbla zastosovuєtsya zvnіshno w erosіyah, vyrazki, gostroma spojówek w viglyadі 2,5 i 10% zaopatrzenie w wodę.
Menedżer.
- Przygotować 2% roztwór AgNO 3 o objętości 50 ml (ρ= 1,015 g/ml). Jakie umysły są potrzebne, aby zająć się tym rozchinem?
- Utwórz transformację
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Sól, oznaczenie, klasyfikacja, nazewnictwo, autorytet, sposoby posiadania.
· Farmaceuta powinien przeprowadzić identyfikację farmakopealnego leku siarczan baru.
Menedżer.
1. Jaka jest metoda siarczanu baru w medycynie? Dlaczego siarczan baru jest stapiany z węglanem sodu przed reakcjami identyfikacyjnymi? Vidpovіd potwierdzone równymi reakcjami.
2. Reakcje Viconatiego i identyfikacja soli BaSO4, CaSO4, Na2SO4.
3. Kompleksowe spoluky, oznaczenie, budov dla A. Wernera, natura wiązania chemicznego, klasyfikacja, nazewnictwo, dysocjacja. Kompleks Zastosuvannya spoluk w medycynie i analizie chemicznej.
· Farmaceuta, który pracuje ze stężeniem amoniaku, dopuszczając się poważnego uszkodzenia sprzętu ochronnego - wykonując prace przy poplamionej szafie bez zwiększonej siły pociągowej.
Menedżer.
- Jakie są konsekwencje, które można zastosować podczas pracy ze stężeniem amoniaku bez dodatkowego wyposażenia ochronnego? Pomoc medyczna Yaku pershu jest niezbędna do zastosowania w przypadku zatrutych oparów amoniaku.
- Stwórz taką transformację.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Napisz równanie reakcji dla wyglądu molekularnego i jonowego, a dla OVR - patrz metodą równowagi elektronowej.
- Kinetyka chemiczna. Szybkość reakcji chemicznej. Wpływ różnych czynników na szybkość reakcji chemicznych.
· Zі spoluk azot w medycynie zastosovuyutsya amoniak w wodzie, soli, amonu, podtlenku azotu i azotynie sodu.
Menedżer.
- Jaka jest metoda zwycięskiego dawania azotowi? Napisz formuły tych przemówień i równych reakcji, które charakteryzują główne siły.
- Napisz równą reakcję azotanu sodu z nadmanganianem potasu w środowisku kwaśnym. Zbadaj reakcję metodą drzemki_reakcje
- Nieodwracalne i wilkołaki reakcje chemiczne. Gorliwy chemik. Prawo mas dla równych systemów. Stała kapitałowa. Zasada Le Chateliera.
· Farmaceuta powinien przeprowadzić identyfikację soli siarczanu sodu, chlorku sodu, wodorowęglanu sodu.
Menedżer.
- Reakcje Vikonaty akіsnі na jony SO 4 2-, Cl-, HCO 3-.
- Razrahuvat, skіlki gram_v krystalohydrat Na 2 SO 4 10H 2 O farmaceuta musi parzyć w wodzie o masie 500 g, aby wziąć 5% Na 2 SO 4 ?
- Reakcje tlenek-woda. Główne postanowienia teorii elektronowej reakcji wspomagania utleniania. Najważniejsze utleniacze i przewodniki. Reakcje tlenkowo-wodne Zrivnyannya metodą równowagi elektronicznej i metodą jonowo-elektroniczną.
Siła potasowa kwasu siarkowego wydaje się być bogata w leki obce dla organizmu (ksenobiotyki) - preparaty lecznicze te metabolity z rozwiązaniami niektórych małych przemówień - koniugaty, które są łatwo wydalane z organizmu.
Menedżer.
- Odbierz moc potasową kwasu siarkowego w inny sposób, zastępujący na stole reaktywnym. Napisz reakcje rіvnyannya іdpovіdnyh.
- Zsumuj równości cząsteczkowe reakcji, które są wyrażane przez takie szybkie równości jonowe:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Systemy dyspersyjne, oznaczenie, klasyfikacja. Zawiesiny, aerozole, emulsje. Dobór systemów grubodyspersyjnych w medycynie i farmacji.
Farmaceuta musi zażyć 5% kwasu siarkowego.
Menedżer.
- Jaki jest depozyt właściwości utleniających anionu SO 4 2 w stężeniu kwasu? Napisz równanie reakcji charakteryzujących moc rozpuszczonego i stężonego kwasu.
- Przygotować 5% roztwór kwasu siarkowego przez przemycie 50 ml kwasu siarkowego o ułamku masowym H 2 SO 4 30%.
- Koloidni razchini, klasyfikacja, oznaczenie, kinetyka molekularna ta moc optyczna, otrimannya. Stabilność kolumn. Koagulacja. Peptyzacja. Mycel Budova. Dializa.
· Sirka, która trafia do magazynu aminokwasów, jest utleniana w organizmach. W przypadku endogennego kwasu siarkowego bierze udział w egzogennych zarodnikach – fenolu, krezolu i indolu.
Menedżer.
- Opisz moc kwasu siarkowego i omiń zasady pracy z kwasami.
- Aby rozpuścić, jaką objętość kwasu siarkowego o udziale masowym H 2 SO 4 25% i grubości 1,18 g / ml należy przyjąć do neutralizacji wodorotlenkiem potasu, o objętości 50 ml, o udziale masowym KOH 12% i grubości 1,1 g/ml
- Różnica prawdziwa, oznaczenie, podstawowe rozumienie, istota procesu różnicowania. Dyfuzja. Osmoza. Imadło osmotyczne.
· Na obszarach przemysłowych, gdzie występuje dużo vugillya, często wypadają kwaśne lasy.
Menedżer.
- Czym jesteś? magazyn chemiczny kwas dosch w pobliżu obszarów tsikh? Jak się robi wino? Napisz równe reakcje.
- Złóż jony molekularne i krótkotrwałe równe hydrolizie postępujących soli:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Okrążenie jest zakorzenione w przyrodzie w wielkie liczby za procesy biochemiczne rahunok i zemstę w wodach mineralnych pro sirchanih.
Menedżer.
- Moc dnia.
- Utwórz transformację:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Napisz równanie reakcji dla wyglądu molekularnego i jonowego.
- Dysocjacja kwasów, zasad, soli, wody. Kwasowo-zasadowa równa w rozchinah. Ionny dobutok woda, określanie pH.
· Oficjalny preparat leczniczy sirka є sirka, wyłożony (Sulfur praecipitafum).
Menedżer.
- Opisz moc wolnej sirki i alotropowe modyfikacje sirki.
- Utwórz transformację:
Reakcje Zrivnyati metodą równowagi elektronicznej.
- Hydroliza. Istota procesu hydrolizy. Hydroliza różnych rodzajów soli. Hydroliza stopniowa. Napływ różnych czynników na etapie hydrolizy.
· Farmaceuta przeprowadza reakcję identyfikacji 3% roztworu nadtlenku wody: do 1 ml roztworu końcowego dodać 1 ml rozcieńczonego kwasu siarkowego, 1 ml eteru i 0,5 ml dwuchromianu potasu, w wyniku czego kulka eter zmienia kolor na niebieski w obecności kwasu 6
Menedżer.
- Reakcja Vikonaty іdentifіkatsії nadtlenek wódki.
- Napisz równą identyfikację nadtlenku wody i równowagi metodą wagi elektronicznej.
- Charakterystyczna charakterystyka elementów podgrupy głowy grupy VII i ich połowy. Medyczny znaczenie biologiczne halogeny.
· Kisen to preparat farmaceutyczny i opisy w GF. Yogo zastosovuyut do inhalacji na różne rodzaje głodu kwasowego.
20. Menedżer.
- Napisz równe reakcje ujawnionych domów CO, 2, NO, NO2.
- Napisz równe reakcje, które są podstawą laboratoryjnej metody usuwania kwasu. Indukcja reakcji metodą równowagi elektronowej
- Chlor, woda chlorowana, kwas solny, chlorek. Fizyczna i chemiczna moc chloru i spoluku do jogi. Medyczno-biologiczne znaczenie halogenów.
· Farmaceuta sprawdza ważność leków na bazie chlorku sodu, bromku sodu i jodku sodu.
Menedżer.
- Do takich celów w farmacji i medycynie stosuje się sole vicorious.
- Vikonaty akіsnі reakcje na anioni Cl-, Br-, J-.
- Fizyczna i chemiczna moc kwaśnego chloru. Otrimannia. Zastosuvannya.
· Jedną z przemysłowych metod pozyskiwania jodu do celów farmaceutycznych jest proces otrzymywania jodu z wód wiertniczych. Jodek znajdujący się w pobliżu wód wiertniczych utlenia się według schematu:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Menedżer.
- Jak przygotować jod i jak go wykorzystać w medycynie.
- Zbadaj reakcję, która leży u podstaw obsesji na punkcie jodu, metodą reakcji.
- Krytyczna charakterystyka chalkogenów. Moc kwaśna i joga połowa. Medyczno-biologiczne znaczenie kwaśności.
· Farmaceuta określa poprawność preparatów chlorków sodu, potasu i wapnia.
Menedżer.
- Do takich celów vicorists stosuje się w preparatach farmaceutycznych.
- Reakcje Vikonatiego _identyfikacja tych soli.
- Pół kwaśny z wodą. Siły fizyczne i chemiczne wody. Nadtlenek wody, dominacja, przekrwienie w medycynie. Znaczenie wody w życiu organizmów.
· Zі spoluk halogenіv z kwaśnym mniej podchlorynem, aby stał się przedmiotem zainteresowania medycyny jako środek dezynfekujący.
Menedżer.
- Na jakiej mocy podchlorynów opiera się dzień dezynfekcji? Napisz reakcje rіvnyannya іdpovіdnyh.
- Razrahuvati, skіlki gramіv kąpiel chlorowa musi być wzięta za otrimannya 2 litry aktywnego chloru.
- Sirka i її z podłogi. Alotropia wolnej sirki. Siła fizyczna i chemiczna sirków, sirkovodnya, sirkovodnya i soli її.
· W przypadku niedostatecznej kwasowości soku z muszli zalecany jest wewnętrznie rozcieńczony kwas chlorowodorowy.
Menedżer.
- Wymień ogólne zasady pracy z kwasami.
- Razrahuvat, skіlki ml 36,5% - odmiana (ρ = 1,19 g / ml) kwasu solnego i należy wziąć do przygotowania 100 ml. 8,2% - oh (ρ=1,040 g/ml) kwasu.
- Siła fizyczna i chemiczna tlenków siarki, kwasu siarkowego, kwasu siarkowego. Siarczyn. Sulfati. Moc, obsesja, zastosuvannya.
· W farmacji jednym ze standardowych rozmiarów jest 33% octan potasu, czyli sposób rozmieszczenia węglanu potasu w 30% - kwasie oktanowym.
Menedżer.
1. Napisz równanie reakcji dla wyglądu molekularnego i jonowego.
- Istotna charakterystyka elementów podgrupy głowy grupy V. Dominacja wolnego azotu. Wartość azotu w życiu organizmów.
· Recepty przemówień, które są mocnymi zasadami i słabymi kwasami. W celu zastosowania GFH jako stabilizatora dodaje się 0,1 n roztworu wodorotlenku sodu do 4 ml na 1 litr produktu.
Menedżer.
- Napisz równanie reakcji hydrolizy soli CH3COONa.
- Razrahuvat, skіlki gramіv NaOH należy zadzwonić, aby wziąć rozmiar 500 ml 0,1n. Przygotuj wszystkie projekty pod kątem najnowszych technologii bezpieczeństwa.
- amoniak. Sól amonowa. moc. Zastosuvannya w medycynie i farmacji.
· Farmaceuta przygotowuje maść na receptę: 1 g węglanu potasu i 0,5 g tetraboranu sodu miesza się w 70 ml wody destylowanej, 10 g stearyny miesza się z 15 g oleju wazelinowego i dodaje cienkim strumieniem po zmieszaniu ciepłą wodą do węglanowania. .
Menedżer.
- Jakie przemówienia są rozstrzygane w następstwie których zmishuvannya? Jak środek jest ustalony i dlaczego? Vidpovіd potwierdzone równymi reakcjami.
- Przygotowanie wagi technologiczno-chemicznej dla robotów. Weź 1 g węglanu potasu na stronach techniczno-chemicznych.
- Azot tlenkowy. Kwas azotawy i sole її. Zdolności fizyczne i chemiczne. Medyczno-biologiczne znaczenie azotu
· Konieczne jest, aby farmaceuta przygotował 0,05% nadmanganianu potasu w objętości 200 ml do płukania jamy ustnej i gardła.
Menedżer.
- Na jakim autorytecie zakorzeniony jest nadmanganian potasu w yogo likuvalna diya? Yakі spoluky mangan zastosovuetsya in radosne cele?
- Aby zamówić 200 ml 0,05% KMnO 4 (ρ = 0,9994 g/ml.), konieczne jest dodanie kilku gramów KMnO 4 . Zademonstruj technikę przygotowania tego projektu.
- Cząsteczki Budova kwasu azotowego. Moc fizyczna i chemiczna kwasu azotowego i soli її. Medyczno-biologiczne znaczenie azotu i spoluk.
· W farmaceutykach tlenek rtęci (II), który jest skuteczny jako środek antyseptyczny zasib, jest oddzielony od wodorotlenku sodu na komercyjnej soli rtęci (II).
Menedżer.
1. Napisz odpowiednią reakcję na tlenek rtęci (II). Dlaczego reakcje muszą być przeprowadzane u krasnoludków?
3. Podstawowe prawa chemii.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Kwas nadchromowy, który rozpuszcza się z cioma, H 2 CrO 6 ma kolor niebieski. Zanieczyszczenie niebieskim kwasem potwierdza skuteczność preparatu H2O2.
Menedżer.
- Reakcja Zrivnyati tsyu metodą elektroniczno-jonową.
- Yakі spoluky chrom wykazuje moc oksydacyjną, a yakі - vodnovlyuvalnі?
- Dominacja fosfiny, tlenków fosforu i kwasów fosforowych, ich posiadanie. Medyczno-biologiczne znaczenie fosforu
· Sumish tlenek magnezu (85%) i nadtlenek magnezu (15%) - lek znany jako "nadtlenek magnezu", który zastosovuyut w zaburzeniach śluzówkowo-jelitowych.
Menedżer.
- Wyjaśnij lek zobojętniający i bakteriobójczy. Vidpovіd potwierdzone równymi reakcjami.
- Razrahuvat, skilki gramów MgO i MgO 2, które musisz wziąć, aby przygotować 100 g tego leku. Wezwij techniczno-chemiczne teres 10 g tlenku magnezu.
- Charakterystyczna charakterystyka elementów IV grupy głównej podgrupy. Budowa, Siła fizyczna alotropy w węglu. Energia chemiczna wolnego węgla.
· Rozkładać wodorowęglan sodu (sodę pitną) do zastosovatu na widok płukania, płukania przy płonących dolegliwościach oczu, błon śluzowych górnych dróg oddechowych.
Menedżer.
- Na jakiej mocy wodorowęglan sodu ma swoje korzenie w działaniu antyseptycznym? Vidpovіd potwierdzone równymi reakcjami. Czy możesz zwyciężyć jako środek antyseptyczny zasib tetraboran sodu Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Przygotuj 5% NaHCO3 w objętości 50ml (=1,036g/ml).
- Cząsteczki Budowa, fizyczne i chemiczne moce kwaśnego węgla drzewnego. Medyczno-biologiczne znaczenie węgla i jogi.
В· Preparaty zobojętniające sok żołądkowy, które mszczą wodorowęglan sodu, zastępują różne choroby, którym towarzyszy podwyższona kwasowość, tobto. kwasica.
Menedżer.
- Na jaką moc soli działają preparaty zobojętniające kwas? Vidpovіd potwierdzone równymi reakcjami. Czy do tych celów można wykorzystać inne przemówienia?
- Utwórz transformację:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Napisz równanie reakcji dla wyglądu molekularnego i jonowego.
Reakcje Viconatiego Na 2 CO 3 →NaCl→NaNO 3.
- Krzem i pół joga, znajomość przyrody, otrimannya, moc fizyczna i chemiczna. Medyczno-biologiczne znaczenie krzemu.
· 2,5% roztwór NaCl jest podawany wewnętrznie w celu przepłukania odpływu, gdy AgNO 3 jest zanieczyszczony.
Menedżer.
1. Na czym opiera się NaCl? Vidpovіd potwierdzone równymi reakcjami.
3. Główna charakterystyka elementów głównej podgrupy III grupy. Potężny las i spoluk jogi. Znaczenie medyczno-biologiczne w medycynie.
· Do rozwoju rzadkich form leczniczych, uznanych do iniekcji, zastępczych odmian izotonicznych.
Menedżer.
1. Co to jest odmiana izotoniczna? Dlaczego jogę nazywa się izotoniczną?
3. Aluminium i joga z podłogi, panowanie, otrimannya. Medyczne i biologiczne znaczenie aluminium.
· 3% wodny roztwór nadtlenku wody zastosovuyut jako skuteczny zasib bakteriobójczy.
Menedżer.
1. Jaka jest podstawa wody z nadtlenkiem kręgosłupa o działaniu bakteriobójczym i krwi. Jakie obce wpisy należy przyciąć podczas pracy z perhydrolem?
2. Razrahuvati, skilki ml. perhydrol (30% wodny roztwór H 2 Pro 2, ρ = 1,1 g / ml) należy pobrać do pobrania 500 ml 3% roztworu (ρ = 1,005 g / ml). Aby przygotować tsey rozchin z dotrimannym tekhnіki bezpeka.
3. Metale podgrupy czołowej II grupy. Charakterystyka Zagalna, otrimannya, moc fizyczna i chemiczna. Sole wapnia i magnezu. Twardość wody. Usunennia zhorstkostі woda. Znaczenie medyczno-biologiczne pierwiastków w podgrupie głównej II grupy.
· Współczesny przemysł farmaceutyczny wytwarza preparaty lecznicze zgodnie z obozem agregatów, rodzajem układów rozproszonych, sposobem wprowadzania do organizmu.
Menedżer.
1. Jakie systemy nazywamy rozproszonymi?
Jak klasyfikowane są systemy rozproszone?
Czy wyglądają na systemy rozproszone dozujące preparaty lecznicze? Podaj konkretne przykłady.
- Usuń hydrolat kalafonii, zastępując sprzedawcę.
- Charakterystyczna charakterystyka metali kałużowych, obsesja, siła fizyczna i chemiczna. Najważniejsze części metali księżycowych. Medyczno-biologiczne znaczenie metali kałużowych
· Na widok różnic w wodzie w różnych przemówieniach, zastosovuyutsya rіdkі formy lecznicze, które mogą być wzajemnie wzajemne.
Menedżer.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Jacy urzędnicy potrafią wygłaszać przemówienia?
- Przygotować 5% CuSO 4 o objętości 100 ml (ρ = 1,051 g/ml) z niebieskim witriolem CuSO 4 ∙ 5H 2 O
- Charakterystyczna charakterystyka d - pierwiastków. Metale podgrup bocznych I grupy i spoluk. Znaczenie medyczne i biologiczne.
· W Rosji odbywa się elektroprzetwarzanie soku i świeżych ziół o niskiej zawartości soku i dzikiej syroviny: jagód, owoców, roślin okopowych warzyw, różnych organów stworzeń metodą widzenia soków (zmieszanych wewnętrznie) w rodzimym wyglądzie. Przestrzeń wewnętrzna to kolumna bieli, kwasy nukleinowe, węglowodany, garbniki
Menedżer.
1. Jakie różnice nazywamy wzorami kolumnowymi? Jak klasyfikowane są smród? Wymień uprawnienia kolumn. Jaki proces leży u podstaw widzenia soków z zroszonej syroviny?
2. Usunąć wodorotlenek hydrozolu soli fizjologicznej (III) przez hydrolizę FeCl 3. Napisz schemat grzybni.
- Metale drugorzędnych podgrup II grupy, ogólna charakterystyka, budowa, moc fizyczna i chemiczna. Znaczenie medyczne i biologiczne.
· Przygotowując tabletki na bazie ekstraktu z korzenia kozłka lekarskiego nie zaleca się stosowania jako głównego wzmacniacza węglanu magnezu wikorystatu, ponieważ może on powodować neutralizację kwasu izowalerianowego i ruynuvannya valtrativ - rechovina, jeszcze bardziej wrażliwej na napar łąkowy.
Menedżer.
1. Wyjaśnij przejaw mocy kałuży na węglan magnezu. Napisz równanie reakcji dla wyglądu molekularnego i jonowego. Jakie przypomnienia można wykorzystać do przygotowania tabletek z ekstraktem kozłka lekarskiego?
2. Utwórz transformację:
MgO→MgCl2 →MgSO4 →Mg(OH)2 →MgOHCl
Napisz równanie reakcji dla wyglądu molekularnego i jonowego.
3. Ogólna charakterystyka elementów VI, VII grup podgrup bocznych. Przewaga tlenkowa chromu, manganu i ich części. Znaczenie medyczne i biologiczne.
· Zastosowanie gazu zastępczego dwutlenku węgla w produkcji farmaceutycznej do ekstrakcji biologicznie aktywnych przemówień z leczniczej zroszonej syrowiny.
Menedżer.
- Na jakich dominacjach kwasu węglowego jest podtrzymywanie jogi w tych celach?
- Utwórz transformację:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Napisz reakcje wymiany jonowej w formie molekularnej i jonowej.
- Charakterystyczna charakterystyka elementów grupy VIII podgrupy drugorzędowej. Panowanie sali i spoluk jogi. Znaczenie medyczne i biologiczne.
Lista posiłków egzaminacyjnych z dyscyplin
Podstawowe pojęcia i prawa chemii. Takie ustawienie życia atomu.
Prawo okresowe i układ okresowy D.I. Mendeliew w świetle życia atomu.
Mianowanie, zobacz, zrozum, oświecić naturę wiązania chemicznego.
Powołanie, mechanizm oświecenia, siła wiązania kowalencyjnego. Wartościowość. Etap utleniania.
Oksidi: nominacja, klasyfikacja, nazewnictwo, władza i sposoby posiadania.
Kwasy: oznaczenie, klasyfikacja, nazewnictwo, moc i sposoby posiadania.
Uzasadnienie: powołanie, klasyfikacja, nazewnictwo, władza i sposoby posiadania.
Sole: oznaczenie, klasyfikacja, nazewnictwo, autorytet i sposoby posiadania.
Złożone spoluky: spotkanie, budova według Wernera, tipi, nomenklatura.
Szybkość reakcji chemicznej. Urzędnicy, reakcja chemiczna scho vplyvayut swidk_st.
Nieodwracalne i odwracalne reakcje chemiczne. Gorliwy chemik. Zasada M. Chateliera. Stała kapitałowa.
Reakcje utleniania tlenków: najważniejsze, główne pojęcia, dzień utleniania i odnowy, najważniejsze czynniki utleniające i liderzy reakcji.
Systemy dyspersyjne: oznaczenie, klasyfikacja. Systemy gruboziarniste: zawiesiny, aerozole, emulsje.
Koloidni razchiny: vyznachennya, panowanie, obsesja, grzybnia budova.
Różnice prawdziwe: oznaczenie, podstawowe rozumienie, istota procesu różnicowania. Dyfuzja. Osmoza. Imadło osmotyczne.
Główne postanowienia teorii dysocjacji elektrycznej. Mechanizm dysocjacji elektrycznej. Zwiększ tę stałą dysocjacji.
Dysocjacja kwasów, zasad, soli. Dysocjacja różnicy pH.
Istota hydrolizy. Hydroliza różnych rodzajów soli. Hydroliza stopniowa.
Charakterystyczna charakterystyka elementów głównej podgrupy grupy VII. Medyczno-biologiczne znaczenie halogenów
Chlor, woda chlorowana i kwas solny. Otrimanja, panowanie. Chlorek.
Kisnevі spoluki chlor.
Krytyczna charakterystyka chalkogenów. Kisen ta Yogo w połowie drogi. Medyczno-biologiczne znaczenie kwaśności.
Dominacja jest w połowie kwaśna z wodą (woda, nadtlenek wody). Zastosuvannya H 2 Pro 2 w medycynie. Wartość ołowiu.
Sirka. Alotropia wolnej sirki. Chemia władzy świata. Obejście. Kwas Serkovodny i sole її.
Siła fizyczna i chemiczna tlenków siarki, kwasów siarkowego i siarkowego, soli kwasu siarkowego, kwasów siarkowych, ich stagnacja.
Charakterystyczna cecha pierwiastków głównej podgrupy grupy V. Azot i energia.
Dominacja amoniaku i soli amonowych. Zastosuvannya w medycynie i farmacji.
Azot tlenkowy. Kwas azotawy i sole її. Moc fizyczna i chemiczna, stosuvannya.
Fizyczna i chemiczna moc kwasu azotowego. nie wydawaj. Medyczno-biologiczne znaczenie azotu i spoluk.
Charakterystyka pierwiastka 15 R. Podły fosfor: alotropia, siła fizyczna i chemiczna, obsesja.
Fosfina. Tlenki fosforu i kwasu fosforowego: władza, obsesja. Medyczno-biologiczne znaczenie fosforu
Charakterystyczna charakterystyka elementów IV grupy głównej podgrupy. Vuglets: Budova i dominacja fizyczna, alotropia vugletsyu, dominacja chemiczna.
Kisnevі spoluky vugletsiu: cząsteczki Budova, dominacja fizyczna i chemiczna. Medyczno-biologiczne znaczenie węgla i spoluk jogi.
Krzem i pół joga: znajomość przyrody, męskości, siły fizycznej i chemicznej. Medyczno-biologiczne znaczenie krzemu.
Główna podgrupa grupy ІІІ: główna charakterystyka elementów. Bor i joga z boku: otrimannya, siła fizyczna i chemiczna, zastosuvannya w medycynie.
Aluminium i joga: obsesja, siła fizyczna i chemiczna. Medyczne i biologiczne znaczenie aluminium.
Metale podgrupy głowy II grupy: cechy charyzmatyczne, obsesja, siła fizyczna i chemiczna. Sole wapnia i magnezu. Twardość wody. Usunennia zhorstkostі woda. Znaczenie medyczno-biologiczne pierwiastków w podgrupie głównej II grupy.
Luzhnі rzucił: charakterystyka charytatywna, obsesja, dominacja, najważniejsze spoluchy. Znaczenie medyczne i biologiczne.
Charakterystyczna charakterystyka pierwiastków d. Metale drugorzędnej podgrupy I grupy. Pojdnannya midi, sribla. Znaczenie medyczne i biologiczne.
Metale podgrup bocznych II grupy: krytyczna charakterystyka życia, siły fizycznej i chemicznej. Znaczenie medyczne i biologiczne.
Podgrupy boczne VI, VII grupy: charakterystyczna charakterystyka pierwiastków podgrupy, dominacja chromu, manganu i ich połowy. Znaczenie medyczne i biologiczne.
Podgrupa grupy VIII: ogólna charakterystyka elementów podgrupy, siła sali i spoluk yogo. Znaczenie medyczne i biologiczne.
Osada. Na stole ze skórą przed uczniami znajduje się plan lekcji, schemat oddziaływania kwasu azotowego z metalami, zestaw odczynników oraz testy do mocowania skręconego materiału.
Tlenek azotu
Nauczyciel.Zgadnij i napisz wzór na tlenki azotu. Yaki oksi nazywane są solą fizjologiczną, yaki - bez soli fizjologicznej? Czemu?
Naucz się samodzielnie zapisywać wzory pięciu tlenków azotu, nazwij je, określ mgłę azotową kwasów kisnevy i ustal reaktywność między tlenkami a kwasami. Jeden z uczniów jest napisany na dosz (tabeli).
Tabela
Wiązanie tlenków azotu, kwasów i soli
Świadectwo demonstracyjne:
oddziaływanie tlenku azotu(IV) z wodą
Nauczyciel. Na statku NIE 2 dodaj trochę wody i wymieszaj, a następnie spróbuj usunąć plamy lakmusem.
Co jest strzeżone? Rozchin chervonіє przez dwa kwasy, które się osiedliły.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Etap utleniania azotu NIE 2 powodzenia +4. pośrednio między +3 a +5, jak w rozchini stiykish, że tlenek azotu(IV) otrzymuje dwa kwasy - azotan azotowy.
Magazyn molekuły Budova
Nauczyciel.Zapisz na tablicy wzór cząsteczkowy kwasu azotowego, oblicz masę cząsteczkową i stopień utlenienia pierwiastków. Złóż wzory strukturalne i elektroniczne.
Naucz się tworzyć takie formuły (ryc. 1).
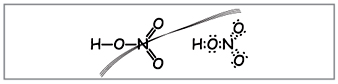
Nauczyciel.Najwyraźniej aż do tych wzorów dziesięć elektronów jest owiniętych wokół azotu, ale nie możesz go użyć, ponieważ. azot znajduje się w innym okresie i na ile to możliwe na zewnętrznej kuli, w nowym może być mniej niż najwyższych elektronów. Ta powierzchowność jest ustalona, więc załóżmy, że między atomem azotu a jednym atomem za mechanizmem donor-akceptor powstaje wiązanie kowalencyjne(rys. 2).
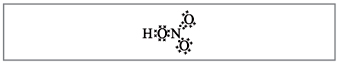
Mal. 2. Formuła elektroniczna kwasu azotowego.
Elektrony atomu azotu zaznaczono czarnymi kropkami
Ten sam wzór strukturalny kwasu azotowego można przedstawić w następujący sposób(rys. 3) :
Mal. 3. Wzór strukturalny kwasu azotowego
(połączenie dawcy-akceptora wskazań ze strzałką)
Jednak na ostatniej ścieżce doprowadzono do tego, że podstawowe ogniwo jest równo podzielone między dwa atomy kwasowości. Stopień utlenienia do azotu w kwasie azotowym wynosi +5, a wartościowość (ujawnia respekt) to ponad połowa, ponad połowa wysokiego zakładu elektronicznego.
Siła fizyczna kwasu azotowego
Nauczyciel.Przed tobą butelki rozcieńczonego i stężonego kwasu azotowego. Opisz moce fizyczne, które możesz przewidzieć.
Naucz się opisywać kwas azotowy jako ważne źródło wody, o żółtawym kolorze, o ostrym zapachu. Kwas azotowy Roschin bez koloru i bez zapachu.
Nauczyciel. Dodam, że temperatura wrzenia kwasu azotowego wynosi +83 ° C, temperatura zamarzania to -41 ° C, tobto. dla wielkich umysłów ojczyzny. Ostry zapach i te, które po uratowaniu nie spalą, tłumaczone są tym, że kwas jest stężony, mało odporny i lekki, a po podgrzaniu często się pęcznieje.
Moc chemiczna kwasu
Nauczyciel. Zgadnij jakie przemówienia mają oddziaływać z kwasami?(Dowiedz się, jak nazwać.)
Zanim zareagujesz, spróbuj wypisać reakcje i zapisać swoje ostrzeżenia (reakcje powinny być spisane w świetle TED).
A teraz jesteśmy dzicy na specyficzne właściwości kwasu azotowego.
Stwierdziliśmy, że kwas po uratowaniu jest teraz przenoszony przez reakcję chemiczną:
4HNO3 \u003d 2H2O + 4NO2 + O2.
(Badania niezależnie rejestrują równowagę elektroniczną reakcji.)
„Zakop gaz”, co widać(NO2) kwas farbuy.
Szczególnie konieczne jest przeprowadzenie kwasu poprzez doprowadzenie go do metalu. Wiesz, że kiedyś usuwały wodę z różnych kwasów, ale podczas interakcji z kwasem azotowym nie jest to usuwane.
Spójrz na diagram na twoim biurku, który pokazuje, jak gazy są postrzegane w reakcji kwasów o różnym stężeniu z metalami.(Robot ze schematem.)
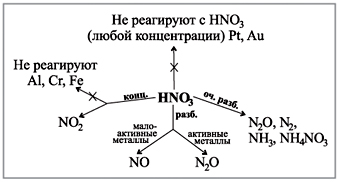
Świadectwo demonstracyjne:
oddziaływanie stężonego kwasu azotowego z miodem pitnym
Jeszcze skuteczniejsze jest zademonstrowanie reakcji kwasu azotowego (stęż.) z proszkiem midi lub drobno pokrojonymi kawałkami miodowej tarcicy:
Naucz się samodzielnie rejestrować elektroniczną równowagę reakcji:
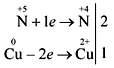
Posiadanie kwasu
Nauczyciel. Lekcja będzie niezrozumiała, jakbyśmy nie mogli dostrzec wartości odżywczej kwasu azotowego.
Metoda laboratoryjna: diya stężony kwas siarkowy na azotanie (ryc. 5).
NaNO3+H2SO4=NaHSO4+HNO3.
W przemyśle kwas jest otrzymywany głównie metodą amoniakalną.
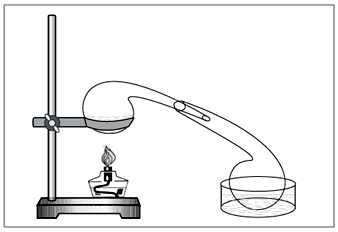
Mal. 5. Do wycofania kwasu azotowego w dos laboratoryjnych
ręcznie pobite stare szkło chemiczne - retorta
Metoda zawierania kwasu azotem i kwasu w temperaturze powyżej 2000 ° C (łuk elektryczny) nie spowodowała szczególnej ekspansji.
W Rosji historia wprowadzenia kwasu azotowego związana jest z nazwiskiem chemika-technologa Iwana Iwanowicza Andrejewa (1880–1919).
Vin y 1915 po utworzeniu w 1917 roku pierwszego zakładu redukcji kwasu amoniakiem i wdrożeniu metody rozprężania na skalę fabryczną. Pierwsza fabryka buv zbudovaniya pod Donieckiem.
Ta metoda obejmuje kilka kroków.
1) Przygotowanie zawiesiny amoniakalnej w proszku.
2) Utlenianie amoniaku znów jest kwaśne na platynowej płycie:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Dalsze utlenianie do tlenku azotu(II) do tlenku azotu(IV):
2NO + O2 = 2NO2.
4) Oznaczanie tlenku azotu (IV) w wodnym kwasie:
3NO2+H2O=2HNO3+NO.
Jako rozróżnienie w obecności kwaśnego, cały tlenek azotu (IV) jest przekształcany w kwas azotowy.
5) Ostatnim etapem usuwania kwasu azotowego jest oczyszczenie gazów, takich jak atmosfera i tlenki azotu. Magazynowanie gazów: do 98% azotu, 2-5% kwasu i 0,02-0,15% tlenków azotu. (W pierwszej kolejności wykorzystywany jest azot, brany do utleniania amoniaku.) Jeżeli tlenki azotu w tych gazach są większe niż 0,02%, to ich katalityczna regeneracja do azotu jest przeprowadzana specjalnie, ponieważ tak małe ilości tych tlenków prowadzą do dużego wpływu na środowisko problemy.
Po tym wszystkim, co zostało powiedziane, post jest odżywczy: czy potrzebujemy teraz kwasu?
Stagnacja kwasu
Nauczyciel.Do fermentacji używany jest kwas azotowy vicorist: azotan dobriv, aw pierwszym wierszu amino-azotan (jak to zdobyć?); przemówienia wibuchowa (dlaczego?); barwnikow; nitrativ, o yakі timetsya na nadchodzącej lekcji.
Dołączony do materiału
Doświadczenie klasy frontalnej
– Dlaczego szybkość utleniania azotu w kwasie azotowym wynosi +5, a wartościowość chotiri?
- Z jakimi metalami kwas azotowy nie wchodzi w reakcję?
- Musisz znać kwas solny i kwas azotowy, na stole są trzy metale - miedź, aluminium i złoto. Jak obwiniasz i dlaczego?
Test
opcja 1
1. Jaki szereg liczb pokazuje różnicę między elektronami dla energii równej w atomach azotu?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Zakończ wyrównywanie reakcji praktycznych:
1) HNO 3 (rozb.) + Cu…;
2) Zn + HNO 3 (stęż.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3 ... .
3. Powiedz mi, jak zilustrować jeden z etapów procesu produkcja przemysłowa kwas azotowy.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Ujemny stan utlenienia objawia się azotem w:
1) N2O; 2) NIE; 3) NO2; 4) Na 3 N.
5. Interakcje wiórów miedzianych ze stężonym kwasem azotowym do produkcji aż do schłodzenia:
1) NO2; 2) NIE; 3) nr 2; 4) NH3.
Opcja 2
1. Wartość najwyższej wartościowości dla azotu wynosi jeden:
1) 1; 2) 2; 3) 5; 4) 4.
2. Możesz zapisać połączenie stężonego kwasu azotowego z metalami obraźliwymi: sód, glin, cynk, żelazo, chrom.
3. Wybierz mowę, taką jak syrovina do ekstrakcji kwasu azotowego:
1) azot i woda;
2) amoniak, powtórzona woda;
3) wydać.
4. Stężony kwas azotowy nie reaguje z:
1) dwutlenek węgla;
2) kwas solny;
3) węgiel;
4) wodorotlenek baru.
5. Dzięki interakcji rozcieńczonego kwasu z magnezem ustalono:
1) NO2; 2) NIE; 3) N2O; 4) NH4NO3.
Vіdpovіdі na testach Opcja 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opcja 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Gramofon Tririvny Zalik klasa 11
Temat: „ NEMETAL"
Forma lekcji: hol
Tsіl: powtórka zdobytej wiedzy uczniów na temat: „Niemetale”; uczyć się o duża moc niemetal to їх spoluk; dalsze kształtowanie umiejętności stosuvannya wiedzy w sytuacjach niestandardowych i życiowych, w zwycięstwach w zadaniach indywidualnych i różnicujących.
menedżer:
1. Zweryfikuj wiedzę i utrwal wiedzę naukowców na temat nierzucających tej połowy; logicznie akceptuj rozwój myśli umysłowej i wolność chemicznej kopalni; przejście od formalno-logicznego przejmowania materiału przez tych do pomysłu w przenośni logicznego za pomocą różnych, wykonalnych i niestandardowych zadań.
2. Rozwijanie nawyków ostrożności, manifestowanie przebaczeń, pielęgnowanie dnia, vminnya, oglądanie sprośności, usprawiedliwianie przekręconych faktów, logiczne wyrażanie myśli i robiti visnówki; przeczytaj rozіrkovuvati, robiti zawiedzione, przewiduj.
3. Przyjąć kształtowanie głównych idei widzenia światła poprzez działalność edukacyjną i kreatywność samodzielności uczniów.
4. Vikhovuvati vminnya pratsyuvati niezależnie od zastosuvannyam self, czyli wzajemnej kontroli. Pokaż zv'yazok przez tych, którzy żyją na całe życie. Vihovuvati naukowy svetoglyad na podstawie autorytetu i życia vzaimozv'yazku.
Posiadanie tego reaktywnego: probówki, lampy alkoholowe, probówki, syrniki i inne typy: ; ;
; ;
;
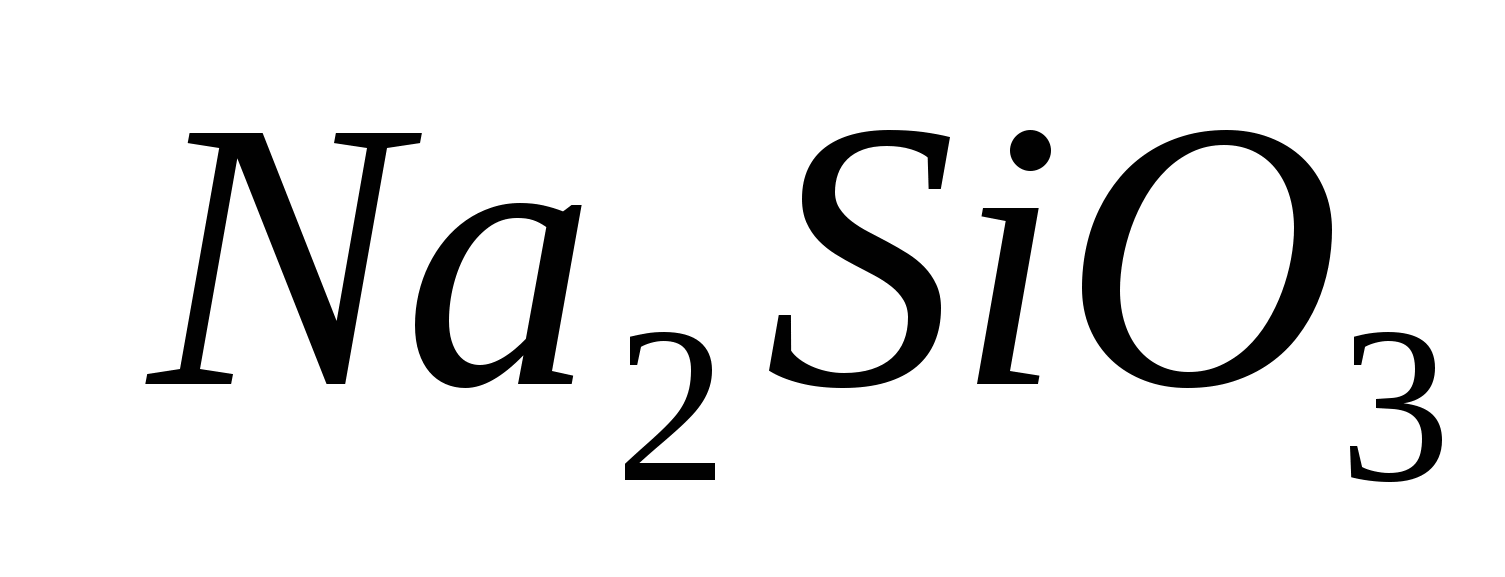 .
.
Przygotowanie do sali.
Nauczyciel przygotowuje zadanie trzech równych fałd ofensywnych gatunków: test, odżywianie teoretyczne, yakіsnі i rozrahunkovі zavdannya, zavdannya do transformacji przemówień.
Nauczyciel przygotowuje uczniów do powtórki zadania.
Od 1 do 2 dnia miesiąca w biurze do drzwi wywieszana jest karta informacyjna.
Arkusz trasy jest widoczny dla skóry. Czerń pracy na scenach pokazana jest na kartach tras.
ARKUSZ TRASY.
F.I. uczenie się
Nazywanie sceny
Liczba etapów
numer zamówienia
Podpis recenzenta
Problem Rosrakhuna
Uznanie
Reinkarnacja
Ukryj lekcję.
Naucz się wchodzić na zajęcia z arkuszami tras, 5 czystymi kartkami, z długopisem i iść na scenę, oznaczeniami do nr 1. Naucz się okradać zadanie na równe składanie i ręczyć za nową literę chi nas, na etapie „ rozpoznawanie przemówień” zdać eksperyment.
Na etapie skóry dodaje się 7 - 8 piór, ponownie sprawdza, umieszcza w arkuszu trasy, nie.
Wynik jest ustalany jako średnia arytmetyczna wszystkich etapów.
DODATEK
„Rozpoznawanie przemówień”
1 rive
1. Przynieś obecność jonów 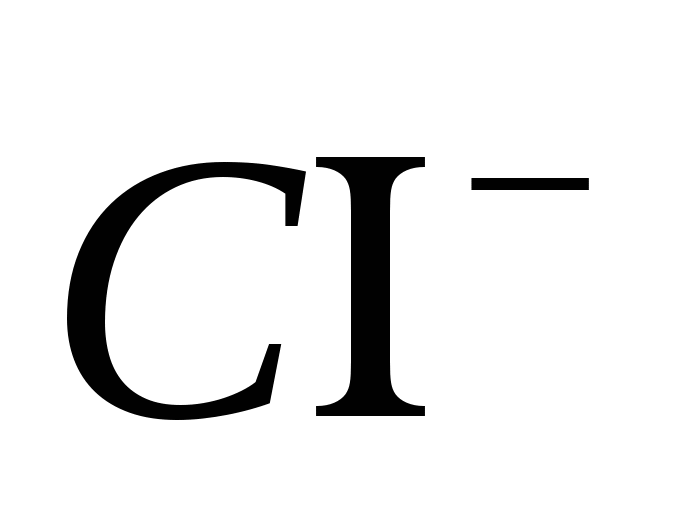
2. Przynieś obecność jonów 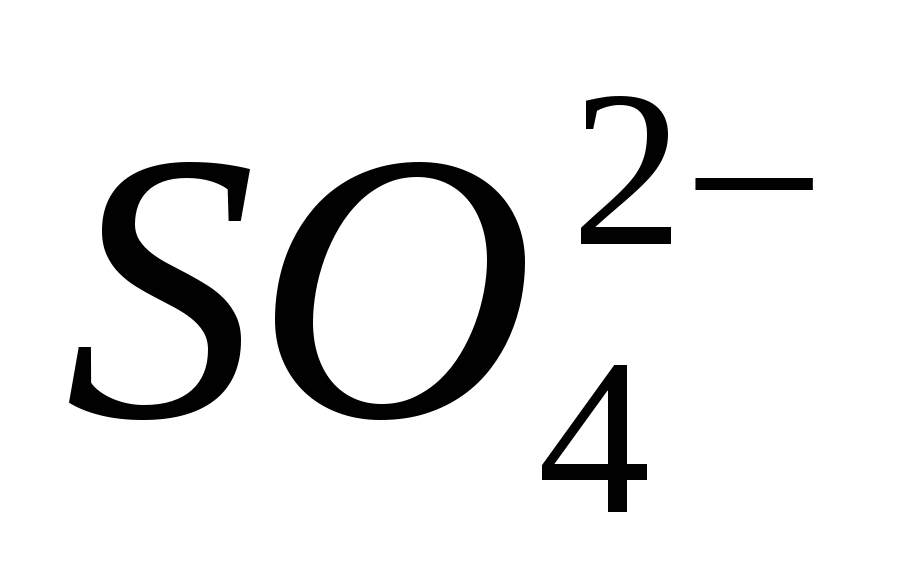
3. Przynieś obecność jonów 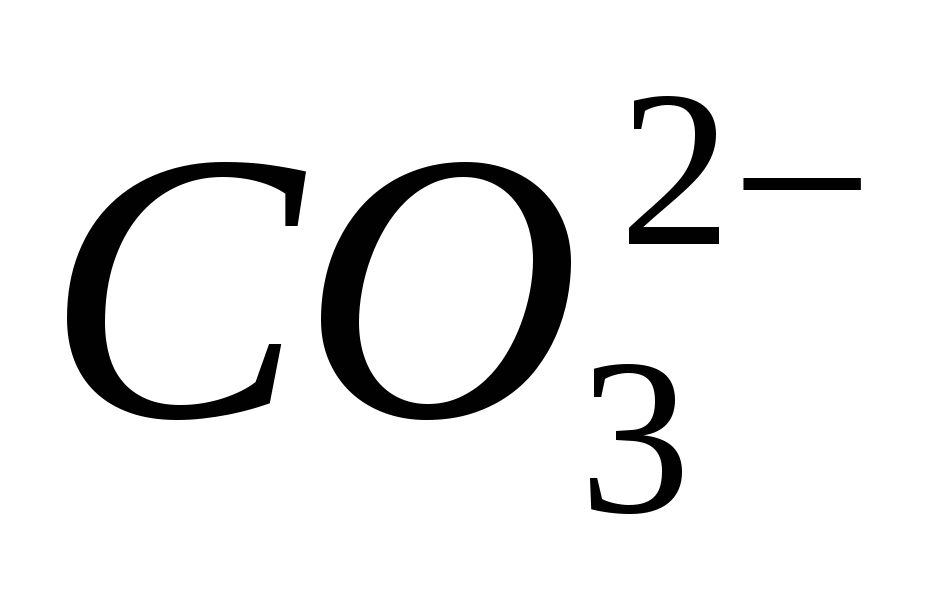
4. Przynieś obecność jonów 
5. Przynieś obecność jonów 
2 riveny
1. Rozpoznaj różnicę za pomocą jednego odczynnika:
2. Rozpoznaj różnicę za pomocą jednego odczynnika:
3. Rozpoznaj różnicę za pomocą jednego odczynnika:
4. Rozpoznaj różnicę za pomocą jednego odczynnika:  ;
;
5. Rozpoznaj różnicę za pomocą jednego odczynnika:
3 rywy
1. Rozpoznawanie bez dodatkowych odczynników:
2. Rozpoznawanie bez dodatkowych odczynników:
3. Rozpoznawanie bez dodatkowych odczynników:
4. Rozpoznawanie bez dodatkowych odczynników:
5. Rozpoznawanie bez dodatkowych odczynników:
Etap „Konwersja przemówień”
1 rive
1. Zatrzymaj reakcję
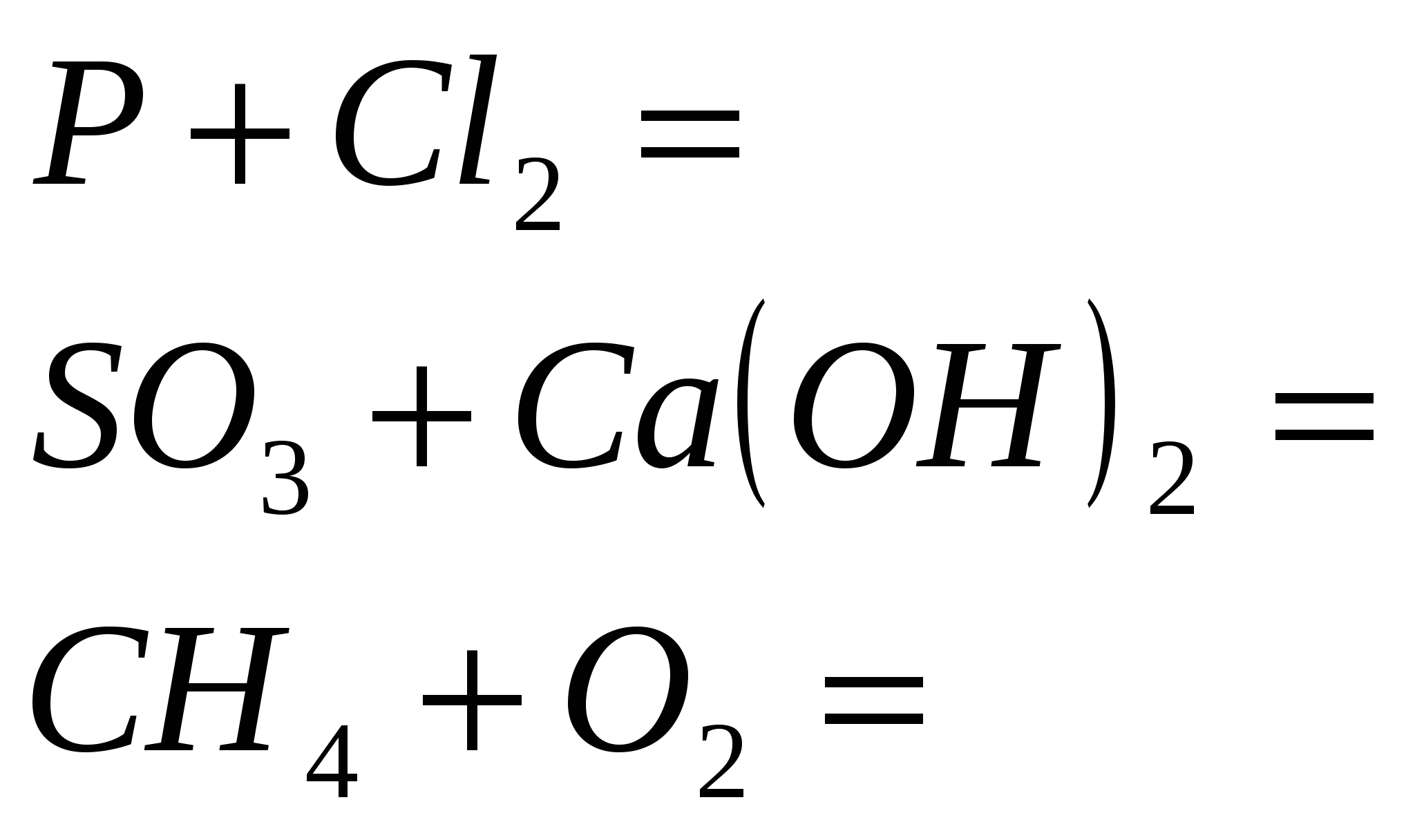
2. Zakończ reakcję
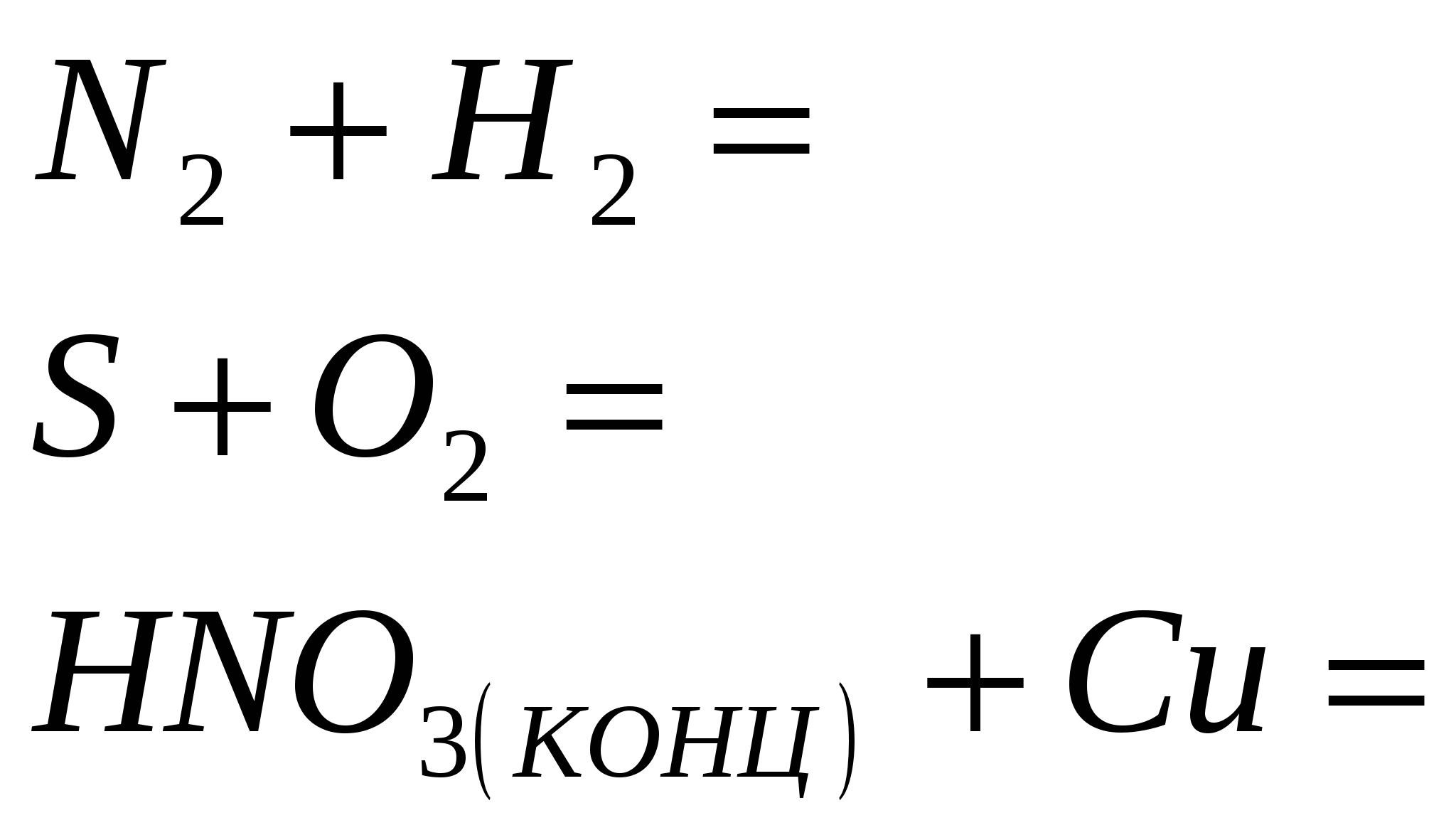
3. Zakończ reakcję
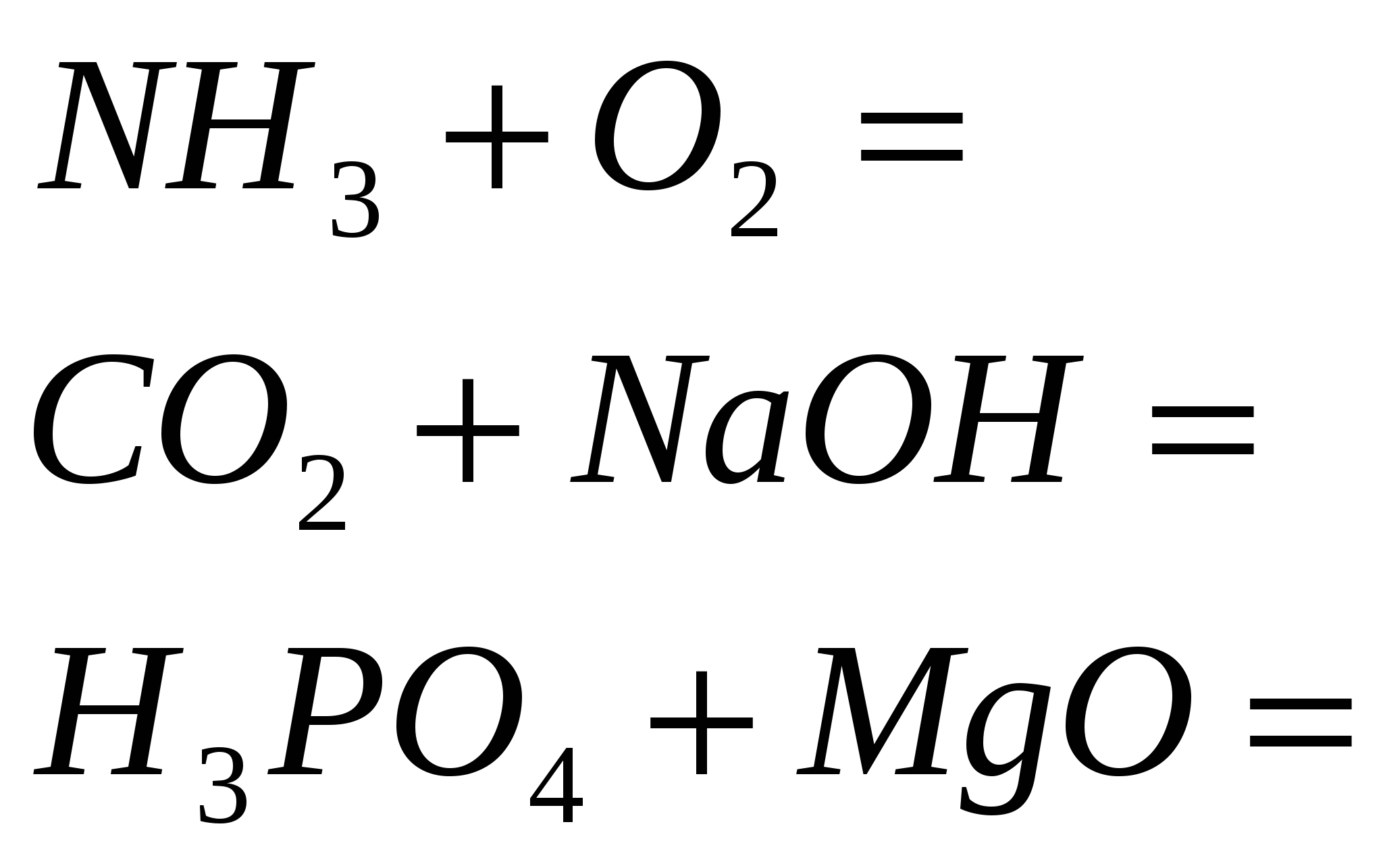
4. Zakończ reakcję
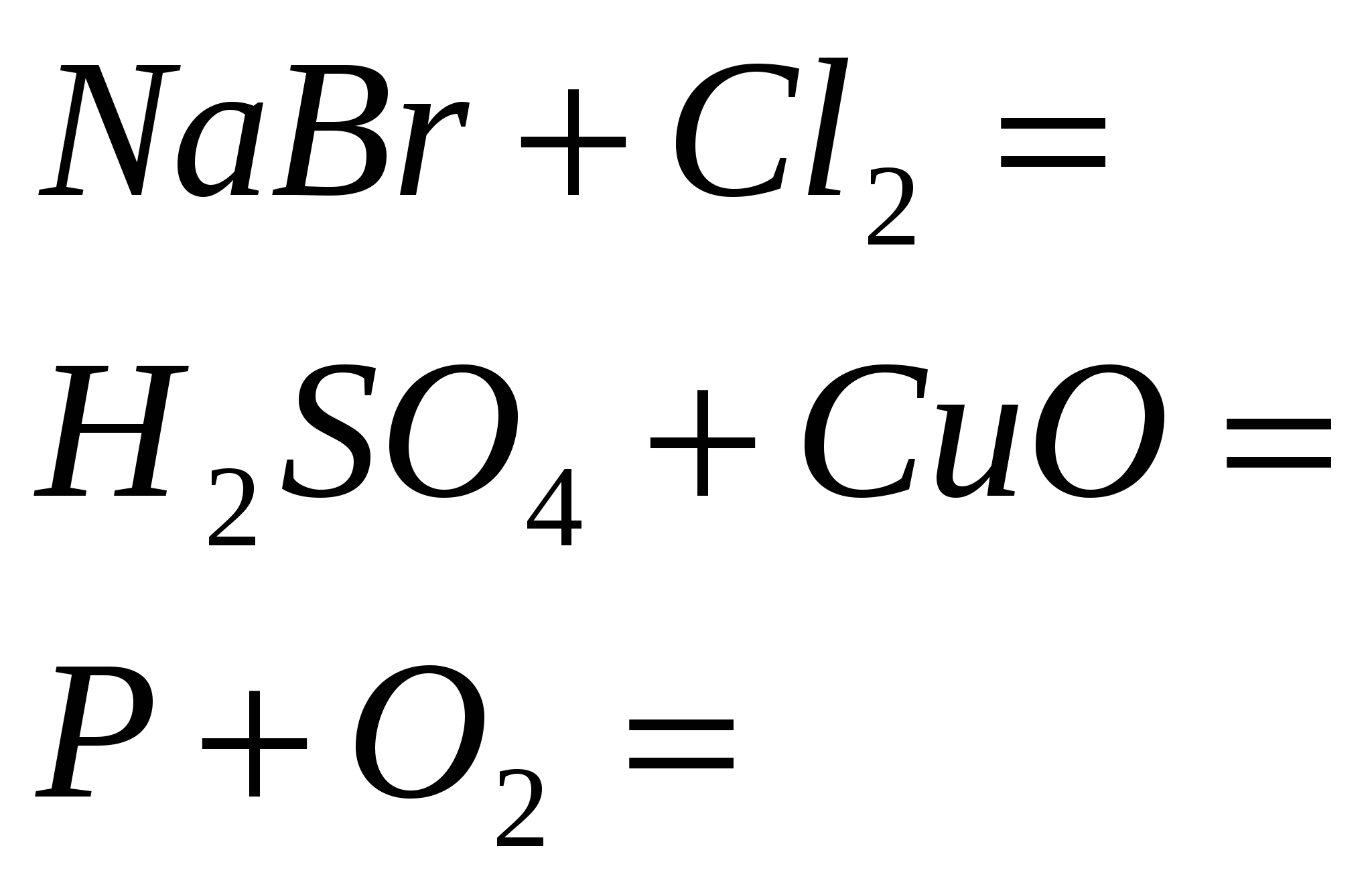
5. Zakończ reakcję
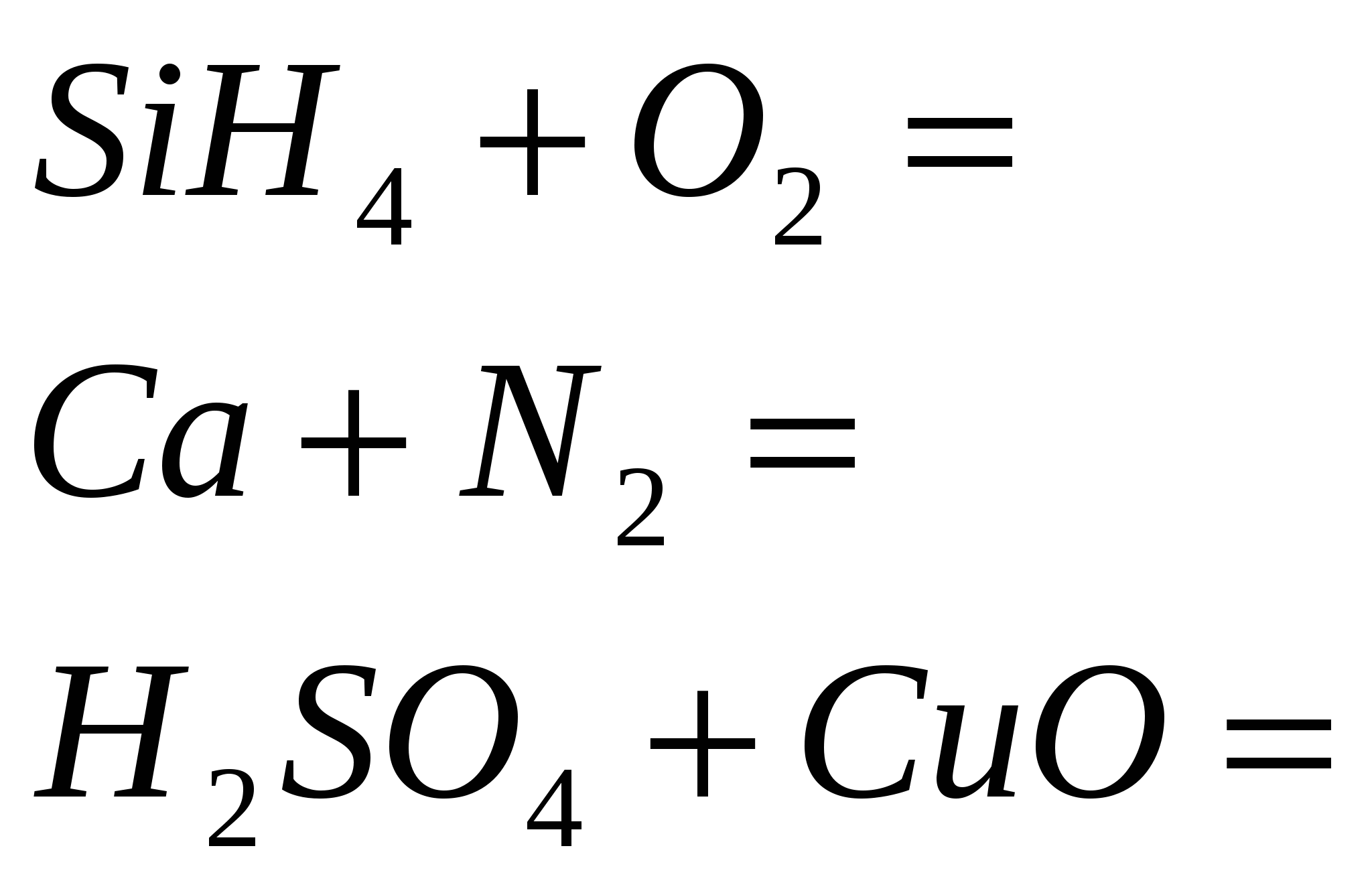
2 riveny
Utwórz transformację:
3złamany
Utwórz transformację:
3.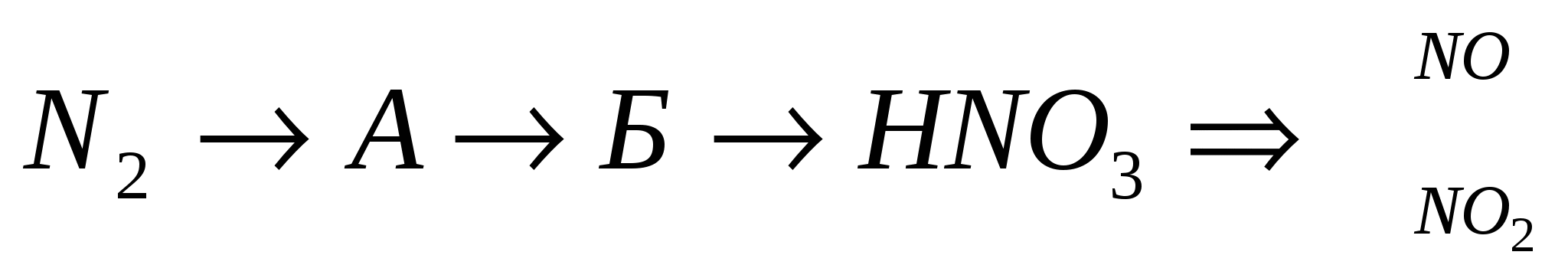
Etap „Test”
opcja 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 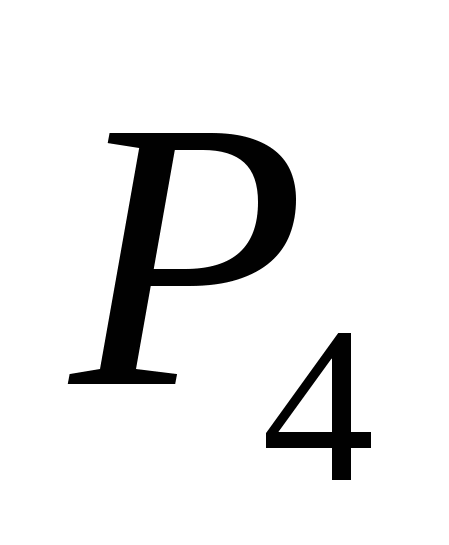 , b) C , c)
, b) C , c) 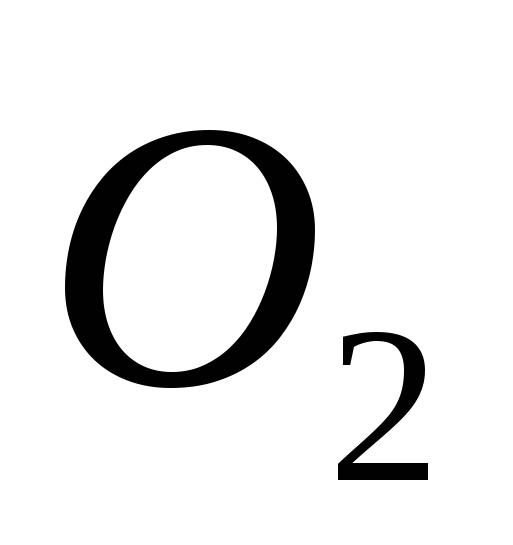 , G)
, G) 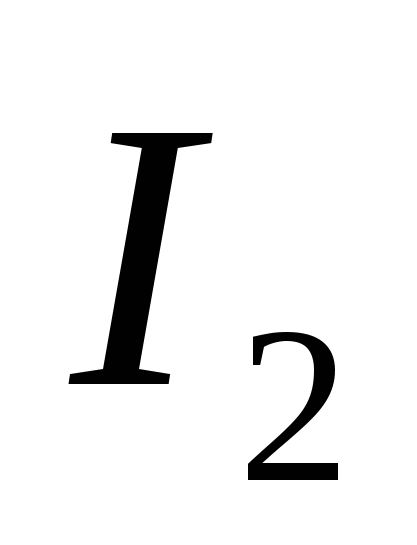 mi)
mi) 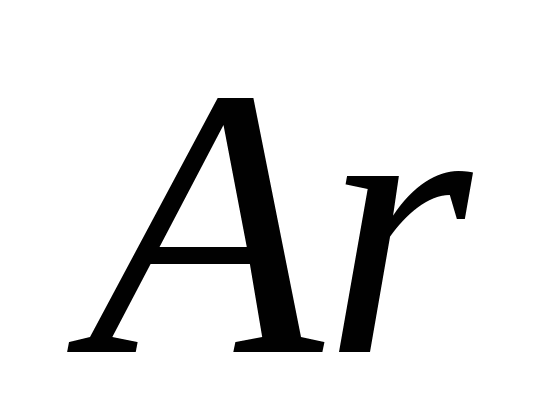 .
.
a)  , b)
, b)  , v)
, v)  , G)
, G)  mi)
mi)  .
.
4. Formuła elektroniczna pierwiastka. Yogo latający vodnev spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Siła kwasów halogenowodorowych rośnie z rzędu:
a) ![]()
b) 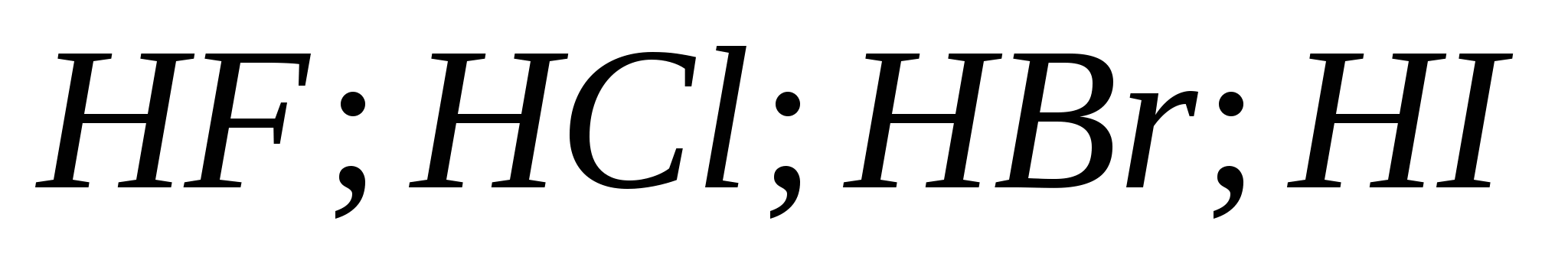
v) 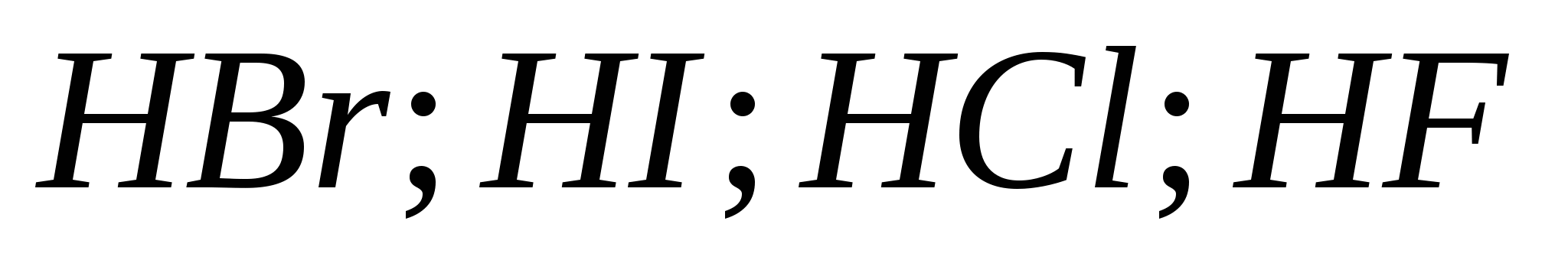
G) 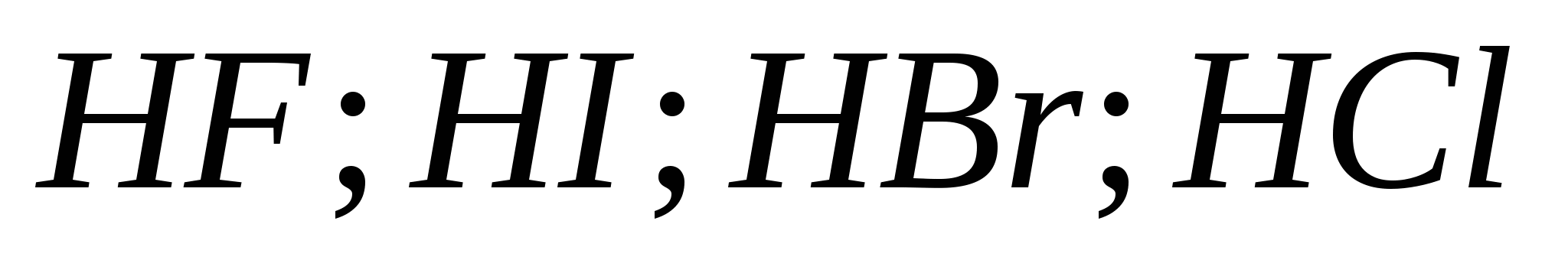
6. Z halogenów zablokowano mowę u walczących dzieci:
a) fluor; b) chlor; c) jod; d) brom.
7. Rozbity kwas siarkowy wykazuje moc utleniania dla stosunku atomów:
a)  , b)
, b)  , v)
, v)  .
.
8. Tlenek azotu V można łączyć:
a)  , b)
, b)  , v)
, v)  , G)
, G) 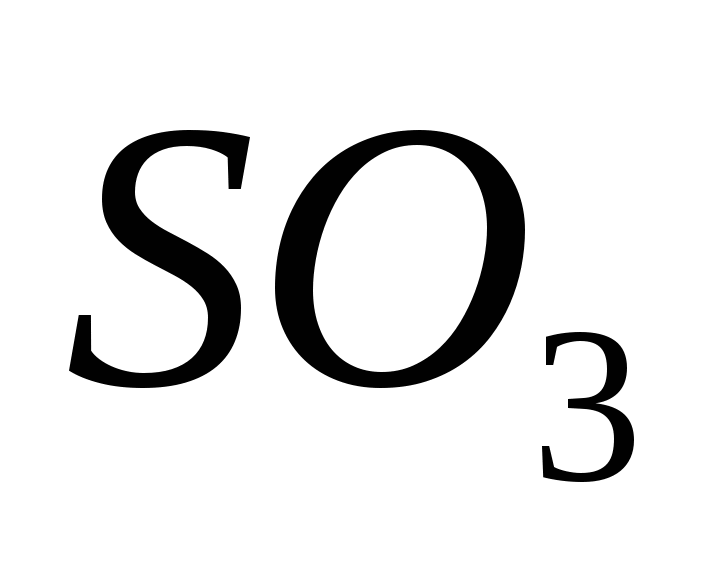 mi)
mi)  .
.
9. Reakcja: sprowadź taką moc do amoniaku:
a) utleniające, b) zbędne, c) kwaśne, d) zasadowe.
10. Siła kwasów z rzędu
a) zmiana, b) wzrost, c) stopniowy wzrost, a następnie zmiana; d) wolno opadać, potem rosnąć, e) nie zmieniać.
Opcja 2
Atomic crystal grati mum proste przemówienia, zatwierdzone:
a)  , b)
, b)  , v)
, v) 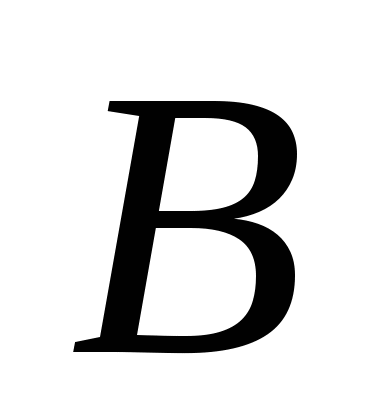 , G)
, G) 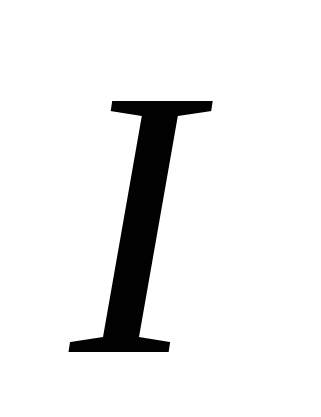 mi)
mi)  .
.
2. Gazy do normalnych odpływów є:
a)  , b)
, b) 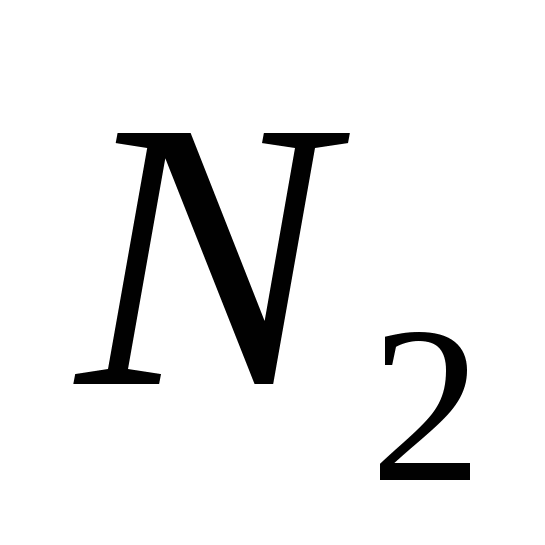 , v)
, v) 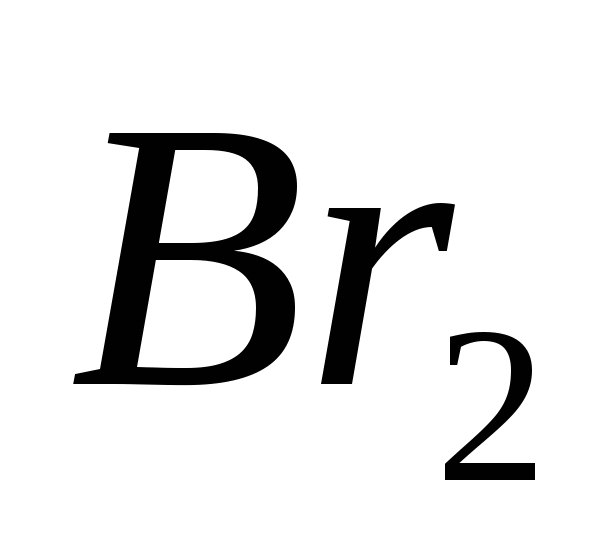 , G)
, G)  mi)
mi)  .
.
3. Modyfikacje alotropowe składają się na następujące elementy:
a) 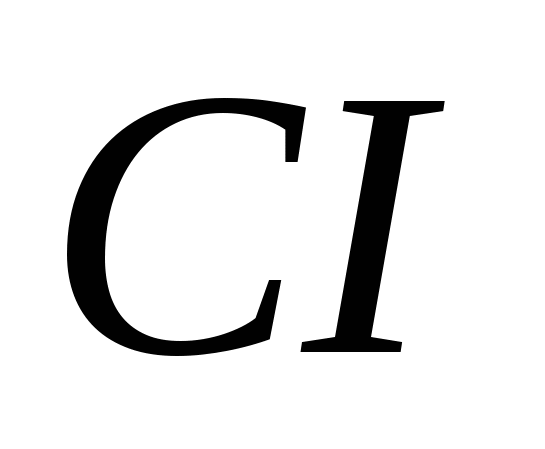 , b)
, b) 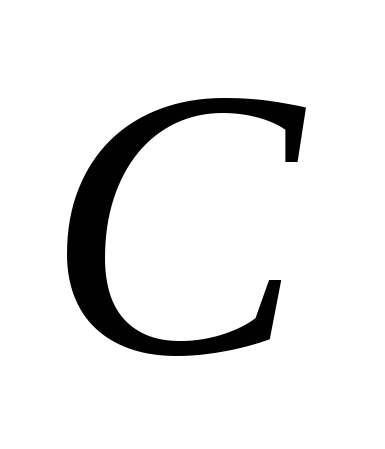 , v)
, v) 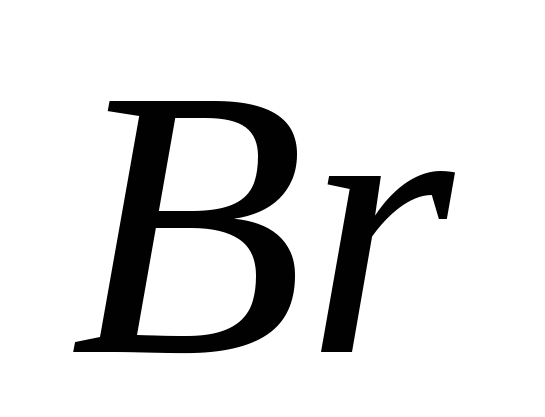 , G)
, G)  mi)
mi)  ,
,
4. Formuła elektroniczna pierwiastka. Yogo latający vodnev spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  mi)
mi)  .
.
5. Główna siła wód letnich zmienia się w serii:
a) 
b) 
v) 
G) 
6. Do zalewania chlorem można stosować różne stężenia:
a)  , b)
, b) 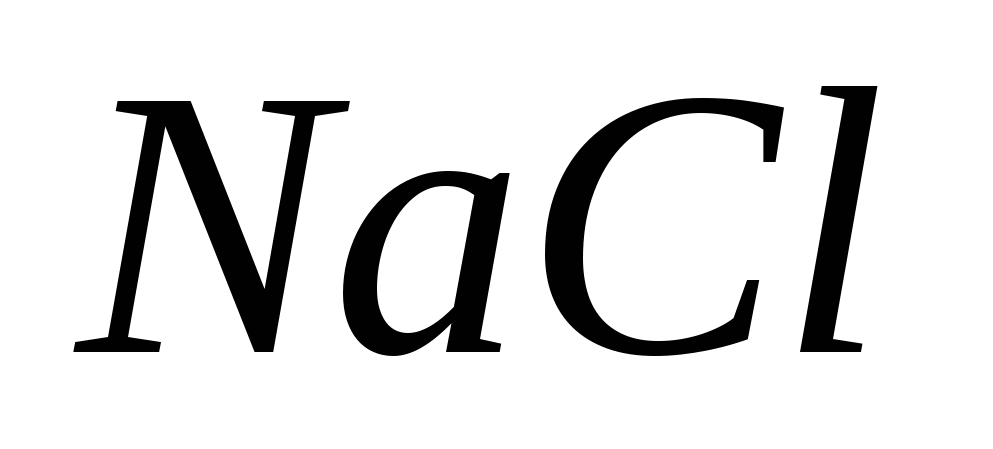 , v)
, v)  , G)
, G)  .
.
7. Stężony kwas siarkowy wykazuje moc utleniania dla zakresu atomów:
a)  , b)
, b)  , v)
, v)  .
.
UWAGA: 9-10 poprawnych odpowiedzi - „5”; 7-8-"4"; 5-6-"3"; mniej niż 5-2
Etap „Teoria”
Zerwałem (na „3”)
Napisz poziom reakcji charakteryzujących moc rozcieńczonego kwasu siarkowego.
Napisz szybkość reakcji charakteryzującą moc tlenku siarki (VI).
Napisz równanie reakcji charakteryzujących moc kwasu solnego.
Napisz równanie reakcji charakteryzujących moc tlenku fosforu (V).
Napisz równe reakcje, które charakteryzują moc amoniaku.
II zerwany (na „4”)
Zapisz wzory wód letnich niemetali w okresie II. Wyjaśnij, jak i dlaczego zmieniają się te kwasowe właściwości.
Zapisz wzory najwyższych tlenków niemetali w III okresie. Wyjaśnij, jak i dlaczego zmieniają się te kwasowe właściwości.
Zapisz wzory najważniejszych kwasów pierwiastków w III okresie. Wyjaśnij, jak i dlaczego zmieniają się te kwasowe właściwości.
Zapisz wzory wód lotnych niemetali VI podgrupy. Wyjaśnij, jak i dlaczego zmieniają się te kwasowe właściwości.
Napisz wzory najważniejszych kwasów pierwiastków podgrupy VA. Wyjaśnij, jak i dlaczego zmieniają się te kwasowe właściwości.
III rive (na „5”)
Zrównoważ utleniającą i kwasową moc kwasu siarkowego i azotowego. Vidpovid potwierdza z równymi reakcjami.
Zrównoważ utleniającą i kwasową moc tlenku siarki (IV) i tlenku węgla (IV). Vidpovid potwierdza z równymi reakcjami.
Zrównoważ utleniającą i kwasową moc wody i fluorowodorku. Vidpovid potwierdza z równymi reakcjami.
Zrównoważ utleniającą i kwasową moc stężonego i rozcieńczonego kwasu azotowego. Vidpovid potwierdza z równymi reakcjami.
Wyrównaj moc utleniającą i kwasową tlenku węgla (II) i tlenku węgla (IV). Vidpovid potwierdza z równymi reakcjami.
Etap „Zadanie Rozrahuna”
Zerwałem (na „3”)
II zerwany (na „4”)
Podczas interakcji z 37 g wodorotlenku wapnia z siarczanem amonu usunięto 15 g amoniaku. Oblicz ułamek masowy wydzielanego amoniaku.
Gdy spalyuvanni w kwaśnym 62 g fosforu, pobrano 130 g tlenku fosforu (V). Oblicz ułamek masowy wyjściowego tlenku fosforu (V).
Ile gramów 10% wodorotlenku sodu potrzeba do zneutralizowania 8,96 litra wody chlorowej?
Kilka litrów dwutlenku węgla można zużyć do przechowywania 10 kg waporyzatora, który pokryje 20% domów.
Ile gramów oblężenia przypada na przepuszczenie 11,2 litra dwutlenku węgla przez 900 g 10% wodorotlenku baru?
III rive (na „5”)
Jaka objętość 80% kwasu azotowego (pl. 1,46 g/ml) jest potrzebna do „dystrybucji” 32 g midi?
Ile masy midi będzie potrzebne, aby reakcja ze zbyt stężonym kwasem azotowym pochłonęła 4 litry (NO) tlenku azotu (IV), tak aby udział objętościowy wyniku jogi wyniósł 96%?
Przy „zmiennym” stężeniu kwasu siarkowego w 20 g stopu złota zaobserwowano 4,2 l (n.o.) tlenku siarki (IV). Określ ułamek masowy w % midi dla tego stopu.
Gazy sumaryczne chloru i wody o objętości 1 litra przepuszczano przez dystrybucję jodku potasu. Widziałem 5,08 r jodu. Określ ułamek objętościowy (%) chloru gazowego w sumie spalin.
Sumish krzem i vugillya o masie 10 g poddano obróbce nadmiernie stężonym roztworem wodorotlenku sodu. Po reakcji zaobserwowano 5,6 litra wody (n.s.). Wyznacz udział masowy krzemu (%) dla tej sumy.
