Przy łączeniu 28 g krzemu z tlenem. Krzemowe związki tlenowe
Charakterystyka ogólna: główna odmienność w stosunku do węgla: brak wiązań p w związkach, silikidy, związki z wodorem (silany), utlenianie i hydroliza, tetrafluorek i tetrachlorek krzemu, hydroliza, heksafluorokrzemiany, związki tlenowe, tlenek krzemu (IV), żel krzemionkowy, Kremnev Kwasy krzemowe, rozpuszczalność i hydroliza Naturalne krzemiany i glinokrzemiany, zeolity, związki krzemoorganiczne, silikony i siloksany, zastosowanie związków krzemu w medycynie.
Krzem (ł. krzem), Si, pierwiastek chemiczny z grupy IV układu okresowego; liczba atomowa 14, masa atomowa 28.086. Krzem wykazuje również hybrydyzację sp3 elektronów
orbitale. Na zewnętrznej warstwie elektronowej atomu krzemu znajdują się wartościowości 3d-
orbitale (Si: 3s23p23d0),
Krzem po tlenie jest najczęstszym pierwiastkiem w skórze. W przeciwieństwie do węgla w stanie wolnym, krzem nie występuje w przyrodzie. Jego najczęstsze związki to tlenek krzemu (IV) SiO2 i sole kwasu krzemowego, krzemiany. Tworzą skorupę skorupy ziemskiej. Związki krzemu znajdują się w roślinach i zwierzętach. Ze względu na właściwości chemiczne, krzem, podobnie jak węgiel, jest niemetaliczny, ale jego niemetaliczność jest mniej wyraźna, ponieważ ma większy promień atomowy
Krzem. tworzy związki z prawie wszystkimi metalami - z środki przeczyszczające (nie znaleziono związków tylko z Bi, Tl, Pb, Hg). Uzyskano ponad 250 krzemków, których skład (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si itd.) Zwykle nie odpowiada klasycznej wartościowości. Krzemiany różnią się ogniotrwałością i twardością; żelazokrzemu (środek redukujący w wytopie specjalnych stopów, patrz żelazostopy) i krzemek molibdenu MoSi2 (grzejniki pieców elektrycznych, łopatek turbiny gazowej, itp.) mają największe znaczenie praktyczne.
Silane Pod działaniem kwasu solnego na krzemki najprostszym związkiem wodoru z krzemu jest silan SiH4:
Silan jest trującym gazem o nieprzyjemnym zapachu, który zapala się spontanicznie. powietrze
Są reaktywne i są silnymi środkami redukującymi.
reagować z wodą w temperaturze pokojowej:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluorek Krzem jest wytwarzany przez fluorowanie ditlenku krzemu za pomocą pierwiastkowego fluoru.
Proces fluorowania prowadzony jest w dwóch etapach w reaktorze płomieniowym, kierując nadmiar pierwiastkowego fluoru z etapu pierwszego do etapu drugiego.
Wynik techniczny to produkcja krzemu w trybie ciągłym z wysoką wydajnością i jakością produktu.
Tetrafluorek krzemu SiF4 powstaje w wyniku oddziaływania kwasu fluorowodorowego (fluorowodorowego) na szkło:
Na2SiO3 + 6HF® 2NaF + SiF4 + 3H2O
Krzemowe związki tlenowe
Najważniejszym związkiem tlenowym krzemu jest dwutlenek krzemu SiO2 (krzemionka), który ma kilka krystalicznych modyfikacji.
Modyfikacja niskotemperaturowa (do 1143 K) nosi nazwę kwarcu. Kwarc ma właściwości piezoelektryczne. Naturalne odmiany kwarcu: kryształ górski, topaz, ametyst. Odmianami krzemionki są chalcedon, opal, agat,. jaspis, piasek.
Krzemionka jest chemicznie odporna; wpływają tylko na fluor, kwas fluorowodorowy i roztwory alkaliczne. Łatwo przechodzi w stan szklisty (szkło kwarcowe). Szkło kwarcowe jest kruche, bardzo odporne chemicznie i termicznie. Odpowiedni kwas krzemowy SiO2 nie ma określonego składu. Zazwyczaj kwas krzemowy rejestruje się jako xH2O-ySiO2. Uzyskane krzemionki: H2SiO3 (H2O-SiO2) - metakrzemowy (tri-oksokremnievaya) H4Si04 (2H20-Si02) - ortokrzemowego (tetra-oksokremnievaya) H2Si2O5 (H2O * SiO 2) - dimetakremnievaya.
Kwasy krzemowe są słabo rozpuszczalnymi substancjami. Zgodnie z mniej metaloidową naturą krzemu w porównaniu z węglem, H2SiO3 jako elektrolit jest słabszy niż H2CO3.
Odpowiednio do soli kwasów krzemowych - krzemiany w wodzie są nierozpuszczalne (z wyjątkiem krzemianów metali alkalicznych). Rozpuszczalne krzemiany są hydrolizowane według równania
2SiO3 - + H20 = Si2O52- + 20H-.
Stężone roztwory rozpuszczalnych krzemianów nazywa się płynnym szkłem. Zwykle krzemian szkła sodowego i wapniowego ma skład Na20-CaO-6Si02. Otrzymuje się go w reakcji
Znana jest szeroka gama krzemianów (dokładniej, oksokrzemianów). Pewna regularność jest obserwowana w strukturze oksokrzemianów: wszystkie składają się z czworościanów Si04, które są połączone ze sobą poprzez atom tlenu. Najczęstsze kombinacje czworościany (Si2O76-), (Si3O9) 6- (Si40l2) 8- (Si6O1812-), który jako jednostki strukturalne mogą być połączone w łańcuchy, taśmy, siatki rusztowania (Fig 4).
Najważniejszymi naturalnymi krzemianami są na przykład talk (3MgO * H20-4Si02) i azbest (SmgO * H2O * SiO2). Podobnie jak w przypadku SiO2, szklisty stan (amorficzny) jest charakterystyczny dla krzemianów. Przy kontrolowanej krystalizacji szkła możliwe jest uzyskanie stanu krystalicznego (sitalls). Sitalls charakteryzują się zwiększoną siłą.
Oprócz krzemianów glinokrzemiany są szeroko rozpowszechnione w przyrodzie. Glinokrzemiany - oksykrzemiany szkieletu, w których część atomów krzemu zastępuje trójwartościowy Al; np. Na12 [(Si, Al) 04] 12.
W przypadku kwasu krzemowego stan koloidalny jest charakterystyczny, gdy sole kwasu H2SiO3 nie ulegają natychmiastowemu wpływowi. Koloidalne roztwory kwasu krzemowego (solów) w określonych warunkach (na przykład po ogrzaniu) można przekształcić w przezroczysty, jednorodny żel podobny do żelu, kwasu krzemowego. Żele są wysokocząsteczkowymi związkami o przestrzennej, bardzo luźnej strukturze utworzonej przez cząsteczki SiO2, których puste przestrzenie są wypełnione cząsteczkami H2O. Podczas odwadniania żelu krzemionkowego otrzymuje się żel krzemionkowy - porowaty produkt o wysokiej zdolności adsorpcji.
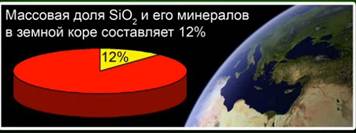
Tlenek krzemu (IV) (krzemionka) - najczęstszy związek w skorupie ziemskiej, stanowiący 12% jego masy w postaci różnych minerałów. Rozróżnić krystaliczną i amorficzną krzemionkę. Najprostszą formułą dla tlenku krzemu (IV) jest SiO2. Krystalizuje w sieci atomowej.
1) Krzemionka krystaliczna - w postaci minerału kwarcowego i jego odmian (kryształ górski, chalcedon, agat, jaspis, krzemień); Kwarc stanowi podstawę piasków kwarcowych szeroko stosowanych w budownictwie i przemyśle krzemianowym.
2) Amorficzna krzemionka - w postaci opalowej kompozycji mineralnej SiO2 nH2O; ziemiste postacie amorficznej krzemionki to ziemia okrzemkowa, Trypolis (ziemia infuzoryczna); Przykładem sztucznej bezpostaciowej bezwodnej krzemionki jest żel krzemionkowy, który otrzymuje się z metakrzemianu sodu:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Żel krzemionkowy ma rozwiniętą powierzchnię, dzięki czemu dobrze wchłania wilgoć.
Żel krzemionkowy jest wysuszonym żelem utworzonym z przesyconych roztworów kwasu krzemowego (nSiO2 · mH2O) przy pH\u003e 5-6. Stały hydrofilowy sorbent.
Pierwsze
Otrzymuje się go przez zakwaszenie roztworów krzemianów metali alkalicznych, a następnie przemycie i wysuszenie utworzonego żelu:
Kwas krzemowy. SiO2 jest bezwodnikiem szeregu kwasów krzemowych
Kwas krzemowy zbudowany jest z czworościennych jednostek strukturalnych (w każdej takiej jednostce atom krzemu znajduje się w centrum czworościanu, a atomy tlenu znajdują się na szczycie). Strukturalne ogniwa, łącząc się w łańcuchy, tworzą bardziej stabilne kwasy polikrzemowe:
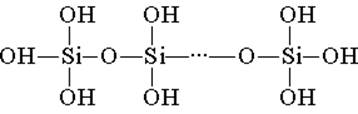
Skład takiego związku można wyrazić wzorem (H2SiO3) n. Jednak kwas krzemowy jest zwykle reprezentowany wzorem H2SiO3. H2SiO3 - kwas jest bardzo słaby, mało rozpuszczalny w wodzie. Po podgrzaniu łatwo rozkłada się w taki sam sposób, jak kwas węglowy:
Wszystkie kwasy krzemowe są bardzo słabe (słabsze niż węgiel).
Krzemiany. Sole wszystkich kwasów krzemowych nazywane są krzemianami, chociaż z reguły w literaturze edukacyjnej krzemiany oznaczają sole kwasu metakrystalicznego. Ich skład zwykle reprezentowany jest wzorem w postaci związków tlenków pierwiastków. Na przykład, krzemian wapnia CaSiO3 można wyrazić jako: CaO x SiO2.
Krzemiany o składzie R2O x nSiO2, w którym R2 oznacza tlenki sodu lub potasu, nazywane są szkłem rozpuszczalnym, a ich stężone roztwory wodne nazywane są ciekłym szkłem. Najważniejsze jest szkło rozpuszczalne w wodzie.
Stojąc w powietrzu, roztwory krzemianów stają się mętne, ponieważ dwutlenek węgla (IV) w powietrzu wypiera kwas krzemowy z jego soli:
Kwas krzemowy jest praktycznie nierozpuszczalny w wodzie - ta właściwość używana jest jako jakościowa reakcja na jon SiO32-.
Krzemiany otrzymuje się przez stopienie krzemionki z alkaliami lub węglanami:
Rozpuszczalność kwasu krzemowego a szybkość jego rozpuszczania zależy od kilku czynników, z których najważniejsza to modyfikacja pobranego dwutlenku krzemu, jego stopień dyspersji i temperatura. Podczas wytrząsania żelu krzemionkowego z wodą, równowaga rozpuszczalności ustalana jest w ciągu kilku godzin, w przypadku kwarcu potrzeba wielu miesięcy, a nawet lat.
SILIKATY NATURALNE (z łacińskiego, silex, rodzaj przypadku krzemionki - krzemień * a. naturalne krzemiany, N. naturliche Silikat, F. silicates naturels, i. silicatos naturales) - klasa minerałów, soli kwasów krzemowych, izo- i heteropolikrystalicznych. Udział naturalnych krzemianów stanowi do 75% masy skorupy ziemskiej i około 25% gatunków mineralnych. W naturze znanych jest ponad 700 naturalnych krzemianów, w tym najważniejsze minerały skałotwórcze (skalenie, piroksety, amfibole, miki itp.)
Glinokrzemiany - grupa naturalnych i syntetycznych krzemianów, których złożone aniony zawierają krzem i aluminium. Przykłady złożonych anionów: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, a czasami Ba2 + i Li + działają jak kationy.
Naturalne glinokrzemiany są najczęściej występującymi minerałami, które stanowią do 50% masy skorupy ziemskiej. Należą do nich skalenie (albit, ortoklaza, anort), minerały ilaste i mika.
Zeolity - Są to wodne glinokrzemiany wapnia, sodu, potasu, baru i niektórych innych pierwiastków. Grupa zeolitów obejmuje ponad 40 minerałów, które różnią się składem (szczególnie w liczbie cząsteczek wody w krystalicznym wodzianem) oraz oczywiście właściwościami fizycznymi i chemicznymi. Ale prawie wszyscy przedstawiciele tej grupy minerałów mają wspólną cechę - są dobrymi sorbentami, posiadają właściwości wymiany jonowej, są w stanie zmienić mobilność poszczególnych jonów i pracować jako sita molekularne. Stosunkowo niedawno minerały te znalazły zupełnie nieoczekiwane zastosowanie - zaczęto je stosować w rolnictwie.
Związki krzemoorganiczne - związki, w których cząsteczkach występuje wiązanie między atomami krzemu i węgla. Związki krzemoorganiczne są czasami nazywane silikonami, od łacińskiego krzemu "krzem". Związki krzemoorganiczne stosuje się do produkcji smarów, polimerów, gum, kauczuków, płynów silikonowych i emulsji. Związki krzemoorganiczne są stosowane w kosmetykach, chemii gospodarczej, farbach i lakierach, detergentach. Wyróżniającą cechą produktów opartych na związkach krzemoorganicznych z produktów na bazie zwykłych związków organicznych są z zasady wyższe właściwości i właściwości, a także bezpieczeństwo użytkowania przez ludzi. Polimery silikonowe można stosować do wytwarzania form do gotowania. Polimeryzacja związków krzemoorganicznych i uszczelniaczy jest bezpieczna dla ludzi i nie wymaga ekstrakcji.
Siloksany - związki zawierające naprzemienne atomy krzemu i tlenu w cząsteczce. Najwyższe mają siloksany o wysokiej masie cząsteczkowej - poliorganosiloksany; patrz polimery silikonowe.
Silikony (poliorganosiloksany) - natlenione związki krzemoorganiczne o wysokim ciężarze cząsteczkowym o wzorze chemicznym n, w którym R = grupa organiczna (metyl, etyl lub fenyl). Teraz przylegają definicja już bardzo rzadko, oraz w pozycji „Silicones” są połączone w poliorganosiloksanach (na przykład oleje silikonowe, takie jak ICP wodoodpornego typu NGL lub niskiej masie cząsteczkowej, gumy SKTN), a nawet monomerów krzemoorganicznych (różne silany), rozmycie rozróżnienia między terminami „silikon” i " silikon. "
Metaliczny krzem  Crystal Silicon
Crystal Silicon
Krzem (Si). Ten pierwiastek chemiczny stanowi 1/4 składu skorupy ziemskiej. Kwarc, kryształ górski, piasek, glina, granit, mika, azbest - wszystko to związki chemiczne krzemu
Krzem jest elementem pośrednim (amfoterycznym) i może wykazywać zarówno właściwości metaliczne, jak i niemetaliczne. Może tworzyć związki chemiczne, zarówno z metalami, jak i niemetalami.
Czysty krzem - chemicznie prosta substancja w kolorze szarym, twarda, ogniotrwała i krucha. Crystal Silicon Ma metaliczny połysk i jest szeroko stosowany w przemyśle półprzewodnikowym (jest to półprzewodnik).
Krzem może rozciągać się jak w stanie krystalicznym ( krystaliczny krzem), oraz w stanie amorficznym ( amorficzny krzem). Krystaliczny krzem tworzy się przez chłodzenie roztworu amorficznego krzemu w stopionym metalu. Z kolei krzem krystaliczny jest materiałem bardzo kruchym i łatwo kruszy się w bezpostaciowy proszek. Tak więc amorficzny krzem jest fragmentem kryształów krystalicznego krzemu.
W stanie wolnym krzem jest dość trudny do zdobycia. Jego produkcja przemysłowa wiąże się z odzyskiem kwarcu, którego wzór chemiczny to SiO 2, reakcja redukcji jest wytwarzana przez gorący koks (węgiel).
SiO 2 + C → CO 2 + Si
W laboratorium czysty krzem zostaje zredukowany z piasku kwarcowego metalicznym magnezem w następujący sposób:
SiO 2 + 2Mg → Si + 2MgO.
Podczas tej reakcji powstaje brązowy proszek amorficznego krzemu. Po podgrzaniu proszek może powoli reagować ze stężonymi roztworami alkaliów (np. Wodorotlenek sodu NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - powstała złożona substancja - zwana także płynnym szkłem.
Interesujące jest to, że aktywność chemiczna krzemu zależy od wielkości jego kryształów. Krystaliczny krzem jest mniej aktywny chemicznie niż amorficzny. Ten ostatni łatwo reaguje z fluorem nawet w zwykłej temperaturze, a w temperaturze 400 - 600 ° C reaguje z tlenem, chlorem, bromem, siarką, tworząc odpowiednie związki chemiczne. W bardzo wysokich temperaturach krzem reaguje z azotem i węglem, tworząc odpowiednio azotek i węglik krzemu.
Jeśli spróbujesz rozpuścić krzem w mieszaninie fluorowodorowego HF (fluorowodorowego) i azotowego kwasu HNO 3, reakcja nie będzie kontynuowana. Ale jeśli przeprowadzasz reakcję chemiczną z alkaliami, na przykład z wodorotlenkiem potasu, wtedy reakcja nastąpi z utworzeniem soli kwasu krzemowego
Si + KOH → K 2 SiO 3 + H 2
Jeśli wypali się w piecu krzemionkowym (piasek) z koksem, okaże się bardzo trwałą substancją krystaliczną. Karborund SiC
SiO 2 + 3C → SiC + 2CO
Karborund - bardzo twarda i ogniotrwała substancja. W przemyśle jest wytwarzany w dużych ilościach dzięki tym właściwościom. Co ciekawe, sieć krystaliczna karborundu jest podobna do sieci najtwardszej substancji - diamentu, ale w niej poszczególne atomy węgla są równomiernie zastępowane przez atomy krzemu.
W wysokich temperaturach, a także podczas reakcji chemicznych pod działaniem kwasów na związki metalu z krzemem, silan SiH 4.
Silane - jest samozapalającym się bezbarwnym gazem. Może się zapalić na powietrzu tworząc krzemionkę i wodę.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Jeśli tlenek krzemu SiO 2 jest ogrzewany w obecności węgla w strumieniu chloru, zachodzi reakcja chemiczna z tworzeniem się chlorku krzemu
SiO 2 + 2C + 2Cl2 → SiCl 4 + 2CO
Chlorek krzemu - jest to ciecz, której temperatura wrzenia wynosi zaledwie 54 0 C. Chlorek krzemu łatwo rozpuszcza się w wodzie z utworzeniem roztworu dwóch kwasów: krzemowego i chlorowodorowego
SiCl 4 + H2O → H2SiO 3 + HCI
Jeśli ta reakcja chemiczna zachodzi w atmosferze wilgotnego powietrza, podczas tworzenia dwóch kwasów pojawi się gęsty dym.
Fluorek krzemu SiF 4 - powstaje w wyniku reakcji chemicznej kwasu fluorowodorowego i tlenku krzemu
SiO 2 + 4HF → SiF 4 + 2H 2 O
Fluorek krzemu jest bezbarwnym gazem o "silnym" zapachu. Podobnie jak chlorek krzemu, w wodzie gaz ten tworzy dwa kwasy: krzemowy i fluorowodorowy. Ale co ciekawe, fluor krzemu może wchodzić w interakcje z kwasem fluorowodorowym w celu utworzenia kwas heksafluorokrzemowy którego wzór chemiczny to H 2 SiF 6. Jego sole i sam kwas są trujące.
Krzem
Metale nieszlachetne i niemetale
W tej lekcji zapoznasz się z tematem "Krzem". Zastanów się nad krzemem: jego strukturą elektroniczną, gdzie krzem występuje w naturze, zbadaj alotropię krzemu, wyjaśnij jej właściwości fizyczne i chemiczne. Dowiedz się, gdzie krzem jest używany w przemyśle i innych obszarach, jak jest wytwarzany. Poznasz krzemionkę, kwas krzemowy i jego sole - krzemiany.
Temat: Metale nieszlachetne i niemetale
Lekcja: Krzem. Gazy szlachetne
Krzem jest jednym z najczęstszych pierwiastków chemicznych w skorupie ziemskiej. Jego zawartość wynosi prawie 30%. W naturze występuje głównie w postaci różnych form dwutlenku krzemu, krzemianów i glinokrzemianów.
Krzem jest czterowartościowy w prawie wszystkich swoich związkach. W tym przypadku atomy krzemu są w stanie wzbudzonym. Ryc. 1.
Aby wejść w ten stan, jeden z elektronów 3s zajmuje wolne miejsce na orbitalach 3p. W tym przypadku, zamiast 2 niesparowanych elektronów w stanie podstawowym, atom krzemu w stanie wzbudzonym będzie miał 4 niesparowane elektrony. Będzie on zdolny do tworzenia 4 wiązań kowalencyjnych przez mechanizm wymiany.


Atomy krzemu nie są podatne na tworzenie wiązań wielokrotnych, ale tworzą związki z pojedynczymi wiązaniami-Si-O-. Krzem, w przeciwieństwie do węgla, nie jest typowy dla alotropii.
Jeden z modyfikacja alotropowa jest krystalicznym krzememw którym każdy atom krzemu jest w hybrydyzacji sp3. Ryc. 2, 3. Krzem krystaliczny jest stałą, ogniotrwałą i trwałą substancją krystaliczną ciemnoszarą z metalicznym połyskiem. W normalnych warunkach - półprzewodnik. Czasami amorficzny krzem jest również emitowany jako kolejna alotropowa modyfikacja krzemu. Jest to ciemnobrązowy proszek, bardziej aktywny chemicznie niż krystaliczny krzem. Czy jest to modyfikacja alotropowa, to kwestia sporna.
Właściwości chemiczne krzemu
1. Interakcje z halogenami
Si + 2F 2 → SiF 4
2. Po podgrzaniu krzem spala się w tlen, powstaje krzemionka (IV).
Si + O2 → SiO2
3. W wysokich temperaturach krzem oddziałuje z azotem lub węglem.
3 Si + 2N 2 → Si 3 N 4
4. Krzem nie reaguje z wodnymi roztworami kwasów. Ale rozpuszcza się w alkaliach.
Si + 2NaOH + H20 ^ Na2SiO3 + 2H2
5. Gdy krzem jest połączony z metalami, powstają krzemki.
Si + 2Mg → Mg 2 Si
6. Krzem nie wchodzi w bezpośrednią interakcję z wodorem, ale związki wodoru z krzemu można uzyskać przez oddziaływanie związków krzemowych z wodą.
Mg 2 Si + 4H 2 O → 2 Mg (OH) 2 + SiH 4 (silan)
Silany mają podobną strukturę do alkanów, ale są znacznie reaktywne. Najbardziej stabilny monosilan jest łatwopalny w powietrzu.
SiH 4 + 2O 2 → SiO2 + 2H 2O
Dostawanie krzemu
Krzem otrzymuje się przez redukcję z tlenku krzemu (IV)
SiO 2 + 2Mg → Si + 2MgO
Jednym z zadań jest uzyskanie silikonu o wysokiej czystości. W tym celu techniczny krzem przenosi się na tetrachlorek krzemu. Powstały tetrachlorek redukuje się do silanu, a silan rozkłada się na krzem i wodór po ogrzaniu.
Krzem jest w stanie wytworzyć dwa tlenki: SiO2 - tlenek krzemu (IV) i SiO - tlenek krzemu (II).
SiO - tlenek krzemu (II) - jest to amorficzna substancja ciemnobrązowa, która powstaje w wyniku oddziaływania krzemu z tlenkiem krzemu (IV)
Si + Sio 2 → 2 Sio.
Pomimo swojej stabilności, substancja ta prawie nigdy nie jest używana.
SiO 2 - tlenek krzemu (IV)


Ta substancja stanowi 12% skorupy ziemskiej. Ryc. 4. Jest reprezentowany przez takie minerały jak kryształ górski, kwarc, ametyst, cytryn, jaspis, chalcedon. Ryc. 5
SiO 2 - tlenek krzemu (IV) - substancja o budowie niemąsteczkowej.
Jego sieć krystaliczna jest atomowa. Ryc. 6. Kryształy SiO 2 mają postać czworościanu, połączonego wzajemnie atomami tlenu. Wzór cząsteczki (SiO 2) n byłby bardziej poprawny. Ponieważ SiO 2 tworzy substancję o strukturze atomowej, a CO 2 - o budowie molekularnej, różnica w ich właściwościach jest oczywista. CO 2 jest gazem, a SiO2 jest stałą przezroczystą substancją krystaliczną, nierozpuszczalną w wodzie i ogniotrwałą.
Właściwości chemiczneSiOkoło 2
1. Tlenek krzemu (IV) SiO2 jest tlenkiem kwasowym. Nie reaguje z wodą. Kwas krzemowy nie może być uzyskany przez hydratację SiO2. Jego sole, krzemiany, można otrzymać w reakcji SiO2 z gorącymi roztworami alkalicznymi.
SiO2 + 2NaOH Na2SiO3 + H20
2. Reaguje z węglanami metali alkalicznych i metali ziem alkalicznych.
CaCO 3 + SiO2 CaSiO 3 + CO 2
3. Współdziała z metalami.
SiO 2 + 2Mg → Si + 2MgO
4. Reakcja z kwasem fluorowodorowym.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Właściwości chemiczne kwasu krzemowego i krzemianów
Pierwsze kwasu krzemowego
Kwas krzemowy wytrąca się jako związek polimerowy. Kwas krzemowy -
H 2 SiO 3 (meta forma) i H 4 SiO 4 (forma orto) - odzwierciedlają stosunek pierwiastków, ale nie prawdziwy skład. Konwencjonalnie, w płaszczyźnie, kompozycja kwasu krzemowego jest przedstawiona jako 7
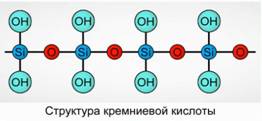
W przypadku kwasu krzemowego zawsze stosuje się wzór H 2 SiO 3.
1. H 2 Sio 3 rozkłada się po podgrzaniu
H 2 SiO 3 H 2 O + SiO 2 (żel krzemionkowy)
2. Oddziałuje z roztworami alkalicznymi
H 2 SiO 3 + 2NaOH Na2SiO 3 + 2H 2O
Sole kwasu krzemowego - krzemiany - odnoszą się do związków jonowych. Są to stałe, bezbarwne substancje. Tylko krzemiany metali alkalicznych, z wyjątkiem litu, są rozpuszczalne w wodzie.
1. Rozpuszczalne krzemiany są hydrolizowane przez anion
Na2SiO3 + H20\u003e NaHSio3 + NaOH
2. Rozpuszczalne krzemiany oddziałują z silnymi kwasami.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
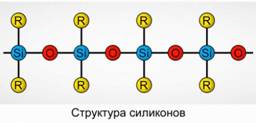
Poliorganosiloksany (silikony)
Poliorganosiloksany (silikony) to natlenione związki krzemoorganiczne o wysokim ciężarze cząsteczkowym.
R 2 [ Sio] n
R oznacza grupę organiczną (metyl, etyl lub fenyl). Podstawą struktury siloksanów jest łańcuch przemiennych atomów krzemu i tlenu. Ryc.8. Zmieniając długość łańcucha i grupy organiczne można uzyskać silikony o różnych właściwościach. Zmieniając warunki polimeryzacji, możesz otrzymać cząsteczki o różnych długościach.


Polimery krótkołańcuchowe to ciecze, a dłuższe są cennymi środkami smarnymi. Ryc. 9, które zachowują swoje właściwości w ogromnym zakresie temperatur od
100 0 С do + 300 0 С. Dłuższe cząsteczki tworzą gumy, które nie tracą swojej elastyczności w niskich temperaturach. Posiada wysoką odporność na ścieranie, są chemicznie obojętne. Ryc. 10. Powoduje różne warianty ich zastosowania. Mogą być używane do tworzenia maszyn do sztucznego serca lub nerek i mogą być używane jako buty do butów. Polimery siloksanowe są stosowane w medycynie do tworzenia różnych implantów tkanek miękkich, ponieważ takie polimery są chemicznie obojętne i nie są odrzucane przez organizm. Nie są zwilżone wodą. Jest stosowany w kremach. Podczas nakładania tego kremu na dłonie, on wymienia gumowe rękawiczki.
Ogród nieorganiczny
W przezroczystej zlewce wypełnionej krzemianem sodu zanurz kryształy kolorowych soli, na przykład siarczanu miedzi. Po pewnym czasie można zauważyć cienkie puste rurki utworzone z kryształów, które składają się z nierozpuszczalnych krzemianów. Ryc. 11

Uzyskiwanie "głupiej" szpachli
Równe objętości krzemianu sodu i alkoholu medycznego są zmieszane. Osad jest filtrowany i wyciskany, aby nie kapać alkoholu. To jest kit. Ryc. 12. Został nazwany tak, ponieważ planowano użyć go jako szpachli do okien. Okazało się jednak, że ma takie właściwości, że nie można go użyć w zamierzonym celu. Jeśli rzucisz piłkę i rzucisz nią na podłogę, odbij się jak gumowa piłka. Po umieszczeniu na stole rozleje się jak płyn. Jeśli uderzysz w solidny przedmiot, rozbijesz go jak ciało stałe. Po chwili, gdy alkohol wyschnie, ten kit po prostu się rozpadnie.
![]()
Podsumowując lekcję
Podczas tej lekcji zapoznałeś się z tematem "Krzemu". Przeanalizowaliśmy informacje o krzemie: jego struktura elektroniczna, gdzie krzem znajduje się w naturze, badał alotropię krzemu, wyjaśnił jej właściwości fizyczne i chemiczne. Nauczyli się, gdzie krzem jest używany w przemyśle i innych dziedzinach, w jaki sposób jest produkowany. Spotkałeś się z krzemionką, kwasem krzemowym i jego solami - krzemianami.
Referencje
1. Rudzitis G.E. Chemia. Podstawy chemii ogólnej. Ocena 11: podręcznik dla instytucji edukacyjnych: poziom podstawowy / G.E. Rudzitis, F.G. Feldman. - wyd. 14. - M.: Enlightenment, 2012.
2. Popel P.P. Chemia: 8 cl. Podręcznik dla szkół średnich / PP. Popel, L.S. - К.: ИЦ "Academy", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. Chemia. 11 klasa. Poziom podstawowy. 2nd ed., Sr. - M.: Drofa, 2007. - 220 str.
Praca domowa
1. №№2-4 (str. 138) Rudzitis G.E. Chemia. Podstawy chemii ogólnej. Ocena 11: podręcznik dla instytucji edukacyjnych: poziom podstawowy / G.E. Rudzitis, F.G. Feldman. - wyd. 14. - M.: Enlightenment, 2012.
2. Jakie są zastosowania poliorganosiloksanów.
3. Porównaj właściwości allotropowych modyfikacji krzemu.
