Właściwości fizyczne sio2. Związki tlenu. Krzem (II) SiO
Tlenek krzemu (II) SiO. W naturze nie występuje, ale można ją uzyskać dzięki reakcji:
SiO2 + Si → 2 SiO.
Pod normalnym ciśnieniem sublimacja monotlenku krzemu rozpoczyna się w około 1200 ° C (gdy same materiały wyjściowe praktycznie jeszcze nie odparowują). W parach SiO jest pojedynczym związkiem. Energia dysocjacji pierwiastków wynosi 789 kJ / mol. Konwersję do stanu stałego można osiągnąć tylko przez szybkie chłodzenie („hartowanie”) fazy gazowej. W przeciwnym razie czas na odrzucenie przez równanie ma czas:
2 SiO = SiO 2 + Si.
Tlenek krzemu jest powoli utleniany przez tlen atmosferyczny i łatwo rozpuszcza się w alkaliach, tworząc sole kwasu krzemowego i uwalnianie wodoru. Jest łatwo zelektryfikowana przez tarcie, uzyskując silny ładunek ujemny.
Tlenek krzemu (IV) SiO2.Tlenek krzemu (IV) nazywany jest również krzemionką. Jest to stała substancja ogniotrwała. (temperatura topnienia 1700 ° C)rozpowszechniony w naturze w dwóch formach: 1) krzemionka krystaliczna - w postaci minerału kwarcu i jego odmian (kryształ górski, chalcedon, agat, jaspis, krzemień); kwarc stanowi podstawę piasków kwarcowych szeroko stosowanych w budownictwie i przemyśle krzemianowym; 2) bezpostaciowa krzemionka - w postaci mineralnej kompozycji opalowej SiO 2 nH2O; ziemskie formy bezpostaciowej krzemionki to diatomit, tripoli (ziemia infuzyjna); Przykładem sztucznej bezpostaciowej bezwodnej krzemionki jest żel krzemionkowy, który otrzymuje się z metakrzemianu sodu:
Żel krzemionkowy ma rozwiniętą powierzchnię i dlatego dobrze wchłania wilgoć.
Przy 1710 ° topi się kwarc. Przy szybkim chłodzeniu stopionej masy powstaje szkło kwarcowe. Ma bardzo niski współczynnik rozszerzalności, dzięki czemu gorące szkło kwarcowe nie pęka, gdy woda jest szybko chłodzona. Szkło laboratoryjne i narzędzia do badań naukowych są wykonane ze szkła kwarcowego.
Strukturę SiO 2 w obrazie planarnym można przedstawić w następujący sposób:
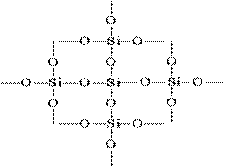
Każdy atom krzemu jest zamknięty w czworościanie 4 atomów tlenu. W tym przypadku atom krzemu znajduje się w centrum, a atomy tlenu znajdują się w wierzchołkach czworościanu. Cały kawałek krzemionki można uznać za kryształ, którego wzór to (SiO 2) n. Taka struktura tlenku krzemu (IV) określa jego wysoką twardość i ogniotrwałość.
Właściwości chemiczne tlenku krzemu (IV) SiO2 odnoszą się do tlenków kwasowych. Podczas łączenia ze stałymi alkaliami, zasadowymi tlenkami i węglanami tworzą się sole kwasu krzemowego:
Jedynie kwas fluorowodorowy oddziałuje z tlenkiem krzemu (IV) (trawienie szkła):
SiO 2 + HF → SiF 4 + H 2 O
Tlenek krzemu (IV) nie rozpuszcza się w wodzie i nie oddziałuje z nim chemicznie. Dlatego kwas krzemowy otrzymuje się pośrednio, na przykład przez hydrolizę:
Kwas ortosilikonowy SiS2 + H2O ↔ H2S + H4 SiO4.
H 4 SiO 4 jest rozpuszczalny, po podgrzaniu lub odstaniu trwa proces polimeryzacji:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 kwas dwuortokremnievy.
2H6 Si2O7 → H2O + H10 Si4O13 kwas tetraorotremilowy.
Zamyka pierścień:
H10 Si4O13 → H2O + (H2SiO3) 4 kwas tetrametakrylowy.
W tym przypadku kwas krzemowy (w zależności od stężenia początkowych roztworów soli i kwasu) można otrzymać zarówno w postaci żelatynowej masy zawierającej wodę, jak iw postaci roztworu koloidalnego (zolu). Skład otrzymanego kwasu krzemowego zależy od materiałów wyjściowych i warunków wytwarzania. Wszystkie kwasy krzemowe są bardzo słabe (słabsze niż węgiel).
Jeśli kwas węglowy w roztworze uwalnia kwas krzemowy z jego soli, wówczas reakcja odwrotna zachodzi podczas kalcynacji. Pierwszą z nich jest niższa wytrzymałość (stopień dysocjacji) kwasu krzemowego, druga - niższa lotność po podgrzaniu.
Po podgrzaniu kwasów polikrzemowych i ich stopniowej dehydratacji można uzyskać delikatne SiO 2, które nazywa się żel krzemionkowy . Dobrze absorbuje wodę, umieszczam ją w urządzeniach, aby zapobiec utlenianiu drogich elementów.
Podgrupa Niemiec
Ge (+4) Sn (+2, +4) Pb(+2) - odporne stany utleniania
German Mendelejew przewidział w 1871 r. I odkrył w 1886 r. Cyna i ołów należą do pierwiastków najbardziej znanych ludzkości od dawna: Egipcjanie byli w stanie wytapiać je z rud ponad 3000 lat pne. er W Indiach ołów stał się znany około 2500 lat, a cyna 1500 lat pne. er Wytapiana cyna produkowana w starożytnych Chinach.
PokwitowanieNaturalne związki germanu są przekształcane w GeO 2 i redukowane wodorem:
GeO 2 + H 2 t → Ge + H 2 O w temperaturach około 1000 ° C
Cyna jest otrzymywana z naturalnego minerału kasiteryt(SnO 2):
SnO 2 + C → Sn + CO.
Najprostszy schemat redukcji ołowiu przemysłowego opiera się na dwóch następujących po sobie reakcjach:
PbS + O 2 → SO 2 + PbO Galena(PbS) jest spalany, a następnie redukowany węglem:
PbO + С → СO + Pb.
Aplikacja.Wszystkie trzy elementy są bardzo ważne dla nowoczesnej technologii. Niektóre związki cyny i ołowiu są również bardzo przydatne. Pochodne ołowiu są wysoce toksyczne.
German jest typowym półprzewodnikiem (n-type z szerokością pasma zabronionego 0,75 eV) i znajduje różne zastosowania w elektrotechnice. Jest najczęściej stosowany do produkcji prostowników prądu przemiennego.. To zastosowanie opiera się na jednobiegunowej przewodności wynikającej z kontaktu czystego germanu i stopu germanu z indem. Prąd (przepływ elektronów) przechodzi w takiej instalacji praktycznie tylko z germanu do stopu, ale nie odwrotnie. Prostowniki Germanium charakteryzują się wyjątkowo wysoką (około 98%) wydajnością i bardzo dużą (przy prawidłowej pracy) żywotnością. Główną wadą takich prostowników jest ich wrażliwość na ogrzewanie - powyżej 70 ° C, ich wydajność szybko spada.
Ważny obszar użytkowania niemcy to optyka na podczerwień, ponieważ promienie o długości fali większej niż 2 mikrony praktycznie nie opóźniają. Wręcz przeciwnie, w świetle i blisko tego zakresu (0,2 ± 2 mikrony) german intensywnie absorbuje energię. Jeśli błyszcząca metalowa powierzchnia (która dobrze magazynuje ciepło, ale nie nagrzewa się dobrze) jest pokryta folią germanową, to powierzchnia nagrzewa się znacznie więcej niż bez folii. Doniesiono, że w beczce przygotowanej w ten sposób pod działaniem światła słonecznego można uzyskać wrzącą wodę.
Cynę stosuje się głównie do cynowania żelaza w celu ochrony przed rdzewieniem. (blacha biała dla przemysłu konserwowego). Grubość takich powłok cynowych jest bardzo mała - rzędu mikronów. W postaci cienkich arkuszy (tzw. Stanniole) cyna jest zużywana do produkcji kondensatorów w przemyśle elektrycznym . Ołów jest używany do produkcji płyt akumulatorowych, płyt kabli elektrycznych, kul i strzałów, w celu ochrony przed promieniowaniem rentgenowskim i promieniowaniem g, jak również w przemyśle chemicznym (rurociągi itp.). Bardzo duże ilości cyny i ołowiu są wydawane na wytwarzanie wielu ważnych technicznie stopów.
Najważniejsze z nich to różne brązy (stopy Cu i Sn), stopy do łożysk (babbity, zwykle wytwarzane na bazie Pb lub Sn, a także zawierające Sb i Cu), stopy typograficzne (5-30% Sn, 10-20% Sb, reszta to Pb) i zwykłe „miękkie” lutowie (30-70% Sn, 70-30% Pb). Często można go zastąpić tańszym stopem 90% Pb, 6% Sn, 4% Sb. Duże znaczenie mają stopy do łożysk o przybliżonym składzie 98% Pb, 1% Ca, 1% Na.
Krzemionka (krzemionka, krzemionka) jest substancją składającą się z bezbarwnych kryształów o wysokiej wytrzymałości, twardości i ogniotrwałości. Dwutlenek krzemu jest odporny na kwasy i nie oddziałuje z wodą. Wraz ze wzrostem temperatury reakcji substancja oddziałuje z alkaliami, rozpuszcza się w kwasie fluorowodorowym, jest doskonałym dielektrykiem.
W przyrodzie dwutlenek krzemu jest szeroko rozpowszechniony: krystaliczny tlenek krzemu jest reprezentowany przez takie minerały jak jaspis, agat (krystaliczne związki dwutlenku krzemu), kryształ górski (duże kryształy materii), kwarc (wolny dwutlenek krzemu), chalcedon, ametyst, morion, topaz (kolorowe kryształy krzemionka).
W normalnych warunkach (przy naturalnej temperaturze i ciśnieniu otoczenia) istnieją trzy krystaliczne modyfikacje dwutlenku krzemu - trójdymitu, kwarcu i krystobalitu. Gdy temperatura wzrasta, dwutlenek krzemu najpierw zamienia się w koesyt, a następnie w stiszowit (minerał znaleziony w 1962 r. W kraterze meteorytu). Według badań, to stishovit, pochodna dwutlenku krzemu, wyprowadza dużą część płaszcza Ziemi.
Wzór chemiczny substancji - SiO 2
Przygotowanie krzemionki
Ditlenek krzemu jest wytwarzany przemysłowo w zakładach kwarcowych wytwarzających czysty koncentrat kwarcowy, który jest następnie wykorzystywany w przemyśle chemicznym i elektronicznym, w produkcji optyki, gumy i wypełniaczy farb i lakierów, produkcji biżuterii itp. Naturalny dwutlenek krzemu, zwany inaczej krzemionką, jest szeroko stosowany w budownictwie (beton, piasek, dźwięk i materiały izolacyjne).
Syntezę dwutlenku krzemu metodą syntetyczną przeprowadza się przez działanie kwasów na krzemian sodu, w niektórych przypadkach na inne rozpuszczalne krzemiany lub metodą koagulacji krzemionki koloidalnej pod wpływem jonów. Ponadto dwutlenek krzemu jest wytwarzany przez utlenianie krzemu tlenem w temperaturze około 500 stopni Celsjusza.
Zastosowanie dwutlenku krzemu
Materiały zawierające krzem są szeroko stosowane zarówno w dziedzinie wysokich technologii, jak iw życiu codziennym. Ditlenek krzemu stosuje się w produkcji szkła, ceramiki, wyrobów betonowych, materiałów ściernych, a także w inżynierii radiowej, instalacjach ultradźwiękowych, zapalniczkach itp. W połączeniu z wieloma składnikami krzemionka jest wykorzystywana do produkcji kabli światłowodowych.
Nieporowaty bezpostaciowy dwutlenek krzemu jest również stosowany w przemyśle spożywczym jako dodatek, zarejestrowany pod numerem E551, zapobiegający zbrylaniu się i zbrylaniu głównego produktu. Dwutlenek  krzemowa żywność jest stosowana w przemyśle farmaceutycznym jako enterosorbent w produkcji past do zębów. Substancja znajduje się w chipsach, krakersach, paluszkach kukurydzianych, kawie rozpuszczalnej itp.
krzemowa żywność jest stosowana w przemyśle farmaceutycznym jako enterosorbent w produkcji past do zębów. Substancja znajduje się w chipsach, krakersach, paluszkach kukurydzianych, kawie rozpuszczalnej itp.
Silica Harm
Oficjalnie potwierdzono, że substancja dwutlenku krzemu przechodzi przez przewód pokarmowy bez zmian, po czym jest całkowicie usuwana z organizmu. Według 15-letnich badań przeprowadzonych przez francuskich ekspertów picie wody pitnej o wysokiej zawartości tlenku glinu zmniejsza ryzyko rozwoju choroby Alzheimera o 10%.
Zatem informacje o zagrożeniach związanych z dwutlenkiem krzemu, który jest substancją obojętną chemicznie, są fałszywe: suplement diety E551, przyjmowany doustnie, jest całkowicie bezpieczny dla zdrowia.
Tlenek krzemu SiO 2 jest substancją stałą, bardzo ogniotrwałą (temperatura topnienia powyżej 1700 ° C), szeroko rozpowszechnioną w naturze, gdzie występuje głównie w postaci minerału kwarcowego, a także krystobalitu i trydymitu.
W zwykłych temperaturach kwarc jest stabilną modyfikacją, wraz ze wzrostem temperatury obserwuje się transformacje polimorficzne:
Krzemionka wszystkich modyfikacji w postaci monomeru nie istnieje; zawsze jest polimerowy i „zbudowany” z czworościanów tworzących bardzo silną sieć atomową
Każdy atom krzemu w kryształach (SiO 2) n jest czworościanowo otoczony czterema atomami tlenu, z których każdy jest zmostkowany. Poprzez wspólny atom tlenu, czworościany pod różnymi kątami wiążą się ze sobą, tworząc ciągłą trójwymiarową sieć; wzajemne rozmieszczenie czworościanów w przestrzeni determinuje jedną lub inną modyfikację krzemionki.
W różnych modyfikacjach siła wiązania krzemionki jest różna. Wpływa to na wielkość kątów Si-O-Si i odległości Si-O, na przykład kąt wiązania Si-O-Si w różnych modyfikacjach krzemionki waha się od 120 do 180 °. Przejściom kwarcowo-tridymitowo-krystobalitowym towarzyszy rozbijanie i przekształcanie wiązań, które mogą występować tylko w wysokich temperaturach.
Kwarc Często spotykane w przyrodzie w postaci wyjątkowo dobrze ukształtowanych kryształów, czasem o znacznych rozmiarach. Kryształy powstają z czworościanów ułożonych spiralnie wokół osi centralnej, w formie spirali. W tym samym krysztale kierunek spirali może być przeciwny. Takie kryształy są izomerami optycznymi. Obracają płaszczyznę polaryzacji światła i mogą być zarówno prawą, jak i lewą ręką. Te i inne kryształy różnią się jako podmiot od ich lustrzanego odbicia.
Kwarc jest używany w różnych dziedzinach nauki i technologii, a jego kryształy są często sztucznie uprawiane. Niektóre rodzaje kwarcu to specjalne nazwy. Przezroczyste, bezbarwne kryształy nazywane są kryształami górskimi. Istnieją również kolorowe odmiany kwarcu: kwarc różowy, fiolet (ametyst), ciemnobrązowy (dymny topaz), zielony (chryzopraz) itp. Krystaliczna modyfikacja kwarcu z domieszkami innych substancji nazywana jest chalcedonem. Odmianami chalcedonu są agat, jaspis i inne. Kryształ górski i kolorowe odmiany kwarcu są używane jako kamienie szlachetne i półszlachetne.
Tridimit występuje w skałach wulkanicznych, ale w bardzo małych ilościach. Znane pochodzenie trójdymitowe i meteorytowe.
Krystobalit w przyrodzie czasami występuje w postaci małych kryształów osadzonych w lawie, takich jak tridimit. Tridimit i krystobalit mają bardziej „luźną” strukturę niż kwarc. Zatem gęstość krystobalitu, trydymitu i kwarcu wynosi 2,32; Odpowiednio 2,26 i 2,65 g / cm3.
Stopiony krzemionka z powolnym chłodzeniem łatwo tworzy amorficzne szkło kwarcowe. Krzemionka w postaci szkła występuje również w naturze. Gęstość szkła amorficznego wynosi 2,20 g / cm 3 - niższa niż wszystkich modyfikacji krystalicznych. Szkło kwarcowe ma niewielki współczynnik rozszerzalności temperaturowej, dlatego służy do przygotowania szkła laboratoryjnego odpornego na nagłe zmiany temperatury.
Wszystkie modyfikacje krzemionki w wodzie są praktycznie nierozpuszczalne (w temperaturze 25 ° C, rozpuszczalność kwarcu wynosi 7, krystobalit - 12, trydymit - 16, szkło kwarcowe - 83 mg / l). Dlatego w normalnych warunkach działają tylko roztwory alkaliczne i kwas fluorowodorowy:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO2 + 4HF = SiF 4 + 2H 2 O. (2)
Ta ostatnia reakcja jest stosowana w „trawieniu” szkła.
Dodana krzemionka reaguje z zasadowymi tlenkami, zasadami (reakcja (1)) i węglanami, tworząc krzemiany:
SiO 2 + CaO = СaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO2. (4)
Reakcje (3) i (4) stanowią podstawę produkcji przemysłowej różnych szkieł, a także cementu. Tak więc skład zwykłego szkła (na przykład okna do wytwarzania naczyń) wyraża się wzorem Na 2 O. CaO. 6SiO 2. Takie szkło wytwarza się przez stopienie mieszaniny sody, piasku i wapienia. Proces przeprowadza się w temperaturze ~ 1400 ° C aż do całkowitego usunięcia gazów:
Na2CO3 + CaCO3 + 6SiO2 = Na2O. CaO. 6SiO2 + 2CO2.
W przypadku specjalnych gatunków szkła - ogniotrwałego, „niezniszczalnego” - podczas gotowania dodać tlenki baru, ołowiu, boru. Aby uzyskać kolorowe szkła, wprowadza się różne dodatki, na przykład dodatek tlenku kobaltu Co 2 O 3 daje niebieski kolor, tlenek chromu Cr 2 O 3 - zielony, dwutlenek manganu MnO 2 - różowy.
Tlenek SiO2 jest bezwodnikiem wielu kwasów krzemowych, których skład może być wyrażony wzorem ogólnym xSiO 2? YH 2O, gdzie xiy są liczbami całkowitymi: 1) x = 1, y = 1: SiO2. H 2 Oh, tj. H 2 SiO 3 - kwas meta-krzemowy; 1) x = 1, y = 2: SiO2. 2H2O, tj. kwas ortokrzemowy; 1) x = 2, y = 1: 2SiO 2. H 2 Oh, tj. H 2 Si 2 O 5 - bimeta kwasu krzemowego.
Kwasy, których cząsteczki zawierają więcej niż jedną cząsteczkę SiO 2, należą do polikrzemu.
Najprostszym z kwasów krzemowych jest H 2 SiO 3, który często nazywany jest po prostu krzemem, a jego sole są krzemianami. Z krzemianów tylko krzemiany sodu i potasu są rozpuszczalne w wodzie, pozostałe krzemiany są substancjami ogniotrwałymi, nierozpuszczalnymi w wodzie.
Roztwory krzemianów stają się mętne, gdy stoją w powietrzu, ponieważ zawarty w nich CO 2 wypiera kwas krzemowy z jego soli (H 2 SiO 3 jest słabszy niż kwas węglowy; stała dysocjacji H 2 SiO 3 w pierwszym etapie jest równa K 1 = 2,2-10 -10 ).
H 2 SiO 3 jest praktycznie nierozpuszczalny w wodzie - ta właściwość jest stosowana jako reakcja jakościowa do wykrywania jonów krzemianowych:
Na 2 SiO 3 + CO2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Krzemiany otrzymuje się przez stopienie SiO2 z alkaliami lub węglanami.
Stężone roztwory krzemianów sodu i potasu nazywane są ciekłym szkłem, mają silnie alkaliczną reakcję ze względu na to, że są wysoce zhydrolizowane:
K 2 SiO 3 + H 2 O 2 KON + H 2 SiO 3 ↓.
Płynne szkło stosuje się na przykład do produkcji kleju, wodoodpornych tkanin.
Cement jest bardzo szeroko stosowany w budownictwie jako spoiwo, które po zmieszaniu z wodą twardnieje. Zwykle cement jest produkowany w dużych piecach obrotowych, w których różne krzemiany są prażone i mielone (w temperaturze -1000 ° C).
Istnieje kilka rodzajów cementu, jednak warunkowo możliwe jest rozróżnienie dwóch rodzajów cementu zgodnie z zasadą ich „koagulacji” - zwykłego cementu i cementu portlandzkiego. Proces „wiązania” konwencjonalnego cementu składającego się z krzemianu wapnia zachodzi z powodu tworzenia się węglanu wapnia z powodu dwutlenku węgla w powietrzu:
Cao. SiO2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Przy ustawianiu cementu portlandzkiego dwutlenek węgla nie jest zaangażowany w proces, a hydroliza krzemianów następuje z późniejszym tworzeniem nierozpuszczalnych krystalicznych hydratów:
Ca 3 SiO 5 + H2O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Węgliki i krzemki
· Związki węgla i krzemu z metalami - węgliki i krzemki, oprócz rozważanych reakcji, są również otrzymywane przez oddziaływanie krzemu z wodorkami metali, na przykład:
· 2CaH2 + Si = Ca 2 Si + 2H 2.
· Wszystkie te reakcje zachodzą w wysokich temperaturach. Wśród węglików emitują tak zwane „metanidy” i „acetylen”. Pierwsze są uważane za pochodne metanu zawierające węgiel w stanie utlenienia -4 (Be 2 C, Al 4 C 3), drugie - jako pochodne acetylenu o stopniu utlenienia węgla -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2 , CAC 2). Acetylidy srebra i miedzi (I) można łatwo uzyskać przez przepuszczanie acetylenu przez roztwór amoniaku tlenku srebra lub chlorku miedzi (I). Większość metanidów i acetylidów aktywnie reaguje z wodą (zwłaszcza z kwasami), uwalniając odpowiednie węglowodory:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H2O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C 2H 2.
· W przeciwieństwie do węglików, tylko krzemki metali alkalicznych lub metali ziem alkalicznych oddziałują z wodą i kwasami, wytwarzając najprostszy związek wodorowy monosilanu krzemu, który jest często nazywany po prostu silanem SiN 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
· Silan jest bezbarwnym gazem, który ma zapach pleśni, samorzutnie palny w powietrzu, palący się do SiO 2 i wody:
· SiH 4 + 2O 2 = SiO 2 + 2 H 2 O.
· Alkalia bardzo łatwo rozkładają silan za pomocą równania:
· SiH4 + 2KON + H 2 O = K 2 SiO 3 + 4 H 2,
· Woda również hydrolizuje silan, ale znacznie wolniej:
· SiH4 + 2H2O = SiO2 + 4H2.
· Po podgrzaniu powyżej 400 ° C bez dostępu powietrza, silan rozkłada się na krzem i wodór (jedna z metod produkcji krzemu):
· SiH 4 = Si + 2H 2.
· Oprócz monosilanu, znane są również disilan Si2H6, trisilan Si3H8, tetrasilan Si4H10 itd. W stanie indywidualnym związki izolowano tylko do Si 6 H 14 włącznie. Wszystkie te związki należą do homologicznej serii silanów, której odpowiada ogólny wzór Si nH2 n + 2. Podobnie jak alkany, silany są bezbarwne, pierwsi członkowie szeregu homologicznego są gazowi w normalnych warunkach, następujące są ciecze. Aktywność chemiczna silanów i węglowodorów jest różna: w przeciwieństwie do dostatecznie obojętnych alkanów, silan jest reaktywny. Jest to spowodowane niższym powinowactwem krzemu do wodoru w porównaniu z węglem i bardzo wysokim powinowactwem krzemu do tlenu. Ponadto wiązania Si-Si są mniej trwałe niż wiązania С-С. W przeciwieństwie do wiązania C-H, wiązanie Si-H ma bardziej jonowy charakter.
· Energia wiązań Si-E i CE.
· Niska wytrzymałość wiązania Si-Si wynika z ograniczenia homologicznej serii silanów.
· Wśród węglików i krzemków szczególne miejsce zajmuje karborund SiC, który można nazwać zarówno węglikiem krzemu, jak i krzemkiem węgla. Karborund ma wysoką temperaturę topnienia ze względu na strukturę przypominającą diament; jego twardość jest zbliżona do twardości diamentu. Chemicznie, SiC jest bardzo stabilny.
· Koncepcja roztworów koloidalnych
W przyrodzie i technologii często występują systemy rozproszone, w których jedna substancja jest równomiernie rozłożona jako cząstki wewnątrz innej substancji.
W systemach rozproszonych występuje faza rozproszona - subtelnie rozdrobniona substancja i ośrodek dyspersyjny - jednorodna substancja, w której rozproszona faza jest rozproszona. Systemy dyspersyjne obejmują zwykłe (prawdziwe) roztwory, roztwory koloidalne, a także zawiesiny i emulsje. Różnią się od siebie głównie wielkością cząstek, tj. Stopniem dyspersji (fragmentacji).
Systemy o wielkości cząstek mniejszej niż 1 nm są prawdziwymi roztworami składającymi się z rozpuszczonych cząsteczek lub jonów. Powinny być traktowane jako system jednofazowy. Układy o rozmiarach cząstek większych niż 100 nm są układami gruboziarnistymi - zawiesinami i emulsjami.
Zawiesiny są układami rozproszonymi, w których faza rozproszona jest ciałem stałym, a ośrodek rozpraszający jest cieczą, a ciało stałe jest praktycznie nierozpuszczalne w cieczy.
Emulsje są układami rozproszonymi, w których zarówno faza rozproszona, jak i ośrodek dyspersyjny są cieczami, które nie mieszają się wzajemnie. Przykładem emulsji jest mleko, w którym małe kulki tłuszczu pływają w cieczy.
Zawiesiny i emulsje są układami dwufazowymi.
Roztwory koloidalne są wysoce zdyspergowanymi układami dwufazowymi składającymi się z ośrodka dyspersyjnego i fazy rozproszonej, a wymiary liniowe cząstek tego ostatniego leżą w zakresie od 1 do 100 nm. Jak można zauważyć, roztwory koloidalne według wielkości cząstek są pośrednie między prawdziwymi roztworami i zawiesinami i emulsjami. Cząsteczki koloidalne zazwyczaj składają się z dużej liczby cząsteczek lub jonów.
Roztwory koloidalne są również nazywane solami. Otrzymuje się je metodami dyspersji i kondensacji. Dyspergowanie odbywa się najczęściej za pomocą specjalnych „młynów koloidalnych”. W metodzie kondensacji cząstki koloidalne powstają przez połączenie atomów lub cząsteczek w agregaty. W trakcie wielu reakcji chemicznych zachodzi kondensacja i tworzą się silnie rozproszone układy (wytrącanie, hydroliza, reakcje utleniania-redukcji itp.).
1 nm - nanometr (1 nm = 10 -9 m).
W przeciwieństwie do prawdziwych rozwiązań, cechy charakteryzują się efektem Tyndalla, tj. Rozpraszaniem światła przez cząstki koloidalne. Gdy stożek światła pojawia się przez wiązkę światła, pojawia się w zaciemnionym pokoju. 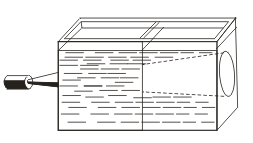 . Więc możesz rozpoznać, czy to rozwiązanie jest koloidalne czy prawdziwe.
. Więc możesz rozpoznać, czy to rozwiązanie jest koloidalne czy prawdziwe.
Jedną z ważnych właściwości zoli jest to, że ich cząstki mają ładunki elektryczne tego samego znaku. Z tego powodu nie łączą się w większe cząstki i nie wytrącają się. Jednocześnie cząstki niektórych zoli, na przykład metali, siarczków, kwasów krzemowych i cyny, mają ładunek ujemny, podczas gdy inne, na przykład wodorotlenki, tlenki metali, mają ładunek dodatni. Pojawienie się ładunku jest wyjaśnione przez adsorpcję jonów z roztworu przez cząstki koloidalne.
Aby wytrącić zol, konieczne jest połączenie jego cząstek w większe agregaty. Kombinacja cząstek w większe agregaty nazywana jest koagulacją, a ich sedymentacja pod wpływem grawitacji nazywana jest sedymentacją.
Zwykle koagulacja zachodzi przy dodawaniu do zoli: 1) elektrolitu, 2) innego zolu, którego cząstki mają przeciwny ładunek, i 3) po podgrzaniu.
