Schemat struktury krzemu. Struktura elektronowa
Struktura atomowa Pozycja w PS: okres III; grupa IV, prowadzenie; Ładowanie jądra: +14 Si; Względna masa atomowa: Ar (Si) = 28 Struktura atomowa: p = 14, e = 14, n = = 14 Wzór elektroniczny: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
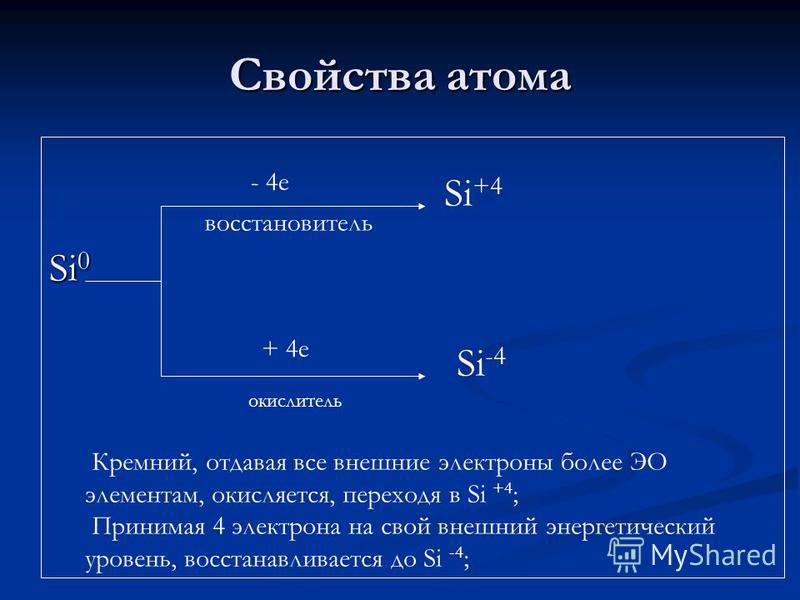
Właściwości atomowe Si e reduktor + 4 e utleniacz Si + 4 Si-4 Krzem, dając wszystkie zewnętrzne elektrony większej liczbie elementów EO, jest utleniany, przechodząc w Si + 4; Biorąc 4 elektrony do zewnętrznego poziomu energii, zostaje zredukowany do Si-4;

Właściwości fizyczne krzemu Krzem jest niemetalem, występuje w stanie krystalicznym i amorficznym. Krystaliczny krzem jest szarawo-stalową substancją o metalicznym połysku, bardzo twardą, ale delikatną. Amorficzny krzem - brązowy proszek. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Struktura krystaliczna krzemu Sieć krystaliczna krzemu jest sześciennym typem diamentu skoncentrowanym na twarzy. Jednak ze względu na dłuższą długość wiązania między Si - Si twardość krzemu jest znacznie mniejsza niż diamentu. Krzem jest delikatny, tylko po podgrzaniu powyżej C.

Właściwości elektrofizyczne Krzem elementarny Krzem elementarny jest typowym półprzewodnikiem. typowy półprzewodnik. Na właściwości elektrofizyczne krzemu krystalicznego duży wpływ mają zawarte w nim śladowe zanieczyszczenia. Aby uzyskać pojedyncze kryształy krzemu z przewodnością otworu, do krzemu wprowadzane są dodatki pierwiastków z trzeciej grupy boru, glinu, galu i indu, z elektronową przewodnością dodatków pierwiastków z piątej grupy fosforu, arsenu lub antymonu.


Flint Flint, ten Flint, ten brzydki i bardzo brzydki i bardzo wytrzymały kamień, trwały kamień, położył podwaliny pod kamienny początek epoki kamienia - stulecie - wiek krzemiennych narzędzi roboczych. narzędzia krzemienne. Istnieją dwa powody: - rozpowszechnienie i dostępność krzemu; - rozpowszechnienie i dostępność krzemu; - zdolność do formowania ostrych krawędzi tnących po rozdrobnieniu; - zdolność do formowania ostrych krawędzi tnących po rozdrobnieniu;




Czy wiesz, że .. Metoda otrzymywania krzemu w czystej postaci została opracowana przez Nikołaja Nikołajewicza Beketowa. Krzem w Rosji produkowany jest w fabrykach: Kamensk - Uralsky (Sverdlovsk Region), Kamensk - Uralsky (Sverdlovsk Region) Shelekh (Irkuck Region). Shelekh (obwód irkucki).

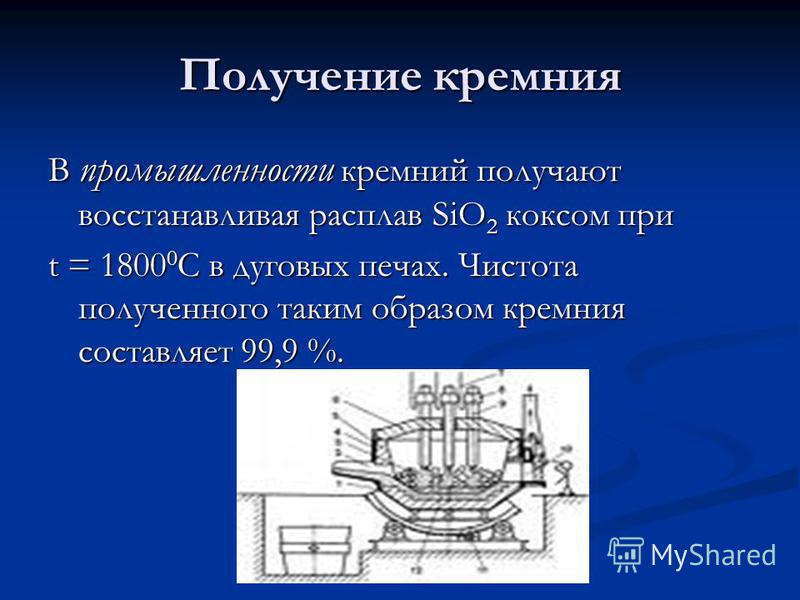
Produkcja krzemu W przemyśle krzem otrzymuje się przez redukcję stopu SiO2 przez koks w t = C w piecach łukowych. Czystość tak otrzymanego krzemu wynosi 99,9%.
Otrzymywanie krzemu Metoda produkcji laboratoryjnej: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Właściwości chemiczne krzemu Po podgrzaniu do 400 ° C krzem reaguje z tlenem, tworząc dwutlenek krzemu: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
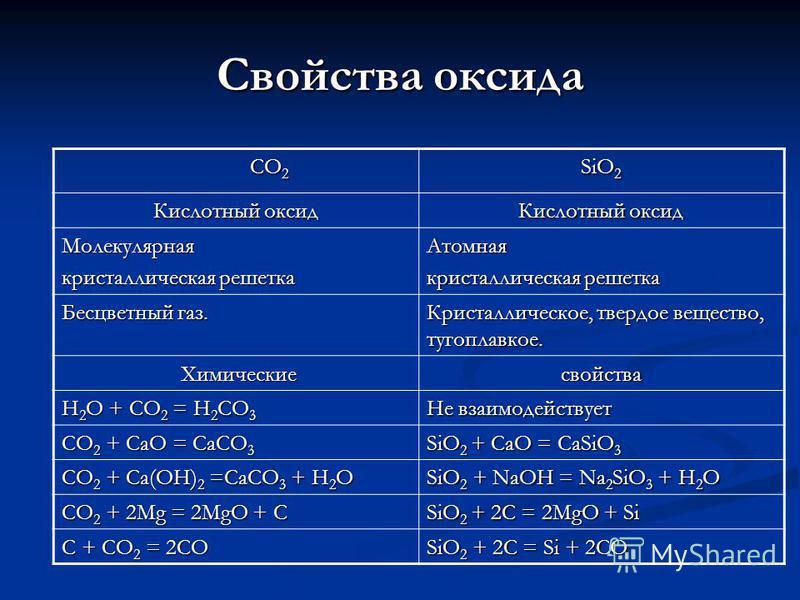
Właściwości CO 2 CO 2 SiO 2 tlenek Kwas tlenkowy Molekularna sieć krystaliczna Atomowy Bezbarwny gaz. Krystaliczny, stały, ogniotrwały. Chemiczne właściwości chemiczne H 2 O + CO 2 = H 2 CO 3 Nie reaguje z CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H2O CO 2 + 2 Mg = 2 MgO + C SiO 2 + 2 C = 2 MgO + Si C + CO 2 = 2 CO SiO 2 + 2 C = Si + 2 CO
Właściwości kwasów H 2 CO 3 H 2 SiO 3 Dwuzasadowy, zawierający tlen, słaby, kruchy latać. Dwuzasadowy, zawierający tlen, słaby, nierozpuszczalny w wodzie. Otrzymywanie: CO 2 + H 2 O = H 2 CO 3 Otrzymywanie: SiO 2 + H 2 O = nie może Niestabilny, kruchy, rozkłada się podczas stania lub ogrzewania: H 2 CO 3 = CO 2 + H 2 O Nie można wybrać w czystej postaci, ponieważ rozkłada się po podgrzaniu: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Minor ewolucja gazu __________

Kwas węglowy Kwas krzemowy - Węglany; - węglowodory; - krzemiany; - krzemiany; Węglany mają wszystkie właściwości soli, są silnymi elektrolitami, całkowicie dysocjują na jony (rozpuszczalne w wodzie). Tylko sole metali alkalicznych są rozpuszczalne, inne tworzą nierozpuszczalne lub w ogóle nie tworzą soli (Al +3, Cr +3, Ag +).
![]()



Rola biologiczna Najważniejszy związek krzemu, SiO 2, jest niezbędny dla życia roślin i zwierząt. Dzięki niemu trzciny, trzciny Dzięki niemu trzciny, trzciny i skrzypce stoją mocno jak bagnety. a skrzypki stoją mocno, jak bagnety. Ostre liście turzycy cięte jak ostre liście turzycy cięte jak noże, ściernisko na skoszonych nożach polnych, ściernisko na skoszonym polu ukłuwa jak igły, a łodygi zbóż przyklejają się jak igły, a łodygi zbóż są tak silne, że nie pozwalają na to tak mocno, że nie pozwól, aby pole na polach spadło z deszczu i pola wiatru na polach, aby wyjść z deszczu i wiatru


Krzem jest pierwiastkiem śladowym, który jest stale obecny w ludzkim ciele. Jego największa ilość jest zawarta w węzłach chłonnych, tkance łącznej aorty, tchawicy, włosach i skórze. Krzem jest potrzebny do budowy komórek nabłonkowych. Krzem jest pierwiastkiem śladowym, który jest stale obecny w ludzkim ciele. Jego największa ilość jest zawarta w węzłach chłonnych, tkance łącznej aorty, tchawicy, włosach i skórze. Krzem jest potrzebny do budowy komórek nabłonkowych. Krzem odgrywa ważną rolę w procesie mineralizacji kości; konieczne do utrzymania elastyczności ściany tętnicy, ma pozytywny wpływ na układ odpornościowy i spowalnia proces starzenia się w tkankach ludzkiego ciała. Średnia zawartość krzemu we krwi wynosi 8,25 mg / dzień. Wraz z wiekiem jej poziom w organizmie maleje, więc u osób starszych zapotrzebowanie na krzem ma tendencję wzrostową. Poprawa absorpcji krzemu przez organizm obecność wapnia, magnezu, manganu i potasu. Krzem odgrywa ważną rolę w procesie mineralizacji kości; konieczne do utrzymania elastyczności ściany tętnicy, ma pozytywny wpływ na układ odpornościowy i spowalnia proces starzenia się w tkankach ludzkiego ciała. Średnia zawartość krzemu we krwi wynosi 8,25 mg / dzień. Wraz z wiekiem jej poziom w organizmie maleje, więc u osób starszych zapotrzebowanie na krzem ma tendencję wzrostową. Poprawa absorpcji krzemu przez organizm obecność wapnia, magnezu, manganu i potasu.

Biologiczna rola krzemu jest również zawarta w składzie niższych żywych organizmów - okrzemek i radiolariów - najbardziej delikatnych brył żywej materii, które tworzą ich niedoścignione szkielety piękna z krzemionki. Krzem jest także częścią niższych żywych organizmów - okrzemek i radiolariów - najbardziej delikatnych brył żywej materii, które tworzą ich niezrównane piękno szkieletów krzemionkowych. Okrzemki Radiolaria Samokontrola 1. Jakie jest miejsce krzemu w układzie okresowym: a) 2 okresy, 4 og. b) 3 okresy, 3 gr. rozdział. c) 3 okresy, 4 gr. rozdział) 2 okresy, 4 gr. b) 3 okresy, 3 gr. rozdział. c) 3 okresy, 4 gr. rozdział. 2. Sieć krzemowa: a) jonowa; b) atomowy; c) molekularny; a) jonowe; b) atomowy; c) molekularny; 3. Zgodnie z rozpowszechnieniem natury krzemu ... element: a) pierwszy; b) drugi; c) trzeci; a) pierwszy; b) drugi; c) trzeci; 4. Krzem reaguje z: a) metalami, wodorem, halogenami; a) metale, wodór, halogeny; b) metale, halogeny, łatwo rozpuszczalne w alkaliach; b) metale, halogeny, łatwo rozpuszczalne w alkaliach; c) tlenki, kwasy, niemetale. c) tlenki, kwasy, niemetale. 5. Sole kwasu krzemowego: a) krzemki; b) wodorokrzemiany; c) krzemiany; a) krzemki; b) wodorokrzemiany; c) krzemiany;

Krzem.
Krzem - element głównej podgrupy IV grupy III okresu układu okresowego pierwiastków chemicznych DI Mendelejewa, o liczbie atomowej 14, masa atomowa: 28,0855. W związkach zwykle wykazuje stopień utlenienia +4 (wartościowość IV) i bardzo rzadko +3, +2 i +1 (wartościowości, odpowiednio, III, II i I). W układzie okresowym krzem Mendelejewa znajduje się w grupie IVA (A-wskazuje, że jest to główna podgrupa) (w grupie węglowej) w trzecim okresie. Nemetall . Oznaczony symbolem Si(lat Krzem). W postaci wolnej - brązowy proszek lub jasnoszary zwarty materiał z metalicznym połyskiem. Struktura kraty: sześcienny, diament.
Stan główny: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, element p.
2. Właściwości fizyczne.
Krystaliczny krzem jest ciemnoszarą substancją o stalowym połysku. Struktura krzemu jest podobna do struktury diamentu. W swoim krysztale każdy atom jest otoczony czworościennymi czterema innymi i jest z nimi połączony wiązaniem kowalencyjnym, które jest znacznie słabsze niż pomiędzy atomami węgla w diamentie. W krysztale krzemu, nawet w normalnych warunkach, niektóre wiązania kowalencyjne są niszczone. Dlatego ma wolne elektrony, które powodują małą przewodność elektryczną. Gdy oświetlenie i ogrzewanie zwiększają liczbę zerwanych wiązań, co oznacza, że liczba wolnych elektronów wzrasta, a przewodność elektryczna wzrasta. Wyjaśnij więc właściwości półprzewodnika krzemu.
Krzem jest bardzo delikatny, jego gęstość wynosi 2,33 g / cm3. Podobnie jak węgiel, odnosi się do substancji ogniotrwałych.
Krzem składa się z trzech stabilnych izotopów: 2814Si (92,27%), 2914Si (4,68%) i 3014Si (3,05%).
3. Bycie w naturze.
Najczęściej w przyrodzie krzem występuje w formie krzemionka - związki na bazie dwutlenku krzemu (IV) SiO2 (około 12% masy skorupy ziemskiej). Głównymi minerałami i skałami utworzonymi przez dwutlenek krzemu są piasek (rzeka i kwarc), kwarc i kwarcyt, krzemień i skalenie. Naturalne krzemiany mają złożony skład i strukturę. Oto skład niektórych naturalnych krzemianów:
ü skalenie K 2 O × Al 2 O 3 × 6SiO 2,
ü azbest 3MgO × 2SiO 2 × 2H 2 O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2 H 2 O,
ü kaolinit 3Al 2O 3 × 2SiO 2 × 2H 2 O.
Drugą najczęstszą grupą w przyrodzie związków krzemu jest krzemiany i glinokrzemiany
Odnotowano pojedyncze fakty dotyczące znalezienia czystego krzemu w natywnej postaci.
4. Właściwości chemiczne krzemu i jego związków.
Przez właściwości chemiczne krzem, podobnie jak węgiel, jest niemetalem, ale jego niemetaliczność jest mniej wyraźna, ponieważ ma większy promień atomowy. Ponieważ atomy krzemu mają 4 elektrony na poziomie energii zewnętrznej, stan utlenienia zarówno -4, jak i +4 jest charakterystyczny dla krzemu (znany jest związek krzemu, gdzie jego stopień utlenienia wynosi +2).
Krzem w normalnych warunkach jest raczej obojętny, co należy tłumaczyć siłą jego sieci krystalicznej. Bezpośrednio współdziała tylko z fluor:
Kwasy (z wyjątkiem mieszaniny fluorowodoru HF i azotowego HNO 3)krzem nie działa. Rozpuszcza się jednak w wodorotlenkach metali alkalicznych, tworząc krzemian i wodór:
Spośród dwóch alotropowych modyfikacji krzemu, krystaliczny i amorficzny, amorficzny krzem jest bardziej aktywny chemicznie. On reaguje z tlenem po podgrzaniu, tworząc SiO 2:
jak również ze wszystkimi halogenyna przykład:
![]()
W wysokiej temperaturze krzem łączy się z węglemformowanie karborundu SiC:
Karborund ma sieć krystaliczną podobną do diamentu, w której każdy atom krzemu jest otoczony czterema atomami węgla i odwrotnie, a wiązania kowalencyjne są bardzo silne, jak w przypadku diamentu. Dlatego w twardości jest zbliżony do diamentu. Kamienie szlifierskie i ściernice są wykonane z węglika krzemu.
Krzemek magnezu. W reakcjach z metalami aktywnymi, występującymi przy powstawaniu krzemki, Krzem działa jako środek utleniający:
W wysokich temperaturach krzem odzyskuje wiele metali ze swoich tlenków. (!!!)
Silane Pod działaniem kwasu chlorowodorowego na krzemki najprostszym związkiem wodoru w krzemie jest silan SiH4:
Silan jest trującym gazem o nieprzyjemnym zapachu, samozapalnym w powietrzu (!!!):
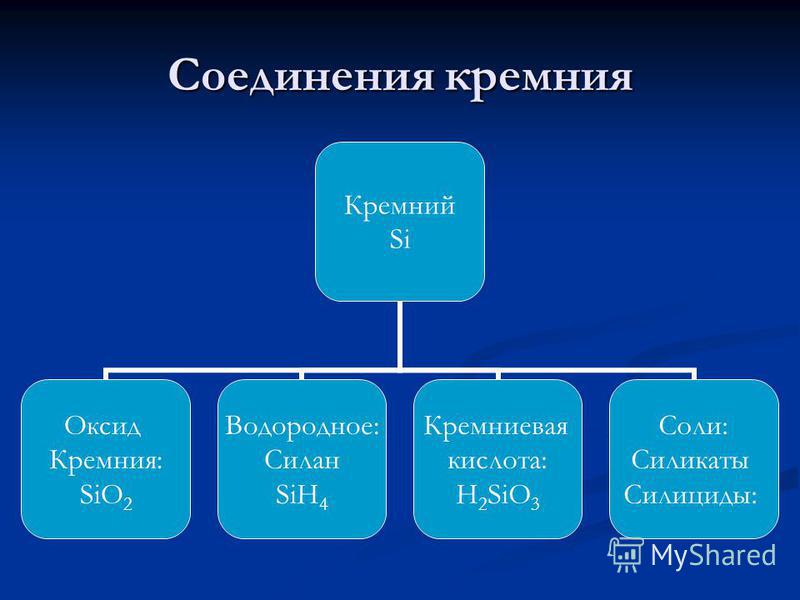
Tlenek krzemu (IV).Nazywany jest także tlenkiem krzemu (IV) krzemionka. Jest to stała substancja ogniotrwała. (temperatura topnienia 1700 ° C) rozpowszechniony w naturze w dwóch formach:
1) krzemionka krystaliczna - w postaci minerału kwarcu i jego odmian (kryształ górski, chalcedon, agat, jaspis, krzemień); kwarc stanowi podstawę piasków kwarcowych szeroko stosowanych w budownictwie i przemyśle krzemianowym;
2) bezpostaciowa krzemionka - w postaci opalowej kompozycji mineralnej SiO 2 × n H2O; ziemskie formy bezpostaciowej krzemionki to diatomit, tripoli (ziemia infuzyjna); przykładem sztucznej bezpostaciowej bezwodnej krzemionki jest żel krzemionkowy, który otrzymuje się z metakrzemianu sodu:
Żel krzemionkowy ma rozwiniętą powierzchnię i dlatego dobrze wchłania wilgoć. .
Przy 1710 ° topi się kwarc. Wraz z szybkim chłodzeniem powstaje stopiona masa szkło kwarcowe . Ma bardzo niski współczynnik rozszerzalności, dzięki czemu gorące szkło kwarcowe nie pęka, gdy woda jest szybko chłodzona. Szkło laboratoryjne i narzędzia do badań naukowych są wykonane ze szkła kwarcowego.
Najprostsza formuła tlenku krzemu (IV) SO 2 jest podobna do wzoru tlenku węgla (IV) CO 2. Tymczasem ich właściwości fizyczne są bardzo różne (SiO 2 - ciało stałe, CO2 - gaz). Ta różnica wynika ze struktury sieci krystalicznych. C02 krystalizuje w sieci molekularnej SiO2 - w atomie. Strukturę SiO 2 w obrazie planarnym można przedstawić w następujący sposób:
Liczba koordynacyjna atomu węgla w stałym CO2 wynosi 2, a krzem w SiO 2 wynosi 4. Każdy atom krzemu jest zamknięty w czworościanie 4 atomów tlenu. W tym samym czasie atom krzemu znajduje się w centrum, a atomy tlenu znajdują się w wierzchołkach czworościanu . Cały kawałek krzemionki można uznać za kryształ, którego wzór to (SiO 2) n. Ta struktura tlenku krzemu (IV) określa jego wysoką twardość i ogniotrwałość .
Właściwości chemiczne tlenku krzemu (IV) SiO2 odnoszą się do tlenków kwasowych. Podczas łączenia ze stałymi alkaliami, zasadowymi tlenkami i węglanami tworzą się sole kwasu krzemowego:
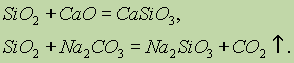
Jedynie kwas fluorowodorowy oddziałuje z tlenkiem krzemu (IV):
Ta reakcja służy do wytrawiania szkła. .
Krzem (IV) nie rozpuszcza się w wodzie i nie wchodzi w interakcje z chemikaliami. (!!!) Dlatego kwas krzemowy otrzymuje się pośrednio przez działanie kwasem na roztwór krzemianu potasu lub sodu:
W tym przypadku kwas krzemowy (w zależności od stężenia początkowych roztworów soli i kwasu) można otrzymać zarówno w postaci żelatynowej masy zawierającej wodę, jak iw postaci roztworu koloidalnego (zolu).
Kwas krzemowy. SiO2 jest bezwodnikiem wielu kwasów krzemowych, których skład może być wyrażony ogólnym wzorem: xSiO 2 × yH 2 O, gdzie x i y - liczby całkowite:
1) x = 1, y = 1: SiO2 × H2O, tj. H2SiO3 - kwas metakrzemowy;
2) x = 1, y = 2: SiO2 × 2H2O, tj. H4 SiO4 - kwas ortokrzemowy;
3) x = 2, y = 1: 2SiO 2 × H2O, tj. H 2 Si 2 O 5 - kwas bimetakrynowy.
Kwas krzemowy zbudowany jest z czworościennych jednostek strukturalnych (w każdej takiej jednostce atom krzemu znajduje się w środku czworościanu, aw jego wierzchołkach znajdują się atomy tlenu). Połączenia strukturalne, łączące się w łańcuchy, tworzą bardziej stabilne kwasy polisilikonowe:
Skład takich związków można wyrazić wzorem (H2SiO3) n. Jednak zwykle kwas krzemowy jest reprezentowany wzorem H 2 SiO 3. H 2 SiO 3 - kwas jest bardzo słaby, mało rozpuszczalny w wodzie. Po podgrzaniu łatwo rozkłada się jak kwas węglowy:
Wszystkie kwasy krzemowe są bardzo słabe (słabsze niż węgiel).
Krzemiany. Nazywane są sole wszystkich kwasów krzemowychkrzemiany, chociaż z reguły w literaturze edukacyjnej krzemiany oznaczają sole kwasu metakrzemowego. Ich skład jest zwykle reprezentowany przez formułę w postaci związków tlenków pierwiastków. Na przykład krzemian wapnia CaSiO3 można wyrazić jako: CaO x SiO2.
Krzemiany o składzie R 2 O × nSiO 2, gdzie R 2 O - tlenki sodu lub potasu , są nazywane rozpuszczalne szkło , a ich stężone roztwory wodne - płynne szkło . Najważniejsze jest szkło sodowo-sodowe..
Stojąc w powietrzu, roztwory krzemianów stają się mętne, ponieważ dwutlenek węgla (IV) w powietrzu wypiera kwas krzemowy z jego soli:
Kwas krzemowy jest praktycznie nierozpuszczalny w wodzie - ta właściwość jest stosowana jako reakcja jakościowa na jon SiO 3 2-.
Krzemiany otrzymuje się przez stopienie krzemionki z alkaliami lub węglanami:
5. Odkrycie jonu SiO 3 2. (nic nie mogę znaleźć ...)
6. Rola związków krzemu w tworzeniu gleby i leśnictwie.
Skały magmowe są dość stabilne w swoim składzie i zawierają głównie związki krzemu, glinu, żelaza, alkaliów, magnezu i wapnia. Zgodnie z zawartością Si0 2, skały magmowe dzielą się na cztery grupy: kwasowe (\u003e 65%), średnie (52-65%), podstawowe (40-52%) i ultrabasiczne (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Kwaśne skały magmowe- granity, pegmatyty, ryolity, daktyle i inne - zwykle mają jasny i brązowawy kolor z wyraźnymi kryształami kwarcu, skalenia, miki. Zawartość SiO 2 w nich jest wysoka (ponad 65%) ze znaczną ilością potasu i sodu. Jednocześnie mało żelaza, wapnia i magnezu jest znikomy. Gleby na kwaśnych skałach magmowych, na przykład na granitach, różnią się we wczesnych stadiach wietrzenia przez kruchość, żwirowy charakter materiału źródłowego. Po zwietrzeniu w wilgotnych warunkach łatwo tracą pierwiastki ziem alkalicznych, w wyniku czego gleba na takich zwietrzałych podłożach (żwirze skał) jest wyjątkowo słaba, słabo płodna.
Główne skały magmowe -bazalt, gabro itp. mają z reguły kolor ciemny (do czarnego). Charakteryzują się niższą zawartością SiO2 w porównaniu do skał kwaśnych. Główne skały magmowe są stosunkowo bogate w związki żelaza, manganu, chromu, kobaltu, cynku, tytanu, niklu, miedzi. Produkty ich wietrzenia dość szybko zyskują charakter gliny, zachowują odczyn zasadowy i obojętny przez długi czas i wyróżniają się zwiększoną zawartością próchnicy i minerałów ilastych. Gleba na takich skałach jest bardziej płodna.
Oprócz kwaśnych i podstawowych gatunków często występują skały magmowe typu przejściowego(średnie) - natrętne skały grupy diorytów i ich wylewne odpowiedniki - andezyty. W związku z tym gleby na tych skałach uzyskują cechy podobne do tych ograniczonych do skał kwaśnych lub zasadowych. Znacznie rzadziej rasy ultrabasic:perydotyty i pikryty, które mają najniższą zawartość SiO2.
Skały metamorficzne -przejściowe między masywnymi skałami krystalicznymi i osadowymi. Starożytne skały osadowe nurkowane, wysokie ciśnienie i temperatury są metamorfizowane, tworząc gnejsy, serpentynity, marmur, kwarcity, łupki. Gnejsy są szczególnie podobne pod względem składu do granitów. Gleby, które tworzą się na takich skałach, mają cechy podobne do gleb samych kwaśnych skał magmowych.
Chlor.
1. Pozycja aluminium w tabeli D. I. Mendelejew. Struktura atomu, przejaw stopnia utlenienia.
Chlor - element głównej podgrupy grupy VII, trzeci okres, o liczbie atomowej 17. Jest oznaczony symbolem Cl (łac. Chlorum). Aktywny chemicznie niemetalowy . Zawarte w grupie halogenowej .
Prosty chlor w zwykłych warunkach - trujący gaz żółtawozielony kolor jest cięższy od powietrza, o silnym zapachu . Cząsteczka chloru okrzemkowego (wzór Cl 2).
Stan główny: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, element p. Art.: -1 +1 +3 +5 +7.
Struktura powłoki elektronowej.
Na poziomie walencyjnym zawiera atom chloru 1 niesparowany elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, więc wartość 1 dla atomu chloru jest bardzo stabilna. Ze względu na obecność w atomie chloru niezajętych orbitali pod-poziomu, atom chloru może wykazywać inne stopnie utlenienia. Schemat tworzenia stanów wzbudzonych atomu:
Znane są również związki chloru, w których atom chloru formalnie wykazuje wartościowość 4 i 6, na przykład ClO2 i Cl2O6. Jednak te związki są rodnikami, to znaczy mają jeden niesparowany elektron.
2. Właściwości fizyczne.
W normalnych warunkach chlor jest żółto-zielonym gazem o duszącym zapachu. Niektóre z jego właściwości fizycznych przedstawiono poniżej.
Gęstość: 3,214 g / l, ciecz - w -35 ° C - 1,557, telewizor. przy -105 0 С- 1,9 g / cm 3.
Temperatura topnienia: 172,2 K
Temperatura wrzenia: 238,6 K
Ciepło topnienia: 6,41 kJ / mol
Ciepło parowania: 20,41 kJ / mol.
Chlor gazowy jest stosunkowo łatwy do skroplenia. Począwszy od ciśnienia 0,8 MPa (8 atmosfer), chlor będzie płynny już w temperaturze pokojowej. Po ochłodzeniu do temperatury -34 ° C, chlor również staje się ciekły przy normalnym ciśnieniu atmosferycznym. Płynny chlor jest żółto-zieloną cieczą o bardzo wysokim działaniu korozyjnym (ze względu na wysokie stężenie cząsteczek). Zwiększając ciśnienie, można osiągnąć istnienie ciekłego chloru do temperatury +144 ° C (temperatura krytyczna) przy ciśnieniu krytycznym 7,6 MPa. Pod względem przewodności elektrycznej, ciekły chlor ma miejsce wśród najsilniejszych izolatorów: przewodzi prąd prawie miliard razy gorszy niż woda destylowana i 10 22 razy gorszy niż srebro. Prędkość dźwięku w chlorze jest około półtora razy mniejsza niż w powietrzu.
3. Bycie w naturze.
W naturze występują dwa izotopy chloru 35 Cl i 37 Cl. Chlor jest najpowszechniejszym halogenem w skorupie ziemskiej. . Chlor jest bardzo aktywny - łączy się bezpośrednio z prawie wszystkimi elementami układu okresowego. Dlatego w naturze występuje tylko w postaci związków w składzie minerałów:
ü halit NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl 2 · 6H 2 O,
ü karnalit KCl · MgCl 2 · 6H 2 O,
ü Kainit KCl · MgSO 4 · 3H 2 O.
Największe rezerwy chloru zawarte są w solach, wodach, morzach i oceanach (zawartość w wodzie morskiej wynosi 19 g / l). Chlor stanowi 0,024% całkowitej liczby atomów w skorupie ziemskiej; numer Clarke'a (liczby wyrażające średnią zawartość pierwiastków chemicznych w skorupie ziemskiej, hydrosferze, Ziemi, ciałach kosmicznych, układach geochemicznych lub kosmochemicznych itp., w stosunku do całkowitej masy tego układu. Wyraża się ją w% lub g / kg). chlor - 0,017%. Ludzkie ciało zawiera wagowo 0,25% jonów chloru. U ludzi i zwierząt chlor występuje głównie w płynach międzykomórkowych (w tym we krwi) i odgrywa ważną rolę w regulacji procesów osmotycznych, jak również w procesach związanych z pracą komórek nerwowych.
4. Właściwości chemiczne chloru i jego związków. Uzyskiwanie chloru.
Struktura atomu krzemu. Si. +14. Stan podekscytowany. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Zdjęcie 3 prezentacji „Silicon” na lekcje chemii na temat „krzemu”Wymiary: 960 x 720 pikseli, format: jpg. Aby pobrać darmowy obraz na lekcję chemii, kliknij obraz prawym przyciskiem myszy i kliknij „Zapisz obraz jako ...”. Aby pokazać zdjęcia w lekcji, możesz również pobrać prezentację „Silicon.ppt” za darmo ze wszystkimi zdjęciami w archiwum zip. Rozmiar archiwum - 562 KB.
Pobierz prezentacjęKrzem
„Krzem i jego związki” - struktura i właściwości atomów. Półprzewodnik. t stop (Si) = 1415 ° C, t stopu (diament) = 3730 ° C. Uzyskiwanie krzemu. Odkrycie krzemu. Zawarte także w składzie roślin i zwierząt. Właściwości fizyczne krzemu. Cegła jest więc ceramiką, a płytki i fragmenty starożytnej greckiej amfory są również ceramiką. Cele: Właściwości chemiczne krzemu.
„Związki krzemu” - krzem i jego związki. Właściwości chemiczne SiO2. Silane Uzyskiwanie kwasu krzemowego. Właściwości krzemu. Tlenek krzemu. Naturalne krzemiany. Stan utleniania Rhinestone Topaz. Zdobycie krzemu w laboratorium. Bycie w naturze. Sieci krystaliczne. Odkrycie krzemu. Ametyst. Uzyskiwanie krzemu.
„Izotopy krzemu” - rozdział izotopów krzemu. Produkcja krzemu polikrystalicznego. Perspektywy użycia krzemu monoizotopowego. Rozcieńczenie izotopowe przy hodowli pojedynczego kryształu z tygla kwarcowego. Produkcja nasion pojedynczego kryształu. Zależność położenia maksimum pasma Ramana na masie atomowej.
„Lekcja silikonowa” - Który z najważniejszych pierwiastków chemicznych w żywej i nieożywionej naturze? Tlenki węgla i krzemu. Substancja jest przezroczysta. O manifestacji właściwości niemetalicznych i metalicznych. Podsumowanie refleksji. Końcowe testy. Tlenki węgla i wodorotlenki krzemu? Stan agregacji: a) ciecz, b) gaz, c) ciało stałe.
„Krzem” - Krzem jest prostą substancją. Właściwości fizyczne. Tlenek krzemu (IV). Krzemki Znaczenie dla organizmów żywych. Interakcja z metalami. Interakcja z niemetalami. Węglik krzemu. Krzem w naturze. Krzem. Produkty przemysłu krzemianowego. Jednym z rodzajów naturalnych związków krzemu są krzemiany.
„Węgiel i krzem” - tlenek krzemu (IV). Elementy grupy IV głównej podgrupy. Toksyczność. 7. Interesujące o węglu. Krzemiany. Poślizg w dotyku. Diament jest najtwardszą naturalną substancją. Właściwości chemiczne Ponad 99% węgla w atmosferze ma postać dwutlenku węgla. Węgliki. 6. Zastosowanie. Jeden z najłagodniejszych wśród ciał stałych.
Łącznie jest 6 prezentacji.
