Wzór chemiczny kwasu siarkowego. Kwas siarkowy: właściwości chemiczne, przygotowanie
H2SO3, słaby kwas dwuzasadowy. W formie wolnej nie jest alokowany, istnieje w roztworach wodnych. Siarczany kwasu siarkowego ... Wielki słownik encyklopedyczny
Kwas siarkowy - (H2SO3) słaby kwas dwuzasadowy. Występuje tylko w roztworach wodnych. Sole S. do. Siarczyny. Stosowany w przemyśle celulozowym i przemyśle spożywczym. Zobacz także Kwasy i bezwodniki ... Rosyjska encyklopedia o ochronie pracy
kwas siarkowy - - [A.S. Goldberg. Angielski rosyjski słownik energetyczny. 2006] Tematy energii w ogóle EN kwas siarkawy ... Technical Translator's Guide
H2SO3, słaby kwas dwuzasadowy. W formie wolnej nie jest alokowany, istnieje w roztworach wodnych. Siarczany kwasu siarkowego. * * * Kwas siarkowy, kwas siarkowy, H2SO3, słaby kwas dwuzasadowy. Bezpłatne nie jest wybrane, ... ... Słownik encyklopedyczny
kwas siarkowy - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. kwas siarkowy rus. kwas siarkowy ryšiai: sinonimas - vandenilio trioksosulfatas (2-) ... Chemijos terminų aiškinamasis žodynas
H2SO3, słaby kwas dwuzasadowy, odpowiadający stopniowi utlenienia siarki +4. Znany tylko w rozcieńczonych roztworach wodnych. Stałe dysocjacji: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18 ° C). Daje dwa rzędy soli: normalne siarczyny i kwas ... Wielka sowiecka encyklopedia
H2SO3, słaby kwas dwuzasadowy. W wolnej formie nie jest podświetlona, istnieje w wodach. p rah. Sole S. k. Siarczyny ... Nauka przyrodnicza. Słownik encyklopedyczny
Zobacz Siarka ... Słownik encyklopedyczny FA Brockhaus i I.A. Efrona
Dwutlenek siarki (dwutlenek) powstaje przez spalanie siarki w powietrzu lub w tlenie. Otrzymuje się go również przez kalcynowanie w powietrzu ("palenie") siarczków metali, na przykład pirytów żelaza:
Zgodnie z tą reakcją dwutlenek siarki zwykle uzyskuje się w przemyśle (dla innych przemysłowych metod otrzymywania cm, 9 § 131).
Dwutlenek siarki jest bezbarwnym gazem ("dwutlenkiem siarki") o ostrym eapachu gorącej siarki. Skrapla się dość łatwo w bezbarwną ciecz. Kiedy ciecz paruje, następuje silny spadek temperatury (przed).
Dwutlenek siarki jest wysoce rozpuszczalny w wodzie (około 40 objętości w 1 objętości wody w); w tym samym czasie następuje reakcja z wodą i powstaje kwas siarkawy:
Tak więc dwutlenek siarki jest bezwodnikiem kwasu siarkowego. Po podgrzaniu rozpuszczalność maleje, a równowaga przesuwa się w lewo; stopniowo cały dwutlenek siarki ponownie uwalnia się z roztworu.
Cząsteczka zbudowana jest podobnie do cząsteczki ozonu. Jądra jego składowych atomów tworzą trójkąt równoramienny:
Tutaj atom siarki, podobnie jak centralny atom tlenu w cząsteczce ozonu, znajduje się w stanie hybrydyzacji α, a kąt jest bliski. Zorientowany prostopadle do płaszczyzny cząsteczki, orbital atomu siarki nie uczestniczy w hybrydyzacji. Z powodu tych orbitali i podobnie zorientowanych orbitali atomów tlenu powstaje trójśrodkowe wiązanie; Para elektronów niosąca ją należy do wszystkich trzech atomów cząsteczki.
Dwutlenek siarki jest wykorzystywany do produkcji kwasu siarkowego, a także (w znacznie mniejszych ilościach) do bielenia słomy, wełny, jedwabiu i jako środek dezynfekujący (do niszczenia grzybów pleśniowych w piwnicach, piwnicach, beczkach z winem, zbiornikach fermentacyjnych).
Kwas siarkowy jest bardzo delikatnym związkiem. Znany jest tylko w roztworach wodnych. Próbując wyizolować kwas siarkawy, rozpada się on na wodę. Na przykład, gdy stężony kwas siarkowy działa na siarczyn sodu, dwutlenek siarki jest uwalniany zamiast kwasu siarkowego:
Roztwór kwasu siarkowego należy chronić przed powietrzem, w przeciwnym razie absorbując tlen z powietrza, powoli utlenia się do kwasu siarkowego:
Kwas siarkowy jest dobrym środkiem redukującym. Na przykład wolne halogeny są przywracane do halogenków wodoru:
![]()
Jednak przy oddziaływaniu z silnymi reduktorami kwas siarkowy może odgrywać rolę czynnika utleniającego. Tak więc jego reakcja z siarkowodorem przebiega głównie zgodnie z równaniem:
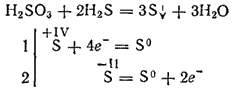
Będąc dwuzasadowym, kwas siarkawy tworzy dwa rzędy soli. Jego średnie sole nazywane są siarczynami, kwaśnymi solami - hydrosulfitami.
Podobnie jak kwas, siarczyny i hydrosulfity są środkami redukującymi. Gdy są utleniane, otrzymuje się sole kwasu siarkowego.
Siarczyny najaktywniejszych metali podczas kalcynacji rozkładają się wraz z powstawaniem siarczków i siarczanów (reakcja samo-utleniania - samo-redukcja):
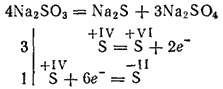
Siarczany potasowe i sodowe służą do bielenia niektórych materiałów w przemyśle tekstylnym do barwienia tkanin w fotografii. Roztwór (ta sól istnieje tylko w roztworze) służy do przetwarzania drewna w tak zwaną pulę siarczynową, z której następnie otrzymuje się papier.
Kwas siarkawy jest w stanie reagować z tlenem. Tworzy to kwas siarkowy. Ta reakcja trwa bardzo długo i jest możliwa tylko w przypadku naruszenia zasad przechowywania. Kwas siarkowy ma właściwości zarówno utleniające, jak i redukujące. Z jego pomocą można uzyskać kwasy halogenowe. Wodny roztwór podczas reakcji z chlorem tworzy kwas solny i siarkowy.
Podczas reakcji z silnymi reduktorami kwas siarkowy pełni rolę czynnika utleniającego. Jedną z tych substancji jest siarkowodór, gaz o bardzo nieprzyjemnym zapachu. Oddziałując z wodnym roztworem kwasu siarkowego, tworzy siarkę i wodę. Sole kwasu siarkowego mają również właściwości redukujące. Są one podzielone na siarczyny i hydrosulfity. Reakcje utleniania tych soli dają kwas siarkowy.
Produkcja kwasu siarkowego
Kwas siarkowy powstaje tylko w wyniku oddziaływania dwutlenku siarki i wody. Potrzebujesz dostać kwaśnego gazu. Można to zrobić za pomocą miedzi i kwasu siarkowego. Delikatnie wlej stężony kwas siarkowy do tuby i wrzuć do niego kawałek miedzi. Podgrzej lampę lampą spirytusową.
W wyniku ogrzewania powstaje siarczan miedzi (siarczan miedzi), woda i dwutlenek siarki, które za pomocą specjalnej rurki należy doprowadzić do stożka z czysta woda. W ten sposób można uzyskać kwas siarkowy.
Pamiętaj, że dwutlenek siarki jest szkodliwy dla ludzi. Powoduje uszkodzenie dróg oddechowych, utratę apetytu i ból głowy. Długotrwałe wdychanie może powodować omdlenie. Podczas pracy z nim należy zachować ostrożność.
Zastosowanie kwasu siarkowego
Kwas siarkowy ma właściwości antyseptyczne. Znajduje zastosowanie w dezynfekcji powierzchni, fermentacji ziarna. Może być stosowany do wybielania niektórych substancji, które rozkładają się, gdy reagują z silnymi utleniaczami (na przykład chlor). Takie substancje obejmują wełnę, jedwab, papier i inne. Jego właściwości antybakteryjne są stosowane w celu zapobiegania fermentacji wina w beczkach. Tak więc szlachetny napój może być przechowywany przez bardzo długi czas, uzyskując szlachetny smak i wyjątkowy aromat.
Kwas siarkowy jest wykorzystywany do produkcji papieru. Dodatek tego kwasu zawarty jest w technologii produkcji celulozy siarczynowej. Następnie traktuje się roztworem wodorosiarczynu wapnia, aby związać ze sobą włókna.
