Spoluki sirki. Fone oksiduoto vandens žingsniai. Formulės su pussirkiu. Syrka. Sirvodenas. sulfidas
Sirka, її fizinės ir cheminės institucijos. Biologinė syrki reikšmė, її zasosuvannya (demerkurizacija).
Siera gamtoje
gimtoji sirka
PbS - švino blisk
Cu 2 S- midniy blisk
ZnS - cinko mišinys
FeS 2 - piritas, piritas, kotijos auksas
H 2 S- sirvandenis (mineraliniuose dzhereliuose ir gamtinėse dujose)
CaSO 4 * 2H2O- klubai
MgSO 4 * 7H2O- girka sil (anglų k.)
Na2SO4*10H2O- glauber's sil (mirabilitas)
Fizinė galia
Tos pačios spalvos vientisa kristalinė kalba, nedūžtanti prie vandens, vanduo nesušlampa (plaukioja paviršiuje), t ° rulonas = 445 ° С.
Viena iš ypatingų sirkos fizinių galių -flotacijaMilteliai sulieja vandenį, kuris yra puikūs kristalai, kurie gali nuskęsti šalia vandens. Dešinėje, kur vanduo neskęsta, o dalelės yra apipjaustytos vandens paviršiuje, o kitos lemputės prilipo prie jų rakhunoku.Piktumo galia matant vietines sėklas iš namų. Rūda yra sekli, užlieta vandeniu, o iš apačios ją išpučia vėjai, vandens purslai, o namai apačioje prisipildo vandens.alotropija
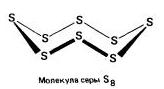
Serkiams būdingas alotropinių modifikacijų pabarstymas, ale nibilsh vіdomі vidosmіni:rombinis (Kristolinis) , monoklina(Holchasta) і plastmasinis .
Rombinis (a – сірка) – S 8
t ° pl. = 113 °C; ρ = 2,07 g / cm 3. Geriausia įmanoma modifikacija.
Monoklina (b – sirka) – S 8
tamsios spalvos galvos, t ° pl. = 119 °C; ρ = 1,96 g / cm3. Kepsnys iki 96 ° C temperatūroje; šmaikščiais protais jis pavirs rombu.
Plastmasinis S n
rudos spalvos guma panaši (amorfinė) masė. Nestiyka, sustingęs pavirs deimantu.
PLASTIKO IŠĖMIMAS
Sirkos Budova atomas
Elektronikos pasiskirstymas pagal lygius ir polygius
pagrindinė stovykla
1s 2 2s 2 2p 6 3s 2 3p 4
Elektronikos platinimas pagal
orbitos (poilsio kamuolys)žingsnis
oksiduotasvalentingumas
Pagrindinėje stovykloje
Perche zbujeniy stan
Kitas zbujeniy stan
otrimannya sіrki
1. Promisloviy metodas - viplavlenya iš rūdos už papildomą vandens statymą.
2. Ne visiškai oksiduotas vanduo (su nerūgštiniu rūgštingumu).
2H 2S + O 2 = 2S + 2H2O
3. Wackenroderio reakcija
2H 2 S + SO 2 = 3S + 2H 2 O
Pasaulio galios chemija
Сірка – oksiduojantis S 0 + 2ē→ S -2 | sirka - pagrindinis pareigūnas: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Vzaєmodia sіrki sinaudokite su sodriais ir įžemintais metalais, middy, mercury, siblombe šildymo: 2 Na + S→ Na 2 S DOSVID S + Hg = HgS Gyvsidabris yra nepastovus. Її bet otruynі. Tsya reakcija slypi regėjimo ir magnetinio gyvsidabrio pagrindu, pavyzdžiui, iš sugedusio medicininio termometro. Mіstya, nes negalima panaudoti nė dėmės gyvsidabrio, pabarstyti sіrki milteliais. Syrka ir gyvsidabris reaguoja, kai jie uždaromi. Rezultatas – įžūli, neprotinga ir ne nuobodu kalba. Visas procesas vadinamas demerkurizacija 2. Vzaєmodiya sіrkic su mažiausiais metalais (krim Au, Pt) esant reguliuojamam t °: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS DOSVID Cu + S t
→
CuS DOSVID 3. Vzaєmodia sіrki zdeyakim nemetalai pareiškimams binarny spoluk: H2 + S→ H2S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Vzaєmodіya sіrki su kisnem: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Vzaєmodiya sіrkic halogenai (išskyrus jodą): S + Cl 2→ S +2 Cl 2 ** Vzamodiya sirki zrūgštys - oksidatoriai: S + 2H 2 SO 4 (konc.)→ 3S +4 O2 + 2H2O S + 6HNO 3 (konc.)→ H2S +6O4 + 6NO2 + 2H2O ** Neproporcingos reakcijos: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
čiulpti
Gumos vulkanizavimas, ebonito atmetimas, sirnikų, parako ištrynimas, kovojant su Silskojaus vyriausybės moksleiviais, medicininiais tikslais (sirchano tepalai vaikams naikinti nuo ligų ir kt.), rūgščių atmetimui
Pradžia zavdannya21 dalis; dešinėje 1, 3, 4 pusėje. 99-100.
dodatkovі zkhadanіya
Užbaikite standartines reakcijas, p Nustatykite našumą naudodami elektroninio balanso metodą, įskaitant oksidatorių, pirmtaką.
#2. Zdіysnіt peržiūra už schemos:
Tse tsikavo...
- Vietoj sirkių 70 kg sveriančių žmonių organizme – 140 g.
- Dobu žmonėms reikia 1 g sirkos.
- Žalieji bagati žirneliai, raugas, plastikai, kviečiai, mėsa, riba, vaisiai ir mangai.
- Syrka turėtų patekti į hormonų, vitaminų, biliukų sandėlį, įgaunamas kremzlės audinyje, plaukuose, nešvarus. Kai organizme trūksta jutimo, trūksta naktų ir cistų traškumo, slenka plaukai.
Mėgaukitės savo sveikata!Chi tu žinai vi..
- Spoluki sirki gali būti naudojami kaip vaistai;
- Сірка yra tepalo, skirto škiri grybelinėms ligoms gydyti, kovai su šašais, pagrindas. Natrio tiosulfatas Na 2 S 2 O 3 pergalingas kovoti už ją.
- Daug druskos rūgšties druskų ir kristalizacijos vandeniui ištirpinti: ZnSO 4 × 7H 2 O × CuSO 4 × 5H 2 O. Їх zasosovuyut jako antiseptikas naudojamas rozlinui išlyginti ir grūdams smulkinti kovoje su Silskojaus vyriausybės moksleiviais.
- Zalizny vitriol FeSO 4 × 7H 2 O vicoristovy su anemija.
- BaSO 4 zasosovyat esant rentgenografinėms žarnyno slinkimo dozėms.
- Alumokalіevі galun KAI (SO 4) 2 × 12H 2 O - kraujo-stuburo augimas poringumu.
- Mineralas Na 2 SO 4 × 10H 2 Pavadinsiu jį „Glauberio galia“ Glauberio chemiko I.R. garbei. Visai ne, bet slunkeris buvo sukurtas priimti. Vienas iš miesto gyventojų išsiuntė jį į dzherelį. Yak tilki vin vipiv buteliuką sūraus vandens, iš karto žemė permirksta. Glauberis pasiekė vandenį, tada kristalizavosi su Na 2 SO 4 × 10H 2 O. Contagion її zasosovyat jakas yra vežamas medicinoje, su farbuvannі medvilniniais popieriniais audiniais. Jį taip pat galite rasti vyrobnitsvі skloje.
- Medžiai gali išjudinti dirvožemio konstrukciją nuo žemės ir paskatinti elemento sukibimą su kabančia rasa.
- Chasnik vidіlyaє rechovinu - albucidas Tsya kalba susirgus, pasitikėjimas senais, širdžių įveikimas susirgus.
Į chalkogenų grupę įeina sirka – daugybė kitų elementų, pavyzdžiui, daugybė rūdinių genčių. Sulfatai, sulfidai, oksidai ir spuogeliai yra dar platesni, svarbūs pramonėje ir gamtoje. Į tai statistikos duomenyse aišku, kaip smarvė, kuri barška, bet tai pati sirka, o kalba paprasta.
Syrka ir її charakteristikos
Danišką elementą galima rasti ir periodinėje sistemoje.
- Šosta grupė, grupės vadovas.
- Trečiasis Maliy laikotarpis.
- Atominė masė - 32,064.
- Serijos numeris yra 16, protonų ir elektronų stiliaus, neutronų taip pat yra 16.
- Leidžiamas nemetaliniams elementams.
- Skaitomos formulės, jak "es", elemento pavadinimas sirka, lotyniškas siera.
Gamtoje yra chotiri stabilių izotopų, kurių masės skaičiai yra 32.33.34 ir 36. Danija yra geriausias elementas plėsti gamtoje. Supažindinkite su biogeniniais elementais, kad patektumėte į svarbių organinių molekulių sandėlį.
Elektronų budova atomas
Spolukai savo universalumu yra susieti su atomo elektroninio biudžeto ypatumais. Vono pasukite puolimo konfigūracijos formulę: 1s 2 2s 2 2p 6 3s 2 3p 4.
Užsakymas rodomas sumontavus stacionarų malūną. Tačiau atrodo, kad jei atrodo, kad atomas turi papildomos galios, tada galima suskaidyti elektronus į 3p ir 3s-paraleles, toliau pereinant prie 3d, kas, atrodo, galioja. Dėl to kinta ne tik atomo valentingumas, bet visose įmanomose oksidacijos stadijose. Tai reikšmių skaičius, kurį reikia padidinti, taigi ir žodžių, skirtų syrkos dalyvavimui, skaičius.
Oksiduoto vandens žingsniai per dieną
Galite pamatyti keletą pagrindinių šio rodiklio parinkčių. Dėl sіrki tse:
Tarp jų rečiausias vystymasis yra S +2, ir jie visur yra rausvos spalvos. Nuo oksiduoto vandens stadijos dugne nusėda visos kalbos cheminis aktyvumas ir oksidacinė sveikata. Taigi, pavyzdžiui, z'єднання з -2 - tse sulfidi. Jie turi tipišką oksiduojantį elementą.
Chim yra žymus oksidacijos lygis aplinkoje, o dėl volodya rechovina sukelia daugiau sūkurių oksidacinės sveikatos. Tsiomą nesunku apversti, jei duodamos dvi bazinės rūgštys, kurios nustatys syrką:
- H 2 SO 3 - sirchista;
- H 2 SO 4 - sirchana.
Atrodo, likusi dalis yra stabilesnė, stipresnė, tuo didesnė koncentracija, dar rimtesnė oksidacija.
paprastas pokalbis
Jakų paprastosios kalbos sirka yra gražus tos pačios rūšies gyvos formos kristalas. Jei noriu tik vienos iš formų, tai yra du pagrindiniai kalbos principai. Persha, monoclinna arba rombinis - tse і zhovte netinka razchinyatsya šalia vandens, ir atimta ekologiškų mažmenininkų. Pamatykite trapumą ir gražią struktūros formą, kurią suteikia karūnėlė. Lydymosi temperatūra – arti 110 0 С.
Jei nepraleidžiate tarpinio momento, kai įkeliamos tokios modifikacijos, tuomet galite akimirksniu sukurti nedrąsią stovyklą - plastikinį sirku. Vona – tai gumos klampus rudas atspalvis, kuris kaitinant arba per šaltai vėl pavirs deimanto forma.
Jei kalbate apie chemiškai švarų sirką, su bagatorazinio filtravimo atsilikimu, tai štai, vandenyje labai maži kristalai, polinkis ir nelygumai. Zdatnі pasirūpinti kontaktu su vologo ir kisnіy povіtrya. Gaunu daug chemijos veiklos.

Žinios gamtoje
Gamtoje yra natūralių genčių, iš kurių yra pusgalvių, ir tai yra paprastas žodis. Be to, nereikia keršyti:
- mineraluose, rūdose ir rūdose;
- tvarino, roslino ir žmonių organizmuose, taigi, kaip patekti į organinių molekulių sandėlį;
- gamtinėse dujose, naftoje ir naftoje;
- naftinguose skalūnuose ir natūraliuose vandenyse.
Galite įvardyti nedidelį skaičių kalnakasių, kurie yra sąraše:
- kinovaras;
- piritas;
- sfaleritas;
- prieš pinigus;
- galena ir іnshі.
Sirchanokysl virobnitstvo yra didelė dalis laimėtų metų sezonų. Kita dalis yra pergalinga medicininiais tikslais, Silskoe valdžia, pramoniniais procesais ir kalbos praktika.
Fizinė galia
Їх galima apibūdinti keliais punktais.
- Vandenyje tai nėra rozchhinnaya, anglies disulfidas ar terpentinas - gerai eiti.
- Su trivialia grotele kaupiu neigiamą krūvį.
- Lydymosi temperatūra tampa 110 0 С.
- Virimo temperatūra 190 0 С.
- Pasiekęs 300 0 С, jis patenka į keteros liniją, lengvai subyrėja.
- Kalbant grynai, savarankiškai skolintis galios kuras yra dar geresnis.
- Pats savaime kvapas praktiškai nėra lengvas, tačiau vanduo ir puspapločiai mato aštrų supuvusių kiaušinių kvapą. Taigi pati, kaip ir deyaki dujomis panašūs dvejetainiai atstovai.
Jau seniai žmonės matė pateiktos Bully kalbos fizinę galią. Pati dėl savo degumo sіrka і taip vadinosi. Be vikorisovyvuvuyu dusinantys ir garai garai, nes jie yra suformuoti per dieną karštyje, kaip prieš priešus. Be to, aliejaus likimui rūgštingumas taip pat yra svarbesnis už išgalvotą vertę.

Linksmi autoritetai
Tema: "Syrka ir її spoluky" mokykliniame chemijos kurse paskola yra ne viena pamoka, o kilka. Aje їkh duzhe bagato. Tai bus paaiškinta šios kalbos chemija. Galite parodyti tiek oksidacijos galią su stipresniais prototipais (metalais, boru ir іnshі), tiek ir su daugiau nemetalų.
Tačiau jiems tokia veikla nerūpi, tik su fluoru kartu su bet kokiais protais. Visiems jiems reikalingas šildymas. Galima nustatyti keletą kalbos kategorijų, su kuriomis yra ryšys tarp šių:
- metė;
- nemetalai;
- pievos;
- stiprios oksiduojančios rūgštys – sirchana ir azoto.
Spoluki sirki: raznovodi
Šių universalumą paaiškins nevienodos pagrindinio elemento - sirkos - oksidacijos stadijos vertės. Taigi, norėdami sužinoti daugiau, galite pamatyti keletą pagrindinių kalbų tipų:
- z'єднання Зі oksidacijos pakopa -2;
Jei pažvelgsite į klasę, o ne į valentingumo rodiklį, tada duotas elementas sutvarkys tokias molekules, kaip:
- rūgštis;
- oksidas;
- druskos;
- binarni spuces su nemetalais (sirkovugletai, chloridai);
- organiška kalba.
Dabar galite pamatyti pagrindinius iš jų ir uždėti ant jų pirštą.

Recovini su oksidacijos pakopa -2
Spoluki sirki 2 - tse її konformacijos su metalais, taip pat su:
- anglyse;
- pasiklystame;
- fosforo;
- silicio;
- mish'yak;
- boro.
Cich vipadkah jie rodomi kaip oksidatorius, nes visi elementai yra labiau elektriškai teigiami. Ypač svarbu juos pamatyti.
- Сірковуглец - CS 2. Prozora rіdina su būdingu imliu efіru aromatu. Є toksiška, liepsnoje ir vibuhaє kalba. Vikoristovuyutsya jakų razchinnik, ir daugybei rūšių aliejų, riebalų, nemetalų, vidutinių nitratų, dervų ir gumų. Taip pat yra svarbi detalės siūlės virobiškumo dalis – klampumas. Pažadai sintezuojami dideliais skaičiais.
- Vanduo sulfidinis arba sulfidinis vanduo - H 2 S. Dujos, kurios negali būti sukietintos ir saldymedis pasimėgavimui. Kvapas aitrus, krašte nepriimtinas, supuvęs kiaušinis. Otruyny, vairavo dyshal centrą, todėl jak po'yazu іoni mіdі. Kai jis yra atkirstas, yra kvėpavimas ir mirtis. Jis plačiai naudojamas medicinoje, organinėje sintezėje, organinių rūgščių sintezėje, taip pat energetiškai matomo siruvino pajėgumuose.
- Metalų sulfidai plačiai naudojami medicinoje, sulfatiniame alkoholyje, nebenaudojamuose vaistiniuose preparatuose, paruoštuose liuminoforuose ir kitose pelėse. Pradinė formulė yra Me x S y.

З'єднання Зі oksidacijos žingsnis +4
Spoluks of sirki 4 - visi svarbesni oksidai ir susijusios druskos bei rūgštis. Visa smarvė užpildoma plačiais smaigaliais, kurie pramonėje gali būti reikšmingesni. Gali pasirodyti, kad tai oksiduojasi ir dažniau pasireiškia nauja galia.
Formulės su pusgrūdžiu su oksidacijos laipsniu +4 pakopos:
- oksidas - grynos dujos SO 2;
- rūgštis - grynas H 2 SO 3;
- soli gali pateikti formulę Me x (SO 3) y.
Vienas iš populiariausių є arba anhidridų. Vynas yra bezbarvina kalba, su volodya kvapu gerklės syrnik. Perkant puikius, nesunku užuosti, kai yra ugnikalnių.
Jis lengvai suyra vandenyje iš rūgšties ir sirchistoy tirpalo. Būti vedama, kaip tipinė druska, į kurią įvesti ties viglyadi sulfit-jonu SO 3 2-. Tsey anhidridas yra pagrindinės dujos, kurios patenka į laivyno atmosferą. Pats vynas pilamas į šviesą.
З'єднання, kurioje ties pilkomis pakopomis oksidavosi +6
Toks pripažinimas, visų pirma, yra anhidrido ir sirchanos rūgšties su jo druskomis išraiška:
- sulfatai;
- hidrosulfatai.
Taigi, kadangi sirkos atomas juose randamas puikiai oksiduotoje būsenoje, tai cich galia yra visiškai lygi nuliui. Kvapas stipriai oksiduoja.
Serki (VI) oksidas – sirchaniy anhidridas – yra lakus nevaisingas ridinas. Ryžiams būdinga – stipri drėgmės sugėrimo geba. Sumažinti neterminuotai. Išpilstydami į vandenį duokite vieną stipriausių mineralinių rūgščių – sirchaną. Koncentracijos skirtumai її svarbu riebus, šiek tiek kramtomas ridinoy. Jei sirchano rūgšties tirpale yra anhidrido, jis bus ypač gerai žinomas, vadinamas oleumu. Laimėk vikorystvutsya pramonėje su virobnitstvі rūgštimi.
Serduotos druskos - sulfatai - labai vertingi tokie spoluki, jakai:
- klubai CaSO 4 2H 2 O;
- baritas BaSO 4;
- mirabilitas;
- švino sulfatas ir інші.
Kvepia sandėliavimu versle, chemine sinteze, medicinoje, paruoštais optiniais priedais ir akiniais bei maisto pramone.
Žinoma, kad hidrosulfatas plačiai naudojamas metalurgijoje; Taip pat pats smarvė padės paversti daugybę susilankstančių oksidų į skirtingas sulfato formas, kad jų būtų galima rasti įvairių rūšių.
Vivchennya sirki mokyklos chemijos kurse
Jei gražiausia išmokti žinių apie tuos, kurie taip pat yra sirka, pavyzdžiui, valdžios galia, kas yra sirkos poelgis? 9 klasė – gražiausias laikotarpis. Tai ne pati ausis, nes vaikams viskas nauja ir tylu. Vidurys yra vivchenna chemijos moksle, jei anksčiau padėti pamatai padės man suprasti temą. Tomai, norėdamas pamatyti maistą, pamatyk patį klasės draugą. Tuo pačiu visa tema išsiplėtė iki kelių blokų, kai kuriuose okremose yra pamoka "С'єднання сірки. 9 klasė".
Bus paaiškinta žmonių skaičiui. Taip pat verta pažvelgti į mitybą apie vitaminus ir mineralus pramonėje. Apskritai tema bus pristatyta 3 metų viduryje.
O vynuogių ašį ant vivchennya reikia tarkuoti tik 10 klasėje, jei organizmai žiūri į maistą. Taip pat bus sugadintas biologijos smarvė vidurinėje mokykloje. Adzhe sirka patekti į tokių organinių molekulių sandėlį kaip:
- tiospirti (Merkaptani);
- bіlki (tretino struktūra, ant kurios rodoma disulfido mіstkіv forma);
- tioaldegidiv;
- tiofenoliai;
- tioefiri;
- sulfoninės rūgštys;
- sulfoksidas ir іnshі.
Їх žr. specialioje sieros organinių z'єdnan grupėje. Kvapas gali būti svarbesnis ne tik gyvų būtybių biologiniuose procesuose, bet ir pramonėje. Pavyzdžiui, sulfonrūgštys yra daugelio vaistų (aspirino, sulfanilamido ar streptocido) pagrindas.
Be to, yra nuolatinis tokių dalykų kaip veiksmai komponentas:
- amino rūgštys;
- fermentai;
- vitaminai;
- hormonai.
Kambario temperatūroje vanduo į reakciją patenka tik su gyvsidabriu. Reguliuojant temperatūrą, aktyvumas žymiai padidėja. Kaitinant sirką, ji be vidurio reaguoja paprastomis frazėmis, už vidinių dujų, azoto, seleno, telūro, aukso, platinos, iridžio ir jodo vinjetės. Sulfidinis azotas ir auksas pašalinami netiesioginiu būdu.
Susisiekimas su metalais
Syrka viyavlya oksiduota galia dėl sulfidų sąveikos:
Vzamodia su vandeniu veikia 150-200 ° С:
H 2 + S = H 2 S.
Vzaєmodiya z kisnem
Vanduo dega rūgštyje 280 ° C temperatūroje, posūkyje - 360 ° C temperatūroje, kurioje nustatoma oksidų suma:
S + O2 = SO2;
2S + 3O 2 = 2SO 3.
Derinys su fosforu ir anglimi
Kaitinamas be elektros energijos, vanduo reaguoja su fosforu, anglimi, parodydamas oksidacijos galią:
2P + 3S = P2S3;
Derinys su fluoru
Esant stiprioms oksiduojančioms medžiagoms, pasireiškia tokia galia:
S + 3F 2 = SF 6.
Vzaєmodiya su lankstymo žodžiais
Kai jungiasi su sulankstomais syrkos žodžiais, tai tarsi švinas:
S + 2HNO3 = 2NO + H2SO4.
reakcijos disproporcija
Syrka tinka neproporcingoms reakcijoms, kai nustatoma sąveika su pieva, sulfidais ir sulfatais:
3S + 6KOH = K2S +4O3 + 2K2S-2 + 3H2O.
1.7. otrimannya sіrki
Vietinės rūdos
Kai šildomas neprieinant prie maisto
FeS 2 = FeS + S.
Vandens oksidacija, jei trūksta rūgštingumo
2H 2S + O 2 = 2S + 2H2O.
Iš dujų patenkama į metalurgijos ir kokso krosnis, kai kaitinama esant katalizatoriui
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. sirvodden
Vodneve z'єdnannya sirki - sirvodden H 2 S ... Sirevodn yra kovalentinė z'єdnannya. Molekulės yra analogiškos vandens molekulėms, vandens atomas yra sp 3-hibridizacijos stadijoje, tačiau vandens molekulės nepriima vandens molekulių. Syrkio atomas mažiau elektriškai neigiamas, kuo atomas žemesnis, mažesnis dydis, mažesnis krūvis, mažesnis krūvis. HSH valentinis pjūvis tampa 91,1 °, o H - S juosta tampa 0,133 nm.
Fizinė galia
Ekstravagantiško proto sirvoddenas yra dujos be dujų, turinčios stiprų būdingą supuvusių kiaušinių kvapą. T pl = -86 °C, T rulonas = -60 ° C, supuvęs vandenyje, 20 ° C temperatūroje 100 g vandens ištirpsta 2,58 ml H 2 S. Net šakotas, įkvėpus, vyteles paralyžiuoja, kas gali baigtis mirtina. Gamtoje matosi vulkaninių dujų sandėliuose, įsikuria augančių ir gyvų organizmų gniužuliuose. Geras tirpalas vandenyje, treniruodamasis sutaisysiu silpną druskos rūgštį.
Linksmi autoritetai
Vandeninis tirpalas turi silpną dvibazių rūgščių galią:
H2S = HS- + H+;
HS - = S 2 + H +.
Sire vanduo deginti povitri blakitnym half'am. Sujungtos prieigos atveju nustatomas galiojantis sertifikatas:
2H 2S + O 2 = 2H 2O + 2S.
Turint didžiulę prieigą prie židinio židinio, vanduo turi būti gaminamas prieš patvirtinant alyvos oksidą (IV):
2H 2S + 3O 2 = 2H 2O + 2SO 2.
Sirkhovenas gali tiekti galią. Vandens nuosėdos gali būti oksiduojamos vandens tirpale iki sauso vandens, grynų dujų ir sieros rūgšties.
Pavyzdžiui, bromo vanduo in vitro:
H2S + Br2 = 2HBr + S.
keitimas su chloro vandeniu:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Vandens srove gali būti paleidžiama, vikoristija ir švino oksidas, todėl supervandens reakcija gali sukelti puikių tipų šilumą:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Vzaєmodia sіrvodnyu sіrchistim dujos vikoristovuyutsya, skirta pašalinti sirkus iš dujų, patekti į metalurgijos ir sirchano rūgšties virobniztva:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Zsim procesas susiejo vietinės sirkos apšvietimą vulkaninių procesų metu.
Vienos valandos grynų dujų ir vandens srautu per pievą nustatomas tiosulfatas:
4SO2 + 2H2S + 6NaOH = 3Na 2S2O3 + 5H2O.
Normaliam protui vanduo yra bebarės ir net toksiškos dujos, turinčios būdingą supuvusių kiaušinių kvapą.
Jei norite, kad yogo otrymannya laboratorijoje būtų, į sulfidą įpilkite praskiestos druskos rūgšties:
Pirmasis būdas pašalinti vandenį iš vandens į aliuminio sulfidą įpilant šalto vandens:
Šitaip atkirstas Sirvodinas – aiškiau.
Sirevodn yra kovalentinė z'єdnannya. Jogo molekulės gali slėpti struktūrą, panašią į švino molekulių struktūras (Div. Rozd. 2.2). Tačiau, atsižvelgiant į vandens molekules, vandens molekulės neatitinka vandeningų garsų. Dešinėje tuo pilkos atomas yra mažiau elektriškai neigiamas, apatinis atomas yra rūgštus, ale yra didesnio dydžio. Štai kodėl vandens atomas gali būti mažesnis už krūvį, o ne atomas yra rūgštus. Per vandens jungčių matomumą nuleidžiu vandens temperatūrą, nuleidžiu vandenį. Vandens garsų matomumas vandenyje paaiškins tą patį niekšui vandens skirtumą.
Vandeninis tirpalas turi silpną dvibazių rūgščių galią:
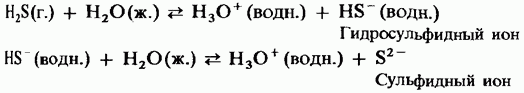
Vanduo degs tamsoje pusmases. Kai yra gretima prieiga prie ugnies, vanduo yra prižiūrimas, kad matytųsi vandens matymas, nes jis kondensuojasi ant šalto aikštės paviršiaus:
Esant dideliam priėjimui prie krosnies, vanduo turi būti gaminamas prieš patvirtinant sieros dioksidą:
Sirkhovenas gali tiekti galią. Pavyzdžiui, vynas iš bario bromo vandens ir atsinaujinantis iš jų į jonus
Hidrochloridas yra dvibazinė rūgštis, kurią galima naudoti dviems druskų serijoms – sulfidui ir hidrosulfidui (div. Vishche). Šalia vandens galima rasti pašalinių metalų sulfidų tirpalais. Hidrolizės rezultatas:
Neardomieji kitų metalų sulfidai gali būti nusodinami iš šių metalų druskų vandeninių tirpalų, praeinant per vandens šaltinį. Pavyzdžiui, jei vanduo praleidžiamas pro tarpą, jie gali atkeršyti juodai apgulę sulfidą.
Reakcija yra pergalinga atliekant analitinio vandens tyrimo kokybę.
sirki oksidai
Sierra patvirtino daugybę oksidų, iš kurių svarbiausi yra du: sirki dioksidas ir sirka trioksidas
Sieros dioksidas yra be alkoholio, be alkoholio dujos, turinčios aštrų kvapą. Laboratoriškai jį galima pašalinti sudeginant kokiu nors būdu arba rūgštyje, įdedant šiltų rūgščių variacijų atskiedimų į kokią nors nesulfitinę druską arba kaitinant koncentruotą rūgštį iš vidurio:
Serumo dioksidas-rūgštinis oksidas. Jį lengva atpažinti iš vandens, prisipildžiusi sirchisty rūgšties. Rūgštis jonizuojasi rečiau, be to, tai silpna rūgštis:
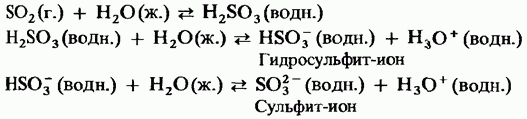
Kai į dujas panašus sieros dioksidas praleidžiamas per natrio hidroksido tirpalą, susidaro natrio sulfitas. Natrio sulfitas, reaguojantis su pertekliniu sieros dioksidu, nustatantis natrio hidrosulfitą analogiškai reaguojant į anglies dioksidą gazuotame vandenyje.
І į dujas panašus sieros dioksidas, і th vandens pagrindu pagaminti tirpalai є pusbroliai. Pavyzdžiui, dujinis natrio hidroksidas yra oksidas iš sulfato tirpalo ir gryna rūgštis pridedama prie jono
Sieros dioksidas pramoninėse atliekose yra distiliuojamas per vipalyuvanny ant kai kurių sulfidinių rūdų ir užburtas kaip tarpinis produktas pašalinant sirchano rūgštį (7 skyrius). Kviečių dioksidas yra saugomas celiuliozės pramonėje, audiniams šalinti, o taip pat vaisiams ir daržovėms perdirbti, esant nereikšmingoms zberigann.
Sieros dioksidas labai svarbus užsikimšusioje atmosferoje ir ypač apšviečiant rūgštines plokšteles. Atmosferoje vynas oksiduojamas iki sieros trioksido:
Esant normaliam protui, šis procesas retkarčiais atremiamas, bet esant katalizatoriui galima jo atsikratyti, galbūt prieš panaudojant kontaktiniame rūgšties šalinimo procese. Nedideli kiekiai druskos ir mangano, kurių galima rasti atmosferoje, leidžia katalizuoti oksiduotą sieros dioksidą. Pilkasis trioksidas reaguoja su alkoholio pagalba, todėl atsiranda tamsiai raudonos spalvos, nes tai yra rūgšties tabletės (Div. Sozh Ch. 12).
Kietasis sieros trioksidas yra polimorfinis. Dvi navazhliviškos formos Pirmoji iš jų – ciklinės struktūros trimeris (15.24 pav., a); žvilgsnio kristalai. mє aciklinė polimerinė struktūra (15.24 pav., b); Nuostabu matant plikus kristalus. Lydymosi temperatūra. Esant vologui, jis žingsnis po žingsnio virsta Obidvi forma, kad virtų 45 °C temperatūroje. Garų trioksido garai laikomi izoliuotose simetriškose plokštumose molekulėse.
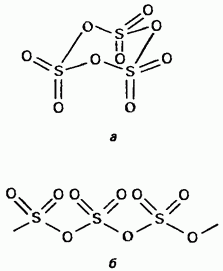
Mažas. 15.24 val. Syrky trioksidas, Aciklinė struktūra, b - Aciklinė struktūra.
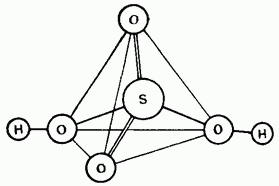
Mažas. 15.25 val. Sirchano rūgšties molekulės struktūra.
Laboratorinėse kriauklėse sieros trioksidas išleidžiamas su pašildytu sulfatu
Vandens trioksidas gali būti labai rūgštus. Vynas egzotermiškai reaguoja su vandeniu, paverčiant rūgštimi:
Syrka trioksidas yra stiprus oksidatorius. Pavyzdžiui, vynas oksiduoja vandenilio bromidą iki vandenilio bromo.
Sirchana rūgštis
Sirchana rūgštis yra nevaisinga aliejinė ridinos rūgštis. Kaina yra vienas iš svarbiausių pramoninės chemijos produktų. Її promislova іtrimannya papildomam kontakto procesui і stasosuvannya aprašyta skyriuje. 7.
Neskiesta sirchano rūgštis yra kovalentinis tirpalas. Molekulės gali būti tetraedrinės budov (15.25 pav.).
Syrchana rūgštis virti ir suskaidyti 340 ° C temperatūroje,
Virimo temperatūra yra aukšta, o druskos rūgšties klampumas yra didelis;
Syrchana rūgštis yra stipri dvibazė rūgštis. Vandenyje vanduo pakils, o hidrosulfato ir sulfato jonai yra patvirtinti:
Syrchana rūgštis rūpinasi visų rūgštims būdingų reakcijų likimu. Vona reaguoja su metalais, tirpindama metalų ir vandens sulfatus, reakcijose su karbonatais, tirpindama sulfatus, dioksidus anglyje ir vandenyje bei reakcijose su lydiniais ir pievomis, užtikrindama sulfatus ar hidrosulfatus.
Koncentruota sirchano rūgštis smarkiau reaguoja su vandeniu. Dėl priežasties sirchan rūgšties reikėtų pilti pilant į vandenį, o ne navpaki. Rūgštis yra higroskopinė, t.y. Kad її vikoristovuyut džiovina dujas, nes nereaguoja su juo, praeina їkh per sіrchan rūgštį. Sieros rūgšties santykis su vandeniu ir danga yra didelis, tačiau sieros rūgštis gali būti dehidratuojanti priemonė; kiekvienai koncentruotai sirchano rūgščiai:
balti kristalai į pentahidrato sulfatą paverčia bevandenį sulfatą
angliavandeniai, pavyzdžiui, sacharozė, yra suanglėję:
popierius gali būti karbonizuotas koncentruotos organinės rūgšties deriniu, kuri kaupiama su rūgšties doze ant celiuliozės pluošto;
etanolis virsta etilenu:
(Etanolio dehidratacija naudojant organinę rūgštį, kuri turėtų būti kontroliuojama
protus, gaminti etoksietaną (dietinį eterį) iki patvirtinimo ir reakcija į pergalę eliminuojant etoksietaną pramoniniu mastu);
chlorbenzeno ir trichloretanalio (chloralo) suma dehidratuojama (16.3 skirsnis).
Koncentruota sirchano rūgštis yra stiprus oksidatorius. Laimėjo oksiduojančius metalus ir nemetalus. beje
Jako užpakalis, kaip ištirti koncentruotos sirchano rūgšties oksidacijos galią, taip pat oksiduojamus jonus į jonus, taip pat bromido jonus į virusinį bromą prasidėjusiose reakcijose:
Nareshty, sirchano rūgštis organinėje chemijoje virsta kaip sulfonuojanti medžiaga (17 skyrius).
Sulfatai, sulfatai ir tiospoliai
Sulfato jonai turi tetraedrinę struktūrą, panašią į sieros rūgšties molekulės struktūrą.
Soli. Sulfatas susidaro praskiestos sirchano rūgšties reakcijose su metalais, oksidais, hidroksidais ir karbonatais. Dėl vyno sulfato batonėlio ir іnshі sulfato roschinnі prie vandens. Kalcio sulfatas vandenyje nėra labai stiprus. Prieš kaitindami kepsnius išmaišykite sulfatu. Vinnyts visom sulfati zaliza. Pavyzdžiui, kaitinamas sulfatas nusėda su patvirtintu fiziologinio tirpalo oksidu:
Norėdami bet kokiu būdu atgauti sulfato jonus, pridėkite vandens slėgį į chlorido barą. Jei preliminariai yra sulfato jonų įrodymų, bus nustatytas sulfato bario apgultis:
Sulfati gali būti labai svarbūs zasosuvane. Pavyzdžiui, magnio sulfatas (angl. sil, girka sil) naudojamas virobnituoti vibukhovy upes, ruošti sirnikus ir ugniai atsparius audinius. Nasicheni razchin tsієї soli vikoristovutsya medicinos praktikoje kaip protivopalny zasіb.
Natrio tiosulfatas gali būti laikomas natrio sulfato analogu, kuriame vienas atomas yra pakeistas vienu sieros atomu. Tarp Tіospolukos vaikų jie sugalvos vieną dalyką - tiocyanat kaliyu. Vin yra cianato kalio analogas. Tіocyanat kalіyu galima išmesti, sulydant cianido kalіyu su sіrkoyu:
Tiocyanat kaliyu vikoristovuyutsya į yak_sіanіnіy kalіy gaminti prieš kreivai
Dar kartą, pakartokite dar kartą!
1. Pereinant į žemesnę VI kokybės kategorijos dalį, elementai palaipsniui keičiasi iš nemetalinių į metalinius.
2. VI grupės elementai gali uždengti pastatą vandeniu ir reakciniais metalais, nustatydami sceną, kurioje gali smirdėti oksidacijos pakopos -2.
3. Kisen yra labai elektronegatyvus ir stipriai oksiduojasi.
4. Ozonas dar stipriau oksiduojasi, mažiau rūgštus.
5. Kisen vaidina nepaprastai svarbų vaidmenį biologinėse sistemose;
6. Kisen yra patvirtintas su mažais binarny spoluca spolukais, įvairių tipų oksidais:

7. Vandens peroksidas є yra stiprus oksidatorius.
8. Syrka in viglyadi galima rasti decilkoh enantiotropinėmis formomis.
9. Norint atmesti vandenį nuo žemės apkrovų, Frash procesas sustingsta, tokiu atveju sunku užstrigti ir perkaista garai.
10. Сірка pastatys spolukus, kuriuose yra stovyklose, kurių oksidacijos lygiai +2, +4, +6 ir -2.
11. Sirwater yra silpna dvibazė rūgštis ir vyraujanti.
12. Dujinis sieros dioksidas ir vandens pagrindo tirpalai.
13. Vandens trioksidas gali būti stipriai rūgštus ir oksiduotas.
14. Syrchana rūgštis yra stipri dvibazė rūgštis, džiovinimo agentas, dehidratuojantis agentas ir stiprus oksidatorius.
15. Druskos rūgšties ir sulfato jonų molekulės gali turėti tetraedrinę struktūrą.