Silicio struktūros schema. Elektronų apvalkalo struktūra
Atominės struktūros pozicija PS: III laikotarpis; IV grupė, vedanti; Kernelio įkrova: +14 Si; Santykinė atominė masė: Ar (Si) = 28 Atominė struktūra: p = 14, e = 14, n = = 14 Elektroninė formulė: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
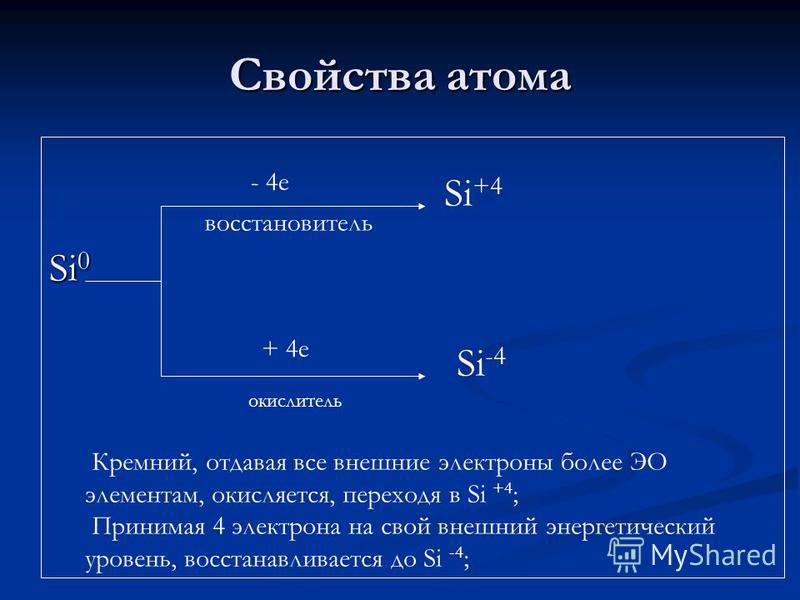
Atominės savybės Si redukuojantis agentas + 4 e oksidatorius Si + 4 Si -4 Silicis, suteikiantis visus išorinius elektronus daugiau EO elementų, oksiduojamas, einantis į Si + 4; Atsižvelgiant į 4 išorinius energijos lygius, jis sumažinamas iki Si-4;

Silicio fizikinės savybės yra ne metalas, jis yra kristalinėje ir amorfinėje būsenoje. Kristalinis silicis yra pilkšvai plieninė medžiaga su metaliniu blizgesiu, labai sunku, bet trapi. Amorfinis silicio rudos spalvos milteliai. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Silicio kristalinė struktūra Silicio kristalinis tinklelis yra kubinis veido centruotas deimantas. Tačiau dėl ilgesnio obligacijų ilgio tarp Si-Si silicio kietumas yra gerokai mažesnis nei deimantų. Silicis yra trapus tik šildant virš C.

Elektrofizinės savybės Elementinis silicis Elementinis silicis yra tipinis puslaidininkis. tipinis puslaidininkis. Kristalinio silicio elektrofizines savybes stipriai įtakoja jame esančios pėdsakai. Norint gauti atskirus silicio kristalus su skylės laidumu, 3 grupės boro, aliuminio, galio ir indio elementų priedai yra įterpiami į silicį, elektroniniu laidumu pridėjus 5-ojo fosforo, arseno ar antimono grupės elementus.


„Flint Flint“, šis „Flint“, šis bjaurus ir labai bjaurus ir labai patvarus akmuo, tvirtas akmuo, padėjo pamatą akmens amžiaus akmeniui - šimtmečiui - kvarcinio darbo įrankiams. žiauniniai įrankiai. Yra dvi priežastys: - silicio paplitimas ir prieinamumas; - silicio paplitimą ir prieinamumą; - sugebėjimas suformuoti aštrius pjovimo kraštus, kai jie yra pjaustyti; - sugebėjimas suformuoti aštrius pjovimo kraštus, kai jie yra pjaustyti;




Ar žinote, kad .. Silicio grynos formos gavimo metodą sukūrė Nikolajus Nikolajevas Beketovas. Silicis Rusijoje gaminamas gamyklose: Kamensk - Uralsky (Sverdlovsko sritis), Kamensk - Uralsky (Sverdlovsko sritis) Shelekh (Irkutsko sritis). Shelekh (Irkutsko regionas).

Silicio gamyba Pramonėje silicis gaunamas sumažinant SiO 2 lydymą koksu, esant t = C lanko krosnyse. Tokiu būdu gauto silicio grynumas yra 99,9%.
Silicio gavimas Laboratorijos gamybos metodas: SiO Mg 2MO + Si SiO Mg 2MO + Si


Silicio cheminės savybės Įkaitinus iki 400 ° C, silicis reaguoja su deguonimi ir sudaro silicio dioksidą: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
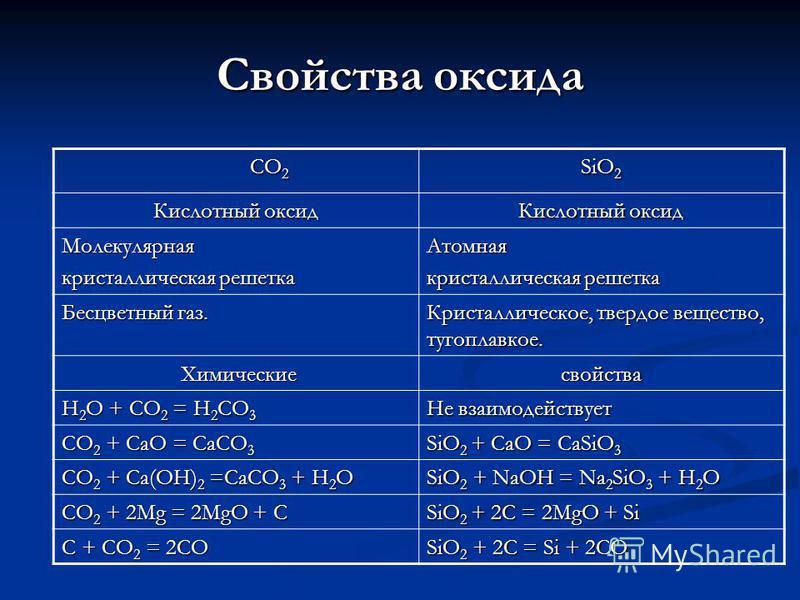
CO 2 CO 2 SiO 2 oksido savybės Rūgštinis oksidas Molekulinis kristalų grotelės Atominės bespalvės dujos. Kristalas, kietas, atsparus ugniai. Cheminės cheminės savybės H 2 O + CO 2 = H 2CO 3 nereaguoja CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO3 + H2O SiO 2 + NaOH = Na 2 SiO 3 + H20 CO 2 + 2Mg = 2MO + C Si02 + 2C = 2MO + SiC + CO 2 = 2CO Si02 + 2C = Si + 2CO
Rūgščių savybės H 2 CO 3 H 2 SiO 3 Dibasinė, deguonies turinti, silpna, trapi skraidymas. Dibas, deguonies turintis, silpnas, netirpus vandenyje. Gavimas: CO 2 + H 2 O = H 2 CO 3 Priimamasis: SiO 2 + H 2 O = negali Nestabilus, trapus, skaidantis stovint arba šildant: H 2 CO 3 = CO 2 + H 2 O Negalima pasirinkti grynąja forma, nes suyra kaitinant: H 2 SiO 3 = Si02 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Mažos dujų išsiskyrimas __________

Silicio rūgšties anglies rūgštys - karbonatai; - angliavandeniliai; - silikatai; - silikatai; Karbonatai turi visas druskų savybes, yra stiprūs elektrolitai, visiškai išsiskiria į jonus (tirpsta vandenyje). Tik šarminių metalų druskos yra tirpios, kitos sudaro netirpias arba nesudaro druskų (Al +3, Cr +3, Ag +).
![]()



Biologinis vaidmuo Svarbiausias silicio junginys SiO 2 yra būtinas augalams ir gyvūnams. Jo dėka, nendrės, nendrės, dėka jo, nendrės, nendrės ir nugarinės yra tvirtai panašios į bajonetus. ir horsetails stovi tvirtai, pavyzdžiui, bajonetai. Aštrių griovelių lapai, išpjauti kaip „Sharp“ nuosėdų lapai, pjaustyti kaip peiliai, pjauti ant pjovimo lauko peilių, pjautos ant pjovimo laukų, pvz. neleiskite laukų laukams nukristi nuo lietaus ir vėjo lauko laukuose, kad eitumėte iš lietaus ir vėjo


Silicis yra mikroelementas, kuris nuolat yra žmogaus organizme. Jo didžiausias kiekis yra limfmazgiuose, aortos jungiamuosiuose audiniuose, trachėjoje, plaukuose ir odoje. Siliciui reikalingos epitelio ląstelės. Silicis yra mikroelementas, kuris nuolat yra žmogaus organizme. Jo didžiausias kiekis yra limfmazgiuose, aortos jungiamuosiuose audiniuose, trachėjoje, plaukuose ir odoje. Siliciui reikalingos epitelio ląstelės. Silicis vaidina svarbų vaidmenį kaulų mineralizacijos procese; būtina išlaikyti arterinės sienos elastingumą, turi teigiamą poveikį imuninei sistemai ir lėtina senėjimo procesą žmogaus organizmo audiniuose. Vidutinis silicio kiekis kraujyje yra 8,25 mg per parą. Su amžiumi jo lygis organizme mažėja, todėl vyresnio amžiaus žmonėms silicio poreikis didėja. Pagerinti silicio absorbciją organizme kalcio, magnio, mangano ir kalio. Silicis vaidina svarbų vaidmenį kaulų mineralizacijos procese; būtina išlaikyti arterinės sienos elastingumą, turi teigiamą poveikį imuninei sistemai ir lėtina senėjimo procesą žmogaus organizmo audiniuose. Vidutinis silicio kiekis kraujyje yra 8,25 mg per parą. Su amžiumi jo lygis organizme mažėja, todėl vyresnio amžiaus žmonėms silicio poreikis didėja. Pagerinti silicio absorbciją organizme kalcio, magnio, mangano ir kalio.

Biologinis silicio vaidmuo taip pat yra įtrauktas į žemesnių gyvų organizmų - diatomų ir radiolarijų - sudėtingiausias gyvas medžiagas, kurios sukuria nepralenkiamus grožio skeletus, pagamintus iš silicio. Silicis taip pat yra mažesnių gyvų organizmų - diatomų ir radiolarijų - dalis, kuri yra subtiliausias gyvosios medžiagos gabalėlis, kuris sukuria nepaprastą silicio skeleto grožį. Diatomos Radiolaria Savikontrolė 1. Kas yra silicio vieta periodinėje sistemoje: a) 2 periodai, 4 og. b) 3 laikotarpiai, 3 gr. skyriuje. c) 3 laikotarpiai, 4 gr. skyrius) 2 periodai, 4 gr. b) 3 laikotarpiai, 3 gr. skyriuje. c) 3 laikotarpiai, 4 gr. skyriuje. 2. Silicio grotelės: a) joninė; b) atomų; c) molekulinė; a) jonų; b) atomų; c) molekulinė; 3. Pagal silicio paplitimą ... elementas: a) pirmiausia; b) antrasis; c) trečiasis; a) pirmasis; b) antrasis; c) trečiasis; 4. Silicis reaguoja su: a) metalais, vandeniliu, halogenais; a) metalai, vandenilis, halogenai; b) metalai, halogenai, lengvai tirpūs šarmuose; b) metalai, halogenai, lengvai tirpūs šarmuose; c) oksidai, rūgštys, nemetalai. c) oksidai, rūgštys, nemetalai. 5. Silicio rūgšties druskos: a) silicidai; b) hidrosilikatai; c) silikatai; a) silicidai; b) hidrosilikatai; c) silikatai;

Silicis.
Silicis - periodinio cheminių elementų sistemos III periodo III grupės pagrindinio pogrupio IV elementas, \\ t atomų skaičius 14, atominė masė: 28.0855. Junginiuose paprastai yra oksidacijos laipsnis +4 (valencija IV) ir labai retai +3, +2 ir +1 (atitinkamai valentai, III, II ir I). Periodinėje lentelėje Mendeleevo silicis yra IVA grupėje (A reiškia, kad tai yra pagrindinis pogrupis) (anglies grupėje). Nemetall . Žymi simboliu Si(lat Silikonis). Laisvoje formoje - rudi milteliai arba šviesiai pilka kompaktiška medžiaga su metaliniu blizgesiu. Grotelių struktūra: kubinis, deimantas.
Pagrindinė būsena: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-elementas.
2. Fizinės savybės.
Kristalinis silicis yra tamsiai pilka medžiaga su plieno blizgesiu. Silicio struktūra panaši į deimantų struktūrą. Savo kristaluose kiekvienas atomas yra apsuptas keturių keturių tetračerių ir su jais susijęs kovalentiniu ryšiu, kuris yra daug silpnesnis nei tarp anglies atomų deimanto. Silicio kristaluose, net ir normaliomis sąlygomis, kai kurios kovalentinės jungtys sunaikinamos. Todėl joje yra laisvi elektronai, kurie sukelia nedidelį elektros laidumą. Kai apšvietimas ir šildymas didina skaldytų obligacijų skaičių, tai reiškia, kad didėja laisvųjų elektronų skaičius ir didėja elektros laidumas. Taigi turėtų paaiškinti silicio puslaidininkių savybes.
Silicis yra labai trapus, jo tankis yra 2,33 g / cm3. Kaip ir anglis, nurodomos ugniai atsparios medžiagos.
Silicį sudaro trys stabilūs izotopai: 2814Si (92,27%), 2914Si (4,68%) ir 3014Si (3,05%).
3. Gamta.
Dažniausiai gamtoje yra silicis silicio dioksido - junginiai, kurių pagrindinės sudėtinės dalys yra silicio dioksidas (IV) SiO2 (apie 12% žemės plutos masės). Pagrindinės silicio dioksido susidariusios mineralinės medžiagos ir uolienos yra smėlis (upė ir kvarcas), kvarcas ir kvarcitas, pelenai ir lauko špatas. Natūralūs silikatai turi sudėtingą sudėtį ir struktūrą. Čia yra kai kurių natūralių silikatų sudėtis:
ü lauko špatas K 2 O × Al 2 O 3 × 6SiO 2,
ü asbesto 3MO × 2SiO 2 × 2H 2 O,
ü žėručio K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü kaolinitas 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Antras dažniausias silicio junginių pobūdis yra silikatai ir aliuminio silikatai
Pažymėti vieni faktai, kad grynas silicis rastas gimtąja forma.
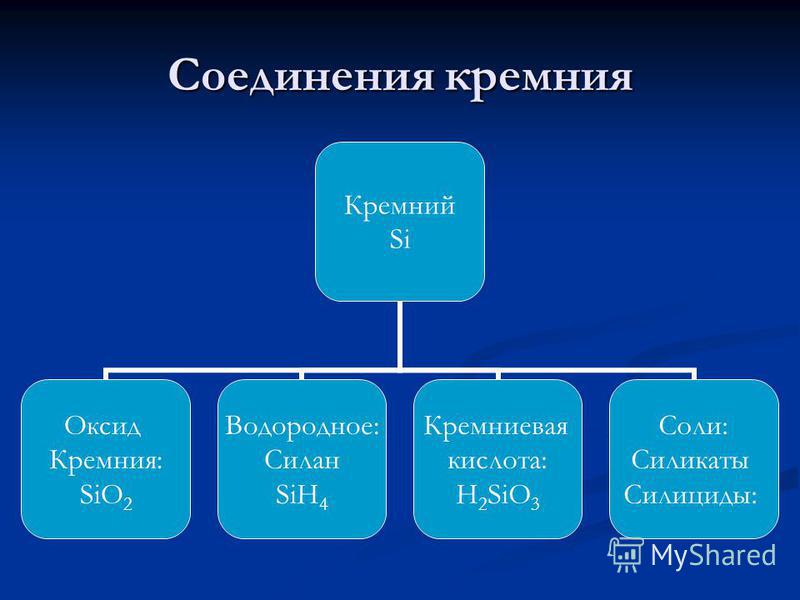
4. Silicio ir jo junginių cheminės savybės.
Pagal chemines savybes, silicis, kaip ir anglis, yra ne metalas, tačiau jo nemetalumas yra mažiau ryškus, kadangi jis turi didesnį atominį spindulį. Kadangi silicio atomai išoriniame energijos lygmenyje yra 4 elektronai, tiek -4, tiek ir 4-osios oksidacijos būklė būdinga siliciui (žinomas silicio junginys, kurio oksidacijos laipsnis yra +2).
Silicis normaliomis sąlygomis yra gana inertiškas, kuris turėtų būti paaiškintas jo kristalinės grotelės stiprumu. Jis tiesiogiai sąveikauja tik su fluoro:
Rūgštys (išskyrus hidrofluorinio HF ir nitrato HNO 3 mišinį)silicis neveikia. Tačiau jis ištirpsta šarminių metalų hidroksiduose, susidaro silikatas ir vandenilis:
Iš dviejų alotropinių silicio modifikacijų, kristalinio ir amorfinio silicio yra chemiškai aktyvesnis. Jis reaguoja deguonimi kaitinant, sudaro SiO 2:
taip pat su visais halogenaipavyzdžiui:
![]()
Aukštoje temperatūroje silicis jungiasi angliessudaro karborundo SiC:
„Carborundum“ turi deimantinius kristalus, kuriuose kiekvienas silicio atomas yra apsuptas keturių anglies atomų ir atvirkščiai, o kovalentinės obligacijos yra labai stiprios, kaip ir deimantų. Todėl kietumas yra artimas deimantui. Šlifavimo akmenys ir šlifavimo diskai gaminami iš silicio karbido.
Magnio silicidas. Reakcijose su aktyviais metalais, atsirandant susidarius silicidai, Silicis veikia kaip oksidatorius:
Aukštoje temperatūroje silicis atgauna daug metalų iš jų oksidų (!!!)
Silanas Vandenilio chlorido rūgšties poveikis silicidams - paprasčiausias silicio junginys yra silanas SiH 4:
Silanas yra nuodingas dujų, turinčių nemalonų kvapą, savaime užsidega ore (!!!):
Silicio oksidas (IV).Taip pat vadinamas silicio oksidas (IV) silicio dioksido. Tai kieta ugniai atspari medžiaga. (lydymosi temperatūra 1700 ° C) gamtoje plačiai paplitęs dviem būdais:
1) kristalinis silicio dioksidas - kvarco ir jo veislių (uolienų kristalas, kalcedonas, agatas, jaspis, flintas) mineralinio pavidalo; kvarcas yra kvarco smėlio, plačiai naudojamo statyboje ir silikatų pramonėje, pagrindas;
2) amorfinis silicio dioksidas - opalinės mineralinės sudėties SiO 2 × forma n H20; žemės amorfinės silicio formos yra diatomitas, tripolis (infuzinė žemė); dirbtinio amorfinio bevandenio silicio dioksido pavyzdys yra silikagelis, gaunamas iš natrio metasilikato:
Silikagelis turi išsivystytą paviršių ir todėl gerai sugeria drėgmę. .
1710 ° kvarcas tirpsta. Su greitu aušinimu susidaro išlydyta masė kvarco stiklas . Jis turi labai mažą išsiplėtimo koeficientą, todėl karštas kvarcinis stiklas nesilaužęs, kai vanduo greitai atšaldomas. Laboratoriniai stiklo dirbiniai ir moksliniai tyrimai yra gaminami iš kvarco stiklo.
Paprasčiausia silicio oksido (IV) SO 2 formulė yra panaši į anglies monoksido (IV) CO 2 formulę. Tuo tarpu jų fizinės savybės labai skiriasi (SiO 2 - kietas, CO 2 - dujos). Šis skirtumas atsiranda dėl kristalų grotelių struktūros. C0 2 kristalizuojasi molekulinėje grotelėje, SiO 2 - atominėje. SiO 2 struktūrą plokščiame vaizde galima pavaizduoti taip:
Anglies atomo koordinatinis skaičius kietajame CO 2 yra 2, o silicis SiO 2 yra 4. Kiekvienas silicio atomas yra uždarytas keturių deguonies atomų tetraedre. Tuo pačiu metu silicio atomas yra centre, o deguonies atomai yra prie Tetraedro viršūnių . Visą silicio gabalėlį galima laikyti kristalu, kurio formulė yra (SiO 2) n. Ši silicio oksido (IV) struktūra lemia aukštą jo kietumą ir atsparumą ugniai .
Silicio oksido (IV) SiO 2 cheminės savybės reiškia rūgštinius oksidus. Lydant kietąsias šarmas, bazinius oksidus ir karbonatus, susidaro silicio rūgšties druskos:
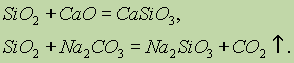
Tik silicio oksidas (IV) sąveikauja tik su fluoro rūgštimi:
Ši reakcija naudojama stiklui etchuoti. .
Silicis (IV) netirpsta vandenyje ir nėra chemiškai sąveikauja su ja. (!!!) Todėl silicio rūgštis netiesiogiai gaunama veikiant rūgštimi kalio arba natrio silikato tirpale:
Šiuo atveju silicio rūgštis (priklausomai nuo druskos ir rūgšties pradinių tirpalų koncentracijos) gali būti gaunama tiek želatinės masės, kurioje yra vandens, tiek koloidinio tirpalo (sol) pavidalu.
Silicio rūgštis. SiO 2 yra daugelio silicio rūgščių anhidridas, kurio sudėtis gali būti išreikšta bendra formule: xSiO 2 × yH 2 O, kur x ir y - sveikieji skaičiai:
1) x = 1, y = 1: SiO 2 × H2O, t.y. H 2 SiO 3 - metazilo rūgštis;
2) x = 1, y = 2: SiO2 × 2H2O, t. Y. H4 SiO 4 - ortoilicino rūgštis;
3) x = 2, y = 1: 2SiO2 × H20, t. Y. bimetakrino rūgštis.
Silicio rūgštis yra pastatyta iš tetraedrinių struktūrinių vienetų (kiekviename tokiame vienete silicio atomas yra tetraedro centre, o viršūnėse yra deguonies atomų). Struktūrinės jungtys, jungiančios grandines, sudaro stabilesnes polisilicines rūgštis:
Tokių junginių sudėtis gali būti išreikšta formule (H 2 SiO 3) n. Tačiau paprastai silicio rūgštis yra formulė H 2 SiO 3. H 2 SiO 3 - rūgštis yra labai silpna, mažai tirpsta vandenyje. Šildant lengvai skaidosi, kaip anglies rūgštis:
Visos silicio rūgštys yra labai silpnos (silpnesnės už anglis).
Silikatai. Visų silicio rūgščių druskos vadinamossilikatai, nors paprastai švietimo literatūroje silikatai reiškia metacilo rūgšties druskas. Jų sudėtį paprastai sudaro formulė elementų junginių pavidalu. Pavyzdžiui, kalcio silikatas CaSiO3 gali būti išreikštas kaip: CaO × SiO 2.
R 2 O × nSiO 2 kompozicijos silikatai, kuriuose R2O - natrio arba kalio oksidai , yra vadinami tirpus stiklas , a jų koncentruoti vandeniniai tirpalai - skystas stiklas . Natrio sodos stiklas yra svarbiausias..
Silikatų tirpalai auga ore, nes anglies dioksidas (IV) ore pakeičia druskos rūgštį iš jo druskų:
Silicio rūgštis yra praktiškai netirpi vandenyje - ši savybė naudojama kaip kokybinė reakcija į jonų SiO 3 2-.
Silikatai gaunami sujungus silicio dioksidą su šarmais arba karbonatais:
5. jonų SiO 3 atradimas 2. (nieko nerandu ...)
6. Silicio junginių vaidmuo dirvožemio formavime ir miškininkystėje.
Tepaliniai akmenys yra gana stabilūs jų sudėtyje ir juose daugiausia yra silicio, aliuminio, geležies, šarmų, magnio ir kalcio junginių. Pagal Si0 2 turinį, akmeniniai akmenys yra suskirstyti į keturias grupes: rūgštus (\u003e 65%), vidutinės (52–65%), bazinės (40-52%) ir ultrabasic (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Rūgštiniai akmeniniai akmenys- granitai, pegmatitai, riolitai, dacitas ir kt. - paprastai yra šviesios ir rusvos spalvos su ryškiais kvarco, lauko špardo, žėručio kristalais. SiO 2 kiekis juose yra didelis (daugiau kaip 65%) su dideliu kiekiu kalio ir natrio. Tuo pačiu metu mažai geležies, kalcio ir magnio yra nereikšmingi. Dirvožemis, esantis rūgščiuose klojiniuose, pvz., Ant granito, ankstyvosiose atmosferos stadijose skiriasi nuo trapumo, žaliavos žvyro pobūdžio. Kai oras susiduria drėgnomis sąlygomis, jie lengvai praranda šarminių žemių elementus, dėl kurių dirvožemis tokiuose atspariuose substratuose (akmenų pluoštas) yra labai prastas, prastai derlingas.
Pagrindiniai uodegos akmenys -bazaltas, gabbro ir tt, kaip taisyklė, turi tamsią (juodą) spalvą. Jiems būdingas mažesnis SiO 2 kiekis, palyginti su rūgštinėmis uolomis. Pagrindiniai uodegos akmenys yra gana gausūs geležies, mangano, chromo, kobalto, cinko, titano, nikelio, vario junginių. Jų atmosferos produktai gana greitai įgauna molio charakterį, ilgai išlaiko šarminę ir neutralią reakciją ir pasižymi padidėjusiu humuso ir molio mineralų kiekiu. Tokių uolienų dirvožemis yra derlingesnis.
Be rūgščių ir pagrindinių rūšių dažnai randama pereinamojo tipo klintis(vidutinės) - įsibrovančios diorito grupės uolos ir jų efusyvūs kolegos - andezitai. Atitinkamai šių uolienų dirvožemiai pasižymi panašiomis savybėmis kaip ir rūgštinėse ar pagrindinėse uolose. Daug mažiau paplitęs ultrabazinės veislės:peridotitai ir pikitai, kurių SiO 2 kiekis yra mažiausias.
Metamorfinės uolos -pereinamojo laikotarpio tarp masinių kristalinių ir nuosėdinių uolienų. Senovės nuosėdos, nardantys, aukštas slėgis ir temperatūra, yra metamorfuoti, formuojantys gneisses, serpentinitus, marmurą, kvarcitus, skalūnus. „Gneisses“ yra ypač panašūs į granitus. Dirvožemis, susidarantis ant tokių uolų, turi panašias savybes kaip ir pačių rūgštinių uolienų uolienos.
Chloras.
1. Aliuminio padėtis lentelėje DI Mendeleev. Atomo struktūra, pasireiškiantis oksidacijos laipsniu.
Chloras - VII grupės pagrindinio pogrupio elementas, trečiasis laikotarpis su atominiu skaičiumi 17. Jis žymimas simboliu Cl (lat. Chlorum). Chemiškai aktyvus ne metalo . Įtraukta į halogenų grupę .
Paprasta chloro medžiaga įprastomis sąlygomis - nuodingas dujų gelsvas-žalios spalvos yra sunkesnės už orą, turinčios stiprų kvapą . Diatominė chloro molekulė (Cl2 formulė).
Pagrindinė būsena: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-elementas. Straipsnis: -1 +1 +3 +5 +7.
Elektronų apvalkalo struktūra.
Į chloro atomo valentinį lygį yra 1 nesusijęs elektronas : 1s 2 2s 2 2p 6 3s 2 3p 5, todėl 1 chloro atomo valencija yra labai stabili. Dėl to, kad chloro atomo yra neužpildytų d-lygių orbitų, chloro atomas gali turėti kitų oksidacijos laipsnių. Atomo sužadintų būsenų susidarymo schema:
Taip pat žinomi chloro junginiai, kuriuose chloro atomas formaliai turi 4 ir 6 valentų, pavyzdžiui, Cl02 ir Cl2O6. Tačiau šie junginiai yra radikalai, ty jie turi vieną nesusijusį elektroną.
2. Fizinės savybės.
Normaliomis sąlygomis chloras yra geltonai žalios dujos su kvėpuojančiu kvapu. Kai kurios jo fizinės savybės pateiktos toliau.
Tankis: 3,214 g / l, likeris - -35 ° C - 1,557, televizorius. -105 ° C - 1,9 g / cm3.
Lydymosi temperatūra: 172,2 K
Virimo temperatūra: 238,6 K
Sulietos šilumos kiekis: 6,41 kJ / mol
Garavimo išgarinimas: 20,41 kJ / mol.
Chloro dujos yra gana lengvai suskystinamos. Pradedant 0,8 MPa (8 atmosferos) slėgiu, chloras jau bus kambario temperatūroje skystas. Aušinant iki –34 ° C temperatūros, chloras taip pat tampa skystas esant normaliam atmosferos slėgiui. Skystas chloras yra geltonas-žalias skystis, turintis labai aukštą koroziją (dėl didelės molekulių koncentracijos). Padidinant slėgį, galite pasiekti skystą chlorą iki +144 ° C temperatūros (kritinė temperatūra) esant kritiniam 7,6 MPa slėgiui. Kalbant apie elektros laidumą, skystas chloras vyksta tarp stiprių izoliatorių: jis veikia beveik milijardą kartų blogiau nei distiliuotas vanduo ir 10 22 kartus blogesnis nei sidabras. Garso greitis chlore yra maždaug pusantro karto mažesnis nei ore.
3. Gamta.
Gamtoje yra du chloro izotopai 35Cl ir 37 Cl. Chloras yra labiausiai paplitęs halogenas žemės plutoje. . Chloras yra labai aktyvus - jis tiesiogiai jungiasi su beveik visais periodinės sistemos elementais. Todėl gamtoje jis randamas tik junginių pavidalu mineralų sudėtyje:
ü halito NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofito MgCl2 · 6H2O,
ü karnititas KCl · MgCl2 · 6H2O,
ü Kainitas KCl · MgSO 4 · 3H 2 O.
Didžiausi chloro rezervai yra druskose, vandenyse, jūroje ir vandenynuose (jūros vandens kiekis yra 19 g / l). Chloras sudaro 0,024% viso žemės plutos atomų skaičiaus; klarko numeris (skaičiai, išreiškiantys vidutinį cheminių elementų kiekį žemės plutoje, hidrosferoje, Žemėje, kosmoso kūnuose, geocheminėse ar kosmocheminėse sistemose ir tt, palyginti su bendra šios sistemos mase. Jis išreiškiamas% arba g / kg.) chloras - 0,017%. Žmogaus organizme yra 0,25% chloro jonų. Žmonėms ir gyvūnams chloras daugiausia randamas tarpląsteliniuose skysčiuose (įskaitant kraują) ir vaidina svarbų vaidmenį reguliuojant osmosinius procesus, taip pat procesus, susijusius su nervų ląstelių darbu.
4. Chloro ir jo junginių cheminės savybės. Kaip gauti chlorą.
Silicio atomo struktūra. Si. +14. Susijaudinusi būsena. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
„Silicio“ pristatymo 3 pav. į chemijos pamokas apie „silicio“ temąMatmenys: 960 x 720 taškų, formatas: jpg. Norėdami atsisiųsti nemokamą chemijos pamokos vaizdą, dešiniuoju pelės mygtuku spustelėkite vaizdą ir spustelėkite „Išsaugoti vaizdą kaip ...“. Norėdami parodyti nuotraukas pamokoje, galite nemokamai atsisiųsti „Silicon.ppt“ pristatymą su visomis zip-archyvo nuotraukomis. Archyvo dydis - 562 KB.
Atsisiųsti pristatymąSilicis
"Silicis ir jo junginiai" - Atomų struktūra ir savybės. Puslaidininkiai. t lydalo (Si) = 1415 ° C, t lydalo (deimantas) = 3730 ° C. Silicio gavimas. Silicio atradimas. Taip pat yra augalų ir gyvūnų sudėtis. Silicio fizinės savybės. Taigi plyta yra keramika, o senovės graikų amforos plytelės ir fragmentai taip pat yra keramika. Tikslai: cheminės silicio savybės.
"Silicio junginiai" - silicis ir jo junginiai. SiO2 cheminės savybės. Silanas Silicio rūgšties gavimas. Silicio savybės. Silicio oksidas. Natūralūs silikatai. Oksidacijos būsena Kalnų krištolas Topazas. Silicio gavimas laboratorijoje. Būdamas gamtoje. Kristalinės grotelės. Silicio atradimas. Ametistas. Silicio gavimas.
"Silicio izotopai" - silicio izotopų atskyrimas. Polikristalinio silicio gamyba. Monoizotopinio silicio naudojimo perspektyvos. Izotopinis skiedimas auginant vieną kvarcinio tiglio kristalą. Vienkristalinių sėklų gamyba. Didžiausios Ramano juostos padėties priklausomybė nuo atominės masės.
„Silicio pamoka“ - Kuris iš svarbiausių gyvų ir negyvybinių cheminių elementų? Anglies ir silicio oksidai. Medžiaga yra skaidri. Dėl nemetalinių ir metalinių savybių pasireiškimo. Apibendrinimas. Galutinis bandymas. Anglies ir silicio hidroksidų oksidai? Agregacijos būsena: a) skystis, b) dujos, c) kieta.
"Silicis" - silicis yra paprasta medžiaga. Fizinės savybės. Silicio oksidas (IV). Silicidai Gyvų organizmų reikšmė. Sąveika su metalais. Sąveika su nemetalais. Silicio karbidas. Silicis gamtoje. Silicis. Silikato pramonės produktai. Vienas iš natūralių silicio junginių tipų yra silikatai.
"Anglis ir silicis" - silicio oksidas (IV). Pagrindinio pogrupio IV grupės elementai. Toksiškumas. 7. Įdomu anglies. Silikatai. Paslenkite. Deimantas yra sunkiausia natūrali medžiaga. Cheminės savybės Daugiau kaip 99% anglies anglies dioksido. Karbidai. 6. Taikymas. Vienas iš minkštiausių tarp kietųjų medžiagų.
Iš viso yra 6 pristatymai.
