Saat menghubungkan 28 g silikon dengan oksigen. Senyawa oksigen silikon
Silikon. Karakteristik umum. Perbedaan utama dari karbon: tidak adanya ikatan p dalam senyawa. Silisida. Senyawa dengan hidrogen (silan), oksidasi dan hidrolisis. Tetrafluorida dan silikon tetraklorida, hidrolisis. Hexafluorosilikat. Senyawa oksigen. Silikon oksida (IV). Silika gel. Kremnev asam. Silikat. Kelarutan dan hidrolisis. Silikat alami dan aluminosilikat, zeolit. Senyawa organosilicon. Silikon dan siloksan. Penggunaan senyawa silikon dalam pengobatan.
Silikon (lat. Silicium), Si, elemen kimia Grup IV Sistem Berkala; nomor atom 14, massa atom 28.086. Silicon juga memamerkan hibridisasi elektronik sp3
orbital. Pada lapisan elektron terluar atom silikon terdapat valensi 3d-
orbital (Si: 3s23p23d0),
Silikon setelah oksigen adalah unsur paling umum di kerak bumi. Tidak seperti karbon dalam keadaan bebas, silikon tidak ditemukan di alam. Senyawa yang paling umum adalah silikon oksida (IV) SiO2 dan garam asam silikat, silikat. Mereka membentuk cangkang kerak bumi. Senyawa silikon ditemukan pada tumbuhan dan hewan. Dengan sifat kimia, silikon, seperti karbon, adalah non-logam, tetapi non-logamnya kurang jelas, karena memiliki jari-jari atom lebih besar
Silikon. membentuk senyawa dengan hampir semua logam - dengan icicides (tidak ditemukan senyawa hanya dengan Bi, Tl, Pb, Hg). Lebih dari 250 silisida diperoleh, yang komposisinya (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, dll.) Biasanya tidak sesuai dengan valensi klasik. Silisida berbeda dalam hal refraktilitas dan kekerasan; ferrosilicon (zat pereduksi dalam peleburan paduan khusus, lihat Ferroalloys) dan molibdenum silisida MoSi2 (pemanas tungku listrik, bilah turbin gas, dll.) merupakan hal penting yang paling praktis.
Silane Di bawah aksi asam klorida pada silisida, senyawa hidrogen paling sederhana dari silikon adalah silan SiH4:
Silane adalah gas beracun dengan bau tidak sedap yang menyala secara spontan. udara
Mereka reaktif dan agen pereduksi kuat.
bereaksi dengan air saat suhu kamar:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluoride Silikon diproduksi oleh fluorinasi silikon dioksida dengan unsur fluor.
Proses fluorinasi dilakukan dalam dua tahap dalam reaktor nyala, mengarahkan kelebihan unsur fluor dari tahap 1 ke tahap 2.
Hasil teknis adalah produksi silikon dalam mode kontinu dengan hasil tinggi dan kualitas produk.
Silikon tetrafluoride SiF4 dibentuk oleh aksi asam hidrofluorik (hidrofluorik) pada gelas:
Na2SiO3 + 6HF® 2NaF + SiF4 + 3H2O
Senyawa oksigen silikon
Senyawa oksigen paling penting dari silikon adalah silikon dioksida SiO2 (silika), yang memiliki beberapa modifikasi kristal.
Modifikasi suhu rendah (hingga 1143 K) disebut kuarsa. Kuarsa memiliki sifat piezoelektrik. Varietas kuarsa alami: kristal batu, topas, batu kecubung. Varietas silika adalah kalsedon, opal, agate,. jasper, pasir.
Silika tahan secara kimia; itu hanya dipengaruhi oleh fluor, asam hidrofluorik dan larutan alkali. Dengan mudah masuk ke kondisi kaca (kaca kuarsa). Kaca kuarsa rapuh, sangat tahan bahan kimia dan panas. Asam silikat SiO2 yang sesuai tidak memiliki komposisi khusus. Biasanya, asam silikat dicatat sebagai xH2O-ySiO2. Asam silikat dipilih: H2SiO3 (H2O-SiO2) - meta-silikon (tiga-oxo-silikon), H4Si04 (2H20-Si02) - orto-silikon (tetra-oxo-silikon), H2Si2O5 (H2O * SiO2) - silikon dimetik
Asam silikat adalah zat yang sulit larut. Sesuai dengan sifat silikon metaloid yang lebih sedikit dibandingkan dengan karbon, H2SiO3 sebagai elektrolit lebih lemah dari H2CO3.
Sesuai dengan asam silikat, garam-silikat dalam air tidak dapat larut (kecuali silikat logam alkali). Silikat terlarut dihidrolisis oleh persamaan
2SiO3 - + H20 = Si2O52- + 20H-.
Solusi terkonsentrasi silikat terlarut disebut gelas cair. Silikat kaca jendela biasa dari natrium dan kalsium memiliki komposisi Na20-CaO-6Si02. Itu diperoleh melalui reaksi
Berbagai macam silikat (lebih tepatnya, oksosilikat) diketahui. Keteraturan tertentu diamati dalam struktur oksosilikat: semua terdiri dari Si04 tetrahedra, yang terhubung satu sama lain melalui atom oksigen. Kombinasi tetrahedra yang paling umum adalah (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), yang, sebagai unit struktural, dapat digabungkan menjadi rantai, pita, jaring, dan kerangka (Gbr. 4).
Silikat alami yang paling penting adalah, misalnya, talk (3MgO * H20-4Si02) dan asbes (SmgO * H2O * SiO2). Seperti halnya SiO2, keadaan kaca (amorf) adalah karakteristik dari silikat. Dengan kristalisasi kaca yang terkontrol, dimungkinkan untuk memperoleh keadaan kristal-halus (sitalls). Sitalls ditandai dengan peningkatan kekuatan.
Selain silikat, aluminosilikat tersebar luas di alam. Aluminosilikat - kerangka oksosilikat, di mana sebagian atom silikon digantikan oleh trivalen Al; mis. Na12 [(Si, Al) 04] 12.
Untuk asam silikat, keadaan koloid adalah karakteristik ketika garam asam H2SiO3 tidak terpengaruh langsung. Larutan koloid asam silikat (sol) dalam kondisi tertentu (misalnya, ketika dipanaskan) dapat diubah menjadi massa-gel asam silikat yang transparan dan homogen seperti gel. Gel adalah senyawa molekul tinggi dengan struktur spasial, sangat longgar yang dibentuk oleh molekul SiO2, yang rongga-rongganya diisi dengan molekul H2O. Ketika mendehidrasi silika gel, silika gel diperoleh - produk berpori dengan kapasitas adsorpsi tinggi.
Silikon oksida (IV) (silika) - senyawa paling umum di kerak bumi, membentuk 12% dari massa dalam bentuk berbagai mineral. Bedakan antara kristal dan silika amorf. Formula paling sederhana untuk silikon oksida (IV) adalah SiO2. Ini mengkristal dalam kisi atom.
1) Kristal silika - dalam bentuk mineral kuarsa dan varietasnya (kristal batu, kalsedon, batu akik, jasper, batu api); kuarsa membentuk dasar pasir kuarsa yang banyak digunakan dalam konstruksi dan industri silikat.
2) silika amorf - dalam bentuk komposisi mineral opal SiO2 nH2O; bentuk silika amorf yang bersahaja adalah diatomit, Tripoli (bumi infusorial); Contoh dari silika anhidrat amorf buatan adalah silika gel, yang diperoleh dari natrium metasilikat:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Silica gel memiliki permukaan yang berkembang sehingga menyerap kelembaban dengan baik.
Gel silika adalah gel kering yang dibentuk dari larutan asam silicat jenuh (nSiO2 · mH2O) pada pH\u003e 5-6. Sorben hidrofilik padat.
Mendapatkan
Ini diperoleh dengan pengasaman larutan alkali logam silikat, diikuti dengan mencuci dan mengeringkan gel yang terbentuk:
Asam silikat. SiO2 adalah anhidrida dari sejumlah asam silikat
Asam silikat dibangun dari unit struktural tetrahedral (di setiap unit tersebut, atom silikon berada di tengah tetrahedron, dan ada atom oksigen di bagian atas). Tautan struktural, menyatukan dalam rantai, membentuk asam polisilikon yang lebih stabil:
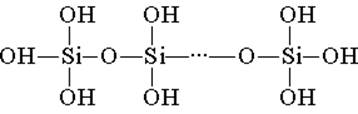
Komposisi senyawa tersebut dapat dinyatakan dengan rumus (H2SiO3) n. Namun, asam silikat biasanya diwakili oleh rumus H2SiO3. H2SiO3 - asam sangat lemah, sedikit larut dalam air. Saat dipanaskan, asam ini mudah terurai dengan cara yang sama dengan asam karbonat:
Semua asam silikat sangat lemah (lebih lemah dari batubara).
Silikat. Garam dari semua asam silikat disebut silikat, meskipun, sebagai suatu peraturan, dalam literatur pendidikan, silikat menyiratkan garam dari asam metakristalin. Komposisi mereka biasanya diwakili oleh formula dalam bentuk senyawa oksida unsur. Sebagai contoh, kalsium silikat CaSiO3 dapat dinyatakan sebagai: CaO × SiO2.
Silikat komposisi R2O × nSiO2, di mana R2O adalah natrium atau kalium oksida, disebut gelas larut, dan larutan encer pekatnya disebut gelas cair. Yang paling penting adalah gelas yang larut dalam natrium.
Ketika berdiri di udara, larutan silikat tumbuh keruh, karena karbon dioksida (IV) di udara menggantikan asam silikat dari garamnya:
Asam silikat praktis tidak larut dalam air - sifat ini digunakan sebagai reaksi kualitatif terhadap ion SiO32-.
Silikat diperoleh dengan menggabungkan silika dengan alkali atau karbonat:
Kelarutan asam silikat dan laju pembubarannya tergantung pada beberapa faktor, yang paling penting adalah modifikasi silikon dioksida yang diambil, derajat dispersi, dan suhu. Ketika mengocok gel silika dengan air, keseimbangan kelarutan terbentuk dalam beberapa jam, dalam kasus kuarsa, diperlukan berbulan-bulan bahkan bertahun-tahun.
SILIKAT ALAMI (dari bahasa Latin. silex, genus. kasus silicis - flint * a. silikat alami; N. naturliche Silikate; F. silikat naturel; dan. silicatos naturales) - kelas mineral, garam silikat, iso- dan asam heteropolikristalin. Pangsa silikat alami menyumbang hingga 75% dari massa kerak bumi dan sekitar 25% dari spesies mineral. Di alam, lebih dari 700 silikat alami diketahui, termasuk mineral pembentuk batuan yang paling penting (feldspars, pyroxenes, amphiboles, micas, dll.)
Aluminosilikat - sekelompok silikat alami dan sintetik, anion kompleks yang mengandung silikon dan aluminium. Contoh anion kompleks: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, dan terkadang Ba2 + dan Li + bertindak sebagai kation.
Aluminosilikat alami adalah mineral yang paling umum, mereka menyumbang hingga 50% dari massa kerak bumi. Ini termasuk feldspars (albite, orthoclase, anortite), mineral lempung dan mika.
Zeolit - Ini adalah aluminosilikat berair kalsium, natrium, kalium, barium dan beberapa elemen lainnya. Kelompok zeolit mencakup lebih dari empat puluh mineral, yang berbeda dalam komposisi (terutama dalam jumlah molekul air dalam hidrat kristalin), dan tentu saja dalam sifat fisik dan kimia. Tetapi hampir semua perwakilan dari kelompok mineral ini memiliki milik bersama - mereka adalah sorben yang baik, memiliki sifat penukar ion, dapat mengubah mobilitas ion individu dan bekerja sebagai saringan molekuler. Dan relatif baru-baru ini, mineral ini telah menemukan penggunaan yang sama sekali tidak terduga - mereka mulai digunakan dalam pertanian.
Senyawa organosilicon - Senyawa yang molekulnya ada ikatan antara silikon dan atom karbon. Senyawa organosilicon kadang-kadang disebut silikon, dari nama silikon Latin "silikon". Senyawa organosilicon digunakan untuk menghasilkan pelumas, polimer, karet, karet, cairan silikon dan emulsi. Senyawa organosilicon digunakan dalam kosmetik, bahan kimia rumah tangga, cat dan pernis, deterjen. Fitur khas produk-produk yang berdasarkan pada senyawa organosilicon dari produk-produk yang berdasarkan pada senyawa organik yang umum, pada umumnya, memiliki kinerja dan karakteristik yang lebih tinggi, serta keamanan penggunaan manusia. Polimer silikon dapat digunakan untuk membuat cetakan dalam masakan. Polimerisasi senyawa organosilicon dan sealant aman bagi manusia dan tidak memerlukan ekstraksi.
Siloksan - senyawa yang mengandung atom silikon dan oksigen bolak-balik dalam molekul. Yang tertinggi memiliki siloxanes dengan berat molekul tinggi - polyorganosiloxanes; lihat polimer silikon.
Silikon (polyorganosiloxanes) - senyawa organosilicon beroksigen tinggi dengan berat molekul tinggi dengan rumus kimia n, di mana R = kelompok organik (metil, etil atau fenil). Sekarang definisi ini sangat jarang dipatuhi, dan polyorganosiloxanes (misalnya, minyak silikon tipe PMS, penolak air jenis NGL atau karet SKTN berat molekul rendah) dan bahkan monomer organosilicon (berbagai silan) juga digabungkan menjadi "silikon", menghapus perbedaan antara "silikon" dan " silikon. "
Silikon metalik  Silikon kristal
Silikon kristal
Silikon (Si). Unsur kimia ini adalah 1/4 dari komposisi kerak bumi. Kuarsa, batu kristal, pasir, tanah liat, granit, mika, asbes - semua ini senyawa kimia silikon
Silikon adalah elemen antara (amfoter) dan dapat menunjukkan sifat logam dan non-logam. Dapat membentuk senyawa kimia, baik dengan logam maupun non-logam.
Silikon murni - zat kimiawi sederhana dari warna abu-abu, keras, tahan api dan rapuh. Silikon kristal memiliki kilau logam dan banyak digunakan dalam industri semikonduktor (adalah semikonduktor).
Silikon dapat meregang seperti dalam keadaan kristal ( silikon kristal), dan dalam keadaan amorf ( silikon amorf). Silikon kristalin dibentuk dengan mendinginkan larutan silikon amorf dalam logam cair. Pada gilirannya, silikon kristal adalah bahan yang sangat rapuh dan mudah dihancurkan menjadi bubuk amorf. Jadi, silikon amorf adalah fragmen kristal silikon kristalin.
Dalam keadaan bebas, silikon cukup sulit didapat. Produksi industrinya dikaitkan dengan pemulihan kuarsa, rumus kimia dimana - SiO 2, reaksi reduksi dihasilkan oleh kokas panas (karbon).
SiO 2 + C → CO 2 + Si
Di laboratorium, silikon murni direduksi dari pasir silika dengan magnesium logam menggunakan reaksi berikut:
SiO 2 + 2Mg → Si + 2MgO.
Selama reaksi ini, bubuk coklat silikon amorf terbentuk. Ketika dipanaskan, bubuk tersebut dapat bereaksi lambat dengan larutan alkali pekat (misalnya, natrium hidroksida NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - zat kompleks yang dihasilkan - juga disebut gelas cair.
Sangat menarik bahwa aktivitas kimia silikon tergantung pada ukuran kristalnya. Silikon kristalin kurang aktif secara kimia dari pada amorf. Yang terakhir bereaksi dengan mudah dengan fluor bahkan pada suhu biasa, dan pada suhu 400 - 600 0 C bereaksi dengan oksigen, klor, brom, belerang untuk membentuk senyawa kimia yang sesuai. Pada suhu yang sangat tinggi, silikon bereaksi dengan nitrogen dan karbon untuk membentuk, masing-masing, nitrida dan silikon karbida.
Jika Anda mencoba melarutkan silikon dalam campuran asam fluorida HF (hidrofluorik) dan asam nitrat HNO 3, maka reaksi tidak akan dilanjutkan. Tetapi jika Anda melakukan reaksi kimia dengan alkali, misalnya, dengan kalium hidroksida, maka reaksi akan terjadi dengan pembentukan garam asam silikat.
Si + KOH → K 2 SiO 3 + H 2
Jika dikalsinasi dalam tungku silika (pasir) dengan kokas, ternyata zat kristalin yang sangat padat. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - zat yang sangat keras dan tahan api. Dalam industri, diproduksi dalam jumlah besar karena sifat-sifat ini. Menariknya, kisi kristal carborundum mirip dengan kisi zat yang paling sulit - berlian, tetapi di dalamnya atom karbon individu secara seragam digantikan oleh atom silikon.
Pada suhu tinggi, serta selama reaksi kimia di bawah aksi asam pada senyawa logam dengan silikon, silan Sih 4.
Silane - itu adalah gas tidak berwarna yang menyala sendiri. Dapat menyala di udara untuk membentuk silika dan air.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Jika silikon oksida SiO 2 dipanaskan dengan adanya karbon dalam aliran klor, reaksi kimia terjadi dengan pembentukan silikon klorida
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Silikon klorida - itu adalah cairan, suhu mendidih yang hanya 54 0 C. Silikon klorida mudah larut dalam air dengan pembentukan larutan dua asam: silikat dan hidroklorik
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Jika reaksi kimia ini berlangsung dalam atmosfer udara lembab, asap tebal akan muncul selama pembentukan dua asam.
Silikon fluorida SiF 4 - terbentuk sebagai hasil reaksi kimia asam fluorida dan silikon oksida
SiO 2 + 4HF → SiF 4 + 2H 2 O
Silikon fluorida adalah gas tidak berwarna dengan bau "kuat". Seperti halnya silikon klorida, dalam air gas ini membentuk dua asam: silikon dan hidrofluorik. Namun yang menarik, silikon fluorida dapat berinteraksi dengan asam hidrofluorat untuk terbentuk asam heksafluorosilikat yang rumus kimianya adalah H 2 SiF 6. Garam dan asamnya sendiri beracun.
Silikon
Logam tidak mulia dan bukan logam
Dalam pelajaran ini Anda akan mempelajari topik "Silikon". Pertimbangkan informasi tentang silikon: struktur elektroniknya, di mana silikon berada di alam, pelajari alotropi silikon, jelaskan fisiknya dan sifat kimia. Pelajari di mana silikon digunakan dalam industri dan bidang lain, bagaimana silikon diproduksi. Anda akan berkenalan dengan silika, asam silikat dan garamnya - silikat.
Topik: Logam dasar dan non-logam
Pelajaran: Silikon. Gas mulia
Silikon adalah salah satu unsur kimia paling umum di kerak bumi. Kontennya hampir 30%. Di alam, itu terutama ditemukan dalam berbagai bentuk silikon dioksida, silikat dan aluminosilikat.
Silikon bersifat tetravalen di hampir semua senyawanya. Dalam hal ini, atom silikon berada dalam keadaan tereksitasi. Fig. 1.
Untuk memasuki kondisi ini, salah satu dari elektron 3s menempati tempat kosong pada orbital 3p. Dalam hal ini, alih-alih 2 elektron tidak berpasangan dalam keadaan dasar, atom silikon dalam keadaan tereksitasi akan memiliki 4 elektron tidak berpasangan. Dia akan dapat membentuk 4 ikatan kovalen dengan mekanisme pertukaran.


Atom silikon tidak rentan terhadap pembentukan ikatan rangkap, tetapi membentuk senyawa dengan ikatan tunggal-Si-O-. Silikon, tidak seperti karbon, tidak khas dari alotropi.
Salah satu modifikasi allotropic adalah silikon kristaldi mana setiap atom silikon dalam sp 3 hibridisasi. Fig. 2, 3. Silikon kristal adalah zat kristalin padat, tahan api, dan tahan lama berwarna abu-abu gelap dengan kilau logam. Dalam kondisi normal - semikonduktor. Terkadang, silikon amorf juga dipancarkan sebagai modifikasi alotropik silikon lainnya. Ini adalah bubuk coklat gelap, lebih aktif secara kimia dari silikon kristalin. Apakah itu modifikasi allotropik adalah titik diperdebatkan.
Sifat kimia silikon
1. Interaksi dengan halogen
Si + 2F 2 → SiF 4
2. Ketika dipanaskan, silikon terbakar dalam oksigen, silika (IV) terbentuk.
Si + O 2 → SiO 2
3. Pada suhu tinggi, silikon berinteraksi dengan nitrogen atau karbon.
3Si + 2N 2 → Si 3 N 4
4. Silikon tidak bereaksi dengan larutan asam berair. Tetapi larut dalam alkali.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Ketika silikon menyatu dengan logam, silisida terbentuk.
Si + 2Mg → Mg 2 Si
6. Silikon tidak secara langsung berinteraksi dengan hidrogen, tetapi senyawa hidrogen silikon dapat diperoleh melalui interaksi silisida dengan air.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silan)
Silan memiliki struktur yang mirip dengan alkana, tetapi sangat reaktif. Monosilan yang paling stabil mudah terbakar di udara.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Mendapatkan silikon
Silikon diperoleh dengan reduksi dari silikon oksida (IV)
SiO 2 + 2Mg → Si + 2MgO
Salah satu tugasnya adalah mendapatkan silikon dengan kemurnian tinggi. Untuk tujuan ini, silikon teknis ditransfer ke silikon tetraklorida. Tetraklorida yang dihasilkan direduksi menjadi silan, dan silan terurai menjadi silikon dan hidrogen ketika dipanaskan.
Silikon mampu membentuk dua oksida: SiO 2 - silikon oksida (IV) dan SiO - silikon oksida (II).
SiO - silikon oksida (II) - ini adalah zat coklat gelap amorf, yang dibentuk oleh interaksi silikon dengan silikon oksida (IV)
Si + Sio 2 → 2 Sio.
Meskipun stabil, zat ini hampir tidak pernah digunakan.
SiO 2 - silikon oksida (IV)


Zat ini menyumbang 12% dari kerak bumi. Fig. 4. Diwakili oleh mineral seperti kristal batu, kuarsa, batu kecubung, citrine, jasper, kalsedon. Fig. 5
SiO 2 - silikon oksida (IV) - suatu zat dari struktur non-molekul.
Kisi kristalnya adalah atom. Fig. 6. Kristal SiO 2 memiliki bentuk tetrahedron, yang saling berhubungan oleh atom oksigen. Rumus molekul (SiO 2) n akan lebih benar. Karena SiO 2 membentuk substansi struktur atom, dan CO 2 - dari struktur molekul, perbedaan sifatnya jelas. CO 2 adalah gas, dan SiO 2 adalah zat kristal transparan yang padat, tidak larut dalam air dan tahan api.
Sifat kimiaSiSekitar 2
1. Silikon oksida (IV) SiO 2 adalah oksida asam. Itu tidak bereaksi dengan air. Asam silikat tidak dapat diperoleh dengan hidrasi SiO 2. Garamnya, silikat, dapat diperoleh dengan mereaksikan SiO 2 dengan larutan alkali panas.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Bereaksi dengan karbonat dari logam alkali dan alkali tanah.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Berinteraksi dengan logam.
SiO 2 + 2Mg → Si + 2MgO
4. Reaksi dengan asam hidrofluorik.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Sifat kimia asam silikat dan silikat
Mendapatkan asam silikat
Asam silikat mengendap sebagai senyawa polimer. Formula Asam Silikat -
H 2 SiO 3 (bentuk meta) dan H 4 SiO 4 (bentuk ortho) - mencerminkan rasio elemen, tetapi bukan komposisi sebenarnya. Secara konvensional, di pesawat, komposisi asam silikat digambarkan sebagai 7
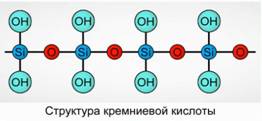
Untuk asam silikat, formula H 2 SiO 3 selalu digunakan.
1. H 2 Sio 3 terurai saat dipanaskan
H 2 SiO 3 H 2 O + SiO 2 (silika gel)
2. Berinteraksi dengan larutan alkali
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Garam asam silikat - silikat - lihat senyawa ionik. Ini adalah zat padat berwarna. Hanya silikat logam alkali, kecuali litium, yang larut dalam air.
1. Silikat larut dihidrolisis oleh anion
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. Silikat larut berinteraksi dengan asam kuat.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
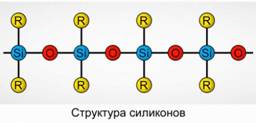
Polyorganosiloxanes (silikon)
Polyorganosiloxanes (silikon) adalah senyawa organosilicon beroksigen tinggi dengan berat molekul tinggi.
R 2 [ Sio] n
R adalah kelompok organik (metil, etil atau fenil). Dasar dari struktur siloxanes adalah rantai atom silikon dan oksigen bolak-balik. Gbr.8. Dengan memvariasikan panjang rantai dan gugus organik, silikon dengan sifat yang berbeda dapat diperoleh. Dengan mengubah kondisi polimerisasi, Anda bisa mendapatkan molekul dengan panjang yang berbeda.


Polimer rantai pendek adalah cairan, lebih panjang merupakan pelumas yang berharga. Fig. 9, yang mempertahankan sifat mereka dalam kisaran suhu yang sangat besar dari
100 0 to hingga + 300 0 molecules Molekul yang lebih panjang membentuk karet yang tidak kehilangan elastisitasnya pada suhu rendah. Memiliki daya tahan tinggi terhadap gesekan, secara kimiawi lembam. Fig. 10. Itu menyebabkan berbagai varian aplikasi mereka. Mereka dapat digunakan untuk membuat mesin jantung atau ginjal buatan, dan dapat digunakan sebagai sepatu untuk sepatu. Polimer siloksan digunakan dalam pengobatan untuk membuat berbagai implan jaringan lunak, karena polimer tersebut bersifat inert secara kimia dan tidak ditolak oleh tubuh. Mereka tidak dibasahi dengan air. Ini digunakan dalam krim. Saat mengoleskan krim ini di tangannya, ia akan mengganti sarung tangan karet.
Kebun Anorganik
Dalam gelas transparan yang diisi dengan natrium silikat, celupkan kristal garam berwarna, misalnya, tembaga sulfat. Setelah beberapa waktu, dapat dilihat bahwa tabung berlubang tipis terbentuk dari kristal, yang terdiri dari silikat yang tidak larut. Fig. 11

Menjadi dempul "bodoh"
Volume yang sama dari natrium silikat dan alkohol medis dicampur. Endapan disaring dan diperas agar tidak meneteskan alkohol. Ini dempul. Fig. 12. Dinamai demikian karena direncanakan untuk menggunakannya sebagai dempul untuk windows. Tetapi ternyata ia memiliki sifat seperti itu sehingga tidak dapat digunakan untuk tujuan yang dimaksudkan. Jika Anda melempar bola dan melemparkannya ke lantai, bola itu akan memantul seperti bola karet. Jika diletakkan di atas meja, itu akan menyebar seperti cairan. Jika Anda mengenai benda padat, benda itu akan hancur seperti benda padat. Setelah beberapa saat, ketika alkohol mengering, dempul ini akan hancur.
![]()
Ringkas pelajaran
Dalam pelajaran ini, Anda telah mempelajari topik "Silikon." Kami memeriksa informasi tentang silikon: struktur elektroniknya, tempat silikon berada di alam, mempelajari alotropi silikon, menjelaskan sifat fisik dan kimianya. Mereka belajar tentang di mana silikon digunakan dalam industri dan bidang lain, bagaimana silikon diproduksi. Anda bertemu dengan silika, asam silikat dan garamnya - silikat.
Referensi
1. Rudzitis G.E. Kimia Dasar-dasar kimia umum. Kelas 11: buku teks untuk lembaga pendidikan: tingkat dasar / G.E. Rudzitis, F.G. Feldman. - edisi ke-14. - M.: Pencerahan, 2012.
2. Popel P.P. Kimia: 8 cl .: Buku Pelajaran untuk sekolah menengah / PP. Popel, L.S. - К.: ИЦ "Academy", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. Kimia Kelas 11. Tingkat dasar 2nd ed., Sr. - M.: Drofa, 2007. - 220 hlm.
PR
1. №№2-4 (hlm. 138) Rudzitis G.E. Kimia Dasar-dasar kimia umum. Kelas 11: buku teks untuk lembaga pendidikan: tingkat dasar / G.E. Rudzitis, F.G. Feldman. - edisi ke-14. - M.: Pencerahan, 2012.
2. Apa saja aplikasi dari polyorganosiloxanes.
3. Bandingkan sifat-sifat modifikasi alotropik silikon.
