Belerang. Hidrogen sulfida dan sulfida
4.doc
240Belerang. Hidrogen sulfida, sulfida, hidrosulfida. Sulfur oksida (IV) dan (VI). Asam sulfat dan asam sulfat dan garamnya. Ester asam sulfat. Sodium Tiosulfat
4.1. Belerang
Belerang adalah salah satu dari beberapa unsur kimia yang digunakan orang selama beberapa milenium. Ini didistribusikan secara luas di alam dan ditemukan baik dalam keadaan bebas (sulfur asli) dan dalam senyawa. Mineral yang mengandung sulfur dapat dibagi menjadi dua kelompok - sulfida (pirit, glitter, boneka) dan sulfat. Belerang asli ditemukan dalam jumlah besar di Italia (Pulau Sisilia) dan Amerika Serikat. Di CIS, endapan belerang asli ditemukan di wilayah Volga, di negara-negara Asia Tengah, di Krimea dan daerah lainnya.
Mineral dari kelompok pertama meliputi PbS pembersih timah, pembersih tembaga Cu 2 S, pembersih perak - Ag 2 S, seng blende - ZnS, kadmium halangan - CdS, pirit atau besi pirit - FeS 2, kalkopirit - CuFeS 2, cinnabar - HgS.
Mineral kelompok kedua meliputi gipsum CaSO 4 2H 2 O, mirabilite (garam Glauber) - Na 2 SO 4 10H 2 O, dan kizerite - MgSO 4 H 2 O.
Belerang ditemukan pada hewan dan tumbuhan, sebagai bagian dari molekul protein. Senyawa sulfur organik ditemukan dalam minyak bumi.
Mendapatkan
1. Ketika belerang diperoleh dari senyawa alami, misalnya, dari belerang piritik, ia dipanaskan hingga suhu tinggi. Sulfur pirit terurai menjadi besi (II) sulfida dan belerang:
2. Sulfur dapat diperoleh dengan oksidasi hidrogen sulfida oleh kurangnya oksigen oleh reaksi:
2H 2 S O 2 = 2S 2H 2 O
3. Saat ini, pemulihan belerang dengan reduksi karbon dioksida dari sulfur dioksida SO 2 adalah produk sampingan yang umum dalam peleburan logam dari bijih belerang:
SO 2 C = CO 2 S
4. Gas limbah metalurgi dan oven kokas mengandung campuran sulfur dioksida dan hidrogen sulfida. Campuran ini dilewatkan pada suhu tinggi di atas katalis:
H 2 S SO 2 = 2H 2 O 3S
^ Sifat fisik
Belerang adalah warna kuning lemon yang keras dan rapuh. Ini praktis tidak larut dalam air, tetapi larut dalam CS2 anilin dalam karbon disulfida dan beberapa pelarut lainnya.
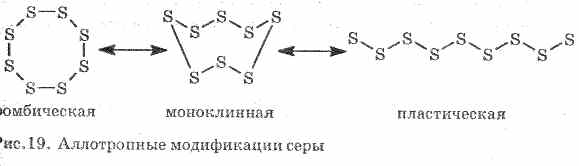
Miskin menghantarkan panas dan arus listrik. Belerang membentuk beberapa modifikasi alotropik:
1 . ^ Sulfur belerang (paling stabil), kristal memiliki bentuk octahedra.
Ketika belerang dipanaskan, warna dan viskositasnya berubah: pertama, kuning muda terbentuk, dan kemudian ketika suhu meningkat, ia menjadi gelap dan menjadi begitu kental sehingga tidak mengalir keluar dari tabung, dengan pemanasan lebih lanjut, viskositas turun lagi, dan pada 444, 6 ° sulfur belerang mendidih .
2. ^ Belerang monoklinik - modifikasi dalam bentuk jarum kuning gelap, diperoleh dengan secara perlahan mendinginkan belerang cair.
3. Belerang plastikterbentuk jika belerang yang dipanaskan hingga mendidih dituangkan ke dalam air dingin. Mudah direntangkan seperti karet (lihat gbr. 19).
Sulfur alami terdiri dari campuran empat isotop stabil: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Sifat kimia
Atom belerang, yang memiliki tingkat energi eksternal yang tidak lengkap, dapat menempel dua elektron dan menunjukkan derajat
Oksidasi -2. Belerang menunjukkan keadaan oksidasi dalam senyawa dengan logam dan hidrogen (Na 2 S, H 2 S). Ketika mundur atau menipisnya elektron ke atom unsur yang lebih elektronegatif, tingkat oksidasi belerang mungkin 2, 4, 6.
Belerang relatif lembam dalam cuaca dingin, tetapi dengan meningkatnya suhu, reaktivitasnya meningkat. 1. Dengan logam, sulfur menunjukkan sifat pengoksidasi. Ketika reaksi-reaksi ini membentuk sulfida (dengan emas, platinum dan iridium tidak bereaksi): Fe S = FeS
2. Dalam kondisi normal, sulfur tidak bereaksi dengan hidrogen, dan pada 150-200 ° C terjadi reaksi reversibel:
3. Dalam reaksi dengan logam dan dengan hidrogen, belerang berperilaku sebagai zat pengoksidasi yang khas, dan dengan adanya zat pengoksidasi kuat menunjukkan sifat-sifat pereduksi.
S 3F 2 = SF 6 (tidak bereaksi dengan yodium)
4. Pembakaran sulfur dalam oksigen berlangsung pada 280 ° C, dan di udara pada 360 ° C. Ini membentuk campuran SO 2 dan SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Ketika dipanaskan tanpa udara, sulfur langsung bergabung dengan fosfor, karbon, menunjukkan sifat pengoksidasi:
2P 3S = P 2 S 3 2S C = CS 2
6. Saat berinteraksi dengan zat kompleks, sulfur berperilaku terutama sebagai zat pereduksi:
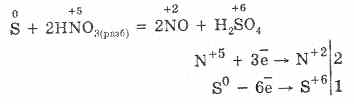
7. Belerang mampu bereaksi tidak proporsional. Jadi, ketika mendidih bubuk belerang dengan alkali, sulfit dan sulfida terbentuk:
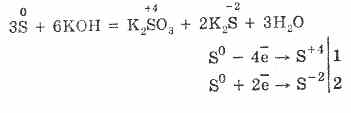
Aplikasi
Belerang banyak digunakan dalam industri dan pertanian. Sekitar setengah dari produksinya dikonsumsi untuk menghasilkan asam sulfat. Belerang digunakan untuk vulkanisasi karet: dalam hal ini, karet diubah menjadi karet.
Dalam bentuk belerang (serbuk halus) belerang digunakan untuk memerangi penyakit kebun anggur dan kapas. Ini digunakan untuk memperoleh bubuk mesiu, korek api, komposisi bercahaya. Dalam pengobatan, salep belerang disiapkan untuk pengobatan penyakit kulit.
4.2. Hidrogen sulfida, sulfida, hidrosulfida
Hidrogen sulfida adalah analog air. Formula elektroniknya
Ini menunjukkan bahwa dua elektron p dari tingkat eksternal atom sulfur terlibat dalam pembentukan ikatan H - S - H. Molekul H 2 S memiliki bentuk sudut, sehingga polar.
^ Berada di alam
Hidrogen sulfida ditemukan di alam dalam gas vulkanik dan di perairan beberapa sumber mineral, seperti Pyatigorsk, Matsesta. Ini dibentuk oleh pembusukan zat organik yang mengandung sulfur dari berbagai residu hewan dan tumbuhan. Ini menjelaskan karakteristik bau yang tidak menyenangkan dari limbah, tangki septik dan tempat pembuangan sampah.
Mendapatkan
1. Hidrogen sulfida dapat diperoleh dengan koneksi langsung sulfur dengan hidrogen dengan memanaskan:
2. Tapi biasanya itu diperoleh dengan aksi asam klorida encer atau asam sulfat pada besi (III) sulfida:
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Reaksi ini sering dilakukan dalam peralatan Kipp.
^ Sifat fisik
Dalam kondisi normal, hidrogen sulfida adalah gas tidak berwarna dengan bau telur busuk yang kuat. Sangat beracun, penghirupan berikatan dengan hemoglobin, menyebabkan kelumpuhan, yang tidak sehat.
Ko menyebabkan kematian. Dalam konsentrasi rendah, kurang berbahaya. Penting untuk bekerja dengannya di lemari knalpot atau dengan perangkat tertutup rapat. Konten yang diizinkan dari H 2 S di tempat produksi adalah 0,01 mg per 1 liter udara.
Hidrogen sulfida relatif mudah larut dalam air (pada 20 ° 2.5 2,5 volume hidrogen sulfida larut dalam 1 volume air).
Suatu larutan hidrogen sulfida dalam air disebut air hidrogen sulfida atau asam hidrogen sulfida (ia mendeteksi sifat-sifat asam lemah).
^ Sifat kimia
1, Ketika sangat panas, hidrogen sulfida hampir sepenuhnya terurai untuk membentuk belerang dan hidrogen.
2. Gas hidrogen sulfida terbakar di udara dengan nyala biru dengan pembentukan sulfur oksida (IV) dan air:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Dengan kekurangan oksigen, sulfur dan air terbentuk: 2H 2 S O 2 = 2S 2 H 2 O
3. Hidrogen sulfida adalah zat pereduksi yang cukup kuat. Sifat kimia penting ini dapat dijelaskan sebagai berikut. Dalam larutan H 2 S, relatif mudah untuk menyumbangkan elektron ke molekul oksigen udara:
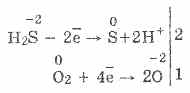
Pada saat yang sama, oksigen di udara mengoksidasi hidrogen sulfida menjadi sulfur, yang membuat air hidrogen sulfida keruh:
2H 2 S O 2 = 2S 2H 2 O
Ini menjelaskan fakta bahwa hidrogen sulfida tidak terakumulasi dalam jumlah yang sangat besar di alam ketika bahan organik meluruh - oksigen dari udara mengoksidasi menjadi sulfur bebas.
4, Hidrogen sulfida bereaksi dengan kuat dengan larutan halogen, misalnya:
H 2 S I 2 = 2HI S Belerang dibebaskan dan larutan iodin menjadi berubah warna.
5. Berbagai oksidator bereaksi dengan kuat dengan hidrogen sulfida: di bawah aksi asam nitrat, sulfur bebas terbentuk.
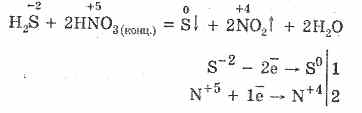
6. Suatu larutan hidrogen sulfida bersifat asam karena disosiasi:
H 2 SH HS - HS - H S -2
Tahap pertama biasanya menang. Ini adalah asam yang sangat lemah: lebih lemah dari asam batubara, yang biasanya menggantikan H2S dari sulfida.
Sulfida dan hidrosulfida
Asam hidrofluorat, sebagai dibasik, membentuk dua baris garam:
Sulfida tengah (Na 2 S);
Asam - hidrosulfida (NaHS).
Garam-garam ini dapat diperoleh: melalui interaksi hidroksida dengan hidrogen sulfida: 2NaOHH 2 S = Na 2 S 2H 2 O
Interaksi langsung belerang dengan logam:
Reaksi pertukaran garam dengan H2S atau antara garam:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Hidrosulfida hampir semuanya larut dalam air.
Sulfida logam alkali dan alkali tanah juga mudah larut dalam air, tidak berwarna.
Sulfida logam berat secara praktis tidak larut atau sedikit larut dalam air (FeS, MnS, ZnS); Beberapa dari mereka tidak larut dalam asam encer (CuS, PbS, HgS).
Sebagai garam dari asam lemah, sulfida dalam larutan berair dihidrolisis tinggi. Misalnya, sulfida logam alkali, ketika dilarutkan dalam air, memiliki reaksi alkali:
Na 2 S НОНNaHS NaOH
Semua sulfida, seperti hidrogen sulfida itu sendiri, adalah zat pereduksi yang kuat:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
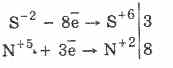
Beberapa sulfida memiliki warna karakteristik: CuS dan PbS - hitam, CdS - kuning, ZnS - putih, MnS - pink, SnS - coklat, Al 2 S 3 - oranye. Analisis kualitatif kation didasarkan pada kelarutan yang berbeda dari sulfida dan warna yang berbeda dari banyak dari mereka.
^ 4.3. Sulfur Oksida (IV) dan Asam Sulfat
Sulfur oksida (IV), atau sulfur dioksida, dalam kondisi normal, adalah gas tidak berwarna dengan bau yang menyesakkan. Ketika didinginkan hingga -10 ° C, ia mencair menjadi cairan yang tidak berwarna.
Mendapatkan
1. Di bawah kondisi laboratorium, sulfur oksida (IV) diperoleh dari garam asam belerang dengan aksi asam kuat pada mereka:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. Sulfur dioksida juga terbentuk oleh interaksi asam sulfat pekat ketika dipanaskan dengan logam aktif rendah:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. Sulfur oksida (IV) juga terbentuk ketika belerang dibakar di udara atau oksigen:
4. Dalam kondisi industri, SO 2 diperoleh dengan memanggang pirit dengan FeS 2 atau bijih sulfur dari logam non-ferro (seng blende ZnS, PbS, dll.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Rumus struktural molekul SO 2:
Empat atom belerang dan empat elektron dari dua atom oksigen mengambil bagian dalam pembentukan ikatan dalam molekul SO 2. Tolak tolakan pasangan elektron ikatan dan pasangan elektron bebas belerang memberikan molekul bentuk sudut.
Sifat kimia
1. Sulfur oksida (IV) menunjukkan semua sifat asam oksida:
Interaksi air
Interaksi dengan alkali
Interaksi dengan oksida dasar.
2. Sulfur oksida (IV) ditandai dengan mengurangi sifat:
S 4 O 2 O 0 2 2S 6 O -2 3 (dengan adanya katalis, saat dipanaskan)
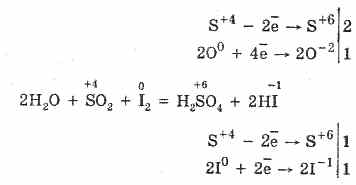
Tetapi di hadapan agen pereduksi kuat, SO 2 berperilaku sebagai agen pengoksidasi:
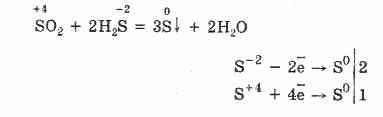
Dualitas redoks belerang (IV) oksida dijelaskan oleh fakta bahwa belerang memiliki tingkat oksidasi 4 di dalamnya, dan oleh karena itu dapat, menyerahkan 2 elektron, dioksidasi menjadi S 6, dan dengan mengambil 4 elektron, ia dapat direduksi menjadi S °. Manifestasi dari sifat-sifat ini atau lainnya tergantung pada sifat komponen reaktif.
Sulfur oksida (IV) sangat larut dalam air (40 volume SO 2 larut dalam 1 volume pada 20 ° C). Dalam hal ini, asam sulfur yang hanya ada dalam larutan air terbentuk:
SO 2 H 2 ОH 2 SO 3
Reaksinya dapat dibalik. Dalam larutan air, sulfur oksida (IV) dan asam sulfur dalam kesetimbangan kimia, yang dapat digeser. Dengan pengikatan H 2 SO 3 (netralisasi asam
Anda) reaksi berlangsung dalam arah pembentukan asam belerang; ketika melepaskan SO 2 (meniup melalui larutan nitrogen atau pemanasan), reaksi berlangsung menuju bahan awal. Larutan asam sulfat selalu mengandung sulfur oksida (IV), yang membuatnya berbau tajam.
Asam sulfat memiliki semua sifat asam. Dalam solusi itu terdisosiasi dalam langkah-langkah:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Tidak stabil secara termal, tidak stabil. Asam belerang, seperti dibasic, membentuk dua jenis garam:
Sulfit tengah (Na 2 SO 3);
Asam - hidrosulfit (NaHSO 3).
Sulfit terbentuk ketika alkali sepenuhnya dinetralkan oleh asam:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
Hidrosulfit diperoleh dengan kekurangan alkali:
H 2 SO 3 NaOH = NaHSO 3 H 2 O
Asam sulfat dan garamnya memiliki sifat pengoksidasi dan reduksi, yang ditentukan oleh sifat pasangan reaksi.
1. Jadi, di bawah aksi oksigen sulfit dioksidasi menjadi sulfat:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
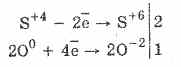
Oksidasi asam sulfat oleh bromin dan kalium permanganat berlangsung lebih mudah:
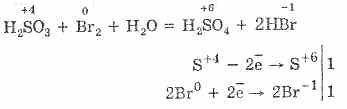
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
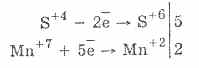
2. Dengan adanya zat pereduksi yang lebih kuat, sulfit menunjukkan sifat oksidatif:
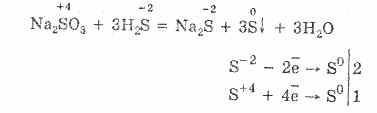
Hampir semua hidrosulfit dan logam alkali sulfit larut dari garam asam sulfur.
3. Karena H 2 SO 3 adalah asam lemah, aksi asam pada sulfit dan hidrosulfit menghasilkan pelepasan SO 2. Metode ini biasanya digunakan ketika mendapatkan SO 2 dalam kondisi laboratorium:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Sulfit yang larut dalam air mudah mengalami hidrolisis, akibatnya konsentrasi ion OH - meningkat dalam larutan:
Na 2 SO 3 NONNaHSO 3 NaOH
Aplikasi
Sulfur oksida (IV) dan asam sulfat menghitamkan banyak pewarna, membentuk senyawa-senyawa tak berwarna. Yang terakhir dapat terurai kembali ketika dipanaskan atau dalam cahaya, sebagai akibatnya warna dikembalikan. Oleh karena itu, efek pemutihan dari SO 2 dan H 2 SO 3 berbeda dari efek pemutihan klorin. Biasanya, belerang (IV) rxid memutihkan wol, sutra dan jerami.
Sulfur oksida (IV) membunuh banyak mikroorganisme. Oleh karena itu, untuk menghancurkan jamur cetakan, mereka mengasapi gudang mentah, gudang, tong anggur, dll. Ini juga digunakan dalam transportasi dan penyimpanan buah dan buah. Dalam jumlah besar, sulfur oksida IV) digunakan untuk memproduksi asam sulfat.
Aplikasi penting adalah larutan kalsium hidrosulfit CaHSO 3 (cairan sulphite), yang digunakan untuk mengolah kayu dan bubur kertas.
^ 4.4. Sulfur oksida (VI). Asam sulfat
Sulfur oksida (VI) (lihat tab. 20) adalah cairan tidak berwarna yang membeku pada suhu 16,8 ° C hingga massa kristal padat. Ini menyerap kelembaban dengan sangat kuat, membentuk asam sulfat: SO 3 H 2 O = H 2 SO 4
Tabel 20. Sifat-sifat sulfur oksida
Pembubaran sulfur oksida (VI) dalam air disertai dengan pelepasan sejumlah besar panas.
Sulfur oksida (VI) sangat larut dalam asam sulfat pekat. Suatu larutan SO3 dalam asam anhidrat disebut oleum. Oleum dapat mengandung hingga 70% SO 3.
Mendapatkan
1. Sulfur oksida (VI) diperoleh dengan oksidasi sulfur dioksida dengan oksigen dengan adanya katalis pada suhu 450 ° С (lihat Produksi asam sulfat):
2SO 2 O 2 = 2SO 3
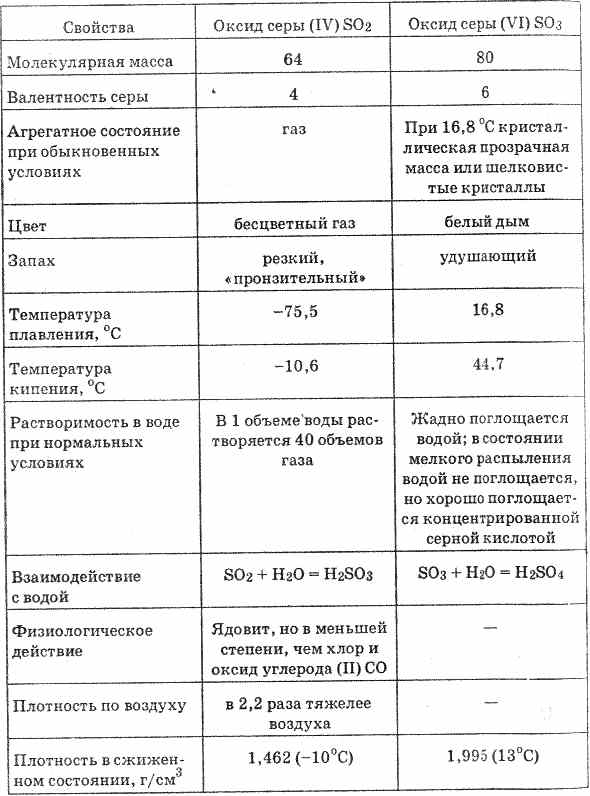
2. Cara lain untuk mengoksidasi SO 2 menjadi SO 3 adalah dengan menggunakan nitric (IV) oxide sebagai zat pengoksidasi:
Nitric oxide (II) yang dihasilkan ketika berinteraksi dengan oksigen atmosfer dengan mudah dan cepat berubah menjadi nitric oxide (IV): 2NO O 2 = 2NO 2
Yang lagi dapat digunakan dalam oksidasi SO 2. Oleh karena itu, NO 2 bertindak sebagai pembawa oksigen. Metode pengoksidasi SO 2 menjadi SO 3 disebut nitrous. Molekul SO 3 memiliki bentuk segitiga, di tengahnya
Atom sulfur berada:
Struktur seperti ini disebabkan oleh tolakan timbal balik dari pasangan elektron ikatan. Atom belerang telah menyediakan enam elektron eksternal untuk pembentukannya.
Sifat kimia
1. SO 3 - asam oksida khas.
2. Sulfur oksida (VI) memiliki sifat zat pengoksidasi yang kuat.
Aplikasi
Sulfur oksida (VI) digunakan untuk menghasilkan asam sulfat. Yang paling penting adalah metode kontak untuk memperoleh
Asam sulfat. Dengan metode ini, Anda bisa mendapatkan H 2 SO 4 dari konsentrasi apa pun, serta oleum. Proses ini terdiri dari tiga tahap: memperoleh SO 2; oksidasi SO 2 menjadi SO 3; mendapatkan H 2 SO 4.
SO 2 diperoleh dengan membakar pirit FeS 2 di tungku khusus: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Untuk mempercepat pemanggangan, pirit adalah pra-tanah, dan untuk pembakaran sulfur yang lebih lengkap, secara signifikan lebih banyak udara (oksigen) yang disuntikkan daripada yang dibutuhkan oleh reaksi. Gas yang meninggalkan kiln terdiri dari sulfur (IV) oksida, oksigen, nitrogen, senyawa arsenik (dari pengotor dalam pirit) dan uap air. Ini disebut gas bakar.
Gas pembakaran menjalani pembersihan menyeluruh, karena bahkan sejumlah kecil senyawa arsenik, serta debu dan kelembaban, meracuni katalis. Gas dibersihkan dari senyawa arsenik dan debu, melewatinya melalui endapan elektrostatik khusus dan menara pencuci; kelembaban diserap oleh asam sulfat pekat dalam menara pengering. Gas murni yang mengandung oksigen dipanaskan dalam penukar panas hingga 450 ° C dan memasuki peralatan kontak. Di dalam alat kontak ada rak-rak kisi yang diisi dengan katalis.
Sebelumnya, platinum logam yang dihancurkan halus digunakan sebagai katalis. Selanjutnya, digantikan oleh senyawa vanadium - vanadium oksida (V) V 2 O 5 atau vanadyl sulfate VOSO 4, yang lebih murah daripada platinum dan lebih lambat teracuni.
Reaksi oksidasi SO 2 menjadi SO 3 dapat dibalik:
2SO 2 O 2 2SO 3
Peningkatan kandungan oksigen dalam gas kalsinasi meningkatkan hasil sulfur oksida (VI): pada suhu 450 ° C, biasanya mencapai 95% atau lebih.
Belerang oksida (VI) yang terbentuk kemudian diumpankan dengan metode arus berlawanan ke menara absorpsi, di mana ia diserap oleh asam sulfat pekat. Saat jenuh, asam sulfat anhidrat pertama-tama terbentuk, dan kemudian oleum. Di masa depan, oleum diencerkan menjadi asam sulfat 98% dan dikirim ke konsumen.
Formula struktural asam sulfat:
^ Sifat fisik
Asam sulfat adalah cairan berminyak yang berat, tidak berwarna, dan mengkristal pada suhu 10,4 ° C, hampir dua kali lipat ( = 1,83 g / cm 3) lebih berat dari air, tidak berbau, tidak mudah menguap. Sangat higroskopis. Kelembaban menyerap dengan melepaskan sejumlah besar panas, sehingga Anda tidak bisa menuangkan air ke asam sulfat pekat - akan ada percikan asam. Untuk
Asam sulfat harus ditambahkan ke air dalam porsi kecil.
Asam sulfat anhidrat melarutkan hingga 70% sulfur oksida (VI). Ketika dipanaskan, ia menghilangkan SO 3 sampai larutan dengan fraksi massa H 2 SO 4 dari 98,3% terbentuk. Anhidrat H 2 SO 4 hampir tidak menghantarkan arus listrik.
^ Sifat kimia
1. Bercampur dengan air dalam proporsi apa pun dan membentuk hidrat dengan komposisi berbeda:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6.5H 2 O
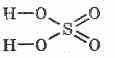
2. Asam sulfat pekat mengkarbonisasi bahan organik - gula, kertas, kayu, serat, menghilangkan unsur-unsur air:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Batubara yang terbentuk sebagian berinteraksi dengan asam:
Dehidrasi gas didasarkan pada penyerapan air oleh asam sulfat.
Sebagai asam non-volatil yang kuat, H 2 SO 4 menggantikan asam lain dari garam kering:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Namun, jika H 2 SO 4 ditambahkan ke larutan garam, tidak terjadi perpindahan asam.
H 2 SO 4 - asam dibasat kuat: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2- 4
Ini memiliki semua sifat asam kuat tidak mudah menguap.
Asam sulfat encer ditandai oleh semua sifat asam non-pengoksidasi. Yaitu: ia berinteraksi dengan logam yang ada dalam rangkaian elektrokimia dari tegangan logam hingga hidrogen:
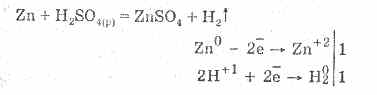
Interaksi dengan logam disebabkan oleh reduksi ion hidrogen.
6. Asam sulfat pekat adalah zat pengoksidasi energetik. Ketika dipanaskan, sebagian besar logam teroksidasi, termasuk yang ada dalam rangkaian tekanan elektrokimia setelah hidrogen, tidak bereaksi hanya dengan platinum dan emas. Tergantung pada aktivitas logam, produk reduksi dapat S -2, S ° dan S 4.
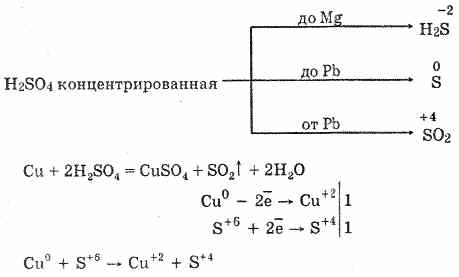
Dalam dingin, asam sulfat pekat tidak berinteraksi dengan logam kuat seperti aluminium, besi, dan kromium. Ini karena pasifnya logam. Fitur ini banyak digunakan ketika diangkut dalam wadah besi.
Namun, saat dipanaskan:
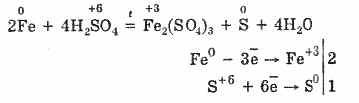
Jadi, asam sulfat pekat berinteraksi dengan logam karena reduksi atom pembentuk asam.
Reaksi kualitatif terhadap ion sulfat SO 2-4 adalah pembentukan endapan kristal putih BaSO 4, tidak larut dalam air dan asam:
SO 2- 4 Ba 2 BaSO 4
Aplikasi
Asam sulfat adalah produk paling penting dari industri kimia utama yang terlibat dalam produksi
Asam organik, alkali, garam, pupuk mineral dan klorin.
Untuk berbagai aplikasi asam sulfat menempati urutan pertama di antara asam. Jumlah terbesar dikonsumsi untuk mendapatkan pupuk fosfat dan nitrogen. Karena tidak mudah menguap, asam sulfat digunakan untuk menghasilkan asam lain - hidroklorik, hidrofluorik, fosfat, dan asetat.
Banyak dari itu berlaku untuk pemurnian produk minyak bumi - bensin, minyak tanah, minyak pelumas - dari kotoran berbahaya. Dalam teknik mesin, asam sulfat membersihkan permukaan logam dari oksida sebelum pelapisan (pelapisan nikel, pelapisan krom, dll.). Asam sulfat digunakan dalam pembuatan bahan peledak, serat buatan, pewarna, plastik dan banyak lainnya. Ini digunakan untuk mengisi baterai.
Garam asam sulfat penting.
^ Sodium SulfatNa 2 SO 4 mengkristal dari larutan berair dalam bentuk hidrat Na 2 SO 4 10H 2 O, yang disebut garam Glauber. Ini digunakan dalam pengobatan sebagai obat pencahar. Natrium sulfat anhidrat digunakan dalam pembuatan soda dan gelas.
^ Ammonium Sulphate(NH 4) 2 SO 4 - pupuk nitrogen.
Kalium sulfatK 2 SO 4 - pupuk kalium.
Kalsium sulfat CaSO 4 ditemukan di alam dalam bentuk mineral gipsum CaSO 4 2H 2 O. Ketika dipanaskan hingga 150 ° C, ia kehilangan sebagian air dan masuk ke dalam hidrat 2CaSO 4 H 2 O, yang disebut gypsum terbakar, atau puing-puing. Ketika dicampur dengan air menjadi massa pucat, alabaster mengeras lagi setelah beberapa waktu, berubah menjadi CaSO 4 2H 2 O. Gypsum banyak digunakan dalam konstruksi (plester).
Magnesium sulfatMgSO 4 ditemukan di air laut, menyebabkan rasanya pahit. Kristal hidrat, disebut garam pahit, digunakan sebagai obat pencahar.
Vitriol- nama teknis hidrat kristal dari logam sulfat Fe, Cu, Zn, Ni, Co (garam dehidrasi bukan vitrials). Tembaga sulfatCuSO 4 5H 2 O adalah zat beracun biru. Tanaman disemprot dengan larutan encer dan biji ditabur sebelum disemai. Vitriol besiFeSO 4 7H 2 O adalah zat hijau muda. Digunakan untuk mengendalikan hama tanaman, tinta, cat mineral, dll. Seng sulfatZnSO 4 7H 2 O digunakan dalam produksi tinta mineral, dalam sittoprechatanii, obat-obatan.
^ 4.5. Ester asam sulfat. Sodium Tiosulfat
Ester asam sulfat termasuk dialkil sulfat (RO 2) SO 2. Ini adalah cairan mendidih tinggi; lebih rendah larut dalam air; di hadapan alkali, alkohol dan garam asam sulfat terbentuk. Dialkil sulfat yang lebih rendah adalah agen alkilasi.
Dietil sulfat(C 2 H 5) 2 JADI 4. Titik lebur -26 °,, titik didih 210 °,, larut dalam alkohol, tidak larut dalam air. Diperoleh dengan mereaksikan asam sulfat dengan etanol. Apakah agen etilasi dalam sintesis organik. Menembus kulit.
Dimethyl sulfate(CH 3) 2 SO 4. Titik lebur -26,8 ° С, titik didih 188,5 ° С. Larut dalam alkohol, buruk - dalam air. Bereaksi dengan amonia tanpa adanya pelarut (dengan ledakan); Belerang beberapa senyawa aromatik, seperti ester fenol. Ini diperoleh dengan interaksi 60% oleum dengan metanol pada 150 ° It. Ini adalah agen metilasi dalam sintesis organik. Karsinogenik, menyerang mata, kulit, organ pernapasan.
^ Sodium Tiosulfat Na 2 S 2 O 3
Garam asam tiosulfurat di mana dua atom belerang memiliki tingkat oksidasi yang berbeda: 6 dan -2. Zat kristal, larut dalam air. Tersedia dalam bentuk kristal Na 2 S 2 O 3 5H 2 O, umumnya disebut sebagai hyposulphite. Diperoleh oleh interaksi natrium sulfit dengan belerang selama mendidih:
Na 2 SO 3 S = Na 2 S 2 O 3
Seperti asam tiosulfurik, asam ini merupakan zat pereduksi kuat dan mudah teroksidasi oleh klorin menjadi asam sulfat:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
Penggunaan natrium tiosulfat untuk penyerapan klor (dalam masker gas pertama) didasarkan pada reaksi ini.
Oksidasi yang sedikit berbeda terjadi dengan zat pengoksidasi lemah natrium tiosulfat. Ini membentuk garam asam tetrationat, misalnya:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Sodium tiosulfat adalah produk sampingan dalam produksi NaHSO 3, pewarna sulfur, dalam pemurnian gas industri dari sulfur. Ini digunakan untuk menghilangkan jejak klorin setelah kain pemutih, untuk mengekstraksi perak dari bijih; adalah fiksatif dalam fotografi, reagen dalam iodometri, penangkal keracunan dengan senyawa arsenik, merkuri, agen anti-inflamasi.
Sulfur unsur kimia terletak di grup VIА, periode 3 PSCE. Pada lapisan elektron terluar atom belerang ada 6 elektron. Menampilkan sifat-sifat zat pengoksidasi dalam pembentukan zat dengan logam dan hidrogen, sulfur memperoleh keadaan oksidasi -2 (membutuhkan 2 elektron).
Dalam komposisi senyawa yang mengandung oksigen, sulfur menunjukkan keadaan oksidasi +4 dan +6. Jadi, sulfur dicirikan oleh keadaan oksidasi -2; 0; +4; +6.
Di alam, belerang ditemukan di negara asalnya dan dalam komposisi mineral. Misalnya, sulfur mengandung timbal mengkilap (komponen utama adalah timbal sulfida PbS) dan tembaga mengkilap (komponen utama adalah tembaga sulfida Cu2S).
Belerang membentuk beberapa zat sederhana - modifikasi alotropik. Belerang belah ketupat paling stabil pada suhu kamar (Gbr. 1). Zat ini terdiri dari molekul S 8. Belerang belah ketupat berwarna kuning dan meleleh pada suhu + 112,8 ° C.
Fig. 1. Modifikasi belerang secara besar-besaran
Ketika dipanaskan, belerang belah ketupat berangsur-angsur berubah menjadi massa coklat gelap kental. Ini adalah modifikasi allotropic lain dari sulfur - sulfur plastik. Sulfur plastik terdiri dari molekul sulfur linier S n.
Belerang dalam reaksi kimia dengan logam dan hidrogen berperan sebagai agen pengoksidasi. Tingkat oksidasi menurun dari 0 hingga -2. Dalam reaksi dengan oksigen, sulfur bertindak sebagai zat pereduksi, meningkatkan derajat oksidasi dari 0 hingga +4.
Perhatikan contoh interaksi yang melibatkan belerang.
Ketika sulfur berinteraksi dengan hidrogen, hidrogen sulfida terbentuk:
Ketika seng berinteraksi dengan sulfur, seng sulfida terbentuk:
Belerang terbakar dalam oksigen dengan pembentukan sulfur oksida (IV) (Gbr. 2):

Fig. 2. Membakar belerang dalam oksigen
Pertimbangkan sifat-sifat senyawa sulfur dengan keadaan oksidasi "-2". Senyawa tersebut meliputi hidrogen sulfida dan sulfida - garam asam hidrogen sulfida.
Hidrogen sulfida adalah gas dengan bau telur busuk. Itu terbakar di udara. Selain itu, dengan kekurangan dan kelebihan oksigen, hasil pembakaran berbeda.
Dalam kelebihan oksigen, hidrogen sulfida terbakar untuk membentuk sulfur oksida (IV) dan air:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Dengan kekurangan oksigen, pembakaran hidrogen sulfida yang tidak sempurna terjadi dengan pelepasan sulfur: 2H 2 S + O 2 = 2S + 2H 2 O.
Hidrogen sulfida sangat larut dalam air. Solusi yang dihasilkan adalah asam hidrogen sulfida yang lemah. Garam hidrogen sulfida disebut sulfida. Asam hidrofluorik dan sulfida yang larut dalam air masuk ke dalam reaksi pertukaran.
Interaksi asam hidrogen sulfida dan tembaga (II) klorida membentuk tembaga tidak larut (II) sulfida dan asam klorida: H 2 S + CuCl 2 = CuS + 2HCl.
Ketika kalium sulfida berinteraksi dengan seng nitrat, endapan seng sulfida dan kalium nitrat terbentuk: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Referensi
- Orzhekovsky P.A. Kumpulan tugas dan latihan dalam kimia: kelas 9: ke buku teks P.A. Orzhekovsky dan lainnya. "Kimia. Kelas 9 / P. Orzhekovsky, N.A. Titov, F.F. Hegel - M.: AST: Astrel, 2007. (p. 91-97)
- Orzhekovsky P.A. Kimia: kelas 9: studi. untuk gambar umum. institusi / P. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kimia: kelas 9: studi untuk umum. institusi / P. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kimia: neorgan. kimia Organ Kimia: studi. untuk 9 cl. / G.E. Rudzitis, F.G. Feldman. - L: Pendidikan, Buku Teks Moskwa OJSC, 2009.
- Khomchenko I.D. Koleksi tugas dan latihan kimia untuk sekolah menengah. - M.: RIA "Gelombang Baru": Penerbit Umerenkov, 2008.
- Ensiklopedia untuk anak-anak. Volume 17. Kimia / Bab. ed. V.A. Volodin, Ved. ilmiah ed. I. Leenson. - M.: Avanta +, 2003.
- Kumpulan tunggal sumber daya pendidikan digital (pengalaman video tentang topik) ().
- Versi elektronik jurnal "Kimia dan Kehidupan" ().
PR
- c. 136 No. 3; hal.140 №№ 2-4 dari buku teks P.A. Orzhekovsky "Kimia: kelas 9" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013.
Sulfida (dari lat belerang, belerang - belerang)
senyawa belerang dengan unsur yang lebih elektropositif; dapat dianggap sebagai garam asam hidrogen sulfida (Lihat Asam hidrogen sulfida) H 2 S. Ada dua seri C: rata-rata (normal) dari rumus umum M 2 S dan asam (hidrosulfida) dari rumus umum MHS, di mana M adalah logam monovalen. Logam C. alkali tidak berwarna, larut dalam air. Larutan berair mereka sangat terhidrolisis dan basa. Di bawah aksi asam encer memancarkan H 2 S. Logam alkali tanah tidak berwarna, sedikit larut dalam air. H 2 S dipancarkan di udara lembab. Sifat lainnya mirip dengan logam S. alkali. Keduanya dan S. lainnya mudah teroksidasi menjadi sulfat. C. logam berat secara praktis tidak larut dalam air. Hampir semuanya berwarna hitam atau hitam-cokelat (dengan pengecualian ZnS putih, MnS merah muda, CdS kuning, oranye-merah Sb 2 S 3, kuning SnS 2). Rasio yang tidak sama antara asam C dan asam amonium digunakan dalam analisis kimia. I.K. Malina.
Ensiklopedia Besar Soviet. - M.: Ensiklopedia Soviet. 1969-1978 .
Lihat apa "Sulphides" di kamus lain:
Senyawa belerang dengan logam dan beberapa non-logam. Logam sulfida adalah garam dari asam hidrogen sulfida H2S: sedang (misalnya, Na2S) dan asam, atau hidrosulfida (NaHS). Dengan membakar sulfida alami, logam non-ferro dan SO2 diperoleh. Fosfor sulfida dan ... ... Kamus Ensiklopedis Besar
Ensiklopedia Modern
Sulfida - SULFIDES, sulfida anorganik dari senyawa sulfur dengan logam dan beberapa non-logam. Termasuk dalam bijih sulfida; digunakan sebagai fosfor (misalnya, CdS, ZnS). Molybdenum sulfide, pelumas titanium padat. Fosfor sulfida ... ... Kamus Ensiklopedis Bergambar
- (lat baru., dari bahasa Latin. sulfur belerang). Senyawa beberapa tubuh dengan sulfur, sesuai dengan oksida atau asam. Kamus kata-kata asing termasuk dalam bahasa Rusia. Chudinov, AN, 1910. SULFIDES Novolatinsk., Dari Lat. belerang, belerang. Sambungan ... ... Kamus kata-kata asing dari bahasa Rusia
1. Senyawa sulfur alami dari logam dan beberapa non-logam. Dalam kimia hubungan dianggap sebagai garam asam hidrogen sulfida H2S. Sejumlah elemen membentuk polisulfida dengan sulfur, yang merupakan garam dari asam poli sulfat H2Sx. Yang utama ... ... Ensiklopedia geologi
Sulfida - - senyawa sulfur dengan logam dan beberapa non-logam; garam logam sulfida dari asam hidrogen sulfida H2S. [Kamus terminologis untuk beton dan beton bertulang. FSUE “SIC“ Construction ”NIIZHB dan stasiun metro A. A. Gvozdeva, Moscow, 2007. 110 hal.] ...… Ensiklopedia istilah, definisi, dan penjelasan bahan bangunan
SULPHES, s, u sulfida, seorang, suami (spec.) Senyawa kimia belerang dengan logam dan non-logam tertentu. Organik dengan Alami | adj sulfida, oh, oh. Kamus Ozhegova. S.I. Ozhegov, N.Yu. Shvedov. 1949 1992 ... Kamus Ozhegova
Sulfida, R2S (R aromatic radikal), paling mudah diperoleh dengan menambahkan tetes demi tetes larutan garam diazo ke 60 70 ... Ensiklopedia Brockhaus dan Efron
SULFID - (1) dalam kimia anorganik, senyawa unsur-unsur dengan sulfur, di mana atom-atom sulfur memiliki tingkat oksidasi 2. Dalam kimia. hubungan dianggap sebagai garam asam hidrogen sulfida lemah (larutan H2S). Banyak S. alami ... ... Ensiklopedia Politeknik Besar
Oh mn (unit sulfida, dan; m.). [dari lat. sulfur sulfur] Chem. Senyawa belerang dengan logam dan beberapa non-logam. C. titanium. Organik dengan Alami (kelas mineral). ◁ Sulfide, th, oh. Dengan campuran campuran. Dari bijih bijih. * * * sulfida dari senyawa sulfur ... Kamus ensiklopedis
- (dari sulfur belerang Latin) kelas senyawa kimia yang merupakan senyawa logam (serta sejumlah non-logam B, Si, P, As) dengan sulfur (S), di mana ia memiliki keadaan oksidasi −2. Dapat dianggap sebagai garam hidrogen sulfida ... ... Wikipedia
Buku
- Deposito uranium dari jenis ketidaksepakatan dalam Fanerozoikum, Andrei Borisovich Khalezov. Ciri-ciri endapan uranium dalam struktur lembah paleo sungai pada permukaan ketidaksepakatan struktural dan stratigrafi dipertimbangkan pada contoh tiga wilayah wilayah Ural dengan berbagai ...
Belerang - Elemen periode ke-3 dan grup VIA dari sistem Berkala, mengacu pada nomor seri 16 chalcogens. Rumus elektronik atom [10 Ne] 3s 2 3p 4, karakteristik oksidasi 0, ‑II, + IV dan + VI, keadaan S VI dianggap stabil.
Skala oksidasi belerang:
Keelektronegatifan sulfur adalah 2,60, ini ditandai dengan sifat non-logam. Dalam senyawa hidrogen dan oksigen itu terkandung dalam berbagai anion, itu membentuk asam yang mengandung oksigen dan garamnya, senyawa biner.
Di alam - kelima belas elemen prevalensi kimia (ketujuh di antara non-logam). Ini ditemukan dalam bentuk bebas (asli) dan terkait. Elemen vital untuk organisme tingkat tinggi.
Belerang S. Zat sederhana. Kristal kuning (α-rhombic dan β-monoclinic,
pada 95,5 ° C) atau amorf (plastik). Di situs kisi ada molekul S 8 (siklus tipe "korona" non-planar), sulfur amorf terdiri dari rantai S n. Zat leleh rendah, viskositas cairan melewati maksimum pada 200 ° C (celah molekul S 8, jalinan rantai S n). Dalam pasangan - molekul S 8, S 6, S 4, S 2. Pada 1500 ° C, sulfur monoatomik muncul (dalam persamaan kimia untuk kesederhanaan, setiap sulfur diwakili sebagai S).
Belerang tidak larut dalam air dan dalam kondisi normal tidak bereaksi, belerang larut dalam karbon disulfida CS 2.
Belerang, terutama bubuk, memiliki aktivitas tinggi ketika dipanaskan. Bereaksi sebagai agen pengoksidasi dengan logam dan non-logam:
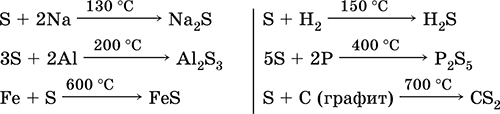
bagaimana dengan agen pereduksi - dengan fluor, oksigen, dan asam (saat direbus):
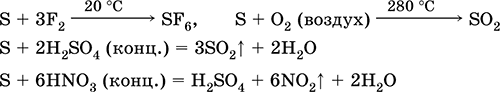
Belerang mengalami penguraian dalam larutan alkali:
3S 0 + 6KOH (conc.) = 2K 2 S ‑II + K 2 S IV O 3 + 3H 2 O
Pada suhu tinggi (400 ° C) belerang menggantikan yodium dari hidrogen iodida:
S + 2НI (g) = I 2 + H 2 S,
tetapi dalam solusi, reaksi berlawanan:
I 2 + H 2 S (p) = 2 HI + S ↓
Mendapatkan: di industri dilebur dari endapan alami sulfur asli (menggunakan uap air), dilepaskan selama desulfurisasi produk gasifikasi batubara.
Sulfur digunakan untuk mensintesis karbon disulfida, asam sulfat, pewarna sulfat (tong), dalam vulkanisasi karet, sebagai cara melindungi tanaman dari embun tepung, dan untuk mengobati penyakit kulit.
Hidrogen sulfida H 2 S. Asam bebas oksigen. Gas tidak berwarna dengan bau yang menyesakkan, lebih berat dari udara. Molekul memiliki struktur tetrahedron ganda tidak lengkap [:: S (H) 2]
(sp 3 - hibridisasi, sudut jack H - S - H jauh dari tetrahedral). Tidak stabil saat dipanaskan di atas 400 ° C. Ini sedikit larut dalam air (2,6 l / 1 l H 2 O pada 20 ° C), larutan jenuh adalah desimolar (0,1 M, "air hidrogen sulfida"). Asam yang sangat lemah dalam larutan, praktis tidak berdisosiasi pada tahap kedua menjadi S 2-ion (konsentrasi maksimum S 2 -1 sama dengan 1 10 -13 mol / l). Saat berdiri di udara, larutan menjadi keruh (inhibitor - sukrosa). Ini dinetralkan oleh alkali, tidak sepenuhnya - oleh amonia hidrat. Zat pereduksi kuat. Ini masuk ke dalam reaksi pertukaran ion. Zat sulfida, mengendap dari larutan sulfida berwarna berbeda dengan kelarutan sangat rendah.
Reaksi kualitatif - sedimentasi sulfida, serta pembakaran H 2 S yang tidak lengkap dengan pembentukan endapan belerang kuning pada benda dingin yang dimasukkan ke dalam nyala api (spatula porselen). Produk sampingan dari penyulingan minyak bumi, gas oven alami dan kokas.
Ini digunakan dalam produksi senyawa sulfur, anorganik dan organik yang mengandung sulfur sebagai reagen analitis. Sangat beracun. Persamaan reaksi yang paling penting:
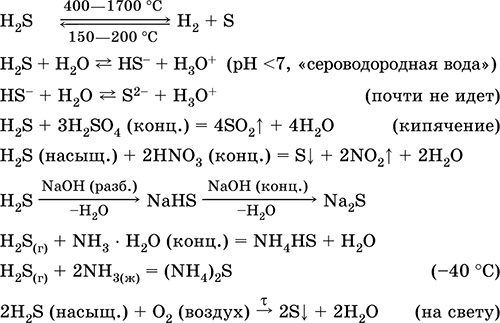

Mendapatkan: di industri - sintesis langsung:
H 2 + S = H 2 S(150–200 ° C)
atau dengan memanaskan belerang dengan parafin;
di laboratorium - perpindahan sulfida oleh asam kuat
FeS + 2НCl (conc.) = FeCl 2 + H 2 S
atau hidrolisis lengkap senyawa biner:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Sodium sulfida Na 2 S. Garam bebas oksigen. Putih, sangat higroskopis. Meleleh tanpa dekomposisi, stabil secara termal. Ini larut dalam air, dihidrolisis oleh anion, menciptakan media yang sangat basa dalam larutan. Saat berdiri di udara, larutan menjadi keruh (sulfur koloidal) dan berubah menjadi kuning (pewarna polisulfida). Zat pereduksi khas. Menempel belerang. Ini masuk ke dalam reaksi pertukaran ion.
Reaksi kualitatif pada ion S 2 - deposisi berbagai logam sulfida berwarna, di mana MnS, FeS, ZnS diuraikan menjadi HCl.
Ini digunakan dalam produksi pewarna belerang dan selulosa, untuk menghilangkan rambut kulit selama penyamakan kulit, sebagai reagen dalam kimia analitik.
Persamaan reaksi yang paling penting:
Na 2 S + 2НCl (dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (conc.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (hingga 50 ° C)
Na 2 S + 4HNO 3 (conc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (sat.) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (di atas 400 ° C)
Na 2 S + 4H 2 O 2 (conc.) = Na 2 SO 4 + 4H 2 O
S 2– + M 2+ = MnS (kopral) ↓; FeS (hitam) ↓; ZnS (putih) ↓
S 2– + 2Ag + = Ag 2 S (hitam) ↓
S 2– + M 2+ = CdS (kuning) ↓; PbS, CuS, HgS (hitam) ↓
3S 2– + 2Bi 3+ = Bi 2 S 3 (koreksi - hitam) ↓
3S 2– + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Mendapatkan di industri - kalsinasi mineral mirabilite Na 2 SO 4 10H 2 O di hadapan zat pereduksi:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, cat. Fe 2 O 3)
Na 2 SO 4 + 4C (coke) = Na 2 S + 4CO (800–1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600–700 ° C)
Aluminium sulfida Al 2 S 3. Garam bebas oksigen. Putih, ikatan Al - S didominasi kovalen. Ini meleleh tanpa dekomposisi di bawah tekanan N 2 yang berlebihan, ia mudah disublimasikan. Ini teroksidasi di udara ketika dikalsinasi. Dihidrolisis sepenuhnya dengan air, tidak mengendap dari larutan. Terurai oleh asam kuat. Ini digunakan sebagai sumber padat hidrogen sulfida murni. Persamaan reaksi yang paling penting:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (murni)
Al 2 S 3 + 6НCl (des.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (conc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (udara) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
Mendapatkan: interaksi aluminium dengan sulfur cair tanpa adanya oksigen dan kelembaban:
2Al + 3S = AL 2 S 3(150–200 ° C)
Besi (II) sulfida FeS. Garam bebas oksigen. Hitam dan abu-abu dengan warna hijau, tahan api, terurai ketika dipanaskan dalam ruang hampa. Dalam keadaan basah sensitif terhadap oksigen di udara. Tidak larut dalam air. Tidak mengendap pada kejenuhan larutan garam besi (II) dengan hidrogen sulfida. Terurai oleh asam. Ini digunakan sebagai bahan baku dalam produksi besi, sumber padat hidrogen sulfida.
Komposisi besi (III) komposisi Fe 2 S 3 tidak diketahui (tidak diterima).
Persamaan reaksi yang paling penting:
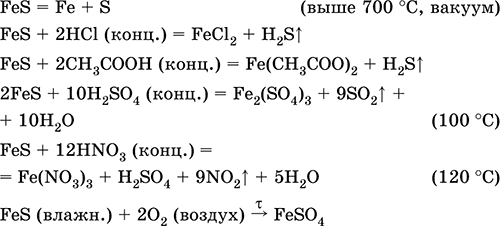
Menerima:
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2 H 2 S = 9 Fes + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Cl + H 2 S
Besi disulfida FeS 2. Koneksi biner. Ia memiliki struktur ion Fe 2+ (–S - S–) 2–. Kuning gelap, stabil secara termal, terurai pada kunci kontak. Tidak larut dalam air, tidak bereaksi dengan asam encer, alkali. Ini diurai oleh agen pengoksidasi asam, dipanggang di udara. Ini digunakan sebagai bahan baku dalam produksi besi, sulfur dan asam sulfat, katalis dalam sintesis organik. Di alam - mineral bijih pirit dan marcasite.
Persamaan reaksi yang paling penting:
FeS 2 = FeS + S (di atas 1170 ° C, vakum)
2FeS 2 + 14H 2 SO 4 (conc., Mountains) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (conc.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (udara) = 8SO 2 + 2Fe 2 O 3 (800 ° C, pemanggangan)
Amonium hidrosulfida NH 4 HS. Garam asam bebas oksigen. Putih, meleleh di bawah tekanan. Sangat fluktuatif, tidak stabil secara termal. Mengoksidasi di udara. Ini larut dalam air, dihidrolisis oleh kation dan anion (menang), menciptakan lingkungan alkali. Solusinya menjadi kuning di udara. Ini didekomposisi oleh asam, dalam larutan jenuh menambah sulfur. Alkali tidak dinetralkan, garam tengah (NH 4) 2 S tidak ada dalam larutan (untuk kondisi memperoleh garam tengah, lihat judul "H 2 S"). Ini digunakan sebagai komponen pengembang foto, sebagai reagen analitis (sulfida precipitator).
Persamaan reaksi yang paling penting:
NH 4 HS = NH 3 + H 2 S (di atas 20 ° C)
NH 4 HS + HCl (dec.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (conc.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (sat. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
Mendapatkan: saturasi larutan pekat NH 3 dengan hidrogen sulfida:
NH 3 H 2 O (conc.) + H 2 S (g) = NH 4 HS + H 2 O
Dalam kimia analitik, larutan yang mengandung NH4 HS dan NH 3 H 2 O dalam jumlah yang sama secara konvensional dianggap sebagai larutan (NH 4) 2 S dan formula garam rata-rata digunakan dalam penulisan persamaan reaksi, meskipun amonium sulfida dihidrolisis sepenuhnya dalam air menjadi NH 4 HS dan NH 3 H 2 O.
Sulfur dioksida. Sulfit
Sulfur dioksida SO 2. Asam oksida. Gas tidak berwarna dengan bau menyengat. Molekul memiliki struktur segitiga tidak lengkap [: S (O) 2] (sp 2 - hibridisasi), mengandung σ, π - ikatan S = O. Mudah dicairkan, stabil secara termal. Ini larut dalam air (~ 40 l / 1 l H 2 O pada 20 ° C). Membentuk polihidrat dengan sifat asam lemah, produk disosiasi - ion HSO 3 - dan SO 3 2−. Ion HSO 3 - memiliki dua bentuk tautomer - simetris (non-asam) dengan struktur tetrahedron (sp 3 - hibridisasi), yang mendominasi dalam campuran, dan asimetris (Asam) dengan struktur tetrahedron tidak lengkap [: S (O) 2 (OH)] (sp 3 - hibridisasi). Ion SO 3 2– juga tetrahedral [: S (O) 3].
Bereaksi dengan alkali, amonia hidrat. Zat pereduksi khas, agen oksidasi lemah
Reaksi kualitatif - perubahan warna "air yodium" kuning-coklat. Menengah dalam produksi sulfit dan asam sulfat.
Ini digunakan untuk memutihkan wol, sutra dan jerami, menjaga dan menyimpan buah-buahan, sebagai desinfektan, antioksidan, pendingin. Beracun.
Senyawa H 2 SO 3 (asam belerang) tidak diketahui (tidak ada).
Persamaan reaksi yang paling penting:
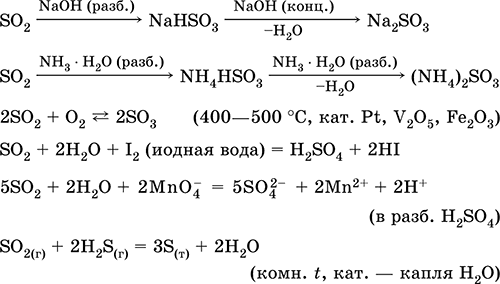
Pelarutan dalam air dan sifat asam:
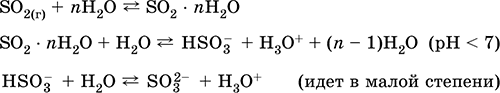
Mendapatkan: dalam industri - pembakaran belerang di udara yang diperkaya dengan oksigen, dan, pada tingkat lebih rendah, pembakaran bijih sulfida (gas yang terkait dengan SO 2 selama memanggang pirit):
S + O 2 = JADI 2(280–360 ° C)
4FeS 2 + 11O2 = 2Fe 2 O 3 + 8 JADI 2(800 ° C, pemanggangan)
di laboratorium - perpindahan sulfit dengan asam sulfat:
BaSO 3 (t) + H 2 SO 4 (conc.) = BaSO 4 ↓ + SO 2 + H 2 O
Sodium sulfit Na 2 SO 3. Saline Putih Ketika dipanaskan di udara itu terurai tanpa meleleh, meleleh di bawah tekanan argon yang berlebihan. Dalam keadaan basah dan dalam larutan peka terhadap oksigen di udara. Ini larut dalam air, dihidrolisis oleh anion. Terurai oleh asam. Zat pereduksi khas.
Reaksi kualitatif pada ion SO 3 2 - - pembentukan endapan putih barium sulfit, yang ditransfer ke dalam larutan dengan asam kuat (HCl, HNO 3).
Ini digunakan sebagai reagen dalam kimia analitik, komponen larutan fotografi, penetral klorin dalam pemutihan kain.
Persamaan reaksi yang paling penting:
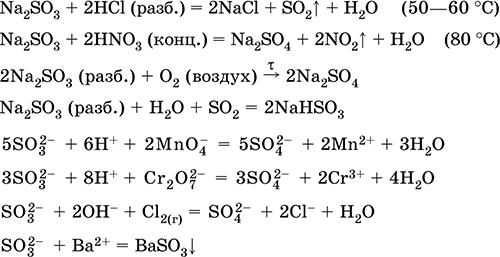
Menerima:
Na 2 CO 3 (conc.) + SO 2 = Na 2 SO 3 + CO 2
Asam sulfat. Sulfat
Asam sulfat H 2 SO 4. Asam oksoat. Cairan tidak berwarna, sangat kental (berminyak), sangat higroskopis. Molekul memiliki struktur tetrahedral тет terdistorsi (sp 3 dan hibridisasi), mengandung kovalen σ - ikatan S - OH dan σπ - ikatan S = O. Ion SO 4 2-memiliki struktur tetrahedral yang benar. Ini memiliki kisaran suhu yang luas dari keadaan cair (~ 300 derajat). Ketika dipanaskan di atas 296 ° C sebagian terurai. Ini disuling sebagai campuran azeotropik dengan air (fraksi massa asam adalah 98,3%, titik didih adalah 296-340 ° C), terurai sepenuhnya dengan pemanasan yang lebih kuat. Campuran tanpa batas dengan air (dengan kuat exo-Efek). Asam kuat dalam larutan, dinetralkan oleh alkali dan amonia hidrat. Mengubah logam menjadi sulfat (dengan kelebihan asam pekat dalam kondisi normal, hidrosulfat terlarut terbentuk), tetapi logam Be, Bi, Co, Fe, Mg dan Nb dipasivasi dalam asam pekat dan tidak bereaksi dengan itu. Bereaksi dengan oksida basa dan hidroksida, menguraikan garam dari asam lemah. Pengoksidasi lemah dalam larutan encer (karena H I), kuat - dalam larutan pekat (karena S VI). Nah melarutkan SO 3 dan bereaksi dengan itu (cairan berminyak berat terbentuk - oleum mengandung H 2 S 2 O 7).
Reaksi kualitatif pada SO 4 2-ion - pengendapan barium sulfat putih BaSO 4 (endapan tidak dikonversi menjadi larutan asam klorida dan nitrat, berbeda dengan endapan putih BaSO 3).
Ini digunakan dalam produksi sulfat dan senyawa belerang lainnya, pupuk mineral, bahan peledak, pewarna dan obat-obatan, dalam sintesis organik, untuk "pembukaan" (tahap pertama pemrosesan) bijih dan mineral penting industri, dalam pengilangan produk minyak bumi, elektrolisis air, sebagai elektrolit baterai timbal . Beracun, menyebabkan kulit terbakar. Persamaan reaksi yang paling penting:
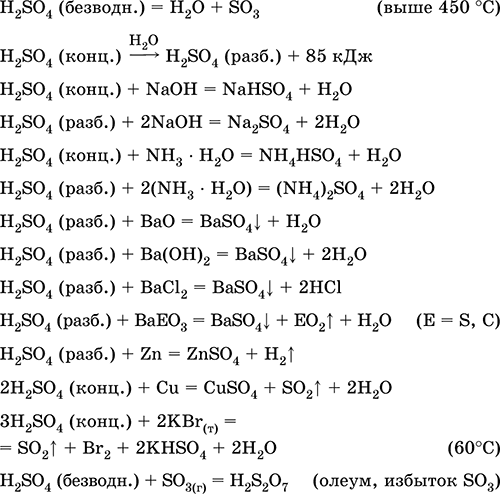
Mendapatkan di industri:
a) sintesis SO 2 dari bijih sulfur, bijih sulfida, hidrogen sulfida dan sulfat:
S + O 2 (udara) = JADI 2(280–360 ° C)
4FeS 2 + 11O2 (udara) = 8 JADI 2 + 2Fe 2 O 3 (800 ° C, pemanggangan)
2H 2 S + 3O 2 (g) = 2 JADI 2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (coke) = CaO + JADI 2 + CO (1300–1500 ° C)
b) konversi SO 2 ke SO 3 pada peralatan kontak:
c) sintesis asam sulfat pekat dan anhidrat:
H 2 O (Coll. H 2 SO 4) + SO 3 = H 2 SO 4(conc., anhyd.)
(penyerapan SO 3 oleh air murni dengan produksi H 2 SO 4 tidak dilakukan karena pemanasan yang kuat dari campuran dan pembusukan balik H 2 SO 4, lihat di atas);
d) sintesis oleum - campuran H 2 SO 4 anhidrat, asam disaric H 2 S 2 O 7 dan kelebihan SO 3. SO 3 terlarut memastikan oleum waterlessness (H 2 SO 4 segera terbentuk ketika air masuk), yang memungkinkannya diangkut dengan aman dalam tangki baja.
Sodium sulfate Na 2 SO 4. Saline Putih, higroskopis. Meleleh dan mendidih tanpa dekomposisi. Membentuk kristal hidrat (mineral mirabilite) mudah kehilangan air; nama teknis Garam Glauber. Ini larut dalam air, tidak terhidrolisis. Bereaksi dengan H 2 SO 4 (conc.), SO 3. Dipulihkan oleh hidrogen, kokas saat dipanaskan. Ini masuk ke dalam reaksi pertukaran ion.
Ini digunakan dalam pembuatan kaca, selulosa dan cat mineral, sebagai obat. Terkandung dalam air asin dari danau garam, khususnya di Teluk Kara-Bogaz-Gol di Laut Kaspia.
Persamaan reaksi yang paling penting:
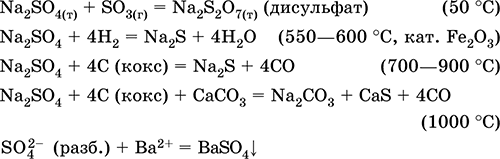
Kalium hidrosulfat KHSO 4. Garam asam oxol. Putih, higroskopis, tetapi tidak membentuk hidrat kristalin. Ketika dipanaskan meleleh dan terurai. Ini larut dalam air, anion mengalami disosiasi dalam larutan, medium larutannya sangat asam. Ini dinetralkan oleh alkali.
Ini digunakan sebagai komponen fluks dalam metalurgi, bagian integral dari pupuk mineral.
Persamaan reaksi yang paling penting:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (hingga 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (dil.) + KOH (conc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450-700 ° C)
6KHSO 4 + M 2 O 3 = 2 KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
Mendapatkan: pengobatan kalium sulfat dalam asam sulfat dingin (dengan lebih dari 6O%)
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
Kalsium sulfat CaSO 4. Saline Putih, sangat higroskopis, tahan api, terurai saat dikalsinasi. CaSO 4 alami ditemukan dalam bentuk mineral yang sangat umum gipsum CaSO 4 2H 2 O. Pada 130 ° C, gipsum kehilangan sebagian air dan masuk ke dalamnya plester terbakar2CaSO 4 H 2 O (nama teknis alabaster). Gypsum yang sepenuhnya didehidrasi (200 ° C) merespons mineral tersebut anhidritCaSO 4. Ini sedikit larut dalam air (0,206 g / 100 g H 2 O pada 20 ° C), kelarutan berkurang ketika dipanaskan. Bereaksi dengan H 2 SO 4 (conc.). Dipulihkan oleh kokas selama fusi. Tetapkan sebagian besar kekerasan "konstan" air tawar (untuk perincian lebih lanjut, lihat 9.2).
Persamaan reaksi yang paling penting: 100–128 ° C
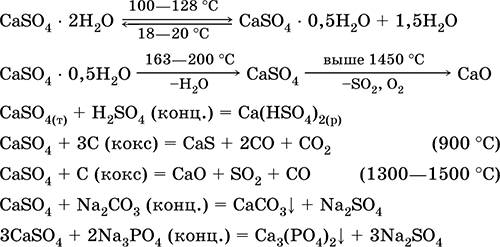
Ini digunakan sebagai bahan baku dalam produksi SO 2, H 2 SO 4 dan (NH 4) 2 SO 4, sebagai fluks dalam metalurgi, pengisi kertas. Mortar pengikat dibuat dari "set" gipsum yang terbakar lebih cepat dari campuran berdasarkan Ca (OH) 2. Pengerasan disediakan oleh pengikatan air, pembentukan gipsum dalam bentuk massa batu. Burnt gypsum digunakan untuk membuat gips, bentuk dan produk arsitektur dan dekoratif, dinding dan panel partisi, dan lantai batu.
Aluminium potassium sulfate KAl (SO 4) 2. Garam oksol ganda. Putih, higroskopis. Dengan panas yang kuat terurai. Membentuk kristal hidrat - alumina potassium tawas. Larut dalam air, dihidrolisis dengan kation aluminium. Bereaksi dengan alkali, amonia hidrat.
Ini digunakan sebagai mordan dalam pewarnaan kain, penyamakan kulit, koagulan dalam pemurnian air tawar, komponen komposisi ukuran kertas, dan agen hemostatik eksternal dalam kedokteran dan tata rias. Itu dibentuk oleh kristalisasi bersama aluminium dan kalium sulfat.
Persamaan reaksi yang paling penting:
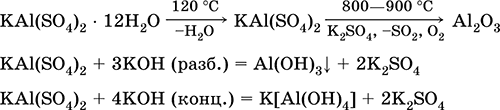
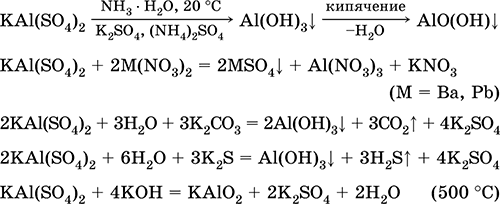
Chromium (III) sulfate - potassium KCr (SO 4) 2. Garam oksol ganda. Merah (hidrat ungu tua, nama teknis tawas kalium). Saat dipanaskan terurai tanpa meleleh. Ini mudah larut dalam air (warna abu-abu biru dari larutan sesuai dengan aquacomplex 3+), itu dihidrolisis oleh kation kromium (III). Bereaksi dengan alkali, amonia hidrat. Oksidator dan agen pereduksi yang lemah. Ini masuk ke dalam reaksi pertukaran ion.
Reaksi kualitatif menjadi ion Cr 3+ - reduksi menjadi Cr 2+ atau oksidasi menjadi CrO 4 kuning–.
Ini digunakan sebagai agen penyamakan kulit, mordan dalam mewarnai kain, reagen dalam foto. Ini dibentuk oleh kristalisasi bersama kromium (III) dan kalium sulfat. Persamaan reaksi yang paling penting:
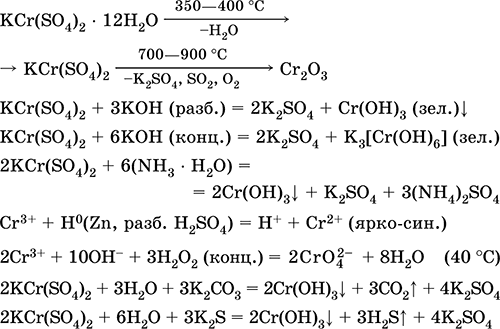
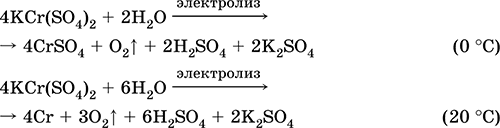
Mangan (II) sulfat MnSO 4. Saline Putih, ketika dikalsinasi, meleleh dan terurai. Crystalline hydrate MnSO 4 5H 2 O - red - pink, nama teknis vitriol mangan. Ini larut dalam air, warna merah muda terang (hampir tidak berwarna) dari larutan sesuai dengan aquacomplex 2+; dihidrolisis oleh kation. Bereaksi dengan alkali, amonia hidrat. Zat pereduksi lemah bereaksi dengan zat pengoksidasi khas (kuat).
Reaksi kualitatif ke ion Mn 2+ - konduksi dengan ion MnO 4 dan hilangnya warna ungu yang terakhir, oksidasi Mn 2+ menjadi MnO 4, dan penampilan warna ungu.
Ini digunakan untuk memperoleh Mn, MnO 2 dan senyawa mangan lainnya, sebagai zat gizi mikro dan pereaksi analitik.
Persamaan reaksi yang paling penting:
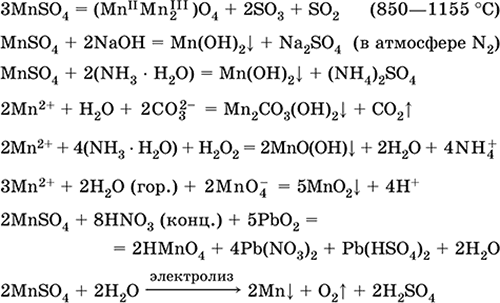
Menerima:
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Besi (II) sulfat FeSO 4. Saline Putih (hidrat hijau muda, nama teknis besi vitriol),higroskopis. Ini terurai ketika dipanaskan. Ini larut dalam air, sebagian kecil dihidrolisis oleh kation. Ini cepat teroksidasi dalam larutan oleh oksigen di udara (larutan berubah menjadi kuning dan menjadi keruh). Bereaksi dengan agen pengoksidasi asam, alkali, amonia hidrat. Zat pereduksi khas.
Digunakan sebagai komponen cat mineral, elektrolit dalam elektroplating, pengawet kayu, fungisida, obat anti-anemia. Di laboratorium, lebih sering diambil sebagai garam ganda Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( garam mora) lebih tahan terhadap udara.
Persamaan reaksi yang paling penting:
![]()
Menerima:
Fe + H 2 SO 4 (dec.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. Kelompok VA bukan logam
Nitrogen Amonia
Nitrogen - sebuah elemen dari periode ke-2 dan VA - grup dari sistem Berkala, nomor seri 7. Rumus elektron atom [2 He] 2s 2 2p 3, karakteristik oksidasi 0, –III, + III dan + V, lebih jarang + II, + IV dan lainnya; Keadaan Nv dianggap relatif stabil.
Skala Oksidasi Nitrogen:
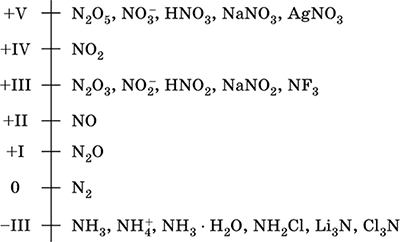
Nitrogen memiliki elektronegativitas tinggi (3,07), yang ketiga setelah F dan O. Menunjukkan sifat non-logam (asam) yang khas. Membentuk berbagai asam, garam dan senyawa biner yang mengandung oksigen, serta kation amonium NH4 + dan garamnya.
Di alam - ketujuh belas elemen prevalensi kimia (kesembilan di antara non-logam). Unsur vital untuk semua organisme.
Nitrogen N 2. Zat sederhana. Ini terdiri dari molekul non-polar dengan σππ - ikatan N ≡ N yang sangat stabil, ini menjelaskan inertness kimia nitrogen dalam kondisi normal. Gas tidak berwarna dan tidak berbau yang mengembun menjadi cairan tidak berwarna (tidak seperti O 2).
Komponen utama udara: 78,09% volume, 75,52% berat. Dari udara cair, nitrogen mendidih di atas oksigen O 2. Ini sedikit larut dalam air (15,4 ml / 1 l H 2 O pada 20 ° C), kelarutan nitrogen kurang dari oksigen.
Pada suhu kamar, N 2 hanya bereaksi dengan litium (dalam suasana lembab), membentuk litium nitrida Li 3 N, nitrida elemen lain disintesis dengan pemanasan kuat:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
Dalam pelepasan listrik, N 2 bereaksi dengan fluor dan pada tingkat yang sangat kecil dengan oksigen:
Reaksi reversibel untuk menghasilkan amoniak berlangsung pada 500 ° C, di bawah tekanan hingga 350 atm dan tentu saja dengan adanya katalis (Fe / F 2 O 3 / FeO, di laboratorium Pt):
Sesuai dengan prinsip Le Chatelier, peningkatan hasil amonia harus terjadi dengan peningkatan tekanan dan penurunan suhu. Namun, laju reaksi pada suhu rendah sangat rendah, sehingga prosesnya dilakukan pada 450-500 ° C, mencapai 15% hasil amoniak. N 2 dan H2 yang tidak bereaksi kembali ke reaktor dan dengan demikian meningkatkan derajat reaksi.
Nitrogen pasif secara kimiawi berkenaan dengan asam dan alkali, tidak mendukung pembakaran.
Mendapatkan di industri - distilasi fraksional dari udara cair atau penghilangan oksigen dari udara dengan cara kimia, misalnya dengan reaksi 2C (kokas) + O2 = 2CO dengan pemanasan. Dalam kasus ini, nitrogen diproduksi, yang juga mengandung kotoran dari gas mulia (terutama argon).
Masuk laboratorium sejumlah kecil nitrogen murni secara kimia dapat diperoleh dengan reaksi kombinasi dengan pemanasan sedang:
N ‑III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
Ini digunakan untuk sintesis amonia, asam nitrat dan produk yang mengandung nitrogen lainnya, sebagai lingkungan lembam untuk proses kimia dan metalurgi dan penyimpanan bahan yang mudah terbakar.
Amonia NH 3. Senyawa biner, tingkat oksidasi nitrogen adalah - III. Gas tidak berwarna dengan bau khas yang tajam. Molekul memiliki struktur tetrahedron [: N (H) 3)] yang tidak lengkap (sp 3 гиб-hibridisasi). Kehadiran nitrogen dalam molekul NH3 dari pasangan donor elektron dalam orbital sp 3 - hibrida menyebabkan reaksi penambahan yang khas dari kation hidrogen, dengan pembentukan kation. amonium NH 4+. Dicairkan di bawah tekanan pada suhu kamar. Dalam keadaan cair dikaitkan karena ikatan hidrogen. Tidak stabil secara termal. Ini larut dalam air (lebih dari 700 l / 1 l H 2 O pada 20 ° C); proporsi dalam larutan jenuh adalah = 34% berdasarkan massa dan = 99% volume, pH = 11,8.
Sangat reaktif, rentan terhadap reaksi adisi. Timbul dalam oksigen, bereaksi dengan asam. Ini menunjukkan pengurangan (karena N -III) dan sifat pengoksidasi (karena H I). Kering hanya dengan kalsium oksida.
Reaksi kualitatif - pembentukan "asap" putih yang bersentuhan dengan gas HCl, menghitamnya kertas yang dilembabkan dengan larutan Hg 2 (NO 3) 2.
Produk antara dalam sintesis HNO 3 dan garam amonium. Digunakan dalam pembuatan soda, pupuk nitrogen, pewarna, bahan peledak; amonia cair adalah pendingin. Beracun.
Persamaan reaksi yang paling penting:
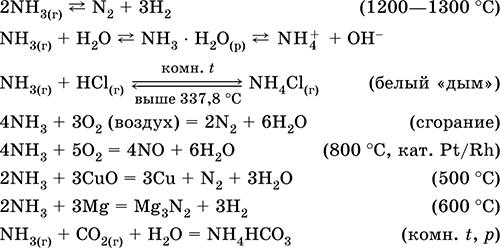
Mendapatkan: di laboratorium - perpindahan amonia dari garam amonium ketika dipanaskan dengan soda kapur (NaOH + CaO):
atau merebus larutan amonia, diikuti dengan mengeringkan gas.
Masuk industri amonia disintesis dari nitrogen (lihat) dengan hidrogen. Diproduksi oleh industri baik dalam bentuk cair atau dalam bentuk larutan air pekat dengan nama teknis air amonia.
Ammonia Hidrat NH 3 H 2 O. Senyawa antarmolekul. Putih, dalam kisi kristal adalah molekul NH 3 dan H 2 O, terikat oleh ikatan hidrogen yang lemah H 3 N ... HON. Hadir dalam larutan amonia, basa lemah (produk disosiasi - kation NH 4 - dan anion OH -). Kation amonium memiliki struktur π-tetrahedral yang teratur (sp 3 - hibridisasi). Tidak stabil secara termal, terurai total dengan merebus larutan. Dinetralkan oleh asam kuat. Menunjukkan pengurangan sifat (karena N III) dalam larutan pekat. Ini masuk ke dalam reaksi pertukaran ion dan kompleksasi.
Reaksi kualitatif - pembentukan "asap" putih yang bersentuhan dengan HCl gas.
Ini digunakan untuk membuat media alkali lemah dalam larutan, selama pengendapan hidroksida amfoter.
Larutan amonia 1M terutama mengandung NH 3 H 2 O hidrat dan hanya 0,4% ion NH 4 + dan OH - (karena disosiasi hidrat); dengan demikian, ion "amonium hidroksida NH 4 OH" praktis tidak terkandung dalam larutan, tidak ada senyawa seperti itu dalam hidrat padat. Persamaan reaksi yang paling penting:
NH 3 H 2 O (conc.) = NH 3 + H 2 O (mendidih dengan NaOH)
NH 3 H 2 O + HCl (des.) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (conc.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (conc.) + ЗBr 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40–50 ° C)
2 (NH 3 H 2 O) (conc.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (conc.) + Ag 2 O = 2OH + 3H 2 O
4 (NH 3 H 2 O) (conc.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH 3 H 2 O) (conc.) + NiCl 2 = Cl 2 + 6H 2 O
Larutan amonia encer (3-10% - -) sering disebut amonia cair (nama itu ditemukan oleh para alkemis), dan larutan pekat (18,5–25%) air amonia (diproduksi oleh industri).
