Sifat fisik sio2. Senyawa oksigen. Silikon (II) SiO
Silikon oksida (II) SiO. Di alam, itu tidak terjadi, tetapi dapat diperoleh dengan reaksi:
SiO 2 + Si → 2 SiO.
Di bawah tekanan normal, sublimasi silikon monoksida dimulai pada sekitar 1200 ° C (ketika bahan awal itu sendiri belum menguap). Secara berpasangan, SiO adalah senyawa individu. Energi disosiasi elemen adalah 789 kJ / mol. Konversi ke keadaan padat hanya dapat dicapai dengan pendinginan cepat ("quenching") dari fase gas. Jika tidak, pemutusan oleh persamaan memiliki waktu untuk berlalu:
2 SiO = SiO 2 + Si.
Silikon monoksida secara perlahan dioksidasi oleh oksigen atmosfer dan mudah larut dalam alkali untuk membentuk garam asam silikat dan melepaskan hidrogen. Itu mudah dialiri listrik oleh gesekan, memperoleh muatan negatif yang kuat.
Silikon oksida (IV) SiO 2.Silikon oksida (IV) juga disebut silika. Ini adalah zat refraktori padat. (titik lebur 1700 ° C)tersebar luas di alam dalam dua bentuk: 1) silika kristal - dalam bentuk mineral kuarsa dan varietasnya (kristal batu, kalsedon, batu akik, jasper, batu api); kuarsa membentuk dasar pasir kuarsa yang banyak digunakan dalam konstruksi dan industri silikat; 2) silika amorf - dalam bentuk komposisi opal mineral SiO 2 nH 2 O; bentuk silika amorf yang bersahaja adalah diatomit, tripoli (tanah infusorial); Contoh dari silika anhidrat amorf buatan adalah silika gel, yang diperoleh dari natrium metasilikat:
Silica gel memiliki permukaan yang berkembang, dan karenanya menyerap kelembaban dengan baik.
Pada 1710 ° kuarsa mencair. Dengan pendinginan cepat dari massa cair, gelas kuarsa terbentuk. Ini memiliki koefisien ekspansi yang sangat rendah, sehingga kaca kuarsa panas tidak pecah ketika air didinginkan dengan cepat. Peralatan gelas laboratorium dan instrumen untuk penelitian ilmiah terbuat dari kaca kuarsa.
Struktur SiO 2 dalam gambar planar dapat direpresentasikan sebagai berikut:
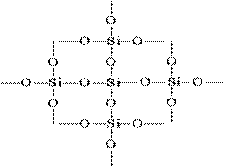
Setiap atom silikon tertutup dalam tetrahedron dengan 4 atom oksigen. Dalam hal ini, atom silikon terletak di tengah, dan atom oksigen terletak di simpul tetrahedron. Seluruh potongan silika dapat dianggap sebagai kristal dengan rumusnya (SiO 2) n. Struktur silikon oksida (IV) yang demikian menentukan tingkat kekerasan dan refraktorinya yang tinggi.
Sifat kimia silikon oksida (IV) SiO 2 mengacu pada asam oksida. Ketika menggabungkannya dengan alkali padat, oksida basa dan karbonat, garam asam silikat terbentuk:
Hanya asam hidrofluorik yang berinteraksi dengan silikon oksida (IV) (etsa gelas):
SiO 2 + HF → SiF 4 + H 2 O
Silikon (IV) oksida tidak larut dalam air dan tidak secara kimia berinteraksi dengannya. Oleh karena itu, asam silikat diperoleh secara tidak langsung, misalnya dengan hidrolisis:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 asam orthosilicon.
H 4 SiO 4 larut, ketika dipanaskan atau berdiri, proses polimerisasi sedang berlangsung:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 asam diorthokremnievy.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 tetraorotremilicic acid.
Dia menutup cincin itu:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 asam tetramethacilicic.
Dalam hal ini, asam silikat (tergantung pada konsentrasi larutan awal garam dan asam) dapat diperoleh baik dalam bentuk massa yang mengandung air agar-agar, dan dalam bentuk larutan koloid (sol). Komposisi asam silikat yang diperoleh tergantung pada bahan awal dan kondisi sediaan. Semua asam silikat sangat lemah (lebih lemah dari batubara).
Jika asam karbonat dalam larutan melepaskan asam silikat dari garamnya, maka reaksi sebaliknya terjadi selama kalsinasi. Yang pertama adalah karena kekuatan yang lebih rendah (tingkat disosiasi) asam silikat, yang kedua - volatilitas yang lebih rendah ketika dipanaskan.
Ketika dipanaskan asam polisilat dan dehidrasi bertahap dapat diperoleh SiO 2 halus, yang disebut gel silika . Ini menyerap air dengan baik, saya letakkan di perangkat untuk mencegah oksidasi elemen mahal.
Subkelompok Jerman
Ge (+4) Sn (+2, +4) Pb(+2) - status oksidasi yang tahan
Germanium diramalkan oleh DI Mendeleev pada tahun 1871, dan ditemukan pada tahun 1886. Timah dan timah merupakan unsur yang paling dikenal umat manusia sejak lama: orang Mesir mampu meleburnya dari bijih lebih dari 3000 tahun SM. er Di India, timah hitam dikenal sekitar 2500 tahun, dan timah 1500 tahun sebelum masehi. er Peleburan timah diproduksi di Tiongkok kuno.
Kwitansi.Senyawa alami germanium dikonversi menjadi GeO 2 dan direduksi dengan hidrogen:
GeO 2 + H 2 t → Ge + H 2 O pada suhu sekitar 1000 ° C.
Timah diperoleh dari mineral alami kasiterit(SnO 2):
SnO 2 + C → Sn + CO.
Skema paling sederhana untuk pengurangan timbal industri didasarkan pada dua reaksi berturut-turut:
PbS + O 2 → SO 2 + PbO Galena(PbS) dibakar dan kemudian dikurangi dengan batubara:
PbO + С → СO + Pb.
Aplikasi.Ketiga elemen ini sangat penting bagi teknologi modern. Beberapa senyawa timah dan timah juga banyak digunakan. Turunan timbal sangat beracun.
Germanium adalah semikonduktor yang khas (tipe-n dengan lebar celah pita 0,75 eV) dan menemukan berbagai kegunaan dalam teknik listrik. Ini paling banyak digunakan untuk pembuatan penyearah AC.. Aplikasi ini didasarkan pada konduktivitas unipolar yang timbul dari kontak antara germanium murni dan paduan germanium dengan indium. Arus (aliran elektron) lewat dalam instalasi semacam itu praktis hanya dari germanium ke alloy, tetapi tidak sebaliknya. Penyearah Germanium ditandai dengan efisiensi yang sangat tinggi (sekitar 98%) dan umur layanan yang sangat besar (dengan operasi yang tepat). Kerugian utama dari penyearah tersebut adalah sensitivitasnya terhadap pemanasan - di atas 70 ° C, efisiensinya cepat turun.
Area penggunaan penting jerman adalah optik inframerah, karena sinar dengan panjang gelombang lebih dari 2 mikron, ia praktis tidak menunda. Sebaliknya, dalam jarak cahaya dan dekat (0,2? 2 mikron), germanium secara intensif menyerap energi. Jika permukaan logam mengkilap (yang menyimpan panas dengan baik, tetapi tidak memanas dengan baik) ditutupi dengan film germanium, maka permukaan lebih panas daripada tanpa film. Dilaporkan bahwa dalam tong yang disiapkan dengan cara ini di bawah sinar matahari, air mendidih dapat diperoleh.
Timah terutama digunakan untuk pengalengan besi untuk melindunginya dari karat. (pelat timah untuk industri pengalengan). Ketebalan lapisan timah semacam itu sangat kecil - sesuai urutan mikron. Dalam bentuk lembaran tipis (disebut. Stannioles) timah dikonsumsi untuk pembuatan kapasitor dalam industri listrik . Timbal digunakan untuk pembuatan pelat baterai, pelat kabel listrik, peluru dan tembakan, untuk melindungi terhadap sinar-X dan sinar-g, serta dalam industri kimia (saluran pipa, dll.). Jumlah timah dan timah yang sangat besar dihabiskan untuk pembuatan sejumlah paduan penting secara teknis.
Yang paling penting di antaranya adalah berbagai perunggu (paduan Cu dan Sn), paduan untuk bantalan (babbits, biasanya dibuat berdasarkan Pb atau Sn dan juga mengandung Sb dan Cu), paduan tipografi (5-30% Sn, 10-20% Sb, sisanya adalah Pb) dan solder "lunak" yang biasa (30-70% Sn, 70-30% Pb). Ini sering dapat diganti dengan paduan yang lebih murah 90% Pb, 6% Sn, 4% Sb. Yang sangat penting adalah paduan untuk bantalan dengan komposisi perkiraan 98% Pb, 1% Ca, 1% Na.
Silika (silika, silika) adalah zat yang terdiri dari kristal tidak berwarna dengan kekuatan, kekerasan, dan refraktori yang tinggi. Silikon dioksida tahan terhadap asam dan tidak berinteraksi dengan air. Dengan peningkatan suhu reaksi, zat berinteraksi dengan alkali, larut dalam asam hidrofluorik, adalah dielektrik yang sangat baik.
Di alam, silikon dioksida didistribusikan secara luas: kristal silikon oksida diwakili oleh mineral seperti jasper, agate (senyawa silikon dioksida kristal), batu kristal (kristal besar materi), kuarsa (silikon dioksida gratis), kalsedon, batu kecubung, morion, topas (kristal berwarna silika).
Dalam kondisi normal (pada suhu dan tekanan lingkungan alami), ada tiga modifikasi kristal silikon dioksida - tridimit, kuarsa, dan kristobalit. Ketika suhu naik, silikon dioksida pertama kali berubah menjadi coesite, dan kemudian menjadi stishovite (mineral yang ditemukan pada tahun 1962 di kawah meteorit). Menurut penelitian, stishovit, turunan dari silikon dioksida, yang melapisi sebagian besar mantel bumi.
Formula kimia zat - SiO 2
Persiapan silika
Silikon dioksida diproduksi secara industri di pabrik kuarsa yang menghasilkan konsentrat kuarsa murni, yang kemudian digunakan dalam industri kimia dan elektronik, dalam pembuatan optik, karet dan pengisi cat dan pernis, pembuatan perhiasan, dll. Silikon dioksida alami, atau disebut silika, banyak digunakan dalam konstruksi (beton, pasir, bahan insulasi suara dan panas).
Sintesis silikon dioksida dengan metode sintetis dilakukan oleh aksi asam pada natrium silikat, dalam beberapa kasus pada silikat terlarut lainnya atau dengan metode koagulasi silika koloid di bawah pengaruh ion. Selain itu, silikon dioksida dihasilkan oleh oksidasi silikon dengan oksigen pada suhu sekitar 500 derajat Celcius.
Aplikasi silikon dioksida
Bahan yang mengandung silikon banyak digunakan baik di bidang teknologi tinggi dan dalam kehidupan sehari-hari. Silikon dioksida digunakan dalam pembuatan kaca, keramik, produk beton, bahan abrasif, serta dalam rekayasa radio, instalasi ultrasonik, korek api, dll. Dalam kombinasi dengan sejumlah bahan, silika digunakan dalam pembuatan kabel serat optik.
Silikon dioksida amorf non-berpori juga digunakan dalam industri makanan sebagai aditif, terdaftar dengan nomor E551, mencegah penggumpalan dan pengerasan pada produk utama. Dioksida  makanan silikon digunakan dalam industri farmasi sebagai obat enterosorben, dalam pembuatan pasta gigi. Zat ini ditemukan dalam keripik, kerupuk, batang jagung, kopi instan, dll.
makanan silikon digunakan dalam industri farmasi sebagai obat enterosorben, dalam pembuatan pasta gigi. Zat ini ditemukan dalam keripik, kerupuk, batang jagung, kopi instan, dll.
Silica Harm
Secara resmi dikonfirmasi bahwa substansi silikon dioksida melewati saluran pencernaan tidak berubah, setelah itu sepenuhnya dikeluarkan dari tubuh. Menurut penelitian 15 tahun oleh para ahli Perancis, minum air minum alumina tinggi mengurangi risiko terkena penyakit Alzheimer sebesar 10%.
Dengan demikian, informasi tentang bahaya silikon dioksida, yang merupakan zat kimia lembam, adalah salah: suplemen makanan E551, yang dikonsumsi secara oral, sepenuhnya aman untuk kesehatan.
Silikon oksida SiO 2 adalah zat padat, sangat tahan api (titik lebur lebih dari 1700 ° C), tersebar luas di alam, di mana ia ditemukan terutama dalam bentuk mineral kuarsa, serta kristobalit dan tridimit.
Pada suhu yang biasa, kuarsa adalah modifikasi yang stabil, dengan meningkatnya transformasi polimorfik suhu yang diamati:
Silika semua modifikasi dalam bentuk monomer tidak ada; selalu polimer dan "dibangun" dari tetrahedra membentuk kisi atom yang sangat kuat
Setiap atom silikon dalam (SiO2) n kristal dikelilingi tetrahedral oleh empat atom oksigen, masing-masing dijembatani. Melalui atom oksigen yang umum, tetrahedra pada sudut yang berbeda mengikat satu sama lain, membentuk kisi tiga dimensi terus menerus; pengaturan timbal balik tetrahedra dalam ruang menentukan satu atau modifikasi silika lainnya.
Dalam modifikasi yang berbeda dari kekuatan ikatan silika bervariasi. Ini mempengaruhi besarnya sudut Si-O-Si dan jarak Si-O, misalnya, sudut ikatan Si-O-Si dalam berbagai modifikasi silika bervariasi dari 120 hingga 180 °. Transisi kuarsa-tridimit-kristobalit disertai dengan putus dan transformasi ikatan, yang hanya dapat terjadi pada suhu tinggi.
Kuarsa Sering ditemukan di alam dalam bentuk kristal yang terbentuk sangat baik, kadang-kadang berukuran cukup besar. Kristal terbentuk dari tetrahedra yang tersusun dalam bentuk spiral di sekitar poros tengah, dalam bentuk spiral. Dalam kristal yang sama, arah heliks mungkin berlawanan. Kristal seperti itu adalah isomer optik. Mereka memutar bidang polarisasi cahaya, dan dapat menjadi tangan kanan dan kiri. Kristal tersebut dan kristal lainnya berbeda sebagai subjek dari gambar cerminnya.
Kuarsa digunakan dalam berbagai bidang sains dan teknologi, dan kristalnya sering ditanam secara buatan. Beberapa jenis kuarsa adalah nama khusus. Kristal berwarna transparan disebut kristal batu. Ada juga varietas kuarsa berwarna: mawar kuarsa, violet (kecubung), coklat tua (smoky topaz), hijau (chrysoprase), dll. Modifikasi kristal kuarsa dengan pencampuran zat lain disebut kalsedon. Varietas kalsedon adalah batu akik, jasper, dan lain-lain. Kristal batu dan varietas kuarsa berwarna digunakan sebagai batu berharga dan semimulia.
Tridimite terjadi pada batuan vulkanik, tetapi dalam jumlah yang sangat kecil. Asal tridim dan meteorit diketahui.
Cristobalite di alam kadang-kadang ditemukan dalam bentuk kristal kecil yang tertanam di lava, seperti tridimite. Tridimite dan cristobalite memiliki struktur yang lebih "longgar" daripada kuarsa. Dengan demikian, kepadatan kristobalit, tridimit, dan kuarsa adalah 2,32; Masing-masing 2,26 dan 2,65 g / cm 3.
Silika meleleh dengan pendinginan lambat dengan mudah membentuk kaca kuarsa amorf. Silika dalam bentuk kaca juga ditemukan di alam. Kerapatan kaca amorf adalah 2,20 g / cm 3 - lebih rendah dari semua modifikasi kristal. Kaca kuarsa memiliki koefisien ekspansi suhu yang sedikit, oleh karena itu, kaca kuarsa digunakan untuk menyiapkan peralatan laboratorium yang tahan terhadap perubahan suhu yang mendadak.
Semua modifikasi silika dalam air praktis tidak larut (pada suhu 25 ° C, kelarutan kuarsa adalah 7, cristobalite - 12, tridymite - 16, kaca kuarsa - 83 mg / l). Oleh karena itu, dalam kondisi normal, hanya larutan alkali dan asam hidrofluorik yang bertindak untuknya:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
Reaksi yang terakhir digunakan dalam "etsa" gelas.
Silika yang ditambahkan bereaksi dengan oksida basa, alkali (reaksi (1)) dan karbonat untuk membentuk silikat:
SiO 2 + CaO = СaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
Reaksi (3) dan (4) mendasari produksi berbagai gelas industri, serta semen. Dengan demikian, komposisi gelas biasa (misalnya, jendela, untuk pembuatan piring) diungkapkan dengan rumus Na 2 O. CaO. 6SiO 2. Gelas semacam itu diproduksi dengan menggabungkan campuran soda, pasir, dan batu kapur. Proses ini dilakukan pada suhu ~ 1400 ° C hingga penghilangan gas secara lengkap:
Na 2 CO 3 + CaCO 3 + 6 Si 2 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
Untuk kadar khusus gelas - tahan api, "tidak mudah pecah" - saat memasak, tambahkan oksida barium, timah, boron. Untuk mendapatkan kacamata berwarna, berbagai aditif juga diperkenalkan, misalnya, penambahan kobalt oksida Co 2 O 3 memberi warna biru, kromium oksida Cr 2 O 3 - hijau, mangan dioksida MnO 2 - pink.
SiO 2 oksida adalah anhidrida dari sejumlah asam silikat, yang komposisinya dapat dinyatakan dengan rumus umum xSiO 2 ∙ yH 2 O, di mana x dan y adalah bilangan bulat: 1) x = 1, y = 1: SiO 2. H 2 Oh, i.e. H 2 SiO 3 - asam meta-silikon; 1) x = 1, y = 2: SiO 2. 2H 2 O, mis. asam ortosilikat; 1) x = 2, y = 1: 2SiO 2. H 2 Oh, i.e. H 2 Si 2 O 5 - asam bimeta silikat.
Asam yang molekulnya mengandung lebih dari satu molekul SiO 2 termasuk dalam polisilikon.
Asam silikat yang paling sederhana adalah H 2 SiO 3, yang sering disebut hanya silikon, dan garamnya adalah silikat. Dari silikat, hanya natrium dan kalium silikat yang larut dalam air, silikat yang tersisa bersifat refraktori, tidak larut dalam air.
Solusi silikat tumbuh keruh ketika berdiri di udara, karena CO 2 yang terkandung di dalamnya menggantikan asam silikat dari garamnya (H 2 SiO 3 lebih lemah dari asam karbonat; konstanta disosiasi H 2 SiO 3 pada tahap pertama adalah K 1 = 2.2. 10 -10 ).
H 2 SiO 3 praktis tidak larut dalam air - sifat ini digunakan sebagai reaksi kualitatif untuk mendeteksi ion silikat:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Silikat diperoleh dengan menggabungkan SiO 2 dengan alkali atau karbonat.
Solusi natrium dan kalium silikat terkonsentrasi disebut gelas cair, mereka memiliki reaksi basa kuat karena fakta bahwa mereka sangat terhidrolisis:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Kaca cair digunakan, misalnya, untuk pembuatan lem, kain tahan air.
Semen sangat banyak digunakan dalam konstruksi sebagai bahan pengikat, yang bila dicampur dengan air mengeras. Biasanya, semen diproduksi dalam tanur putar besar di mana berbagai silikat dipanggang dan ditumbuk (pada suhu -1000 ° C).
Ada beberapa jenis semen, namun, secara kondisional mungkin untuk membedakan dua jenis semen sesuai dengan prinsip “koagulasi” mereka - semen biasa dan semen Portland. Proses "pengaturan" semen konvensional yang terdiri dari kalsium silikat, terjadi karena pembentukan kalsium karbonat karena karbon dioksida di udara:
Cao. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Ketika pengaturan semen Portland karbon dioksida tidak terlibat dalam proses, dan hidrolisis silikat terjadi dengan pembentukan hidrat kristalin yang tidak larut:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Karbida dan silikida
· Senyawa karbon dan silikon dengan logam - karbida dan silikida, selain reaksi yang dipertimbangkan, juga diperoleh melalui interaksi silikon dengan logam hidrida, misalnya:
· 2CaH 2 + Si = Ca 2 Si + 2H 2.
· Semua reaksi ini berlangsung pada suhu tinggi. Di antara karbida memancarkan apa yang disebut "metanida" dan "asetilena". Yang pertama dianggap sebagai turunan metana yang mengandung karbon dalam keadaan oksidasi -4 (Be 2 C, Al 4 C 3), yang kedua - sebagai turunan asetilena dengan tingkat oksidasi karbon -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2 , CAC 2). Asetilida perak dan tembaga (I) dapat dengan mudah diperoleh dengan melewatkan asetilena melalui larutan amonia perak oksida atau tembaga (I) klorida. Sebagian besar metanida dan asetilida aktif bereaksi dengan air (terutama dengan asam), melepaskan hidrokarbon yang sesuai:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C 2 H 2.
· Tidak seperti karbida, hanya silikida dari logam alkali atau logam alkali tanah yang berinteraksi dengan air dan asam, menghasilkan senyawa hidrogen silikon monosilan yang paling sederhana, yang sering disebut hanya silan SiН 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
· Silane adalah gas tidak berwarna yang memiliki bau jamur, mudah terbakar secara spontan, membakar ke SiO 2 dan air:
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Alkali sangat mudah menguraikan silan dengan persamaan:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Air juga menghidrolisis silan, tetapi jauh lebih lambat:
· SiH 4 + 2H 2 O = SiO 2 + 4H 2.
· Ketika dipanaskan di atas 400 ° C tanpa akses udara, silan terurai menjadi silikon dan hidrogen (salah satu metode untuk memproduksi silikon):
· SiH 4 = Si + 2H 2.
· Selain monosilan, disilane Si 2 H 6, trisilane Si 3 H 8, tetrasilane Si 4 H 10, dll. Juga dikenal. Dalam keadaan individu, senyawa diisolasi hanya hingga Si 6 H 14 inklusif. Semua senyawa ini termasuk dalam rangkaian silan homolog, yang sesuai dengan rumus umum Si n H 2 n + 2. Seperti alkana, silana tidak berwarna, anggota pertama dari seri homolog berbentuk gas dalam kondisi normal, berikut ini adalah cairan. Aktivitas kimia silan dan hidrokarbon berbeda: berbeda dengan alkana inert yang cukup, silan semuanya reaktif. Ini karena afinitas silikon yang lebih rendah untuk hidrogen dibandingkan dengan karbon dan afinitas silikon yang sangat tinggi untuk oksigen. Selain itu, obligasi Si-Si kurang tahan lama dibandingkan dengan С-С. Berbeda dengan ikatan C - H, ikatan Si - H memiliki karakter yang lebih ionik.
· Energi ikatan Si-E dan CE.
· Kekuatan ikatan Si-Si yang rendah disebabkan oleh terbatasnya rangkaian silan yang homolog.
· Di antara karbida dan silikida, tempat khusus ditempati oleh karborundum SiC, yang dapat disebut silikon karbida dan karbon silisida. Carborundum memiliki titik lebur yang tinggi karena strukturnya yang seperti intan; kekerasannya dekat dengan berlian. Secara kimia, SiC sangat stabil.
· Konsep solusi koloidal
Dalam alam dan teknologi, sistem terdispersi sering ditemukan di mana satu zat terdistribusi secara merata sebagai partikel di dalam zat lain.
Dalam sistem terdispersi, ada fase terdispersi - zat yang terbagi halus dan media dispersi - zat homogen di mana fase terdispersi didistribusikan. Sistem dispersi meliputi solusi biasa (benar), solusi koloid, serta suspensi dan emulsi. Mereka berbeda satu sama lain terutama dalam ukuran partikel, yaitu tingkat dispersi (fragmentasi).
Sistem dengan ukuran partikel kurang dari 1 nm adalah solusi sejati yang terdiri dari molekul atau ion terlarut. Mereka harus dianggap sebagai sistem fase tunggal. Sistem dengan ukuran partikel lebih besar dari 100 nm adalah sistem terdispersi kasar - suspensi dan emulsi.
Suspensi adalah sistem terdispersi di mana fase terdispersi adalah padatan dan medium dispersi adalah cairan, dan padatan secara praktis tidak larut dalam cairan.
Emulsi adalah sistem terdispersi di mana fase terdispersi dan media dispersi adalah cairan yang tidak saling larut. Contoh emulsi adalah susu, di mana bola-bola kecil lemak mengambang dalam cairan.
Suspensi dan emulsi adalah sistem biphasic.
Solusi koloid adalah sistem dua fase terdispersi tinggi yang terdiri dari media dispersi dan fase terdispersi, dan dimensi linear dari partikel-partikel yang terakhir terletak pada kisaran 1 hingga 100 nm. Seperti dapat dilihat, larutan koloid dengan ukuran partikel adalah perantara antara larutan sejati dan suspensi dan emulsi. Partikel koloid biasanya terdiri dari sejumlah besar molekul atau ion.
Solusi koloid juga disebut sol. Mereka diperoleh dengan metode dispersi dan kondensasi. Penyebaran paling sering dilakukan dengan menggunakan "pabrik koloid" khusus. Dalam metode kondensasi, partikel koloid terbentuk dengan menggabungkan atom atau molekul menjadi agregat. Selama berlangsungnya banyak reaksi kimia, terjadi kondensasi dan sistem yang sangat terdispersi terbentuk (presipitasi, hidrolisis, reaksi reduksi oksidasi, dll.).
1 nm - nanometer (1 nm = 10 -9 m).
Berbeda dengan solusi sejati, sinds ditandai oleh efek Tyndall, yaitu hamburan cahaya oleh partikel koloid. Ketika sebuah kerucut cahaya muncul melalui seberkas cahaya, itu muncul di ruangan yang gelap. 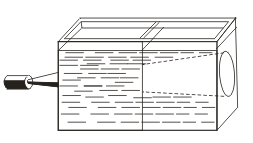 . Jadi, Anda dapat mengenali apakah solusi ini koloid atau benar.
. Jadi, Anda dapat mengenali apakah solusi ini koloid atau benar.
Salah satu sifat penting sol adalah partikelnya memiliki muatan listrik dengan tanda yang sama. Karena ini, mereka tidak bergabung menjadi partikel yang lebih besar dan tidak mengendap. Pada saat yang sama, partikel-partikel dari beberapa sol, misalnya, logam, sulfida, asam silikat dan asam timah, memiliki muatan negatif, sementara yang lain, misalnya hidroksida, oksida logam, memiliki muatan positif. Penampilan muatan dijelaskan oleh adsorpsi ion dari larutan oleh partikel koloid.
Untuk mengendapkan sol, perlu bagi partikelnya untuk bergabung menjadi agregat yang lebih besar. Kombinasi partikel menjadi agregat yang lebih besar disebut koagulasi, dan sedimentasi mereka di bawah pengaruh gravitasi disebut sedimentasi.
Biasanya koagulasi terjadi ketika menambah sol: 1) elektrolit, 2) sol lain yang partikelnya bermuatan berlawanan, dan 3) ketika dipanaskan.
