Ha 28 g szilíciumot csatlakoztat oxigénnel. Szilícium oxigénvegyületek
Szilícium. Általános jellemző: A fő különbség a széntől: a p kötések hiánya a vegyületekben Szilícium-oxidok, hidrogén (szilánok), oxidáció és hidrolízis, tetrafluorid és szilícium-tetraklorid, hidrolízis, hexafluoroszilikátok, oxigénvegyületek. Szilikátok Oldhatóság és hidrolízis Természetes szilikátok és alumínium-szilikátok, zeolitok Szerves szilícium-vegyületek Szilikonok és sziloxánok Szilíciumvegyületek alkalmazása gyógyászatban.
szilícium (lat. Silicium), Si, az időszakos rendszer IV. atomszám: 14, atomtömeg 28.086. A szilícium az elektronikus sp3 hibridizációját is mutatja
pályák. A szilícium-atom külső elektronrétegén valens 3d-
orbiták (Si: 3s23p23d0),
A szilícium az oxigén után a leggyakoribb elem a kéregben. A szabad állapotban lévő széntől eltérően a szilícium nem található a természetben. A leggyakoribb vegyületek a szilícium-oxid (IV) SiO2 és a kovasav sók, szilikátok. A földkéreg héját alkotják. A szilíciumvegyületeket növényekben és állatokban találjuk. Kémiai tulajdonságok szerint a szilícium, mint a szén, nem fém, de nem-fémessége kevésbé kifejezett, mivel nagyobb atomos sugara van
Silicon. szinte valamennyi fémből álló vegyületeket képez ilitsidy (Nem találtak csak vegyületeket Bi, Tl, Pb, Hg). Több mint 250 szilicidet kaptunk, amelyek összetétele (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, stb.) Általában nem felel meg a klasszikus értékeknek. A szilicidek a refraktivitás és a keménység tekintetében különböznek; A ferroszilícium (redukálószer a speciális ötvözetek olvasztásában, lásd Ferroötvözetek) és a molibdén-szilicid MoSi2 (elektromos kemencék, gázturbinás lapátok stb.) a legnagyobb gyakorlati jelentőséggel bír.
Szilán. A szilícium-oxid sósav hatására a szilícium legegyszerűbb hidrogénvegyülete a szilán SiH4:
A szilán egy olyan mérgező gáz, amelynek kellemetlen szaga spontán gyullad. a levegőt
Ezek reaktívak és erős redukálószerek.
reagáljon vízzel, amikor szobahőmérsékleten:
SiH4 + 2H2O → SiO2 + 4H2,:
tetrafluorid A szilíciumot szilícium-dioxid elemi fluorálásával állítják elő.
A fluorálás folyamatát egy lángreaktorban két szakaszban hajtjuk végre, és az első fázisból a II.
A technikai eredmény a szilícium gyártása folyamatos üzemmódban, magas hozammal és termékminőséggel.
Szilícium-tetrafluorid Az SiF4-et hidrofluoros (hidrogén-fluorid) sav hatására képezi üvegre:
Na2Si03 + 6HF® 2NaF + SiF4 + 3H2O
Szilícium oxigénvegyületek
A szilícium legfontosabb oxigénvegyülete a szilícium-dioxid Si02 (szilícium-dioxid), amely több kristályos módosítással rendelkezik.
Az alacsony hőmérsékletű módosítást (legfeljebb 1143 K) kvarcnak nevezzük. A kvarcnak piezoelektromos tulajdonságai vannak. Természetes kvarcfajták: szikla kristály, topáz, ametiszt. A szilícium-dioxid fajtái chalcedon, opál, agát,. jáspis, homok.
A szilikát kémiailag ellenálló; csak fluor, hidrogén-fluorid és alkáli oldatok befolyásolják. Könnyen üveges állapotba kerül (kvarcüveg). A kvarcüveg törékeny, nagyon kémiai és hőálló. A megfelelő Si02 szilíciumsav nem tartalmaz specifikus összetételt. Jellemzően a kovasavat xH2O-ySi02-ként regisztráljuk. Kiválasztottuk a szilícium-savakat: H2SiO3 (H2O-Si02) - meta-szilícium (három-oxo-szilícium), H4Si04 (2H20-Si02) - orto-szilícium (tetra-oxo-szilícium), H2Si2O5 (H2O * Si02) - dimetil-szilícium.
A szilicilsavak rosszul oldódó anyagok. A szilícium kevésbé metalloid jellege szerint a szénhez képest H2SiO3 elektrolitként gyengébb, mint a H2CO3.
A szilícium-savak só-szilikátjai vízben oldhatatlanok (kivéve az alkálifém-szilikátokat). Az oldható szilikátokat az egyenlet hidrolizálja
2Si03 - + H20 = Si2O52- + 20H-.
Oldható szilikátok koncentrált oldatait folyékony üvegnek nevezik. A nátrium és a kalcium szokásos ablaküveg-szilikátja Na20-CaO-6Si02 összetételű. Reakcióval nyerjük
A szilikátok széles választéka (pontosabban az oxoszilikátok) ismert. Az oxoszilikátok szerkezetében egy bizonyos szabályosság figyelhető meg: mindegyik Si04 tetraéderből áll, amely oxigénatomon keresztül kapcsolódik egymáshoz. A tetraéder leggyakoribb kombinációi (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), amelyek szerkezeti egységként láncok, szalagok, hálók és csontvázak kombinálhatók (4. ábra).
A legfontosabb természetes szilikátok például a talkum (3MO * H20-4Si02) és az azbeszt (SmgO * H2O * SiO2). A SiO2-hoz hasonlóan az üveges (amorf) állapot a szilikátokra jellemző. Az üveg szabályozott kristályosításával kristályos állapotot (sitallokat) kaphatunk. A Sitalls-ot fokozott erő jellemzi.
A szilikátokon kívül az alumínium-szilikátok is széles körben elterjedtek. Alumínium-szilikátok - keret-oxoszilikátok, amelyekben a szilícium-atomok egy részét háromértékű Al helyettesíti; pl. Na12 [(Si, Al) 04] 12.
A szilíciumsav esetében a kolloid állapot jellemző, amikor a sav H2SiO3 sói nem érintik azonnal. A szilíciumsav (szol) kolloid oldatai bizonyos körülmények között (például melegítéskor) átlátszó, homogén, gélszerű szilíciumsav gélgé alakíthatók át. A gélek nagy molekulatömegű vegyületek, amelyek térbeli, nagyon laza szerkezetűek, melyeket SiO2 molekulák alkotnak, amelyek üregei H2O molekulákkal vannak feltöltve. Szilikagél kiszárításakor szilikagélt kapunk, amely nagy adszorpciós kapacitású porózus termék.
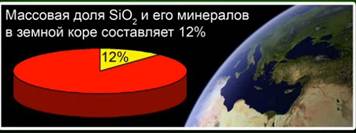
Szilícium-oxid (IV) (szilícium-dioxid) - a földkéreg legelterjedtebb vegyülete, amely tömegének 12% -át teszi ki különböző ásványi anyagok formájában. Meg kell különböztetni a kristályos és az amorf szilícium-dioxidot. A szilícium-oxid (IV) legegyszerűbb képlete a SiO2. Az atomrácsban kristályosodik.
1) Kristályos szilícium-dioxid - kvarc ásványi formája és fajtái (kőzetkristály, chalcedon, agát, jáspis, flint) formájában; A kvarc az építőiparban és a szilikátiparban széles körben alkalmazott kvarc homok alapja.
2) Amorf szilícium-dioxid - az opál ásványi készítmény SiO2 nH2O formájában; az amorf szilícium földi formái diatóma, Tripoli (infúziós föld); A mesterséges amorf vízmentes szilícium-dioxid például szilikagél, amelyet nátrium-metaszilikátból nyerünk:
Na2Si03 + 2HCI = 2NaCl + H2SiO3
A szilikagél fejlett felülettel rendelkezik, ezért jól felszívja a nedvességet.
Szilikagél Szárított gél, amely szilíciumsav (nSiO2 · mH2O) túltelített oldatából áll, pH = 5-6 értéken. Szilárd hidrofil szorbens.
vétel
Ezt az alkálifém-szilikát-oldatok savanyításával nyerik, majd a képződött gélt mosjuk és szárítjuk.
Szilíciumsav. A SiO2 számos szilícium-sav anhidridje
A szilíciumsav tetraéderes szerkezeti egységekből épül fel (minden ilyen egységben a szilíciumatom a tetraéder közepén van, és az oxigénatomok a tetején vannak). A láncokban egyesülő szerkezeti kapcsolatok stabilabb poliszilinsavat képeznek:
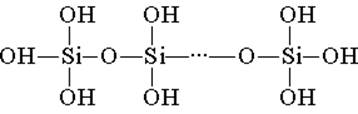
Az ilyen vegyület összetétele a (H2SiO3) képlettel kifejezhető. A szilícium-savat általában H2SiO3 képlet képviseli. H2SiO3 - a sav nagyon gyenge, kevés vízben oldódik. Fűtéskor ugyanolyan módon bomlik, mint a szénsav:
Minden kovasav nagyon gyenge (gyengébb, mint a szén).
szilikátok. Minden szilícium-sav sóját szilikátnak nevezzük, bár általában az oktatási irodalomban a szilikátok metakristályos sókat tartalmaznak. Összetételüket általában a képlet mutatja az elemek oxidjainak formájában. Például a CaSiO3 kalcium-szilikát kifejezhető: CaO × SiO2.
Az R2O × nSiO2 kompozíció szilikátjait, ahol R2O jelentése nátrium- vagy kálium-oxid, úgy nevezik oldható üvegnek, és koncentrált vizes oldatait folyékony üvegnek nevezik. A legfontosabb a nátriumoldható üveg.
Levegőben állva a szilikátok oldatai zavarosak, mivel a levegőben lévő szén-dioxid (IV) a sóból a szilícium-savat kiszorítja:
A szilíciumsav gyakorlatilag vízben nem oldódik - ezt a tulajdonságot a SiO32- ion minőségi reakciójaként használják.
A szilikátokat szilícium-dioxid lúgokkal vagy karbonátokkal történő olvasztásával állítjuk elő:
A szilicilsav oldhatósága és az oldódás sebessége számos tényezőtől függ, amelyek közül a legfontosabb a szilícium-dioxid módosítása, diszperzió mértéke és hőmérséklete. A szilikagél vízzel való rázásakor az oldhatósági egyensúly pár óra alatt jön létre, kvarc esetén több hónap és még évek szükségesek.
TERMÉSZETI SILIKÁTOK (a latin. silex, nemzetség. szilicis eset - flint * a. természetes szilikátok; N. naturliche Silikate; F. szilikátok naturels; és szilicatos naturales) - ásványi anyagok, szilícium-, izo- és heteropolycarmininsavak. A természetes szilikátok aránya a földkéreg tömegének 75% -át és az ásványi fajok mintegy 25% -át teszi ki. A természetben több mint 700 természetes szilikát ismert, köztük a legfontosabb kőzetképző ásványok (feldspars, piroxének, amfibolok, mikaszok stb.).
alumínium-szilikátok - természetes és szintetikus szilikátok csoportja, amelyek komplex anionjai szilíciumot és alumíniumot tartalmaznak. Komplex anionok példái: -, -, 2 -. Kationként Na +, K +, Mg2 +, Ca2 +, és néha Ba2 + és Li +.
A leggyakoribb ásványi anyagok a természetes alumínium-szilikátok, amelyek a földkéreg tömegének legfeljebb 50% -át teszik ki. Ezek közé tartoznak a földpátok (albit, ortokláz, anortit), agyagásványok és csillám.
zeolitok - Kálcium, nátrium, kálium, bárium és más elemek vizes alumínium-szilikátjai. A zeolitok csoportja több mint negyven ásványi anyagot tartalmaz, amelyek összetétele különbözik (különösen a kristályos hidrátban lévő vízmolekulák számában), és természetesen a fizikai és kémiai tulajdonságokban is. De az ásványi anyagok csoportjának szinte minden képviselője rendelkezik közös tulajdon - jó szorbensek, ioncserélő tulajdonságokkal rendelkeznek, megváltoztathatják az egyes ionok mobilitását és molekulaszűrőként működhetnek. És viszonylag nemrégiben ezek az ásványok teljesen váratlan felhasználást találtak - kezdték használni a mezőgazdaságban.
Szerves szilícium vegyületek - olyan vegyületek, amelyek molekuláiban kötés van a szilícium és a szénatom között. Szerves szilícium vegyületeket néha szilikonoknak neveznek a "szilícium" latin szilícium nevéből. A szerves szilíciumvegyületeket kenőanyagok, polimerek, gumik, gumik, szilikon folyadékok és emulziók előállítására használják. A szerves szilíciumvegyületeket kozmetikumokban, háztartási vegyszerekben, festékekben és lakkokban, mosószerekben használják. Megkülönböztető jellemző a közös szerves vegyületeken alapuló szerves szilíciumvegyületeken alapuló termékek általában nagyobb teljesítmény és jellemzők, valamint az emberi felhasználás biztonsága. A szilikon polimerek öntőformák készítéséhez használhatók. A szerves szilíciumvegyületek és a tömítőanyagok polimerizációja ember számára biztonságos és nem igényel extrakciót.
sziloxán - a molekulában váltakozó szilícium- és oxigénatomokat tartalmazó vegyületek. A legnagyobb molekulatömegű sziloxánok - poliorganosziloxánok; lásd a szilikon polimerek.
szilikonok (poliorganosziloxánok) - oxigénezett nagy molekulatömegű szerves szilíciumvegyületek, amelyek kémiai képlete n, ahol R = szerves csoport (metil, etil vagy fenil). Most ez a meghatározás rendkívül ritka, és a poliorganosziloxánok (például PMS típusú szilikonolajok, NGL típusú vízlepergető vagy kis molekulatömegű SKTN-kaucsuk) és még a szerves szilícium-monomerek (különböző szilánok) is "szilikonokká" vannak kombinálva, így törlődik a "szilikonok" és a "szilikonok" között. szilikon. "
Fémes szilícium  Kristály szilícium
Kristály szilícium
szilícium (Si). Ez a kémiai elem a földkéreg összetételének 1/4-a. Kvarc, szikla kristály, homok, agyag, gránit, csillám, azbeszt - mindezt szilícium vegyi vegyületek
A szilícium egy közbenső elem (amfoter), és fém- és nemfémes tulajdonságokkal is rendelkezik. Kémiai vegyületeket képezhet fémekkel és nemfémekkel egyaránt.
Tiszta szilícium - kémiailag egyszerű, szürke színű, kemény, tűzálló és törékeny anyag. Kristály szilícium Fémes csillogása van, és széles körben használják a félvezető iparágban (félvezető).
A szilícium kristályos állapotban nyúlik ki ( kristályos szilícium), és amorf állapotban ( amorf szilícium). A kristályos szilíciumot olvadt fémben lévő amorf szilícium oldatának hűtésével állítjuk elő. A kristályos szilícium viszont nagyon törékeny anyag, és könnyen összezúzható amorf porba. Így amorf szilícium a kristályos szilícium kristályainak fragmense.
Szabad állapotban a szilícium meglehetősen nehéz. Ipari termelése a kvarc helyreállításához kapcsolódik, kémiai képlet amely - Si02, a redukciós reakciót forró koksz (szén) képezi.
Si02 + C → CO 2 + Si
A laboratóriumban a tiszta szilíciumot a szilícium-dioxid homokból fém magnéziummal redukáljuk a következő reakcióval:
SiO 2 + 2Mg → Si + 2MgO.
A reakció során barna amorf szilícium por képződik. Melegítés közben a por lassan reagálhat koncentrált lúgoldatokkal (például nátrium-hidroxid-oldattal).
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - az így kapott összetett anyag - más néven folyékony üveg.
Érdekes, hogy a szilícium kémiai aktivitása a kristályok méretétől függ. A ko-kristályos szilícium kevésbé kémiailag aktív, mint az amorf. Ez utóbbi a szokásos hőmérsékleten is könnyen reagál a fluorral, és 400 - 600 ° C hőmérsékleten oxigénnel, klórdal, brómmal, kénnel reagál a megfelelő kémiai vegyületek előállítására. Nagyon magas hőmérsékleten a szilícium reagál nitrogénnel és szénnel, hogy nitridet és szilícium-karbidot képezzen.
Ha a szilíciumot hidrofluoros HF (hidrofluor) és nitrogén-HNO 3 savak keverékében próbálja feloldani, akkor a reakció nem folytatódik. Ha azonban kémiai reakciót végez egy alkáliával, például kálium-hidroxiddal, akkor a reakció a szilíciumsav sójának kialakulásával történik.
Si + KOH → K 2 SiO 3 + H 2
Ha a kemencében szilícium-dioxidot (homokot) kalcinálunk kokszdal, akkor nagyon szilárd kristályos anyag keletkezik. karborundum SiC
Si02 + 3C → SiC + 2CO
karborundum - nagyon kemény és tűzálló anyag. Az iparágban ezek a tulajdonságok miatt nagy mennyiségben készülnek. Érdekes módon a karborund kristályrács hasonló a legnehezebb anyag - gyémánt - rácsához, de ebben az esetben az egyes szénatomok egyenletesen helyettesítve vannak a szilícium atomokkal.
Magas hőmérsékleten, valamint kémiai reakciók során a fém-vegyületek savak hatására szilíciummal, szilán SiH 4.
Cilan - öngyulladó színtelen gáz. Ez levegőn gyulladhat szilícium-dioxid és víz képződéséhez.
SiH4 + 2O2\u003e → Si02 + 2H2O
Ha a SiO 2 szilícium-oxidot klór jelenlétében szén jelenlétében melegítjük, kémiai reakció folyik a szilícium-klorid képződésével.
Si02 + 2C + 2CI 2 → SiCl4 + 2CO
Szilícium-klorid - folyadék, amelynek forráspontja mindössze 54 0 C. A szilícium-kloridot könnyen feloldjuk vízben, két sav: szilícium-dioxid és sósav oldatával.
SiCl4 + H20 → H 2 SiO 3 + HCl
Ha ez a kémiai reakció nedves levegő atmoszférájában megy végbe, két sav képződése során vastag füst jelenik meg.
Szilícium-fluorid SiF 4 - hidrogén-fluorid és szilícium-oxid kémiai reakciójának eredményeként keletkezett
Si02 + 4HF → SiF 4 + 2H 2 O
A szilícium-fluorid színtelen gáz "erős" szaggal. A szilícium-klorid mellett vízben ez a gáz két savat képez: szilíciumot és hidrogén-fluoridot. Érdekes módon a szilícium-fluorid kölcsönhatásba léphet a hidrogén-fluoriddal hexafluor-szilíciumsav amelynek kémiai képlete H 2 SiF 6. Sói és maga a sav mérgező.
szilícium
Nemesfémek és nemfémek
Ebben a leckében tanulmányozod a "Szilícium" témát. Fontolja meg a szilíciumra vonatkozó információkat: az elektronikus szerkezetét, ahol a szilícium a természetben van, tanulmányozza a szilícium allotrópiát, magyarázza meg a fizikai és a fizikai tulajdonságait kémiai tulajdonságok. Ismerje meg, hogy az iparban és más területeken miként használják fel a szilíciumot, hogyan állítják elő. Ismerje meg a szilícium-dioxidot, a kovasavat és sóit - szilikátokat.
Téma: Alapanyagok és nemfémek
Lecke: Szilícium. Nemesgázok
A szilícium az egyik leggyakoribb kémiai elem a földkéregben. Tartalma közel 30%. A természetben főként a szilícium-dioxid, a szilikátok és az alumínium-szilikátok különböző formáiban találhatók.
A szilícium szinte minden vegyületében tetravalens. Ebben az esetben a szilícium atomok gerjesztett állapotban vannak. Ábra. 1.
Ebbe az állapotba való belépéshez a 3-as elektronok egyike üres helyet foglal el a 3p pályákon. Ebben az esetben a fázisállapotban lévő két páratlan elektron helyett a gerjesztett állapotban lévő szilícium atomnak 4 páratlan elektronja lesz. A csere mechanizmusa révén 4 kovalens kötést hozhat létre.


A szilícium atomok nem hajlamosak több kötés kialakulására, hanem egyetlen kötésű Si-O- vegyületet képeznek. A szilíciumtól eltérően a szén nem jellemző az allotropiára.
Az egyik az allotróp módosítás kristályos szilíciumamelyben minden szilikon atom sp3 hibridizációban van. Ábra. 2, 3. A kristályos szilícium szilárd, tűzálló és tartós, sötétkék kristályos anyag, fémfényű. Normál körülmények között - félvezető. Néha az amorf szilíciumot is szilícium egy másik allotróp módosításaként bocsátják ki. Sötétbarna por, amely kémiailag aktívabb, mint a kristályos szilícium. Fontos kérdés, hogy ez egy allotróp módosítás.
A szilícium kémiai tulajdonságai
1. Halogénekkel való kölcsönhatás
Si + 2F 2 → SiF 4
2. Fűtés közben oxigénben ég, szilícium-dioxid (IV) képződik.
Si + O 2 → SiO 2
3. Magas hőmérsékleten a szilícium kölcsönhatásba lép nitrogénnel vagy szénnel.
3Si + 2N 2 → Si 3 N 4
4. A szilícium nem reagál a savak vizes oldatával. De lúgokban oldódik.
Si + 2NaOH + H20 → Na 2 SiO 3 + 2H 2
5. Amikor szilíciumot fuzionálnak fémekkel, szilicidek képződnek.
Si + 2Mg → Mg 2 Si
6. A szilícium nem közvetlenül kölcsönhatásba lép a hidrogénnel, hanem a szilícium-hidrogénvegyületeket a szilícium-oxidok vízzel való kölcsönhatásával lehet elérni.
Mg2Si + 4H 2O → 2Mg (OH) 2 + SiH4 (szilán)
A szilánok szerkezetileg hasonlóak az alkánokhoz, de jelentősen reaktívak. A legstabilabb monoszilán levegőben gyúlékony.
SiH4 + 2O 2 → Si02 + 2H 2 O
A szilícium megszerzése
A szilíciumot szilícium-oxidból (IV) történő redukcióval nyerjük
SiO 2 + 2Mg → Si + 2MgO
Az egyik feladat a nagy tisztaságú szilícium előállítása. Ebből a célból a műszaki szilíciumot szilícium-tetrakloridba visszük át. A kapott tetrakloridot szilánra redukáljuk, és a szilánt szilícium- és hidrogéngá bomlik hevítés közben.
A szilícium két oxidot képez: Si02 - szilícium-oxid (IV) és SiO - szilícium-oxid (II).
SiO - szilícium-oxid (II) - ez egy amorf, sötétbarna anyag, amelyet a szilícium és a szilícium-oxid kölcsönhatása (IV) képez.
Si + SiO 2 → 2 SiO.
Stabilitása ellenére ezt az anyagot szinte soha nem használják.
SiO 2 - szilícium-oxid (IV)


Ez az anyag a földkéreg 12% -át teszi ki. Ábra. 4. Olyan ásványi anyagokat képvisel, mint a kőzetkristály, kvarc, ametiszt, citrin, jáspis, chalcedony. Ábra. 5.
Si02 - szilícium-oxid (IV) - nem molekuláris szerkezetű anyag.
Kristályrácsa atomi. Ábra. 6. A SiO 2 kristályok tetraéder formájúak, amelyek oxigénatomokkal vannak összekapcsolva. A (Si02) n molekula képlete pontosabb lenne. Mivel a SiO 2 atomszerkezet és a molekuláris szerkezetű CO 2 -ot képez, a tulajdonságaik különbsége nyilvánvaló. CO 2 egy gáz, és Si02 egy szilárd, átlátszó kristályos anyag, amely vízben és tűzálló anyagban nem oldódik.
Kémiai tulajdonságokSiKörülbelül 2
1. A (IV) szilícium-oxid szilícium-oxid egy savas oxid. Nem reagál vízzel. A szilícium-sav nem érhető el a SiO 2 hidratálásával. Sóit, szilikátjait úgy állíthatjuk elő, hogy a Si02-t forró alkáli oldatokkal reagáltatjuk.
Si02 + 2NaOH Na2Si03 + H20
2. Reagál alkáli- és alkáliföldfémek karbonátjaival.
CaCO 3 + Si02 CaSiO 3 + CO 2
3. kölcsönhatásba lép a fémekkel.
SiO 2 + 2Mg → Si + 2MgO
4. Reakció hidrogén-fluoriddal.
Si02 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
A szilíciumsav és szilikátok kémiai tulajdonságai
A szilíciumsav felvétele
A kovasav polimer vegyületként kicsapódik. Szilíciumsav-képletek -
H 2 SiO 3 (meta forma) és H4 SiO 4 (ortoforma) - tükrözi az elemek arányát, de nem a valódi összetételt. Hagyományosan a síkban a szilíciumsav összetételét az 1. ábrán mutatjuk be. 7.
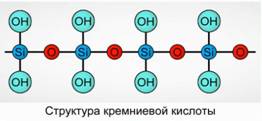
A kovasav esetében mindig a H 2 SiO 3 képletet alkalmazzuk.
1. H 2 SiO 3 hevítéskor bomlik
H 2 SiO 3H 2O + Si02 (szilikagél)
2. Kölcsönhatásba lép az alkáli oldatokkal
H2Si03 + 2NaOH Na2Si03 + 2H 2O
Szilsav-sók - szilikátok - az ionos vegyületekre vonatkozik. Ezek szilárd színtelen anyagok. Csak a lítium kivételével alkálifém-szilikátok oldhatók vízben.
1. Az oldható szilikátokat anion hidrolizálja
Na2Si03 + H20 * NaHSio 3 + NaOH
2. Az oldható szilikátok erős savakkal kölcsönhatásba lépnek.
Na 2SiO 3 + 2HCI → H2S04 3 + 2NaCl
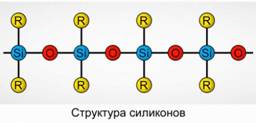
Poliorganosziloxánok (szilikonok)
A poliorganosziloxánok (szilikonok) oxigénezett, nagy molekulatömegű szerves szilícium vegyületek.
R 2 [ SiO] n
R jelentése szerves csoport (metil-, etil- vagy fenilcsoport). A sziloxánok szerkezete alapja egy váltakozó szilícium atomok és oxigén lánc. 8. ábra. A lánc és a szerves csoportok hosszának változtatásával különböző tulajdonságokkal rendelkező szilikonok nyerhetők. A polimerizáció körülményeinek megváltoztatásával különböző hosszúságú molekulákat kaphatunk.


A rövid láncú polimerek folyadékok, a hosszabbak értékes kenőanyagok. Ábra. 9, amely megőrzi tulajdonságait egy hatalmas hőmérsékleti tartományban
100 0 С és + 300 0 ° C közötti hosszabb molekulák alkotnak gumit, amelyek alacsony hőmérsékleten nem veszítik el rugalmasságukat. A kopásállósággal szemben nagy ellenállóképessége kémiailag inert. Ábra. 10. Alkalmazásuk különböző változatait okozza. Használhatók mesterséges szív- vagy veseberendezések létrehozására, és cipőként használhatók. A sziloxán polimerek gyógyászatban különböző lágyszövet implantátumok előállítására használatosak, mivel az ilyen polimerek kémiailag inertek, és a test nem utasítják el őket. Nem nedvesítik vízzel. Krémekben használják. Amikor a krémet a kezére alkalmazza, a gumikesztyűt kicseréli.
Szervetlen kert
Egy átlátszó főzőpohárban, amelyet nátrium-szilikáttal töltünk, a színes sók kristályait, például réz-szulfátot merítsük. Néhány idő elteltével látható, hogy a kristályokból az oldhatatlan szilikátokból álló vékony üreges csövek képződnek. Ábra. 11.

A "hülye" gitt
Egyenlő mennyiségű nátrium-szilikát és orvosi alkohol keveredik. A csapadékot leszűrjük és kiszorítjuk, hogy ne csepegjen alkohol. Ez gitt. Ábra. 12. Ezt úgy nevezték el, mert azt tervezték, hogy kittként használják az ablakokhoz. De kiderült, hogy olyan tulajdonságokkal rendelkezik, amelyeket nem lehetett használni a rendeltetésének megfelelően. Ha dobja a labdát, és dobja a padlóra, ugrál, mint egy golyó. Ha az asztalra kerül, úgy folyik, mint egy folyadék. Ha egy szilárd tárgyat talál, akkor egy szilárd test lesz. Egy idő után, amikor az alkohol megszárad, ez a gitt csak morzsolódik.
![]()
Összegezve a leckét
Ebben a leckében tanulmányozta a "Szilícium" témát. Megvizsgáltuk a szilíciumra vonatkozó információkat: az elektronikus szerkezete, ahol a szilícium a természetben található, tanulmányozta a szilícium allotropiáját, magyarázta fizikai és kémiai tulajdonságait. Megtanulták, hogy az iparban és más területeken miként használják fel a szilíciumot. A szilícium-dioxiddal, szilíciumsavval és sóival - szilikátokkal találkoztak.
Irodalom
1. G. Rudzitis. Kémia. Az általános kémia alapjai. 11. osztály: tankönyv oktatási intézmények számára: alapszint / G.E. Rudzitis, F.G. Feldman. - 14. szerk. - M.: Megvilágosodás, 2012.
2. Popel P.P. Kémia: 8 cl .: tankönyv középiskoláknak / PP-nek. Popel, L.S. - К.: ИЦ "Akadémia", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. Kémia. 11. osztály. Alapszint. 2. kiadás, Sr. - M .: Drofa, 2007. - 220 p.
házi feladat
1. №2-2-4 (138. o.) Rudzitis G.E. Kémia. Az általános kémia alapjai. 11. osztály: tankönyv oktatási intézmények számára: alapszint / G.E. Rudzitis, F.G. Feldman. - 14. szerk. - M.: Megvilágosodás, 2012.
2. Melyek a poliorganosiloxánok alkalmazása.
3. Hasonlítsa össze a szilícium allotróp módosításainak tulajdonságait.
