A nemfém példák genetikai sorozata. Genetikai kapcsolat az anyagosztályok között - Tudás Hypermarket
Az egyszerű anyagok, oxidok, bázisok, savak és sók között genetikai kapcsolat van, nevezetesen a kölcsönös átmenet lehetősége (transzformáció).
Például egy egyszerű anyag - kalcium az oxigénnel való kölcsönhatás eredményeként oxidokká alakul: 2Ca + O 2 = 2CaO.
A kalcium-oxid vízzel való kölcsönhatás során CaO + H20 = Ca (OH) 2 kalcium-hidroxidot képez, és az utóbbi savval való kölcsönhatás során sóvá alakul: Ca (OH) 2 + H2S04 = CaSO 4 + 2H 2 O.
Ezeket az átalakításokat a rendszer képviseli:
Ca → CaO → Ca (OH) 2 → CaSO 4
Hasonló rendszer írható a nemfém, például kén esetében is:
S → SO 3 → H 2SO 4 → CaSO 4
Így ugyanaz a só különböző módon nyerhető.
Lehetőség van a sótól a szervetlen vegyületek és az egyszerű anyagok más osztályaira való fordított átmenetre is:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H 2 = Cu + H20 (rézcsökkentés)
A szervetlen vegyületek osztályai közötti hasonló kapcsolat, amely az egyik osztály anyagainak egy másik anyagból történő előállításán alapul, genetikai.
A komplex vegyületek tulajdonságait a szervetlen vegyületek főbb osztályainak genetikai rendszere tükrözi (lásd az ábrát). Ez tükrözi a szervetlen anyagok két fő vonalon való kialakulásának szakaszát, a tipikus fémektől a tipikus nemfémekig, amelyeknek ellentétes tulajdonságai vannak.
Azok a fémek, amelyeknek egy atom kémiai tulajdonsága az elektronok és a nemfémek adományozásának képessége, amelynek fő kémiai tulajdonsága az atomok azon képessége, hogy tulajdonságaikban egymással ellentétes elektronokat csatolnak. Az anyagok összetételének bonyolultsága miatt ezek az ellentétes tendenciák továbbra is megjelennek.
A legalacsonyabb oxidációs állapotban a tipikus fémek és átmeneti elemek alkotják a bázikus oxidokat, míg a magas oxidációs állapotban a tipikus nemfémek és átmeneti elemek alkotják az ellentétes savas oxidokat.
Egyszerű anyagok
amfoter
Nem-fémek
Bázikus oxidok
amfoter
savas
terület
amfoter
hidroxidok
A szervetlen vegyületek főbb osztályainak genetikai rendszere
Az anyagok összetételének további bonyolultsága miatt hidroxidokat képeznek, a bázishoz tartozó bázis-oxidokat és a savnak megfelelő sav-oxidokat. A tulajdonságokkal és savval ellentétes bázisok aktívan reagálnak egymással, sókat képezve. Az ellentétek kölcsönhatása a reakció hajtóereje. Ezért a bázikus és savas oxidok, bázisok és savak aktívan kölcsönhatásba lépnek egymással, és két savas oxid vagy két bázikus oxid nem lép kölcsönhatásba, mivel tulajdonságaik közel vannak.
Így egy összetett vegyület tulajdonságait az alkotóelemei tulajdonságai alapján határozzuk meg. Ezeknek a tulajdonságoknak a főbb változásait a következő alkalmazások foglalják össze (6. táblázat).
1. A szekvenciaszám növekedésével járó időszakokban az elemek tulajdonságai fémből nem nem fémké válnak. A külső szinten az elektronok száma növekszik, az elem oxidációja fokozódik, csökken az atom és az ion sugara, az ionizációs energia és az elektron növekedés affinitása. Ennek megfelelően nőnek az oxidok és hidroxidok bázikus csökkenése és savas tulajdonságai.
2. A fő alcsoportokban az oxidok és a hidroxidok alapvető tulajdonságai növekszik az atomszám növekedésével. A szekvenciaszám növekedésével rendelkező oldalsó csoportok elemei esetében a tulajdonságok összetettebb változása jellemző. Először is, a fém tulajdonságai fokozódnak és csökkenthetők.
3. Az aktív fémek erősen kifejezett alapvető tulajdonságokkal rendelkező oxidok és hidroxidok. A legaktívabb fémek alkáli- és alkáliföldfémek. Vízoldható oxidokat és erős oldható bázisokat - lúgokat képeznek.
4. Az alacsony aktivitású fémek (az alkáli és a lúgos földek kivételével) gyenge bázisokat képeznek, amelyeket nehéz vízben oldani:
Cu (OH) 2, Fe (OH) 3.
5. Az erősen kifejezett savas tulajdonságokkal rendelkező oxidok és hidroxidok az aktív nemfémeknek felelnek meg.
6. Az amfoter fémek amfoter oxidokat és hidroxidokat képeznek.
7. Ha egy elem különböző mértékű oxidációt mutat, akkor különböző tulajdonságú oxidok és hidroxidok felelnek meg.
Témakör: A fémek és a nemfémek és azok vegyületei közötti GENETIKUS CSATLAKOZÁS. 9. osztály
Célkitűzések: oktatási: a "genetikai sorozat", "genetikai kapcsolat" fogalmának megszilárdítása; megtanulják, hogyan készítsünk genetikai sorozatú elemeket (fémek és nemfémek) a genetikai sorozatnak megfelelő reakcióegyenletek elkészítéséhez; ellenőrizze a tudás megtanulását kémiai tulajdonságok oxidok, savak, sók, bázisok, fejlesztés: a kémiai reakciók egyenleteinek kiegyenlítése, következtetéseinek elemzése, összehasonlítása, összefoglalása és levonása; oktatási: a tudományos világkép kialakulásának elősegítése.
Osztályok biztosítása: táblázatok "Periódusos rendszer", "Oldhatósági táblázat", "Fémek tevékenységsorozata", utasítások a diákoknak, feladatok a tudás tesztelésére.
Haladás: 1) Org. a pillanatban
2) Ellenőrizze a d / s értéket
3) Tanulmányozza az új anyagot
4) Rögzítés
5) D / C
1) Org. a pillanatban. Szívesen.
2) Ellenőrizze a d / s értéket.
A genetikai kapcsolatok a különböző osztályok közötti kapcsolatok az egymásra épülések alapján.
Ismerve a szervetlen anyagok osztályait, lehetséges a fémek és nemfémek genetikai sorozatának elkészítése. E sorozat alapja ugyanaz.
A fémek között kétféle sor van:
1
. Olyan genetikai sorozat, amelyben az alkáli bázis. Ez a sorozat a következő átalakítások segítségével jeleníthető meg:fém → bázikus oxid → lúg → só
Például K → K
2 O → KOH → KCI2
. A genetikai sorozat, ahol az alap egy oldhatatlan bázis, akkor a sorozat a transzformációs láncként ábrázolható:fém → bázis-oxid → só → oldhatatlan bázis →
→bázikus oxid → fém
Például: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. A nemfémek genetikai sorozata, ahol az oldható sav egy linkként működik a sorozatban. Az átalakítási lánc a következőképpen ábrázolható:nem fém → savas oxid → oldható sav → só
Például P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. A nemfémek genetikai sorozata, ahol az oldhatatlan sav a linkben hivatkozik:nem fém → sav-oxid → só → sav →
→sav-oxid → nem fém
Például
Si→ SiO 2 → na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si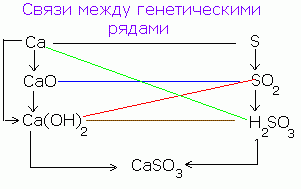
Frontális beszélgetés:
Mi a genetikai kapcsolat? A genetikai kapcsolatok a különböző osztályok közötti kapcsolatok az interkonverziók alapján.
Genetikai sorozat - egy sor anyag - különböző osztályok képviselői, amelyek egy kémiai elem vegyületei, amelyek egymás közötti átalakításokkal és ezeknek az anyagoknak az átalakulásait tükrözik. E sorozat alapja ugyanaz.
Milyen típusú genetikai sorozatokat lehet megkülönböztetni?
a) Olyan genetikai sorozat, amelyben az alkáli bázis. Ez a sorozat a következő átalakítások segítségével jeleníthető meg:
fém → bázikus oxid → lúg → só
például a K → K kálium genetikai sorozata
2 O → KOH → KCIb) A genetikai sorozat, ahol az alap egy oldhatatlan bázis, akkor a sorozat a transzformációs láncként ábrázolható:
fém → bázis-oxid → só → oldhatatlan bázis → bázis-oxid → fém
például: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuA nemfémek között kétféle sor megkülönböztetése is lehetséges:
a) A nemfémek genetikai sorozata, ahol az oldható sav a hivatkozásként működik. A transzformációs lánc a következőképpen ábrázolható: nem fém → savas oxid → oldható sav → só.
Például: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Nemfémek genetikai sora, ahol oldhatatlan sav: nem fém → sav-oxid → só → sav → sav-oxid → nem fém, mint a link a sorozatban
Például: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiFeladatok végrehajtása a következő lehetőségek közül:
1. Válaszd ki a változataidban lévő oxid-képleteket, magyarázd el a választásodat, az összetett anyagok összetételének jellemzőinek ismeretében. Hívja őket.
2. A variáns képlet oszlopában keresse meg a savas képleteket, és magyarázza el a választását a vegyületek összetételének elemzése alapján.
3. Határozza meg a savösszetételben lévő savmaradékok értékeit.
4. Válassza ki a sóformákat és adja meg őket.
5. Töltsük fel a magnéziummal és a variánsokkal savakkal képződő sókat. Írja le őket, nevezze el.
6. A variáció képletoszlopában keresse meg az alap képleteket, és magyarázza el a választását a vegyületek összetételének elemzése alapján.
7. Változatában válassza ki azokat az anyagokat, amelyekkel az ortofoszforsav (sósav, kénsav) oldata reagálhat. Készítsük el a megfelelő reakcióegyenleteket.
9. Az opció képletei közül válassza ki azokat az anyagokat, amelyek kölcsönhatásba léphetnek egymással. Készítsük el a megfelelő reakcióegyenleteket.
10. Készítsen láncot a szervetlen vegyületek genetikai kötéseiből, amely tartalmaz egy olyan anyagot, amelynek képlete az első változatban található.
1. lehetőség
2. lehetőség
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
lítium-
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4CuSO
4Ezekből az anyagokból genetikai vonalat készítenek az összes képlettel. Írja be azokat a reakcióegyenleteket, amelyekkel elvégezheti ezt a transzformációs láncot:
I opció: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opció:na 2 SO 4, NaOH, na, na 2 O 2 , na 2 O4) Rögzítés1.
al→ al 2 O 3 → AICI 3 → al( OH) 3 → al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Házi feladat:
a kalciumról a kalcium-karbonátra való fokozatos átmenetet ábrázolja, és készítsen jelentést bármely gyógyászatban alkalmazott só használatáról (további irodalom).

A fémek között kétféle sor különböztethető meg: 1. Genetikai sorozat, amelyben az alkáli bázis. Ezt a sorozatot a következő transzformációk képviselhetik: fém- bázis-oxid - alkáli-só, például a kálium K-K 2 O-KOH-KCl genetikai sorozata.

2. Olyan genetikai sorozat, ahol az oldhatatlan bázis bázisként működik, majd a sorozat transzformációs láncként ábrázolható: fém - bázis-oxid - só - oldhatatlan bázis - bázis-oxid - fém. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu genetikai sorozata réz "\u003e Cu a réz genetikai sorozata"\u003e "title =" (! LANG: 2. Genetikai sorozat, ahol az alap egy oldhatatlan bázis, akkor a sorozat a transzformáció láncaként ábrázolható: fém - bázis-oxid - só - oldhatatlan bázis - a fő oxid fém. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Olyan genetikai sorozat, ahol az oldhatatlan bázis bázisként működik, majd a sorozat transzformációs láncként ábrázolható: fém - bázis-oxid - só - oldhatatlan bázis - bázis-oxid - fém. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
A nemfémek között kétféle sor megkülönböztetése is lehetséges: 1. A nemfémek genetikai sorozata, ahol az oldható sav a linkben a link. A transzformációs lánc a következőképpen ábrázolható: nemfém-sav-oxid oldható sav-szol. P - P205 - H3P04 - Na3P04. Foszforgenetikai tartomány

A szervetlen vegyületek osztályai között genetikai kapcsolat van. Az egyszerű anyagokból összetett lehet, és fordítva. Egy osztályú vegyületekből egy másik osztályba tartozó vegyületeket kaphatunk.
A szervetlen vegyületek osztályai közötti egyszerűsített genetikai kapcsolat a következő sémával ábrázolható:
Az ilyen transzformációk nem-fémekre történő szekvenciáját a következő sémával lehet ábrázolni: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → 3. (РО 4) 2
(Saon) 3 PO 4
A tipikus fémek esetében a következő átalakítási láncot készítheti:
Ba → BaO → Ba (OH) 2 → BaSO 4
Olyan fémek esetében, amelyek oxidjai és hidroxidjai amfoter (félméter), az alábbi átalakítások végezhetők el:
Al → Al 2O 3 → Al (OH) 3 → Na → AlCI3 → AlOHCI 2 → Al (OH) 3 → Al 2O 3.
Az osztályok közötti kapcsolatok:
1. Fémek, nemfémek→ sót.
A fémek és nemfémek közvetlen kölcsönhatásával az oxigénmentes savak (halogenidek, szulfidok) sói keletkeznek:
2Na + Ci2 = 2NaCl
Ezek a vegyületek stabilak és nem melegülnek fel.
2. Bázikus oxidok, sav-oxidok→ sót.
CaO + CO 2 = CaCO3;
Na20 + SO3 = Na2S04.
3. Bázisok, savak→ sót.
Ez egy semlegesítési reakció útján történik:
2NaOH + H2S04 = Na2S04 + 2H 2O,
HE - + H + → H20;
Mg (OH) 2 + 2HC1 = MgCI 2 + 2H 2O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Fémek→ bázikus oxidok.
A legtöbb fém kölcsönhatásba lép az oxigénnel, és oxidokat képez:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A1203.
Az arany, az ezüst, a platina és más nemesfémek nem hatnak az oxigénnel, az ilyen fémek oxidjai közvetve keletkeznek.
5. Nemfémek→ savas oxidok.
A nemfémek (a halogének és a nemesgázok kivételével) kölcsönhatásba lépnek az oxigénnel, oxidokat képezve:
4P + 5O2 = 2P205;
S + O 2 = SO 2.
6. Bázikus oxidok→ bázis.
A vízzel való közvetlen kölcsönhatás csak alkálifém- és alkáliföldfémek (alkáli) hidroxidjaiból nyerhető:
Na20 + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
A fennmaradó okokat közvetetten kapják meg.
7. Savas oxidok→ sav.
Savas oxidok vízzel reagálnak, hogy a megfelelő savakat képezzék:
SO 3 + H20 = H 2SO 4;
Р 2O 5 + 3H 2O = 2H3P04.
Kivétel a SiO 2, amely nem reagál vízzel.
8. Bázisok, sav-oxidok→ sót.
A sók kölcsönhatásba lépnek a savas oxidokkal:
2NaOH + SO 3 = Na2S04 + H20,
2OH - + SO 3 = SO 4 2- + H20;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Savak, bázikus oxidok→ sót.
Fém-oxidok savakban oldódnak, sók képződnek:
CuO + H2S04 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na20 + 2HS1 = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Alapok→ bázikus oxidok.
Az oldhatatlan bázisok és a LiOH hevítés közben bomlik:
2LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Savak→ savas oxidok.
Az instabil oxigéntartalmú savak hevítéskor bomlanak (H 2 SiO 3) és még melegítés nélkül (H 2CO 3, HClO). Ugyanakkor számos sav is ellenáll a melegítésnek (H2S04, H3P04).
H2S04 = H20 + Si02;
H 2CO 3 = H20 + CO 2.
12. Fém-oxidok→ fémek.
Néhány nehézfém-oxid fémre és oxigénre bomlik:
2HgO = 2Hg + O 2.
Szintén a megfelelő oxidokból fémeket kapunk redukálószerek segítségével:
3M02 + 4Al = 3Mn + 2AI 2O 3;
Fe203 + 3H2 = 2Fe + 3H 2O.
13. Savas oxidok→ nem-fémek.
A legtöbb nemfém-oxid nem melegszik fel. A nemfém és az oxigén csak néhány instabil oxidot (halogén-oxidot) bont le.
Egyes nemfémeket a megfelelő oxidokból történő redukcióval nyerünk:
Si02 + 2Mg = 2MO + Si.
14. Sók, bázisok → bázisok.
Az oldhatatlan bázisokat a megfelelő savak oldatokkal történő lúgok hatására állítjuk elő:
CuS04 + 2NaOH = Cu (OH) 2 ↓ + Na2S04,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Sók, savak → savak.
Ha az eredmény gyengébb vagy illékonyabb, az oldható sók savakkal reagálnak (a nyomássorozattal összhangban):
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s) + H 2SO 4 (k) = NaHS04 + HCl.
16. Sók→ bázikus oxidok, sav-oxidok.
Néhány oxigéntartalmú sav (nitrát, karbonát) sói melegítés közben bomlanak:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
A TÉMÁBAN FELTÉTELES MUNKAVÁLLALKOZÁSOKRA VONATKOZÓ KERESKEDELEMEK „NEMZETKÖZI ÖSSZEFOGLALÓK OSZTÁLYA” \\ t
1. Nevezze meg az alább felsorolt anyagokat, osztja szét a szervetlen vegyületek osztályaiba: Na3P04, H2S04, NO, B203, MgS, BaI2, Ca (OH) 2, KNO3, HN02, Cl2 O7, Fe (OH) 2, P205, HF, Mn02.
2. Az alább felsorolt anyagokból egy lépésben hidroxidot (savat vagy bázist) kaphatunk: réz, vas-oxid (P), bárium-oxid, nitrogén-oxid (P), nitrogén-oxid (V), szilícium-oxid, réz-szulfát, kálium-klorid , kálium, magnézium-karbonát.
3. A fenti listából írja le az alábbiakhoz kapcsolódó anyagok képleteit: 1) oxidok; 2) okok; 3) savak; 4) sók:
CO 2, NaOH, HCI, S03, CuS04, NaN03, KCI, H2S04, Ca (OH) 2, P205, HN03, Al (OH) 3.
4. Nevezze meg az anyagokat: Zn (OH) 2, MgO, P203, NaHC03, H3P03, Fe2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Jelölje meg, hogy melyik osztályba tartozik az egyes anyagok.
5. Írja be a következő anyagok molekuláris képleteit, és adja meg, hogy melyik osztályba tartozik az egyes anyagok:
1) réz (II) hidroxi-karbonát;
2) nitrogén-oxid (V);
3) nikkel (II) -hidroxid;
4) bárium-hidrogén-foszfát;
5) perklórsav;
6) króm (III) -hidroxid;
7) kálium-klorát;
8) hidrogén-szulfid-sav;
9) nátrium-cinkát.
6. Adjon példákat a következők közötti kapcsolatra:
1) egyszerű anyagok - nemfémek;
2) egyszerű anyag és oxid;
3) oxidok;
4) összetett anyagok, amelyek nem oxidok;
5) fém és nem fém;
6) három anyag.
7. A következő anyagok közül melyik reagálhat:
1) szén-monoxid (IV): HCI, 02, NO 2, KOH, H20;
2) magnézium-oxid: Ba (OH) 2, HCI, CO 2, O 2, HNO 3;
3) vas (II) -hidroxid: KCI, HCI, KOH, 02, H20, HNO3;
4) hidrogén-klorid: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Lehetséges-e a következő anyagok kölcsönhatása?
1) szén-monoxid (IV) és kálium-hidroxid;
2) kálium-hidroszulfát és kalcium-hidroxid;
3) kalcium-foszfát és kénsav;
4) kalcium-hidroxid és kén-oxid (IV);
5) kénsav és kálium-hidroxid;
6) kalcium-hidrogén-karbonát és foszforsav;
7) szilícium-dioxid és kénsav;
8) cink-oxid és foszfor-oxid (V).
Írja be a lehetséges reakciók egyenleteit, adja meg azokat a feltételeket, amelyekben előfordulnak. Ha a reakciók különböző anyagokhoz vezethetnek, akkor jelezzük, hogy mi a különbség a végrehajtás feltételeiben.
9. Adja meg a reakciók egyenleteit a következő anyagok előállításához: nátrium-ortofoszfát (4 út), kálium-szulfát (7 út), cink-hidroxid.
10. A szóda (nátrium-karbonát) előállításának egyik módja a víz és a szén-monoxid (IV) nátrium-aluminátra kifejtett hatása. Töltsük fel a reakcióegyenleteket.
11. Megváltoztatja az együtthatókat, írja a reakciótermékeket:
1) MgO + 2H 2SO 4 →
2) 2SO 2 + Ba (OH) 2
3) 3N 2O 5 + 2Al (OH) 3
4) P205 + 4NaOH →
5) P205 + 6NaOH →
6) P205 + 2NaOH →
12. Készítsük el a reakciók egyenleteit különböző típusú sók fogadására:
1) SO 2 + Ba (OH) 2 → (közepes és savas sók),
2) A1203 + H20 + HNO3 → (közepes só, bázisos sók),
3) Na 2O + H 2 S → (közeg és savas sók),
4) SO 3 + Sa (OH) 2 (közeg és bázisos sók),
5) CaO + H20 + P205 → (bázikus só, savas sók).
13. Végezze el a reakcióegyenleteket:
CaO + A1203 → CaHPO 4 + Ca (OH) 2 →
Cr203 + H2S04 → AlOHS04 + NaOH →
Cr203 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn207 + KOH → ZnS + H 2S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2SO 4 (elégtelen) →
AlCl3 + NaOH (hiányos) → (FeOH) Cl + NaHS →
AlCI3 + NaOH → Na2Zn02 + H 2SO 4 (felesleg) →
AlC1 3 + NaOH (felesleg.) → Ca (AlO 2) 2 + HCl (felesleg) →
14. Írja fel a reakcióegyenleteket, amelyekkel a következő átalakításokat végezheti el:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → Na2R2 → Cr 2O 3 → K
7) P → P 2O 5 → HPO 3 → H3P04 → NaH2P04 → Na3P04
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHS04 → Na 2SO 4 → BaSO 4
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO 4 → ZnCl2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → CuO
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgS04 → MgCl2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2SO 3 → KHS03 → K 2SO 3 → KHSO 3 → SO 2
19) P205 → H3P04 → Ca (H2P04) 2 → Ca3 (PO 4) 2 → Ca (H 2PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al203 → AlCI3 → Al (OH) 3 → NaAlO2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO 3) 2
25) AlCI3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCI3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2O 3
28) K → KOH → KHSO 4 → K 2SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCI2 → MgOHCI → Mg (OH) 2 → MgOHNO 3
33) CuS04 → CuCl2 → ZnCl2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2O 3 → NaA 2O 2 → Al (OH) 3 → AlOHCl2
35) ZnSO 4 → Zn (OH) 2 → ZnCl2 → AlCI3 → Al (OH) 3 → A1 2O 3
36) CuCl2 → Cu (OH) 2 → CuS04 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO 3) 3 → Fe
38) Al203 → AlCI3 → Al (OH) 3 → NaAlO2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgS04 → MgCI2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) alumínium-szulfát → alumínium-klorid → alumínium-nitrát → alumínium-oxid → kálium-aluminát → alumínium-hidroxid → alumínium-hidroxid → alumínium-klorid.
41) Na → NaOH → Na3P04 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO3 → Ba (HCO 3) 2 → BaCO3 → (BaOH) 2CO3 → BaO → BaSO 4
43) Cu → CuS04 → (CuOH) 2S04 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bárium → bárium-hidroxid → bárium-hidrogén-karbonát → bárium-klorid → bárium-karbonát → bárium-klorid → bárium-hidroxid
45) P → P205 → H3P04 → Ca (H2P04) 2 → CaHPO 4 → Ca3 (PO 4) 2
46) Cr → CrO → Cr 2O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr203 → CrCl3 → Cr (OH) 3 → Na 3 → Cr2 (SO 4) 3 → CrCl3
48) K → KOH → KCI → KOH → K 2SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2S → SO 2 → S → ZnS → ZnO → ZnCl2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl2
51) С → CO 2 → NaHCO 3 → Na 2CO 3 → CO 2
52) S → SO 2 → K 2SO 3 → KHSO 3 → K 2SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → Н 3 РО 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → 3. (РО 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2SO 4 → CuS04 → CuO → Cu (NO 3) 2
59) KHS03 → CaS03 → Ca (HSO 3) 2 → SO 2 → K 2SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHS03 → SO 2
61) NaHC03 → Na2C03 → NaCI → NaHS04 → Na2S04
62) K → KOH → KCI → KNO 3 → K 2SO 4 → KCl
63) NaCI → Na → NaOH → Na2S04 → NaCl
64) Al → AlCI3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe203 → FeCl3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCI2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgS04 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl2 → Ca (NO 3) 2 → O 2
74) FeS → Fe203 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl3
75) KS1 → K2S04 → KOH → K 2CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2S → SO 2 → Na 2SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2O 3 → Al (OH) 3
81) CaCl2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCI → HCl → CaCl2 → Ca (NO 3) 2
84) Na 2SO 3 → SO 2 → H2S04 → HCl → FeCl2
85) С → Na2C03 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2O 5 → Ca (H 2PO 4) 2 → CaHPO 4 → H3P04
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl 2 → HCl → H 2
89) P 2O 5 → Na 2 HPO 4 → Na3P04 → Ca3 (PO 4) 2 → CaSO 4
90) NH3 ^ NH4C1NH3H2O → NH4HCO3 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2 HPO 4 → NH3 → NH4N03
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2SO 4 → KNO 3 → KHS04
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe203 → FeCI3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe203
100) Al → A1 2O 3 → A1 (NO 3) 3 → A1 2O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl2
103) H 2S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl2 → FeCI3 → Fe203 → Fe (OH) 3 → Fe (NO 3) 3
106) P205 → Ca3 (PO4) 2 → H3P04 → CaHPO 4 → Ca (H 2PP 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H3PO4 → NH4H2P04 → (NH4) 2HP04 → Na3P04 → Ca3 (PO 4) 2
110) CaCO 3 → Na2C03 → Na3P04 → NaH2P04 → Ca3 (PO 4) 2
111) CaCl2 → CaSO 3 → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2
112) NaOH → Na2C03 → NaHS04 → NaNO3 → NaHS04
113) Na2Si03 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO3 → KHS04 → K2S04 → KCI → Na 2SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3PO 4 → Ca3 (PO 4) 2 → CaHPO 4 → Ca (H 2PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2SO 4 → KHS04 → BaSO 4
122) N 2O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl2
125) NH3H2O → NH4Ci ^ NH3 → NH4HCO3 → (NH4) 2CO3
126) Cu (OH) 2 → H20 → HNO3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH3 + H2O → NH4HCO3 → CaCO 3 → CaSiO 3 → CaCl2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCI3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na2ZnO2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na2 → Na2ZnO2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2O 3 → KA2 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K3 → Al (NO 3) 3 → NaAlO2 → Al 2 O 3
140) Legyen → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
KÍSÉRLETI TAPASZTALATOK A TÉMÁBAN „AZ INORGANIKUS ÖSSZETEVŐK ALAPJÁRÁSAI”
TAPASZTALAT 1.Semlegesítési reakciók.
a) Egy erős sav és egy erős bázis kölcsönhatása.
Öntsünk 5 ml 2 N sósavoldatot egy porcelán edénybe, és cseppenként adjunk hozzá 2 n nátrium-hidroxid-oldatot. Keverjük össze az oldatot egy üvegrúddal, és teszteljük annak hatását a lakmusra, és egy csepp oldatot helyezzünk a lakmus tesztre. Semleges reakciót kell elérni (a kék és piros lakmuspapír nem változik a színben). A kapott oldatot szárazra pároljuk. Mi alakult ki? Írjon molekuláris és ionos reakcióegyenleteket.
b) A gyenge sav és az erős bázis kölcsönhatása.
Öntsünk egy kémcsőbe 2 ml 2 N lúgos oldatot és adjunk hozzá ecetsav-oldatot, amíg az oldat semleges. Írjon molekuláris és ionos reakcióegyenleteket. Magyarázza el, hogy miért veszi át az egyensúlyi ionreakciót, amelyben egy gyenge elektrolit (ecetsav) vesz részt a vízmolekulák kialakulása felé.
TAPASZTALAT 2. Amfoter hidroxidok.
A laboratóriumban rendelkezésre álló reagensektől kapjuk a cink-hidroxid csapadékát. A kapott csapadékot rázzuk össze, és kis mennyiségben öntsük 2 csőbe. A csövek egyikében hozzáadunk sósavoldatot, a másikban nátrium-hidroxid-oldatot (feleslegben). Mi a megfigyelés? Írja fel a megfelelő reakciók egyenleteit molekuláris és ionos formában.
TAPASZTALAT 3.A sók kémiai tulajdonságai.
a) A sóoldatok kölcsönhatása a kevéssé oldódó anyag képződésével.
Öntsünk 2 ml nátrium-karbonát oldatot a csőbe, és adjunk hozzá bárium-klorid oldatot, amíg fehér csapadék nem jelenik meg. Írja fel a kémiai reakcióegyenletet ionos és molekuláris formában. A csapadékot két részre osztjuk. Öntsön kénsavoldatot az egyik csőbe, és a nátrium-hidroxidot a másikba. Végezzen következtetést a csapadék savakban és lúgokban való oldhatóságáról.
b) A sóoldat savakkal való kölcsönhatása illékony vegyület előállítására.
Öntsünk 2 ml nátrium-karbonát oldatot a csőbe, és adjunk hozzá kis mennyiségű sósavoldatot. Mi a megfigyelés? Írja be a kémiai reakcióegyenleteket ionos és molekuláris formában.
c) A sóoldatok alkáliákkal való kölcsönhatása illékony vegyület képződésével.
Öntsünk egy kevés ammóniumsó-oldatot a csőbe, adjunk hozzá 1-2 ml nátrium-hidroxid-oldatot, és forraljuk fel. A reakciókeverékkel ellátott kémcsőben nedves, vörös lakmus tesztet készítünk. Mi a megfigyelés? Adjon magyarázatot. Írja be a reakcióegyenleteket.
g ) A sók aktívabb fémekkel való kölcsönhatása, mint a só részét képező fém.
Tisztítsa meg a vas (acél) szöget finom csiszolópapírral. Ezután réz-szulfát-oldatba merítse. Néhány idő elteltével figyelje meg a rézfelszínt a köröm felületén. Írja fel a megfelelő reakcióegyenletet ionos és molekuláris formában.
TAPASZTALAT 4.Bázikus és savas sók.
a) ólom-hidroxi-karbonát előállítása.
Adjunk hozzá egy kevés ólom (II) -oxidot az ólom (II) -acetát oldathoz, és néhány percig forraljuk fel az elegyet. A lehűtött oldatot elvezetjük a csapadékból, és szén-dioxid-áramot vezetünk át rajta. Mi a megfigyelés? Szűrjük meg a csapadékot és szárítsuk meg a szűrőpapír lapjai között. Jelölje meg az ólom-hidroxi-karbonát csapadékának színét és jellegét. Írja be a reakcióegyenleteket. Készítsen grafikus képletet a kapott sóból.
b) Magnézium-hidrogén-karbonát előállítása.
Néhány magnéziumsó nagyon hígított oldatához adjunk hozzá egy kevés nátrium-karbonát oldatot. Milyen anyag csapódik ki? Telített oldat szén-dioxiddal. Figyelje meg a csapadék fokozatos feloldódását. Miért történik ez? Írja be a reakcióegyenleteket.
TAPASZTALAT 5.Komplex sók beszerzése.
a) Komplex kationos vegyületek képződése.
Adjunk hozzá cseppenként ammóniaoldatot 2-3 ml réz (II) -klorid-oldattal, amíg réz (II) -hidroxid csapódik ki, majd feleslegben ammóniaoldatot adunk a csapadék feloldásához. Hasonlítsa össze a Cu 2+ ionok színét a kapott oldat színével. Milyen ionok vannak jelen az oldatban? Írja be a reakcióegyenletet egy komplex vegyület előállításához.
b) Komplex anionokkal rendelkező vegyületek képződése.
A higany (II) nitrát 1-2 ml-es oldatához cseppenként hígított kálium-jodid-oldatot adunk a HgI 2 csapadék képződéséhez. Ezután feleslegben kálium-jodid-oldatot öntünk, amíg a csapadék fel nem oldódik. Írja be a komplex só előállításának reakcióit.
TAPASZTALAT 6.Dupla sók (kálium-alumínium) előállítása.
Mérjünk be 7,5 g Al 2 (SO 4) 3 ∙ 18H 2 O-t és oldjunk fel 50 ml vízben, és ehhez elegendően nagy porcelánedényt használjunk. Számítsa ki a reakcióegyenletet és mérje meg a reakcióhoz szükséges kálium-szulfát tömegét. Készítsünk forró, telített kálium-szulfát-oldatot, és öntsük egy porcelán edénybe alumínium-szulfát oldatával keverés közben. Egy idő után figyeljük meg az alumínium kálium-alum-kristályok kicsapódását. Lehűtés és kristályosítás után öntsük le az anyalúgot, szárítsuk meg az alumínium kristályokat a szűrőpapírlapok között, és mérjük meg a kapott kristályokat. Számítsa ki a hozam százalékát.
BEÁLLÍTÁSI FELADATOK
1. Ha 16 g réz (II) -szulfát-oldatból feleslegben hidrogén-szulfidot vezetünk, 1,92 g csapadékot kapunk. Keresse meg a réz-szulfát tömegarányát a használt oldatban és a felhasznált hidrogén-szulfid térfogatát.
2. A réz teljes kicsapására szulfid formájában 291 cm3 réz (II) -szulfát-oldatból, 10 tömeg% -os frakcióval, 17,6 g vas (II) -szulfid és hidrogén-klorid feleslegével reagáltatva kapott gázt alkalmaztunk. Keresse meg az eredeti réz-szulfát oldat sűrűségét.
3. A K 2S oldat és a híg kénsav közötti kölcsönhatás során felszabaduló gáz áthalad egy ólom (II) -nitrát-oldat fölött. A keletkezett csapadék tömege 71,7 g, ha a sűrűség 1,176 g / cm3, és a tömegarány 25%.
4. 8 g réz (II) -szulfátot tartalmazó oldathoz 4,68 g nátrium-szulfidot tartalmazó oldatot adunk. A csapadékot leszűrjük, a szűrletet bepároljuk. A párologtatás után a szűrletben lévő anyagok tömegét meghatározzuk és a réz-szulfid-csapadék tömegét meghatározzuk.
5. A vas (II) -szulfid egy részét a sósav feleslegével kezeljük. A kapott reakcióelegyet 12,5 cm3 NaOH-oldattal 25% -os tömegű frakcióval és 1,28 g / cm3 sűrűséggel reagáltatva savas sót képez. Keresse meg az eredeti vas-szulfid tömegét.
6. A 176 g tömegű vas (II) -szulfidot sósav felesleggel kezeltük, és a keletkező gázt felesleges levegőn égettük. Milyen mennyiségű KOH oldatot tartalmaz 40% -os tömegtömeggel és 1,4 g / cm3 sűrűséggel az égés során keletkező gáz teljes semlegesítéséhez?
7. 100 g technikai pirit pörkölésével gázot kaptunk, amelyet teljesen semlegesítettünk 400 cm3 nátrium-hidroxid-oldattal, 25 tömeg% -os frakcióval és 1,28 g / cm3 sűrűséggel. Határozzuk meg a piritban lévő szennyeződések tömegarányát.
8. 2 g vas, vas (II) és vas (III) -oxid elegyéhez 16 cm3 HC1-oldatot adtunk 20 tömeg% -os frakcióval és 1,09 g / cm3 sűrűséggel. A felesleges sav semlegesítésére 10,8 cm3 nátrium-hidroxid-oldatot vettünk fel, 1,05 g / cm3 10% -os sűrűségű frakcióval. Keresse meg a keverékben lévő anyagok tömegét, ha a felszabaduló hidrogén térfogata 224 cm3 (NU).
9. 10,5 g tömegű Ca (OH) 2, CaCO 3 és BaSO 4 keveréke van, amikor az elegyet feleslegben sósavval kezeltük, 672 cm3 (IU) gázt szabadítottunk fel, és 71,2 g savat reagáltak részesedése 10%. Határozzuk meg a keverékben lévő anyagok tömegét.
10. Bárium-klorid, kalcium-karbonát és nátrium-hidrogén-karbonát keveréke van. Ha ezt a keveréket 10 g vízben oldjuk, az oldhatatlan maradék 3,5 g, 20 g kiindulási keverék kalcinálásakor 5,2 g-mal csökken a masszája.
11. Van egy kén- és salétromsavat tartalmazó oldat. Ahhoz, hogy az oldat 10 g-ját teljesen semlegesítsük, 12,5 cm3 KOH-oldatot fogyasztunk 19% -os tömegtömeggel és 1,18 g / cm3 sűrűséggel. Ha a bárium-klorid feleslegét hozzáadjuk 20 g azonos savoldathoz, 4,66 g csapadék válik ki. Keresse meg a keverékben lévő savak tömegfrakcióit.
12. A 100 g KC1 és KNO3 keverékéből kapott hidrogén-kloridot 71,8 cm3 vízben oldjuk. 100 g ugyanezen só keverék kalcinálásakor 93,6 g szilárd maradék marad. Keresse meg a hidrogén-klorid tömegarányát a vízben.
13. Ha 2 m 3 levegőt (NU) Ca (OH) 2 oldatán keresztül vezetünk, 3 g szénsav só csapadékot kapunk. Keresse meg a levegőben lévő CO 2 térfogatát és tömegarányát.
14. A szén-dioxidot 50 g CaCO3-tartalmú szuszpenzión vezetjük át. A reakció 8,96 dm 3 gáz (NU). Mi a maradék tömege a szilárd fázisban?
15. Amikor a CaO-hoz vizet adunk, annak tömege 30% -kal nőtt. Milyen része volt a CaO-nak (tömegszázalékban)?
16. 18,47 g tömegű ólom (II) -oxidot hidrogénáramban melegítünk. A reakció után a kapott ólom és az el nem reagált oxid tömege 18,07 g. Mi az ólom-oxid tömege, amely nem reagált?
17. A szén-monoxidot meleg (III) -oxidon vezetjük át melegítés közben. A szilárd maradék tömegét a reakció után 2 g-nál kisebb, mint a vas-oxid kezdeti tömegét. Milyen mennyiségű CO volt a reakció (az oxid teljesen csökkent)?
18. 8.96 dm 3 (NU) N 2, CO 2 és SO 2 keveréke van, a hidrogén 25 relatív sűrűségével. A feleslegben lévő KOH oldaton való áthaladás után a keverék térfogata 4-szer csökkent. Keresse meg az eredeti keverék gázmennyiségeit.
19. Két pohárban 100 g HC1 oldatot, 2,5 tömegszázalékos frakciót tartalmaz. Egy üvegben 10 g CaCO3-ot adtunk, a másikban 8,4 g MgCO 3-ot. Hogyan különbözik a szemüveg tömege a reakció után?
20. Milyen mennyiségű (NU) mennyiségű kén-dioxidot kell vezetni 200 cm3-es oldaton 0,1% -os nátrium-hidroxid-oldattal és 1 g / cm3 sűrűséggel, hogy savassót kapjunk?
21. Mekkora a szén-dioxid maximális mennyisége (szén-dioxid), amely 25 cm3 oldatot képes felvenni 25% -os NaOH-frakcióval és 1,1 g / cm3 sűrűséggel?
22. Mekkora az oldat minimális térfogata 20% -os KOH-frakcióval és 1,19 g / cm3 sűrűséggel, amely az összes szén-dioxidot elnyeli, 23,2 g mágneses szén-monoxiddal történő teljes csökkentésével?
23. Mekkora a KOH minimális tömege, amelyet 24,5 g ortofoszforsavval kell reagálni úgy, hogy csak kálium-dihidrogén-foszfát legyen a termék?
24. Mekkora a Ca (OH) 2 minimális tömege 16 g kalcium-hidrogén-karbonát-oldathoz 5% -os só tömegarányú közeghez, hogy közepes sót kapjunk?
25. Milyen mennyiségű kálium-hidrogén-foszfátot kell adni 12,25 g H3P04 tartalmú oldathoz, hogy az oldat csak kálium-dihidrogén-foszfátot tartalmaz?
26. Az oldat 56,1 g kalcium és magnézium-karbonát keveréket tartalmaz szuszpenzióban. Ahhoz, hogy szénhidrogén-karbonátokká alakítsák, az összes szén-dioxidot 7 dm 3 (NU) etán égetésével töltötték. Keresse meg a kalcium-karbonát tömegét a kezdeti keverékben.
27. Ahhoz, hogy 9,5 g nátrium-hidro- és dihidrogén-foszfát keveréket közepes sóvá alakítsunk, 10 cm3 oldatot, 27,7 tömeg% -os nátrium-hidroxid-frakciót és 1,3 g / cm3 sűrűséget kell alkalmazni. Keresse meg a hidrogén-foszfát tömegét a keverékben.
28. Ha 6 g nátrium-hidroxidot tartalmazó oldatban szén-dioxidot vezetünk, 9,5 g sav és közepes só keverékét kapjuk. Keresse meg a felhasznált szén-dioxid mennyiségét.
29. Miután 11,2 dm 3 (NU) CO 2 -ot hagytunk át KOH-oldatban, 57,6 g sav és közepes só keverékét kaptuk. Keresse meg a közepes só tömegét.
30. Milyen mennyiségű ortofoszforsavat kell semlegesíteni, hogy 1,2 g dihidro- és 4,26 g nátrium-hidrogén-foszfátot kapjunk?
31. NaOH-ot adunk a kénsav oldathoz, így 3,6 g hidroszulfátot és 2,84 g nátrium-szulfátot kapunk. Határozzuk meg a reagált sav és lúg kémiai mennyiségét.
32. Miután a hidrogén-kloridot 200 ml 3% -os nátrium-hidroxid-oldattal 10% -os tömegű frakcióval és 1,1 g / cm3 sűrűséggel hígítottuk, a kapott oldatban a NaOH tömegaránya felére csökkent. Határozzuk meg a NaCl tömegarányát a kapott oldatban.
33. 14,4 g réz és oxid (II) elegyének feloldása 48,5 g 80% -os HNO tömegtömegű oldatot fogyasztott. Keresse meg a réz és az oxid tömegfrakcióit a kezdeti keverékben.
34. A 6,2 g nátrium-oxid tömegét 100 cm3 vízben oldjuk, és az 1. oldatot kapjuk, majd 10% -os tömegarányú sósavat adunk az oldathoz addig, amíg a közeg semlegesvé nem válik, és a 2. oldatot kapjuk. :
1) az 1., 2. oldatban lévő anyagok tömegfrakciói;
2) a HC1 oldatának tömege, amely az 1. számú oldat semlegesítésére irányult.
35. 3 g cink kölcsönhatásba lép 18,69 cm3 HC1-oldattal, 14,6 tömeg% -os frakcióval és 1,07 g / cm3 sűrűséggel. Fűtés közben a keletkező gázt 4 g-os forró CuO-n át vezetjük.
36. A kalcium-hidrid felesleges vízzel történő kezelése után felszabaduló gáz, a FeO-t el nem hagyva. Ennek eredményeképpen az oxid tömeg 8 g-tal csökkent, a vízzel kezelt CaH2-tömeg pedig megtalálható.
37. A CaCO 3 minta kalcinálása során a tömeg 35,2% -kal csökkent. A szilárd reakciótermékeket feleslegben oldott sósavoldatban feloldjuk, így 0,122 dm 3 (NU) gázt kapunk. Határozzuk meg az eredeti kalcium-karbonát minta tömegét.
38. A réz-nitrátot lebontottuk, és a kapott réz (II) -oxidot hidrogénnel teljesen csökkentettük. A kapott termékeket egy csőben P205-gyel, majd a cső tömegét 3,6 g-tal megnöveljük. Milyen minimális térfogatú kénsav, amelynek tömegaránya 88%, sűrűsége 1,87 g / cm3 szükséges a kísérlet során kapott oldódáshoz. réz és mi a tömege a bomlott sónak?
39. A nitrogén-monoxid (IV) feleslegben feloldott kálium-hidroxid-oldattal történő felszívódása után oxigén nélkül 40,4 g KNO3-ot kapunk. Milyen anyagot alakítanak ki és mi a tömege?
40. 400 g sósavat és sót tartalmazó oldatot semlegesítünk kénsav, 287 cm3 nátrium-hidroxid-oldatot használtunk 10% -os tömegtömeggel és 1,115 g / cm3 sűrűséggel. Ha a kiindulási oldat 100 g-jához feleslegben bárium-klorid-oldatot adunk, 5,825 g csapadék válik ki. Határozzuk meg a savak tömegfrakcióit a kezdeti oldatban.
41. Miután a szén-dioxidot nátrium-hidroxid-oldattal átitattuk, 13,7 g közeg és savas sók keverékét kaptuk. Annak érdekében, hogy nátrium-kloridokká alakítsuk, 75 g sósavat, 10 tömeg% -os HCl-frakciót kell alkalmazni. Keresse meg az elnyelt szén-dioxid mennyiségét.
42. A sósav és kénsavak keverékét, amelynek össztömege 600 g azonos savtömegű frakciókat tartalmaz, nátrium-hidrogén-karbonát feleslegével és 32,1 dm3 3-as gázzal kezeltünk. Keresse meg a savak tömegarányát a kezdeti keverékben.
43. Az 1 dm3 nátrium-hidroxid-oldat semlegesítéséhez 66,66 cm3 HNO3-oldatot használtunk 63% -os tömegtömeggel és 1,5 g / cm3 sűrűséggel. Milyen mennyiségű kénsavoldatot kell alkalmazni, amelynek tömege 24,5% és sűrűsége 1,2 g / cm3 lenne ugyanolyan mennyiségű lúg semlegesítéséhez?
44. Milyen térfogatarányban kell 5% -os sűrűségű és 1,03 g / cm3 sűrűségű kénsavoldatot és 5% -os tömegarányú és 1,1 g / cm3 sűrűségű bárium-hidroxid-oldatot készíteni a teljes semlegesítéshez? Képzelje el a választ, mint a savoldat alkáli oldat térfogatának hányadosa.
45. Számítsuk ki a 0,9 g / cm3 sűrűségű és 25% -os tömegszázalékú ammóniaoldat minimális térfogatát, ami a 0,5 mg természetes mészkő 92% -os tömeges frakciójával történő lebontásával nyert szén-dioxid teljes felszívódásához szükséges.
46. A 2,92 g nátrium-hidroxid és nátrium-karbonát elegyének kloriddá történő teljes átalakításához 1,344 dm 3 hidrogén-klorid (NU) szükséges. Keresse meg a nátrium-karbonát tömegét a keverékben.
47. A 16% -os tömegarányú 25 g réz (II) -szulfát-oldathoz 16% -os tömegarányú nátrium-hidroxid-oldatot adunk. A képződött csapadékot leszűrjük, majd a szűrletet lúgos. A szűrlet teljes semlegesítéséhez 25 cm3 kénsavoldatot vettünk, amelynek moláris koncentrációja 0,1 mol / dm3. Számítsa ki a hozzáadott nátrium-hidroxid oldat tömegét.
48. A CuO teljes redukciójával kapott anyagot 15,8 g 11,2 dm 3 (NU) térfogatú hidrogénnel tömény kénsavban való melegítéssel feloldjuk. Milyen a gáz (NU) térfogata a reakció eredményeként?
49. Az 50 cm3 sósav 20% -os sűrűségű és 1,10 g / cm3 sűrűségű teljes sójának teljes semlegesítésére a 20 tömeg% KOH tömegarányú kálium-hidroxid-oldatot használtuk. Milyen a kémiai mennyisége a kapott oldatban?
50. A szén-dioxid feleslegének 0,84 g forró szénen történő áthaladásával nyert gázt 14,0 g melegített réz (II) -oxiddal reagáltatjuk. Milyen mennyiségű salétromsav oldata 63% -os tömegtömeggel és 1,4 g / cm3 sűrűséggel van szükség az utolsó reakcióban kapott anyag teljes feloldásához?
51. A réz (II) -nitrát állandó tömegére kalcinálva a só tömege 6,5 g-kal csökkent, a só súlya lebomlott?
52. Ha feleslegben hidrogén-kloridot alkalmaztunk, 6,72 dm 3 (NW) gázt szabadítottunk fel alumínium és egy ismeretlen monovalens fém keverékével, és a keverék tömegét felére csökkentettük. A maradékot híg salétromsavval kezelve 0,333 dm 3 (NU) NO-ot szabadítottunk fel. Az ismeretlen fém azonosítása.
53. A kréta minta tömege 105 g, és az oxigénelem kémiai mennyisége 1 mol. Határozzuk meg a CaCO 3 tömegtömegét a kréta mintában (az oxigént csak a kalcium-karbonát összetételében tartalmazza).
54. A (VI) kén-oxid vízzel való kölcsönhatásakor 25% -os kénsav tömegarányú oldatot kapunk. Ha ehhez az oldathoz feleslegben Ba (OH) 2-t adtunk, 29,13 g tömegű csapadékot kaptunk. Milyen S03 és H20 tömegeket alkalmaztunk savoldat kialakítására?
55. Ha 16% -os nátrium-hidroxid tömegarányú SO2-ot 200 g-os oldatba vittünk, sók keverékét állítottuk elő, amely 41,6 g savsót tartalmaz. Milyen tömeget tartalmaz a kéntartalmú 4,5 tömeg% szennyező anyag? Mi a közepes só súlya?
56. A 80 g Ca (NO 3) 2-oldattal való kölcsönhatás 50 g Na 2CO 3-oldatot vett fel. A csapadékot elkülönítettük, miközben a feleslegben lévő sósavval kezeltük, 2,24 dm 3 (NU) gázot szabadítottunk fel. Melyek a sók tömeges frakciói a kezdeti oldatban? Mi a nátrium-nitrát tömegaránya az oldatban a csapadék elválasztása után?
57. Ha cinket kölcsönhatásba lép a kénsavval, akkor 10 dm3 (NU) SO2 és H 2S keveréke argon relatív sűrűséggel 1,51. Mi a feloldott cink kémiai mennyisége? Mi a SO 2 tömegaránya a gázkeverékben?
58. Cink és alumínium fűrészpor keverékének 11 g össztömeget tartalmazó mintáját feleslegben oldottuk fel. Határozzuk meg a kibocsátott gáz térfogatát (NU), ha a cink tömege a keverékben 30%.
59. 4,0 g tömegű nátrium-hidroxidot 9,8 g tömegű alumínium-hidroxiddal ötvözünk, majd kiszámítjuk a kapott nátrium-metaaluminát tömegét.
60. Amikor 10 g réz és alumínium keverékét tömény salétromsavval dolgozzuk fel szobahőmérsékleten kiadott 2,44 dm 3 gáz (NU). Milyen térfogat (NU) szabadul fel, amikor a keverék ugyanolyan tömegét feldolgozzuk fel felesleges KOH oldattal?
61. A 20 g-os réz és alumínium ötvözetét lúgos felesleggel kezeljük, az oldhatatlan maradékot tömény salétromsavban oldjuk. A kapott sót izoláljuk, állandó tömegre kalcináljuk, és 8 g szilárd maradékot kapunk. Határozzuk meg a felhasznált NaOH-oldat térfogatát 40% -os tömegtömeggel és 1,4 g / cm3 sűrűséggel.
62. A 39 g tömegű alumínium és fém (II) (nem-amfoter-oxid) keverékét feleslegben oldott KOH oldattal kezeljük, a kibocsátott gázt 27 g víz előállítására égettük. Az oldatlan maradékot teljesen feloldjuk 25,2 cm3 oldatban, amelynek HCl-frakciója 36,5%, sűrűsége 1,19 g / cm3. Határozzuk meg az oxidot.
63. A cink és réz chipek keverékét feleslegben oldott KOH oldattal kezeltük, míg a 2,44 dm 3 (NU) gázt szabadítottuk fel. Ugyanazon fém minta teljes klórozásához a klórt 8,96 dm 3 (NU) térfogatra volt szükség. Számítsa ki a mintában lévő cink tömegarányát.
64. 49 g tömegű vas, alumínium és magnézium fűrészpor keverékét feleslegben hígított H2S04-tal kezeltük, így 1,95 mól gázt kaptunk. Ugyanez a keverék egy másik része, amely 4,9 g súlyú volt, feleslegben lúgos oldattal kezeltük, 1,68 dm 3 (NU) gázt kaptunk. Keresse meg a fémek tömegét a keverékben.
65. Mi a 10 g NaOH-ot és 13,6 g ZnCl2-t tartalmazó oldatok egyesítésekor keletkező üledék tömege?
66. Az Al, Mg, Fe, Zn keverékének két része van, ugyanaz a moláris összetételben, mindegyik 7,4 g súlyú, egy adagot sósavban oldunk, és 3,584 dm 3 gázt (NU) kapunk, a másik az alkáli oldatban és Kapott 2,016 dm 3 gáz (NU). Ismert, hogy mindkét keverékben 3 Zn atom van A1 atomonként. Keresse meg a fémek tömegét a keverékben.
67. 1 g réz, magnézium és alumínium keverékét feleslegben sósavval kezeljük. Az oldatot szűrjük, a szűrlethez feleslegben nátrium-hidroxid-oldatot adunk. A csapadékot elválasztjuk és 0,2 g állandó tömegre kalcináljuk, a sósavval végzett kezelés után fel nem oldott maradékot levegőben kalcináljuk és 0,8 g fekete anyagot kapunk. Keresse meg az alumínium tömegarányát a keverékben.
68. Cink, magnézium és réz oxigén ötvözetének melegítésében a keverék tömege 9,6 g-tal nőtt, a terméket részlegesen lúgban oldjuk, és a feloldáshoz 40 cm3 KOH-os 40 tömeg% KOH-s sűrűségű oldatot kell alkalmazni. 3. Az ötvözet azonos részével való reakcióhoz 0,7 mol HC1 szükséges. Keresse meg a fémek kémiai mennyiségét az ötvözetben.
69. 5 g réz és cink ötvözetét feleslegben nátrium-hidroxid-oldattal kezeljük. Ezután a szilárd maradékot elválasztjuk, és tömény HN03-tal kezeljük, az így kapott sót izoláljuk, állandó tömegre kalcináljuk, és 2,5 g szilárd maradékot kapunk. Határozzuk meg a fémek tömegét az ötvözetben.
70. 12,8 g réz és alumínium ötvözetét sósav feleslegével kezeljük. Az oldatlan maradékot tömény salétromsavban oldjuk, a kapott oldatot bepároljuk, a száraz maradékot állandó tömegre kalcináljuk, és 4 g szilárd anyagot kapunk. Határozzuk meg a réz tömegarányát az ötvözetben.
71. Milyen tömegarányban kell két adag A1-et venni úgy, hogy amikor az alkáli oldathoz hozzáadjuk, és a másik egyenlő mennyiségű hidrogént adunk a sósavba?
72. Alumínium és réz (II) -oxid keverék feldolgozásával feleslegben lévő KOH-oldattal 6,72 dm 3 (NU) gázt szabadítunk fel, és az elegy azonos részének szobahőmérsékleten történő koncentrált oldásával 75,2 g sót kapunk. Keresse meg a kezdeti anyagok keverékének tömegét.
73. Milyen mennyiségű réz (II) -oxidot lehet helyreállítani hidrogénnel, melyet egy alumínium feleslegének 139,87 cm3 40% -os nátrium-hidroxiddal és 1,43 g / cm3 sűrűségű reagáltatásával állítunk elő?
74. 7,83 g két fém ötvözetének teljes oxidációjával 14,23 g oxidot képződtek, melynek során az alkáli feleslegben fel nem oldódott 4,03 g üledék maradt. Határozzuk meg az ötvözet fémek minőségi összetételét, ha kationjaik oxidációs állapota +2 és +3, és az oxidok mólaránya 1: 1 (feltételezzük, hogy az oxidációs állapotú fémoxid amfoter tulajdonságokkal rendelkezik).
75. Két, azonos tömegű alumíniumot feloldunk: egy kálium-hidroxid oldatban, a másik sósavban. Hogyan viszonyulnak egymáshoz az evolúciós gázok mennyisége (nos)?
76. Az 1000 g-os alumíniummal rendelkező rézötvözetet feleslegben lúgos oldattal kezeljük, az oldatlan csapadékot salétromsavban oldjuk, majd az oldatot bepároljuk, a maradékot állandó tömegre kalcináljuk. Az új maradék tömege 0,388 g. Milyen tömegű fém van az ötvözetben?
77. A 20 g tömegű cink- és rézötvözetet 30% -os tömegarányú és 1,33 g / cm3 sűrűségű nátrium-hidroxid-oldattal kezeljük. A szilárd maradékot elkülönítettük, és tömény HNO3-oldattal kezeljük. Az eljárás során képződött sót izoláltuk és állandó tömegre kalcináltuk. A szilárd maradék tömege 10,016 g, kiszámítjuk az ötvözetben lévő fémek tömegfrakcióit és az elfogyasztott alkáli oldat térfogatát.
78. A 2 g réz és alumínium ötvözetét feleslegben lúgos oldattal kezeljük. A maradékot leszűrjük, mossuk, feloldjuk HN03-ban, az oldatot bepároljuk és állandó tömegre kalcináljuk. A kalcinálás után a maradékanyag tömege 0,736 g, majd kiszámítjuk az ötvözetben lévő fémek tömegfrakcióit.
79. A vas, réz és alumínium elegyének klórozása 8,96 dm3 klórt (NU) igényel, és ugyanazon minta kölcsönhatása hidrogén-kloriddal 5,6 dm 3 (NU). Ha ugyanazzal a tömegű fémek alkáli keverékével kölcsönhatásba lép, 1,68 dm 3 (NU) gáz szabadul fel. Keresse meg a keverékben lévő fémek kémiai mennyiségeit.
80. 5,0 g tömegű kálium-hidridet 80 cm3 térfogatú vízben oldunk, és a kapott oldathoz 0,81 g tömegű alumíniumot adunk, és az így kapott oldatban lévő anyagok tömegfrakcióit ezer százalékos pontossággal határozzuk meg.
A LITERATÚRA LISTÁJA
1. Barannik, V.P. A szervetlen vegyületek modern orosz nomenklatúrája / V.P. Barannik // Az All-Union Kémiai Társaság naplója. DI Mengyelejev. - 1983. - XXVIII. - 9–16.
2. Wroblewski, A.I. Kémiai szimulátor / A.I. Wroblewski. - 2. kiadás, Pererab. és adjunk hozzá. - Minsk: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Feladatok és gyakorlatok az általános kémia területén: tanulmányok. kézikönyv az egyetemeknek / szerk. VA Rabinovich és H.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Általános és szervetlen kémiai feladatok: tanulmányok. a magasabb szintű diákok számára. Proc. intézmények / R.A. Lidin, V.A. Milk, L.L. Andrejev; by ed. RA Metiloxazolidin. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. A szervetlen anyagok nómenklatúrájának alapjai / R.А. Lidin [et al.]; by ed. BD Stepin. - M .: Chemistry, 1983 - 112 p.
6. Stepin, B.D. Az IUPAC szabályok alkalmazása a szervetlen vegyületek nómenklatúrájára az orosz / B.D. Stepin, R.A. Lidin // Az All-Union Kémiai Társaság naplója. DI Mengyelejev. - 1983. - XXVIII. - 17–20.
| Bevezetés …………………………………………………………………… A szervetlen anyagok körére vonatkozó általános szabályok ………… .. Oxidok ………………………………… ……………………………… Bázikus oxidok ………………………………………………………… ... Sav-oxidok ………………………………… ............................ Amfoter-oxidok ……………………………………………………… .. Oxidok beszerzése …………………………………………………………. Az „oxidok” témája …………………………………………………… Savak ……………………………………………………………………. Gyakorlatok önálló munkára a „Savak” témában ………………………………………………………… Alapok …………………………………………………… ……… .. Az alapítványok önálló munkájához kapcsolódó gyakorlatok ………………………………………………………. Sók …………………………………………………………………………. Gyakorlatok önálló munkára a "Sók" témában .......................................................... Szervetlen vegyületek osztályai közötti genetikai kapcsolat ......................................... …………… .. Gyakorlatok önálló munkára a „Szervetlen vegyületek osztályai közötti genetikai kapcsolat” témában ……………………………………………… Kísérleti kísérletek a „Szervetlen vegyületek főbb osztályai…” témakörben ……… .. Elszámolási feladatok …………………………………………………………… Referenciák ................... |
oktatás: a "genetikai sorozat", "genetikai kapcsolat" fogalmának meghatározása; megtanulják, hogyan készítsünk genetikai sorozatú elemeket (fémek és nemfémek) a genetikai sorozatnak megfelelő reakcióegyenletek elkészítéséhez; ellenőrizze, hogyan ismerik az oxidok, savak, sók, bázisok kémiai tulajdonságait;
fejlődnek: fejleszti a kémiai reakciók egyenleteit az elemzés, összehasonlítás, összegzés és következtetések levonására;
nevelési : elősegíti a tudományos világkép kialakulását.
2. Osztályok biztosítása: a „Periódusos rendszer”, „Oldhatósági táblázat”, „Fémaktivitási sorozat” táblázatok, a diákoknak szóló utasítások, a tudás tesztelésének feladatai.
3. Teljesítési sorrend:
3.1. Elülső felmérés.
3.2. A feladatok megoldása.
3.3. Végezze el az opciók hitelesítési munkáját.
4. Jelentés elrendezése:
4.1. Írja be a gyakorlati lecke témáját és céljait.
4.2. Problémamegoldás.
4.3. Oldja meg az önálló munka saját verzióját, a jegyzetfüzetbe való íráshoz és a tanárhoz történő átadáshoz szükséges döntést.
A munka előrehaladása
1. Frontális beszélgetés:
Mi a genetikai kapcsolat?
Genetikai kapcsolatok - ezek a különböző osztályok közötti kapcsolatok egymásra épülése alapján.
Mi az a genetikai sorozat?
Genetikai sor - anyagok sorozata - különböző osztályok képviselői, amelyek egy kémiai elem vegyületei, amelyek interkonverziókkal kapcsolódnak és tükrözik ezen anyagok átalakulását. E sorozat alapja ugyanaz.
Milyen típusú genetikai sorozatokat rendelnek?
A fémek között kétféle sor van:
a) Olyan genetikai sorozat, amelyben az alkáli bázis. Ez a sorozat a következő átalakítások segítségével jeleníthető meg:
fém → bázikus oxid → lúg → só
például a kálium K → K 2 O → KOH → KCl genetikai sorozata
b) A genetikai sorozat, ahol az alap egy oldhatatlan bázis, akkor a sorozat a transzformációs láncként ábrázolható:
fém → bázis-oxid → só → oldhatatlan bázis → bázis-oxid → fém
például: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
A nemfémek között kétféle sor megkülönböztetése is lehetséges:
a) A nemfémek genetikai sorozata, ahol az oldható sav a hivatkozásként működik. A transzformációs lánc a következőképpen ábrázolható: nem fém → savas oxid → oldható sav → só.
Például: P → P205 → H3P04 → Na3P04
b) Nemfémek genetikai sora, ahol oldhatatlan sav: nem fém → sav-oxid → só → sav → sav-oxid → nem fém, mint a link a sorozatban
Például: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Feladatok végrehajtása a következő lehetőségek közül:
| 1. lehetőség | 2. lehetőség |
|
I opció: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
II. Opció: Na2S04, NaOH, Na, Na 2O 2, Na 2O
Házi feladat: a kalciumról a kalcium-karbonátra való fokozatos átmenetet ábrázolja, és készítsen jelentést bármely gyógyászatban alkalmazott só használatáról (további irodalom).
Utasítások a gyakorlati leckéhez
A szervetlen anyagok főbb osztályai közötti genetikai kapcsolat.
célok: a "genetikai sorozat", "genetikai kapcsolat" fogalmának meghatározása; megtanulják az elemek genetikai sorozatát (fémek és nemfémek) készíteni a genetikai sorozatnak megfelelő reakcióegyenletek elkészítéséhez; ismételje meg az oxidok, savak, sók, bázisok tulajdonságait.
A munka előrehaladása
Írja le a fogalmak meghatározásait:
Genetikai kapcsolat - __________________________________________
Genetikai sor - ___________________________________________
A fémek genetikai sorozata, amelyben a lúg bázisként működik. általánosságban képviselhető: fém → bázikus oxid → lúg → só. Készítse el ezt a sorozatot káliummal. Írja be a reakciók egyenleteit, amelyek segítségével elvégezheti ezt a transzformációs láncot.
A nemfémek genetikai sorozata, ahol az oldható sav egy linkként működik a sorozatban az alábbiak szerint ábrázolható: nem fém → savas oxid → oldható sav → só. Ezt a sorozatot foszfor használatával készítse el. Írja be a reakciók egyenleteit, amelyek segítségével elvégezheti ezt a transzformációs láncot.
Genetikai sor, ahol az alap oldhatatlan bázis ábrázolható a transzformációs lánc: fém → bázikus oxid → só → oldhatatlan bázis → bázikus oxid → fém. Építsd ezt a sorozatot rézzel. Írja be a reakciók egyenleteit, amelyek segítségével elvégezheti ezt a transzformációs láncot.
A nemfémek genetikai sorozata, ahol az oldhatatlan sav a linkben található ábrázolható a transzformációs lánc: nem fém → sav-oxid → só → sav → sav-oxid → nem fém. Építsd ezt a sorozatot szilícium használatával. Írja be a reakciók egyenleteit, amelyek segítségével elvégezheti ezt a transzformációs láncot.
Feladatok végrehajtása a következő lehetőségek közül:
| 1. lehetőség | 2. lehetőség |
|
1. Válaszd ki a változataidban lévő oxid-képleteket, magyarázd el a választásodat, az összetett anyagok összetételének jellemzőinek ismeretében. Hívja őket.
2. A variáns képlet oszlopában keresse meg a savas képleteket, és magyarázza el a választását a vegyületek összetételének elemzése alapján.
3. Határozza meg a savösszetételben lévő savmaradékok értékeit.
4. Válassza ki a sóformákat és adja meg őket.
5. Töltsük fel a magnéziummal és a variánsokkal savakkal képződő sókat. Írja le őket, nevezze el.
6. A variáció képletoszlopában keresse meg az alap képleteket, és magyarázza el a választását a vegyületek összetételének elemzése alapján.
7. Változatában válassza ki azokat az anyagokat, amelyekkel az ortofoszforsav (sósav, kénsav) oldata reagálhat. Készítsük el a megfelelő reakcióegyenleteket.
9. Az opció képletei közül válassza ki azokat az anyagokat, amelyek kölcsönhatásba léphetnek egymással. Készítsük el a megfelelő reakcióegyenleteket.
10. Készítsen láncot a szervetlen vegyületek genetikai kötéseiből, amely tartalmaz egy olyan anyagot, amelynek képlete az első változatban található.
Ezekből az anyagokból genetikai vonalat készítenek az összes képlettel. Írja be azokat a reakcióegyenleteket, amelyekkel elvégezheti ezt a transzformációs láncot:
én opció: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IIopció: Na2S04, NaOH, Na, Na 2O 2, Na 2O
Házi feladat: a kalciumról a kalcium-karbonátra való fokozatos átmenetet ábrázolja, és készítsen jelentést bármely gyógyászatban alkalmazott só használatáról (további irodalom).
