A szilícium szerkezete. Elektronhéjszerkezet
Atomszerkezet Pozíció PS-ben: III. IV. csoport, vezető; Kernel töltés: +14 Si; Relatív atomtömeg: Ar (Si) \u003d 28 Atomszerkezet: p \u003d 14, e \u003d 14, n \u003d \u003d 14 Elektronikus képlet: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
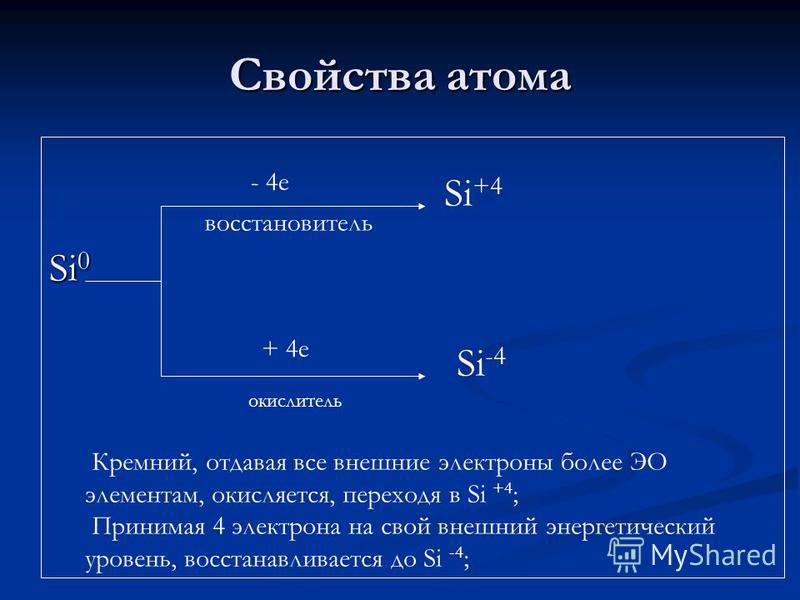
Atomtulajdonságok Si e redukálószer + 4 e oxidálószer Si + 4 Si -4 A szilíciumot, amely minden külső elektronot több EO-elemnek ad, oxidálódik, átjutva Si + 4-be; 4 elektront a külső energia szintjére Si-4-re redukálva;

A szilícium fizikai tulajdonságai nemfémek, kristályos és amorf állapotban léteznek. A kristályos szilícium szürkés acél anyag, fémfényű, nagyon kemény, de törékeny. Amorf szilícium-barna por. p \u003d 2,33 g / cm3; t pl. \u003d C; t kip. \u003d C;

A szilícium kristályszerkezete A szilícium kristályrácsja köbös arc-központú gyémánt típusú. De a Si-Si közötti hosszabb kötéshossz miatt a szilícium keménysége lényegesen kisebb, mint a gyémánt. A szilícium csak törékeny, ha fel van melegítve C felett.

villamos fizikai tulajdonságok Az elemi szilícium az elemi szilícium egy tipikus félvezető. tipikus félvezető. A kristályos szilícium elektrofizikai tulajdonságait nagymértékben befolyásolja a benne lévő nyomok. A p-típusú vezetőképességű szilícium-kristályok előállításához a bór, az alumínium, a gallium és az indium harmadik csoportjának alkotórészei, az adalékanyag elektronikus vezetőképességével, szilícium-dioxidba kerülnek. V elemek foszfor, arzén vagy antimon csoportok.


Flint Flint, ez a Flint, ez a csúnya és nagyon csúnya és nagyon tartós kő, tartós kő, megalapozta a kő korszakának kezdetét - az évszázadot - a szilánkos munkaeszközök századát. korlátos szerszámok Két oka van: - a szilícium prevalenciája és rendelkezésre állása; - a szilícium elterjedtsége és rendelkezésre állása; - az éles vágóélek kialakításának képessége csorbításkor; - az éles vágóélek kialakításának képessége csorbításkor;




Tudja, hogy .. A szilícium tiszta formájának előállítására szolgáló módszert Nikolai Nikolayevich Beketov fejlesztette ki. Oroszországban a szilíciumot gyárakban állítják elő: Kamensk - Uralsky (Sverdlovsk régió), Kamensk - Uralsky (Sverdlovsk régió) Shelekh (Irkutszk régió). Shelekh (Irkutszk régió).

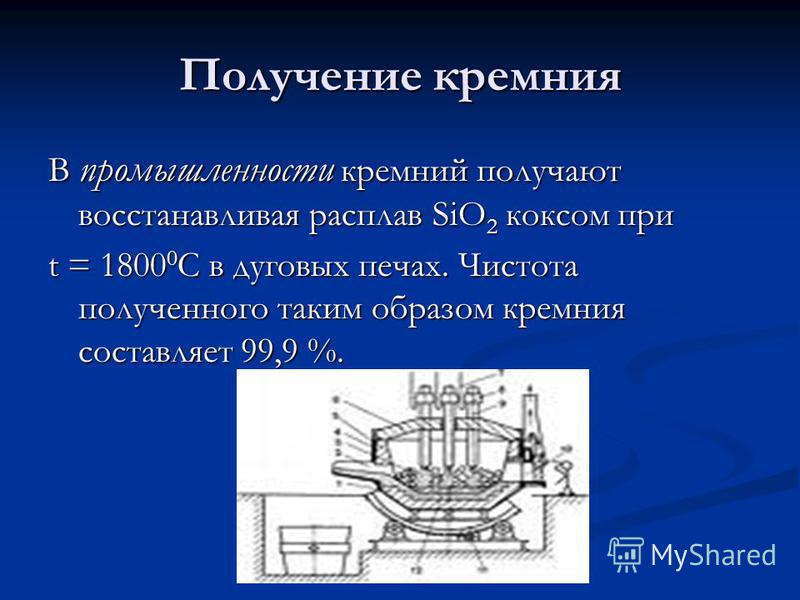
A szilícium előállítása Az iparban a szilíciumot úgy kapjuk meg, hogy a szilícium-dioxid olvadékát ívkályhákban t \u003d C-ben kokszmal csökkentjük. Az így kapott szilícium tisztasága 99,9%.
Szilícium előállítása Laboratóriumi gyártási módszer: SiO Mg 2MO + Si SiO Mg 2MO + Si


A szilícium kémiai tulajdonságai 400 - C-ra melegítve a szilícium reagál oxigénnel szilícium-dioxid képződéséhez: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
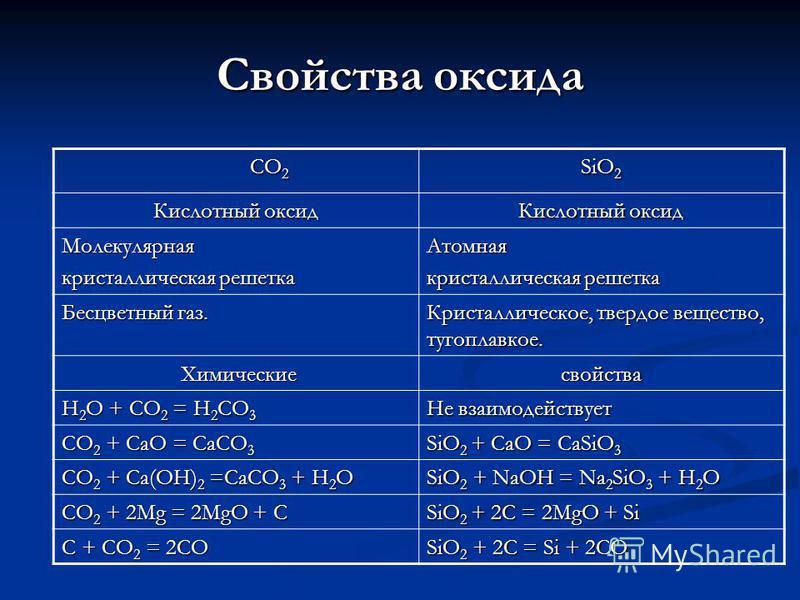
CO 2 CO 2 SiO 2 oxid tulajdonságai Sav-oxid Molekuláris kristályrács Atom Színtelen gáz. Kristályos, szilárd, tűzálló. Kémiai kémiai tulajdonságok H 2 O + CO 2 \u003d H 2CO 3 Nem reagál CO 2 + CaO \u003d CaCO 3 SiO 2 + CaO \u003d CaSiO 3 CO 2 + Ca (OH) 2 \u003d CaCO 3 + H 2 O SiO 2 + NaOH \u003d Na 2 Si02 + H20 CO 2 + 2Mg \u003d 2MO + C Si02 + 2C \u003d 2MO + SiC + CO 2 \u003d 2CO Si02 + 2C \u003d Si + 2CO
A savak savai H 2 CO 3 H 2 SiO 3 Dibas, oxigéntartalmú, gyenge, törékeny denevér. Dibasikus, oxigéntartalmú, gyenge, vízben nem oldódó. Fogadás: CO 2 + H 2 O \u003d H 2 CO 3 Fogadás: SiO 2 + H 2 O \u003d nem instabil, törékeny, lebomlik állva vagy melegítve: H 2 CO 3 \u003d CO 2 + H 2 O Nem választható tiszta formában, mert felmelegítéskor bomlik: H 2 SiO 3 \u003d Si02 + H20 Zn + H 2CO 3 \u003d ZnCO 3 + H 2 Kis gázfejlődés __________

Szénsavas szénsav - karbonátok; - szénhidrogének; - szilikátok; - szilikátok; A karbonátok a sók összes tulajdonságával rendelkeznek, erős elektrolitok, teljesen ionmentesek (vízben oldódnak). Csak az alkálifémsók oldhatók, a többiek oldhatatlanok vagy egyáltalán nem képeznek sókat (Al +3, Cr +3, Ag +).
![]()



Biológiai szerep A legfontosabb szilíciumvegyület, a SiO 2, elengedhetetlen a növényi és állati élethez. Hála neki, nád, nád, hála neki, nád, nád és horsetails szilárdan hasonlítanak a bajonettekhez. és a horsetails szorosan állnak, mint a bajonettek. A Sharp üledék levágása, mint a Sharp üledék levágása, mint a kések, a kaszálás a kaszált mezőkéseken, tarló a kaszált mezőkön, mint a tűk, és a gabonafélék szárai, mint a tűk, és a gabonafélék olyan erősek, hogy nem engedik olyan erősnek, hogy ne hagyja, hogy a mezők kitöltése az esőből és a mezők szélterületeiből esjen az esőből és a szélből


A szilícium egy nyomelem, amely folyamatosan az emberi testben található. Legnagyobb mennyiségét a nyirokcsomók, az aorta kötőszövete, a légcső, a haj és a bőr tartalmazza. Szilíciumra van szükség az epiteliális sejtek építéséhez. A szilícium egy nyomelem, amely folyamatosan az emberi testben található. Legnagyobb mennyiségét a nyirokcsomók, az aorta kötőszövete, a légcső, a haj és a bőr tartalmazza. Szilíciumra van szükség az epiteliális sejtek építéséhez. A szilícium fontos szerepet játszik a csont mineralizáció folyamatában; az artériás fal rugalmasságának fenntartásához szükséges, pozitív hatást gyakorol az immunrendszerre, és lelassítja az öregedési folyamatot az emberi test szövetében. A vér átlagos szilíciumtartalma 8,25 mg / nap. Az életkorban a test szintje csökken, így az időseknél a szilícium iránti igény általában növekszik. Javítsa a szilikon felszívódását a szervezetben a kalcium, magnézium, mangán és kálium jelenlétében. A szilícium fontos szerepet játszik a csont mineralizáció folyamatában; az artériás fal rugalmasságának fenntartásához szükséges, pozitív hatást gyakorol az immunrendszerre, és lelassítja az öregedési folyamatot az emberi test szövetében. A vér átlagos szilíciumtartalma 8,25 mg / nap. Az életkorban a test szintje csökken, így az időseknél a szilícium iránti igény általában növekszik. Javítsa a szilikon felszívódását a szervezetben a kalcium, magnézium, mangán és kálium jelenlétében.

A szilícium biológiai szerepe az alacsonyabb élő szervezetek - diatomák és radiolárok - összetételében is megtalálható, amelyek a legkifinomultabb élőanyagcsomók, amelyek megalapozatlan, szilícium-dioxidból készült szépségcsontjaikat hozzák létre. A szilícium szintén része az alacsonyabb élő szervezeteknek - diatómáknak és radiolársaknak - a legkifinomultabb élőanyagcsomóknak, amelyek a szilícium-csontvázak felülmúlhatatlan szépségét hozzák létre. Diatómák Radiolaria Önellenőrzés 1. Mi a szilícium helye az időszakos rendszerben: a) 2 periódus, 4 og. b) 3 időszak, 3 gr. fejezet. c) 3 időszak, 4 gr. fejezet) 2 periódus, 4 gr. b) 3 időszak, 3 gr. fejezet. c) 3 időszak, 4 gr. fejezet. 2. Szilíciumrács: a) ionos; b) atom; c) molekuláris; a) ionos; b) atom; c) molekuláris; 3. A szilícium prevalenciája szerint ... elem: a) először; b) a második; c) a harmadik; a) az első; b) a második; c) a harmadik; 4. A szilícium reagál a következőkkel: a) fémek, hidrogén, halogének; a) fémek, hidrogén, halogének; b) lúgokban könnyen oldódó fémek, halogének; b) lúgokban könnyen oldódó fémek, halogének; c) oxidok, savak, nemfémek. c) oxidok, savak, nemfémek. 5. Szénsav sók: a) szilicidek; b) hidroszilikátok; c) szilikátok; a) szilicidek; b) hidroszilikátok; c) szilikátok;

Silicon.
szilícium - a DI Mendeleev időszakos rendszerének 3. időszakának IV. atomi szám 14, atomtömeg: 28.0855. A vegyületekben általában +4-es (IV. Valencia) és nagyon ritkán +3, +2 és +1 (valencia, III, II és I) oxidáció. A periodikus táblázatban a Mendeleev szilícium a IVA csoportban található (A-jelzi, hogy ez a fő alcsoport) (a széncsoportban), a harmadik időszakban. félfém . Jelképpel jelölve Si(lat. szilícium). Szabad formában - barna por vagy világos szürke kompakt anyag fémes csillogással. Rácsszerkezet: köbméter, gyémánt.
Fő állapot: + 14 Si 14e 1s 2 2s 2 2p 6 3s 2 3p 2, p-elem.
2. Fizikai tulajdonságok.
A kristályos szilícium sötét szürke, acélfényű anyag. A szilícium szerkezete hasonló a gyémánt szerkezetéhez. Kristályában mindegyik atomot négy másik tetraéder veszi körül, és egy kovalens kötéssel kapcsolódik hozzájuk, ami sokkal gyengébb, mint a gyémánt szénatomjai között. Szilíciumkristályban, még normál körülmények között is, néhány kovalens kötés elpusztul. Ezért szabad elektronokkal rendelkezik, amelyek kis elektromos vezetőképességet okoznak. Amikor a világítás és a fűtés növeli a törött kötések számát, ami azt jelenti, hogy a szabad elektronok száma nő, és az elektromos vezetőképesség nő. Tehát meg kell magyaráznia a szilícium félvezető tulajdonságait.
A szilícium nagyon törékeny, sűrűsége 2,33 g / cm3. A szénhez hasonlóan tűzálló anyagokra is utal.
A szilícium három stabil izotópból áll: 2814Si (92,27%), 2914Si (4,68%) és 3014Si (3,05%).
3. A természetben.
A legtöbb esetben a természetben a szilícium megtalálható az űrlapon kovasav - szilícium-dioxidon (IV) SiO2 alapuló vegyületek (a földkéreg tömegének körülbelül 12% -a). A szilícium-dioxid által alkotott fő ásványok és sziklák a homok (folyó és kvarc), a kvarc és a kvarcit, a kőzetek és a földpát. A természetes szilikátok összetétele és szerkezete összetett. Itt van néhány természetes szilikát összetétele:
ü kagyló K 2 O × Al 2 O 3 × 6SiO 2,
ü asbeszt 3MO × 2SiO 2 × 2H 2 O,
ü csillám K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü kaolinit 3Al 2O 3 × 2SiO 2 × 2H 2 O.
A szilíciumvegyületek második leggyakoribb csoportja a szilikátok és alumínium-szilikátok.
Megjegyezzük, hogy a tiszta szilícium natív formában történő megtalálásakor egyetlen tény áll fenn.
4. A szilícium és vegyületek vegyi tulajdonságai.
tovább kémiai tulajdonságok a szilícium, mint a szén, egy nem fém, de nem fém, kevésbé kifejezett, mivel nagyobb atommagja van. Mivel a szilícium atomok a külső energia szintjén 4 elektronból állnak, a -4 és +4 oxidációs állapota jellemző a szilíciumra (egy szilíciumvegyület ismert, ahol az oxidáció mértéke +2).
A szilícium normál körülmények között meglehetősen inert, ami a kristályrács erősségével magyarázható. Közvetlenül csak az fluor:
savak (kivéve a hidrogén-fluorid és a nitrogén-HNO 3 keverékét)a szilícium nem működik. Ez azonban alkálifém-hidroxidokban oldódik, szilikátot és hidrogént képezve.
A szilícium, a kristályos és az amorf szilícium két allotróp módosításából kémiailag aktívabb az amorf szilícium. Reagál oxigénnel felmelegítve, képezve Si02-t:
és mindenkivel halogénekpéldául:
![]()
Magas hőmérsékleten a szilícium csatlakozik szénnela karborund szilícium-dioxid képződése:
A Carborundum gyémántszerű kristályrácsot tartalmaz, amelyben minden szilíciumatomot négy szénatom vesz körül, és fordítva, és a kovalens kötések nagyon erősek, mint a gyémánt. Ezért keménységben közel van a gyémánthoz. A csiszoló kövek és csiszolókorongok szilícium-karbidból készülnek.
Magnézium-szilicid. Aktív fémekkel való reakciók során, előidézve a szilicid, A szilícium oxidálószerként működik:
Magas hőmérsékleten a szilícium visszanyeri sok fémét az oxidjaikból. (!!!)
Szilán. A szilícium-oxid sósav hatására a szilícium legegyszerűbb hidrogénvegyülete a szilán-SiH 4:
A szilán egy olyan mérgező gáz, amelynek kellemetlen szaga van, öngyullad a levegőben (!!!):
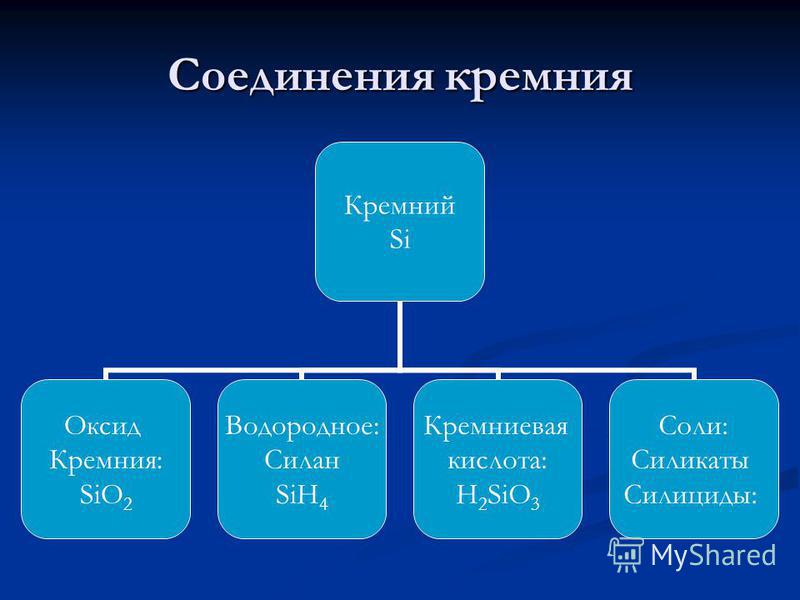
Szilícium-oxid (IV).A (IV) szilícium-oxidot is nevezik kovasav. Ez egy szilárd tűzálló anyag. (olvadáspont 1700 ° C) a természetben széles körben elterjedt két formában:
1) kristályos szilícium-dioxid - kvarc ásványi formája és fajtái (kőzetkristály, chalcedon, agát, jáspisz, korom) formájában; a kvarc az építőiparban széles körben használt kvarc homok alapja szilikát ipar;
2) amorf szilícium-dioxid - az opál ásványi készítmény SiO 2 × formájában n H20; az amorf szilícium földi formái diatóma, tripoli (infúziós föld); A mesterséges amorf vízmentes szilícium-dioxid például szilikagél, amelyet nátrium-metaszilikátból nyerünk:
A szilikagél fejlett felülettel rendelkezik, és így jól felszívja a nedvességet. .
1710 ° -on kvarc olvad. A gyors hűléssel az olvadt tömeg képződik kvarcüveg . Nagyon kis tágulási együtthatója van, így a forró kvarcüveg nem törik meg a vizet gyorsan lehűtve. A laboratóriumi üvegeszközök és tudományos kutatási eszközök kvarcüvegből készülnek.
A (IV) SO2 szilícium-oxid legegyszerűbb képlete a szén-monoxid (IV) CO 2 képletéhez hasonló. Eközben fizikai tulajdonságaik nagyon különbözőek (SiO 2 - szilárd, CO 2 - gáz). Ez a különbség a kristályrácsok szerkezetének köszönhető. C0 2 kristályosodik a molekuláris rácsban, Si02 - az atomban. A síkképben lévő Si02 szerkezete a következőképpen ábrázolható:
A szilárd szén-dioxid szénatomjának koordinációs száma 2, a szilícium a Si02-ban pedig 4. Minden szilícium atom 4 oxigénatom tetraéderében van. Ugyanakkor a szilícium atom a középpontban van, és az oxigénatomok a tetraéder tetején helyezkednek el . A szilícium-dioxid egész darabja kristálynak tekinthető, amelynek képlete (Si02) n. A (IV) szilícium-oxid szerkezete meghatározza a keménységét és a refraktivitását .
A szilícium-oxid (IV) Si02 kémiai tulajdonságai savas oxidokra vonatkoznak. A szilárd lúgokkal, bázikus oxidokkal és karbonátokkal történő összekeverésekor szilíciumsav sókat képeznek:
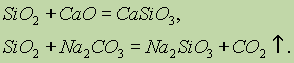
Csak a hidrogén-fluorid (IV) kölcsönhatásba lép a szilícium-oxiddal: \\ t
Ezt a reakciót az üveg ásatására használjuk. .
A (IV) szilícium nem oldódik vízben és nem kémiailag kölcsönhatásba lép vele. (!!!) Ezért a kovasavat közvetett módon kálium- vagy nátrium-szilikát-oldattal savval reagáltatva nyerik:
Ebben az esetben a kovasav (a só és a sav kezdeti oldatának koncentrációjától függően) egy vizet tartalmazó zselatikus tömeg és kolloid oldat (szol) formájában is előállítható.
Szilíciumsav. A SiO 2 számos szilícium-sav anhidridje, amelynek összetétele az alábbi általános képlettel fejezhető ki: xSiO 2 × yH 2 O, ahol x és y - egész:
1) x \u003d 1, y \u003d 1: Si02 2 H20, azaz H 2 SiO 3 - metaszilinsav;
2) x \u003d 1, y \u003d 2: SiO 2 × 2H 2O, azaz H 4 SiO 4 - ortoszilinsav;
3) x \u003d 2, y \u003d 1: 2SiO 2 × H20, azaz H 2Si 2O 5 - bimetakrinsav.
A szilíciumsav tetraéderes szerkezeti egységekből épül fel (minden ilyen egységben a szilíciumatom a tetraéder közepén van, és a tetején oxigénatomok vannak). A láncokban egyesülő szerkezeti kapcsolatok stabilabb poliszilinsavat képeznek:
Az ilyen vegyületek összetétele a (H2 SiO 3) n képlettel fejezhető ki. Általában azonban a szilícium-savat a H2 SiO3 képezi. H 2 SiO 3 - a sav nagyon gyenge, kevés vízben oldódik. Hevítéskor könnyen bomlik, mint a szénsav:
Minden kovasav nagyon gyenge (gyengébb, mint a szén).
Szilikát. Az összes kovasav sóját nevezikszilikátok, bár általában az oktatási irodalomban a szilikátok metacilinsav sókat tartalmaznak. Összetételüket általában a képlet mutatja az elemek oxidjainak formájában. Például a CaSiO3 kalcium-szilikát a következőképpen fejezhető ki: CaO × SiO 2.
Az R2O × nSiO 2 összetételű szilikátok, ahol R2O - nátrium- vagy kálium-oxidok , hívják oldható üveg , és koncentrált vizes oldataik - folyékony üveg . A nátrium-szódás üveg a legfontosabb..
Levegőben állva a szilikátok oldatai zavarossá válnak, mivel a levegőben lévő szén-dioxid (IV) a sóból a szilícium-savat kiszorítja:
A szilíciumsav vízben gyakorlatilag nem oldódik - ezt a tulajdonságot a SiO 3 2- ionhoz való kvalitatív reakcióként használják.
A szilikátokat szilícium-dioxid lúgokkal vagy karbonátokkal történő olvasztásával állítjuk elő:
5. Az ion SiO 3 felfedezése 2. (Nem találok semmit ...)
6. A szilíciumvegyületek szerepe a talajképzésben és az erdészetben.
A vulkanikus kövek összetételükben meglehetősen stabilak, és főként szilícium, alumínium, vas, lúgok, magnézium és kalcium vegyületeket tartalmaznak. A Si0 2-tartalom szerint a vulkanikus kőzet négy csoportra oszlik: savas (\u003e 65%), közepes (52-65%), bázikus (40-52%) és ultraszabályos (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Savas tompa sziklák- gránit, pegmatit, riolit, dacit és mások - általában világos és barnás színűek, kimondottan kvarc, földpát, csillám kristályokkal. Jelentős mennyiségű kálium- és nátriumtartalmú SiO2-tartalom magas (több mint 65%). Ugyanakkor kevés vas és kalcium és magnézium elhanyagolható. A savas vulkanikus sziklák talajai, például a gránitokon, az időjárás kezdeti szakaszában különböznek a forróság, a forrásanyag kavics jellegétől. Amikor nedves körülmények között viharvert, könnyen elvesztik az alkáliföldfémeket, aminek következtében az ilyen viharvert aljzatok (sziklák eluviuma) rendkívül szegény, rosszul termékeny.
Majnás tégelyes sziklák -bazalt, gabbro, stb. általában sötét (fekete) színű. A savas sziklákhoz viszonyítva alacsonyabb SiO 2-tartalommal rendelkezik. A fő vaskos sziklák viszonylag gazdagok a vas, a mangán, a króm, a kobalt, a cink, a titán, a nikkel, a réz összetételében. Az időjárási viszonyaik termékei gyorsan megszerzik agyag karaktert, hosszú ideig lúgos és semleges reakciót tartanak fenn, és a humusz és agyag ásványi anyagok megnövekedett tartalma jellemzik. Az ilyen sziklák talajai termékenyebbek.
A savas és alapfajok mellett gyakran megtalálhatók átmeneti típusú völgyes kövek(közepes) - a diorit csoport támadó sziklái és effúziós társaik - andeziták. Ennek megfelelően ezeken a sziklákon a talaj hasonló tulajdonságokkal rendelkezik, mint a savas vagy bázisos sziklák. Sokkal kevésbé gyakori ultrabazikus fajták:peridotitok és picritek, amelyek a legalacsonyabb SiO 2-tartalommal rendelkeznek.
Metamorf kőzetek -átmenet a masszív kristályos és üledékes kőzetek között. A búvárkodás, a magas nyomás és a hőmérséklet alatt álló ősi üledékes sziklák metamorfáltak, gneisseket, szerpentiniteket, márványt, kvarcitokat, palátákat képeznek. A gneissek különösen hasonlóak a gránitoknál. Az ilyen sziklákon képződő talajok ugyanolyan jellemzőkkel rendelkeznek, mint maguk a savas vulkanikus sziklák talajai.
Klór.
1. Az alumínium helyzete a táblázatban DI Mendeleev. Az atom szerkezete, az oxidáció mértéke.
klór - a VII. csoport fő alcsoportjának egy elemét, a 3. periódust, a 17. számú atomszámmal. Ez a Cl (lat. Chlorum) szimbólummal van jelölve. Kémiailag aktív félfém . A halogéncsoportba tartozik .
Egyszerű anyag klór normál körülmények között - a mérgező gáz sárgás-zöld színű nehezebb, mint a levegő, erős szaggal . Diatóma-klór-molekula (Cl 2 képlet).
Fő állapot: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-elem. Art. -1 +1 +3 +5 +7.
Az elektronhéj szerkezete.
A klóratom valenciaszintjénél van 1 páratlan elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, így egy klóratom 1-es értéke nagyon stabil. A klóratom a klóratom jelenléte miatt a klóratomban más oxidációs fokú lehet. Az atom gerjesztett állapotainak kialakulásának vázlata:
Ismeretesek a klórvegyületek is, amelyekben a klóratom formálisan 4-es és 6-os valenciát mutat, például Cl02 és Cl 2O 6. Ezek a vegyületek azonban radikálisok, azaz egy páratlan elektron.
2. Fizikai tulajdonságok.
Normál körülmények között a klór sárga-zöld gáz, amely elfojtó szaggal rendelkezik. Néhány fizikai tulajdonságát az alábbiakban mutatjuk be.
Sűrűség: 3,214 g / l, likőr - -35 ° C-on - 1,555, TV. -105 ° C-1,9 g / cm3.
Olvadáspont: 172,2 K
Forráspont: 238,6 K
Fúziós hő: 6,41 kJ / mol
A bepárlás hõmérséklete: 20,41 kJ / mol.
A klórgáz viszonylag könnyen folyékony. 0,8 MPa (8 atmoszféra) nyomással kezdve a klór már szobahőmérsékleten folyékony lesz. -34 ° C-ra hűtött hőmérsékleten a klór normál légköri nyomáson is folyékonyvá válik. A folyékony klór egy sárga-zöld folyadék, amely nagyon magas maró hatású (a molekulák nagy koncentrációja miatt). A nyomás növelésével elérheti a folyékony klór jelenlétét +144 ° C hőmérsékleten (kritikus hőmérséklet) 7,6 MPa kritikus nyomáson. Az elektromos vezetőképesség szempontjából a legerősebb szigetelők között folyékony klór kerül sor: az áram közel milliárdszor rosszabb, mint a desztillált víz, és 10 22-szer rosszabb az ezüstnél. A klór hangereje másfélszer kevesebb, mint a levegőben.
3. A természetben.
A természetben két klór 35 izotópja és 37 ° C. A klór a leggyakoribb halogén a földkéregben. . A klór nagyon aktív - közvetlenül kapcsolódik az időszakos rendszer szinte minden eleméhez. Ezért a természetben csak az ásványi anyagok összetételében található vegyületek formájában találhatók:
ü halit-nátrium-klorid,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofit MgCI 2 · 6H 2 O,
ü karnallit KCl · MgCI 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
A legnagyobb klórtartalmat sók, vizek, tengerek és óceánok tartalmazzák (a tengervíz tartalma 19 g / l). A klór a földkéregben lévő atomok számának 0,024% -át teszi ki; clarke szám (a földkéreg, a hidroszféra, a Föld, az űrrészek, a geokémiai vagy kozmokémiai rendszerek kémiai elemeinek átlagos tartalmát kifejező számok, stb. a rendszer teljes tömegére vonatkoztatva.% vagy g / kg.) klór - 0,017%. Az emberi test 0,25 tömeg% klórionokat tartalmaz. Emberekben és állatokban a klórt elsősorban az intercelluláris folyadékokban (beleértve a vért is) találják, és fontos szerepet játszik az ozmotikus folyamatok szabályozásában, valamint az idegsejtek munkájához kapcsolódó folyamatokban.
4. Klór és vegyületeinek kémiai tulajdonságai. A klór megszerzése.
A szilícium atom szerkezete. Si. 14. Izgatott állapot. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e, 4e. 2. 2. 6. 2. 2.
A "Szilícium" bemutató 3. képe kémiai órákra a "szilícium" témábanMéretek: 960 x 720 képpont, formátum: jpg. A kémiaórához ingyenes kép letöltéséhez kattintson a jobb gombbal a képre, majd kattintson a "Kép mentése másként ..." gombra. Ahhoz, hogy a képeket a leckében jelenítse meg, a zip-archívum összes képével ingyenesen letöltheti a „Silicon.ppt” bemutatóját. Archívum mérete - 562 KB.
Letöltés bemutatásaszilícium
"Szilícium és vegyületei" - Az atomok szerkezete és tulajdonságai. Semiconductor. t olvadék (Si) \u003d 1415 ° C, t olvadék (gyémánt) \u003d 3730 ° C. A szilícium megszerzése. A szilícium felfedezése. A növények és állatok összetételében is szerepel. A szilícium fizikai tulajdonságai. Ezért a tégla kerámia, és az ókori görög amphora csempe és töredéke is kerámia. Célkitűzések: A szilícium kémiai tulajdonságai.
"Szilíciumvegyületek" - szilícium és vegyületei. A SiO2 kémiai tulajdonságai. Szilán. A szilíciumsav felvétele. Szilícium tulajdonságai. Szilícium-oxid. Természetes szilikátok. Oxidációs állapot Strasszos. Topaz. A szilícium megszerzése a laboratóriumban. A természetben. Kristályrácsok. A szilícium felfedezése. Ametiszt. A szilícium megszerzése.
"Szilícium-izotópok" - a szilícium-izotópok elkülönítése. Polikristályos szilícium előállítása. A monoizotópos szilícium használatának kilátásai. Izotóp hígítás, amikor egy kvarctégelyből egyetlen kristályt termelnek. Egykristályos magok gyártása. A Raman-sáv legmagasabb pozíciójának az atomtömeg függvénye.
"Szilícium lecke" - Melyik az élő és nem élő természet legfontosabb vegyi elemei? Szén- és szilícium-oxidok. Az anyag átlátszó. A nemfémes és fémes tulajdonságok megnyilvánulásáról. A reflexió összegzése. Végső tesztelés. Szén-oxidok és szilícium-hidroxidok? Az aggregáció állapota: a) folyadék, b) gáz, c) szilárd.
"Szilícium" - A szilícium egyszerű anyag. Fizikai tulajdonságok. Szilícium-oxid (IV). Szilicidek. Jelentése élő szervezeteknek. Fémekkel való kölcsönhatás. Nemfémekkel való kölcsönhatás. Szilícium-karbid. Szilícium a természetben. Silicon. Szilikátipar termékek. A természetes szilíciumvegyületek egyik típusa a szilikátok.
"Szén és szilícium" - szilícium-oxid (IV). A fő alcsoport IV. Csoportjának elemei. Toxicitás. 7. Érdekes a szén. Szilikát. Érintse meg a tapintást. A gyémánt a legnehezebb természetes anyag. Kémiai tulajdonságok A légkörben lévő szén több mint 99% -a szén-dioxid formájában van. Karbidok. 6. Alkalmazás. Az egyik legkönnyebb a szilárd anyagok között.
Összesen 6 előadás van.
