A sio2 fizikai tulajdonságai. Oxigénvegyületek. Szilícium (II) SiO
Szilícium-oxid (II) SiO. A természetben ez nem fordul elő, de a reakcióval elérhető:
SiO 2 + Si → 2 SiO.
Normál nyomáson a szilícium-monoxid szublimációja körülbelül 1200 ° C-on kezdődik (amikor maguk a kiindulási anyagok gyakorlatilag nem párolognak be). Párban a SiO egy egyedi vegyület. Az elemek disszociációs energiája 789 kJ / mol. A szilárd állapotba történő átalakítást csak a gázfázis gyors hűtésével („leállításával”) lehet elérni. Ellenkező esetben az egyenlet által okozott diszmutációnak időbe telik:
2 SiO = Si02 + Si.
A szilícium-monoxidot lassan oxidálja a légköri oxigén, és könnyen oldódik lúgokban, hogy szilícium-sav sókat képezzenek és hidrogént szabadítsanak fel. A súrlódás könnyen villamosít, erős negatív töltést kap.
Szilícium-oxid (IV) Si02.A (IV) szilícium-oxidot szilícium-dioxidnak is nevezik. Ez egy szilárd tűzálló anyag. (olvadáspont: 1700 ° C)a természetben széles körben elterjedt két formában: 1) kristályos szilícium-dioxid - kvarc ásványi formája és fajtái (kőzetkristály, chalcedon, agát, jáspisz, korom) formájában; a kvarc az építőiparban és a szilikátiparban széles körben alkalmazott kvarchomok alapja; 2) amorf szilícium-dioxid - ásványi opál készítmény SiO 2 formájában nH20; az amorf szilícium földi formái diatóma, tripoli (infúziós föld); A mesterséges amorf vízmentes szilícium-dioxid például szilikagél, amelyet nátrium-metaszilikátból nyerünk:
A szilikagél fejlett felülettel rendelkezik, ezért jól felszívja a nedvességet.
1710 ° -on kvarc olvad. Az olvadt tömeg gyors hűlésével kvarcüveg képződik. Nagyon kis tágulási együtthatója van, így a forró kvarcüveg nem törik meg a vizet gyorsan lehűtve. A laboratóriumi üvegeszközök és tudományos kutatási eszközök kvarcüvegből készülnek.
A síkképben lévő Si02 szerkezete a következőképpen ábrázolható:
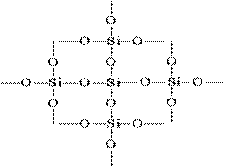
Minden egyes szilíciumatom 4 oxigénatomot tartalmazó tetraéderben van. Ebben az esetben a szilíciumatom a középpontban található, és az oxigénatomok a tetraéder csúcsaiban találhatók. A szilícium-dioxid egész darabja kristálynak tekinthető, amelynek képlete (Si02) n. A (IV) szilícium-oxid ilyen szerkezete meghatározza annak nagy keménységét és refraktivitását.
A szilícium-oxid (IV) Si02 kémiai tulajdonságai savas oxidokra vonatkoznak. A szilárd lúgokkal, bázikus oxidokkal és karbonátokkal történő összekeverésekor szilíciumsav sókat képeznek:
Csak a hidrogén-fluorid kölcsönhatásba lép a (IV) szilícium-oxiddal (üveg-maratás):
Si02 + HF → SiF4 + H20
A szilícium (IV) -oxid nem oldódik vízben, és nem kémiailag kölcsönhatásba lép vele. Ezért a kovasavat közvetve, például hidrolízissel nyerik:
SiS2 + H202H2S + H4Si04 orthosilicon sav.
H4 SiO 4 oldható, melegítve vagy állva, folyamatban van egy polimerizációs eljárás:
2H 4 SiO 4 → H20 + H6Si2O7 diorthokremnievy sav.
2H 6 Si 2O 7 → H20 + H10Si4O13 tetraorotremilinsav.
Zárja a gyűrűt:
H 10Si 4O 13 → H20 + (H2S04) 4 tetrametacilsav.
Ebben az esetben a kovasav (a só és a sav kezdeti oldatának koncentrációjától függően) egy vizet tartalmazó zselatikus tömeg és kolloid oldat (szol) formájában is előállítható. A kapott szilíciumsav összetétele a kiindulási anyagoktól és az előállítás körülményeitől függ. Minden kovasav nagyon gyenge (gyengébb, mint a szén).
Ha a karbonsav oldatban oldja meg a sókat, akkor a fordított reakció a kalcinálás során következik be. Az első a szilíciumsav alacsonyabb szilárdsága (disszociációs foka), a második pedig alacsonyabb volatilitása fűtött.
Melegített poliszilinsavak és fokozatos dehidratálódásuk esetén finom Si02-t kaphatunk, amelyet nevezünk szilikagél . A víz jól felszívódik, azt a készüléket helyezem el, amely megakadályozza a drága elemek oxidációját.
Németország alcsoportja
Ge (+4) Sn (+2, +4) Pb(+2) - rezisztens oxidációs állapotok
A mániumot DI Mendeleev előrejelezte 1871-ben, és 1886-ban fedezték fel. Az ón és az ólom az emberiségnek leginkább ismert elemei közé tartoznak: az egyiptomiak képesek voltak 3000 évnél régebben ömlíteni őket. e. Indiában az ólom körülbelül 2500 év múlva ismerte el az ólmot, és a bádog 1500 évvel a Kr. E. e. Az ókori Kínában gyártott olvasztó ón.
Megközelítés.A germánium természetes vegyületeket GeO 2-re alakítjuk és hidrogénnel redukáljuk.
GeO 2 + H 2 t → Ge + H20 körülbelül 1000 ° C hőmérsékleten
Ón természetes ásványi anyagból készül kassziteritet(SnO 2):
SnO 2 + C → Sn + CO.
Az ipari ólomcsökkentés legegyszerűbb rendszere két egymást követő reakción alapul:
PbS + O2 → SO 2 + PbO galenit(PbS) égetik, majd szénnel redukálják:
PbO + С → СO + Pb.
Alkalmazás.Mindhárom elem nagyon fontos a modern technológia számára. Néhány ón- és ólomvegyület szintén jelentősen hasznos. Az ólom-származékok nagyon mérgezőek.
A Germanium egy tipikus félvezető (n-típusú, 0,75 eV sávszélességű) és különböző alkalmazási területeket talál az elektrotechnikában. A leggyakrabban AC egyenirányítók gyártására használják.. Ez az alkalmazás a tiszta germánium és a germánium ötvözet indiumgal való érintkezéséből eredő unipoláris vezetőképességen alapul. Az áram (elektronáram) gyakorlatilag csak a germániumtól az ötvözetig terjed, de nem fordítva. A germánium egyenirányítót rendkívül magas (kb. 98%) hatásfok jellemzi, és nagyon nagy (megfelelő működési) élettartammal rendelkezik. Az ilyen egyenirányítók fő hátránya a fűtésérzékenységük 70 ° C felett van, hatékonyságuk gyorsan csökken.
Fontos felhasználási terület németország infravörös optika, mivel a 2 mikronos hullámhosszú sugarak gyakorlatilag nem késleltetik. Éppen ellenkezőleg, a fényben és a közelben (0,2-2 mikron) a germánium intenzíven elnyeli az energiát. Ha egy fényes fémfelület (amely jól tárolja a hőt, de nem melegszik fel) germániumfóliával van borítva, akkor a felület sokkal több fűtésre kerül, mint film nélkül. Azt jelentették, hogy a napfény hatására ilyen módon elkészített hordóban forró víz nyerhető.
A konzervdoboz főleg a vaskeményedéshez használatos a rozsdásodás elleni védelem érdekében. (ónlemez a konzervipar számára). Az ilyen ónbevonatok vastagsága nagyon kicsi - mikronos sorrendben. Vékony lemezek formájában (ún. Stannioles) ón kerül felhasználásra az elektromos iparban a kondenzátorok gyártásához . Az ólmot akkumulátorlemezek, elektromos kábelek, golyók és lövések gyártására használják, hogy megvédjék a röntgensugárzást és a sugárzást, valamint a vegyiparban (csővezetékek, stb.). Számos technikailag fontos ötvözet gyártására nagyon nagy mennyiségű ón és ólom kerül felhasználásra.
Ezek közül a legfontosabbak a különböző bronzok (Cu és Sn ötvözetek), csapágyak ötvözetei (babbit, általában Pb vagy Sn alapján, Sb és Cu-t is beleértve), tipográfiai ötvözetek (5-30% Sn, 10-20% Sb, a többi Pb) és a szokásos „puha” forrasztás (30-70% Sn, 70-30% Pb). Gyakran helyettesíthető egy olcsóbb ötvözet, amely 90% Pb, 6% Sn, 4% Sb. Nagy jelentőséggel bírnak a csapágyak ötvözetei, amelyek megközelítőleg 98% Pb, 1% Ca, 1% Na.
A szilícium-dioxid (szilícium-dioxid, szilícium-dioxid) olyan anyag, amely színtelen kristályokból áll, nagy szilárdsággal, keménységgel és refraktivitással. A szilícium-dioxid ellenáll a savaknak és nem hat a vízzel. A reakcióhőmérséklet növekedésével az anyag kölcsönhatásba lép az alkáliákkal, oldódik hidrogén-fluoridban, kiváló dielektromos.
A természetben a szilícium-dioxid széles körben elterjedt: a kristályos szilícium-oxidot olyan ásványi anyagok képviselik, mint a jáspisz, achát (kristályos szilícium-dioxid-vegyületek), kőzetkristály (nagy kristályok), kvarc (szabad szilícium-dioxid), chalcedony, ametiszt, morion, topáz (színes kristályok) szilícium-dioxid).
Normál körülmények között (természetes környezeti hőmérsékleten és nyomáson) három kristályos módosítást végeznek a szilícium-dioxid - tridimit, kvarc és krisztobalit. Amikor a hőmérséklet emelkedik, a szilícium-dioxid először koesitté, majd stishovitává alakul (egy ásvány, amelyet 1962-ben találtak meteorit kráterben). A tanulmányok szerint a föld köpenyének nagy részét a stishovit, a szilícium-dioxid származéka képezi.
Az anyag kémiai képlete - Si02
A szilikagél előállítása
A szilícium-dioxidot ipari kvarc üzemekben állítják elő, amelyek tiszta kvarckoncentrátumot termelnek, amelyet akkor használnak a vegyiparban és az elektronikai iparban, az optika, a gumi és a festék és lakk töltőanyagok, ékszerek gyártása stb. Természetes szilícium-dioxidot, más néven szilícium-dioxidot, széles körben használnak az építőiparban (beton, homok, hang és hőszigetelő anyagok).
A szilícium-dioxid szintetizálása szintetikus módszerrel a savak nátrium-szilikáton, bizonyos esetekben más oldható szilikátokon, vagy a kolloid szilícium-dioxid ionok hatására történő koagulálásával történik. Ezenkívül a szilícium-dioxidot úgy állítják elő, hogy a szilíciumot oxigénnel oxidáljuk körülbelül 500 Celsius-fokos hőmérsékleten.
Szilícium-dioxid alkalmazása
A szilíciumtartalmú anyagokat széles körben használják mind a magas technológiák, mind a mindennapi élet területén. A szilícium-dioxidot üveg, kerámia, betontermékek, csiszolóanyagok, valamint rádiómérnöki, ultrahangos berendezések, öngyújtók stb. Számos összetevővel kombinálva a szilícium-dioxidot használják száloptikai kábelek gyártásához.
A nem porózus amorf szilícium-dioxidot az élelmiszeriparban adalékanyagként is használják, az E551 szám alatt regisztrálva, megakadályozva a fő termék összeomlását és meggyorsítását. dioxid  a szilikon ételeket a gyógyszeriparban gyógyszer-enteroszorbensként használják a fogpaszták gyártásában. Az anyag zsetonokban, kekszekben, kukoricapálcákban, instant kávéban, stb.
a szilikon ételeket a gyógyszeriparban gyógyszer-enteroszorbensként használják a fogpaszták gyártásában. Az anyag zsetonokban, kekszekben, kukoricapálcákban, instant kávéban, stb.
Szilikátveszély
Hivatalosan megerősítették, hogy a szilícium-dioxid anyaga változatlanul halad át a gyomor-bélrendszeren, majd teljesen eltávolodik a testből. A francia szakemberek 15 éves tanulmánya szerint a magas alumínium-oxid-ivóvíz fogyasztása 10% -kal csökkenti az Alzheimer-kór kialakulásának kockázatát.
Így a kémiailag inert anyagot tartalmazó szilícium-dioxid veszélyeiről szóló információ hamis: az orálisan bevitt E551 étrend-kiegészítő teljesen biztonságos az egészségre.
A SiO 2 szilícium-oxid szilárd, nagyon tűzálló anyag (olvadáspont több mint 1700 ° C), széles körben elterjedt a természetben, ahol főként kvarc ásványi anyag, valamint krisztobalit és tridimit formájában található.
A szokásos hőmérsékleten a kvarc stabil változás, növekvő hőmérsékleti polimorf transzformációk figyelhetők meg:
A monomer formájú összes módosítás szilikátja nem létezik; ez mindig polimer és tetraéderből épül fel, ami nagyon erős atomrácsot alkot
Minden szilícium atom a (SiO 2) n kristályokban négy oxigénatommal tetraéderesen körülveszi, amelyek mindegyike áthidalt. Egy közös oxigénatomon keresztül a különböző szögeknél a tetraéder kötődik egymáshoz, és folyamatos háromdimenziós rácsot alkot; a tetraéder kölcsönös elrendezése az űrben meghatározza a szilícium-dioxid egy vagy másik módosítását.
Különböző módosítások esetén a szilícium-dioxid kötési szilárdsága változó. Ez befolyásolja a Si-O-Si szögek nagyságát és a Si-O távolságokat, például a szilícium-dioxid-kötés szöge a szilícium-dioxid különböző módosításaiban 120 és 180 ° között változik. A kvarc-tridimit-krisztobalit átmeneteket a kötések törése és átalakítása kíséri, amelyek csak magas hőmérsékleten fordulhatnak elő.
Kvarc. Gyakran a természetben rendkívül jól képzett kristályok formájában találhatók, néha jelentős méretűek. A kristályokat spirál alakú, spirális alakban elrendezett tetraéderből állítjuk elő. Ugyanabban a kristályban a spirál iránya ellentétes lehet. Az ilyen kristályok optikai izomerek. Forgatják a fény polarizációs síkját, és lehetnek jobb és balkezesek is. Ezek és más kristályok a téma tükrében különböznek a tükörképüktől.
A kvarcot a tudomány és a technológia különböző területein használják, kristályait gyakran mesterségesen termesztik. Bizonyos típusú kvarcok különleges nevek. Az átlátszó, színtelen kristályokat szikla kristálynak nevezik. Vannak színes kvarcfajták is: rózsa-kvarc, ibolya (ametiszt), sötétbarna (füstös topáz), zöld (chrysoprase), stb. A kvarc kristályos módosítása más anyagok keverékével chalcedonnak nevezik. A chalcedony fajtái achát, jáspis stb. A kő kristályos és színes kvarcfajtákat drágakövekként és féldrágakövekként használják.
A tridimit vulkáni kőzetekben fordul elő, de nagyon kis mennyiségben. Ismert tridimit és meteorit eredet.
A természetben lévő Cristobalitot néha a lávaba ágyazott kis kristályok formájában találják, mint a tridimit. A tridimit és a cristobalite szerkezete sokkal lazaabb, mint a kvarc. Így a krisztobalit, a tridimit és a kvarc sűrűsége 2,32; 2,26 és 2,65 g / cm3.
A lassú hűtésű szilícium-dioxid-olvadék könnyen képez amorf kvarcüveget. A szilícium üveg formájában is megtalálható a természetben. Az amorf üveg sűrűsége 2,20 g / cm3 - alacsonyabb, mint az összes kristályos módosítás. A kvarcüveg enyhe hőmérsékleti együtthatóval rendelkezik, ezért laboratóriumi üvegeszközöket állítanak elő, amelyek ellenállnak a hirtelen hőmérséklet-változásoknak.
A vízben lévő szilícium-dioxid minden módosítása gyakorlatilag nem oldódik (25 ° C hőmérsékleten a kvarc oldhatósága 7, krisztobalit - 12, tridimit - 16, kvarcüveg - 83 mg / l). Ezért normál körülmények között csak lúgos oldatok és hidrogén-fluorid hatnak rá:
Si02 + 2KO = K 2 SiO 3 + H 2 O, (1)
Si02 + 4HF = SiF 4 + 2H 2 O. (2)
Az utóbbi reakciót az üveg "maratására" használjuk.
A hozzáadott szilícium-dioxid bázikus oxidokkal, lúgokkal (1. reakció) és karbonáttal reagál, szilikátokat képezve:
Si02 + CaO = СaSiO 3, (3)
Si02 + Na2C03 = Na 2 SiO 3 + CO 2. (4)
A (3) és (4) reakciók különböző szemüvegek, valamint a cement ipari termelését szolgálják. Így a közönséges üveg összetétele (például az ablakok az ételek gyártásához) a Na 2 O CaO képlettel fejezhető ki. 6SiO 2. Ilyen üveg előállítása a szóda, a homok és a mészkő keverékének összeolvasztásával történik. Az eljárást kb. 1400 ° C hőmérsékleten hajtjuk végre a gázok teljes eltávolításáig:
Na 2CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6Si02 + 2CO2.
Különleges minőségű üveg - tűzálló, "törhetetlen" - főzés közben adjon hozzá bárium, ólom, bór oxidokat. A színes üvegek előállításához különböző adalékanyagokat is bevezetnek, például a Co 2 O 3 kobalt-oxid hozzáadása kék színű, Cr 2 O 3 króm-oxid - zöld, mangán-dioxid MnO 2 - rózsaszín.
A Si02-oxid számos szilícium-sav anhidridje, amelynek összetételét az xSiO 2 ∙ yH 2 O általános képlettel fejezhetjük ki, ahol x és y egész számok: 1) x = 1, y = 1: Si02. H 2 Oh, azaz H 2 SiO 3 - meta-szilícium-sav; 1) x = 1, y = 2: Si02. 2H 2O, azaz ortoszilinsav; 1) x = 2, y = 1: 2Si02. H 2 Oh, azaz H 2 Si 2 O 5 - bimeta szilíciumsav.
Azok a savak, amelyek molekulái több Si02-molekulát tartalmaznak, poliszilíciumhoz tartoznak.
A legegyszerűbb szilícium-savak H2 SiO 3, amelyet gyakran egyszerűen szilíciumnak neveznek, sói szilikátok. Szilikátokból csak nátrium- és kálium-szilikátok oldhatók vízben, a maradék szilikátok tűzálló, vízben oldhatatlan anyagok.
Szilikátok oldatai zavarossá válnak, amikor a levegőben állnak, mivel a benne lévő szén-dioxid a sóiból kiszorítja a szilícium-savat (H 2 SiO 3 gyengébb, mint a szénsav; az első lépésben a H2 SiO 3 disszociációs állandója K 1 = 2,2. ).
H 2 SiO 3 vízben gyakorlatilag nem oldódik - ezt a tulajdonságot a szilikátionok kimutatására szolgáló minőségi reakcióként használják:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2CO 3 + H 2 SiO 3 ↓.
A szilikátokat úgy állítjuk elő, hogy a Si02-t lúgokkal vagy karbonátokkal fuzionáljuk.
A nátrium- és kálium-szilikátok koncentrált oldatait folyékony üvegnek nevezik, erősen lúgos reakciójuk van, mivel erősen hidrolizáltak:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Folyékony üvegeket használnak, például ragasztó, vízálló szövetek gyártásához.
A cementet nagyon széles körben használják kötőanyagként, amely vízzel összekeverve keményedik. Általában a cementet nagy forgó kemencékben állítják elő, ahol különböző szilikátokat pörkölnek és őrölnek (-1000 ° C hőmérsékleten).
Számos típusú cement van, azonban feltételesen meg lehet különböztetni kétféle cementet a „koaguláció” elvének megfelelően - a közönséges cement és a portlandcement. A kalcium-szilikátból álló "hagyományos" cement elrendezése a levegőben lévő szén-dioxid miatt kalcium-karbonát képződése miatt következik be:
CaO. Si02 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
A portlandcement beállításakor a szén-dioxid nem vesz részt a folyamatban, és a szilikátok hidrolízise az oldhatatlan kristályos hidrátok képződésével következik be:
Ca 3 SiO 5 + H20 = Ca2Si04 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2O = Ca 2 SiO 4. 4H 2 O ↓.
· Karbidok és szilicidek
· A fémek - karbidok és szilicidek szén- és szilíciumvegyületeit a vizsgált reakciók mellett a szilícium és a fémhidridek közötti kölcsönhatással is elérhetjük, például:
· 2CaH2 + Si = Ca 2 Si + 2H2.
· Mindezek a reakciók magas hőmérsékleten zajlanak. A karbidok közül az úgynevezett "metanidokat" és az "acetilént" bocsátják ki. Az első metánszármazékokat az oxidációs állapotban lévő 4 szénatomot (Be 2C, Al4C3), a második - acetilén-származékként szén-oxidációval rendelkező -1-et (Li 2 C 2, Ag 2 C 2, Cu 2C 2 , CAC 2). Az ezüst és a réz (I) acetilidjei könnyen előállíthatók, ha az acetilént ezüst-oxid vagy réz (I) -klorid ammóniaoldatán keresztül vezetjük. A legtöbb metanid és acetilid aktívan reagál vízzel (különösen savakkal), felszabadítva a megfelelő szénhidrogéneket:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H 2O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C2H2.
· A karbidokkal ellentétben csak az alkáli- vagy alkáliföldfémek szilicidjei kölcsönhatásba lépnek a vízzel és a savakkal, a legegyszerűbb hidrogénvegyület szilícium-monoszilánt képezve, amelyet gyakran egyszerűen szilán-szilán 4-nek neveznek:
· Ca 2 Si + 4HCl = 2CaCl2 + SiH4.
· A szilán egy színtelen gáz, amelynek a szaga a levegőben spontán gyúlékony, Si02-re és vízre égve:
· SiH4 + 2O2 = Si02 + 2H 2 O.
· Az alkáliák nagyon könnyen bontják a szilánt az alábbi képlettel:
· SiH4 + 2KON + H20 = K 2 SiO 3 + 4H 2,
· A víz is hidrolizálja a szilánt, de sokkal lassabban:
· SiH4 + 2H2O = Si02 + 4H2.
· Ha 400 ° C fölé melegítjük a levegőt, a szilán szilícium- és hidrogéngá bomlik (a szilícium előállításának egyik módja):
· SiH 4 = Si + 2H2.
· A monoszilán mellett ismertek a szilil-Si 2H 6, a triszilán Si3H8, a tetrasilán Si4H10 stb. Egyedi állapotban a vegyületeket csak Si 6 H 14-ig terjedő mennyiségben izoláljuk. Mindezek a vegyületek a szilánok homológ sorozatához tartoznak, amelyekhez az Si nH2n + 2 általános képlet felel meg. Az alkánokhoz hasonlóan a szilánok színtelenek, a homológ sorozat első tagjai normál körülmények között gázok, az alábbi folyadékok. A szilánok és a szénhidrogének kémiai aktivitása eltérő: ellentétben a kellően inert alkánokkal, a szilán minden reakcióképes. Ennek oka az alacsonyabb szilícium-affinitás a hidrogénhez képest, és a szilícium nagyon magas affinitása az oxigénhez. Továbbá a Si-Si kötvények kevésbé tartósak, mint a С-С kötvények. A C-H kötéssel ellentétben a Si-H kötés ionosabb.
· A Si-E és a CE kötések energiája.
· A Si-Si kötés alacsony ereje a szilánok homológ sorozatának korlátozottsága.
· A karbidok és a szilicidek között egy speciális helyet foglal el a karborund SiC, amelyet mind a szilícium-karbidnak, mind a szén-szilicidnek nevezhetünk. A Carborundum gyémántszerű szerkezete miatt magas olvadáspontja van; keménysége közel van a gyémánthoz. Kémiailag a SiC nagyon stabil.
· A kolloid oldatok fogalma
A természetben és a technológiában gyakran találhatók diszpergált rendszerek, amelyekben egy anyag egyenletesen oszlik el a részecskék között egy másik anyagban.
A diszpergált rendszerekben van egy diszpergált fázis - egy finoman eloszlatott anyag és egy diszperziós közeg - egy homogén anyag, amelyben a diszpergált fázis eloszlik. A diszperziós rendszerek közé tartoznak a szokásos (igaz) oldatok, kolloid oldatok, valamint szuszpenziók és emulziók. Ezek különböznek egymástól, elsősorban részecskeméretekben, azaz a diszperzió mértékében (fragmentáció).
Az 1 nm-nél kisebb részecskeméretű rendszerek valóban oldódó molekulákból vagy ionokból álló oldatok. Ezeket egyfázisú rendszernek kell tekinteni. A 100 nm-nél nagyobb részecskeméretű rendszerek durva diszpergált rendszerek - szuszpenziók és emulziók.
A szuszpenziók diszpergált rendszerek, amelyekben a diszpergált fázis szilárd, és a diszperziós közeg folyadék, és a szilárd anyag a folyadékban gyakorlatilag nem oldódik.
Az emulziók diszpergált rendszerek, amelyekben mind a diszpergált fázis, mind a diszperziós közeg olyan folyadék, amely nem kölcsönösen elegyedik. Az emulzió egyik példája a tej, amelyben a kis zsírgolyó folyadékban lebeg.
A szuszpenziók és emulziók kétfázisú rendszerek.
A kolloid oldatok diszpergáló közegből és diszpergált fázisból álló, nagy mértékben diszpergált kétfázisú rendszerek, és az utóbbi részecskék lineáris méretei 1 és 100 nm között vannak. Amint látható, a részecskeméretű kolloid oldatok közömbösek az igazi oldatok és szuszpenziók és emulziók között. A kolloid részecskék általában nagyszámú molekulából vagy ionból állnak.
A kolloid oldatokat is szoloknak nevezik. Ezeket diszperziós és kondenzációs módszerekkel állítják elő. A szórást a leggyakrabban speciális „kolloid malmok” segítségével végzik. A kondenzációs eljárásban kolloid részecskék képződnek az atomok vagy molekulák aggregátumokba való egyesítésével. Számos kémiai reakció folyamán kondenzáció lép fel, és erősen diszpergált rendszerek keletkeznek (csapadék, hidrolízis, oxidációs-redukciós reakciók stb.).
1 nm-nanométer (1 nm = 10 -9 m).
A valódi megoldásokkal ellentétben a sinds-t a Tyndall-hatás jellemzi, azaz a fény kolloid részecskékkel való szórását. Amikor egy fénykúp egy fénysugáron keresztül jelenik meg, egy sötétített szobában jelenik meg. 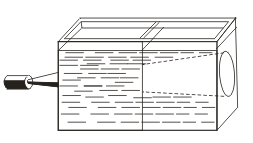 . Tehát felismerheti, hogy ez a megoldás kolloid vagy igaz.
. Tehát felismerheti, hogy ez a megoldás kolloid vagy igaz.
A szolák egyik fontos tulajdonsága, hogy részecskéiknek ugyanaz a jel villamos töltése van. Emiatt nem egyesülnek nagyobb részecskékké és nem csapódnak ki. Ugyanakkor egyes szolák, például fémek, szulfidok, szilícium- és ón-savak részecskék negatív töltéssel rendelkeznek, míg mások, például hidroxidok, fém-oxidok pozitív töltéssel rendelkeznek. A töltés megjelenése az ionok kolloid részecskékből történő adszorpciójával magyarázható.
A szuszpenzió kicsapásához szükséges, hogy részecskéi nagyobb aggregátumokba kerüljenek. A részecskék nagyobb aggregátumokba történő kombinációját koagulációnak nevezik, és a gravitáció hatása alatt történő ülepítésüket üledéknek nevezik.
Általában a véralvadás akkor történik, ha a szolákhoz hozzáadjuk: 1) elektrolit, 2) egy másik sol, amelynek részecskékkel ellentétes töltése van, és 3) melegítéskor.
