Kén. Hidrogén-szulfid és szulfidok
4.doc
240Kén. Hidrogén-szulfid, szulfidok, hidroszulfidok. Kén-oxidok (IV) és (VI). Kénsav és kénsav és sóik. A kénsav észterei. Nátrium-tioszulfát
4.1. kén
A kén az egyik kevés kémiai elem, amelyet az emberek évezredek óta használnak. Széles körben elterjedt a természetben, és mind a szabad állapotban (natív kénben), mind a vegyületekben megtalálható. A kéntartalmú ásványok két csoportra oszthatók - szulfidok (piriták, csillogók, dummies) és szulfátok. A natív ként nagy mennyiségben találják Olaszországban (Szicília-sziget) és az USA-ban. A FÁK-ban a natív kéntartalmú lerakódások a Volga régióban, Közép-Ázsiában, a Krím-félszigeten és más területeken találhatók.
Az első csoport ásványi anyagai közé tartozik a PbS ólom ragyogása, a Cu 2 S réz ragyogása, az Ag 2 S ezüst ragyogása.
A második csoport ásványai közé tartoznak a gipsz CaSO 4H 2O, mirabilit (Glauber só) - Na2S0410H20 és kizerit - MgS04H 2O.
A kén az állatokban és a növényekben található, a fehérje molekulák részeként. Szerves kénvegyületeket találtak a kőolajban.
vétel
1. Ha kén keletkezik természetes vegyületekből, például piritikus kénből, magas hőmérsékletre melegítjük. A kén-pirit bomlik vas (II) -szulfid és kén előállítására:
2. A kén a hidrogén-szulfid oxigénhiányos oxidálásával nyerhető a reakcióval:
2H2S02 = 2S 2H 2O
3. Napjainkban a kén-dioxid szén-dioxid-kibocsátással történő kén-visszanyerése az SO 2 általános mellékterméke a kénércek fémek olvasztásában:
SO 2C = CO 2S
4. A kohászati és kokszolókemencék hulladékgázai kén-dioxid és hidrogén-szulfid keverékét tartalmazzák. Ezt a keveréket magas hőmérsékleten vezetjük át a katalizátoron:
H2SS02 = 2H203S
^ Fizikai tulajdonságok
A kén kemény, törékeny citromsárga színű. Gyakorlatilag vízben oldhatatlan, de szén-diszulfidban és néhány más oldószerben jól oldódik a CS 2 anilinben.
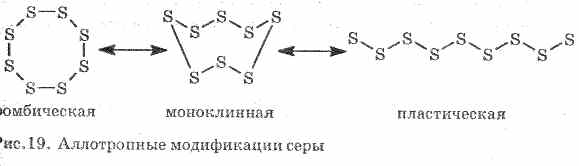
A szegény hő- és elektromos áramot vezet. A kén több allotróp módosulást képez:
1 . ^ Rombos kén (legstabilabb), kristályok oktaéder formájúak.
Ha ként melegítenek, színe és viszkozitása megváltozik: először világos sárgát képez, majd a hőmérséklet emelkedésekor sötétebbé válik, és olyan viszkózusvá válik, hogy nem folyik ki a csőből, további melegítéssel a viszkozitás ismét csökken, és 444, 6 ° С-on csökken a kén. .
2. ^ Monoklin kén - sötét sárga tű formában történő módosítása, amelyet az olvadt kén lassú hűtésével nyerünk.
3. Műanyag kénakkor keletkezik, ha a forrásba hevített ként hideg vízbe öntjük. Könnyen kifeszített, mint a gumi (lásd a 19. ábrát).
A természetes kén négy stabil izotóp keverékéből áll: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Kémiai tulajdonságok
Egy kénatom, amelynek külső energiaszintje hiányos, két elektront is csatlakoztathat és fokozatot mutathat
Oxidáció -2. A kén ilyen oxidációs állapotot mutat fémekkel és hidrogénnel (Na 2S, H 2 S). Ha az elektronok visszaszorulnak vagy kimerülnek a több elektronegatív elem atomjához, a kén-oxidáció mértéke 2, 4, 6 lehet.
A kén viszonylag inert a hidegben, de növekvő hőmérséklet mellett reaktivitása megnő. 1. Fémek esetében a kén oxidáló tulajdonságokkal rendelkezik. Amikor ezek a reakciók szulfidokat képeznek (arany, platina és iridium nem reagál): Fe S = FeS
2. Normál körülmények között a kén nem reagál hidrogénnel, és 150–200 ° C-on reverzibilis reakció lép fel:
3. Fémekkel és hidrogénnel végzett reakciók során a kén szokásos oxidálószerként viselkedik, és erős oxidálószerek jelenlétében redukáló tulajdonságokkal rendelkeznek.
S 3F 2 = SF 6 (nem reagál jóddal)
4. Az oxigénben lévő kén égése 280 ° C-on, levegőben 360 ° C-on történik. Ez SO 2 és SO 3 keverékét képezi:
S02 = SO 2 2S 3O 2 = 2SO 3
5. Levegő nélkül fűtött kén közvetlenül foszfort, szénnel kombinál, oxidáló tulajdonságokat mutatva:
2P 3S = P 2S 3 2S C = CS2
6. Komplex anyagokkal való kölcsönhatás esetén a kén elsősorban redukálószerként viselkedik:
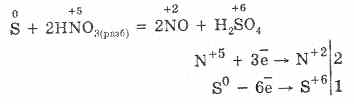
7. A kén diszproporcionális reakciókat képes alkalmazni. Tehát, ha az alkáli forró kénpor, szulfitok és szulfidok képződnek:
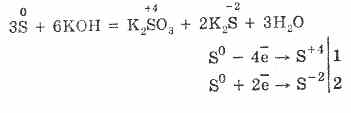
kérelem
A ként széles körben használják az iparban és a mezőgazdaságban. Termelésének mintegy fele a kénsav előállításához kerül felhasználásra. A ként a gumi vulkanizálására használják: ebben az esetben a gumi gumiké alakul.
A kén (finompor) formájában a kén felhasználható a szőlő és a gyapot betegségek leküzdésére. A pisztoly, a meccsek, a fényes kompozíciók előállítására szolgál. Az orvostudományban elkészített kénzsír a bőrbetegségek kezelésére.
4.2. Hidrogén-szulfid, szulfidok, hidroszulfidok
A hidrogén-szulfid víz analógja. Elektronikus képlete
Ez azt mutatja, hogy a kénatom külső szintjének két p-elektronja részt vesz a H-S-H kötések kialakulásában. A H 2 S molekula szögletes, ezért poláris.
^ A természetben
A hidrogén-szulfidot a vulkáni gázokban és egyes ásványi forrásokban, például Pyatigorskban, Matsestában találjuk meg. A különböző állati és növényi maradékokból származó kéntartalmú szerves anyagok bomlásából áll. Ez megmagyarázza a szennyvíz, a csővezetékek és a hulladéklerakók jellegzetes kellemetlen szagát.
vétel
1. A hidrogén-szulfidot a kén közvetlen hidrogénnel való összekötésével lehet előállítani melegítéssel:
2. Általában azonban a híg sósav vagy kénsav vas (III) -szulfidon végzett hatásával állítható elő:
2HCI FeS = FeCI 2H 2S 2 2H FeS = Fe2H2S2 Ezt a reakciót gyakran a Kipp készülékben hajtjuk végre.
^ Fizikai tulajdonságok
Normál körülmények között a hidrogén-szulfid színtelen gáz, amely erős, jellegzetes szagú rothadt tojást tartalmaz. Nagyon mérgező, az inhaláció kötődik a hemoglobinhoz, ami paralízist okoz, ami egészségtelen.
Ko halálhoz vezet. Alacsony koncentrációban, kevésbé veszélyes. Szükséges a kipufogó szekrényben vagy hermetikusan zárt eszközökkel együtt dolgozni. A H 2 S megengedett tartalma a termelési helyiségekben 0,01 mg / 1 liter levegő.
A hidrogén-szulfid vízben viszonylag jól oldódik (20 ° C-on 2,5 térfogatnyi hidrogén-szulfid oldódik 1 térfogatnyi vízben).
A vízben lévő hidrogén-szulfid oldatot hidrogén-szulfidvíznek vagy hidrogén-szulfid-savnak nevezik (a gyenge sav tulajdonságait érzékeli).
^ Kémiai tulajdonságok
1, Amikor erősen felmelegszik, a hidrogén-szulfid majdnem teljesen bomlik kén és hidrogén képződésére.
2. Gáznemű hidrogén-szulfid ég a levegőben kék lánggal, kén-oxid (IV) és víz képződésével:
2H 2S 3O 2 = 2SO 2 2H 2O
Az oxigén hiányában kén és víz képződik: 2H 2S 2 2 = 2S 2H 2O
3. A hidrogén-szulfid meglehetősen erős redukálószer. Ez a fontos kémiai tulajdonság a következőképpen magyarázható. A H 2 S oldatában viszonylag könnyű az elektronokat adni a levegő oxigén molekuláinak:
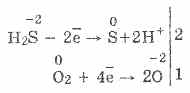
Ugyanakkor a levegőben lévő oxigén oxidálja a hidrogén-szulfidot kénvé, ami zavarossá teszi a hidrogén-szulfidot:
2H 2S 2 2 = 2S 2H 2O
Ez magyarázza azt a tényt, hogy a szerves anyag bomlásakor a hidrogén-szulfid nem halmozódik fel nagyon nagy mennyiségben - a levegő oxigénje szabad kénvé oxidálja.
4. ábra: A hidrogén-szulfid halogén oldatokkal erőteljesen reagál, például:
H 2 S 2 = 2HI S A kén felszabadul és a jódoldat elszíneződik.
5. Különböző oxidálószerek erősen reagálnak hidrogén-szulfiddal: salétromsav hatására szabad kén képződik.
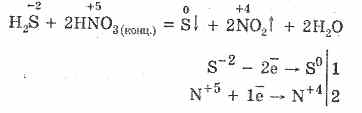
6. A disszociáció következtében savas oldat van:
H 2 SH HS - HS - H S -2
Az első szakasz általában uralkodik. Ez egy nagyon gyenge sav: gyengébb, mint a szénsav, amely rendszerint a H2S-t szulfidokból kiszorítja.
Szulfidok és hidroszulfidok
A hidrogén-fluorid, mint kétbázisú, két sót képez:
Közép-szulfidok (Na2S);
Savanyú hidroszulfidok (NaHS).
Ezek a sók a hidroxidok hidrogén-szulfiddal való kölcsönhatásával nyerhetők: 2NaOHH2S = Na 2S 2H 2 O
A kén közvetlen kölcsönhatása a fémekkel:
A sók cseréje H 2 S vagy sók között:
Pb (NO 3) 2 Na2S = PbS2NaNO3
CuS04H 2S = CuS2H2S04Cu2H2S = CuS 2H
A hidroszulfidok szinte mindegyike vízben oldódik.
Az alkáli és alkáliföldfémek szulfidjai szintén könnyen oldódnak vízben, színtelen.
A nehézfém-szulfidok gyakorlatilag nem oldódnak vagy vízben kevéssé oldódnak (FeS, MnS, ZnS); Némelyikük nem oldódik híg savakban (CuS, PbS, HgS).
Egy gyenge sav sóként a vizes oldatokban lévő szulfidok nagymértékben hidrolizálódnak. Például az alkálifém-szulfidok vízben oldva lúgos reakciót mutatnak:
Na 2S НОНNaHS NaOH
Valamennyi szulfid, mint maga a hidrogén-szulfid, erőteljes redukálószer:
3PbS-8HN5O3 (par.) = 3PbS 6O 4 4H 2O 8N 2O 2
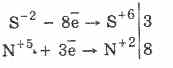
Néhány szulfid jellegzetes színe: CuS és PbS - fekete, CdS - sárga, ZnS - fehér, MnS - rózsaszín, SnS - barna, Al 2 S 3 - narancs. A kationok kvalitatív elemzése a szulfidok különböző oldhatóságán és sok különböző színén alapul.
^ 4.3. Kén-oxid (IV) és kénsav
A kén-oxid (IV) vagy a kén-dioxid normál körülmények között színtelen gáz, éles elfojtó szaggal. -10 ° C-ra hűtve, színtelen folyadékgá válik.
vétel
1. Laboratóriumi körülmények között a (IV) kén-oxidot kénsav sóiból erős savak hatására állítják elő:
Na 2SO 3H 2SO 4 = Na 2SO 4S 2 2H 2O 2NaHSO 3H 2SO 4 = Na 2SO 4 2SO 2 * 2H 2O 2HSO-3 2H = 2S02 2H 2O
2. A kén-dioxidot a koncentrált kénsav kölcsönhatása is képezi alacsony aktivitású fémekkel való melegítéskor:
Cu 2H 2SO 4 = CuS04S02 2H2O
Cu 4H 2SO 2-4 = Cu 2SO 2-4S02 + 2H 2O
3. A kén-oxid (IV) akkor is keletkezik, ha a ként levegőben vagy oxigénben égetik:
4. Ipari körülmények között a SO 2 -ot úgy kapjuk, hogy piritot FeS2-vel vagy színesfémek kénércével (cink-keverék ZnS, ólomfény PbS stb.) Pirítunk:
4FeS 2 11О 2 = 2Fe 2O 3 8SO 2
A SO 2 molekula szerkezeti képlete:
Négy kénatom és két oxigénatom közül négy elektron vesz részt az SO2 molekulában a kötések kialakulásában. A kötő elektronpárok és a magányos elektron-pár kölcsönös repulziója a molekulát szögletes formájúvá teszi.
Kémiai tulajdonságok
1. A (IV) kén-oxid a savas oxidok összes tulajdonságával rendelkezik:
Víz kölcsönhatás
Kölcsönhatás lúgokkal, \\ t
Interakció bázikus oxidokkal.
2. A (IV) kén-oxidot a tulajdonságok csökkentése jellemzi:
S 4O 2O 0 22S 6O-3 (katalizátor jelenlétében, melegítve)
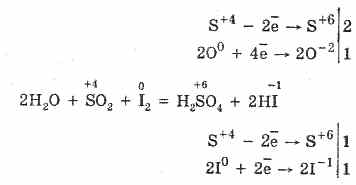
De erős redukálószerek jelenlétében az SO 2 oxidálószerként viselkedik:
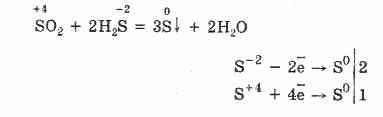
A kén (IV) -oxid redox-kettősségét azzal magyarázza, hogy a kén oxidációs állapota benne van 4-ben, és így 2 elektronból feloldva S 6-ra oxidálható, és 4 elektron segítségével S ° -ra redukálható. Ezen vagy más tulajdonságok megnyilvánulása a reaktív komponens természetétől függ.
A (IV) kén-oxid nagy mértékben oldódik vízben (40 térfogat SO 2 oldódik 1 térfogatban 20 ° C-on). Ebben az esetben csak a vizes oldatban lévő kénsav képződik:
SO 2H 2H 2H 2SO 3
A reakció reverzibilis. A vizes oldatban a kén-oxid (IV) és a kénsav kémiai egyensúlyban van, amely eltolható. H 2SO 3 kötésével (sav semlegesítése)
Ön) a reakció a kénsav kialakulásának irányába megy; az SO 2 eltávolításakor (nitrogén vagy fűtés oldata) a reakció a kiindulási anyagok felé halad. A kénsavoldat mindig kén-oxidot (IV) tartalmaz, amely éles szagot ad.
A kénsav savak minden tulajdonságával rendelkezik. A megoldás az alábbi lépésekben disszociál:
H2S03HHSO-3HSO-3 --H SO 2-3
Termikusan instabil, illékony. A kénsav, mint kétbázisú, kétféle sót képez:
Közép-szulfitok (Na2S03);
Savanyú hidroszulfit (NaHS03).
A lúgok akkor képződnek, amikor a sav a lúg teljesen semlegesíti:
H 2SO 3 2NaOH = Na 2SO 3 2H 2O
A hidroszulfitokat alkáli hiánya miatt kapjuk:
H 2SO 3 NaOH = NaHS03H20
A kénsav és sói oxidáló és redukáló tulajdonságokkal rendelkeznek, amit a reakciópartner jellege határoz meg.
1. Tehát az oxigén-szulfitok szulfátokká oxidálódnak:
2Na 2S 4O 3O 0 2 = 2Na 2S 6O -2 4
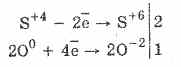
A bróm és a kálium-permanganát által okozott kénsav-oxidáció még könnyebben megy végbe:
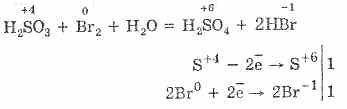
5H 2S 4O 3 2KMn 7O 4 = 2H 2S 6O 4 2M 2S 6O 4 K 2S 6O 4 3H 2 O
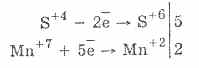
2. Hatékonyabb redukálószerek jelenlétében a szulfitok oxidatív tulajdonságokkal rendelkeznek:
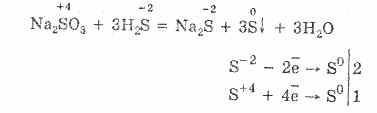
Majdnem minden hidroszulfit és alkálifém-szulfit oldódik a kénsav sóiból.
3. Mivel a H2S03 gyenge sav, a savak szulfitokra és hidroszulfitokra gyakorolt hatása SO 2 felszabadulását eredményezi. Ezt a módszert általában SO 2 előállítására használják laboratóriumi körülmények között:
NaHS03H2S04 = Na2S04S02H2O
4. A vízoldható szulfitok könnyen hidrolizálódnak, aminek következtében az oldatban az OH-ionok koncentrációja nő.
Na2S03NONNaSSO 3 NaOH
kérelem
A kén-oxid (IV) és a kénsav elszíneződik sok színezékkel, és színtelen vegyületeket képez. Az utóbbi újra felforrósodhat, ha melegszik vagy a fényben, aminek következtében a szín helyreáll. Ezért az SO 2 és a H 2 SO 3 fehérítő hatása eltér a klór fehérítő hatásától. Általában a kén (IV) rxid fehéríti a gyapotot, a selymet és a szalmát.
A kén-oxid (IV) sok mikroorganizmust öl meg. Ezért a penészgombák elpusztítására a nyers pincéket, pincéket, borhordókat stb. Fumigálják. A gyümölcsök és bogyók szállítására és tárolására is használják. Nagy mennyiségben a IV. Kén-oxidot használják kénsav előállítására.
Fontos alkalmazás a kalcium-hidroszulfit CaHSO 3 (szulfit-oldat) oldat, amelyet a fa és a papírpép kezelésére használnak.
^ 4.4. Kén-oxid (VI). Kénsav
A (VI) kén-oxid (lásd a 20. ábrát) színtelen folyadék, amely 16,8 ° C-on szilárd kristályos tömegre szilárdul. Nagyon erősen elnyeli a nedvességet, kénsavat képezve: SO 3H 2 O = H 2 SO 4
20. táblázat: A kén-oxidok tulajdonságai
A kén-oxidok (VI) vízben való oldódása jelentős mennyiségű hő felszabadulásával jár.
A (VI) kén-oxid koncentrált kénsavban nagyon jól oldódik. Az SO3 oldatot vízmentes savban olajnak nevezzük. Az olajok legfeljebb 70% SO 3 -ot tartalmazhatnak.
vétel
1. A (VI) kén-oxidot a kén-dioxid oxigénnel történő oxidálásával állítják elő katalizátor jelenlétében 450 ° C hőmérsékleten (lásd Kénsav-termelés):
2SO 2O 2 = 2SO 3
2. Az SO 2 SO3-ra történő oxidálásának másik módja a nitrogén (IV) -oxid oxidálószerként való alkalmazása:
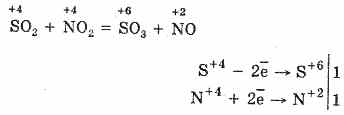
A keletkező nitrogén-monoxid (II) a légköri oxigénnel való interakció során könnyen és gyorsan nitrogén-monoxiddá (IV) válik: 2NO 2 = 2NO 2
Ami ismét használható SO2 oxidációjához. Ezért az NO2 oxigén hordozóként működik. Ezt az eljárást SO2 SO3-ra oxidálására nitrogénnek nevezzük. Az SO3 molekula háromszög alakú, amelynek középpontjában
A kénatom a következő:
Ilyen szerkezet a kötő elektronpárok kölcsönös repulziójának köszönhető. A kénatom hat külső elektront biztosított a kialakulásához.
Kémiai tulajdonságok
1. SO 3 - tipikus sav-oxid.
2. A (VI) kén-oxidnak erős oxidálószer tulajdonságai vannak.
kérelem
A kénsavat (VI) használják kénsav előállítására. A legfontosabb a kapcsolatfelvétel módszere
Kénsav. Ezzel a módszerrel bármilyen koncentrációjú H 2 SO 4-t, valamint oleumot is kaphat. A folyamat három szakaszból áll: SO2 beszerzése; SO 2 oxidálása SO3-ra; H 2 SO 4 előállítása.
SO 2 -ot úgy kapunk, hogy pirit FeS 2-et égetünk speciális kemencékben: 4FeS 2 11О 2 = 2Fe 2O 3 8SO 2
A pörkölés felgyorsítása érdekében a pirit előkészül, és a kén teljesebb kiégetése érdekében lényegesen több levegőt (oxigént) injektálunk, mint amennyi a reakcióhoz szükséges. A kemencéből kilépő gáz kén (IV) -oxidból, oxigénből, nitrogénből, arzénvegyületekből (piritokból származó szennyeződésekből) és vízgőzből áll. Ezt pörkölőgáznak nevezik.
A pörkölőgáz alapos tisztításon megy keresztül, mivel még kis mennyiségű arzénvegyület, valamint por és nedvesség mérgezi a katalizátort. A gázt az arzénvegyületekből és a porból tisztítják, speciális elektromos elektrosztatikus kicsapókon és mosótoronynak köszönhetően; a nedvességet a koncentrált kénsav felszívja egy szárítótoronyban. Az oxigéntartalmú tisztított gázt hõcserélõben melegítjük 450 ° C-ig, és belép az érintkezõbe. Az érintkező berendezés belsejében katalizátorral töltött rácsos polcok találhatók.
Korábban katalizátorként finom zúzott fém platinát használtak. Ezt követően vanádiumvegyületeket - vanádium-oxidot (V) V 2O 5 vagy vanozil-szulfátot (VOSO 4) helyettesítettünk, amely olcsóbb, mint a platina, és lassabban mérgezett.
Az SO 2 és SO 3 oxidációs reakciója reverzibilis:
2SO 2O 2 2SO 3
A kalcináló gáz oxigéntartalmának növekedése növeli a kén-oxid (VI) hozamát: 450 ° C hőmérsékleten általában 95% vagy annál nagyobb.
A képződött kén-oxidot (VI) ezután ellenáramú módszerrel tápláljuk be abszorpciós toronyba, ahol a koncentrált kénsav abszorbeálja. Ahogy telített, vízmentes kénsav első formái, majd olaj. A jövőben az oleumot 98% -os kénsavra hígítjuk és a fogyasztóknak szállítjuk.
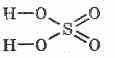
A kénsav szerkezeti képlete:
^ Fizikai tulajdonságok
A kénsav egy nehéz, színtelen, olajos folyadék, amely 10,4 ° C-on, majdnem kétszer kristályosodik ( = 1,83 g / cm3) a víznél nehezebb, szagtalan, nem illékony. Rendkívül higroszkópos. A nedvesség nagy mennyiségű hő felszabadításával elnyeli, így nem vihet be vizet a tömény kénsavba - a sav fröccsenő lesz. A
A kénsavat kis adagokban kell hozzáadni a vízhez.
A vízmentes kénsav feloldja a 70% -os kén-oxidot (VI). Melegítéskor eltávolítja az SO3-ot, amíg a H2S04 tömegarányú 98,3% -os oldat keletkezik. A vízmentes H 2 SO 4 alig vezet villamos energiát.
^ Kémiai tulajdonságok
1. Bármilyen arányban keveredik vízzel és különböző összetételű hidrátokat képez:
H 2SO 4H 2O, H2S04 2H 2O, H2S04 3H 2O, H2S04 4H 2O, H 2SO 4 6,5H 2O
2. Koncentrált kénsav karbonizálja a szerves anyagot - cukor, papír, fa, rost, elveszítve tőlük a víz elemeit:
C12H22O11H2S04 = 12C2 2SO 4 11H 2O
A képződött szén részben kölcsönhatásba lép a savval:
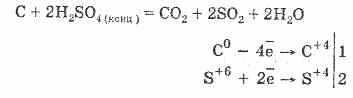
A gáz-dehidratáció a kénsav-víz abszorpcióján alapul.
Erős, illékony savként a H 2SO 4 kiszárítja a többi sót a száraz sókból:
NaN03H 2SO 4 = NaHS04HNO3
Ha azonban a sóoldatokhoz H 2SO 4-t adunk, akkor a sav-eltolódás nem következik be.
H 2SO 4 - erős kétbázisos sav: H 2SO 4H HSO-4HSO-4HH SO 2-4
A nem illékony erős savak minden tulajdonságával rendelkezik.
A hígított kénsavat a nem oxidáló savak összes tulajdonsága jellemzi. Nevezetesen: kölcsönhatásba lép a fémekkel, amelyek a fémek feszültségének elektrokémiai sorozata hidrogénig terjednek:
A fémekkel való kölcsönhatás a hidrogénionok redukciójának köszönhető.
6. A koncentrált kénsav egy energetikus oxidálószer. Melegítéskor a legtöbb fém oxidálódik, beleértve a hidrogén utáni elektrokémiai feszültségsorozatot is, nem reagál csak a platinával és az aranyral. A fém aktivitásától függően a redukciós termékek S -2, S ° és S 4 lehetnek.
A hidegben a tömény kénsav nem hat az olyan erős fémekkel, mint az alumínium, a vas és a króm. Ez a fémek passziválásának köszönhető. Ezt a funkciót széles körben használják, ha vastartályban szállítják.
Fűtés esetén azonban:
Így a savképző atomok redukciója következtében a tömény kénsav kölcsönhatásba lép a fémekkel.
A szulfátionhoz való SO 2 - 4 minőségi reakció egy fehér kristályos BaSO4 csapadék képződése, amely vízben és savakban nem oldódik:
SO 2-4Ba 2 'BaSO 4'
kérelem
A kénsav a fő vegyipar legfontosabb terméke, amely nem
Szerves savak, lúgok, sók, ásványi műtrágyák és klór.
Különböző alkalmazásokhoz a kénsav első helyen áll a savak között. A legnagyobb mennyiséget foszfát és nitrogén műtrágyák előállítására használják. A nem-illékony kénsav más savak - sósav, hidrogén-fluorid, foszforsav és ecetsav - előállítására szolgál.
Rengeteg a kőolajtermékek - benzin, petróleum, kenőolajok - káros szennyeződések tisztítására. A gépgyártásban a kénsav a bevonat megtisztítása előtt megtisztítja a fém felületét (nikkel bevonat, krómozás stb.). A kénsavat robbanóanyagok, mesterséges szálak, festékek, műanyag és sok más gyártásához használják. Az elemek töltésére szolgál.
A kénsav sók fontosak.
^ Nátrium-szulfátA Na2S04 vizes oldatokból kristályosodik Na 2SO 4 10H 2 O hidrátja formájában, amelyet Glauber-sónak nevezünk. Gyógyszerként hashajtóként alkalmazzák. Vízmentes nátrium-szulfátot használnak szóda és üveg gyártásához.
^ Ammónium-szulfát(NH 4) 2 SO 4 - nitrogén műtrágya.
Kálium-szulfátK 2 SO 4 - kálium műtrágya.
Kalcium-szulfát A CaSO 4 a természetben gipsz ásványi CaSO 4H 2 O-ként van jelen. 150 ° C-ra melegítve elveszíti a víz egy részét, és egy 2CaSO 4 H 2 O hidrátba, az égetett gipszbe vagy az alabástromba kerül. Ha vízzel keveredik a pépes tömegre, az alabástrom egy idő után ismét keményedik, CaSO 4 2H 2 O-ra változik. A gipszet széles körben használják az építőiparban (gipsz).
Magnézium-szulfátA MgS04 a tengervízben található, ami keserű ízét okozza. A kristályos hidrátot, amelyet keserű sónak nevezünk, hashajtószerként használjuk.
vitriol- a Fe, Cu, Zn, Ni, Co fémszulfátok kristályos hidrátjainak műszaki neve (dehidratált sók nem vitrialisok). Réz-szulfátA CuSO 4 5H 2 O kék toxikus anyag. A növényeket hígított oldattal permetezzük, és a vetőmagokat vetés előtt vetjük. Vas vitriolFeSO 4 7H 2 O világos zöld anyag. Növények, tinták, ásványi festékek stb. Cink-szulfátA ZnSO 4 7H 2 O-t ásványi festékek, sittoprechatanii, gyógyszer előállítására használják.
^ 4.5. A kénsav észterei. Nátrium-tioszulfát
A kénsav-észterek közé tartoznak a dialkil-szulfátok (RO 2) SO 2. Ezek magas forráspontú folyadékok; vízben kevésbé oldódik; alkáli jelenlétében alkohol és kénsav sói képződnek. Az alacsonyabb dialkil-szulfátok alkilezőszerek.
Dietil-szulfát(C2H5) 2S04. Olvadáspont -26 ° C, forráspont 210 ° C, alkoholokban oldódik, vízben oldhatatlan. A kénsavat etanollal reagáltatjuk. Az etilálószer szerves szintézisben van. A bőr behatol.
Dimetil-szulfát(CH3) 2S04. Olvadáspont -26,8 ° C, forráspont: 188,5 ° C. Alkoholban oldódik, rossz - vízben. Reagál ammóniával oldószer nélkül (robbanással); Néhány aromás vegyület kén, például fenol-észterek. 60% -os olaj és 150 ° C közötti metanollal való kölcsönhatással állítható elő. A szerves szintézisben metilálószer. Rákkeltő, a szemet, a bőrt, a légzőszerveket érinti.
^ Nátrium-tioszulfát Na 2S 2O 3
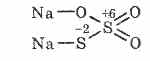
A tioszulfórsav sója, amelyben két kénatom különbözik az oxidációs állapottól: 6 és -2. Kristályos anyag, jól oldódik vízben. Kapható kristályos Na 2S 2O 3 5H 2 O formában, amelyet általában hiperszulfitnak neveznek. A nátrium-szulfit és a kén közötti kölcsönhatással a forrásban keletkezik:
Na2S03S = Na2S203
A tioszulfonsavhoz hasonlóan erős redukálószer, amely klórral kénsavvá oxidálódik:
Na 2S 2O 3 4CI 2 5H 2O = 2H 2SO 4 2NaCl 6HCI
Ezen a reakción alapul a nátrium-tioszulfát klórtartalmú felhasználása (az első gázmaszkokban).
Enyhén eltérő oxidáció esetén nátrium-tioszulfát gyenge oxidálószerek lépnek fel. Ez tetration-sav sóit képezi, például:
2Na 2S 2O 3I 2 = Na 2S 4O 6 2NaI
A nátrium-tioszulfát a kénből származó ipari gázok tisztításakor a nátrium-karbonát, kénfestékek előállításának mellékterméke. A szövetek fehérítése után a klór nyomainak eltávolítására használják, az ércekből az ezüst eltávolítására; egy fixálószer a fotózásban, egy reagens a jodometriában, az ellenanyag mérgezésére arzénvegyületekkel, higany, gyulladásgátló szer.
A kémiai elem kéntartalma a VIBA-csoportban található, 3. PSCE. A kénatom külső elektronrétegén 6 elektron van. Az oxidálószer tulajdonságait fémekkel és hidrogénnel képződő anyagok esetében a kén megszerzi az -2 oxidációs állapotot (2 elektron).
Az oxigéntartalmú vegyületek összetételében a kén oxidációs állapota +4 és +6. Így a ként oxidációs állapotok jellemzik -2; 0; 4; 6.
A természetben a ként a natív állapotában és az ásványi anyagok összetételében találjuk. Például a kén ólomfényt tartalmaz (a fő komponens a PbS ólom-szulfid) és a rézfény (a fő komponens a Cu 2S réz-szulfid).
A kén néhány egyszerű anyagot képez - allotróp módosításokat. A rombos kén szobahőmérsékleten a legstabilabb (1. ábra). Ez az anyag S 8 molekulából áll. A rombos kén sárga és + 112,8 ° C hőmérsékleten olvad.
Ábra. 1. A kén rombos módosítása
Fűtés közben a rombos kén fokozatosan viszkózus sötétbarna tömegévé válik. Ez egy másik kén - műanyag kén allotróp módosítása. A műanyag kén lineáris kénmolekulákból áll.
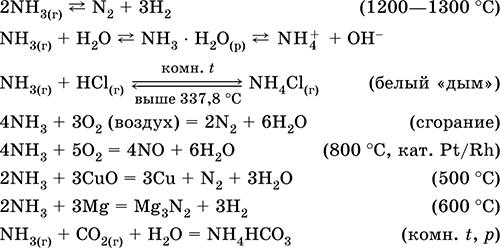
A fémekkel és hidrogénnel végzett kémiai reakciók kénje oxidálószerként játszik szerepet. Az oxidáció mértéke 0-ról -2-re csökken. Az oxigénnel való reakcióban a kén redukálószerként működik, növelve az oxidáció mértékét 0 és +4 között.
Fontolja meg a ként tartalmazó kölcsönhatások példáit.
Ha a kén hidrogénnel kölcsönhatásba lép, hidrogén-szulfid képződik:
Ha cink kölcsönhatásba lép a kénnel, cink-szulfid keletkezik:
A kén oxigénben keletkezik kén-oxid (IV) képződésével (2. ábra):

Ábra. 2. Égő kén az oxigénben
Vegyük figyelembe a "-2" oxidációs állapotú kénvegyületek tulajdonságait. Ilyen vegyületek a hidrogén-szulfid és a szulfidok - a hidrogén-szulfid-savak sói.
A hidrogén-szulfid a rothadt tojások szaga. A levegőben ég. Ezen túlmenően, az oxigénhiány és a feleslegben az égés másképp folytatódik.
Az oxigén feleslegében a hidrogén-szulfid kén-oxidot (IV) és vizet képez:
2H 2S + 3O 2 = 2SO 2 + 2H 2O.
Az oxigénhiány miatt a hidrogén-szulfid hiányos égése a kén kibocsátásával következik be: 2H2S + O2 = 2S + 2H 2 O.
A hidrogén-szulfid vízben nagyon jól oldódik. A kapott oldat gyenge hidrogén-szulfid-sav. A hidrogén-szulfid sókat szulfidoknak nevezzük. A hidrogén-fluorid és a vízoldható szulfidok csere-reakcióba lépnek.
A hidrogén-szulfid-sav és a réz (II) -klorid kölcsönhatása oldhatatlan réz (II) -szulfidot és sósavat képez: H 2S + CuCl 2 = CuS + 2HCl.
Ha kálium-szulfid kölcsönhatásba lép a cink-nitráttal, a cink-szulfid kicsapódik és kálium-nitrát képződik: K 2S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Irodalom
- Orzhekovsky P.A. Kémiai feladatok és gyakorlatok összegyűjtése: 9. osztály: a P.A. Orzhekovszkij és mások. 9. osztály / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M: AST: Astrel, 2007. (91–97. O.)
- Orzhekovsky P.A. Kémia: 9. osztály: tanulmányok. általános képhez. megállapítva. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - M: AST: Astrel, 2007. (34. §)
- Orzhekovsky P.A. Kémia: 9. osztály: általános tanulmányok. megállapítva. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013. (20. és 21. §)
- Rudzitis G.E. Kémia: neorgan. kémia. Hatóság. Kémia: tanulmányok. 9 cl. / G.E. Rudzitis, F.G. Feldman. - M .: Oktatás, Moszkva tankönyvek OJSC, 2009.
- Khomchenko I.D. Kémiai feladatok és gyakorlatok összegyűjtése a középiskolában. - M: RIA "New Wave": Umerenkov kiadó, 2008.
- Enciklopédia gyerekeknek. Kémia / fejezet. Ed. VA Volodin, Ved. tudományos. Ed. I. Leenson. - M .: Avanta +, 2003.
- Digitális oktatási erőforrások egyetlen gyűjteménye (videó tapasztalatok a témában) ().
- A "Kémia és élet" folyóirat elektronikus változata ().
házi feladat
- a. 136 No. 3; 140. o. 2-4. oldal a P.A. Orzhekovsky "Kémia: 9. osztály" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013.
szulfidok (latból kén, kén-kén)
több elektropozitív elemekkel rendelkező kénvegyületek; a hidrogén-szulfid-sók sóinak tekinthetők (lásd. \\ t Hidrogén-szulfid-savH 2 S. Két C sorozat van: az M2S általános képlet átlaga (normál) és az MHS általános képletű sav (hidroszulfidok), ahol M egyértékű fém. C. Az alkálifémek színtelenek, vízben oldódnak. A vizes oldatai erősen hidrolizáltak és lúgosak. Hígított savak hatására H 2 S-t bocsátanak ki. C. Az alkáliföldfémek színtelenek, vízben enyhén oldódnak. A H 2 S nedves levegőbe kerül, más tulajdonságok hasonlóak az S. alkálifémekhez. Mind az S., mind a többi S. könnyen szulfátokká oxidálódik. C. a nehézfémek gyakorlatilag vízben nem oldódnak. Szinte mindegyik fekete vagy fekete-barna (kivéve a fehér ZnS-t, rózsaszínű MnS-t, sárga CdS-t, narancssárga-vörös Sb 2 S 3, sárga SnS 2). A kémiai analízis során a C és a ammónium közötti egyenlőtlenséget alkalmazzuk. I.K. Malina.
Nagy szovjet enciklopédia. - M: Szovjet enciklopédia. 1969-1978 .
Nézze meg, hogy a "szulfidok" más szótárakban vannak:
Kénvegyületek fémekkel és egyes nemfémekkel. A fém-szulfidok hidrogén-szulfid-sav H2S: közeg (például Na2S) és savas vagy hidroszulfidok (NaHS) sói. A természetes szulfidok égetésével színesfémeket és SO2-t kapunk. Foszfor-szulfidok és ... ... Nagy enciklopédikus szótár
Modern enciklopédia
szulfidok - SULFIDEK, kénvegyületek szervetlen szulfidjai fémekkel és egyes nemfémekkel. Tartalmazza a szulfidérceket; foszforként (például CdS, ZnS). Molibdén-szulfid, titán szilárd kenőanyagok. Foszfor-szulfidok ... ... Illusztrált enciklopédikus szótár
- (új lat., a latin kén kénből). Néhány test kénnel alkotott vegyületei, amelyek megfelelnek az oxidoknak vagy savaknak. Az orosz nyelvű idegen szavak szótára. Chudinov, AN, 1910. SULFIDES Novolatinsk. kén, kén. Kapcsolat ... ... Az orosz nyelv idegen szavai
1. Fémek és egyes nemfémek természetes kénvegyületei. A vegyi anyagban a hidrogén-szulfid-H2S sói. Számos elem képezi a poliszulfidokat kénnel, amelyek a H2Sx poli-kénsav sói. A fő ... ... Geológiai enciklopédia
szulfidok - - kénvegyületek fémekkel és egyes nemfémekkel; a hidrogén-szulfid-sav hidrogén-szulfid-sói. [Terminológiai szótár a beton és vasbeton számára. „SIC“ „Építés” NIIZHB és A. A. Gvozdeva metróállomás, Moszkva, 2007. 110 p.] ...… Az építőanyagok kifejezéseinek, fogalmának és magyarázatainak enciklopédiája
SULPHES, s, u szulfid, a férj (Spec.). Kémiai kémiai vegyületek fémekkel és bizonyos nemfémekkel. Szerves Természetes s. | mn. szulfid, ó, ó. Szótár Ozhegova. SI Ozhegov, N.Yu. Shvedova. 1949 1992 ... Szótár Ozhegova
A szulfidokat, R2S-t (R aromás csoport) a legegyszerűbben diazo-sók 60 ° C-os oldatának cseppenként hozzáadásával nyerhetjük. Brockhaus és Efron enciklopédia
szulfidok - (1) szervetlen kémia, ilyen ként tartalmazó elemek, amelyekben a kénatomok oxidációs állapota 2. a gyenge hidrogén-szulfidsav (H2S vizes oldat) sói. Sok S. természetes ... ... Nagy politechnikai enciklopédia
s; pl. (szulfidegységek és m.). [a latból. kén-kén] Chem. Kénvegyületek fémekkel és egyes nemfémekkel. C. titán. Szerves Természetes s. (ásványi anyagok osztálya). F Sulfid, th, ó. Vegyes keverékekkel. Ércércből. * * * kénvegyületek szulfidjai ... Enciklopédikus szótár
- (a latin kéntartalmú kénből) olyan kémiai vegyületek osztálya, amelyek fémvegyületek (valamint számos nemfém B, Si, P, As) kénnel (S), ahol oxidációs állapota −2. A hidrogén-szulfid sóinak tekinthető ... ... Wikipedia
könyvek
- Uranium lerakódások a fánerozoikus, Andrei Borisovich Khalezov-i nézeteltérés típusában. Az uránbetétek jellemzőit a paleo-völgy szerkezeteiben a strukturális és stratigrafikus nézetkülönbségek felszínén az Ural régió három régiójának példáján tekintjük, amelyek különbözőek.
kén - A 3. periódus eleme és a Periódusos rendszer VIA csoportja, a 16. sorszám oxigéncsoport. Az atom [10 Ne] 3s 2 3p 4, a jellemző oxidációs állapotok 0, -II, + IV és + VI, az S VI állapot stabilnak tekinthető.
Kén-oxidációs skála:
A kén elektronegativitása 2,60, nemfémes tulajdonságokkal jellemezhető. A hidrogén- és oxigénvegyületekben különböző anionokban van jelen, oxigéntartalmú savakat és sóikat, bináris vegyületeket képez.
A természetben - tizenötödik kémiai prevalencia elem (a nem fémek hetedik része). Ez megtalálható a szabad (natív) és kapcsolódó formában. Fontos eleme a magasabb szervezeteknek.
Sulphur S. Egyszerű anyag. Kristályos sárga (α-rombos és β-monoklinikus, \\ t
95,5 ° C-on) vagy amorf (műanyag). A rácsos helyeken S8 molekulák (nem-sík „korona” típusú ciklusok), az amorf kén S-láncokból áll. Alacsony olvadáspontú anyag, a folyadék viszkozitása egy maximum 200 ° C-on halad (az S8 molekulák rése, az S n láncok egymásba helyezése). Egy pár - molekulák S 8, S 6, S 4, S 2. 1500 ° C-on monoatomikus kén jelenik meg (az egyszerűség kedvéért kémiai egyenletekben bármely kén S-ként jelenik meg).
A kén nem oldódik vízben, és normál körülmények között nem reagál vele, jól oldódik a CS 2 szén-diszulfidban.
A kén, különösen porított, magas melegítő hatású. Reagál oxidálószerként fémekkel és nemfémekkel:
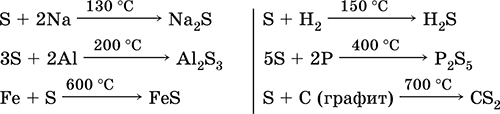
mi a helyzet redukálószer - fluorral, oxigénnel és savakkal (forrásban):
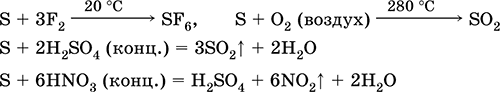
A kén az alkáli oldatokban diszmutálódik:
3S 0 + 6KOH (konc.) = 2K2S-II + K2S IVO3 + 3H 2O
Magas hőmérsékleten (400 ° C) a kén a jódot a hidrogén-jodidból kiszorítja:
S + 2IRI (g) = 2 + H 2S,
de a megoldás a reakció ellentétes:
I 2 + H 2 S (p) = 2 HI + S ↓
vétel: in ipar a széngázosodás termékeinek kénmentesítésével szabaddá váló natív kén természetes lerakódásaiból (vízgőz felhasználásával).
A ként a szén diszulfid, kénsav, kén (vat) festékek szintézisére használják a gumi vulkanizálásában, a növények por alakú penészből való védelmére és a bőrbetegségek kezelésére.
H 2 S hidrogén-szulfid Oxigénmentes sav. Színtelen gáz, amely elfojtó szaggal, a levegőnél nehezebb. A molekula kettős-hiányos tetraéder szerkezete [:: S (H) 2]
(sp 3 - hibridizáció, a H - S - H jack szög messze nem tetraéderes). 400 ° C feletti hőmérsékleten nem stabil. Vízben enyhén oldódik (2,6 l / 1 l H20 20 ° C-on), telített oldat decimoláris (0,1 M, „hidrogén-szulfid víz”). Egy nagyon gyenge sav oldatban, gyakorlatilag nem szétválik a második fázisban az S2-ionokkal (az S 2 -1 maximális koncentrációja 1 10–13 mol / l). Amikor levegőben áll, az oldat zavarossá válik (inhibitor - szacharóz). A lúgok semlegesítik, nem teljesen ammóniahidráttal. Erős redukálószer. Ez ioncserélő reakcióba lép. A szulfidálószer kicsapódik különböző színű szulfidokból, amelyek nagyon kevéssé oldódnak.
Minőségi reakciók - a szulfidok ülepítése, valamint a H 2 S elégtelen égése a lángba (porcelán spatulába) bejuttatott hideg tárgyon keletkező sárga kéntartalommal. A kőolaj, a természetes és a kokszoló gázok finomításának mellékterméke.
Ezt kén, szervetlen és szerves kéntartalmú vegyületek előállítására használják analitikai reagensként. Rendkívül mérgező. A legfontosabb reakciók egyenletei:
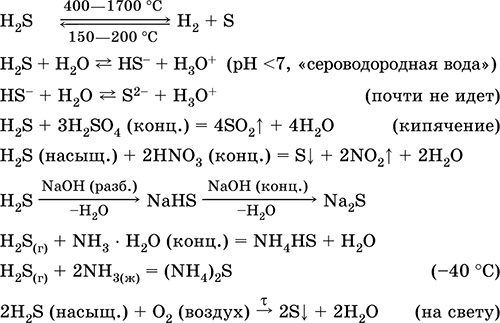

vétel: in ipar - közvetlen szintézis:
H 2 + S = H 2 S(150–200 ° C)
vagy a kén parafinnel történő melegítésével;
a laboratórium - a szulfidok erős savakkal történő eltolódása
FeS + 2НCI (konc.) = FeCl2 + H 2 S
vagy bináris vegyületek teljes hidrolízise:
Al 2S 3 + 6H 2O = 2Al (OH) 3 ↓ + 3 H 2 S
Na 2S nátrium-szulfid Oxigénmentes só. Fehér, nagyon higroszkópos. Lebomlás nélkül olvad, termikusan stabil. Jól oldódik vízben, anion hidrolizálva, egy nagyon lúgos közeget hoz létre az oldatban. Levegőben állva az oldat zavarossá válik (kolloid kén), és sárga színűvé válik (poliszulfid festék). Tipikus redukálószer. A ként csatolja. Ez ioncserélő reakcióba lép.
Minőségi reakciók az S 2–– ionon különböző színű fémszulfidok lerakódása, amelyekből MnS, FeS, ZnS bomlik HCI-ba (s).
A kénfestékek és a cellulóz előállításához, a bőr szőrének eltávolítására a bőr barnulása során, mint analitikai kémiai reagens.
A legfontosabb reakciók egyenletei:
Na2S + 2НCI (bomlik) = 2NaCl + H 2 S
Na 2S + 3H 2SO 4 (konc.) = SO 2 + S ↓ + 2H20 + 2NaS04 (50 ° C-ig)
Na 2S + 4HNO 3 (konc.) = 2NO + S ↓ + 2H20 + 2NaN03 (60 ° C)
Na 2S + H 2S (tel.) = 2NaHS
Na 2S (t) + 2O 2 = Na2S04 (400 ° C felett)
Na 2S + 4H 2O 2 (tömény) = Na2S04 + 4H 2O
S 2– + M 2+ = MnS (testes) ↓; FeS (fekete) ↓; ZnS (fehér) ↓
S 2– + 2Ag + = Ag 2 S (fekete) ↓
S 2– + M 2+ = CdS (sárga) ↓; PbS, CuS, HgS (fekete) ↓
3S 2– + 2Bi 3+ = Bi 2 S 3 (korrigált - fekete) ↓
3S2- + 6H20 + 2M3 + = 3H2S + 2M (OH) 3 ↓ (M = Al, Cr)
vétel a ipar - az ásványi anyag kalcinálása mirabilit Na 2SO 4 10H 2O redukálószerek jelenlétében:
Na2S04 + 4H 2 = Na2S + 4H20 (500 ° C, Fe2O3-kat.)
Na2S04 + 4C (koksz) = Na 2S + 4CO (800-1000 ° C)
Na 2SO 4 + 4CO = Na 2S + 4СO 2 (600–700 ° C)
Alumínium-szulfid Al 2S 3. Oxigénmentes só. Fehér, az Al-S kötés túlnyomórészt kovalens. Az N2 túlzott nyomás alatt elbomlik, könnyen szublimálódik. Kalcinálva levegőben oxidálódik. Vízzel teljesen hidrolizálva nem csapódik ki az oldatból. Erős savakkal bomlik. A tiszta hidrogén-szulfid forrása. A legfontosabb reakciók egyenletei:
Al 2S 3 + 6H 2O = 2Al (OH) 3 ↓ + 3H 2S (tiszta)
Al 2S 3 + 6HCI (bomlik) = 2AlCI3 + 3H 2S
Al 2S 3 + 24HNO 3 (konc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2O (100 ° C)
2Al 2S 3 + 9O 2 (levegő) = 2Al 2O 3 + 6SO 2 (700–800 ° C)
vétel: alumínium és az olvadt kén kölcsönhatása oxigén és nedvesség hiányában:
2Al + 3S = AL 2 S 3(150–200 ° C)
Vas (II) -szulfid FeS. Oxigénmentes só. A fekete és szürke színárnyalatú, tűzálló, vákuumban hevítve bomlik. Nedves állapotban érzékeny a levegőben lévő oxigénre. Vízben nem oldódik. Nem csapódik ki vas (II) sók hidrogén-szulfiddal való telítettsége esetén. Savakkal bomlik. A vas előállításához nyersanyagként, szilárd hidrogén-szulfidforrásként használják.
A Fe2S3 vas (III) összetételének vegyülete nem ismert (nem kapott).
A legfontosabb reakciók egyenletei:
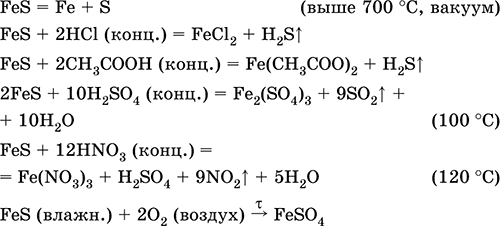
fogadása:
Fe + S = FeS (600 ° C)
Fe203 + H2 + 2H2S = 9 FeS + 3H 2O (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = FeS ↓ + 2NH 4CI + H 2 S
FeS 2 vas-diszulfid. Bináris kapcsolat. Az ionos szerkezete Fe 2+ (–S-S–) 2–. Sötét sárga, termikusan stabil, gyulladásra bomlik. Vízben nem oldódik, nem reagál hígított savakkal, lúgokkal. A levegőben pörkölt sav-oxidálószerek bomlanak le. Nyersanyagként használják a vas, kén és kénsav, a szerves szintézis katalizátora. A természetben - érc ásványok pirit és markazit.
A legfontosabb reakciók egyenletei:
FeS 2 = FeS + S (1170 ° C felett, vákuum)
2FeS 2 + 14H 2SO 4 (konc., Hegyek) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (konc.) = Fe (NO 3) 3 + 2H 2SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (levegő) = 8SO 2 + 2Fe 2 O 3 (800 ° C, pörkölés)
Ammónium-hidroszulfid NH 4 HS. Oxigénmentes só. Fehér, nyomás alatt olvadt. Rendkívül illékony, termikusan instabil. Ez levegőn oxidálódik. Jól oldódik vízben, kation és anion hidrolizálódik (uralja), alkáli környezetet teremt. Az oldat a levegőben sárga színűvé válik. Savakkal bomlik, telített oldatban ként ad. Az alkáliokat nem semlegesítik, a közepes só (NH 4) 2S nem létezik az oldatban (a középső só megszerzésének feltételeiért lásd a „H 2 S” címet). A fotófejlesztők részeként használják analitikai reagensként (szulfid-kicsapó).
A legfontosabb reakciók egyenletei:
NH 4 HS = NH3 + H 2 S (20 ° C felett)
NH4 HS + HCl (bomlik) = NH4CI + H 2S
NH 4 HS + 3HNO 3 (konc.) = S ↓ + 2N02 + NH4N03 + 2H2O
2NH4 HS (telített H 2S) + 2CuS04 = (NH4) 2S04 + H 2SO 4 + 2CuS ↓
vétel: koncentrált NH3-oldat telítettsége hidrogén-szulfiddal:
NH3H20 (konc.) + H 2S (g) = NH 4 HS + H20
Analitikai kémia esetében az NH 4 HS-t és az NH3H20-t egyenlő mennyiségű oldatot szokásosan az (NH4) 2S-oldatnak tekintik, és az átlagos só képletet használjuk a reakcióegyenletek írásakor, bár az ammónium-szulfid vízben teljesen hidrolizálódik NH 4 HS-ra és NH-ra. 3H 2O.
Kén-dioxid. szulfitok
Kén-dioxid SO 2. Sav-oxid. Színtelen gáz csípős szaggal. A molekula egy hiányos háromszög szerkezete [: S (O) 2] (sp 2 - hibridizáció), tartalmaz σ, π - kötéseket S = O. Könnyen cseppfolyósítható, termikusan stabil. Vízben oldódik (~ 40 l / 1 l H20 20 ° C-on). A gyenge savat, a disszociáció termékeit tartalmazó polihidrátot képez - ionok HSO 3 - és SO 3 2−. Ion HSO 3 - két tautomer formával rendelkezik - szimmetrikus (nem savas) a tetraéder (sp 3 - hibridizáció) szerkezetével, amely a keverékben dominál, és aszimmetrikus (savas) egy nem teljes tetraéder szerkezetével [: S (O) 2 (OH)] (sp 3 - hibridizáció). Az ion SO3 2 szintén tetraéder [[S (O) 3].
Reagál lúgokkal, ammónia-hidrátdal. Tipikus redukálószer, gyenge oxidálószer.
Minőségi reakció - a sárga-barna "jódvíz" elszíneződése. Közbenső termék a szulfitok és kénsav előállításában.
Gyapjú, selyem és szalma fehérítésére, gyümölcsök megőrzésére és tárolására használatos, fertőtlenítőszerként, antioxidánsként, hűtőközegként. Mérgező.
A H 2SO 3 (kénsav) vegyület nem ismert (nem létezik).
A legfontosabb reakciók egyenletei:
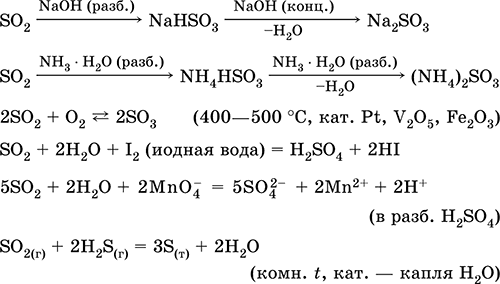
Feloldódás vízben és savas tulajdonságokban:
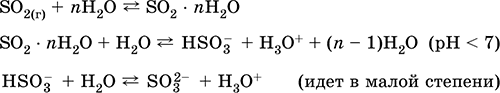
vétel: az iparban - az oxigénnel dúsított levegőben lévő kén égetése, és kisebb mértékben a szulfidércek pörkölése (SO 2 -val kapcsolatos gáz a pirit pörkölése során):
S + O 2 = SO 2(280–360 ° C)
4FeS 2 + 11O 2 = 2Fe 2O 3 + 8 SO 2(800 ° C, pörkölés)
a laboratóriumban - a szulfitok kénsavval való eltolódása:
BaS03 (t) + H 2SO 4 (konc.) = BaS04 ↓ + SO 2 + H 2 O
Nátrium-szulfit Na2S03. Oksosol. White. Amikor levegőn melegítjük, olvadás nélkül elbomlik, argon túlnyomás alatt olvad. Nedves állapotban és az oxigénre érzékeny oldatban. Vízben oldódik, anion által hidrolizálva. Savakkal bomlik. Tipikus redukálószer.
Minőségi reakció ion SO 3 2-on - fehér bárium-szulfit csapadék képződése, amelyet erős savakkal (HCl, HNO 3) adunk az oldatba.
Reagensként használják analitikai kémia, a fotográfiai megoldások összetevője, a klór semlegesítője a szövetek fehérítésében.
A legfontosabb reakciók egyenletei:
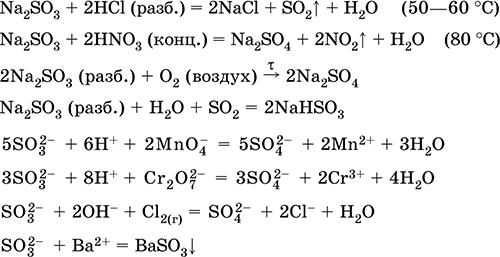
fogadása:
Na 2CO 3 (konc.) + SO 2 = Na2S03 + CO 2
Kénsav. szulfátok
Kénsav H2S04. Oxoinsav. Színtelen folyadék, nagyon viszkózus (olajos), nagyon higroszkópos. A molekulának torz тет tetraéderes szerkezete van (sp 3 гиб hibridizáció), kovalens σ-kötéseket tartalmaz, S-OH és σπ-kötéseket S = O. Az SO 4 2 ion ionja helyesen tetraéderes szerkezetű. Széles hőmérsékleti tartománya van a folyadékállapotnak (~ 300 fok). 296 ° C fölé melegítve részben lebomlik. Azeotróp keverékkel vízzel desztilláljuk (a savtömeg 98,3%, forráspont 296–340 ° C), teljesen lebomlik erősebb melegítéssel. Korlátlan keverékek vízzel (erős exo-effect). Erős sav oldatban, lúgos és ammónia-hidrátdal semlegesítve. A fémeket szulfátokká alakítja (normál körülmények között túlzott koncentrált savval, oldódó hidroszulfátok képződnek), de a Be, Bi, Co, Fe, Mg és Nb fémek a koncentrált savban passziválódnak és nem reagálnak vele. Reagál bázikus oxidokkal és hidroxidokkal, bomlik a gyenge savak sóit. Gyenge oxidálószer híg oldatban (H I miatt), erős - koncentrált oldatban (az S VI miatt). Jól feloldódik az SO 3 és reagál vele (nehéz olajos folyadék képződik - oleum, H 2 S 2 O 7-et tartalmaz).
Minőségi reakció SO4 2-ionon - fehér bárium-szulfát BaSO 4 kicsapása (a csapadékot sósav- és salétromsavoldatra nem alakítjuk át, ellentétben a BaSO 3 fehér csapadékkal).
Szulfátok és más kénvegyületek, ásványi műtrágyák, robbanóanyagok, színezékek és gyógyszerek előállítására használják szerves szintézisben, ipari szempontból fontos ércek és ásványi anyagok "megnyitására" (első feldolgozási szakaszában), kőolajtermékek finomítása, víz elektrolízise, ólom akkumulátorok elektrolitjaként . Mérgező, bőrégést okoz. A legfontosabb reakciók egyenletei:
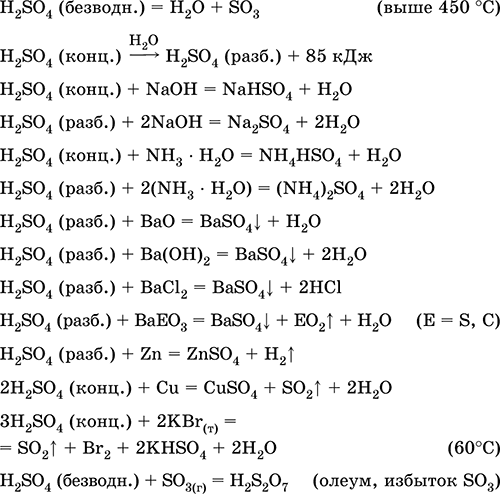
vétel a ipar:
a) kénből, szulfidércből, hidrogén-szulfidból és szulfátércből származó SO 2 szintézise:
S + O 2 (levegő) = SO 2(280–360 ° C)
4FeS 2 + 11O 2 (levegő) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, pörkölés)
2H 2S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (koksz) = CaO + SO 2 + CO (1300–1500 ° C)
b) az SO 2 SO 3-ra történő átalakítása a kontaktusban:
c) koncentrált és vízmentes kénsav szintézise:
H20 (Coll. H 2SO 4) + SO3 = H2S04(konc., anhyd.)
(a SO 2 előállítását tiszta vízzel a H2S04 előállításával nem végezzük a keverék erős melegítése és a H2S04 fordított bomlása miatt, lásd fent);
d) szintézis füstölő kénsav - vízmentes H 2SO 4, diszkarinsav H 2S 2 O 7 és felesleges SO 3 keveréke. A feloldott SO 3 biztosítja az olajmentes vízállóságot (a víz belépésekor azonnal keletkezik a H2S04), ami lehetővé teszi, hogy biztonságosan szállítsák acéltartályokban.
Nátrium-szulfát Na2S04. Oksosol. Fehér, higroszkópos. Elolvad, és bomlás nélkül forral. Kristályos hidrátot képez (ásványi anyag) mirabilit) könnyen elveszíti a vizet; műszaki nevet Glauber sója. Vízben oldódik, nem hidrolizálódik. Reagál H 2SO 4 (konc.), SO3. A hidrogén, a koksz fűtött állapotban van. Ez ioncserélő reakcióba lép.
Ezt üveg, cellulóz és ásványi festékek gyártására használják gyógyszerként. Sós tavak sóoldatában található, különösen a Kaszpi-tenger Kara-Bogaz-Gol-öbölében.
A legfontosabb reakciók egyenletei:
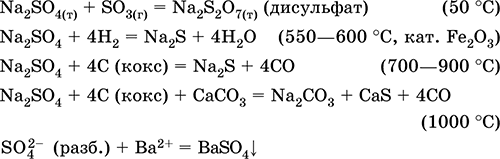
Kálium-hidroszulfát KHSO 4. Savanyú oxol só. Fehér, higroszkópos, de nem képez kristályos hidrátokat. Hevítéskor olvad és elbomlik. Jól oldódik vízben, az anion oldódáson megy keresztül, az oldat közeg erősen savas. A lúgok semlegesítik.
A fémkohászatban a fluxusok összetevőjeként, az ásványi műtrágyák szerves részeként használják.
A legfontosabb reakciók egyenletei:
2KHSO 4 = K 2SO 4 + H 2SO 4 (240 ° C-ig)
2KHSO 4 = K 2S 2O 7 + H20 (320–340 ° C)
KHS04 (hígítás) + KOH (konc.) = K2S04 + H20 KHS04 + KCI = K 2SO 4 + HCl (450-700 ° C)
6KHS04 + M203 = 2KM (SO 4) 2 + 2K 2S04 + 3H 2O (350-500 ° C, M = Al, Cr)
vétel: kálium-szulfát kezelése hidegben (több mint 6%) kénsavval
K2S04 + H 2SO 4 (konc.) = 2 KHSO 4
CaSO 4 kalcium-szulfát. Oksosol. Fehér, nagyon higroszkópos, tűzálló, bomlik kalcináláskor. A természetes CaSO 4 egy nagyon gyakori ásványi anyag formájában található gipsz CaSO 4 2H 2 O. 130 ° C-on a gipsz elveszíti a víz egy részét és belép égett vakolat2CaSO 4 H 2 O (műszaki név Alabástrom). Teljesen dehidratált (200 ° C) gipsz reagál az ásványi anyagra anhidritCaSO 4. Kis mértékben oldódik vízben (0,206 g / 100 g H20 20 ° C-on), az oldhatóság melegítéskor csökken. Reagál H 2 SO 4-val (konc.). A fúzió során a koksz kinyerte. A friss víz "állandó" keménységének nagy részét határozza meg (további részletekért lásd 9.2).
A legfontosabb reakciók egyenletei: 100–128 ° C
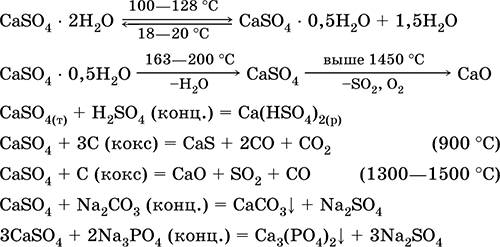
Ezt a nyersanyagot használják SO 2, H 2SO 4 és (NH 4) 2 SO 4 termelésében a kohászatban, a papír töltőanyagban. Az égetett gipszből előállított kötőhabarcs gyorsabban áll be, mint a Ca (OH) 2 alapú keverék. A keményedést a víz megkötése, a gipsz képződése kőtömeg formájában biztosítja. Az égetett gipsz a vakolat, az építészeti és dekoratív formák és termékek, a válaszfalak és a panelek, valamint a kőpadlók készítésére szolgál.
KAl alumínium-kálium-szulfát (SO 4) 2. Dupla oxol só. Fehér, higroszkópos. Erős hővel bomlik. Formák kristályos hidrát - alumínium-kálium-alumínium. Vízben mérsékelten oldódik, alumínium kation által hidrolizálva. Reagál lúgokkal, ammónia-hidrátdal.
Szövetként használják a szövetek színezésében, bőrbőr cseréjében, édesvízi tisztításban a koagulánsban, a papírméretek összetételében, valamint egy külső hemosztatikus szerben az orvostudományban és a kozmetikában. Az alumínium és kálium-szulfátok együttes kristályosításával képződik.
A legfontosabb reakciók egyenletei:
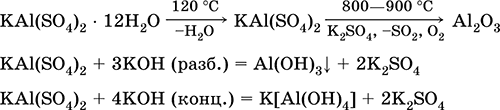
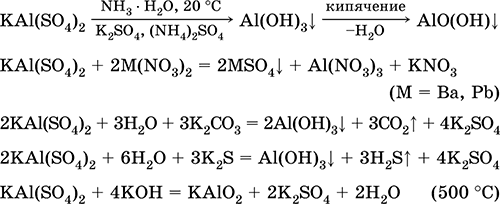
Króm (III) -szulfát - kálium KCr (SO 4) 2. Dupla oxol só. Piros (sötét lila hidrát, műszaki név kálium-alumínium). Ha melegszik, olvadás nélkül bomlik. Könnyen oldódik vízben (az oldat szürke-kék színe megfelel a 3+ akvakomplexnek), a króm (III) kation hatására hidrolizálódik. Reagál lúgokkal, ammónia-hidrátdal. Gyenge oxidálószer és redukálószer. Ez ioncserélő reakcióba lép.
Minőségi reakciók Cr3 + ioncsökkentés Cr2 + -ra vagy oxidáció a sárga CrO 2-2-re.
A bőr bőrkímélő anyagaként használatos, a szövetek festésében, a fényképezőgépben lévő reagensként. Króm (III) és kálium-szulfátok együttes kristályosításával képződik. A legfontosabb reakciók egyenletei:
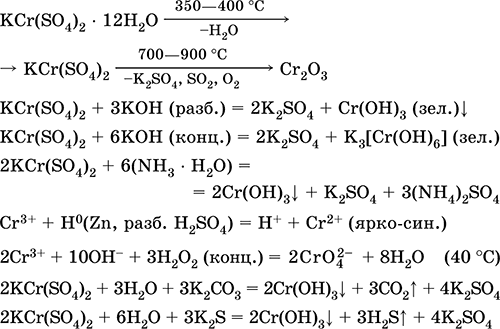
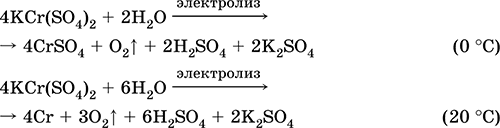
Mangán (II) -szulfát MnSO 4. Oksosol. Fehér, kalcinált, olvad és elbomlik. MnSO 4 kristályos hidrát 5H 2 O - piros - rózsaszín, technikai név mangán vitriol. Vízben oldódik, az oldat világos rózsaszín (majdnem színtelen) színe megfelel a 2+ akvakomplexnek; kation által hidrolizált. Reagál lúgokkal, ammónia-hidrátdal. A gyenge redukálószer reakcióba lép a tipikus (erős) oxidálószerekkel.
Minőségi reakciók az Mn 2+ ionhoz - az MnO 4 ionos vezetéshez és az utóbbi lila színének eltűnéséhez, az Mn 2+ oxidációjához MnO 4-re, és lila szín megjelenése.
Mn, Mn02 és más mangánvegyületek előállítására használják mikrotápanyagként és analitikai reagensként.
A legfontosabb reakciók egyenletei:
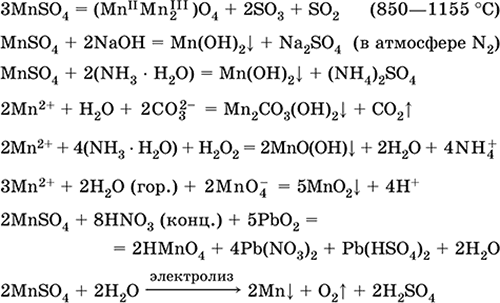
fogadása:
2M 2O 2 + 2H 2SO 4 (konc.) = 2 MnSO 4 + O 2 + 2H 2O (100 ° C)
Vas (II) -szulfát-FeSO 4. Oksosol. Fehér (fényes zöld, technikai név) vas vitriol),nedvszívó. Fűtés közben bomlik. Vízben oldódik, kation által kis mértékben hidrolizálva. Az oldatban oxigénnel gyorsan oxidálódik (az oldat sárgára változik és zavarossá válik). Reagál sav-oxidáló szerekkel, lúgokkal, ammóniahidráttal. Tipikus redukálószer.
Az ásványi festékek alkotórészeként, galvanizáló elektrolitok, faanyagvédő szerek, gombaölő szerek, anaemiaellenes szerek. A laboratóriumban gyakrabban Fe (NH 4) 2 (SO 4) 2 6Н 2 O (kétszer só) sónak tekintjük. sós mora) jobban ellenáll a levegőnek.
A legfontosabb reakciók egyenletei:
![]()
fogadása:
Fe + H 2SO 4 (bomlik) = FeSO 4+ H 2
FeCO 3 + H 2SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. VA-csoport nemfémek
Nitrogén. ammónia
nitrogén - a 2. periódus és a Periódusos rendszer VA csoportja, 7. sorszámú. Atom elektron elektron [2 He] 2s 2 2p 3, jellemző oxidációs állapotok 0, –III, + III és + V, ritkábban + II, + IV és stb.; Az N v állapotot viszonylag stabilnak tekintjük.
Nitrogén-oxidációs skála:
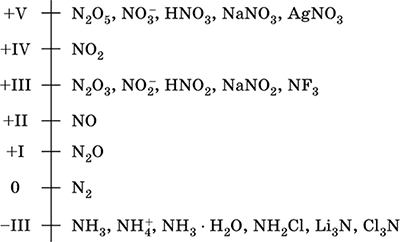
A nitrogén nagy elektronegativitással rendelkezik (3,07), a harmadik pedig az F és az O. A jellemző nemfémes (savas) tulajdonságokat mutatja. Különböző oxigéntartalmú savakat, sókat és bináris vegyületeket, valamint az ammónium-kation NH 4 + -ot és sóit képezi.
A természetben - tizenhetedik kémiai prevalencia elem (a nemfémek közül kilencedik). Fontos elem az összes szervezet számára.
Nitrogén N 2. Egyszerű anyag. Nem stabil polimer molekulákból áll, amelyek nagyon stabil σππ kötéssel rendelkeznek, ez magyarázza a nitrogén kémiai inertességét normál körülmények között. Színtelen, szagtalan gáz, amely színtelen folyadékká kondenzálódik (ellentétben az O 2-vel).
A levegő fő összetevője: 78,09 tömeg%, 75,52 tömeg%. A folyékony levegőből a nitrogén oxigén fölé forog. Kis mértékben oldódik vízben (15,4 ml / 1 l H20 20 ° C-on), a nitrogén oldhatósága kisebb, mint az oxigén.
Szobahőmérsékleten az N 2 csak lítiummal reagál (nedves atmoszférában), lítium-nitrid Li 3 N-t képezve, más elemek nitridjeit erős melegítéssel szintetizáljuk:
N2 + 3Mg = Mg3N2 (800 ° C)
Elektromos kisülés esetén az N 2 fluor- és nagyon kis mértékben oxigénnel reagál:
Az ammónia előállítására szolgáló reverzibilis reakció 500 ° C-on, 350 atm nyomásig és szükségszerűen katalizátor (Fe / F 2 O 3 / FeO jelenlétében) jelenlétében történik:
A Le Chatelier elvének megfelelően az ammónia hozamának növekedése a nyomás növekedésével és a hőmérséklet csökkenésével jár. Az alacsony hőmérsékleten a reakciósebesség azonban nagyon alacsony, így az eljárást 450-500 ° C-on hajtjuk végre, elérve az ammónia 15% -os hozamát. A reagálatlan N 2 és H 2 visszatér a reaktorba, és ezáltal növeli a reakció fokát.
A nitrogén kémiailag passzív a savak és lúgok tekintetében, nem támogatja az égést.
vétel a ipar - folyékony levegő frakcionált desztillálása vagy oxigén eltávolítása levegőből kémiai eszközökkel, például a 2C (koksz) + O 2 = 2CO reakcióval melegítéssel. Ezekben az esetekben nitrogén keletkezik, amely nemesgázok (főleg argon) szennyeződéseket is tartalmaz.
az laboratórium kis mennyiségű kémiailag tiszta nitrogén állítható elő mérsékelt melegítéssel kombinált reakcióval:
N-IIIH4Ni202 (t) = N 2 0 + 2H 2O (60-70 ° C)
NH4CI (p) + KNO2 (p) = N20 + KCI + 2H20 (100 ° C)
Az ammónia, salétromsav és más nitrogéntartalmú termékek szintézisére használják, mint a vegyi és kohászati folyamatok inert környezetének és a gyúlékony anyagok tárolásának.
Ammónia NH 3. A bináris vegyület, a nitrogén oxidációs foka - III. Színtelen gáz éles, jellegzetes szaggal. A molekula egy hiányos tetraéder szerkezete [: N (H) 3)] (sp 3 гиб-hibridizáció). Az elektron donor pár NH3 molekulájában lévő nitrogén jelenléte egy sp 3-hibrid orbitálisban a hidrogén kation jellegzetes addíciós reakcióját eredményezi, egy kation képződésével. ammónia NH 4 +. Nyomás alatt szobahőmérsékleten. A folyékony állapot a hidrogénkötések miatt kapcsolódik. Termikusan instabil. Vízben oldódik (több mint 700 l / 1 l H20 20 ° C-on); a telített oldat aránya 34 tömeg% és 99 térfogat%, pH = 11,8.
Nagyon reaktív, hajlamos az addíciós reakciókra. Az oxigénben keletkezik, savakkal reagál. Csökkenti (az N-III miatt) és oxidálódik (a H I miatt). Csak kalcium-oxiddal szárítva.
Minőségi reakciók - fehér "füst" képződése gáznemű HCl-vel érintkezve, a Hg 2 (NO 3) 2-es oldattal megnedvesített papír megfeketedése.
Közbenső termék a HNO3 és az ammóniumsók szintézisében. Szóda, nitrogén műtrágyák, színezékek, robbanóanyagok gyártásához használatos; a folyékony ammónia hűtőközeg. Mérgező.
A legfontosabb reakciók egyenletei:
vétel: in laboratórium - az ammónia ammóniumsókból történő kiszorítása nátrium-mészvel (NaOH + CaO) melegítve: \\ t
vagy vizes ammóniaoldatot forralunk, majd a gázt szárítjuk.
az ipar az ammóniát nitrogénből (lásd) hidrogénnel szintetizáljuk. Az ipar által gyártott vagy cseppfolyósított formában, vagy koncentrált vizes oldat formájában, technikai megnevezéssel ammónia víz.
Ammónia-hidrát NH3H20. Intermolekuláris vegyület. Fehér, kristályrácsban NH 3 és H 2 O molekulák, amelyeket H3N ... HON gyenge hidrogénkötés köt. Az ammónia vizes oldatában, gyenge bázisban (a disszociációs termékek - az NH 4 kation és az OH-anion) vannak jelen. Az ammónium kationnak rendszeresen π-tetraéderes szerkezete van (sp 3 - hibridizáció). Termikusan instabil, teljesen oldva az oldat forráspontja. Erős savakkal semlegesítve. A redukáló tulajdonságokat (az N III miatt) koncentrált oldatban mutatja. Belép az ioncserélés és a komplexáció reakciójába.
Minőségi reakció - fehér "füst" képződése gáz-hidrogén-kloriddal érintkezve.
Ezt egy gyenge lúgos közeg előállítására használják az amfoter hidroxidok kicsapása során.
Az 1 M ammónia oldat főleg NH3H20-hidrátot és csak 0,4% NH4 + és OH-ionokat tartalmaz (a hidrát disszociációja miatt); így az ionos „ammónium-hidroxid NH4OH” -ot gyakorlatilag nem tartalmazza az oldat, nincs ilyen vegyület a szilárd hidrátban. A legfontosabb reakciók egyenletei:
NH3H20 (konc.) = NH3 + H20 (NaOH-val forralva)
NH3H20 + HCl (bomlik) = NH4CI + H20
3 (NH3H20) (konc.) + CrCl3 = Cr (OH) 3 + 3NH 4Cl
8 (NH3H20) (konc.) + ΒBr2 (p) = N2 + 6NH4Br + 8H 2O (40-50 ° C)
2 (NH3H20) (konc.) + 2KMnO4 = N2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH3H20) (konc.) + Ag 2O = 2OH + 3H 2O
4 (NH3H20) (konc.) + Cu (OH) 2 + (OH) 2 + 4H 2O
6 (NH3H20) (konc.) + NiCl2 = Cl 2 + 6H 2O
A hígított ammóniaoldatot (3-10% - -) gyakran nevezik folyékony ammónia (a nevet az alkimisták találták ki), és a koncentrált oldatot (18,5–25%) ammónia víz (az ipar által gyártott).
