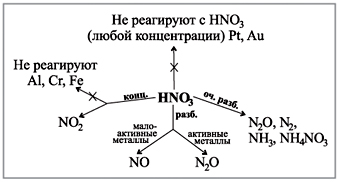
Egyenértékű reakciók, amelyek a hígított sósav erejét jellemzik. Táplálkozási vizsgálatok listája tudományágból
Olynyi farbák által festett régi festmények Pochorninya felülete a raktárba, melyben ólomepe (PbCO3) van, ami a víz légkörben való megjelenésén keresztül kapcsolódik a vastartalmú ólom-szulfid (II) kimutatásához. Ha a felületet víz-peroxiddal borítja, akkor a reakció fehér színű ólom(II)-szulfáttal jön létre:
PbS + 4H2O2 = PbSO4 + 4H2O.
Ily módon helyreállítani a régi képeket, amelyeket olyinyi farbák festettek.
Zasosuvannya kisnyu és sirki
Az élelmiszerek tárolási területét egy 61-es baba képviseli.
engedélyezze a vikoristovuvati yogót a fertőzésre vizet inni hogy a külföldi ipari szennyvizek; fertőtlenítőként az orvostudományban. Az ózon lesz a győztes az effúzió eredményeként.
Borok alkoholsav előállításához, sirnik készítéséhez, bengáli tüzek, küzdelmek a Silskoy állam iskolásaival és a betegségekben szenvedő gyermekek megsegítésére. Syrka, hogy ismerje a gumi, barvnik és pigmentek, darabszálak, luminoforok tárolását és in.
Kicsi. 61. Zasosuvannya sisnyu

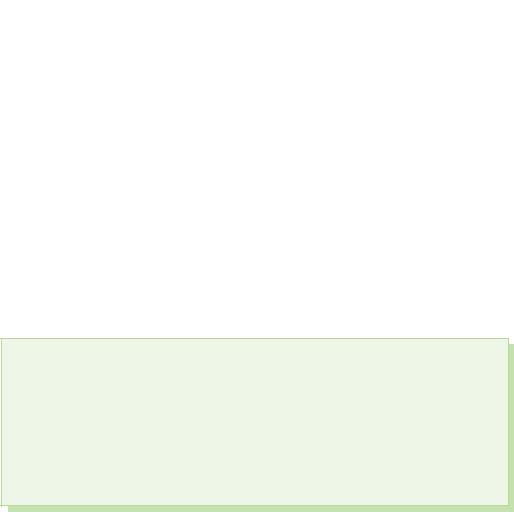
A felezési idejű savanyúság szempontjából a legjellemzőbb oxidációs lépések a –2, a kénatomok, a szelén és a teluru oxidációs lépései –2, +2, +4 és +6.
Az erő és a savanyúság oxidációja a fémekkel, vízzel és tettekkel, nemfémekkel való reakciókban nyilvánul meg.
Tápellátás és betáplálás
1. Tárolja a spoluk kisnyu s kalієm, kaltsієm és alumіnієm képleteket. Mutassa be az oxidált bőrelem lépéseit, és nevezze napnak.
2. Védje a syrka nagy részét az alumínium-szulfidnál.
3. A "kissen" név - Az oxigénium jelentése "scho rozhusav". Írd le kémiai képletek vіdomih savakat neked, a raktárba, aminek az elemet le kell rakni. Nevezze meg a savakat.
4. Milyen alotropikus módosításokat ismer? Milyen bűz származhat egyetlen dologból?
5. Az emberek által belélegzett Kisen a vér hemoglobinjával együtt elveszik. Úgy tűnik, az 1 g-os hemoglobin tömegét 1,35 cm térfogatban (n.u.) adjuk meg 3. Egészséges emberek vérében hemoglobin helyett 140 g / dm3. Zagalny vértérfogat - 6 dm3. Védd a savanyúság kémiáját, hiszen számíthatsz az emberek vérére.
6. A sósav visnaznit tömeghányada a tartományban, vízadagoláskor levágva térfogatban (n.u.) 8,96 dm 3 vízben masoyuval 500 g.
7. Razstavte teljesítménye támadó sémákban oxidbázisú reakciók:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
Van bőrreakciók oxidálódnak és dominálnak.
§ 39. Kisnevmіsnі spoluki sіrki
Van s'єdnannyakh s sirka viyavlyaє oxidációs szakasza+4 × +6.
Serca (IV) oxid. Tiszta sav
Szürke oxid (IV) - SO2 (tiszta gáz) - rúd nélküli, szúrós jellegzetes szagú gáz, amely forró víz közben fordul elő:
S + O2 = t SO2.

A pangást megtalálók egy része a megkövesedett zsíros erekhez volt kötve, amelyek megéghetnek. Jak az ókori történész, idősebb Plinij írása az 1. századtól a hangig. Vagyis „a tűz tüzének illata megőrizhet mindenféle varázst, és elűzhet minden tisztátalan erőt”. A szérum (IV) oxid fertőtlenítő és baktericid ereje időről időre gonosz lesz. A fehéres gázt a zöldségek, gyümölcsök és gyümölcsök feldolgozása során használják fel, hogy megakadályozzák azok rothadását.
Tiszta gáz kibocsátása víz közelében (legfeljebb 40 térfogat SO2 1 térfogat vízre) - nestiyka, kettős bázis sircle sav yaka isnu tilki roschiniben:
SO2 + H2 O H2 SO3.
A tiszta sav gyenge sav, vízkülönbségekben gyakran disszociál a hidroszulfit- és szulfitionok állításaitól:
H + + HSO-, | - H + + SO 2–. |
||||
A tiszta sav kémiai erő, zagalny a savak számára: kölcsönhatás bázikus oxidokkal, bázisokkal, reakciócserébe való belépés alacsonyabb savak sóival, zokrem, vitisnya sókból, gyenge sav:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Serky-oxid (VI)
Serca (VI) oxid van jelen, oxidáló szérum (IV) oxid van jelen katalizátor jelenlétében 500 C-hoz közeli hőmérsékleten:
t, kat.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Az extravagáns elmék számára a serky-oxid (VI) SO3 meddő vízforrás, amely 17 °C alatti hőmérsékleten kristályos szóvá alakul. Ez egy tipikus savas oxid, amely vízzel együtt erős savas savat alakít át:
SO3 + H2O = H2SO4.
Sirchana sav
A grafikus képlet egy kénsavmolekula modellje, és egy kis 62-re irányul.
Kicsi. 62. Sósav molekula grafikus képlete és modellje
Van tenyésztési kérdések sirchan savє erős elektrolit,
і її disoсіatsіyu forgatás így:
H2 SO4 → 2Н + + SO4 2–.
A sósav fizikai ereje
Сірчана sav - fontos (erősség 1,83 g / cm3), olajos, istálló nélküli, szagtalan. Vaughn bármilyen pillantással a vízhez megy.
A H2SO4 1 mol vegyszermennyiséggel történő meghatározásának folyamata 92 kJ hőmennyiségre vetődik, amely a kémiai reakciók hőhatásainak értékéhez igazítható. A sósav és a víz kölcsönhatása során fellépő nagy mennyiségű hő vizualizálása bizonyítéka a mikrogömbök létrejöttének két szónyi H2SO4 n H2O típusú hidráttal.
Például H2SO4 · H2O; H2S04 2H2O; H2SO4 3H2O stb.
az új sav és víz lehetővé teszi, hogy erőteljes vízhordozóként használják, például gázok szárítására.
Az összegek alakulása a sósav vízben történő eloszlatása esetén brikett formájában ellenőrizhető. Emlékszem rád nem adhatsz vizet a savhoz
tételt, majd az oldat megszakítás nélküli keverését, öntse a savat a vízbe.
Vidám tekintélyek citromsav. Sulfati
Sulfati. Hígított sirchan sav minden az erõs savakra jellemzõ: kicserélõdés a fémekkel, amelyek a tevékenység közepe és a víz között állnak; s bázikus amfoter oxidok, s bázisok és sók. Általában vannak szoli: közép - szulfát, például K 2 SO 4 і sav -
hidroszulfát, például KHS04.
A szulfátok és hidroszulfátok többségét a víz jól elvezeti, sok közülük engedélyezett kristályok... A sósav sók Deyaki kristályai és vitriolnak nevezik: citrus vitriol CuSO4 ∙ 5H2 O, fehér vitriol FeSO4 ∙ 7H2 O és ін.
A szerves savak és sók vízszinten történő leromlására különféle sók fejleszthetők:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
A reakció eredményeként bárium-szulfát ostroma következik be.
Laboratóriumi vizsgálat 6
A hígított sirchanoic sav vegyi hatóságának előírása
Öt kémcső használható: fém (cink vagy akár fém a rezgésmérőn), bázikus oxid, nátrium-hidroxid, nátrium-karbonát, nátrium-klorid. Adjon egy csepp fenolftaleint a nátrium-hidroxidhoz, és adjon neki egy cseppet. Öntsön 1-2 cm3 hígított szirupot egy bőrkémcsőbe. (Uvaga! A főoxiddal való reakció ellentétes a szabállyal, hogy fele alkohollal gyorsítsák fel a túlterhelést.)
Mit csinálsz? Milyen jelek utalhatnak a kémiai reakciók túllépésére? Tárolja a kémiai reakciókat molekuláris és ionos nézetben. Mi a helyzet az általad végzett oxidatív-vidnovnoy reakciókkal? Megjegyezni a hígított szirkánsav kémiai erejét.
Tömény sirchan savє erős oxidálószer, nem hígított. A koncentrált sirkánsav kölcsönhatásával
fémet nem lehet látni.
Z fémek, amelyek a víz aktivitása mellett állnak (az arany és a platina kivételével), a serky (IV) SO jóváhagyott oxidja elleni reakció 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2 O.
A vízig terjedő aktivitási tartományban lévő fémekkel való reakcióban a sav koncentrációja a víz oxidjává (IV) koncentrálódhat. fém és a reakció áramlása. Például:
4Zn + 5H2SO4 (fin) = t 4ZnSO4 + H2S + 4H2O.
Nagadaєmo, scho zalizo, alumínium és deyakі іnshi dobta a gonosz elméknek, hogy tömény sirchan savval legeltessenek.
A koncentrált syrchana sav jó az egyszerű szavakkal való interakcióhoz nemfémekkel, például a syrkoy-val:
S + 2H2SO4 = t 3SO2 + 2H2O.
Oxidáló bagato hajtogatás szerves spoluks, sirchan acid obgorta papir, szövet, fa, odyag that shkiru. Ez történik a treba koncentrált sirchansavával.
A koncentrált sirchansav illékony savak és sók eltávolítására használható. Például:
NaCl (TV) + H2 SO4 (konc) = t NaНSO4 + HCl.
A Bilorus sirchan Köztársaságban a savat a "Gomel Khimichny Plant" áfa, a "Grodno Azot" áfa forgalmazza.
A sav ivási területei
A szagot egy kis 63-nak mutatják be.
Kicsi. 63. A citromsav stagnálása
Сірчана sav H2 SO4 - fontos, szagtalan olajos ridin nélkül.
A szircánsavat fémekkel hígítják, amelyek az aktivitás és a víz között állnak; s fém-oxidok; az alapok; sóktól.
Ha tömény savval és fémekkel kölcsönhatásba lép, a víz nem látható.
A szerves savak és sók vízszinten történő leromlásához rosszindulatú a bárium sóinak formulázása.
Tápellátás és betáplálás
1. Írja fel a kén oxidjainak és savas savainak képleteit! Mutasd meg nekik a víz atomjainak oxidációs fokát!
2. Keresse meg a sirki tömegét, amely savanyúan ég, mivel egy hegyen 29,69 kJ hőt látunk. Sajtos mennyiségű sirka-oxid (VI) volt, amit kaptál? A tűzoltási reakció hőhatása 296,9 kJ / mol.
3. Sók, savak és bázisok maró táblázata vízben, adjunk hozzá 2 egyenlő reakcióelegyet hígított sósavból és sókból. Írd le a nevet
v molekuláris és ionos vigliád.
4. Védjük a masszát azzal a vegyszeres mennyiségű szulfátrúddal, amely sósavval hígítva nitrátoldathoz, 200 g-os rúddal, Ba (NO) tömeghígítással védhető. 3) 2 minden útra 10%.
5. Kérjük, a reakció alapján tekintse át a bekezdés szövegét, amely a tömény sósav kémiai erejét jellemzi. Indítsa el a víz atomjainak oxidációjának szakaszait az országban. A bőrreakcióban oxidálószer.
6. Tömény sósav yaky térfogata (= 1,83 g/cm 3) 98%-os H2SO4 tömeghányaddal a szükséges oldat 6,4 r tömeghez?
7. Növelje az oxidatív-fő reakciók beindítására szolgáló sémák hatékonyságát:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2 S + HClO → K2SO4 + HCl.
A bőrreakcióban oxidálószer.
40. § A termék kémiai reakciójának megértése
A beszédtömeg megőrzésének törvényével összhangban tárolt kémia lehetővé teszi a razrahunki, zokryuvat massu, obsyag chihichnuyu reakció termékének végrehajtását. A gyakorlatban nagyon sok reakció megfordul, a beszéd egy része az elpárologtatás, a megoldás vagy a melléktermékek jóváhagyásának eredményében vesz részt. Erről a reakciótermékről azt kell állítani, hogy kevesebb, az egyenlő reakció kialakulása előtt alig látni. Ilyen rangsorban, ha elméletileg elfogadjuk a termék tömegét az egyenlő reakcióhoz, vagy ha a termék kémiai mennyisége 100%, akkor a termékhez való valós folyamatban ez kevesebb lesz, mint 100%.
A reakció termékére való reakció kezdete a görög ábécé betűje (tsya), és ennek részeiben szerepel.
A kémiai reakció termékének típusa egy termék termékére (térfogatára, vegyi mennyiségére) nézve drága érték, amely ténylegesen termékre (terméknél vegyi mennyiségre) van levágva, a reakcióra számítva.
Minden esetben tudni fogjuk, hogy a kémiai reakció terméke szempontjából a legfontosabb. Például vidomo esetén a serky (IV) oxidált oxidjának serka (VI) oxidjává történő reakciójához.
2SO2 + O2 2SO3
vikhid 80%-ossá (vagy 0,8) lesz, ami azt jelenti, hogy körülbelül 64 g tömegű szürke oxid (IV) (térfogat 22,4 dm3, kémiai mennyiség 1 mol) és elfogadható szürke oxid (VI) tömeg nem 80 g (térfogat 22,4 dm3, vegyszer mennyiség 1 mol), tömeg 80 g ∙ 0,8 = 64 g (térfogat 17,9 dm3, vegyszer mennyiség
Az áruk nagyságától a valós folyamatokig további műveletek és műveletek bevezetésére van szükség.
Könnyen átlátható a rózsafüzér csatolásának képe a „reakció termékéhez jutás” fogalmából.
készlet 1. A 48 g tömegű szürkelúg sózása eredményeként 28,6 dm3 térfogatú kén-oxidot (IV) távolítunk el. Vizualizálja a reakcióterméket.
m (S) = 48 g | 1. Vizuálisan sajtos számú mag, |
||||
V gyakorlati (SO2) = 28,6 dm3 | reakcióba lépett: | ||||
Kisasszony) | |||||
(SO2) =? | n (S) | ||||
KISASSZONY) | 32 g/mol |
||||
2. A serka (IV) oxid raktári reakciója: S + O2 = SO2.
3. Ismerjük a szerky-oxid (IV) elméleti mennyiségét:
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
A kémiai reakció termékének bevitelének megértése |
4. Ismerjük a szerky-oxid (IV) elméleti elemzését:
V elmélet (SO2) = n elmélet (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Rozrakhumo vikhid a reakciótermékhez:
Válasz: A gyógyszerre adott válasz 85%.
2. függelék Adja meg a FeS2 tömegét, amely a 8,96 dm3 térfogatú serky (IV) oxid eltávolításához szükséges ahhoz, hogy a reakciótermék 90%-os legyen.
V (SO2) = 8,96 dm3 | 1. A szerky-oxid (IV) vizuálisan jelentős elméleti kicserélődése: |
|||||||||||
(SO2) = 90% | V gyakorlat | V gyakorlat | ||||||||||
m (FeS2) =? | Csillagok V elmélet = | |||||||||||
V elmélet | ||||||||||||
Vtheor (SO2) = | V gyakorlat (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Ismerjük a szürke oxid elméleti kémiai mennyiségét (IV): |
||||||||||||
n elmélet (SO 2) | V elmélet (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3 / mol |
||||||||||||
3. Raktári reakció a sirka (IV) oxidjára és a pirit vegyi mennyiségére, amelyet a vipalnak kell adni:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2O3, 4 mol 8 mol
x = 0,2 mol.
3. A vipalhoz szükséges pirit tömege alapján: m (FeS2) = 0,2 mol · 120 g / mol = 24 g.
Javaslat: a sirka-oxid (IV) betartásához 24 g tömeget kell venni.

A kémiai reakció termékének típusa egy termékre (csontszár, vegyi mennyiség) a ténylegesen vágott termékből termékre (zabpehely, vegyszermennyiség) a reakcióra számolva drága érték. Forduljon meg részein odinitsi chi vidsotkah.
Tápellátás és betáplálás
1. Miért kell egy reakciótermékre adott gyakorlati választ kevesebb, elméletileg alacsonyabb biztosítási fedezetnek nevezni az egyenlő reakcióért?
2. A víz és a víz kémiai reakciója (1 mol) a vizet 0,85 mol kémiai mennyiségben állítja be. Vizualizálja a reakcióterméket.
3. A 200 g tömegű klorid sósavból történő kölcsönhatása eredményeként 100 g tömegű szulfát válik ki.
4. Keressen egy térfogatot (n.u.) és a szürke oxid (IV) kémiai mennyiségét, amelyet 64 g égetett maggal állapítanak meg, mivel a reakciótermék 75%.
5. Számítsa ki az elégetett víz tömegét, ha a szürke (IV) oxid mennyiségét 89,6 dm térfogattal (n.u.) csökkentjük 3-nak az elméletileg lehetséges 80%-ává kell válnia.
6. Úgy tűnik, a serky (VI) vikhid-oxidja, a serky (IV) oxidált oxidja során levágva,
út 85%. A reakcióba bevitt szerky-oxid (IV) tömege, térfogata (n.o.) és kémiai mennyisége alapján, amikor a (VI) oxidot 2,24 dm3 térfogattal (n.u.) távolítják el.
7. Először indítsa el a só tömegfrakcióját a roschiniben, desztillálva 3,2 g tömegről, a szirupos savakban 192 g tömegű, ha a reakciótermék 85%-os lesz.
41. § Nitrogén és foszfor
A nitrogén-nitrogén és a foszfor P rothad a VA csoport periodikus rendszerében. A periódusos rendszerek egész csoportja bemutatja a Mis'yak As-t, a surma Sb-t és a bizmut Bi-t. A nitrogén és a foszfor є nemfémekkel, hozza a mish'yak-ot és a surmat a fémekhez, és a szennyeződést a fémekhez.
Budova atomіv az oxidáció azon szakasza
A VA csoport atomi elemei egyenként 5 elektronnal rendelkeznek a legfontosabb energiaszinthez;
7 N ↓ | 15P ↓ |
Zavdannya.
- Chim viklikana ilyen változás? Milyen teljesítményen kell a dikromátot az edény krómösszegébe ültetni?
- Öntsünk egy kémcsőbe 5-6 csepp kalcium-dikromátot és 3 csepp sósavat. Adjunk hozzá 2 csepp jodidot a kaliyu-hoz, és adjunk hozzá 10 csepp vizet a kémcsövek helyett. Tegyen át egy kis részt egy tollal a kémcsőbe ahelyett, hogy egy csepp keményítőt adna hozzá. Chi zm_nilosya zabarvlenna keményítő? Miért? Rivnyannya OVR és vzvnyannya elektronikus módszer.
- A 15 R elem kezdeti karakterisztikája. A foszfor allotróp módosulásának ereje. A foszfor cseréje egyszerű és összecsukható szavakkal.
A gyógyszertárban a higany(II)-oxid stagnál, mint alacsonyabb fertőtlenítőszer a főzéshez kenőcsök, hogyan lehet sok hígított nátrium-hidroxidot nyerni a higanysók alapján.
Zavdannya.
1. Írjon fel egy konkrét reakciót higany(II)-oxidra! Magyarázza el, miért szükséges a temryaván műveleteket végrehajtani?
3. A kémia alaptörvényei.
A Vikoristannya spoluk cink az orvostudományban ezen a fanyar, fertőtlenítő kialakításon alapul. 0,25% razchin cink-szulfát vykorytutsya szemcseppek készítéséhez egyszerre 2% -os bórsavval.
Zavdannya.
- Készítsen 0,25%-os cink-szulfát oldatot 100 ml térfogattal (ρ = 1,02 g / ml).
- Zd_ysniti revízió
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Kovalens láncszem, viznennya, lásd, a megvilágítás mechanizmusa, az erő. Vegyérték. A színpad oxidálódik.
· Gyógyszerész a zaliza gyógyszer minőségének ellenőrzésére a permanganatometria módszerével.
Zavdannya.
1. Egyenlő válasz és oktatás írása elektronikus módszerrel.
2. Számítsa ki, mekkora térfogatú, 0,5%-os láb (ρ = 1,004 g/ml) méretű nátrium-hidroxid szükséges a 0,1 M klorid (III) 20 ml térfogatú oldatával történő reakcióhoz!
3. Periodikus törvény, hogy periodikus rendszer a napfénynél az atom Budovájáról.
· Zalizo, felújított, mely belsőleg stagnál vele szemben, de medi, vugilla, kovasav, mis'yaku szulfidos házakból is látszik.
Zavdannya.
1. Javasolja a háztól való megszabadulás módját. Obruntuvati vidpovid.
3. A kémiai hangok fő típusa. A természet vidám hangot ad ki.
· A szervezet permanganát є szemekkel, їkh zeshkozhennya, hogy végezzen 3%-os vizes oldat H 2 Pro 2 savas savval.
Zavdannya.
1. Írj egy gyakori reakciót! Az elektronikus módszerrel történő válaszadás szintje
- Oxydi, viznachennya, osztályozás, nómenklatúra, ereje és a megszállottság módszerei.
· A készítményben szereplő szavak számát permanganatometriai módszerrel határozzuk meg, Fe2+-t használunk az Fe3+-vá történő oxidációhoz. A nátrium-permanganát mennyiségének meghatározására megújuló megoldásokat alkalmaznak fűtés és 0,1 N oldatos hűtés során.
Zavdannya.
1. Írja le a standard reakciókat, amelyek az alapdefiníció alapját képezik.
2. Készítsen elő 200 ml 0,1 n KMnO 4-et (a készítmény értékének egyenértékűségi tényezője).
3. Savak, viznachennya, osztályozás, nevezéktan, hatalom, a megszállottság módjai.
· A közeg gyógyszerkönyvi nitrát készítése mellőzendő: a salétromsav hígításából származó ásványi-közeg ötvözet oldata, a házak nitrát eltávolításának megtisztítása érdekében sósavval kicsapni. Az ostromot ennek eredményeként a savas környezetben cinkkel vezetik be, középen pedig nem a házakból, ismét salétromsavban.
Zavdannya.
- Írj egy sort a gyakori reakciókról!
- A Cl-, Br-, J anionra adott pozitív reakciók azonosítása közepes nitrát bázison, amely az alapja a készítmények kloridokban, jodidokban, bromidokban való érvényességének igazolásának kalóriában.
- Bemutatás, viznachennya, osztályozás, nómenklatúra, hatalom, a megszállottság módjai.
9. A közeg nitrátja stagnál eróziók, fordulatok, kötőhártya-gyulladás állapota esetén viglyadákban 2,5 és 10% vizes oldatok.
Zavdannya.
- Készítsünk 2%-os méretű AgNO 3-ot 50 ml térfogatban (ρ = 1,015 g/ml). Hány esze jutott a különbségnek?
- Zd_ysniti revízió
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, osztályozás, nevezéktan, hatalom, a megszállottság módjai.
· A gyógyszerésznek kell elvégeznie a gyógyszerkönyvi készítmény azonosítását szulfátrúddal.
Zavdannya.
1. Hogyan használhatom a vikoriszt-szulfátot az orvostudományban? Miért kell a bárium-szulfátot nátrium-karbonáttal ötvözni az azonosítási reakciók elvégzése előtt? Bizonyíték a hasonló reakciók megerősítésére.
2. BaSO4, CaSO4, Na2SO4 sók azonosítási reakcióinak vikonálása.
3. Összetett spoluks, viznachennya, budova A. Wernernél, a kémiai hang természete, osztályozása, nevezéktan, disszociáció. Komplex megoldások stagnálása az orvosi és kémiai elemzésben.
· Gyógyszerész tömény amiaku oldattal, amely lehetővé teszi a biztonságtechnika durva tönkretételét - fokozott tapadás nélkül vezette a robotokat a lovag fejénél.
Zavdannya.
- Milyen öröklődéseket tud elérni, ha koncentrált amiaku-választékkal dolgozik anélkül, hogy érintené a biztonságtechnikát? A yak pershu orvosi segítség fizetése szükséges az amiak páros eltávolításakor.
- Zdіsniti így átépítése.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
Megírni a megfelelő reakciókat a molekuláris és ionos nézethez, valamint az OVR-hez - az elektronikus egyensúly módszerének szintjét.
- Kémiai kinetika. A kémiai reakciók sebessége. Rugalmas tényezők infúziója a kémiai reakciók sebességére.
· A gyógyszerben lévő nitrogén stagnál az ammónia mennyiségében a vízben, ammóniumsókban, nitrogén-monoxidban és nátrium-nitritben.
Zavdannya.
- Mit kezdjek a nitrogén tisztelettel? Írja le az adott beszédek és egyenlő reakciók képleteit, amelyek a főhatalmat jellemzik!
- Írjon rіvnyannya reakciót nátrium-nitrát és kalcium-permanganát között a savanyú közepén. A reakció felismerése a reakció módszerével
- Nem alkuképes és vérfarkasok kémiai reakciók... Khimichna Rivnovaga. Mac-jog ugyanolyan fontos rendszerekhez. Rivnovagi állandó. Le Chatel elve.
· A sók nátrium-szulfáttal, nátrium-kloriddal, nátrium-hidrogén-karbonáttal történő azonosítását a gyógyszerésznek kell elvégeznie.
Zavdannya.
- Viconatie reakciók SO 4 2-, Cl-, HCO 3- ionokra.
- Rosrahuvati, a Na 2 SO 4 · 10H 2 O krisztallohidrát grammos mennyisége szükséges ahhoz, hogy a gyógyszerész 500 g mennyiségű vizet távolítson el, a Na 2 SO 4 mennyiségének 5%-át?
- Oxidációs vezető reakciók. Az oxidatív-vitális reakciók elektronelméletének főbb rendelkezései. Nayvazhivіshі oxidáló és vezető figurák. Zrivnyannya-oxid-vidnovnykh reakciók az elektronikus egyensúly módszerével és az ion-elektronikus módszerrel.
Kaliєva sіl sіrchanoіy sav és sok idegen készítmény felvitele a szervezet számára (xenobiotikumok) - lіkuvalny gyógyszerek Ez az anyagcsere néhány nem okos beszéd – konjugátum – kijelentésein alapul, mivel könnyen átvihető a szervezetbe.
Zavdannya.
- Otrimatyvu sіl sіl sіlchanoic sav normál módon, vikoryuchi az asztalon a reagens. Írj egy sort a gyakori reakciókról!
- A molekuláris reakciók köre, amelyek ilyen gyors forgási sebességgel forognak:
S 2- + H 2 S → 2HS -
S2- + 2H+ → H2S
HS - + OH - → S 2– + H 2 O
· Diszperziós rendszerek, megnevezés, osztályozás. Szuszpenziók, aeroszolok, emulziók. Vikoristannya durván szétszórt rendszerek az orvostudományban és a gyógyszerészetben.
A gyógyszerésznek el kell távolítania az 5%-os szirkánsav oldatot.
Zavdannya.
- Milyen az SO 4 2 anion oxidatív állapota savkoncentrációban? Írja le a megfelelő reakciókat a hígított és tömény sav erejének jellemzésére!
- Készítsen elő 5%-os erősségű szikánsavat, 50 ml szirkánsavat és 30%-os H 2 SO 4 tömeghányadot.
- Kolosszális különbségek, osztályozás, megnevezés, molekuláris-kinetikai hogy az optikai erő, az elutasítás. Kolosszális különbségek stabilitása. Alvadás. Peptizálás. Budova micel. Dializ.
· Сірка, scho bejutni az aminosavak raktárába, oxidálni a szervezetben. Egy egész endogén sirchan sav gondoskodik az idegen korpaspoluch - fenol, krezol, indol - sorsáról.
Zavdannya.
- Ismertesse a savas sav erejét, és írja felül a savakkal való robotika szabályait!
- A Rosrahuvati-t, amely 25%-os H 2 SO 4 tömeghányadú és 1,18 g / ml-re sűrített szikánsav térfogatú, 50 ml térfogatú kalcium-hidroxid semlegesítésére kell bevenni, 12% KOH tömeghányaddal. és vastag 1,1 g / ml.
- A döntés igazsága, értéke, fő megértése, napjától a döntés folyamatáig. Diffúzió. Ozmózis. Ozmotikus satu.
· Az ipari körzetekben, ahol sok a víz, nem könnyű savdeszkát szerezni.
Zavdannya.
- Shho itt van vegyipari raktár acid táblák qikh területeken? Jak vin színlelni? Írj egy egyszerű reakciót!
- A korai sók molekuláris és gyors hidrolízise:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Sirvododen, hogy bejusson a természetbe rengeteg dolog biológiai folyamatok fejlesztésére, és a pro-ásványvizekben zajlanak.
Zavdannya.
- A hatalom ereje.
- Zd_ysniti revízió:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Írj egy egyszerű reakciót a molekuláris és ionos megjelenítőre.
- Savak, bázisok, sók, víz disszociációja. Sav-bázis rivnovaga in razchiny. Ionny dobutok vodi, pH-oldatok.
· A sirki є sirka hivatalos drogja, bevonva (Sulfur praecipitafum).
Zavdannya.
- Mutassa be a bor erejét és az olaj alotrop módosulatait!
- Zd_ysniti revízió:
Zr_vnyati reakciók az elektronikus mérleg módszerével.
- Hydroliz. Érzékenység a hidrolízis folyamatára. Különböző típusú sók hidrolízise. A hidrolízis lépése. Új faktorok infúziója a hidrolízis szakaszaiba.
A gyógyszerész azonosítási reakciót hajt végre 3%-os peroxid-peroxid oldatból: legfeljebb 1 ml hígított sósav, 1 ml hígított sósav, 1 ml éter és 0,5 ml kalcium-dikromát oldat. a sósav koncentrációja a savban 6
Zavdannya.
- Viconati reakció a víz-peroxid azonosítására.
- Szabványt írni a víz-peroxid és az egészség közötti különbség azonosítására elektronikus mérleg módszerrel.
- A VII-es csoport fej pidcsoport és a spoluk elemeinek általános jellemzői. Orvos- biológiailag értelmes halogén
· Kisen – a GF által leírt gyógyszerészeti termék. Yogo zasosovyut a különböző savanyú éhség inhalálására.
20. Zavdannya.
- Írja le a megfelelő reakciókat a CO, 2, NO, NO2 kimutatására!
- Megírni az r_vnyanyya reakciókat, amelyek a savanyúság elutasításának laboratóriumi módszerének alapját képezik. A reakciók indukciójának szintjei az elektronikus mérleg módszerével
- Klór, klóros víz, sósav, klorid. A klór és a másik fele fizikai és kémiai ereje. A halogének orvosi és biológiai jelentősége.
· A nátrium-klorid, nátrium-bromid és nátrium-jodid alapú gyógyszerek gyógyszerészi felülvizsgálata.
Zavdannya.
- Bármilyen célra felhasználható a só a gyógyszertárban és a gyógyászatban.
- Vykonati yakіsnі reakciói anionokon Cl-, Br-, J-.
- A savas klór fizikai és kémiai ereje. Otrimannya. Zasosuvannya.
· A jód eltávolításának egyik ipari módszere a gyógyszeriparban az a folyamat, amikor a fúróvizekből jódot vonnak ki. A fúróvizek közelében lévő Yodidi a következő séma szerint oxidálódik:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Zavdannya.
- Jak jódkészítmények és hogyan ragadjunk le az orvostudományban.
- Megtanulni a reakciót, megalapozni a jód megszállottságát napivreaktsii módszerrel.
- A kalkogénekre jellemző Zagalny. Savanyú az erő, hogy yogo spoluk. Orvosi és biológiai jelentés
· Gyógyszerész viznacha referencia gyógyszerek nátrium-klorid, kalcium és kalcium.
Zavdannya.
- Bármilyen célra, vikoriszt és gyógyszerészeti készítmények.
- Adott sók azonosítási reakcióinak Viconati.
- A spolukit megsavanyítom vízzel. A víz fizikai és kémiai tekintélyei. Peroxid víz, energia, tárolás a gyógyászatban. A víz jelentése az élőlények életében.
· A savanyú zuzmó-hipokloritokat tartalmazó Zi spoluk halogének fertőtlenítésük miatt az orvostudomány érdeklődési körébe tartoznak.
Zavdannya.
- A hipokloritok erején alapul? Írj egy sort a gyakori reakciókról!
- Rosrahuvati, néhány gramm klórvapnát kell venni 2 liter aktív klór eltávolításához.
- Sirka és її spoluki. A vilnoy sirka alotropia. A víz, víz, víz, sav és sók fizikai és kémiai ereje.
· A zagylé savasságának hiánya esetén belsőleg hígított sósavat kell használni.
Zavdannya.
- Olvassa el újra a savakkal való robot alapvető szabályait.
- Rosrahuvati, 36,5% -os sósavoldat (ρ = 1,19 g / ml) palackban, és elkészítéséhez 100 ml-t kell venni. 8,2% (ρ = 1,040 g/ml) sav.
- A víz-oxidok, a szűz sav és a szerves sav fizikai és kémiai tulajdonságai. Szulfitok. Sulfati. Hatalom, birtoklás, birtoklás.
· A gyógyszertárban van az egyik standard megoldás є oldat, ahol 33%-os kalcium-acetát adagolható, amely 30%-os - szerves sav alapú - kalcium-karbonát oldattal adagolható.
Zavdannya.
1. Írjon egyenlő reakciót a molekuláris és ionos nézőre!
- Az V. csoport fejcsoport elemeinek főbb jellemzői. A nitrogén ereje. A nitrogén értéke az élőlények életében.
· A beszéd különbségeinek előírása, amely erős bázis és gyenge sav. A GFH jak stabilizátor megrendeléséhez 0,1 n nátrium-hidroxid-oldatot szállítunk 4 ml/1 liter oldat méretben.
Zavdannya.
- Írjon példát a CH3COONa só hidrolízisének reakciójára!
- Rosrahuvati, néhány gramm NaOH-t figyelembe kell venni, 500 ml 0,1 n-es mérettel. A biztonságtechnikai megoldások széles skálájának elkészítése.
- Amiak. Só ammónia. Erőteljesség. Stagnálás az orvostudományban és a gyógyszerészetben.
· Egy gyógyszerész elkészített egy kenőcs receptjét: 1 g kalcium-karbonát és 0,5 g nátrium-tetraborát 70 ml desztillált vízben, 10 g sztearin fúzió 15 g vazelin olajjal és vékony sugárban, miközben a rózsát meleg karbonátba keverjük. vízzel. ...
Zavdannya.
- Hány szót fogadtak el a múltban? Yake a középső ember, hogy mit tegyen? Bizonyíték a hasonló reakciók megerősítésére.
- Készítsen techno-kémiai vagit a robotoknak. Tartson tiszteletben 1 g kalória-karbonátot a techno-kémiai teresseken.
- Oxid nitrogénné. Salétromsav és sók. Fizikai és kémiai hatóságok. Orvosi és biológiai érték nitrogénnel
A gyógyszerésznek 0,05%-os permanganátot kell készítenie 200 ml térfogatban az üres száj és torok öblítéséhez.
Zavdannya.
- Milyen hatalommal lehet a cali runtuet yogo politikai akciót állandósítani? A Yaki spoluksyu mangán stagnál ivás céljából?
- A KMnO 4 gramm mennyiségének eltávolításához 0,05% KMnO 4 (ρ = 0,9994 g / ml) szükséges. 200 ml eltávolításához. Mutassa be az adott tartomány megszerzésének technikáját!
- Budova salétromsav molekulák. A salétromsav és sói fizikai és kémiai ereje. Mediko - a nitrogén és a spoluk biológiai értéke.
A Pharmaceuticals higany(II)-oxidot tartalmaz, amely fertőtlenítőszerként gonosz, és a nátrium-hidroxidot a higany (II) hígított sói formájában bocsátja ki.
Zavdannya.
1. Írjon fel egy konkrét reakciót higany(II)-oxidra! Milyen reakciókat kell végrehajtani a temryaván?
3. A kémia alaptörvényei.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
A nadkrómsav, amely egyben megtalálható, a H 2 CrO 6 a kék színek közé tartozik. A sav utántöltés szinergiája és a Н2О2 készítmény támogatása.
Zavdannya.
- Zrіvnyati tsyu reakció elektronikus módszerrel.
- Milyen króm okozhat oxidatív hatást, és mi a helyzet vele?
- A foszfor, a foszfor-oxidok és a foszforsavak ereje és birtoklása. A foszfor gyógyászati és biológiai értéke
· A magnézium-oxid (85%) és a magnézium-peroxid (15%) є egy készítménnyel, "magnézium-peroxid"-nak nevezzük, amelyet bélrendszeri váladékok pangására használnak.
Zavdannya.
- Magyarázza el az antacid és baktériumölő gyógyszert. Bizonyíték a hasonló reakciók megerősítésére.
- Rosrahuvati, néhány gramm MgO-t és MgO 2-t kell bevennie 100 g készítmény elkészítéséhez. Tartson be 10 g magnézium-oxidot a technokémiai terézeken.
- A fej pidcsoport IV csoportjának elemeinek általános jellemzői. Budova, Fizikai erő alotrop a szénben. Egy erős ember vidám ereje a szénben.
· Öblítse le a nátrium-hidrokarbonátot (igyon szódát), hogy álljon a viglyadi öblítésnél, mossa meg, amikor a szem felgyullad, a felső dichny nemesek nyálkahéját.
Zavdannya.
- Antiszeptikus hatású a nátrium-hidrogén-karbonát erejére? Bizonyíték a hasonló reakciók megerősítésére. Mi használható antiszeptikumként a nátrium-tetraborát Na 2 B 4 O 7 ∙ 10H 2 Pro-val?
- Készítsünk 50 ml 5 térfogat%-os NaHC03 oldatot (= 1,036 g/ml).
- Molekulák budovája, a savas spoluk fizikai és kémiai ereje szénben. Mediko - biológiai jelentése a szénben, amely spoluk.
Savkötő készítményekben, amelyek a nátrium-hidrogén-karbonáton állnak bosszút, vicoristovy fiatal betegség esetén, amelyet a savasság felügyel, tobto. acidózis.
Zavdannya.
- A só árának mekkora erejéig használjunk savlekötő szereket? Bizonyíték a hasonló reakciók megerősítésére. Milyen beszédet vásárolhatsz a céljaidhoz?
- Zd_ysniti revízió:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Írj egy egyszerű reakciót a molekuláris és ionos megjelenítőre.
Viconati reakció Na 2 CO 3 → NaCl → NaNO 3.
- Szilícium, hogy jógo spoluky, ismeri a természetet, az elutasítást, a fizikai és kémiai erőt. Mediko - biológiai jelentése szilícium.
· Az AgNO 3 eltávolításakor 2,5%-os NaCl oldatot használnak belsőleg a zagy mosására.
Zavdannya.
1. Miért használjak NaCl oldatot? Bizonyíték a hasonló reakciók megerősítésére.
3. A harmadik csoport fejcsoport elemeinek általános jellemzői. A hatalom unalmas, hogy yogo spoluk. Orvosi és biológiai jelentősége az orvostudományban.
· Ritka lykarsky formák tenyésztésére, ін'єкцій, ін'кцій, vikoristovyut іzotonіchny rozchin jelek.
Zavdannya.
1. Mi is az izotóniás különbség? Miért hívják izotóniásnak?
3. Alumіnіy hogy yogo spoluky, hatalom, elutasítás. Az alumínium orvosi és biológiai jelentősége.
· 3%-os vizes oldat peroxid víz zasosovyat jak zovn_shn_y baktericid zasib.
Zavdannya.
1. Milyen alapon baktericid és vérgerincölő a vízperoxid alapú. Milyen külföldi látogatásokra kell ügyelnie, ha utazik?
2. Rosrahuvati, ifj. perhidrolt (30%-os Н 2 Pro 2 vizes oldata, ρ = 1,1 g / ml) kell venni 500 ml 3%-os oldat eltávolításához (ρ = 1,005 g / ml). A biztonsági technológiának megfelelő megoldások széles skáláját készítse elő.
3. A fej pidcsoport ІІ csoport fémei. Zagalny jellemző, elutasítás, fizikai és kémiai erő. Só kalcium és magnézium. A víz keménysége. Usunennya zhortkosti vodi. A fejcsoport elemeinek orvosi és biológiai jelentősége II.
· Az aggregátummal történő gyógyszergyártás jelenlegi gyógyszeripara, a diszpergált rendszerek típusa, a szervezetbe való bejuttatás módja.
Zavdannya.
1. Milyen rendszereket nevezünk szórt rendszernek?
Hogyan osztályozzuk a szórt rendszereket?
Tartalmaznak kábítószert a viglyadi szétszórt rendszerek? Konkrét csikkeket hozzatok.
- Otrimati kutya hidroszol a razchinnik cseréjének módszerével.
- Idegen fémek lényeges jellemzői, birtoklása, fizikai és kémiai ereje. Naivazhlivіshі poluchny metalіv. A fém gyógyászati és biológiai értéke
A viglyadі víznél razchinіv іznіh beszédek kezdenek pangó rіdki lykarski formi, scho újra változtathatom a különbséget.
Zavdannya.
- Spravzhn_ razchini, razchinn_st, uszítás, nem pusztítás, razchini túlnépesedés. Milyen bürokraták vannak?
- Készítsen elő 100 ml (ρ = 1,051 g/ml) 5 térfogatszázalékos CuSO 4 razinokat CuSO 4 ∙ 5H 2 O citrus vitriollal
- A kezdeti jellemző d - elemek. Fém bitenkénti pidgroup І csoport és їkh spoluk. Orvosi és biológiai jelentősége.
· Oroszországban a gyümölcslé és az alacsony létartalmú friss zöld és kreatív sziruvin elektromos feldolgozása folyik: bogyók, gyümölcsök, zöldséggyökér, zöldségek kis organizmusai, a gyümölcslevek megjelenése (belső természetes) segítségével. A belső vmist kolosszális különbség a téglák között, nukleinsavak, szénhidrátokban, tanninokban
Zavdannya.
1. Önt „kolosszálisnak” hívják? Jak bűz minősíteni? Olvassa el újra a kolosszális különbségek erejét. Milyen folyamatok alapulnak a növekvő sziruvinából származó nedvekről?
2. Otrimálja a hidroszolt a sóoldat (III) hidroxidjával a FeCl hidrolízisének módszerével 3. Írja fel a rügyek diagramját!
- A fémek bitenként a második csoportba tartoznak, a jellemzés, a fizikai, a fizikai és a kémiai erő. Orvosi és biológiai jelentősége.
A macskagyökér kivonat alapú tabletták elkészítésekor nem ajánlott napovnuvach bázisként magnézium-karbonátot használni, mert lehetséges az izovaleriánsav semlegesítése és a valtrát savas kivonata.
Zavdannya.
1. Ismertesse a magnézium-karbonát erejének megnyilvánulását! Írj egy egyszerű reakciót a molekuláris és ionos megjelenítőre. Hogyan lehetek győztes a valerian kivonatú tabletták elkészítésében?
2. Zd_ysniti revízió:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Írj egy egyszerű reakciót a molekuláris és ionos megjelenítőre.
3. A szekunder pidcsoportok VI, VII csoportjai elemeinek általános jellemzői. A króm, a mangán és a spoluk oxidatív ereje. Orvosi és biológiai jelentősége.
· Zrіdzheny szénsavban gáz vikoristovyuyut a gyógyszerészeti virobniztvі a viluchennya biológiailag aktív beszédet lіkarskoy roslinnoy sirovini.
Zavdannya.
- A szén-dioxidban milyen teljesítményre válik a gáz tsikh célokra barázdává?
- Zd_ysniti revízió:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Reakciók a molekuláris és ionos nézővel való információcserére.
- A VIII. csoport elemeinek általános jellemzői a bitenkénti pidcsoporté. A lélek ereje az a yogo spoluk. Orvosi és biológiai jelentősége.
Táplálkozási vizsgálatok listája tudományágból
A kémia törvényeinek fő megértése. Boldog születésnapot az atomnak.
Periodikus törvény és periodikus rendszer D.I. Mengyelejev az atom fényében.
Viznachennya, nézd meg, gondold át a kémiai hang természetét.
A kovalens kapcsolat értéke, megvilágítási mechanizmusa, ereje. Vegyérték. A színpad oxidálódik.
Oxydis: a megszállottság megnevezése, osztályozása, nómenklatúrája, ereje és módszerei.
Savak: viznachennya, osztályozás, nómenklatúra, hatalom és birtoklási módok.
Beadványok: vízumok, besorolás, nómenklatúra, hatalom és a megszállottság módszerei.
Soli: a megszállottság megnevezése, osztályozása, nómenklatúrája, ereje és módszerei.
Komplex spoluksok: viznachennya, budova Wernernél, tipi, nevezéktan.
A kémiai reakciók sebessége. Tisztviselők, scho beadják a kémiai reakció érzését.
Nem reverzibilis és reverzibilis kémiai reakciók. Khimichna Rivnovaga. M. Chatel elve. Rivnovagi állandó.
Oxidációvezető reakciók: érték, alapismeretek, napi oxidáció és megújulás, új oxidáció és ólomreakciók.
Diszperziós rendszerek: jelölés, osztályozás. Durván diszpergált rendszerek: szuszpenziók, aeroszolok, emulziók.
Kolosszális különbségek: érték, hatalom, megszállottság, budova micel.
Valódi döntések: érték, alapvető megértés, nap mint nap a megoldási folyamatig. Diffúzió. Ozmózis. Ozmotikus satu.
Az elektromos disszociáció elméletének főbb rendelkezései. Az elektromos disszociáció mechanizmusa. A lépés a disszociáció állandója.
Savak, bázisok, sók disszociációja. Víz és pH-oldatok disszociációja.
A hidrolízis hiánya. Különböző típusú sók hidrolízise. A hidrolízis lépése.
A VII. csoport főcsoport elemeinek elsődleges jellemzői. A halogének orvosi és biológiai jelentősége
Klór, klóros víz és sósav. Elutasítás, hatalom. Chloridi.
Kisnevi spoluki klór.
A kalkogénekre jellemző Zagalny. Kisen, hogy yogo spoluki. Orvosi és biológiai jelentés
Vlastivosti spoluk savanyú víz (víz, víz-peroxid). Zastosuvannya N 2 Pro 2 a meditól. A meghajtó értéke.
Syrka. A vilnoy sirka alotropia. A világ vidám tekintélyei. Sirvoden. Sósav és sói.
Víz-oxidok, tiszta és tiszta savak, tiszta és tiszta savak sói és mások fizikai és kémiai ereje.
Az V. csoport fejcsoport elemeinek főbb jellemzői. Azonos teljesítményű nitrogén.
Az ammónia és az ammóniasók ereje. Stagnálás az orvostudományban és a gyógyszerészetben.
Oxid nitrogénné. Salétromsav és sók. Fizikai és kémiai erő, tárolás.
A salétromsav fizikai és kémiai ereje. nitrát. Mediko - a nitrogén és a spoluk biológiai értéke.
A 15. R. Vilny-foszfor elem jellemzői: alotropia, fizikai és kémiai erő, birtoklás.
Fosfin. Foszfor-oxid és foszforsav: hatalom, birtoklás. A foszfor gyógyászati és biológiai értéke
A fej pidcsoport IV csoportjának elemeinek általános jellemzői. A szénben: a szénben lévő alotropok fizikai ereje, kémiai ereje.
Kisnevy spoluky a szénben: budova molekulák, fizikai és kémiai erők. Mediko-biológiai jelentése a szénben, amit spoluk.
Spoluky szilícium: természetismeret, elutasítás, fizikai és kémiai erő. Mediko - biológiai jelentése szilícium.
A harmadik csoport fejcsoportja: az elemek főbb jellemzői. A yogo spoluky határa: elutasítás, fizikai és kémiai erő, tárolás az orvostudományban.
Alumínium és jógo spoluky: megszállottság, fizikai és kémiai erő. Az alumínium orvosi és biológiai jelentősége.
A II. csoport fej-pidcsoportjának fémei: jellemzés, megszállottság, fizikai és kémiai erő. Só kalcium és magnézium. A víz keménysége. Usunennya zhortkosti vodi. A fejcsoport elemeinek orvosi és biológiai jelentősége II.
Pocsolyákat dobtak: a jellemzés, birtoklás, hatalom, navazhliv spoluk. Orvosi és biológiai jelentősége.
A d-elemek jellemzése kezdeti. Fém bitenkénti pidgroup I. csoport. Podnannya mіdі, sіbla. Orvosi és biológiai jelentősége.
A második csoport fémei: Budovia jellemzése, fizikai és kémiai erő. Orvosi és biológiai jelentősége.
A VI, VII csoportok másodlagos csoportjai: a csoport elemeinek általános jellemzője, a króm, a mangán ereje és spoluk. Orvosi és biológiai jelentősége.
A VIII. csoport csoportjára mutatva: a csoport elemeinek általános jellemzői, e csoport ereje. Orvosi és biológiai jelentősége.
Ustatkuvannya. A tudósok előtti bőrasztalon egy óraterv, a salétromsav és a fémek kölcsönhatásának diagramja, egy sor reagens, a mellékelt anyag tesztje.
Oxid nitrogénné
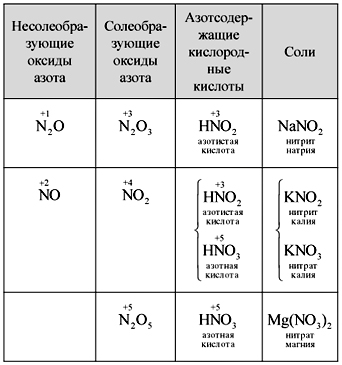
Vchitel.Találd meg, hogy írd le a nitrogén-oxidok képletét. Az oxidokat sóképzőnek vagy nem sósnak nevezik? Miért?
A tudósok egymástól függetlenül felírják öt nitrogén-oxid képletét, elnevezik őket, kitalálják a nitrogénnel kevert savanyú savakat, és megfogalmazzák az oxidok és savak közötti formát. Az egyik tudós felírja az adagot (táblázat).
asztal
Nitrogén-oxidok, savak és sók pótlása
Információ bemutatása:
nitrogén (IV) oxid kölcsönhatása vízzel
Vchitel. Legyen hajód s NEM 2 Van dagály és dagály a vízben, a lakmusz vip tesztje helyett.
Ki sposterіgaєmo? Rosechin chervonin két savan keresztül, rendben van.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Nitrogén oxidációs lépés NEM 2 ajtó +4, tobto. nyert ipari mіzh +3 і +5, mint a merevség szintjén, hogy a nitrogén (IV) oxidot két sav - nitrogén és nitrogén - formába hozzuk.
Raktár ta budova molekulák
Vchitel.A salétromsav molekulaképletének felírásához számítsa ki a molekulatömeget és az oxidált elemek állapotát. Tároljon szerkezeti és elektronikus képleteket.
A tudósok ilyen képleteket fogalmazzanak meg (1. ábra).
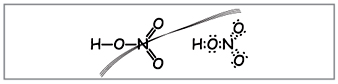
Vchitel.A képletek száma szerint a nitrogén köré tíz elektron tekerhető, ami nem lehet vörös, mert A másik periódusban nitrogén található, és amennyire csak lehet, az újabbnál az utolsó labdán nem biztos, hogy több elektronika van. A szuperfrekvencia asszimilálódik, mintha elengedné, de a nitrogénatom és a savban lévő egyik atom között kovalens kapcsolat jön létre a donor-akceptor mechanizmus mögött.(2. ábra).
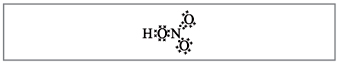
Kicsi. 2. A salétromsav elektronikus képlete.
Az elektron- és nitrogénatomot fekete pontok jelölik
A salétromsav szerkezeti képlete a következőképpen vezethető le(3. ábra) :
Kicsi. 3. A salétromsav szerkezeti képlete
(a donor-elfogadó jelzések sávja csatárral)
Azt azonban az előző út hozta, hogy az allink egyenlően oszlik meg két kisnyatom között. Az oxidált nitrogén szintje a salétromsavban drága +5, és a vegyérték (vadállati tisztelet) drága, több, mint az elektronikus fogadások választéka.
A salétromsav fizikai ereje
Vchitel.Itt van egy üveg hígított tömény salétromsav. Ismertesse a fizikai erőket.
A tudósok leírják, hogy a salétromsav jak ridina fontos a víz szempontjából, rágós színű, szúrós szagú. Razchin salétromsav színtelen és szagtalan.
Vchitel. Dodam, salétromsav forráspontja +83 °C, fagypont –41 °W, tobto. a tse ridin szellemes elméi számára. Csípős szag és olyanok, amelyek kiszedésekor azt magyarázzák, hogy a sav kis mennyiségű fényben koncentrálódik, vagy hevítve gyakran összeesik.
A saverő kémiája
Vchitel. Találd ki, milyen kifejezések cserélik fel a savakat?(Tudományos név.)
Mielőtt reagenseket használna, jósolja meg a reakciók listáját, és írja le figyelmeztetéseit (a TED-lámpánál az igény felírásának reakcióit).
És most a salétromsav sajátos erejével tápláljuk magunkat.
Políroztunk, de a sav a zbergannі zhovtіє esetében most egy kémiai reakciót hajtunk végre:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Tudományosan a reakció elektronikus egyensúlyának önálló rögzítésére.)
"Buri gáz"(NO 2) farbu sav.
Különösen a sav redukálódik fémekké. Tudod, hogy savakból dobták ki a vizet, különben nem vész el a salétromsavval való kölcsönhatás során.
Csodáld meg az ábrát, amely a partikon van, megmutatja, hogyan jelennek meg a gázok a sav és a koncentráció fémekkel való reakciója során.(Robot diagrammal.)
Információ bemutatása:
tömény salétromsav kölcsönhatása közeggel
Még hatékonyabb a salétromsav (tömény) reakciójának demonstrálása a táptalaj porával, vagy a dart hozzáadásával kis mézdarabokkal:
Tudományosan a reakció elektronikus egyensúlyának önálló rögzítésére:
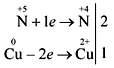
A sav megszállottsága
Vchitel. A lecke érthetetlen lesz, mivel a salétromsav táplálkozása nem látható.
Laboratóriumi módszer: diya tömény sósav nitráttal (5. ábra).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Promislovostі-nál sav a bázikus birtokában amilyen módon.
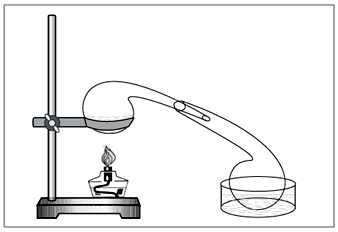
Kicsi. 5. A salétromsav laboratóriumi eltávolításához
kézzel szedett vikoristovuvati régimódi vegyszeres edények - retort
A sav nitrogénnel és savval 2000 ° C-ig (elektromos ív) történő fenntartásának módszerét nem szélesítik ki különösebben.
Oroszországban a salétromsav eltávolításának története Ivan Ivanovics Andreev (1880-1919) kémikus-technológus nevéhez fűződött.
Vin 1915-ben p. Az első ammóniás savanyító berendezés megnyitása és a dezintegrációs eljárások gyári méretekben való megvalósítása 1917-ben p. Az első építőipari üzem Donyeck közelében.
Az egész módszer néhány lépésből áll.
1) Oktatási, társadalmi rendezvények előkészítése.
2) Az amiaku kisnem povitrya oxidációja platina cittszon:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Tovább oxidálva nitrogén-oxiddá (II) nitrogén-oxiddá (IV):
2NO + O2 = 2NO2.
4) Nitrogén(IV)-oxid meghatározása víz- és savtartalomból:
3NO2 + H2O = 2HNO3 + NO.
A folyamat sav jelenlétében könnyen végrehajtható, az összes nitrogén (IV) oxid salétromsavvá alakul.
5) Következtetések a salétromsav eltávolításának szakaszáról - a gázok, például a légkör tisztítása oxidból nitrogénné. Cich gázok raktára: 98% nitrogén, 2-5% sav és 0,02-0,15% nitrogén-oxidok. (A nitrogént az ammónia forrásából veszik fel, az ammónia oxidációjához veszik fel.) Ha ezekben a gázokban a nitrogén-oxidok 0,02%-nál nagyobbak, akkor speciálisan katalitikusan nitrogénné frissítik, így kevés nagy probléma van. .
A táplálkozás összes említett böjtje írta: és mihez kell a sav?
Szívó sav
Vchitel.A salétromsav rossz hatással van a virobnittingre: jó nitrogén, és mindenekelőtt aminosav só (hogyan lehet megszállni?); vibukhovy beszédek (miért?); barvnikiv; nіtratіv, arról, hogyan lehet a támadó szinten.
Záróanyag
Frontális tapasztalat az osztály számára
- Miért +5 az oxidált nitrogén szintje a salétromsavban, és a chotiri vegyértéke?
- Nem lép be a salétromsav a fényes fémekkel való reakcióba?
- Sósavat és salétromsavat kell venni, három fém van az asztalon - méz, alumínium és cink. Hogy érted?
Teszt
1.opció
1. Hány szám kapcsolódik az elektronok eloszlásához a nitrogénatom energiaszintjeihez?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Fejezd be a gyakorlati reakciók gyakorlatiasságát:
1) HNO 3 (rózsaszín) + Cu ...;
2) Zn + HNO3 (tömény) ...;
3) HNO 3 + MgCO 3...;
4) CuO + KNO 3….
3. Általános szabályként mutassa be a folyamat egyik szakaszát ígéreteket salétromsav.
1) 4NH3 + 5O2 = 4NO + 6H20;
2) 5HNO 3 + 3P + 2H 2O = 3H 3PO 4 + 5NO;
3) N 2 + O 2 = 2 NO.
4. Az oxidáció negatív lépései az alján lévő nitrogénben nyilvánulnak meg:
1) N20; 2) NEM; 3) NO 2; 4) Na3N.
5. A mézforgács és a tömény salétromsav kölcsönhatása a jóváhagyásig:
1) NO 2; 2) NEM; 3) N2; 4) NH3.
2. lehetőség
1. A nitrogén vegyértéke egy:
1) 1; 2) 2; 3) 5; 4) 4.
2. Írja fel a tömény salétromsav lehetséges kölcsönhatását az előrehaladó fémekkel: nátrium, alumínium, cink, zalizo, króm!
3. Rezgő beszéd, mint például a salétromsav sziruvinye:
1) nitrogén és víz;
2) amіak, néha az a víz;
3) nitrát.
4. A tömény salétromsav nem lép reakcióba:
1) szén-dioxid gáz;
2) sósav;
3) szénben;
4) hidroxid rúd.
5. Még hígított sav és magnézium kölcsönhatása esetén úgy kell tenni, mintha:
1) NO 2; 2) NEM; 3) N20; 4) NH 4 NO 3.
Beszámolók 1.opció. 1 – 4;
3 – 1; 4 – 4; 5 – 1. 2. lehetőség. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Trivneviy zalik fonó 11 osztály
Téma: " FÉMEK "
Óra forma: zalik
Tsil: átgondolni az ösztöndíjak ismereteit a következő témában: "Nem fémek"; nyilvános információkat elsöprő erők nemfémek és spoluk; a nem szabványos és élethelyzetekre vonatkozó ismeretek megfogalmazásának elősegítése a helyettesítő és differenciált vállalkozásokból.
Zavdannya:
1. A közkincs átdolgozása és a nemfémekkel és a їkh spolukkal kapcsolatos tanulmányok ismereteinek lezárása; vegyük a fejlesztést a félrevezető logika és a volodya kémia szemszögéből; az átmenet az anyag formális-logikai elfogadásáról a képletesen logikus üzenetre a fejlett, megvalósítható és nem szabványos épületek segítségével.
2. Razvinuvicki kímél, felderít kegyelmet, újraéleszti a gyárat, vvdinya smukot lát, tényeket fog fel, hú, ez logikus a gonosz gondolatokhoz és robotokhoz; vchiti rozmіrkovuvati, robiti pripuschennya, előrejelzés.
3. Fogadja el a fő vizuális ötletek megfogalmazását a tudósok kognitív tevékenysége és alkotói önállósága révén.
4. Vihovuvati vmіnnya pratsyuvati önuralom önuralomtól. Mutasd meg a linkeket azoknak, akik az életben élnek. Vihovuvati tudományos svitoglyad a hatalmak összekapcsolása alapján, hogy budovi.
A reagensek kezelése: kémcsövek, alkohollámpák, kémcsövek, syrnik és raschini: ; ;
; ;
;
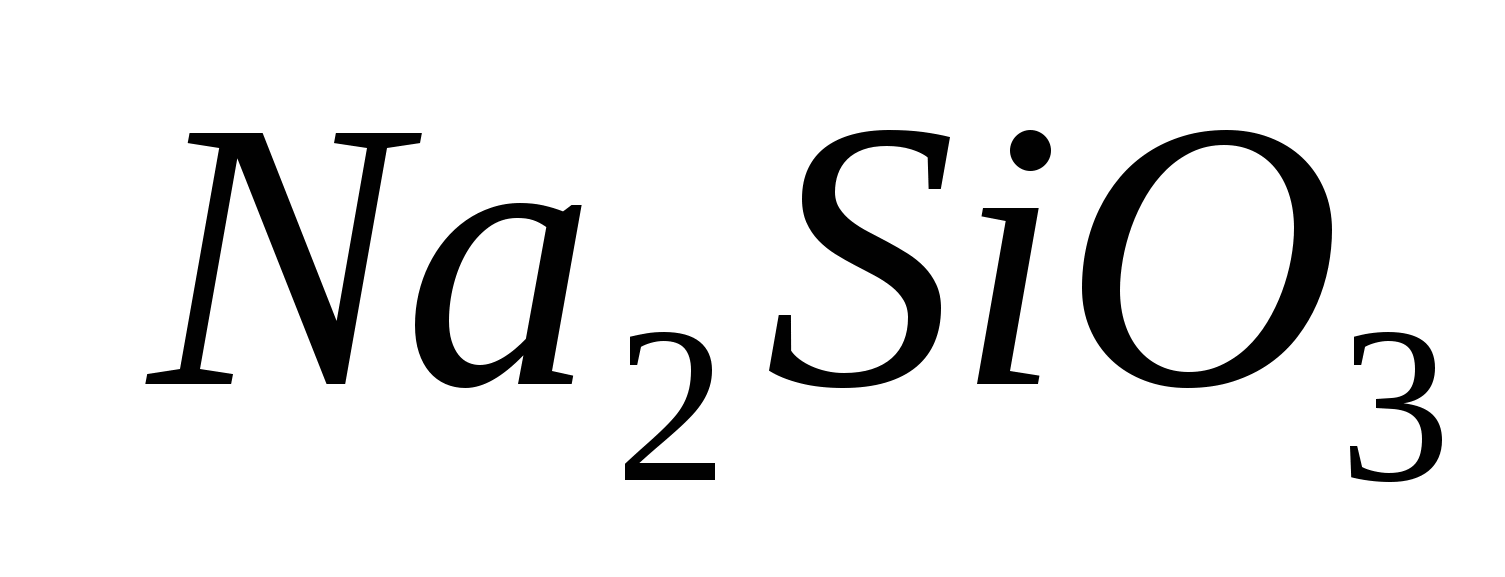 .
.
Felkészülés a bejárat előtt.
A tanár a kezdeti típusok hajtogathatóságának három szintjét készítette elő: teszt, elméleti táplálkozás, szavak megértése és fejlesztése.
A tanár készen áll arra, hogy oktasson, mert felülvizsgálja a csapatot.
1-2 napra tájékoztató lapot küldenek az irodába.
Az útvonallap a bőrön látható. A lépcsőkön lévő robotok diagramja az útvonallapokon látható.
ÚTVONALLAP.
F.І. tudós
Nevezze el a lépést
A szakaszok ütemezése
Regisztrációs szám
A visszavonás aláírása
Rozrakhunkov probléma
Rosp_znavannya
Reinkarnáció
Menj a leckére.
A tudósok útvonallapokkal, 5 üres lappal, tollal lépnek be az osztályba, és mennek a lépésre, az 1-es szám értékeire. A tudósok felveszik az összehajthatóság tudását, és visszatérnek az új betűhöz, ha alszol, a színpadon a "szavak megjelölése".
A roboton a skin szakaszt 7 - 8 tollal vezetik be, a vistavlyát az útvonallap rivnjává alakítva, sz.
A becslés az összes szakasz számtani átlagaként jelenik meg.
KIEGÉSZÍTŐ
"A beszédek elismerése"
1 hasított
1. Győződjön meg róla, hogy tudja 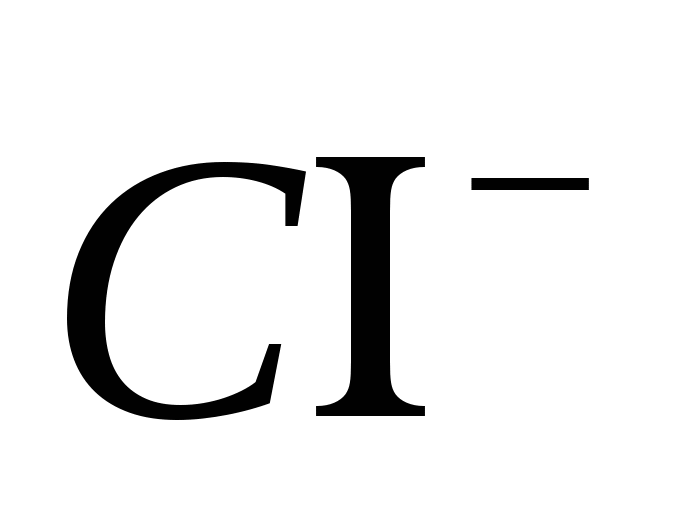
2. Győződjön meg arról, hogy az Ion tiszta 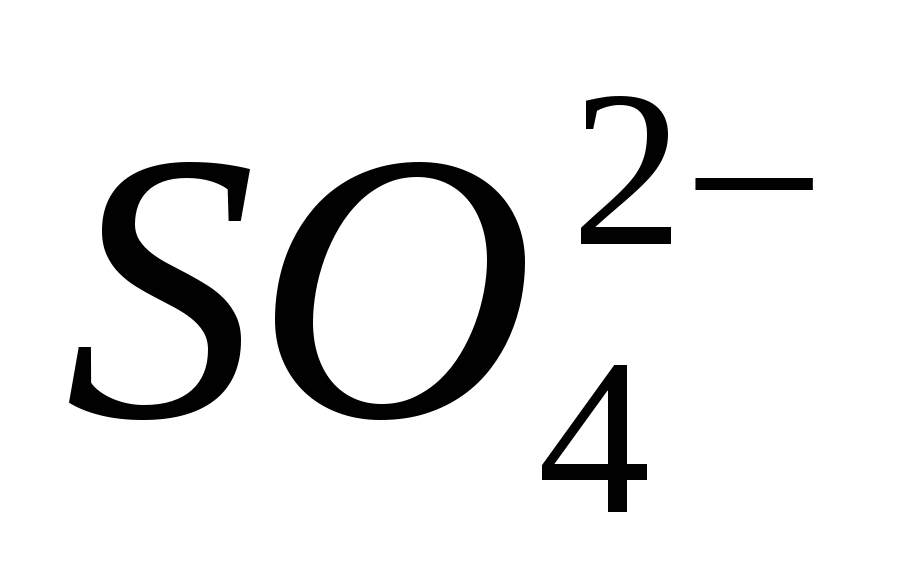
3. Győződjön meg arról, hogy az Ion tiszta 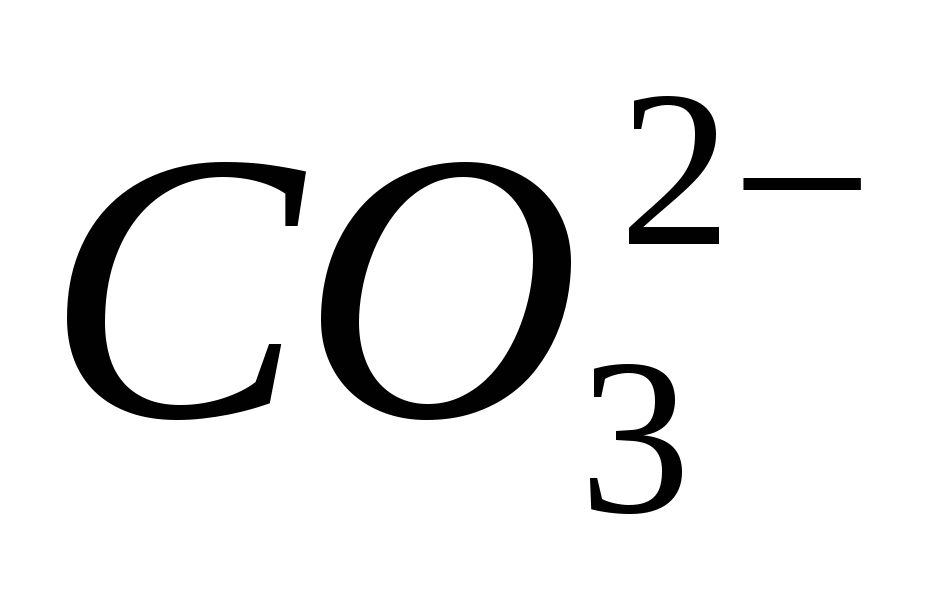
4. Tedd egyértelművé 
5. Győződjön meg arról, hogy az Ion tiszta 
2 hasított
1. Határozza meg a különbségeket egy reagens között:
2. Határozza meg a különbségeket egy reagens között:
3. Határozza meg az egyik reagens mögötti különbségeket:
4. Határozza meg az egyik reagens mögötti különbségeket:  ;
;
5. Határozza meg a különbségeket egy reagens között:
3 rіven
1. Tervezés további jóváhagyáshoz szükséges reagensek nélkül:
2. Tervezés további reagensek nélkül jóváhagyásra:
3. Tervezés további reagensek nélkül jóváhagyásra:
4. Tervezés további reagensek nélkül jóváhagyásra:
5. Tervezés további reagensek nélkül jóváhagyásra:
Koppintson a „Beszéd felülvizsgálata” elemre
1 hasított
1. Fejezd be a standard reakciókat
2. A rutin reakciók befejezéséhez
3. Fejezd be a standard reakciókat
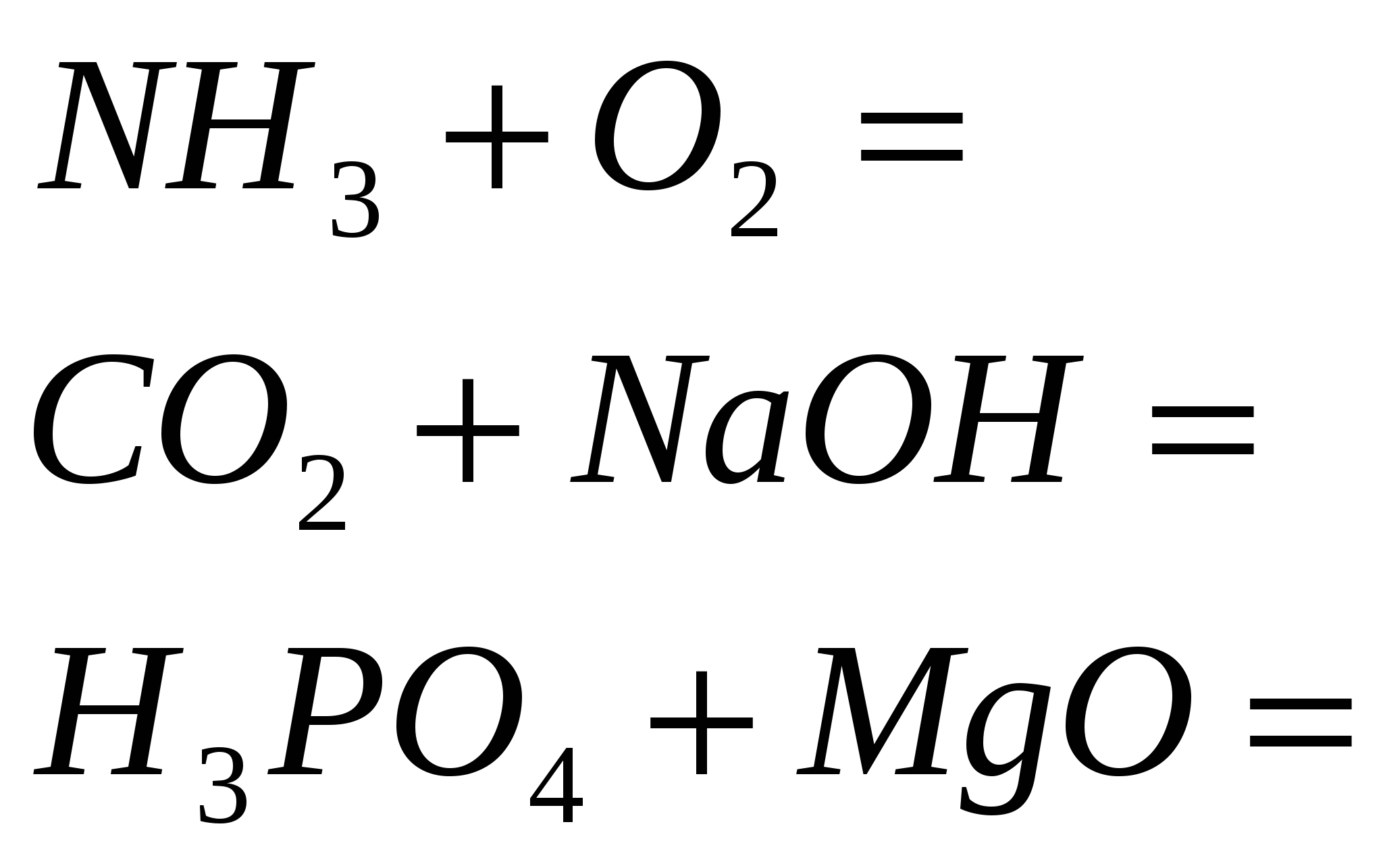
4. Fejezd be a standard reakciókat
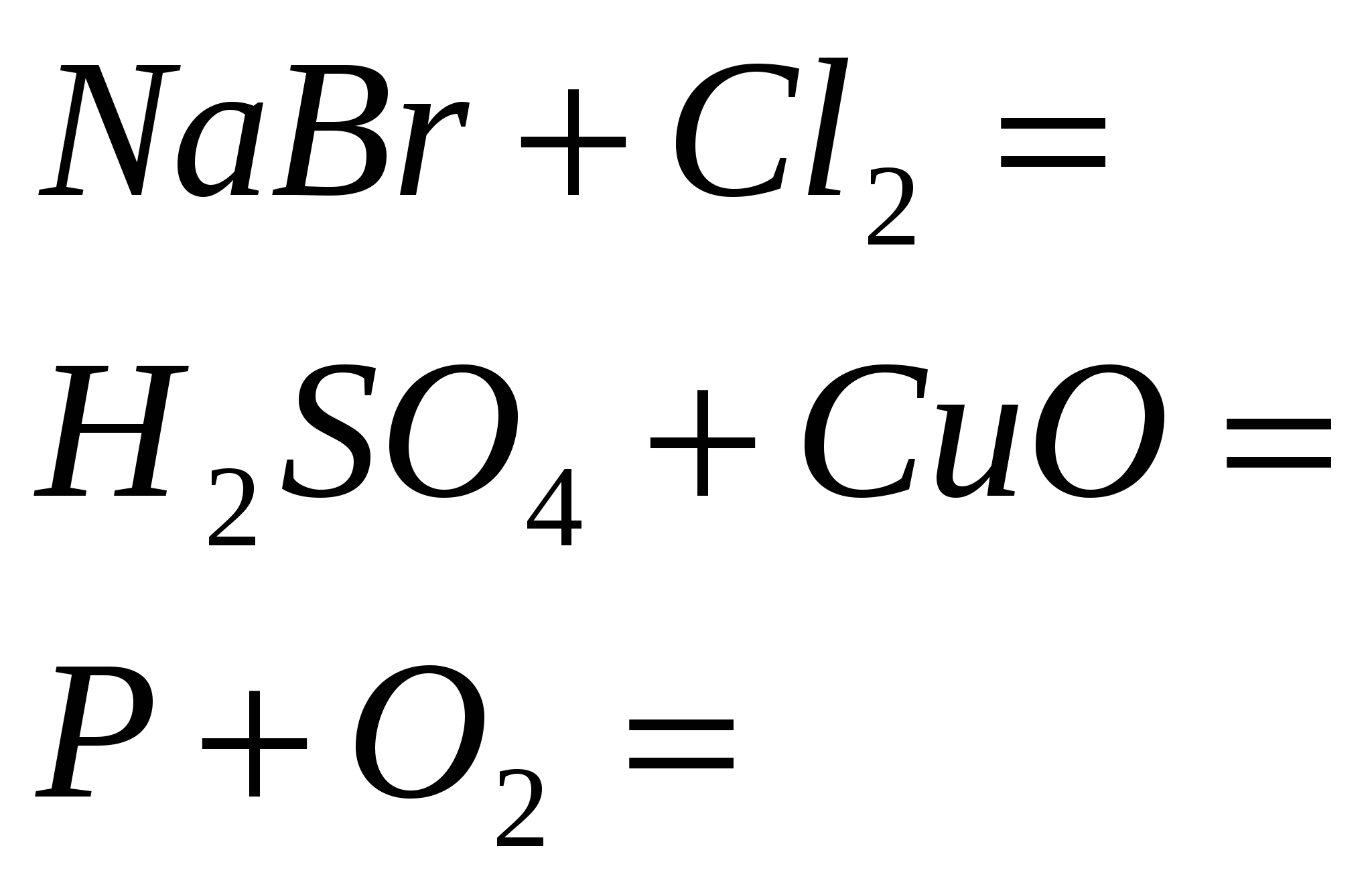
5. Fejezd be a standard reakciókat
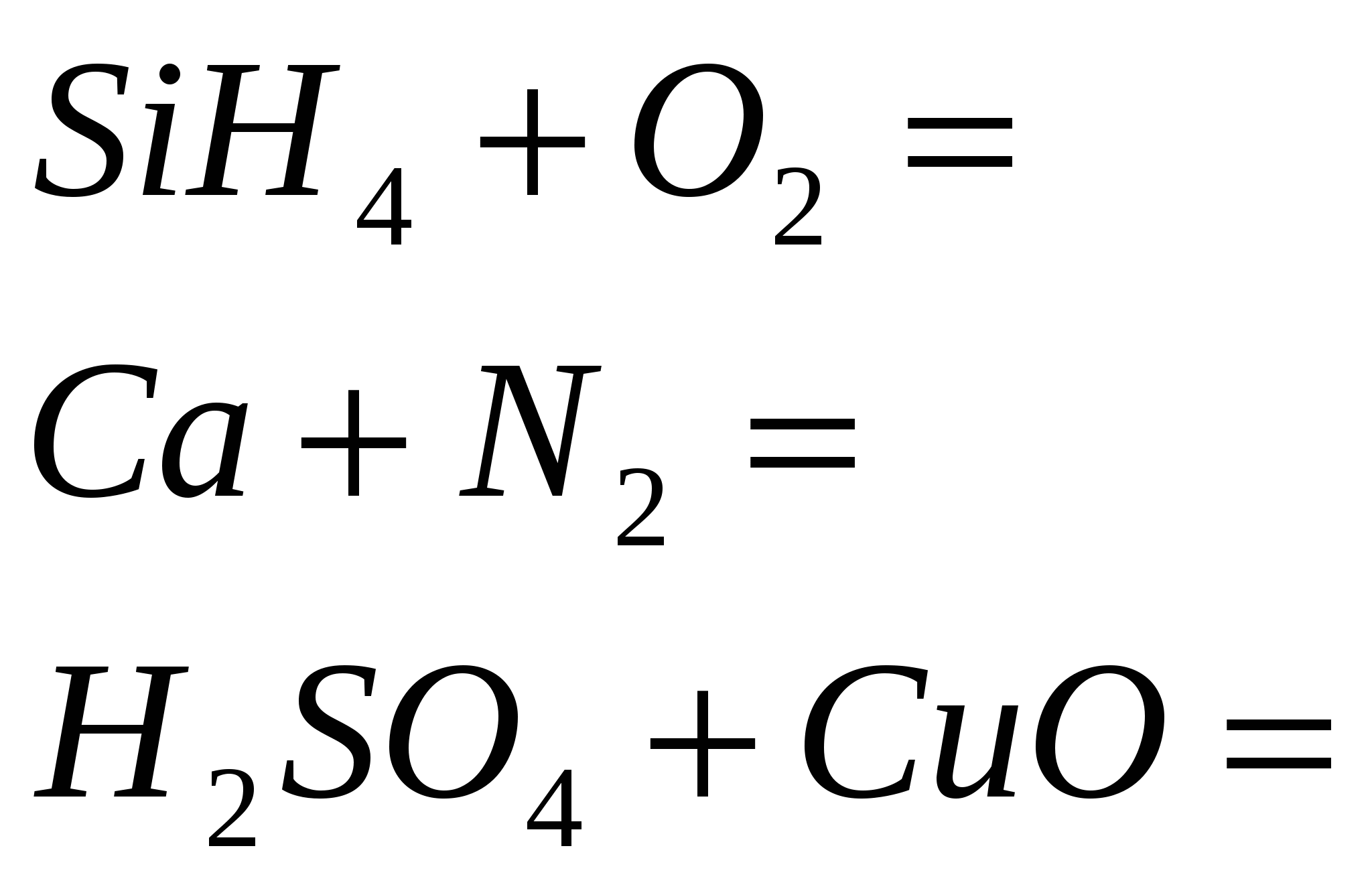
2 hasított
Zdіysnіt revízió:
3rіven
Zdіysnіt revízió:
3.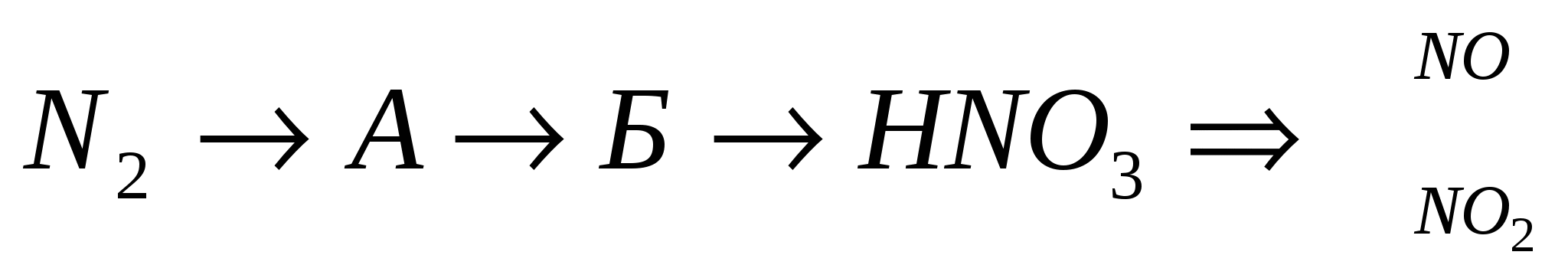
Lépés "Teszt"
1.opció
a) O, b) S, c) Cl, d) C, e) Si.
a)  , b) C, c)
, b) C, c)  , G)
, G)  e)
e)  .
.
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
4. Az elem elektronikus képlete. Yogo flying vodneva spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. A hidrogén-halogenidek növekedési ereje a sorozatban:
a) ![]()
b) 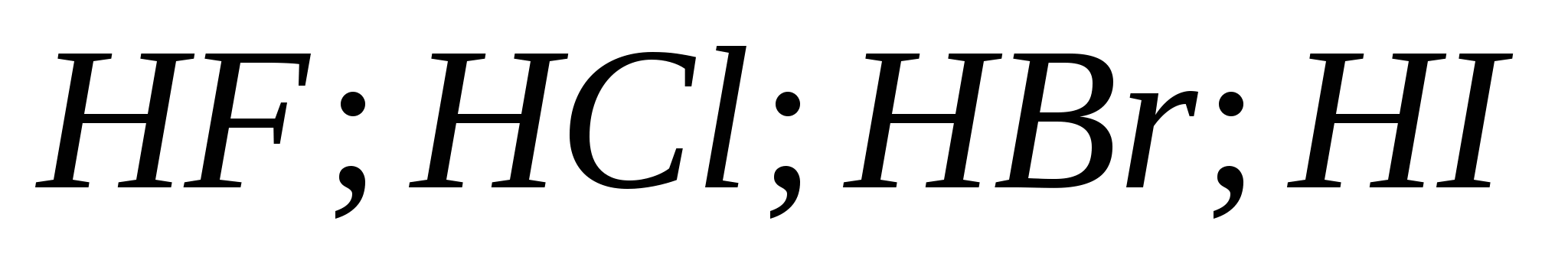
v) 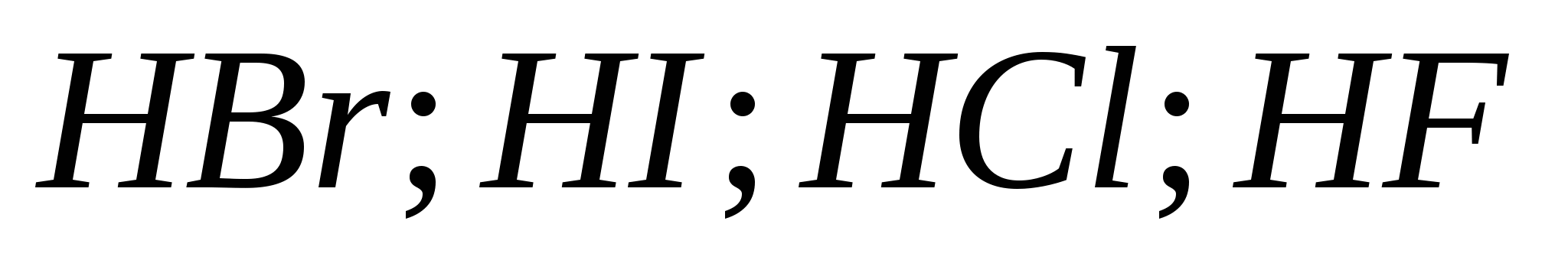
G) 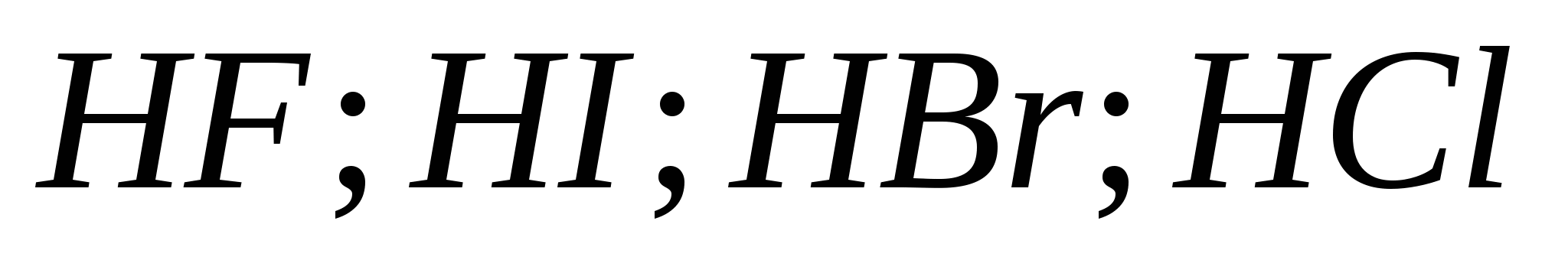
6. A boyovyh diakh előtti halogénektől elakad a beszéd:
a) fluor; b) klór; c) jód; d) bróm.
7. Hígított sirchansav az atomok fejlesztéséhez szükséges oxidáló hatás érdekében:
a)  , b)
, b)  , v)
, v)  .
.
8. A V nitrogén-oxid kombinálható:
a)  , b)
, b)  , v)
, v)  , G)
, G) 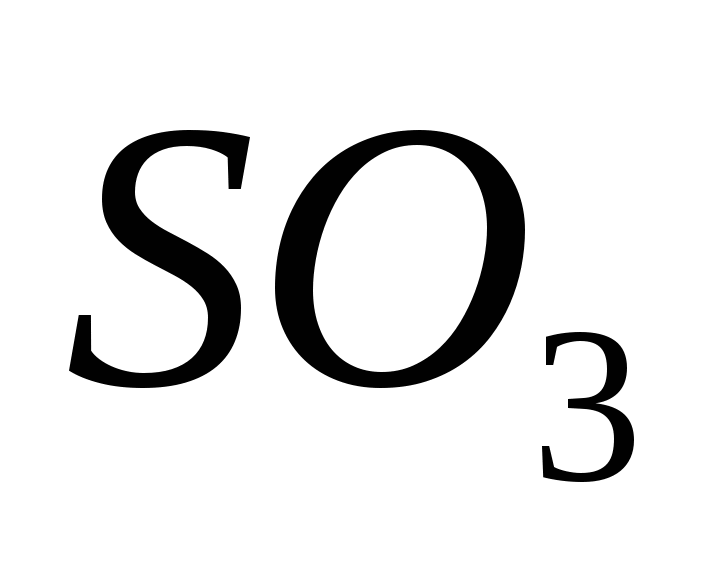 e)
e)  .
.
9. Reakció: ilyen hatóságokat hozni Amerikába:
a) oxidatív, b) egyszeres, c) savas, d) bázikus.
10. A savak erőssége egy sorban
a) változni, b) növekedni, c) sokat változni, majd változni; d) egy csepp esés, felnövés, e) nem változik.
2. lehetőség
Az atomkristály-kegyek lehetnek egyszerű beszédek, jóváhagyva:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Gáz normál elméknek є:
a)  , b)
, b) 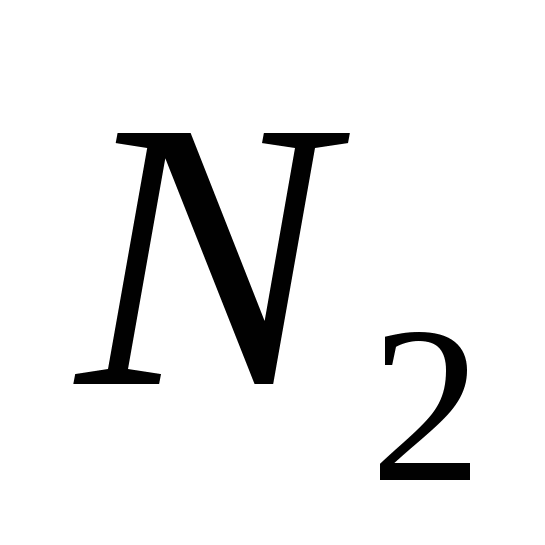 , v)
, v) 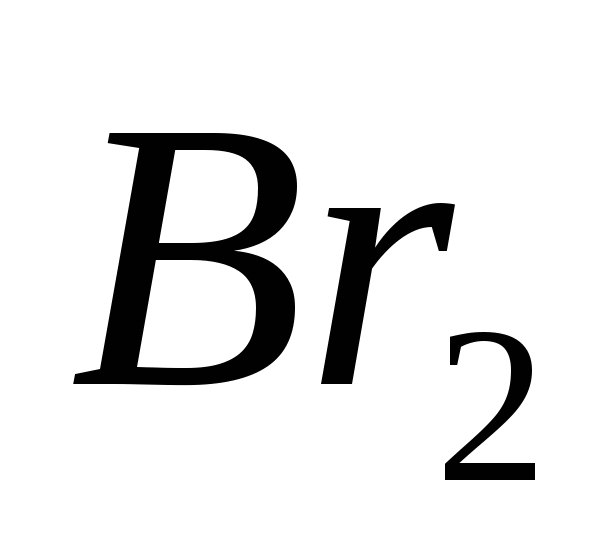 , G)
, G)  e)
e)  .
.
3. Az allotróp módosítások a következő elemeket állítják be:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  ,
,
4. Az elem elektronikus képlete. Yogo flying vodneva spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
5. A nyári vízi utak főereje a következő sorrendben változik:
a) 
b) 
v) 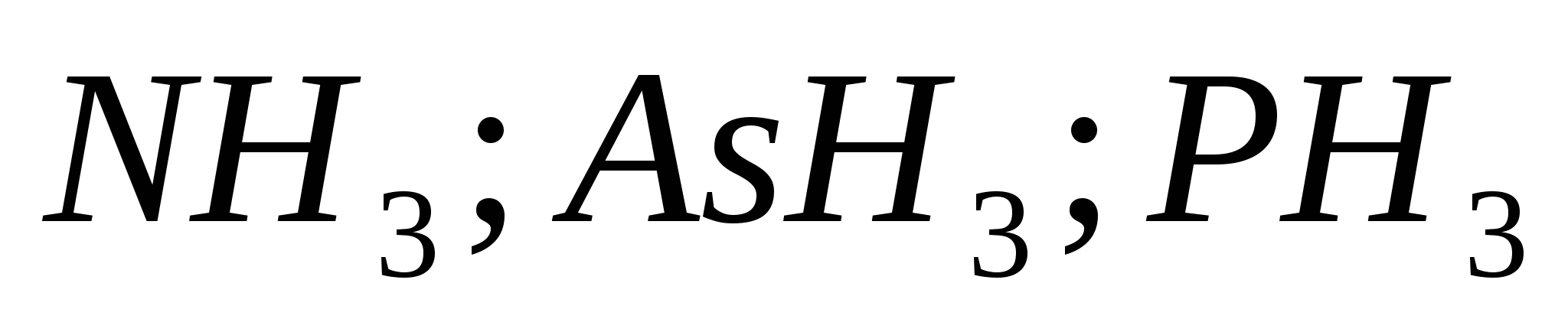
G) 
6. A klórhoz való ragaszkodáshoz használhat koncentrált oldatokat:
a)  , b)
, b) 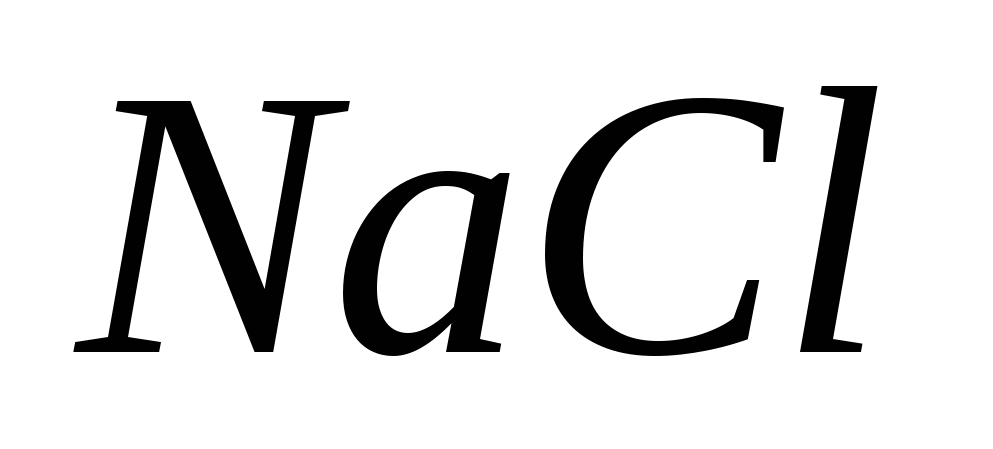 , v)
, v)  , G)
, G)  .
.
7. A koncentrált sirchansav oxidáló erő az atomok rakhunok számára:
a)  , b)
, b)  , v)
, v)  .
.
MEGJEGYZÉS: 9-10 helyes nézet - "5"; 7-8- "4"; 5-6- "3"; kevesebb, mint 5-2
ETAP "elmélet"
felvágtam ("3"-ra)
Írja le a jellemző reakciókat a hígított sósav erejének jellemzésére!
Írjon fel konkrét reakciókat a szerky-oxid (VI) erejének jellemzésére.
Írja le a tipikus reakciókat a nátriumsav erejének jellemzésére!
Írja le a foszfor (V)-oxid teljesítményének jellemzéséhez szükséges reakciókat!
Írd le azokat a reakciós válaszokat, amelyek Amerika hatalmát jellemzik!
II ryven (a "4"-en)
Írja le a nemfémes nyári vízforrások képleteit a második periódusban! Magyarázza el, hogyan és miért változik a saverő.
Írja le a harmadik periódusban lévő egyéb nemfém-oxidok képleteit! Magyarázza el, hogyan és miért változik a saverő.
Írd le a III. periódus legsavasabb elemeinek képleteit! Magyarázza el, hogyan és miért változik a saverő.
Írja fel az illékony vízbázisú nemfémek VI pidcsoport képleteit! Magyarázza el, hogyan és miért változik a saverő.
Írja le a VA pidcsoport elemei közül a legsavasabb savak képleteit! Magyarázza el, hogyan és miért változik a saverő.
III szint ("5"-en)
Határozza meg a sósav és a salétromsav savas és savas tulajdonságait! Kérjük, erősítse meg az egyszerű reakciókat.
Határozza meg a szürke oxid (IV) és a szénben lévő oxid (IV) oxidatív és savas erejét! Kérjük, erősítse meg az egyszerű reakciókat.
Változtassa meg a víz és a fluoridos víz oxidatív és savas erejét. Kérjük, erősítse meg az egyszerű reakciókat.
Határozzuk meg a tömény és hígított salétromsav savasságát! Kérjük, erősítse meg az egyszerű reakciókat.
Határozzuk meg a szénben lévő oxid (II) és az oxid szénben (IV) lévő savasságát! Kérjük, erősítse meg az egyszerű reakciókat.
ETAP "Rozrakhunkova probléma"
felvágtam ("3"-ra)
II ryven (a "4"-en)
37 g kalcium-hidroxid és ammónium-szulfát kölcsönhatásával 15 g ammóniát távolítunk el. Számítsa ki a bemeneti amiak% tömegrészét.
Amikor 62 g foszfort savanyítunk, 130 g foszfor(V)-oxidot távolítunk el. Számítsa ki a bevitt foszfor-oxid tömeghányadát (V).
Hány gramm 10%-os nátrium-hidroxid szükséges 8,96 liter klóros víz semlegesítéséhez?
A literes szén-dioxid-szűrőket 10 kg-os vaknyak-csomagolásba lehet vágni, és a házak 20%-a eltávolítható.
Hány grammos ostromot kell beállítani 11,2 liter szén-dioxid átengedéséhez 900 g 10%-os hidroxid rúdon?
III szint ("5"-en)
Milyen térfogatú 80%-os salétromsav (pl. 1,46 g / ml) szükséges a "razchinennya" 32 g mézhez?
Yaka masa szükséges a túl tömény salétromsavval való reakcióhoz ahhoz, hogy 4 l (n.u.) nitrogén (IV) oxidot eltávolítsunk;
Sósav koncentrációban "törve" 20 g aranyötvözet 4,2 l (n.u.) szürke oxiddal (IV). Vizsnitáljuk az ötvözet tömeghányadát %-ban.
Klórban lévő gázt és 1 liter térfogatot engedünk át kalcium-jodid oldaton. 5,08 r jódot láttam a tsomuban. Keresse meg a klórgáz töredékét (%) a gonosz összegben.
A 10 g tömegű szilícium és vugilla mennyiségét túl tömény nátrium-hidroxid-tartományba öntjük. A reakció eredményeként 5,6 liter víz (n.o.) látható. Visnite a szilícium tömeghányada (%) a tsіy sumіshі.
