Kalcium- és magnéziumvegyületek
Tehát, miután tegnap határozta meg, hogy mennyi kalcium van a zúzott tojáshéjban, akkor felvetették a kérdést: „inni vagy inni?”. Mint a legtöbb emberhez is, tudományos szempontból mindent megtalálok, és amíg magam nem látom, megtudja, ellenőrizze, érezz egy szót a nőnek. Ezért megosztom a gondolataimat a tojáshéj és a kalcium tekintetében talált információk alapján.
A tojáshéj élelmiszer-adalékanyagként való használatára vonatkozó információk összegyűjtése az interneten többször is az orvosok kritikai észrevételeiben mutatkozott meg, hogy a tojáshéjban lévő kalcium-karbonát vízben nem oldódik, és ezért a szervezet nem képes felszívódni.
Emellett a barátom házastársának története emlékeztetett arra, hogy a terhesség alatt elmondta az orvosának, aki észrevette, hogy zúzott tojáshéjat vesz - az orvos elutasította, és valamilyen kalciumtartalmú komplexet írt elő.
Hol van az igazság?
Valóban, a CaCO3 kalcium-karbonát (pontosan ilyen típusú, a tojáshéjban lévő kalcium) vízben és alkoholban nem oldódik.
A kalcium felszívódásának valóban szükséges előfeltétele a vízoldhatóság.
De ne feledje, hogy az emésztésünk alapja a gyomorban kiválasztódó sósav.
És ez történik a gyomorban:
СCO03 + 2HCI (sósav) = СCl2 (kalcium-klorid) + Co2 + H20
De a kalcium-klorid tökéletesen oldódik vízben! Ebben a formában felszívódik a kalcium!
Nem ismeri az orvosokat? Vagy egyszerűen csak ravaszok és eladnak nekünk gyógyszereket!
Ezen túlmenően a reakció során a gyomorsav csökken. Mi a fontos a magas savasságban szenvedők számára.
Példa erre a feleségem, magas savtartalmú, és minden nap kissé zúzott tojáshéjat vesz fel, és ez két problémát old meg egyszerre, és kompenzálja a kalciumhiányt és csökkenti a savasságát. De a tojáshéj por megszűnt citromlé nem iszik - van hányinger! És most megértem, miért.
Amint fentebb láttuk, a kalcium karbonátból történő felszívódásához magas savasságú gyomornedv szükséges.
A valóságban nagyon gyakran fordul elő olyan helyzet, amikor a gyomor savassága alacsony vagy nulla. Ez a helyzet különösen jellemző az idősebb emberekre, amikor a kalcium szükségessége különösen nagy az osteoporosis megelőzésére. Például 50 év után az emberek 40% -ánál alacsony savasság áll fenn. Ilyen körülmények között a kalcium-karbonát felszívódása, amelyhez a sósavnak a gyomorban való oldódása szükséges, 2% -ra csökken.
Talán ez az a válasz, amiért az idősebbek nagyobb valószínűséggel szenvednek a kalcium hiányával kapcsolatos betegségekben - csak a szokásos formájukban nem tudják asszimilálni.
Most fontolja meg, hogy miért javasoljuk, hogy sok zúzott tojáshéj fogadására alkalmas receptet citromlével leállítson.
Amikor citromsavat adunk hozzá a citromsavhoz, a kalcium-karbonát (CaCo3) citromsavval (C6H8O7) reagál, és kalcium-citrát (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Itt van. A kalcium-citrát felszívódása, amely nem igényel sósavat a gyomorban, 44%. Ennek eredményeként alacsony savasságú körülmények között a kalcium-citrát 11-szer több kalciumban jut be a szervezetbe, mint a karbonátból!
És a kalcium-citrát már egy jól ismert gyógyszer, amelyet pénzért értékesítenek nekünk! És azt teszik, csak a citromlevet használják, de a citromsavat!
By the way, a kalcium-karbonát (a felaprított tojáshéjunk) regisztrált élelmiszer-adalékanyag. E170és a kalcium-citrát (a citromlébe öntött tojáshéj) a regisztrált élelmiszer-adalékanyag. E333! És hozzáadnak sok élelmiszertermékhez, különösen a tejtermékekhez, beleértve a tejet is, hogy növeljék a kalcium százalékos arányát.
Tehát miért fizet többet!
Következtetés, ha magas savtartalmú - valószínűleg jobb, ha csak aprított tojáshéjat használunk, ha a savasság alacsonyabb, valószínűleg jobb, ha a tojáshéjpor citromlével eloltani.
És több,
Éjszakán gyorsabban felszabadul az ásványi sók a szervezetből (a reszorpciós folyamatok cirkadián gyorsulása a csontban). Ezért a kalcium készítményeket ebéd után és este kell venni.Ez megakadályozza a kalcium felgyorsult veszteségét az éjszaka második felében, különösen a bélben a csökkent szint (vagy hiány) miatt. A kalcium farmakoterápiás hatásának negatív dózisfüggő hatását is megfigyelték: alacsony dózisokban ez a biometall jobban felszívódik, mint a magasban.
Ezzel kapcsolatban racionálisabb, hogy naponta többször vegye be a kábítószert.
Elolvastuk, megvitatjuk. Az alábbiakban néhány cikket olvashatsz erről a témáról.
__________________________________________________________________________________________________________
Kalcium-citrát és kalcium-karbonát
Forrás< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Kalcium-citrát.
A kalcium-citrát kitűnő forrása az elnyelt kalciumnak, amely nagyon fontos szerepet játszik a szervezetben, mivel számos enzimatikus folyamatot és véralvadást érinti. A kalciumhiány a csont törékenységéhez és az osteoporosishoz vezet. Kisgyermekek számára a fogászati egészség jó, a felnőtteknek rendszeres kalciumbevitelre van szükségük a vérnyomás stabilizálásához.
A National Cancer Institute (USA) szerint az E-333 kiegészítés potenciálisan megakadályozhatja a vastagbélrákot és más rákokat. Ezen túlmenően, a kalcium-citrátokat a gyógyszerben a nehézfémek eltávolítására használják.
Mivel a kalcium-citrát az emberi szervezetben a kalcium egyik legfontosabb szállítási formája, a gyógyászatban kevésbé hatékony kalcium-karbonátot (E-170 adalékanyagot) használnak a kalcium tartalékok feltöltésére a szervezetben. Ugyanezen okból a kalcium-citrátot étrend-kiegészítők formájában (étrend-kiegészítők) használják.
Az élelmiszeriparban az E-333 adalékanyagot stabilizátor, tartósítószer, savasságszabályozó, színmegkötő szerként használják.
Stabilizátorként az E-333 élelmiszer-adalékanyagot sűrített tej, tejszín, krémsajt előállítására használják. Lekvárok, zselék és konzervgyümölcsök esetében az E-333 adalékanyagot savasságszabályozóként használják. A kalcium-citrátokat is széles körben használják a tej és tejtermékek, a pékség és a liszttermékek, valamint az üdítőitalok gazdagítására.
Úgy tűnik, hogy a kalcium-citrát fehér por, kifejezett savanyú ízű. Vízben oldódik. Kalcium-citrát: Ca3 (C6H5O7) 2 molekuláris képlete. Szerezd meg az E-333-at citromsav kölcsönhatásával a kalcium-hidroxiddal.
Tulajdonságok és technológiai funkciók:
Az étrend-kiegészítők lehetséges nevei:
- E-333
- E-333
- Kalcium-citrát
- Kalcium-citrátok
- Monokalcium-citrát
- Dikalcium-citrát
- Trikalcium-citrát
_____________________________________________________________________________________________
Kalcium-citrát
A huszadik század közepén. egyfajta „boom” kezdett: a biokémikusok, a fiziológusok, a biofizikusok, a farmakológusok és a klinikusok egyre nagyobb érdeklődést mutattak a kalcium szerepének tanulmányozásában a szervek és testrendszerek aktivitásának szabályozásában. A kalciumionok szerepet játszanak az izomsejtek gerjesztésében és összehúzódásában, a sejtmembrán permeabilitásának szabályozásában, az intercelluláris kölcsönhatásokban, a véralvadásban, a hormonkiválasztásban, a mediátorokban, az enzimekben; végezze el a cellába belépő jelátalakító funkcióját, részt vesz az intracelluláris metabolizmus szabályozásának folyamatában, beleértve az energiát is. A kardiomiociták membránjának felületén és a szabad kalciumionok tartályai 1000-szer nagyobbak, mint a sejtek citoszoljában. Az extracelluláris térből speciális kalciumcsatornákon keresztül behatolnak a citoplazmába, befolyásolva a különböző szervek fiziológiai folyamatait és funkcióit, az érrendszert, a szisztolé intenzitását, a diasztolt.
A kalcium fontos szerepet játszik a csontszövet kialakulásában és a normális szerkezetének és működésének megőrzésében. A speciális fehérjék mellett a kalciumionok biztosítják a csont keménységét és rugalmasságát.
Mindez elméleti alapul szolgál a sóira épülő kalcium-készítmények fejlesztéséhez és bevezetéséhez az orvosi gyakorlatban. Jelenleg az orvosi gyakorlatban olyan kalcium sókat használunk, mint a glicerofoszfát, glükonát, karbonát, laktát, citrát, klorid, foszfát és sok más.
A KALCIUM CITRATE gyógyszer farmakokinetikája saját jellegzetességekkel rendelkezik. A kalcium felszívódik a bélből egy oldható, ionizált formában. A gyógyszer oldódása jobb a gyomor savas környezetében. A feloldott ionizált kalcium jól behatol minden szövetbe, behatol a placenta barrierbe, átjut az anyatejbe. Elsősorban a székletben, kb. 20% -ban ürül ki a vizelettel. A kalcium-citrát fontos jellemzője, hogy a vese kövek kialakulásának alacsony képessége, ami fontos a só hosszú távú felhasználása szempontjából. Ez annak a ténynek köszönhető, hogy a citrát-só csökkenti a vizeletben az oxalát mennyiségét.
A biológiai hozzáférhetőséget a sebesség és mértéke határozza meg hatóanyag az adagolási formából abszorbeálódik, a rendelkezésre álló terápiás hatás helyén válik elérhetővé.
Éjszakán gyorsabban felszabadul az ásványi sók a szervezetből (a reszorpciós folyamatok cirkadián gyorsulása a csontban). Ezért a kalcium-készítményeket ebéd után és este kell megtenni, ami megakadályozza a kalcium felgyorsult veszteségét az éjszaka második felében, különösen a bélben a csökkentett (vagy hiányzó) szinttel. Megjegyezzük a kalcium farmakoterápiás aktivitásának negatív dózisfüggő hatását: ez a biometall alacsony dózisokban jobban felszívódik, mint nagy dózisokban. Ebben a tekintetben racionálisabb, ha naponta többször szedjük be a kábítószert. Különböző korcsoportok esetében a kalcium bevitelének különböző fiziológiai normái vannak (táblázat).
táblázat
A kalciumbevitel ajánlott aránya a különböző korú embereknél
(a kanadai csontritkulási társaság szerint)
D-vitamin, sósav, laktóz, citromsav, fehérje jelenléte az élelmiszerekben, foszfor, magnézium, valamint egyes élelmiszerek, például vaj, tojás, tej, hal, tőkehal, káposzta stb. Hozzájárulnak a kalciumionok felszívódásához.
A kalcium felszívódása romlik: a fehérje hiánya az élelmiszerben, a vegetáriánus étrend szigorú betartása, a magnézium, a foszfor, az oxálsavban gazdag élelmiszerek (sóska, rabarber, spenót) hiánya.
A kalcium felszívódása lassítja az emésztőszervek (gastritis, enteritis, colitis, peptikus fekély), hasnyálmirigy (cukorbetegség, pancreatitis), más endokrin szervek patológiáit.
Hangsúlyozni kell, hogy egyes gyógyszerek, különösen a glükokortikoidok, a hormonális fogamzásgátló szerek a szisztémás használatra, a levotiroxin szintén rontják a kalciumionok felszívódását.
A tudományos kutatások eredményei (a kanadai csontritkulási társaság adatai) szerint nincs meggyőző bizonyíték arra, hogy más ásványi anyagok (magnézium, cink, réz stb.) További fogyasztása ajánlott az oszteoporózis megelőzésére vagy kezelésére.
Az Ukrajnában és más országokban végzett klinikai vizsgálatok eredményei megerősítették ennek a gyógyszernek a nagy hatékonyságát számos betegség kezelésében. A kalcium-citrátot profilaktikus célokra is használják különböző betegségekben.
Idős embereknél osteoporosis esetén az osteomalacia CALCIUM CITRATE naponta 2-6 tablettát írnak fel, a napi adagot 3-4 adagra osztva. A gyógyszert étkezés előtt vagy 1–1,5 órával étkezés után 3 hónapig szedik. Az ilyen betegeknek naponta is 400–800 NE D3-vitamint kell rendelniük, valamint olajat, tejet, halat és tojást is tartalmaznak az étrendben.
A CALCIUM CITRATE az optimális adagolási forma a kalcium biztosítására nemcsak felnőttek, hanem a gyermekek, valamint a serdülők számára is, mivel segít növelni a csont ásványi sűrűségét, növeli a csonttömeget, erősíti a dentint és a fogzománcot. 6 hónapos kor alatti gyermekek számára 1/2 tablettát (250 mg) írnak fel (aprítva, kis mennyiségű tejben oldva), 6-12 hónapos korukban - napi 1/2 tablettát is 2 alkalommal, 1 éves kortól 10 évig - 1-2 tabletta, 10-18 éves - 2-3 tabletta naponta.
Jelzések a kalcium-citrátra:
a különböző eredetű vérzés, valamint a terhesség és a szoptatás során bekövetkező vérzés okozta hypocalcemia sérülésekkel - a megnövekedett szervezet kalciumionok iránti igényének kielégítésére;
a kalcium felszívódásának megsértése az emésztőrendszeri betegségekben, és a kalcium kiválasztódásának fokozódása a vesékben és a belekben;
hypoparathyreosis, a különböző génekből eredő szervezet dehidratációja, allergiás betegségek és allergiás szövődmények gyógyszerek szedése, megnövekedett vaszkuláris permeabilitás, csökkent véralvadás.
A glükokortikoidok, orális fogamzásgátlók, levotiroxin szedésekor a kalcium-citrátot fel kell írni. Az utóbbi három esetben az étkezés után naponta egyszer 6 tablettát veszünk.
A kalcium-citrát általában jól tolerálható, néha diszipsziás tünetek (székrekedés vagy hasmenés, hányinger, hányás, étvágytalanság, hasi fájdalom), poliuria alakulhat ki.
A CALCIUM CITRATE egyidejű alkalmazása alumíniumot tartalmazó antacidokkal nem ajánlott hatékonyságuk csökkenése miatt. Nem kívánatos, hogy más kalcium-készítményekkel egyidejűleg írja elő.
Összefoglalva megállapíthatjuk, hogy a CALCIUM CITRATE pozitív farmakológiai tulajdonságai:
a citrát-kalcium-só jól oldódik és felszívódik az emésztőrendszerben, ami a szervezetben a kalcium jó felszívódásához vezet, és ennek megfelelően a gyógyszer hatékonyságát megelőző vagy hatásos módon. terápiás alkalmazásezt számos klinikai vizsgálat eredményei is alátámasztják.
A vese károsodásának alacsony kockázata a gyógyszer bevételekor növeli a kalcium-szulfát értékét hosszabb ideig.
IS Chekman, a Nemzeti Orvostudományi Egyetem Klinikai Farmakológiai Tanszékének farmakológiai tanszékének vezetője, az Országos Tudományos Akadémia és Ukrajna Orvostudományi Akadémia levelező tagja, a tudomány és a technológia tiszteletbeli munkatársa, professzor
1. oldal
A karbonátok savakkal való reakciója karbonátok mintaként használható. A szénsav nagyon gyenge és instabil sav. A sókból kevésbé illékony és erősebb savak hatására kiszorítható.
Hasonlóképpen a kalcium-karbonát reakciója a savakkal történik.
A karbonát és a sósav reakciója kalcium-kloridot és magnézium-kloridot eredményez, amely vízben jól oldódik, és különböző koncentrációjú oldat formájában marad. Az ilyen típusú kollektorokban a reakció sebessége főként a nyomástól és a hőmérséklettől függ.
A karbonát sósavval való reakciója eredményeként kalcium-klorid és magnézium, jól oldódik vízben, és különböző koncentrációjú oldat formájában marad.
A nem szárított nátrium-karbonát bejuttatása a reakcióba nagyobb nyomást és a katalizátor mennyiségének növelését teszi szükségessé.
A felsorolt vagy megfigyelt jelenségek magyarázata: miért kezdődik kezdetben erőteljesen a kalcium-karbonát és a kénsav reakciója, majd leáll. Miért eltűnik a meleg ammónium-karbonát anyag a csőből.
A kalcium-karbonát előnyös hatása a portlandcement stabilitására a karbonát alumíniumtartalmú klinker ásványokkal való reakciójával magyarázható. Így a cementkő aluminát komponense kémiailag kötődik, mielőtt érintkezik a környezet szulfátjaival.
A bárium-karbonát néhány alkalmazása a bárium-szulfát gyakorlati oldhatatlanságán alapul, amelyet a bárium-karbonát szulfátionokat tartalmazó anyagokkal való reakciójával képez. Tehát, amikor egy tégla szárítása előtt éget, fehér virágzik a felületén, amit az agyagban lévő gipsz vagy magnézium-szulfát kristályosodása okoz. Ennek elkerülése érdekében agyaghoz hozzáadunk bárium-karbonátot, ami a szulfátion kicsapódását okozza.
A szilárd anyagok kémia bevezetésében a Hedwal, mint elméletileg lehetséges reakció példája, kalcium-karbonát és Si02 reakciójával jár, ami kalcium-szilikát képződéséhez vezet. Ezt a példát kíséri, megjegyezve, hogy az úgynevezett geotermikus metamorfózisoknál a szokásos hőmérséklet nem elegendő, mivel a kalcium-karbonát és a kovasav közötti reakció laboratóriumi körülmények között csak 500 ° C hőmérsékleten figyelhető meg.
Ahhoz, hogy ebben a folyamatban csökkentsük a flegma kialakulásának költségeit, Klima és Ward azt javasolta, hogy ammónium-karbonát oldatot (ammónium-nitrát helyett) használjanak, és a dúsított ammónium-karbonát mészrel való reakciója miatt flegmust hozzanak létre.
A hőmérséklet emelkedésekor a reakció egy alkáliabb szilikát képződése felé mozdul el. Gibson és Ward11 a nátrium-karbonát és a kvarc reakciójával nitrogénáramban 726 ° C és 805 ° C közötti hőmérsékleten azt mutatta, hogy elegendő mennyiségű nátrium-karbonát jelenlétében orto-szilikát keletkezik. A reakciósebesség az időtől, a minta méretétől, a gázáramlási sebességtől és a reakcióelegy összetételétől függ. Gibson és Ward azt állítják, hogy közepes minőségű nátrium-szilikátok vannak.
A nátrium-karbonát feleslegét sósavval titráljuk. Az elemzett termékben a kén mennyiségét a reagált nátrium-karbonát mennyiségével számítjuk ki.
A kalcium-karbonát és a kémiai vegyületek kölcsönhatása.
Kalcium-karbonát
CaCO2 kalcium-karbonát rácsA CaCO₃ egy nagyon gyakori vegyület a világ körül: kréta, mészkő, márvány stb. Ezért érdemes megjegyezni, hogy ennek az anyagnak az ember számára betöltött szerepe nagyon jelentős, mivel a kalcium-karbonátot széles körben használják az élelmiszeriparban, mint természetes fehér színezék. A CaCO₃-t papír, műanyag, építőiparban és sok más területen is használják.
A kalcium-karbonát egy fehér anyag (szilárd kristályok) por vagy szilárd formában. Képes reagálni vízzel, de nem teljesen feloldódott benne. Ezért a víz zavarossá válik, és fehér csapadék van. De ha a vízzel való reakció a jelenlétében történik, akkor oldható sav sót, kalcium-hidrogén-karbonátot kapunk:
CaCO 2 + CO 2 + H20 → Ca (HCO2)
Fontolja meg, hogyan készül a kalcium-karbonát.
A kalcium-karbonát nagy része természetes forrásokból származik. Tehát, hogy kalcium-karbonátot kapjunk, általában egy tiszta forrást, gyakran márványt használjunk.
 David márvány szobra Michelangelo Buonarroti
David márvány szobra Michelangelo Buonarroti
A laboratóriumi körülmények között a kalcium-karbonát kalcium-oxid kalcinálásával nyerhető. A kalcinálás az égés általános fogalmára utal, amelynek eredményeként a vegyi anyagok új tulajdonságokat szereznek. Az égetést megfelelően magas hőmérsékleten hajtjuk végre, nem olvadáspontja.
A kapott kalcium-oxiddal vizet keverünk, a reakció hidroxidot eredményez. Ezután a technikusok szén-dioxidot kapnak, amely áthalad a korábban kapott oldaton. A képződött csapadék kalcium-karbonát:
CaO + H20 = Ca (OH);
Ca (OH) + CO 2 = CaC03 + H20
Ha a szénsav és a kalcium sóját magas hőmérsékletre (900-1000 ° C) melegítjük, akkor a kémiai folyamat eredményeként szén-dioxidot (szén-dioxidot), valamint CaO-kalcium-oxidot használunk fel az építőiparban:
CaCO2 = CaO + CO 2
Ha a hőmérséklet még magasabb (1500 ° C), akkor a reakciótermékek kalcium-karbid és szén-monoxid.
Sósav
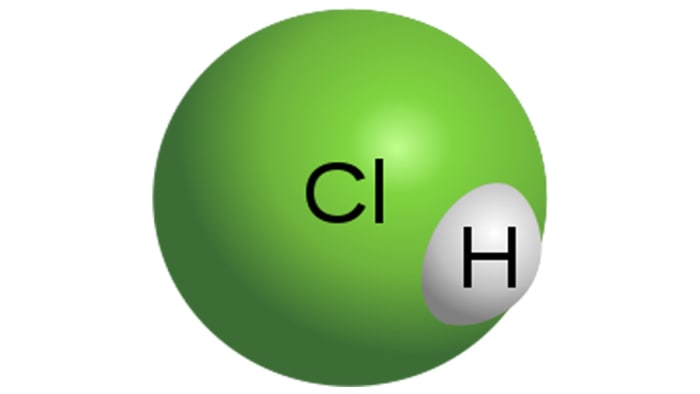 Sósavmolekula
Sósavmolekula
A sósav egy erős monobázisos sav, amelyet a hidrogén-klorid vízben való feloldásával nyerünk. Színtelen folyadék, bár a technikai sav sárga színárnyalatú lehet, például a vas szennyeződése miatt. A HCl tulajdonságai közvetlenül függnek az oldatban lévő hidrogén-klorid koncentrációjától.
A sósav sóit kloridoknak nevezik. Ez az anyag nagyon maró, ezért gondos kezelést igényel: még akkor is, ha egy kis csepp esik a bőrre, akkor nem lehet elkerülni az erős kémiai égést. Ezért erős savakkal végzett munka során ajánlatos mindig magával hordozni semlegesítőszereket: gyenge alkáli oldatok, (szódabikarbóna), stb. Érdemes megjegyezni, hogy a koncentrált savval ellátott tartály megnyitásakor HCl gőzök keletkeznek, amelyek káros hatással vannak a szemre és a légzőrendszerre. Ezért a kémiai kísérletekben a legjobb lenne légzőkészüléket és védőszemüveget használni.
Sósav előállítása
A hidrogén-klorid-gázt vízben oldjuk. A hidrogén-kloridot a következőképpen állítjuk elő: a hidrogén klórban égetve, így szintetikus savat kapunk. Alternatív módon a sósav oldalsó gázok alkalmazásával állítható elő, amelyeket számos kémiai kísérletben nyerünk, például klórozott szénhidrogének klórozásakor. Az így kapott savat abgasicnak nevezik.
Alkalmazzon sósavat az orvostudományban, az iparban és a kémiai reakciókban.
A színtelen sav hidrogén-klorid szagú szagával jól reagál a fémekkel. A redox reakció bekövetkezik. A redukálószerek a reakciófolyamatban fématomok, és az oxidálószerek hidrogén-kationok.
Főként a fémekkel való kémiai reakciók a hidrogén felszabadulásával járnak. Az interakció intenzitása függ a fém aktivitásától, például az alkálifém lítium hevesen reagál, míg az alumínium reakciója gyenge az elem erős oxidfilme miatt.
Sósav és cink:
2HCI + Zn = ZnCl2 + H2
Sósav és vas:
2HCI + Fe = FeCI 2 + H 2
Sósav és magnézium:
2HCI + Mg = MgCl2 + H2
 Magnézium-klorid, az utak jégtől való tisztítására
Magnézium-klorid, az utak jégtől való tisztítására
Fém-oxidokkal savval sót és vizet képez:
CuO + 2HCI = CuC13 + H20
A sósav és a kalcium-karbonát reakciója
A kísérlethez:
kémcső;
kémiai pipetta;
szilárd kalcium-karbonát (márvány);
sósav;
kesztyűk;
légzőkészülék.
Figyelem! Ne próbálja meg ezt az élményt!
A kísérletet jól szellőző helyen végezze, óvatosan alkalmazzon sósavval.
Adjunk hozzá néhány darab márványt az edényhez, és pipettázzunk néhány sósavat. Ennek eredményeképpen azonnali reakció lép fel a buborékok képződésével - a szén-dioxid szabadul fel. Ez egy csere-reakció, amelynek termékei: gyenge és instabil vegyület, szénsav, amely széndioxiddá és vízgé bomlik. A kalcium-karbonát sósavban való oldódási reakciójának egyenlete:
CaC03 + 2HCI (hígítás) → CaCl2 + CO 2 + H20
- a magnéziumelemre jellemző: elektronikus szerkezet, lehetséges oxidációs állapotok, bázikus vegyületek: oxid, hidroxid, sók. Mi a karbonizáció és mi a szerepe az építésben.
MgCO 3 = MgO + CO 2
Alkalmazás.
Az iparban tűzálló anyagok, cementek és kőolajtermékek tisztítására szolgál a gumi előállításához. Az ultra-könnyű magnézium-oxidot nagyon finom csiszolóanyagként használják felületek tisztítására, különösen az elektronikai iparban.
Az orvostudományban a gyomornedv megnövekedett savtartalma esetén alkalmazzák, mivel a sósav túlzott mennyisége okozza. Az égetett magnéziumot akkor is veszik, ha a savat véletlenül a gyomorban szabadítják fel.
Az élelmiszeriparban az E530 élelmiszer-adalékanyagként regisztrálták.
Abszolút fényvisszaverő - olyan anyag, amelynek tükörképessége egy széles spektrális sávban egyenlő. Használható fehér standardként is használható.
Magnézium-hidroxid - A fő fémhidroxid magnézium. Gyenge oldhatatlan bázis.
Normál körülmények között a magnézium-hidroxid színtelen, hatszögletű rács. 350 ° C feletti hőmérsékleten bomlik magnézium-oxidra és vízre. A szén-dioxidot és a vizet felszívja a levegőből, hogy a fő magnézium-karbonátot képezze. A magnézium-hidroxid vízben gyakorlatilag nem oldódik, de ammóniumsókban oldódik. Ez gyenge bázis. A természetben ásványi brucit formájában fordul elő.
Megközelítés.
Oldható magnéziumsók kölcsönhatása lúgokkal: \\ t
Általában:
Mg2 + + 2OH - = Mg (OH) 2 ¯
példák:
MgCl2 + 2NaOH = Mg (OH) 2 + + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 + + 2KNO3
A magnézium-klorid oldatának égett dolomitdal való kölcsönhatása:
MgCl2 + CaO × MgO + 2H 2O = 2 Mg (OH) 2 + + CaCl2
A fém magnézium kölcsönhatása vízgőzzel: \\ t
Mg + 2H 2O = Mg (OH) 2 + + H 2 -
Kémiai tulajdonságok
Mint minden gyenge bázis, a magnézium-hidroxid termikusan instabil. 350 ° C-ra melegítve bomlik:
A savakkal kölcsönhatásba lép só és víz képződéséhez (semlegesítési reakció):
Mg (OH) 2 + 2HCI = MgCI2 + 2H 2O
Mg (OH) 2 + H2S04 = MgS04 + 2H 2O
Savas oxidokkal való kölcsönhatás só és víz képződéséhez:
Mg (OH) 2 + SO 3 = MgS04 + H20
Interakció forró, koncentrált lúgoldatokkal hidroximagnátok képződésével:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
Alkalmazás.
A magnézium-hidroxidot arra használják, hogy a kén-dioxidot, mint flokkulálószert a szennyvízkezeléshez, tűzálló anyagként használják hőre lágyuló polimerekben (poliolefinek, PVC), mint detergensek adalékanyagaként, a magnézium-oxid előállításához, cukorfinomítás, a fogpaszták összetevőjeként.
Az orvostudományban gyógyszerként használják a gyomorban lévő sav semlegesítésére, valamint nagyon erős hashajtó hatására.
Az Európai Unióban a magnézium-hidroxidot E528 élelmiszer-adalékanyagként regisztrálták.
Magnéziumsók.
A legtöbb magnéziumsó erősen vízben oldódik. Az Ion Mg 2+ keserű ízű. A magnézium-halogenidek, a MgF2 kivételével, rendkívül higroszkóposak - levegőn vérzik.
Magnézium-klorid MgCl2 (magnézium-klorid) vízmentes olvadáspontja 718 ° C. A víznyomok jelenlétében „füstöl” a levegőben - bomlik HCl és MgO. A vizes oldatból 1, 2, 4, 6, 8 és 12 vízmolekulával rendelkező színtelen kristályos hidrátok szabadulnak fel. A –3,4 és 116,7 ° közötti hőmérséklettartományban a MgCl 2 × 6H 2 0 kristályos hidrát stabil, ami természetesen biszkofit ásványi anyagként fordul elő, és nagy mennyiségben a tengeri sóoldatok bepárlásával nyerhető. A magnézium-klorid kettős sókat képez, amelyekből rendkívül fontos a KCl × MgCl 2 × 6H 2 O ásványi és kálium-klorid forrás.
Alkalmazás.
1. A magnézium-kloridot főként a fém magnézium előállítására használják, a magnézium-cement előállításához MgCl 2 × 6H 2 0-ot használnak.
2. A jég és a hótakaró adalékként való feldolgozására szolgál. A hóval való reakció eredményeként olvadást okoz. 3. veszélyességi osztályt (mérsékelten veszélyes anyagokat) és agresszív korrozív tulajdonságokat mutat.
Magnézium-bikarbonát - a magnézium és a karbonsav savas sója (Mg (HCO 3) 2) csak vizes oldatokban létezik.
Megközelítés.
Szén-dioxid átvitele magnézium-karbonát szuszpenziójával:
MgCO 3 + CO 2 + H20 = Mg (HCO 3) 2
Fizikai tulajdonságok.
A magnézium-hidrogén-karbonát csak vizes oldatokban van jelen.
A magnézium-hidrogén-karbonát jelenléte vízben ideiglenes merevségét eredményezi.
Kémiai tulajdonságok
Az oldat koncentrálásakor a magnézium-hidrogén-karbonát bomlik:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
Magnézium-hidrofoszfát (diszubsztituált magnézium-foszfát) - a magnézium és a foszforsav savas sója, amely képletben MgHPO 4, vízben kevéssé oldódik, kristályos hidrátokat képez.
Megközelítés.
Az ortofoszforsav magnézium-oxidra vagy magnézium-karbonátra gyakorolt hatása:
MgO + H3P04 = MgHPO4 + H20
MgCO 3 + H 3PO 4 = MgHPO 4 + CO 2 - + H 2 O
A diszubsztituált nátrium-ortofoszfát hatása magnézium-kloridra:
MgCl2 + 2Na 2 HPO 4 = MgHP04 + 2NaCl
A dihidrogén-foszfát-magnézium bomlása:
Mg (H 2PO 4) 2 = MgHPO4 + H3P04
Fizikai tulajdonságok.
A magnézium-hidrogén-foszfát fehér kristályokat képez, amelyek kristályos hidrátok: 225 ° C-os hőmérsékleten MgHPO4-monohidrát keletkezik. H20, 2,32 g / cm3 sűrűség 36 ° C hőmérsékleten, MgHPO4-trihidrát képződik. 3H 2O, sűrűség 2,10 g / cm3, a szobahőmérsékleten MgHPO4-heptahidrát képződik. 7H 2O.
Kémiai tulajdonságok.
Hevítéskor pirofoszfátba kerül:
Alkalmazás.
E343 táplálékkiegészítőben használatos.
Magnézium-dihidrogén-foszfát - a magnézium és az ortofoszforsav fémének sója (Mg (H 2PP 4) 2), vízben oldódó, színtelen higroszkópos kristályok kristályos hidrátokat képeznek.
Megközelítés.
A hidroxid vagy magnézium-oxid oldása ortofoszforsavban: \\ t
Fizikai tulajdonságok.
A magnézium-dihidrogén-foszfát színtelen kristályokat képez.
Mg (H 2PO 4) 2 kristályos hidrátkészítménye. nH20, ahol n = 2, 4, 6.
Magnézium-karbid - magnézium és szén bináris szervetlen vegyülete az Mg formula2 képlettel. Ismert magnézium-karbid, Mg 2 C.
Megközelítés.
A magnézium-fluorid és a kalcium-karbid szinterelése:
Áramló acetilén magnéziumpor felett:
A pentán magnéziumporral való 650 ° C-on történő helyreállításával bonyolultabb Mg2C3-karbidot kaphatunk.
Kémiai tulajdonságok.
Fűtés közben bomlik az Mg2C3 köztes karbid képződésével:
Vízzel kölcsönhatásba lép:
Magnézium-karbonát, magnézium-karbonát, magnézium-karbonát-magnéziumsó.
Tulajdonságok.
Fehér kristályok, sűrűség: 3,037 g / cm3. 500 ° C-on észrevehető, 650 ° C-on pedig teljes mértékben MgO-ká és CO2-ba bomlik. A magnézium-karbonát vízben való oldhatósága jelentéktelen (22 mg / l 25 ° C-on), és a hőmérséklet emelkedésével csökken. Ha a CO 2 -ot telített magnézium-szulfátos szuszpenzióval telítjük, az utóbbi a Mg (HCO 3) 2-bikarbonát képződése következtében feloldódik. A vizes oldatokból CO 2-felesleg hiányában bázikus magnézium-karbonátokat bocsátanak ki. Számos fémből származó karbonátokkal a magnézium-karbonát kettős sókat képez, amelyek magukban foglalják a természetes ásványi dolomit MgCO 3 · CaCO 3-ot.
Elterjedtség a természetben.
A magnézium-karbonát a természetben széles körben elterjedt az ásványi magnezit formájában.
Alkalmazás.
A 3MgCO 3 · Mg (OH) 2 · 3H 2 O bázikus magnézium-karbonátot (az úgynevezett fehér magnéziumot) a hőszigetelő anyagok gyártásához használt gumi vegyületek töltőanyagaként használják.
Az üveg, cement, tégla előállításához magnézium-karbonát szükséges.
Magnézium-nitrát Mg (NO 3) 2 - színtelen higroszkópos kristályok köbös rácsgal; Olvadáspont: 426 ° C (bomlás közben). Oldhatóság vízben (g / 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Etanolban, metanolban, folyékony NH3-ban is oldódik. A koncentrációtól függően a nem-, hexa- és dihidrátok vizes oldatokból kristályosodnak.
A komplex műtrágyák összetevője, mivel a magnézium a fotoszintézishez szükséges klorofill része, növeli számos enzim aktivitását és foszfor-transzporterként működik. A nagy oldhatóság és az alacsony elektromos vezetőképesség miatt a termék rendkívül alkalmas a lomb táplálására és a műtrágyázásra, különösen nagy sós koncentrációjú öntözővizek használata esetén. A műtrágya a zöldségek, bogyók, gyümölcskultúrák, szőlő gyökér- és lombtáplálására szolgál; oxidálószer pirotechnikai készítményekben.
elszenesedés- bármely oldat telítettsége szén-dioxiddal. Építésben használatos.
Ásványi karbonizálás - szilikátot tartalmazó szilícium-savat szénsavval helyettesítjük, hogy karbonátokat képezzenek. A karbonátokból a sziklaképző ásványi anyag a kalcit (mész spar) CaCO3. A magnezit - MgCO3 és a dolomit - CaMg (CO3) 2 kevésbé gyakori. az tiszta víznem tartalmaz szénsavat, a kalcitot kis mennyiségben oldjuk (0,03 g / liter víz); a magnezit gyakorlatilag oldhatatlan. Ha a víz szén-dioxidot tartalmaz, a kalcit könnyen oldódik savas kalcium-karbonát képződésével, vízben oldható - Ca (HCO3) 2-ben.
A karbonizálás a portlandcement betonon történő változása, ha C0 2 levegőnek van kitéve. Különösen befolyásolja a Ca (OH) 2 kalcium-hidroxidot nedvesség jelenlétében. A kalcium-hidroxidot szén-dioxid felszívódásakor kalcium-karbonáttá alakítjuk. A kalcium-karbonát vízben kevéssé oldódik, és ennek következtében hermetikusan zárja be a beton felületén lévő pórusokat (azaz sűrű, vízálló betont).
Jellemzően a pórusvíz pH-értéke 10,5 és 11,5 között van. Ha a karbonizáció következtében 9-re csökken, akkor a megerősítés korróziója lehetséges. Ezért a szénsavas réteg vastagsága fontos tényező a megerősítés védelme szempontjából: minél mélyebb a karbonizáció, annál nagyobb az acél korrózióveszélye. A karbonizáció mélységét a beton fenolftaleinnel történő kezelésével határozhatjuk meg. A fenolftalein hatására lúgos tulajdonságok jelenlétét rózsaszín színű megjelenés jelzi, míg a szénsavas beton eredeti színét megtartja.
A jó minőségű sűrű beton nagyon lassan karbonizálódik. Nem valószínű, hogy a karbonizálódás 50 évnél hosszabb 5–5 mm mélységben is megfigyelhető lesz. Másrészt, az alacsony szilárdságú áteresztő beton karbonizációs mélysége kevesebb, mint 10 év alatt elérheti a 25 mm-t. A tapasztalatok azt mutatják, hogy az alacsony minőségű betontermékek különösen érzékenyek a karbonizációra.
- kalcium-elemre jellemző: elektronikus szerkezet, lehetséges oxidációs állapotok, fő vegyületek: oxid, hidroxid, sók.
kalcium - a második csoport fő alcsoportjának egy elemét, a DI Mendeleev kémiai elemek időszakos táblázatának negyedik periódusát, atomszámmal. Ez a Ca (lat. kalcium) szimbólummal van jelölve. Elektronikus szerkezet 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, oxidációs állapot +2, 0. Alkáliföldfémekre vonatkozik.
Egyszerű anyag kalcium egy puha, kémiailag aktív alkáliföldfém ezüst-fehér színű. Ipari termelés: olvadt kalcium-klorid elektrolízise.
Kalcium-oxid CaO - bázis-oxid, mész. Fehér, higroszkópos. Tűzálló, termikusan instabil, gyullad a gyújtás során. Erősen reagál a vízzel (magas exo-hatással), erősen lúgos oldatot képez, az eljárást mészlehúzásnak nevezik. Reagál savakkal, fém-oxidokkal, nemfémekkel. Más kalciumvegyületek szintetizálására használják, a kötőanyagok összetevőjét az építésben.
Gyártás az iparban - mészkő-égetés (900 - 1200 o C)
Kalcium-hidroxid Ca (OH) 2 - hidratált mész, bázikus hidroxid. Mérsékelt melegítéssel bomlik. Fehér, higroszkópos. A nedvességet és a szén-dioxidot felszívja a levegőből. A hidegben enyhén oldódik. víz, még kevésbé forró vízben. Egy tiszta oldat (mészvíz) gyorsan zavarossá válik a hidroxid kicsapódása miatt (a szuszpenziót mésztejnek nevezik). A kvalitatív reakció a szén-dioxid mészvízen keresztül történő átvitele CaCO3 üledék megjelenésével és az oldatba való átmenettel. Reagál savakkal és savas oxidokkal, ioncserélő reakcióba lép.
A mészhabarcs (homok + lecsapott mész + víz) előkészítéséhez használják, amely kötözőanyagként szolgál kő- és téglafalak, befejező (vakolás) falak és egyéb építési célok számára. Az ilyen oldatok megszilárdulása a CO2 levegőből történő felszívódásának köszönhető.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H2S04 → CaSO 4 + 2H 2O,
Reagál sókkal, ha csapadék képződik:
Ca (OH) 2 + Na2S03 → CaS03 ↓ + 2NaOH
Kalcium-sók.
Kalcium-szulfát (CaSO 4) - szervetlen vegyület, kénsav kalcium-sója.
A természetben CaSO 4-dihidrátként található? 2H 2 O (gipsz, szelén) és vízmentes állapotban - anhidrit.
Kalcium-klorid, CaCl2 - sósav kalcium-sója.
Magas higroszkópos tulajdonságokkal rendelkezik. Oldhatóság (g / 100 g H2O): 74 (20 ° C) és 159 (100 ° C). A kalcium-klorid vizes oldatai alacsony hőmérsékleten fagynak (20% –18,57 ° C-on, 30% -48 ° C-on).
Hidrátot képez CaCl2 · 6H2O-ra, amely 29,8 ° C-ig stabil; magasabb hőmérsékleten 4, 2 és 1 H2O molekulával rendelkező kristályos hidrátok esnek ki a telített oldatból. Ha CaCl2 * 6H2O-t (58,8%) kevertünk hóval vagy jéggel (41,2%), a hőmérséklet -55 ° C-ra csökken (cryohidrát pont).
Kalcium-kloridot kapunk melléktermékként a szóda előállításában.
A kémiai laboratóriumban a kalcium-kloridot használják töltőanyagként a szárítócsövekhez, más néven kalcium-kloridnak, amelyet az edényben lévő anyagok légköri vízgőzből és gázok szárítására történő elkülönítésére szánnak.
A kalcium-kloridot gyorsítószerként is használják a cement elhelyezéséhez;
Kalcium-karbonát (kalcium-karbonát) - szervetlen kémiai vegyület, szénsav só és kalcium. Kémiai képlet —CaCO 3. A természetben ásványok formájában található - kalcit, aragonit és vaterit, a mészkő, márvány, kréta fő összetevője, a tojáshéj része. Vízben és etanolban nem oldódik.
Gitt, különböző tömítőanyagok - mindegyikük jelentős mennyiségben tartalmaz kalcium-karbonátot. Emellett a kalcium-karbonát a háztartási vegyszerek gyártásának alapvető eleme.
A kalcium-karbonátot széles körben használják a tisztítórendszerekben is, a környezetszennyezés elleni küzdelem eszközeként, és a kalcium-karbonát segítségével helyreállítják a talaj savas-bázis egyensúlyát.
- Példák a kalcium és a magnézium oxidjainak és hidroxidjainak az építésben való felhasználására.
Kalcium-oxid és hidroxid:
Amikor mosóhelyiségek vannak.
A fából készült kerítések és a szarufák elmosásakor - a rothadás és a tűz elleni védelem érdekében.
Mészhabarcs készítéséhez. A mész már ősidők óta használják kőműves építésére. A keveréket általában ebben az arányban állítjuk elő: a kalcium-hidroxid (hidratált mész) és víz keverékének egy részéhez három vagy négy darab homokot adunk. Amikor ez megtörténik, a keverék a reakcióval megkeményedik: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Ez egy exoterm reakció, az energiakibocsátás 27 kcal (113 kJ).
Amint az a reakcióból látható, víz folyik a folyadék alatt. Ez negatív tényező, hiszen mészhabarcsos épületekben a magas páratartalom hosszú ideig fennmarad. Ebben a tekintetben, valamint a kalcium-hidroxiddal szembeni további előnyök miatt, a cement gyakorlatilag helyettesítette azt, mint kötőanyagot az építési megoldásokhoz. Ezenkívül nem elfogadható a kályhák fektetésére is, mert a magas hőmérsékletek hatására felszabadul a szén-dioxid.
Szilikátbeton előállításához. A szilikátbeton összetétele megegyezik a mészhabarcs összetételével, de más módszerrel készül - a kalcium-oxid és a kvarchomok keverékét nem kezelik vízzel, hanem túlhevített (174,5-197,4 ° C) vízgőzzel egy autoklávban 9-15 atmoszféra nyomáson.
Szilikát tégla gyártásában.
Oxid és magnézium-hidroxid:
tűzálló anyagok (magnezit építőlemezek) kombinált rendszereinek előállítására cementek előállítására. A magnézium-oxidot (kausztikus magnezit) kötőanyagként használják, amely MgCl2-oldattal összekeverve képes gyorsan megszilárdulni és erősíteni a levegőben.
- a természetes vizek keménysége: meghatározás, keménység típusok, víz keménységének eltávolítására szolgáló módszerek: fizikai, kémiai (reakcióegyenletek), fizikai-kémiai.
Az oldatban nagy mennyiségű kalcium- vagy magnéziumsót tartalmazó természetes vizet kemény víznek nevezzük, szemben a kevés vagy semmilyen kalcium- és magnéziumsót tartalmazó lágy vízzel.
Ezek közül az első a kalcium és magnézium-hidrogén-karbonátok jelenléte, a második az erős savak, szulfátok vagy kalcium- és magnézium-kloridok jelenléte. A karbonát keménységű víz hosszabb forralásával csapadék képződik, amely főként CaCO3-ból áll, és ugyanakkor felszabadul a CO2.
Mindkét anyag a kalcium-karbonát bomlása eredményeként jelenik meg:
Ezért a karbonát merevséget ideiglenes merevségnek is nevezik. Mennyiségileg az ideiglenes merevséget a vízből eltávolított bikarbonát-tartalom jellemzi, amikor egy órát főznek. Az ilyen forralás után fennmaradó merevséget állandó merevségnek nevezzük.
A víz keménységét a vízben lévő kalcium- és magnéziumionok milliekvivalensének összege adja meg. Egy milliekvivalens merevség 20,04 mg / l vagy 12,16 mg / l tartalomnak felel meg.
A természetes vizek keménysége nagyban változik. Különböző a különböző tározókban, és ugyanabban a folyóban egész évben változik (minimális az árvíz alatt). A tengeri vizek keménysége jóval magasabb, mint a folyók és tavak. Így a Fekete-tengervíz teljes keménysége 65,5 mekv / l. A világ óceán vízének keménysége 130,5 mekv / l (beleértve a 22,5 meq / l / meq / l).
Jelentős mennyiségű kalcium- vagy magnéziumsók vízben való jelenléte számos technikai célra nem alkalmas. Így a kemény vízzel ellátott gőzkazánok hosszabb idejű táplálásával a faluk fokozatosan fedett egy mezii sűrű kéregével. Az ilyen kéreg már a rétegvastagságban jelentősen csökkenti a kazán falai közötti hőátadást, és ennek következtében az üzemanyag-fogyasztás növekedéséhez vezet. Ezenkívül hólyagképződést és repedést okozhat mind a fűtőcsövekben, mind a kazán falán.
A kemény víz nem ad szappannal habot, mivel a szappanban lévő zsírsavak oldható nátrium-sói - a palmitin és a sztearinsav - ugyanazon savak oldhatatlan kalcium-sóivá alakulnak:
A kemény vizet nem lehet használni bizonyos technológiai folyamatok, például festés során.
A víz állandó keménysége a kalcium és magnézium szulfátjainak és kloridjainak jelenlétében van, és nem forraljuk ki. Az ideiglenes (eltávolítható) és állandó keménység összege a víz teljes keménysége.
A merevség meghatározásának különböző módjai vannak.
Tekintsünk kettőt közülük:
1) az időbeli merevség meghatározása titrált sósavoldattal
2) komplexometriai módszer a teljes merevség meghatározására.
A vizes minta sósavval történő titrálása során metil-narancs jelenlétében a bikarbonátok bomlása ideiglenes merevséget okoz:
A meghatározás módja. A vizsgálati vizet 100 ml-t pipettával vagy mérőhengerrel egy kúpos lombikba visszük, 2-3 csepp metil-narancsot adunk hozzá és titráljuk 0,1 és 0,3 ml-rel. HCl-oldatot, amíg narancssárga szín jelenik meg.
Számítási eredmények elemzése. 1 ml 0,1 n. A HCl-oldat 0,1 / 1000 g ekvivalens vagy 0,1 mg ekvivalens Ca 2+ -nak felel meg. V (HCl) 0,1 V (HCI) / 1000 g ekvivalens vagy 0,1 V (HCI) mg-ekvivalens Ca 2+ -nak felel meg. 0,1 V (HCl) mEq térfogatban van VA-ban. Ahhoz, hogy a merevséget 1 liter vízben milligramm ekvivalensben fejezzük ki, meg kell osztani a VA értéket és megszorozzuk 1000-gyel, azaz a vizsgált víz keménységét
![]()
Eltávolítási módszerek.
Termikus lágyítás. A víz forráspontja alapján a termikusan instabil kalcium- és magnézium-hidrogén-karbonátok a skála kialakulásával bomlanak:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
A forráspont csak az ideiglenes (karbonát) keménységet távolítja el. Alkalmazást talál az életben.
Reagens lágyítás. Az eljárás alapja a nátrium-karbonát nátrium-karbonát vagy hidratált mész Ca (OH) 2 hozzáadása a vízhez. Ugyanakkor a kalcium- és magnézium-sók oldhatatlan vegyületekbe jutnak, és ennek következtében csapadék keletkezik.
Például a hidratált mész hozzáadásával a kalcium-sók oldhatatlan karbonáttá alakulnak:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
A legjobb reagens a víz teljes keménységének kiküszöbölésére a nátrium-ortofoszfát Na3PO4, amely a legtöbb háztartási és ipari termék része:
3Ca (HCO3) 2 + 2NaPPO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MS04 + 2Na3P04 → Mg3 (PO4) 2 ↓ + 3Na2S04
A kalcium- és magnézium-ortofoszfátok vízben nagyon kevéssé oldódnak, ezért mechanikai szűréssel könnyen elválaszthatók. Ez a módszer viszonylag magas vízfogyasztás esetén indokolt, mivel számos specifikus probléma megoldását jelenti: üledékszűrés, pontos reagens adagolás.
Kationcsere. Az eljárás ioncserélő szemcsés terhelés (leggyakrabban ioncserélő gyanták) alkalmazásán alapul. A vízzel való érintkezés ilyen terhelése elnyeli a keménység sók kationjait (kalcium és magnézium, vas és mangán). Ehelyett az ionformától függően nátriumot vagy hidrogént tartalmaz. Ezeket a módszereket Na-kationizációnak és H-kationizációnak nevezik. Megfelelően kiválasztott ioncserélő terhelés esetén a víz keménysége az egylépéses nátrium-kationizációval 0,05-0,1 ° W-ra csökken, kétlépcsős terheléssel - 0,01 ° W-ig. Az iparban az ioncserélő szűrők a kalcium- és magnéziumionokat nátrium- és káliumionokkal helyettesítik, és lágy vizet termelnek.
Fordított ozmózis. Az eljárás a víz áthaladásán alapul egy féligáteresztő membránon (általában poliamidon). A keménységek sóival együtt a többi sót eltávolítjuk. A tisztítási hatékonyság elérheti a 99,9% -ot.
Nanoszűrés van (a membrán lyukainak névleges átmérője megegyezik a nanométer egységével) és a pikofiltrációval (a membrán lyukainak névleges átmérője megegyezik a pikométer egységével).
Ennek a módszernek a hátrányai:
A fordított ozmózis membránra szállított víz előkezelésének szükségessége;
Az 1 liter termelt víz viszonylag magas költsége (drága berendezések, drága membránok);
A termelt víz alacsony mineralizációja (különösen, ha pikofiltráció). A víz majdnem desztillálódik.
Elektrodialízis. Alapja a sók eltávolítása a vízből egy elektromos mező hatására. Az oldott anyagok ionjainak eltávolítása speciális membránok miatt történik. Ugyanúgy, mint a fordított ozmózis technológia alkalmazása esetén, a többi keménység eltávolítása a keménységionok mellett történik.
A kemény sókból teljesen tiszta vizet desztillálhatjuk.
