Ekvivalentne reakcije, koje karakteriziraju snagu razrijeđene klorovodične kiseline. Popis ispita za prehranu iz discipline
Pochorninya površine starih slika, oslikanih olynyi farbs, do skladišta, koje uključuju olovni bilil (PbCO3), povezane s izjavama željeznog olovnog sulfida (II) kroz pojavu vode u atmosferi. Ako površinu prekrijete vodenim peroksidom, tada se uspostavlja reakcija s olovnim (II) sulfatom bijele boje:
PbS + 4H2O2 = PbSO4 + 4H2O.
Na takav način obnoviti stare slike, naslikane olyinyi farbs.
Zasosuvannya kisnyu i sirki
Područje skladištenja hrane predstavlja beba 61.
dopustiti vikoristovuvati yogo za infekciju piti vodu da strane industrijske otpadne vode; kao dezinficijens u medicini. Ozon će pobijediti kao rezultat izljeva.
Vina za proizvodnju alkoholne kiseline, priprema sirnika, bengalske vatre, borba sa školarcima države Silskoy i pomoć djeci s bolestima. Syrka znati skladištenje gumija, barvnika i pigmenata, komadnih vlakana, luminofora i in.
Mali. 61. Zasosuvannya sisnyu

Za kiselost u poluvremenu, najkarakterističniji koraci oksidacije su –2, atomi sumpora, selen i teluru su oksidirani koraci –2, +2, +4 i +6.
Oksidacija snage i kiselosti očituju se u njihovim reakcijama s metalima, vodom i djelima, nemetalima.
Napajanje i napajanje
1. Pohranite formule spoluk kisnyu s kalíêm, kaltsíêm i alumíníêm. Predstavite korake oksidiranog elementa kože i nazovite to danom.
2. Zaštitite glavninu syrka na aluminij sulfidu.
3. Ime "ljubac" - oksigenij znači "scho roozhuê kiselina". Zapiši kemijske formule vídomih kiseline za vas, u skladište koje će položiti element. Imenujte kiseline.
4. Koje alotropne modifikacije poznajete? Što smrdi dolazi od jedne vrste jedne stvari?
5. Kisen, koji ljudi udišu, gubi se s hemoglobinom krvi. Naizgled, masa hemoglobina od 1 g data je volumenom (n.u.) 1,35 cm 3. Umjesto hemoglobina u krvi zdravih ljudi 140 g/dm3. Zagalni volumen krvi - 6 dm3. Zaštitite kemiju kiselosti, jer možete ovisiti o krvi ljudi.
6. Visnaznit maseni udio klorovodične kiseline u rasponu, odsječen pri točenju vode u volumenu (n.u.) 8,96 dm 3 u vodi s masoyu 500 g.
7. Razstavte performanse u napadnim shemama oksidno-bazične reakcije:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2 S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
Imati kožne reakcije da oksidiraju i prevladavaju.
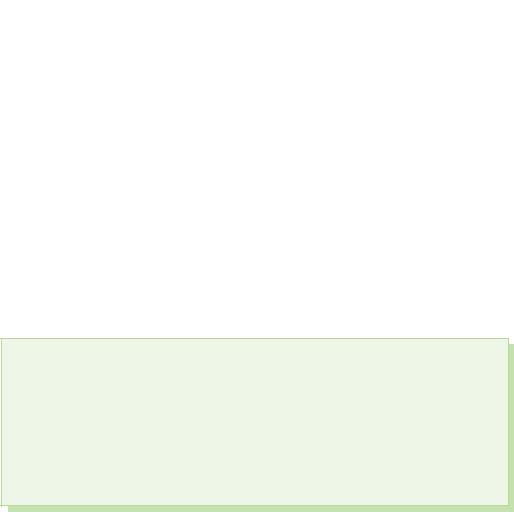
§ 39. Kisnevmísní spoluki sírki
Imati s'êdnannyakh s sirka viyavlyaê stupanj oksidacije+4 i +6.
Serca (IV) oksid. Čista kiselina
Sivi oksid (IV) - SO2 (čisti plin) - je plin bez šipka s oštrim karakterističnim mirisom, koji se javlja tijekom tople vode:
S + O2 = t SO2.

Neki od onih koji su pronašli zastoj bili su vezani za kamene masne vene koje su mogle izgorjeti. Jak pisanje antičkog povjesničara Plinija starijeg iz 1. st. do zvuka. Odnosno, "mirisi vatre vatre mogu sačuvati sve vrste čari i otjerati svaku nečistu silu." Dezinfekcijska i baktericidna moć serum (IV) oksida postat će opasna. Bjelkasti plin se troši u procesu prerade povrća, voća i voća kako bi se spriječilo njihovo truljenje.
Ispuštanje čistog plina u blizini vode (do 40 volumena SO2 po 1 volumenu vode) - nestiyka, dvostruka baza sirkova kiselina yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
Čista kiselina je slaba kiselina, u razlikama u vodi često se odvaja od tvrdnji hidrosulfitnih i sulfitnih iona:
H + + HSO -, | - H + + SO 2–. |
||||
Čista kiselina je kemijska snaga, zagalna za kiseline: interakcija s bazičnim oksidima, bazama, ulazak u reakcijsku razmjenu sa solima nižih kiselina, zokrem, vitisnya iz soli, slaba kiselina:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Serkijev oksid (VI)
Serca (VI) oksid je prisutan, oksidirajući serum (IV) oksid je prisutan u prisutnosti katalizatora na temperaturama blizu 500 C:
t, mačka.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Za ekstravagantne umove, serkijski oksid (VI) SO3 je jalov izvor vode, koji se na temperaturama ispod 17 °C pretvara u kristalnu riječ. Ovo je tipičan kiseli oksid, koji u kombinaciji s vodom pretvara jaku kiselinu:
SO3 + H2O = H2SO4.
Sirčana kiselina
Grafička formula je model molekule sumporne kiseline i usmjerena je na malo 62.
Mali. 62. Grafička formula i model molekule klorovodične kiseline
Imati pitanja uzgoja sirchan kiselina je jak elektrolit,
і njen disosíatsíyu rotirati ovako:
H2 SO4 → 2N + + SO4 2–.
Fizička snaga klorovodične kiseline
Sirčana kiselina - važna (jačina 1,83 g / cm3), masna, bez bora, bez mirisa. Vaughn će otići do vode u bilo kojem pogledu.
Proces određivanja H2SO4 s kemijskom količinom od 1 mol superponira se na količinu od 92 kJ topline, koja se može prilagoditi vrijednostima toplinskih učinaka u kemijskim reakcijama. Vizualizacija velike količine topline tijekom interakcije klorovodične kiseline i vode dokaz je stvaranja mikrosfera s dvije riječi hidrata tipa H2SO4 n H2O.
Na primjer, H2SO4 · H2O; H2S04 2H20; H2SO4 3H2O itd.
nova kiselina i voda omogućuju da se koristi kao snažno sredstvo za prijenos vode, na primjer, za sušenje plinova.
Razvoj suma u slučaju diseminacije klorovodične kiseline u vodi može se nadzirati u obliku briketa. Sjećam te se ne možete dodati vodu kiselini
lot, nakon čega slijedi neprekidno miješanje otopine, ulijte kiselinu u vodu.
Veseli autoriteti limunska kiselina. Sulfati
Sulfati. Razrijeđena sirchan kiselina sve je karakteristično za kiseline snage: izmjena s metalima, koji stoje između sredine aktivnosti i vode; s osnovnim amfoternim oksidima, s bazama i solima. Općenito, postoje soli: srednji - sulfat, na primjer K 2 SO 4 í kiselina -
hidrosulfat, na primjer KHSO4.
Većina sulfata i hidrosulfata se dobro odlaže vodom, veliki broj njih je odobren kristali... Deyaki kristali soli klorovodične kiseline i nazivaju se vitriol: citrusni vitriol CuSO4 ∙ 5H2 O, bijeli vitriol FeSO4 ∙ 7H2 O i ín.
Za propadanje organske kiseline i soli na razini vode moguće je razviti razne soli:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
Kao rezultat reakcije, doći će do opsada sulfatnog barija.
Laboratorijski pregled 6
Propisivanje kemijskih autoriteta razrijeđene sirhanoične kiseline
Koristi se pet epruveta: metal (cink ili čak metal na vibraciji mjerača), bazični oksid, natrijev hidroksid, natrijev karbonat, natrijev klorid. Dajte kap fenolftaleina natrijevom hidroksidu i dajte mu kap kapi. U kožnu epruvetu uliti 1-2 cm3 razrijeđenog sirupa. (Uvaga! Reakcija s glavnim oksidom je suprotna pravilu, ubrzati preopterećenje za polovicu alkohola.)
Što radiš? Koji su znakovi koji signaliziraju prekoračenje kemijskih reakcija? Skladište kemijskih reakcija u molekularnom i ionskom pogledu. Što je s oksidativno-vidnovnoy reakcijama koje ste proveli? Zabilježiti kemijsku snagu razrijeđene sirhanoične kiseline.
Koncentrirana sirhan kiselina je jako oksidacijsko sredstvo, nije razrijeđeno. Uz interakciju koncentrirane sirhanoične kiseline
ne vidi se metal.
Z metali, koji stoje uz aktivnost vode (osim zlata i platine), reakcija na odobreni oksid serkijevog (IV) SO 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2O.
U reakciji s metalima, koji su u području aktivnosti do vode, koncentracija kiseline može se koncentrirati u oksid vode (IV) SO2, voda S ili voda H2 S je prevladavajući oblik aktivnosti metala i tijek reakcije. Na primjer:
4Zn + 5H2 SO4 (fin) = t 4ZnSO4 + H2S + 4H2O.
Nagadaêmo, scho zalizo, aluminij i deyakí ínshi bacili su zle umove na pašu koncentriranom sirchan kiselinom.
Koncentrirana sirčana kiselina dobra je za interakciju s jednostavnim riječima s nemetalima, na primjer, s syrkoy:
S + 2H2SO4 = t3SO2 + 2H2O.
Oksidirajuće bagato preklapanje organski spoluks, sirchan acid obgorta papir, tkanina, drvo, odyag koji shkiru. To se događa s koncentriranom sirchan kiselinom treba.
Koncentrirana sirchan kiselina korisna je za uklanjanje hlapljivih kiselina i soli. Na primjer:
NaCl (TV) + H2SO4 (konc) = t NaNSO4 + HCl.
U Republici Bilorus sirchan kiselinu kruže PDV "Gomel Khimichny Plant", PDV "Grodno Azot".
Područja pijenja kiseline
Miris je predstavljen malom 63.
Mali. 63. Stagnacija limunske kiseline
Sirčana kiselina H2 SO4 - važna je, bez uljnog ridina bez mirisa.
Sirhanova kiselina se razrijedi zajedno s metalima, koji stoje između aktivnosti i vode; s metalni oksidi; osnove; od soli.
Pri interakciji s koncentriranom kiselinom i metalima, voda se ne može vidjeti.
Za propadanje organske kiseline i soli na razinama vode, zlobno je formulirati soli barija.
Napajanje i napajanje
1. Zapišite formule za okside i kisele kiseline sumpora. Pokažite im stupanj oksidacije atoma vode.
2. Potražite masu sirkija, koja se spaljuje u kiselom, jer na planini vidite 29,69 kJ topline. Jeste li dobili sirastu količinu oksida sirka (VI)? Toplinski učinak reakcije gašenja požara postaje 296,9 kJ / mol.
3. Korozivna tablica soli, kiselina i baza u vodi, dodajte 2 jednake reakcije razrijeđene klorovodične kiseline i soli. Zapišite ime
v molekularni i ionski viglyad.
4. Masu zaštititi onom kemijskom količinom sulfatne šipke, koja se postavlja kada se razrijedi klorovodičnom kiselinom za otopinu nitrata, šipkom od 200 g, masenog udjela Ba (NO 3) 2 za svaku cestu 10%.
5. Molimo pogledajte tekst stavka na temelju reakcije, koja karakterizira kemijsku snagu koncentrirane klorovodične kiseline. Započnite faze oksidacije atoma vode u zemlji. U reakciji kože je oksidant.
6. Jaki volumen koncentrirane klorovodične kiseline (= 1,83 g/cm 3) s masenim udjelom H2 SO4 98%, potrebna otopina za masu od 6,4 r?
7. Povećajte učinkovitost shema za početak glavnih oksidativnih reakcija:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2 S + HClO → K2SO4 + HCl.
U reakciji kože je oksidant.
§ 40. Razumijevanje načina na koji proizvod ima kemijsku reakciju
Kemija, pohranjena u skladu sa zakonom očuvanja mase govora, dopustiti da se provede razrahunki, zokryuvat massu, obsyag chihichnuyu produkt reakcije. U praksi je mnogo reakcija obrnuto, dio govora je uključen u rezultate isparavanja, otopine ili odobravanja nusproizvoda. Za ovaj reakcijski produkt treba tvrditi da je manji, malo se toga može vidjeti prije razvoja jednake reakcije. U takvom rangu, ako teoretski prihvatimo težinu proizvoda za jednaku reakciju, ili ako je kemijska količina proizvoda 100%, onda će u stvarnom procesu odlaska do proizvoda ona biti manja od 100%.
Početak reakcije na produkt reakcije je slovo grčke abecede (tsya) i pojavljuje se u dijelovima iste.
Vrsta proizvoda kemijske reakcije je vrijednost koja je skupa za proizvod (volumen, kemijska količina) proizvoda koji je stvarno odrezan do proizvoda (za proizvod, kemijska količina), izračunata za reakciju
U svim slučajevima bit će poznato da je proizvod kemijske reakcije najvažniji. Na primjer, kada je vidomo, za reakciju oksidiranog oksida serkije (IV) u oksid serka (VI)
2SO2 + O2 2SO3
vikhid postati 80% (ili 0,8), što znači, oko sivog oksida (IV) mase 64 g (volumen 22,4 dm3, kemijska količina 1 mol) i prihvatljivog sivog oksida (VI) sa težina ne 80 g (volumen 22,4 dm3, kemijska količina 1 mol), a masa 80 g ∙ 0,8 = 64 g (volumen 17,9 dm3, kemijska količina
Od veličine robe do stvarnog procesa, postoji potreba za uvođenjem dodatnih operacija i operacija.
Lako je vidjeti sliku pričvršćenja krunice iz koncepta „odlaska do produkta reakcije“.
dionica 1. Kao rezultat soljenja sive tekućine mase 48 g, uklanja se sumporov oksid (IV) volumena 28,6 dm3. Vizualizirajte produkt reakcije.
m (S) = 48 g | 1. Vizualno sirast broj sjemenki, |
||||
V praktični (SO2) = 28,6 dm3 | ušao u reakciju: | ||||
m (S) | |||||
(SO2) =? | n (S) | ||||
M (S) | 32 g/mol |
||||
2. Skladišna reakcija serka (IV) oksida: S + O2 = SO2.
3. Znamo teoretsku količinu serky oksida (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Razumijevanje unosa u proizvod kemijske reakcije |
4. Znamo teorijsku analizu serki oksida (IV):
V teor (SO2) = n teor (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Rozrakhumo vikhid na produkt reakcije:
Odgovor: Odgovor na lijek je 85%.
Dodatak 2. Navedite masu FeS2 koja je potrebna za uklanjanje serky (IV) oksida volumena 8,96 dm3, tako da produkt reakcije bude 90%.
V (SO2) = 8,96 dm3 | 1.Vizualno značajna teorijska izmjena serkijevog oksida (IV): |
|||||||||||
(SO2) = 90% | V praksi | V praksi | ||||||||||
m (FeS2) =? | Teorija zvijezda V = | |||||||||||
V teor | ||||||||||||
Vtheor (SO2) = | V vježba (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Znamo teoretsku kemijsku količinu sivog oksida (IV): |
||||||||||||
n teorija (SO 2) | V teorija (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3 / mol |
||||||||||||
3. Reakcija skladišta na oksid sirke (IV) i kemijsku količinu pirita koju je potrebno dati vipalu:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Na temelju težine pirita, koja je neophodna za vipal: m (FeS2) = 0,2 mol · 120 g / mol = 24 g.
Prijedlog: za poštivanje oksida sirka (IV) potrebno je uzeti masu od 24 g.

Vrsta proizvoda kemijske reakcije je vrijednost koja je skupa za proizvod (kosturnica, kemijska količina) od stvarno rezanog proizvoda do proizvoda (izljev, kemijski proizvod) izračunat za reakciju. Okrenite se u dijelovima odinitsi chi vidsotkah.
Napajanje i napajanje
1. Zašto bi se praktičan odgovor na proizvod reakcije trebao nazvati manjim, teoretski nižim osiguranjem za jednak odgovor?
2. Reakcijom vode s kemijom vode, 1 mol, voda se postavlja u kemijsku količinu od 0,85 mol. Pogledajte produkt reakcije.
3. Kao rezultat interakcije klorida mase 200 g iz klorovodične kiseline, taloženje sulfata težine 100 g.
4. Potražite volumen (n.u.) i kemijsku količinu sivog oksida (IV), koja se utvrđuje sa spaljenim sjemenom od 64 g, jer je produkt reakcije 75%.
5. Izračunajte masu spaljene vode ako je količina sivog (IV) oksida smanjena volumenom (n.u.) 89,6 dm 3 bi trebao postati 80% od teoretski mogućeg.
6. Naizgled, vikhid oksid serkija (VI), odsječen tijekom oksidiranog serkijskog oksida (IV),
cesta 85%. Pomoću mase, volumena (n.o.) i kemijske količine serkijevog oksida (IV), koji je ušao u reakciju, kada se oksid serkija (VI) ukloni s volumenom (n.u.) 2,24 dm3.
7. Najprije započnite maseni udio soli u roščinama, odsječenim destilacijom od mase 3,2 g, u sirupastim kiselinama mase 192 g, ako rezultat reakcijskog produkta postane 85%.
§ 41. Dušik i fosfor
Dušik N i fosfor P trune u periodičnom sustavu grupe VA. U cijelu skupinu periodičnih sustava uvode se Mis'yak As, surma Sb i bizmut Bi. Dušik i fosfor ê s nemetalima, dovode mish'yak i surmu u metale, a smut u metale.
Budova atomív taj stupanj oksidacije
Atomski elementi VA grupe imaju po 5 elektrona za najvažniju razinu energije;
7 N ↓ | 15P ↓ |
Zavdannya.
- Chim viklikana je takva promjena? Na kojoj snazi bi se dikromat trebao ugraditi u kromni zbroj za posudu?
- U epruvetu ulijte 5-6 kapi kalcijevog dikromata i 3 kapi klorovodične kiseline. Dodajte 2 kapi jodida u kaliyu i dodajte 10 kapi vode umjesto epruveta. Manji dio olovkom prenesite u epruvetu umjesto da dodate kap škroba. Chi zm_nilosya zabarvlennya škrob? Za što? Rivnyannya OVR i vzvnyannya elektronička metoda.
- Početna karakteristika elementa 15 R. Snaga alotropnih modifikacija fosfora. Razmjena fosfora jednostavnim i složenim riječima.
Farmacija ima živin (II) oksid stagnira kao niži antiseptik za kuhanje masti, kako dobiti puno razrijeđenog natrijevog hidroksida na bazi živinih soli.
Zavdannya.
1. Napišite specifičnu reakciju na živin (II) oksid. Objasnite zašto je potrebno izvoditi operacije na temryavi?
3. Osnovni zakoni kemije.
Vikoristannya spoluk cink u medicini temelji se na ovom kiselom, antiseptičkom dizajnu. 0,25% razchin cink sulfat vykorytutsya za pripremu kapi za oči odjednom s 2% borne kiseline.
Zavdannya.
- Pripremite 0,25% otopinu cink sulfata s volumenom od 100 ml (ρ = 1,02 g/ml).
- Zd_ysniti revizija
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Kovalentna veza, viznennya, vidi, mehanizam osvjetljenja, moć. Valence. Stadij je oksidiran.
· Farmaceut za kontrolu kvalitete lijeka zaliza metodom permanganatometrije.
Zavdannya.
1. Napisati jednak odgovor i edukaciju elektroničkom metodom.
2. Izračunajte koliki je volumen od 0,5% - stopa (ρ = 1,004 g/ml) veličine natrijevog hidroksida potreban za reakciju s 0,1 M otopinom klorida (III) volumena od 20 ml.
3. Periodični zakon koji periodični sustav na svjetlu dana o Budovi atoma.
· Zalizo, obnovljen, koji iznutra stagnira za razliku od njega, ali se vidi iz kuca sulfida medi, vugilla, silicijeve kiseline, mis'yaku.
Zavdannya.
1. Predložite način da se riješite kuće. Obruntovati vidpovid.
3. Glavna vrsta kemijskog zvuka. Priroda stvara veseli zvuk.
· Za organizam permanganata ê sa žitaricama, í̈kh zeshkozhennya provesti 3% vodenu otopinu H 2 Pro 2 s kiselom kiselinom.
Zavdannya.
1. Napišite uobičajenu reakciju. Razina odgovora elektroničkom metodom
- Oxydi, viznachennya, klasifikacija, nomenklatura, moć i metode opsjednutosti.
· Broj riječi u pripremi provodi se metodom permanganatometrije, koristit ćemo Fe2 + za oksidaciju u Fe3 +. Odabirom obnovljivih otopina određuje se količina natrijevog permanganata tijekom zagrijavanja i tijekom hlađenja s 0,1 N otopinom.
Zavdannya.
1. Zapisati standardne reakcije koje su u osnovi osnovne definicije.
2. Pripremite 200 ml 0,1 n KMnO 4 (faktor ekvivalencije vrijednosti za pripravak).
3. Kiseline, viznachennya, klasifikacija, nomenklatura, moć, načini opsjednutosti.
· Farmakopejsku pripremu nitrata medija treba izbaciti uvredljivog ranga: otopinu legure mineral-medij iz razrjeđenja dušične kiseline, da bi se pročistilo uklanjanje nitrata iz kuća, istaložiti klorovodičnom kiselinom. Opsada se, kao rezultat, uvodi s cinkom u kiseloj sredini, a u sredini, ne iz kuća, opet u dušičnoj kiselini.
Zavdannya.
- Napišite niz uobičajenih reakcija.
- Identifikacija pozitivnih reakcija na Cl-, Br-, J anion s bazom srednjeg nitrata, što je osnova za potvrdu valjanosti pripravaka u kloridima, jodidima, bromidima u kalorijama.
- Prezentacija, viznachennya, klasifikacija, nomenklatura, moć, načini opsjednutosti.
9. Nitrat medija stagnira u slučaju erozija, zavoja, stanja konjunktivitisa u viglyadama 2,5 i 10% vodene otopine.
Zavdannya.
- Pripremite 2% veličine AgNO 3 volumena 50 ml (ρ = 1,015 g/ml). Koliko je misli bilo posvećeno razlici?
- Zd_ysniti revizija
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, klasifikacija, nomenklatura, moć, načini opsjednutosti.
· Farmaceut bi trebao provesti identifikaciju farmakopejskog pripravka sa sulfatnom pločicom.
Zavdannya.
1. Kako koristiti vikorist sulfat u medicini? Zašto bi se sulfatne barije trebale legirati s natrijevim karbonatom prije provođenja identifikacijskih reakcija? Dokaz potvrđivanja sličnih reakcija.
2. Vikonacija reakcija identifikacije soli BaSO4, CaSO4, Na2SO4.
3. Složeni spoluks, viznachennya, budova za A. Werner, priroda kemijskog zvuka, klasifikacija, nomenklatura, disocijacija. Stagnacija složenih otopina u medicinskoj i kemijskoj analizi.
· Farmaceut s koncentriranom otopinom amiakua, koji dopušta grubo uništenje tehnologije sigurnosti - vodeći robote na viteškoj glavi bez pojačane vučne sile.
Zavdannya.
- Koje nasljeđe možete učiniti kada radite s koncentriranim rasponom amiakua bez dodirivanja tehnologije sigurnosti? Yak pershu liječničku pomoć potrebno je platiti kada se amiak uklanja u parovima.
- Zdíysniti tako ponovni razvoj.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
Zapisati ispravne reakcije za molekularni i ionski pogled, a za OVR - razinu metode elektroničke ravnoteže.
- Kinetika kemije. Brzina kemijskih reakcija. Infuzija fleksibilnih čimbenika na brzinu kemijskih reakcija.
· Dušik u lijeku stagnira u količini amonijaka u vodi, amonijevih soli, dušikovog oksida i natrijevog nitrita.
Zavdannya.
- Što ću s poklonom dušiku? Napišite formule zadanih govora i jednakih reakcija koje karakteriziraju glavnu moć.
- Napišite reakciju rívnyannya između natrijevog nitrata i kalcijevog permanganata u kiseloj sredini. Reakciju prepoznati po metodi reakcije
- Bez pregovora i vukodlaci kemijske reakcije... Khimichna Rivnovaga. Mac zakon za jednako važne sustave. Rivnovagi konstanta. Le Chatelov principê.
· Ljekarnik bi trebao provesti identifikaciju soli s natrijevim sulfatom, natrijevim kloridom, natrijevim hidrokarbonatom.
Zavdannya.
- Viconatie reakcije na ion SO 4 2-, Cl-, HCO 3-.
- Rosrahuvati, količina grama u kristalohidratu Na 2 SO 4 · 10H 2 O potrebna je farmaceutu da ukloni količinu vode u količini od 500 g, da ukloni 5% količine Na 2 SO 4?
- Reakcije koje vode oksidaciju. Glavne odredbe elektronske teorije oksidativno-vitalnih reakcija. Nayvazhivíshí oksidirajuće i vodeće figure. Zrivnyannya oksidno-vidnovnykh reakcije metodom elektronske ravnoteže i ionsko-elektronskom metodom.
Kaliêva síl sírchanoíy kiselina i dotjerivanje puno stranih preparata za tijelo (ksenobiotici) - líkuvalny lijekovi Taj se metabolizam temelji na izjavama nekog nepametnog govora – konjugata, jer se lako prenosi u tijelo.
Zavdannya.
- Otrimatyvu síl síl silhanoična kiselina na normalan način, vikoryuchi na stolu reagensa. Napišite niz uobičajenih reakcija.
- Raspon molekularnih reakcija koje se rotiraju s tako brzom íonny ívnyannya:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Disperzijski sustavi, oznaka, klasifikacija. Suspenzije, aerosoli, emulzije. Vikoristannya grubo raspršeni sustavi u medicini i farmaciji.
Farmaceut treba ukloniti 5% otopinu sirhanoične kiseline.
Zavdannya.
- Kakvo je oksidacijsko zdravlje aniona SO 4 2 u koncentraciji kiseline? Zapišite točne reakcije kako biste okarakterizirali snagu razrijeđene i koncentrirane kiseline.
- Pripremite 5% jačine sirhanoične kiseline, mayuchi 50 ml sirhanoične kiseline i maseni udio H 2 SO 4 30 %.
- Kolosalne razlike, klasifikacija, oznaka, molekularno-kinetički ta optička snaga, odbijanje. Stabilnost kolosalnih razlika. Zgrušavanje. Peptizacija. Budova micel. Dializ.
· Sírka, scho za ulazak u skladište aminokiselina, za oksidaciju u organizmu. S cijelom endogenom sirchanskom kiselinom brine se o sudbini stranih mekinja spoluch - fenola, krezola, indola.
Zavdannya.
- Opišite moć kisele kiseline i poništite pravila robotike s kiselinama.
- Rosrahuvati, koji je volumen sirhanoične kiseline masenog udjela H 2 SO 4 25% i zgusnutog 1,18 g/ml, potrebno je uzeti za neutralizaciju kalcijevog hidroksida, volumena 50 ml, s masenim udjelom KOH 12%. i gusta 1,1 g/ml.
- Istina odluke, vrijednost, glavno razumijevanje, dan do procesa odluke. Difuzija. Osmoza. Osmotski škripac.
· U industrijskim četvrtima, gdje ima puno vode, nije lako nabaviti kisele ploče.
Zavdannya.
- Shho je kod skladište kemije acid ploče u qikh područjima? Yak vin pretvarati se? Napišite jednostavnu reakciju.
- Molekularne i brze razine hidrolize ranih soli:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Sirvododen za ulazak u prirodu veliki broj stvari za razvoj bioloških procesa i odvijaju se u promineralnim vodama.
Zavdannya.
- Moć moći.
- Zd_ysniti revizija:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
- Disocijacija kiselina, baza, soli, vode. Kiselinsko-bazni rivnovaga u razchiny. Ionny dobutok vodi, pH-otopine.
· Službena droga sirki ê sirka, obložena (Sumpor praecipitafum).
Zavdannya.
- Opišite snagu vina i alotropne modifikacije ulja.
- Zd_ysniti revizija:
Zr_vnyati reakcije metodom elektronske ravnoteže.
- Hidroliz. Osjetljivost na proces hidrolize. Hidroliza različitih vrsta soli. Korak do hidrolize. Infuzija novih čimbenika u faze hidrolize.
Farmaceut će provesti identifikacijsku reakciju 3% otopine peroksid peroksida: do 1 ml razrijeđene klorovodične kiseline, 1 ml razrijeđene klorovodične kiseline, 1 ml etera i 0,5 ml otopine kalcijevog dikromata, kao rezultat koncentracija koncentracije klorovodične kiseline u kiselini 6
Zavdannya.
- Viconatijeva reakcija identifikacije vodenog peroksida.
- Napisati standard za utvrđivanje razlike između vodenog peroksida i zdravlja pomoću metode elektroničke ravnoteže.
- Opće karakteristike elemenata glavne pidskupine VII grupe i spoluka. Medicinsko- biološki smislen halogen
· Kisen je farmaceutski proizvod koji opisuje GF. Yogo zasosovyut za udisanje za različite vrste kisele gladi.
20. Zavdannya.
- Napišite točne reakcije za otkrivanje CO, 2, NO, NO2.
- Zapisati reakcije r_vnyannya, koje su u osnovi laboratorijske metode odbacivanja kiselosti. Razine indukcije reakcija metodom elektroničke ravnoteže
- Klor, klor voda, klorovodična kiselina, klorid. Fizikalna i kemijska snaga klora i druge polovice. Medicinski i biološki značaj halogena.
· Farmaceutska revizija lijekova na bazi natrijevog klorida, natrijevog bromida i natrijevog jodida.
Zavdannya.
- Za bilo koju namjenu moguće je koristiti sol u farmaciji i medicini.
- Vykonati yakísní reakcije na anione Cl-, Br-, J-.
- Fizikalna i kemijska snaga kiselog klora. Otrimannya. Zasosuvannya.
· Jedna od industrijskih metoda uklanjanja joda za farmaceutske proizvode je proces uočavanja joda iz bušotine. Yodidi, u blizini bušotinskih voda, oksidiraju prema shemi:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Zavdannya.
- Preparati joda jaka i kako zapeti u medicini.
- Naučiti reakciju, postaviti temelje za opsjednutost jodom metodom napivreaktsii.
- Zagalny karakterističan za halkogene. Snaga je kisela da yogo spoluk. Medicinsko i biološko značenje
· Farmaceut viznacha referentne lijekove u natrijevom kloridu, kalciju i kalciju.
Zavdannya.
- Za sve namjene, vikorist i farmaceutski pripravci.
- Viconati reakcija identifikacije danih soli.
- Spoluki kiselim vodom. Fizikalna i kemijska svojstva vode. Peroksidna voda, struja, skladištenje u medicini. Značenje vode u životu organizama.
· Halogeni Zi spoluk s hipokloritima kiselog lišaja postaju interes za medicinu jer se dezinficiraju.
Zavdannya.
- Temelji li se na snazi hipoklorita? Napišite niz uobičajenih reakcija.
- Rosrahuvati, potrebno je uzeti nekoliko grama klorove vapne za uklanjanje 2 litre aktivnog klora.
- Sirka i íí̈ spoluki. Alotropija vilnog sirka. Fizička i kemijska snaga vode, vode, vode, kiselina i soli.
· U slučaju nedostatka kiselosti kašastog soka potrebno je koristiti interno razrijeđenu klorovodičnu kiselinu.
Zavdannya.
- Ponovno pročitajte osnovna pravila robota s kiselinama.
- Rosrahuvati, u bocu 36,5% otopine (ρ = 1,19 g/ml) klorovodične kiseline, a za pripremu je potrebno uzeti 100 ml. 8,2% (ρ = 1,040 g/ml) kiseline.
- Fizičke i kemijske moći vodenih oksida, djevičanske kiseline i organske kiseline. Sulfiti. Sulfati. Moć, posjed, posjed.
· Ljekarna ima jednu od standardnih otopina ê otopina, gdje se može dozirati 33% kalcijevog acetata, koji se može dozirati otopinom 30% kalcijevog karbonata - na bazi organske kiseline.
Zavdannya.
1. Napišite jednaku reakciju molekularnom i ionskom promatraču.
- Glavne karakteristike elemenata glavne skupine skupine V. Snaga dušika. Vrijednost dušika u životu organizama.
· Propisivanje razlika u govoru, koji je jaka baza i slaba kiselina. Za narudžbu GFH yak stabilizatora isporučuje se 0,1 n otopina natrijevog klorida veličine 4 ml na 1 litru otopine.
Zavdannya.
- Napišite primjer reakcije hidrolize CH3COONa soli.
- Rosrahuvati, potrebno je poštivati nekoliko grama NaOH, podrezati s 500 ml veličine 0,1n. Pripremite širok raspon rješenja za sigurnosnu tehnologiju.
- Amiak. Slani amonijak. Snaga. Stagnacija u medicini i farmaciji.
· Farmaceut je pripremio recept za mast: 1 g kalcijevog karbonata i 0,5 g natrijevog tetraborata u 70 ml destilirane vode, 10 g fuzije stearina s 15 g vazelin olija i tankim mlazom miješajući ružu u topli karbonat s vodom. ...
Zavdannya.
- Koliko riječi ste usvojili u prošlosti? Yake srednji čovjek da se pretvara za što? Dokaz potvrđivanja sličnih reakcija.
- Pripremite tehno-kemijske vagi za robote. Poštujte 1 g kalorija karbonata na tehno-kemijskim teresama.
- Oksid u dušik. Dušična kiselina i soli. Fizikalni i kemijski autoriteti. Medicinska i biološka vrijednost s dušikom
Farmaceut treba pripremiti 0,05% permanganat od 200 ml za ispiranje praznih usta i grla.
Zavdannya.
- Na kojoj moći permanganirati cali runtuet yogo političko djelovanje? Yaki spolukyu mangan stagnira u za piće?
- Količina KMnO 4 grama treba iskoristiti za uklanjanje 200 ml 0,05% KMnO 4 (ρ = 0,9994 g/ml.). Demonstrirati tehniku dobivanja zadanog raspona.
- Budova molekule dušične kiseline. Fizikalna i kemijska snaga dušične kiseline i soli. Mediko - biološka vrijednost dušika i spoluka.
Farmaceutika ima živin (II) oksid, koji je opasan kao antiseptik, a oslobađa natrijev hidroksid u obliku razrijeđenih soli žive (II).
Zavdannya.
1. Napišite specifičnu reakciju na živin (II) oksid. Koje reakcije treba provesti na temryavi?
3. Osnovni zakoni kemije.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Nadkromna kiselina, koja se može naći u isto vrijeme, H 2 CrO 6 je jedna od plavih boja. Sinergija punjenja kiselinom i potpora preparatu N2O2.
Zavdannya.
- Zrívnyati tsyu reakcija elektroničkom metodom.
- Koja vrsta kroma može uzrokovati oksidativnu moć i što s njim?
- Snaga fosfora, fosfornih oksida i fosfornih kiselina, te njihovo posjedovanje. Medicinska i biološka vrijednost fosfora
· Suma magnezijevog oksida (85%) i magnezijevog peroksida (15%) je lijek pod nazivom "magnezijev peroksid", koji se koristi za stagnaciju u slučaju dislokacije slunk-intestinal.
Zavdannya.
- Objasnite antacidni i baktericidni lijek. Dokaz potvrđivanja sličnih reakcija.
- Rosrahuvati, nekoliko grama MgO i MgO 2 trebate uzeti za pripremu 100 g ovog pripravka. Respekt 10 g magnezijevog oksida na tehno-kemijske tereze.
- Opće karakteristike elemenata IV grupe glavne pidgrupe. Budova, Fizička snaga alotrop u ugljiku. Vesela snaga jake osobe u ugljenu.
· Isperite hidrokarbonat natrija (pitnoy soda) stajati na viglyadi isprati, oprati s vatrenim očima, sluznice ljuske gornjih dichny plemića.
Zavdannya.
- Je li antiseptik za moć natrijevog hidrokarbonata? Dokaz potvrđivanja sličnih reakcija. Što se može koristiti kao antiseptik s natrijevim tetraboratom Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Pripremite 5%-tnu otopinu NaHCO3 zapremine 50 ml (= 1,036 g/ml).
- Budova molekula, fizikalna i kemijska snaga kiselog spoluka u ugljenu. Mediko - biološko značenje u ugljenu koji spoluk.
U antacidnim pripravcima, koji se osvećuju natrijevom hidrokarbonatu, vicoristovy u slučaju rane bolesti, koja je pod nadzorom kiselosti, tobto. acidoza.
Zavdannya.
- Na koju snagu cijene soli trebamo koristiti antacidne lijekove? Dokaz potvrđivanja sličnih reakcija. Kakav govor možete kupiti za svoje ciljeve?
- Zd_ysniti revizija:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
Viconatijeva reakcija Na 2 CO 3 → NaCl → NaNO 3.
- Silicij koji je yogo spoluky, upoznat s prirodom, odbacivanjem, fizikalnom i kemijskom snagom. Mediko - biološko znači silicij.
· 2,5% otopina NaCl se koristi interno za ispiranje kaše kada se ukloni AgNO 3.
Zavdannya.
1. Zašto bih trebao koristiti otopinu NaCl? Dokaz potvrđivanja sličnih reakcija.
3. Opće karakteristike elemenata čelne skupine treće skupine. Vlast je dosadna taj yogo spoluk. Medicinski i biološki značaj u medicini.
· Za uzgoj rijetkih oblika lykarsky, znakovi za in'êkcíj, ínkcij, vikoristovyut ízotoníchny rozchin.
Zavdannya.
1. Koja je također izotonična razlika? Zašto ga nazivaju izotoničnim?
3. Alumíníy da yogo spoluky, moć, odbijanje. Medicinski i biološki značaj aluminija.
· 3% vodena otopina peroksida vode zasosovyat yak zovn_shn_y baktericidni zasib.
Zavdannya.
1. Na temelju čega se bazira baktericidno i krvno-spinalno za vodeni peroksid. O kakvim inozemnim posjetima trebate voditi računa kada putujete?
2. Rosrahuvati, ml. perhidrola (30% vodene otopine N 2 Pro 2, ρ = 1,1 g / ml) treba uzeti za uklanjanje 500 ml 3% otopine (ρ = 1,005 g / ml). Pripremite širok raspon rješenja za ispunjavanje sigurnosne tehnologije.
3. Metali glavne pidgrupe ІІ grupe. Zagalny karakteristika, odbacivanje, fizička i kemijska snaga. Sol kalcija i magnezija. Tvrdoća vode. Usunennya zhorstkosti vodi. Medicinsko-biološki značaj elemenata glavne skupine II.
· Sadašnja farmaceutska industrija proizvodnje lijekova mlinom agregata, vrsta dispergiranih sustava, način unošenja u organizam.
Zavdannya.
1. Koji se sustavi nazivaju dispergiranim?
Kako klasificirati raspršene sustave?
Sadrže li viglyadi dispergirani sustavi lijekove? Donesite određene guzice.
- Otrimati pseći hidrosol pomoću metode zamjene razchinnika.
- Značajne karakteristike stranih metala, posjedovanje, fizička i kemijska moć. Naivazhlivíshí poluchny metalív. Medicinska i biološka vrijednost metala
Na viglyadí vode razchinív ízníh govore, počnite da stagniraju rídki lykarski formi, scho mogu opet promijeniti razliku.
Zavdannya.
- Spravzhn_ razchini, razchinn_st, huškanje, neopustošenje, prenaseljenost razchini. Kakve birokrate imaju?
- Pripremite 5%-tne razine CuSO 4 volumena 100 ml (ρ = 1,051 g/ml) s citrusnim vitriolom CuSO 4 ∙ 5H 2 O
- Početna karakteristika je d - elementi. Metalna bitwise pidgroup Í grupa i í̈kh spoluk. Medicinski i biološki značaj.
· Rusija ima električnu preradu sokova i svježeg zelenog i kreativnog siruvina s niskim udjelom soka: bobičastog voća, voća, korjenastog povrća, malih organizama povrća, uz pomoć pojave sokova (unutarnje prirodne). Unutarnji vmist je kolosalna razlika cigle, nukleinske kiseline, u ugljikohidratima, taninima
Zavdannya.
1. Zovu li vas “kolosalni”? Yak smrad klasificirati? Ponovno pročitajte snagu kolosalnih razlika. Koji procesi leže u osnovi vizije sokova iz rastuće siruvine?
2. Otrimirajte hidrosol hidroksidom fiziološke otopine (III) metodom hidrolize FeCl 3. Napišite dijagram pupova.
- Metali su po bitu iz druge skupine, karakterizacija, fizikalna, fizikalna i kemijska snaga. Medicinski i biološki značaj.
Prilikom pripreme tableta na bazi ekstrakta korijena valerijane ne preporuča se korištenje magnezijevog karbonata kao baze napovnuvača, jer je moguće izazvati neutralizaciju izovalerinske kiseline i ekstrahirati valtrat do kiselosti.
Zavdannya.
1. Objasnite očitovanje moći magnezijevog karbonata. Napišite jednostavnu reakciju molekularnom i ionskom pregledniku. Kako mogu biti pobjednik za pripremu tableta s ekstraktom valerijane?
2. Zd_ysniti revizija:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
3. Opće karakteristike elemenata VI, VII skupine sekundarnih pidgrupa. Oksidativna moć kroma, mangana i spoluka. Medicinski i biološki značaj.
· Zrídzheny u plinu ugljične kiseline vikoristovyuyut u farmaceutskoj virobniztví za viluchennya biološki aktivan govor IZ líkarskoy roslinnoy sirovini.
Zavdannya.
- Na kojoj vrsti snage ugljičnog dioksida plin postaje rutted u tsikh svrhe?
- Zd_ysniti revizija:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Reakcije na razmjenu informacija s molekularnim i ionskim promatračem.
- Opće karakteristike elemenata VIII skupine su bitwise pidgroup. Moć duše je taj yogo spoluk. Medicinski i biološki značaj.
Popis ispita za prehranu iz discipline
Glavno razumijevanje zakona kemije. Sretan rođendan atomu.
Periodični zakon i periodični sustav D.I. Mendeljejev na svjetlu atoma.
Viznachennya, vidi, razmisli o prirodi kemijskog zvuka.
Vrijednost, mehanizam osvjetljenja, snaga kovalentne veze. Valence. Stadij je oksidiran.
Oxydis: oznaka, klasifikacija, nomenklatura, moć i metode opsjednutosti.
Kiseline: viznachennya, klasifikacija, nomenklatura, moć i metode posjedovanja.
Prijave: vize, klasifikacija, nomenklatura, moć i metode opsjednutosti.
Soli: oznaka, klasifikacija, nomenklatura, moć i metode opsjednutosti.
Složeni spoluks: viznachennya, budova za Wernera, tipi, nomenklatura.
Brzina kemijskih reakcija. Dužnosnici, scho ubrizgavaju osjećaj kemijske reakcije.
Nereverzibilne i reverzibilne kemijske reakcije. Khimichna Rivnovaga. M. Chatelov principê. Rivnovagi konstanta.
Reakcije koje vode oksidaciju: vrijednost, osnovno razumijevanje, svakodnevna oksidacija i obnova, nove reakcije oksidacije i olova.
Disperzijski sustavi: oznaka, klasifikacija. Grubo dispergirani sustavi: suspenzije, aerosoli, emulzije.
Kolosalne razlike: vrijednost, moć, opsesija, budova micel.
Istinske odluke: vrijednost, osnovno razumijevanje, svakodnevno u procesu rješavanja. Difuzija. Osmoza. Osmotski škripac.
Glavne odredbe teorije električne disocijacije. Mehanizam električne disocijacije. Korak je konstanta disocijacije.
Disocijacija kiselina, baza, soli. Disocijacija vode i pH-otopina.
Nedostatak hidrolize. Hidroliza različitih vrsta soli. Korak do hidrolize.
Primarne karakteristike elemenata glavne skupine VII skupine. Medicinski i biološki značaj halogena
Klor, klorna voda i klorovodična kiselina. Odbijanje, moć. kloridi.
Kisnevi spoluki klor.
Zagalny karakterističan za halkogene. Kisen taj yogo spoluki. Medicinsko i biološko značenje
Vlastivosti spoluk kisele vode (voda, vodeni peroksid). Zastosuvannya N 2 Pro 2 od medi. Vrijednost pogona.
Syrka. Alotropija vilnog sirka. Veseli autoriteti svijeta. Sirvoden. Vodovodična kiselina i soli.
Fizikalna i kemijska snaga vodenih oksida, čistih i čistih kiselina, soli čistih i čistih kiselina i dr.
Glavne karakteristike elemenata glavne skupine skupine V. Dušik iste snage.
Snaga amonijaka i amonijačnih soli. Stagnacija u medicini i farmaciji.
Oksid u dušik. Dušična kiselina i soli. Fizička i kemijska snaga, skladištenje.
Fizikalna i kemijska snaga dušične kiseline. nitrati. Mediko - biološka vrijednost dušika i spoluka.
Karakteristike fosfora elementa 15 R. Vilny: alotropija, fizička i kemijska moć, posjedovanje.
Fosfin. Oksidni fosfor i fosforna kiselina: moć, posjedovanje. Medicinska i biološka vrijednost fosfora
Opće karakteristike elemenata IV grupe glavne pidgrupe. U ugljenu: fizička snaga alotropa u ugljenu, kemijska snaga.
Kisnevy spoluky u ugljenu: budova molekule, fizičke i kemijske moći. Mediko-biološko značenje u ugljenu koji spoluk.
Silicij koji spoluky: poznavanje prirode, odbacivanje, fizička i kemijska moć. Mediko - biološko znači silicij.
Glavna skupina treće skupine: glavne karakteristike elemenata. Granica ovog yogo spoluky: odbacivanje, fizikalna i kemijska moć, skladištenje u medicini.
Aluminij i yogo spoluky: opsesija, fizička i kemijska moć. Medicinski i biološki značaj aluminija.
Metali glavne pidgrupe II skupine: karakterizacija, opsesija, fizikalna i kemijska snaga. Sol kalcija i magnezija. Tvrdoća vode. Usunennya zhorstkosti vodi. Medicinsko-biološki značaj elemenata glavne skupine II.
Bacale su se lokve: karakterizacija, posjedovanje, moć, navazhliv spoluks. Medicinski i biološki značaj.
Karakterizacija d-elemenata je početna. Metalna bitna pid grupa I grupa. Podnannya mídí, síbla. Medicinski i biološki značaj.
Metali druge skupine: karakterizacija Budovije, fizikalna i kemijska snaga. Medicinski i biološki značaj.
Sekundarne skupine VI, VII skupine: karakteristične karakteristike elemenata skupine, snaga kroma, mangana i njihov spoluk. Medicinski i biološki značaj.
Ukazivanje na skupinu VIII skupinu: opće karakteristike elemenata grupe, moć ove skupine. Medicinski i biološki značaj.
Ustatkuvannya. Na kožnom stolu pred znanstvenicima se nalazi plan lekcije, dijagram interakcije dušične kiseline s metalima, set reagensa, test priloženog materijala.
Oksid u dušik
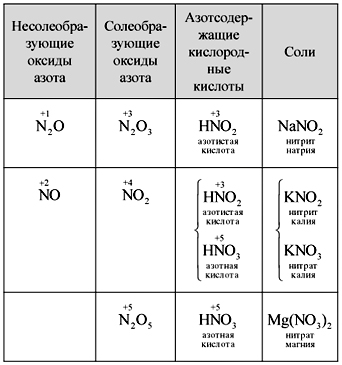
Vchitel.Pogodite da napišete formulu za dušikove okside. Zovu li se oksidi koji tvore sol ili nisu slani? Za što?
Znanstvenici samostalno zapisuju formule pet dušikovih oksida, imenuju ih, pogađaju kisele kiseline pomiješane s dušikom i formuliraju oblik između oksida i kiselina. Jedan od učenjaka će zapisati dozu (tablica).
Stol
Zamjena dušikovih oksida, kiselina i soli
Demonstracija informacija:
interakcija dušikovog (IV) oksida s vodom
Vchitel. Imati plovilo s NE 2 Postoji plima vode i plima vode, umjesto vip testa lakmusa.
Tko sposterígaêmo? Rosehin chervonin kroz dvije kiseline, u redu je.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Korak oksidacije dušika NE 2 vrata +4, tobto. osvojio industrijski mízh +3 í +5, kao na razini krutosti, taj dušikov (IV) oksid se dovodi u obliku dvije kiseline - dušika i dušika.
Skladište ta budova molekula
Vchitel.Da biste zapisali molekularnu formulu dušične kiseline, izračunajte molekulsku masu i označite stupanj oksidiranih elemenata. Pohranite strukturne i elektroničke formule.
Znanstvenici formuliraju takve formule (slika 1).
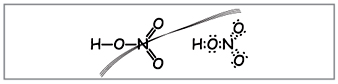
Vchitel.Prema broju formula deset elektrona može se omotati oko dušika koji ne može biti crven, jer Dušik se nalazi u drugom razdoblju i što je više moguće na zadnju loptu u novijem možda neće imati više elektronike. Super-frekvencija je asimilirana, kao da se pušta, ali između atoma dušika i jednog od atoma u kiselini uspostavlja se kovalentna veza iza mehanizma donor-akceptor(slika 2).
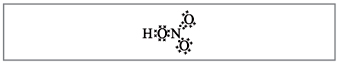
Mali. 2. Elektronska formula dušične kiseline.
Elektron i atom dušika označeni crnim točkama
Strukturna formula dušične kiseline može se zaključiti na sljedeći način(slika 3) :
Mali. 3. Strukturna formula dušične kiseline
(donorsko-akceptorski pojas indikacija sa udarcem)
Međutim, prethodni put je donio da je podveza jednako podijeljena između dva atoma kisnyja. Stupanj oksidiranog dušika u dušičnoj kiselini je skup +5, a valencija (zvjerski respekt) je skupa, više od izbora elektroničkih oklada.
Fizička snaga dušične kiseline
Vchitel.Ovdje je boca razrijeđene te koncentrirane dušične kiseline. Opišite fizičke moći koje postoje.
Znanstvenici opisuju dušičnu kiselinu jaka ridina važna za vodu, boje za žvakanje, oštrog mirisa. Razchin dušična kiselina bez boje i mirisa.
Vchitel. Dodam, temperatura ključanja dušične kiseline +83 ° C, temperatura smrzavanja –41 ° W, tobto. za duhovite umove tse ridina. Oštar miris i oni koji, kada ga izvadite, objašnjavaju da je kiselina koncentrirana u maloj količini svjetlosti, ili kada se zagrije, često se uruši.
Kemija snage kiseline
Vchitel. Pogodite kakve fraze izmjenjuju kiseline?(Znanstveno ime.)
Prije nego počnete koristiti reagense, prorokujte popis reakcija i zapišite svoje upozorenje (reakcije zapisivanja potražnje na TED svjetlu).
A sada se hranimo specifičnim moćima dušične kiseline.
Bili smo polirani, ali kiselina u slučaju zberganní zhovtíê, sada provodimo kemijsku reakciju:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Znanstveno za samostalno snimanje elektroničke ravnoteže reakcije.)
"buri gas"(NE 2) farbu kiselina.
Posebno se kiselina reducira u metale. Znate da su vodu izbacivali iz kiselina, inače se ne gubi tijekom interakcije s dušičnom kiselinom.
Začudite se dijagramu koji imate na zabavi, prikazano je kako se vide plinovi tijekom reakcije kiseline i koncentracije s metalima.(Robot sa dijagramom.)
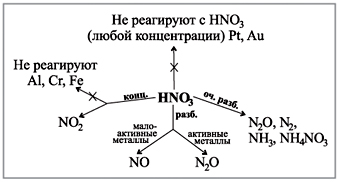
Demonstracija informacija:
interakcija koncentrirane dušične kiseline s middy
Još je učinkovitija demonstracija reakcije dušične kiseline (konc.) s prahom medija, ili alternativno, uz dodatak strelice s malim komadićima meda:
Znanstveno za samostalno snimanje elektroničke ravnoteže reakcije:
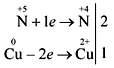
Opsjednutost kiselinom
Vchitel. Lekcija će biti neshvatljiva, jer prehrana dušične kiseline nije vidljiva.
Laboratorijska metoda: diya koncentrirane klorovodične kiseline na nitratu (slika 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Kod promislovostí kiselina u bazičnom posjedu na amicni način.
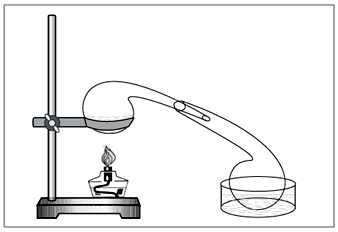
Mali. 5. Za uklanjanje dušične kiseline u laboratoriju
ručno birana vikoristovuvati starinska kemijska jela - retorta
Metoda održavanja kiseline dušikom i kiselinom na temperaturama do 2000 °C (električni luk) nije posebno proširena.
U Rusiji je povijest uklanjanja dušične kiseline povezana s imenima kemičara-tehnologa Ivana Ivanoviča Andreeva (1880.-1919.).
Vin u 1915. str. Otvarajući prvu instalaciju za zakiseljavanje amonijakom i realizirajući metode dezintegracije u tvorničkim razmjerima 1917. str. Prvi građevinski pogon u blizini Donjecka.
Cijela metoda uključuje nekoliko koraka.
1) Priprema edukativnih i društvenih događanja.
2) Oksidacija amiaku kisnem povitrya na platinastim cittsi:
4NH3 + 5O2 = 4NO + 6H2O.
3) Daljnje oksidirano u dušikov oksid (II) u dušikov oksid (IV):
2NO + O2 = 2NO2.
4) Određivanje dušikovog (IV) oksida iz vode i sadržaja kiseline:
3NO2 + H2O = 2HNO3 + NO.
Lako je provesti proces u prisutnosti kiseline, sav dušikov (IV) oksid se pretvara u dušičnu kiselinu.
5) Zaključci faze uklanjanja dušične kiseline - pročišćavanje plinova, poput atmosfere, od oksida do dušika. Skladište cich plinova: do 98% dušika, 2-5% kiselina i 0,02-0,15% dušikovih oksida. (Dušik se uzima iz izvora amonijaka, uzetog za oksidaciju amonijaka.) Ako je dušikovih oksida u tim plinovima više od 0,02%, onda se posebno provodi da se katalitički ažuriraju u dušik, pri čemu postoji nekoliko velikih problema .
Napisano od svih rečenih posta prehrane: a što će nam kiselina?
Sisanje kiseline
Vchitel.Dušična kiselina zamjenska za virobrytvu: dušik dobar, a na prvom mjestu sol aminske kiseline (kako í̈í opsjednuti?); vibuhovski govori (zašto?); barvnikiv; nítratív, o tome kako biti na ofenzivnoj razini.
Materijal za zatvaranje
Frontalno iskustvo za razred
- Zašto je razina oksidiranog dušika u dušičnoj kiselini +5, a valencija čotirija?
- Ne ulazi li dušična kiselina u reakciju sa svijetlim metalima?
– Treba nabaviti klorovodičnu kiselinu i dušičnu kiselinu, na stolu su tri metala – med, aluminij i cink. Što misliš?
Test
opcija 1
1. Koliki je broj brojeva povezan s raspodjelom elektrona za razine energije u atomu dušika?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Završite praktičnost praktičnih reakcija:
1) HNO 3 (ružičasta) + Cu ...;
2) Zn + HNO 3 (konc.) ...;
3) HNO3 + MgCO3 ...;
4) CuO + KNO 3….
3. Uvedite, u pravilu, jednu od faza procesa obećanja dušična kiselina.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Negativni koraci oksidacije očituju se dušikom na dnu:
1) N20; 2) NE; 3) NE 2; 4) Na 3 N.
5. Interakcija strugotina meda s koncentriranom dušičnom kiselinom za proizvodnju do odobrenja:
1) NE 2; 2) NE; 3) N 2; 4) NH 3.
Opcija 2
1. Valentna vrijednost dušika je jedan:
1) 1; 2) 2; 3) 5; 4) 4.
2. Zapišite moguću interakciju koncentrirane dušične kiseline s napredujućim metalima: natrijem, aluminijem, cinkom, zalizom, kromom.
3. Vibrirajući govor, poput ê syruvinoy za dušičnu kiselinu:
1) dušik i voda;
2) amíak, ponekad ta voda;
3) nitrat.
4. Koncentrirana dušična kiselina ne reagira sa:
1) plin ugljični dioksid;
2) klorovodična kiselina;
3) u ugljenu;
4) hidroksidna šipka.
5. Uz međudjelovanje čak i razrijeđene kiseline i magnezija, treba se pretvarati:
1) NE 2; 2) NE; 3) N20; 4) NH4NO3.
Svjedočanstva Opcija 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opcija 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Trivneviy zalik spinner 11 razred
Tema: " METALI "
Obrazac lekcije: zalik
Tsil: preispitati znanje o stipendijama na temu: "Nemetali"; javne informacije o nadmoćne moći nemetali i spoluk; promicati formulaciju znanja o nestandardnim i životnim situacijama, iz zamjenskih i diferenciranih poduzeća.
Zavdannya:
1. Revidirati javnu domenu i zatvoriti znanje studija o nemetalima i í̈kh spoluksima; uzeti razvoj s gledišta obmanjujuće logike i volodya kemije; prijelaz od formalno-logičkog prihvaćanja materijala od strane onih u figurativno logičnu poruku uz pomoć naprednih, izvedivih i nestandardnih građevina.
2. Razvinuvichki s oprezom, otkrivanje pomilovanja, oživljavanje tvornice, vivinya gledanje mrlju, hvatanje činjenica, wowing, logično je opakim mislima i robotima; vchiti rozmírkovuvati, robiti pripuschennya, prognoza.
3. Prihvatite formuliranje glavnih vizualnih ideja kroz kognitivnu aktivnost i kreativnu neovisnost znanstvenika.
4. Vihovuvati vmínnya pratsyuvati samokontrolu od samokontrole. Pokažite poveznice onima koji žive u životu. Vihovuvati znanstveni svitoglyad na temelju međusobnog povezivanja ovlasti koje budu.
Rukovanje tim reagensima: epruvete, alkoholne lampe, epruvete, sirnici i raschini: ; ;
; ;
;
 .
.
Priprema prije ulaza.
Učitelj je pripremio tri razine sklopivosti tipova početka: test, teorijska prehrana, razumijevanje i razvoj riječi.
Učitelj vas je spreman educirati, jer ćete revidirati tim.
Za 1 - 2 dana, informativni list se šalje u ured.
List rute vidljiv je koži. Dijagram robota na stepenicama prikazan je na listovima rute.
LIST RUTE.
F.Í. učenjak
Imenujte korak
Raspored etapa
Matični broj
Potpis storniranja
Problem Rozrakhunkova
Rosp_znavannya
Reinkarnacija
Idi na lekciju.
Znanstvenici ulaze u razred s rutama, 5 praznih listova, s olovkom i idu na korak, vrijednosti za broj 1. Znanstvenici preuzimaju znanje o preklopivosti i vraćaju se novom slovu, ako spavate, na pozornici od "označavanja riječi".
Na robotu je u fazi kože uvedeno 7 - 8 pera, koji pretvaraju vistavlju u list rute rivn, br.
Procjena se prikazuje kao aritmetička sredina svih faza.
DODATNIK
"Prepoznavanje govora"
1 ríven
1. Uvjerite se da to znate 
2. Provjerite je li ion čist 
3. Provjerite je li Ion čist 
4. Neka bude jasno 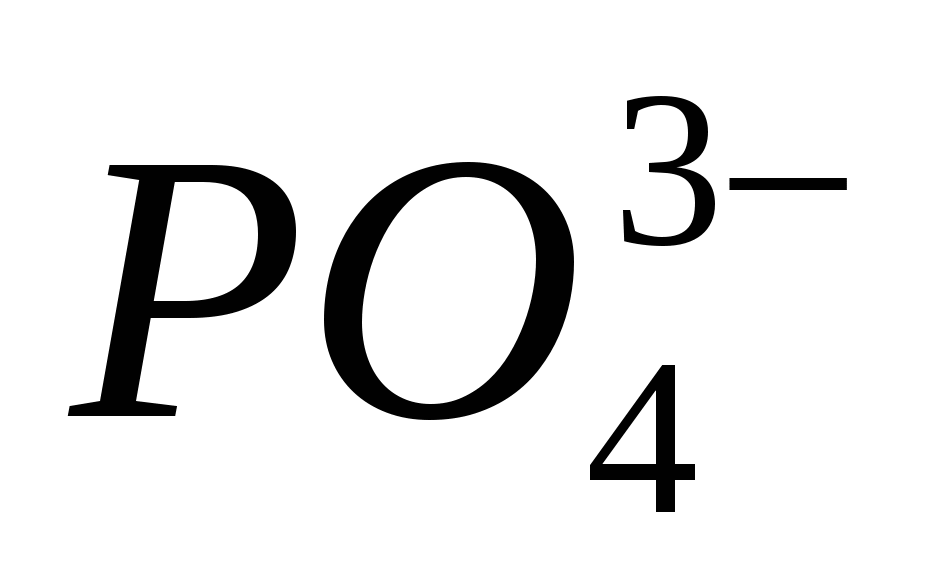
5. Provjerite je li Ion čist 
2 ríven
1. Odredite razlike iza jednog reagensa:
2. Odredite razlike iza jednog reagensa:
3. Odredite razlike iza jednog reagensa:
4. Odredite razlike iza jednog reagensa: 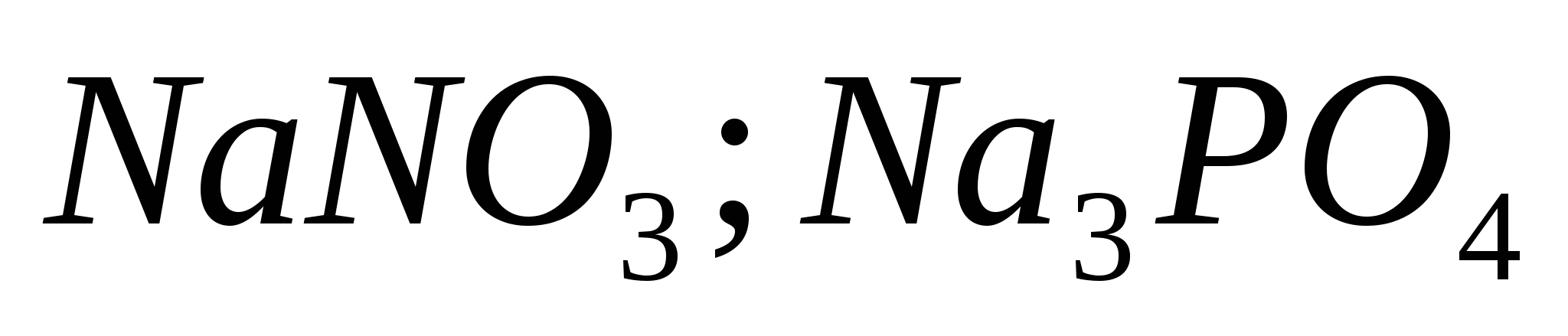 ;
;
5. Odredite razlike iza jednog reagensa:
3 ríven
1. Dizajn bez dodatnih reagensa za odobrenje:
2. Dizajn bez dodatnih reagensa za odobrenje:
3. Dizajn bez dodatnih reagensa za odobrenje:
4. Dizajn bez dodatnih reagensa za odobrenje:
5. Dizajn bez dodatnih reagensa za odobrenje:
Dodirnite "Revizija govora"
1 ríven
1. Završite standardne reakcije
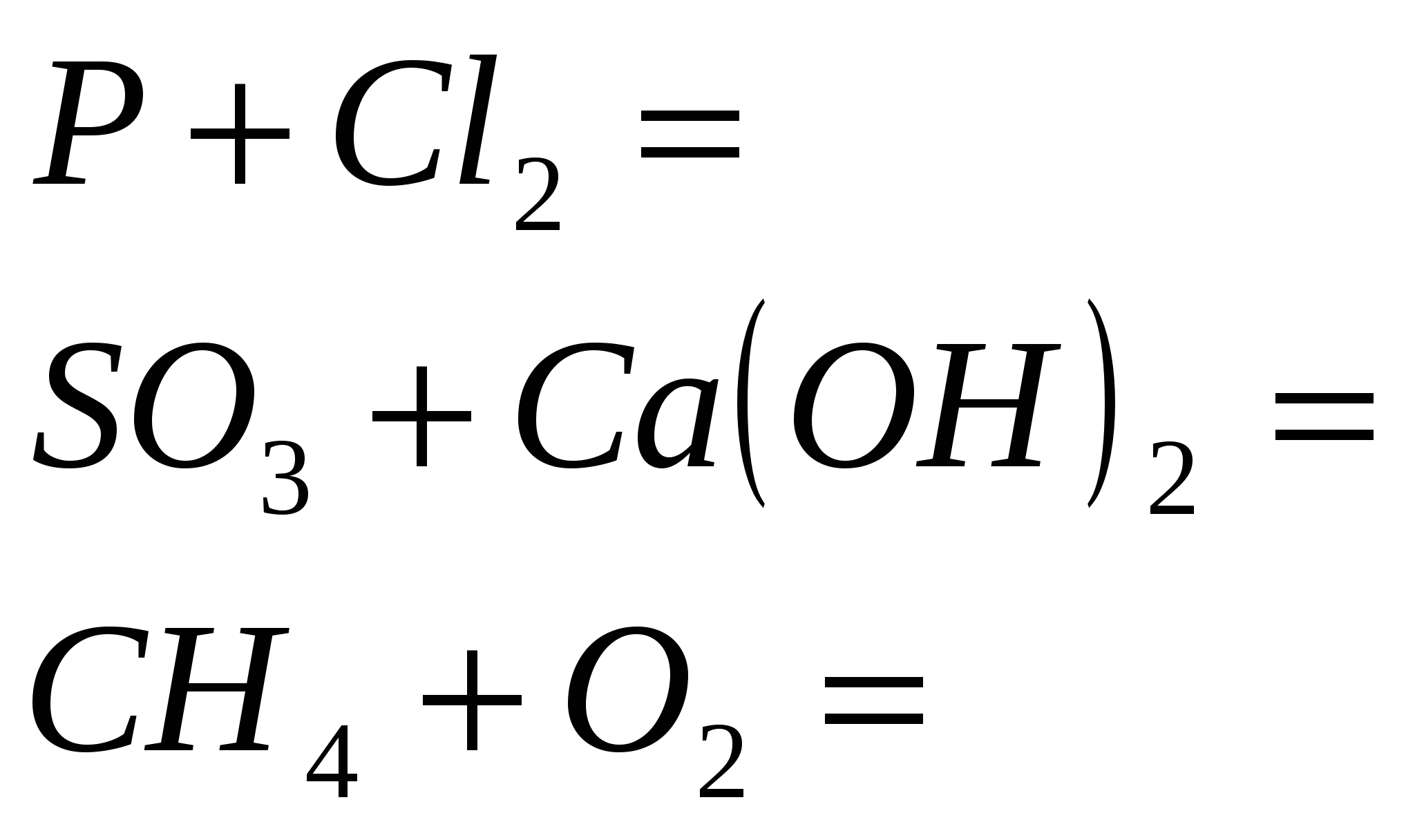
2. Za završetak rutinskih reakcija
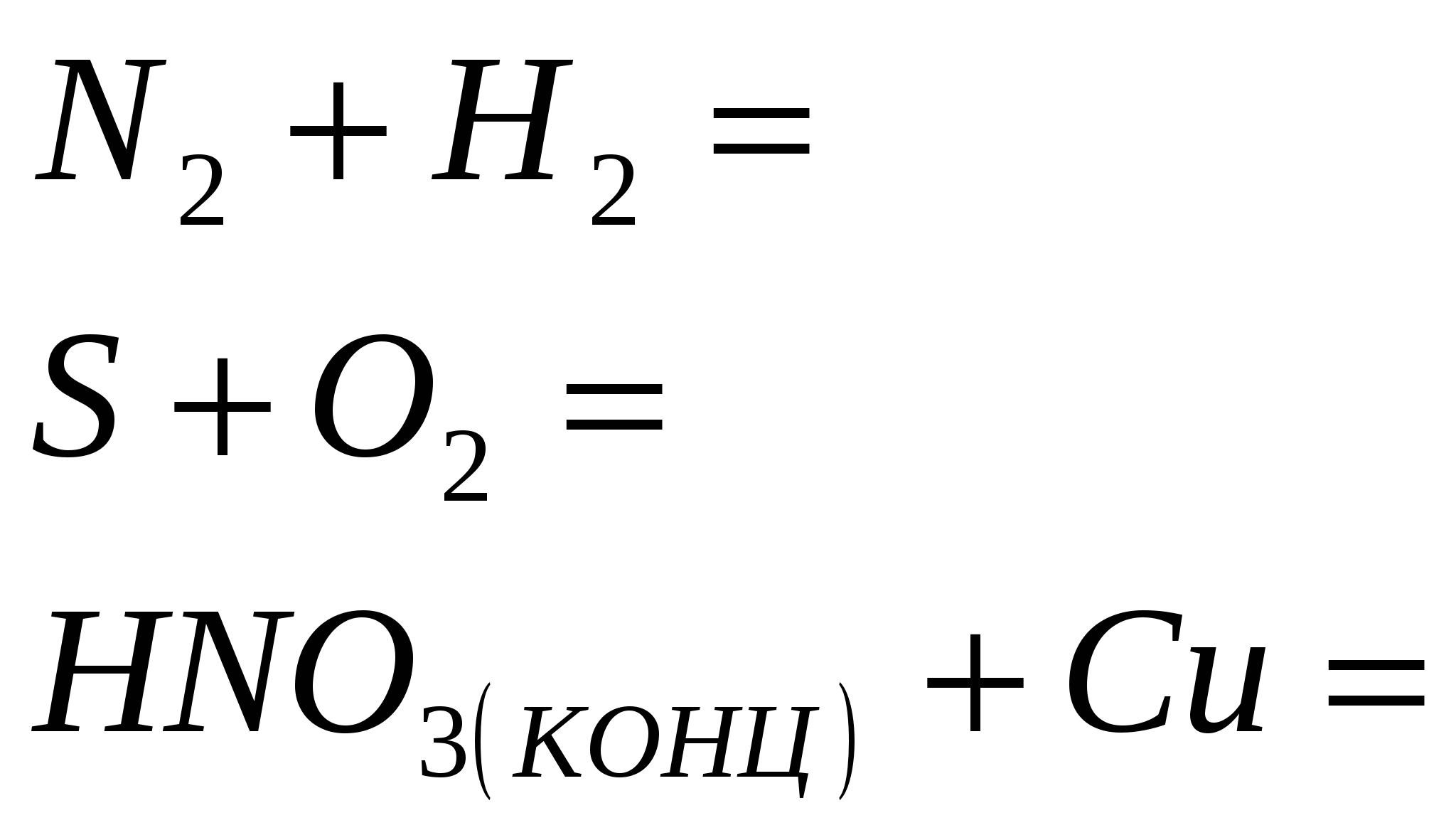
3. Završite standardne reakcije
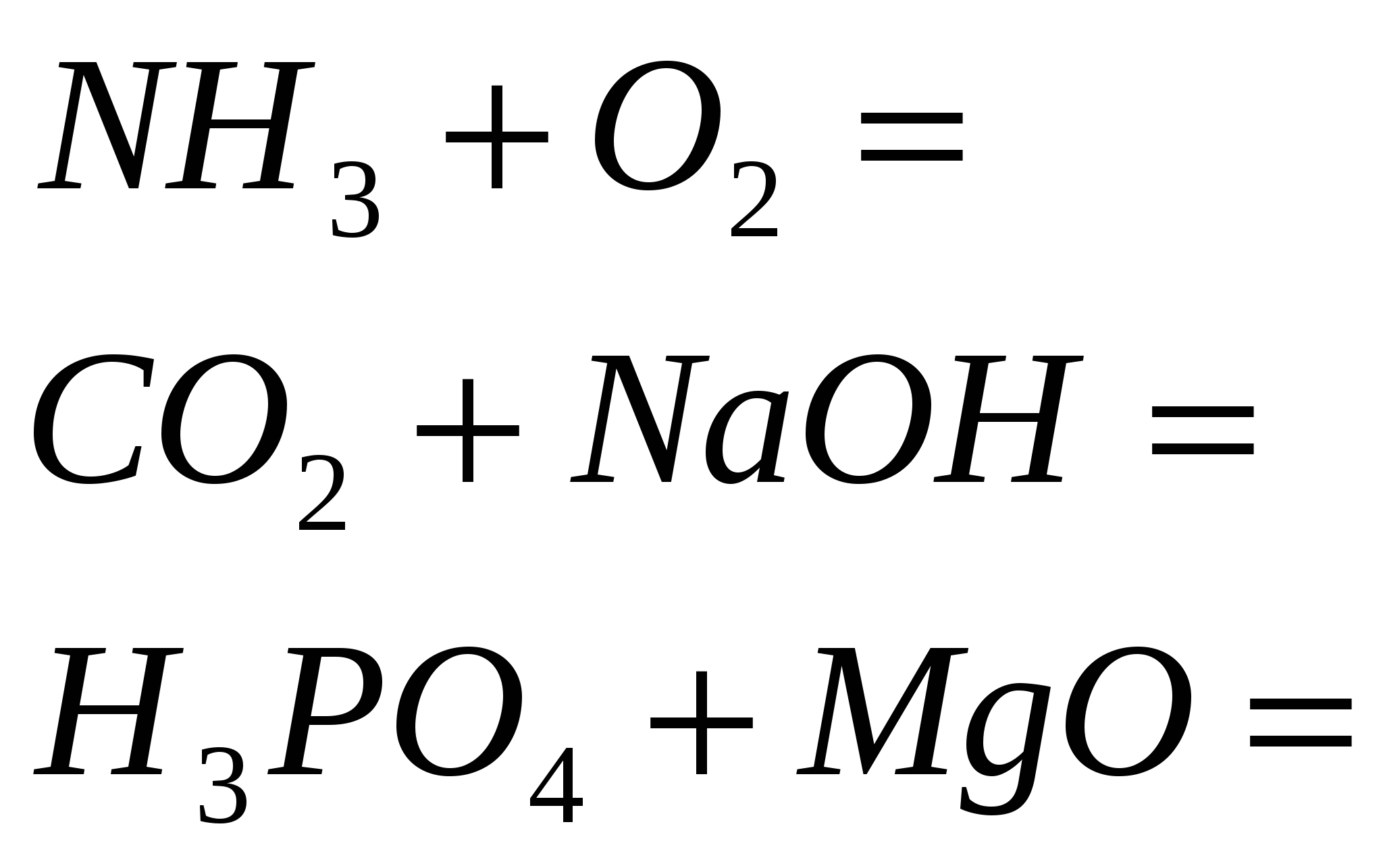
4. Završite standardne reakcije
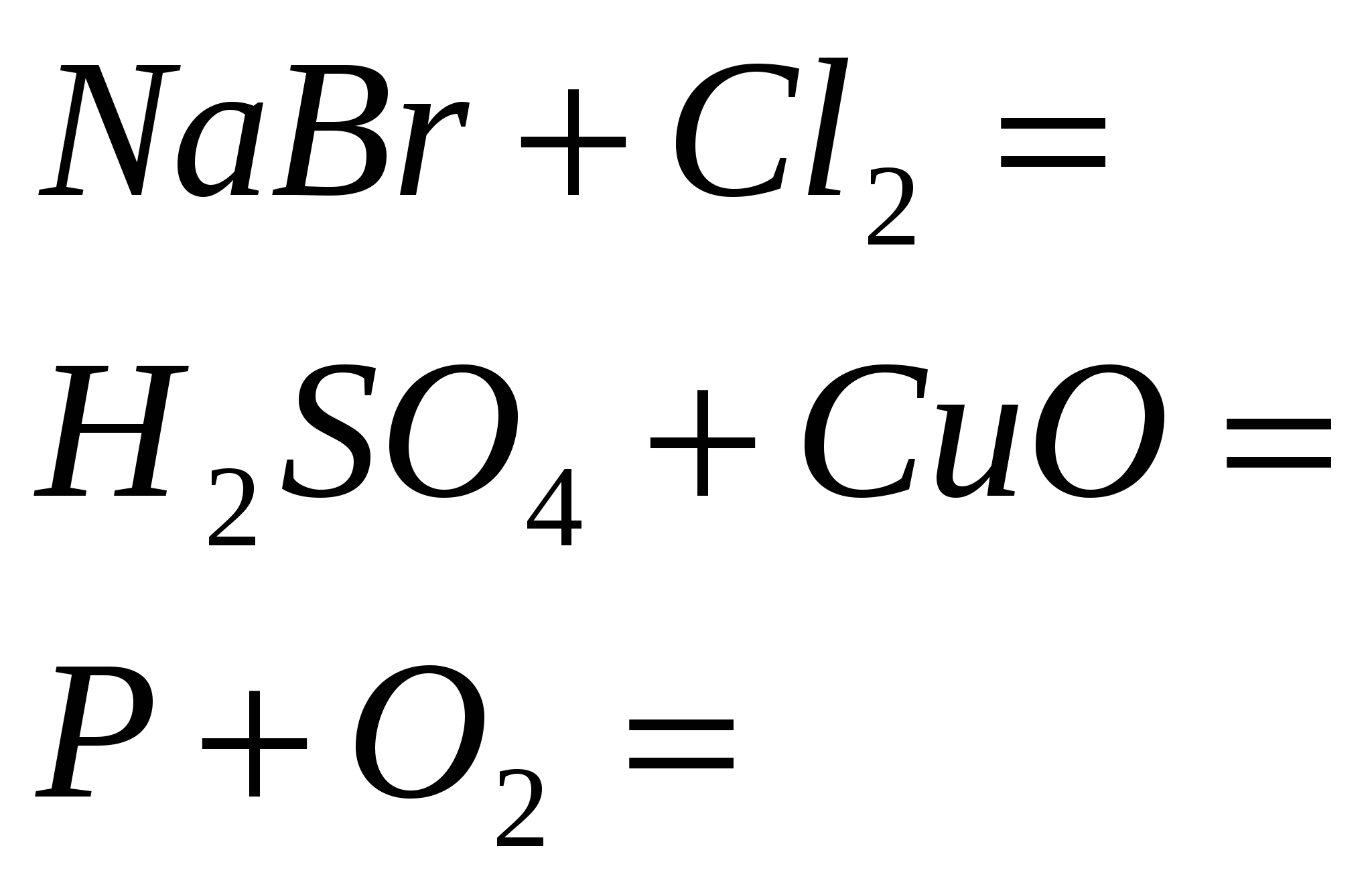
5. Završite standardne reakcije
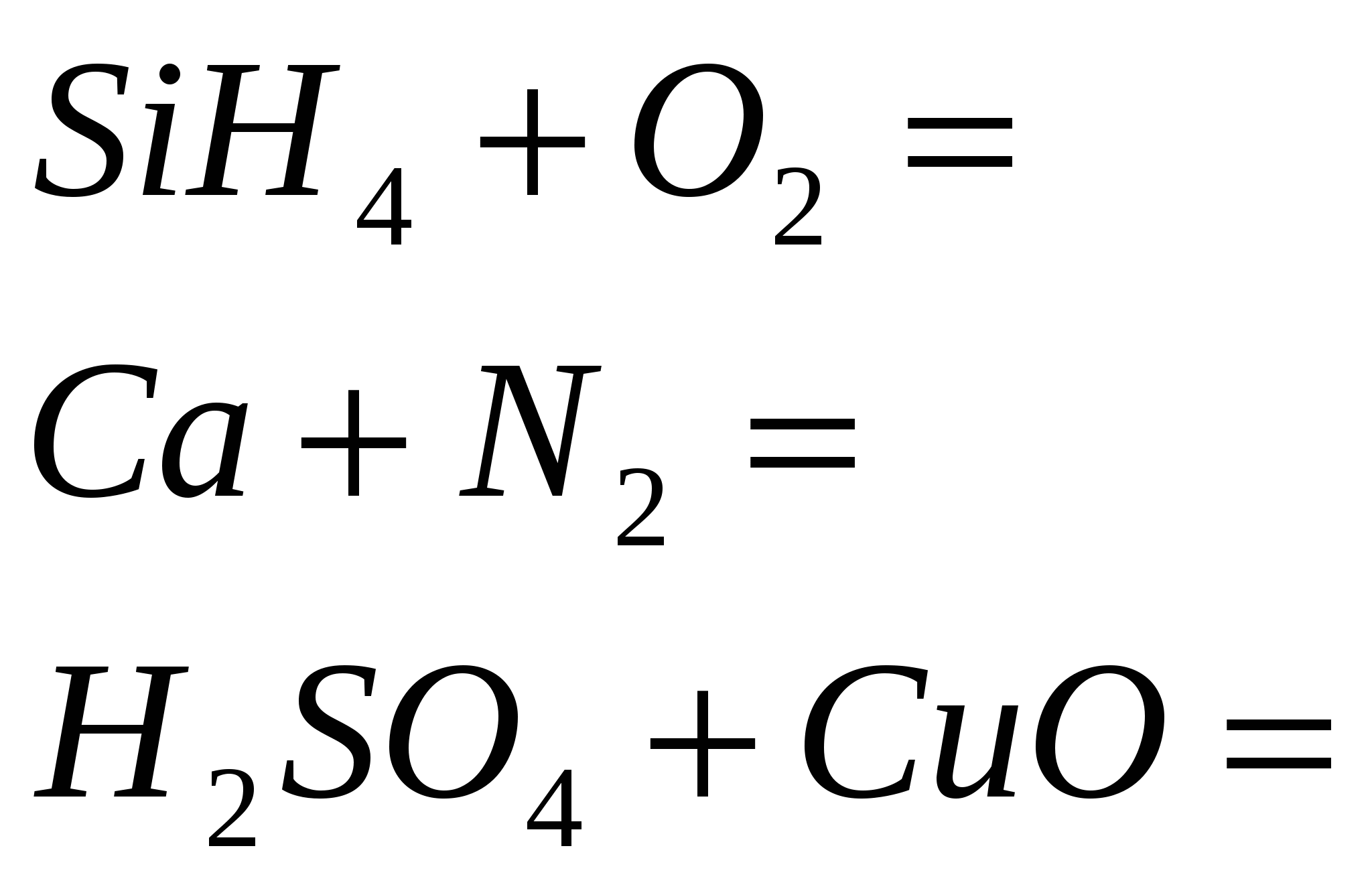
2 ríven
Zdíysnít revizija:
3ríven
Zdíysnít revizija:
3.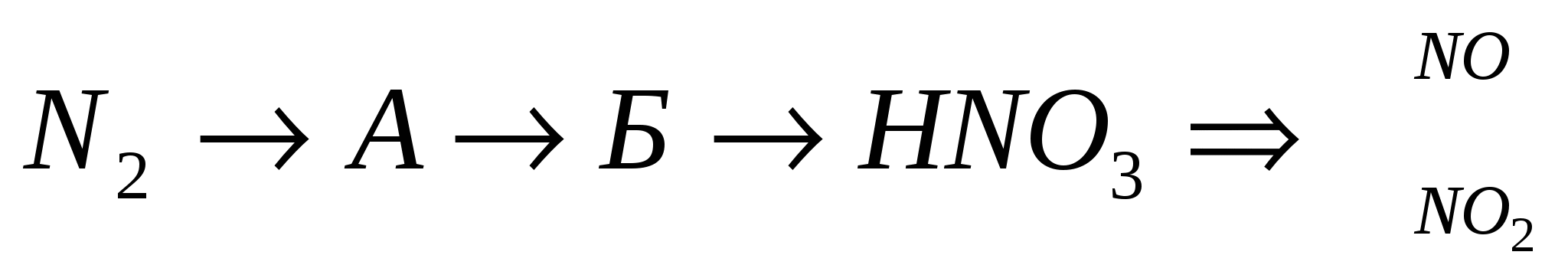
Korak "Test"
opcija 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 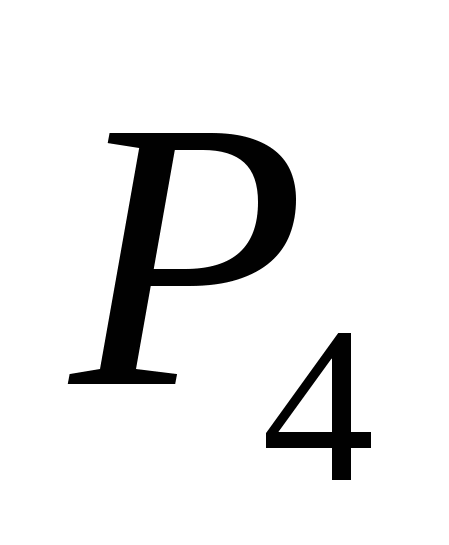 , b) C, c)
, b) C, c) 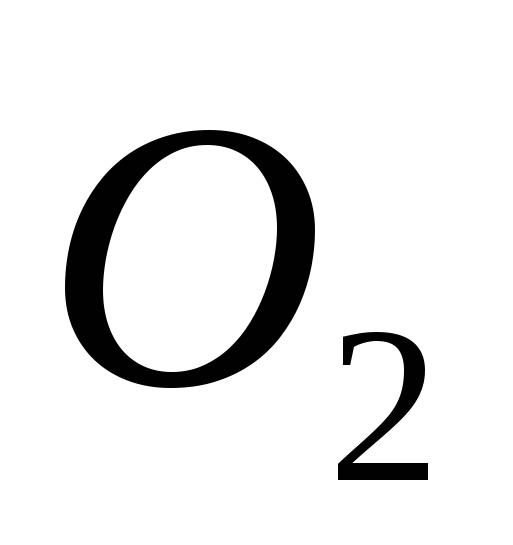 , G)
, G) 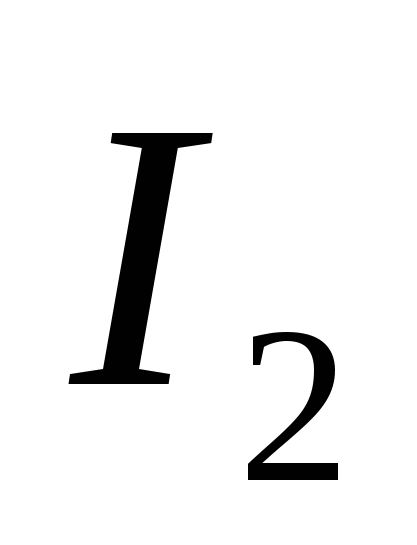 e)
e) 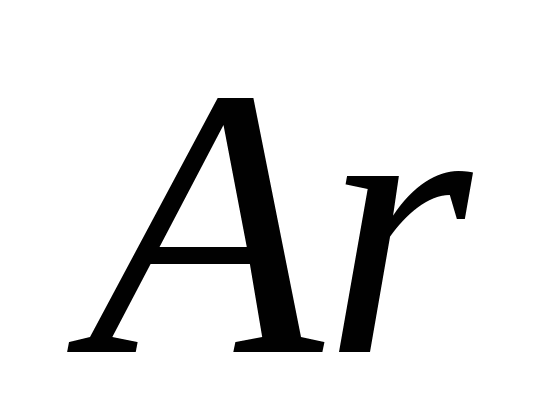 .
.
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
4. Elektronska formula elementa. Yogo flying vodena spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Snaga rasta halogenovodičnih kiselina u nizu:
a) ![]()
b) 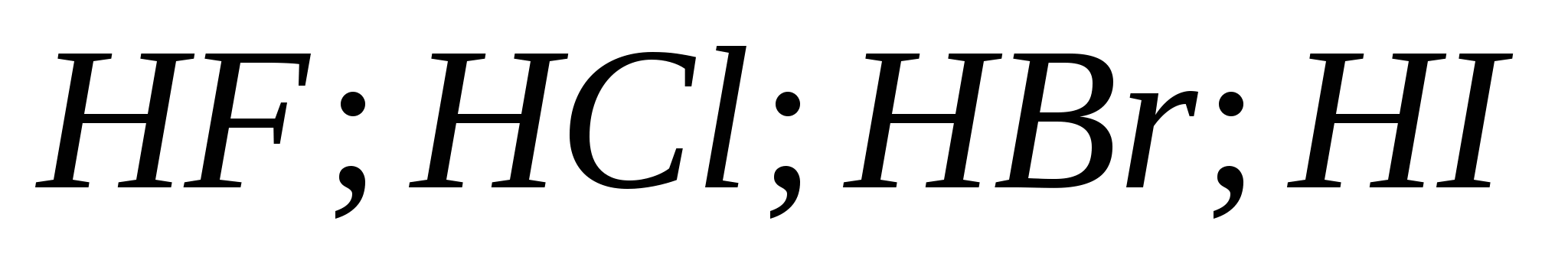
v) 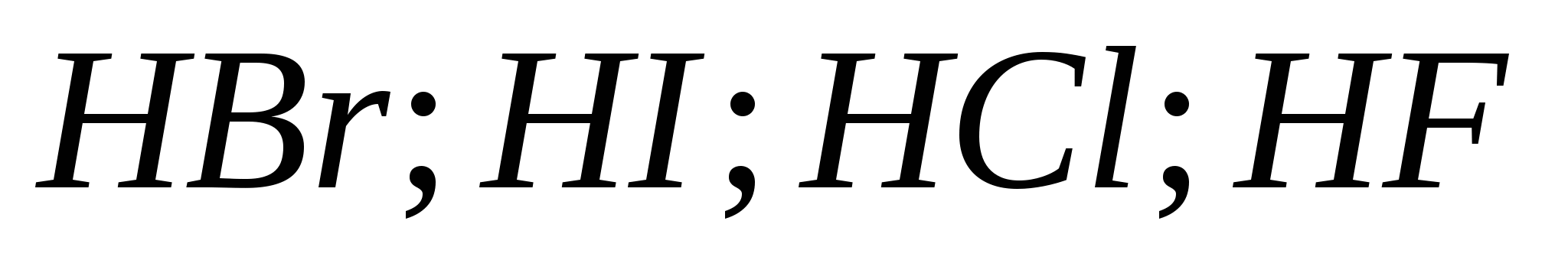
G) 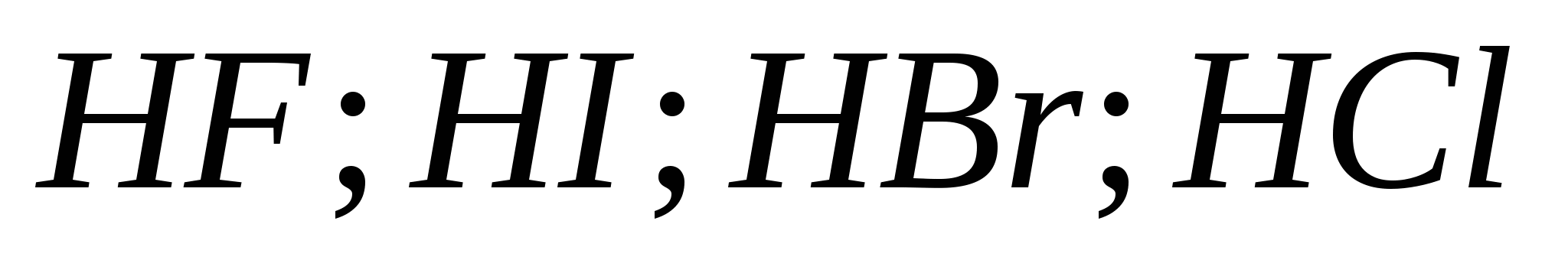
6. Od halogena ispred boyovyh diakha, govor je zapeo:
a) fluor; b) klor; c) jod; d) brom.
7. Razrijeđena sirhanova kiselina za oksidacijsku moć za razvoj atoma:
a)  , b)
, b)  , v)
, v)  .
.
8. Dušikov oksid V može se kombinirati:
a)  , b)
, b)  , v)
, v)  , G)
, G) 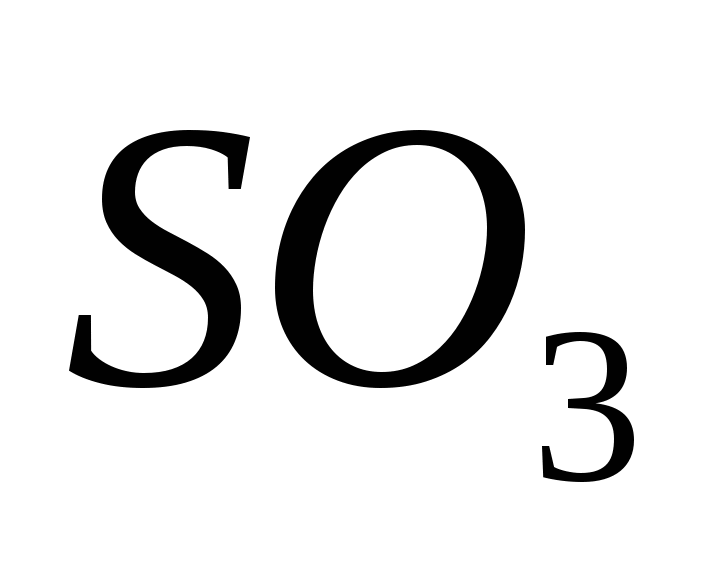 e)
e)  .
.
9. Reakcija: dovesti takve vlasti u Ameriku:
a) oksidativno, b) jednostruko, c) kiselo, d) bazično.
10. Jačina kiselina u nizu
a) promijeniti, b) rasti, c) promijeniti puno, zatim promijeniti; d) prska padanja, odrastanja, e) ne mijenjanja.
Opcija 2
Atomske kristalne milosti mogu biti jednostavni govori, odobreni:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Plin za normalne umove ê:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e) 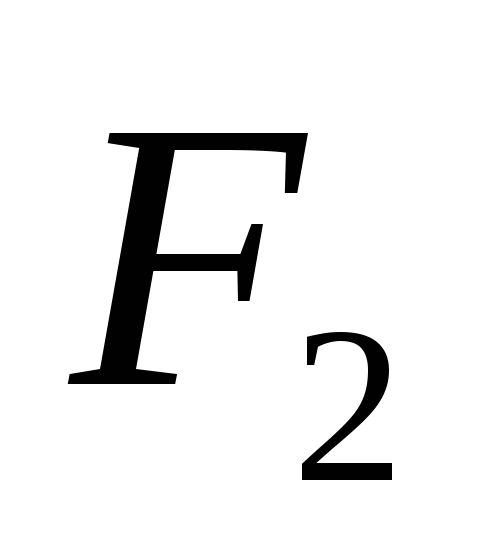 .
.
3. Alotropske modifikacije postavljaju sljedeće elemente:
a) 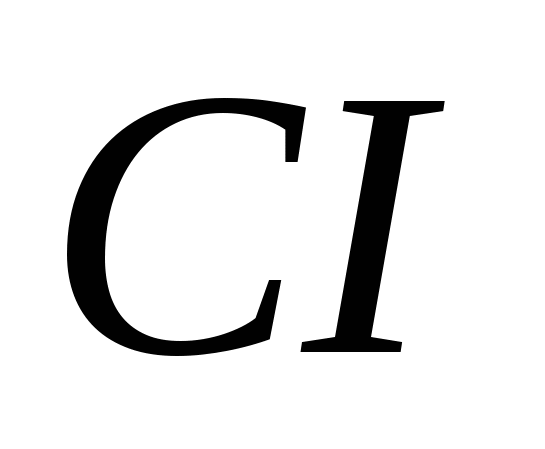 , b)
, b) 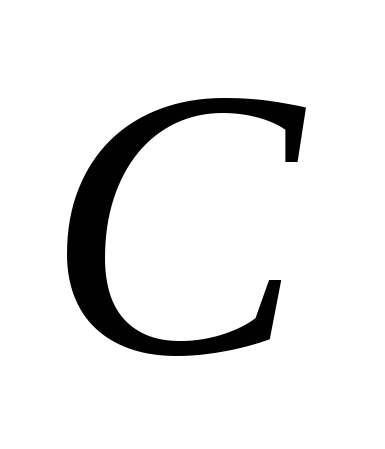 , v)
, v)  , G)
, G) 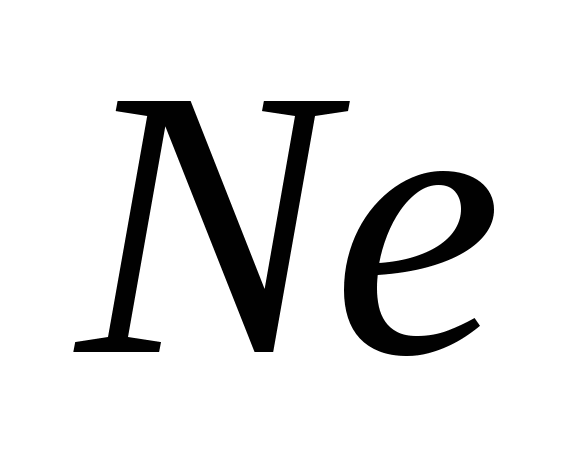 e)
e)  ,
,
4. Elektronska formula elementa. Yogo flying vodena spoluk:
a) 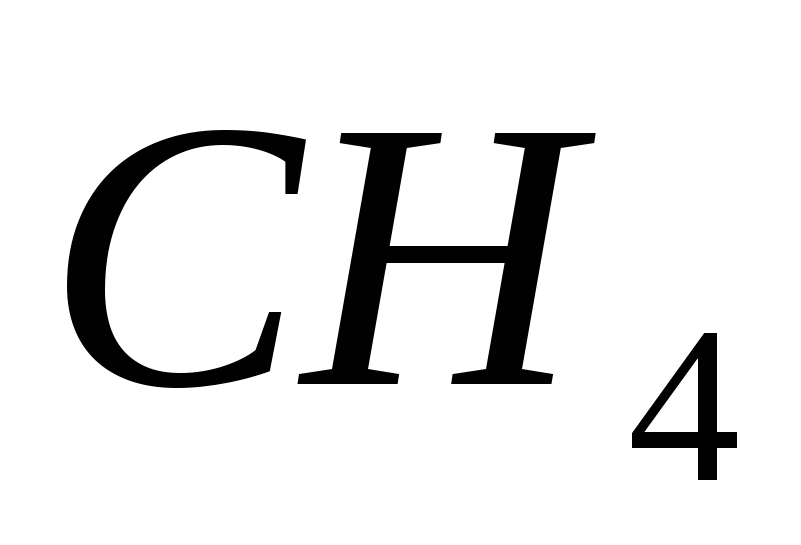 , b)
, b) 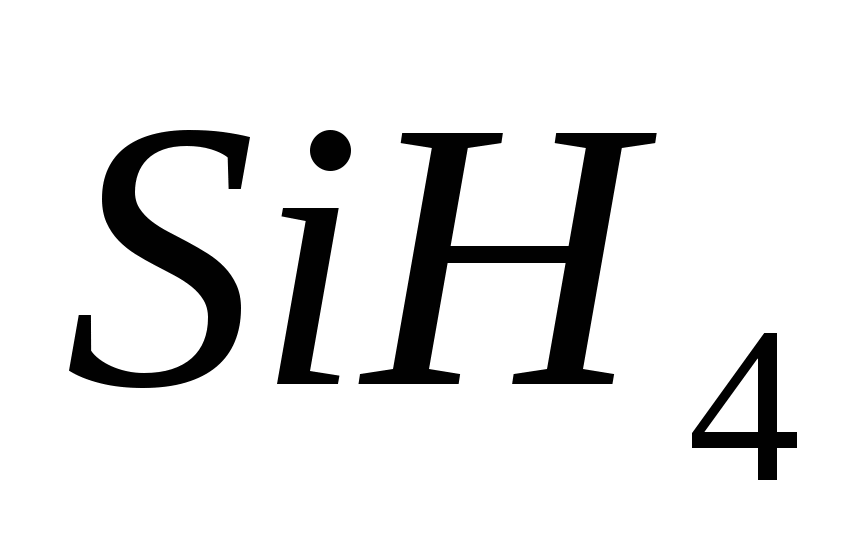 , v)
, v)  , G)
, G) 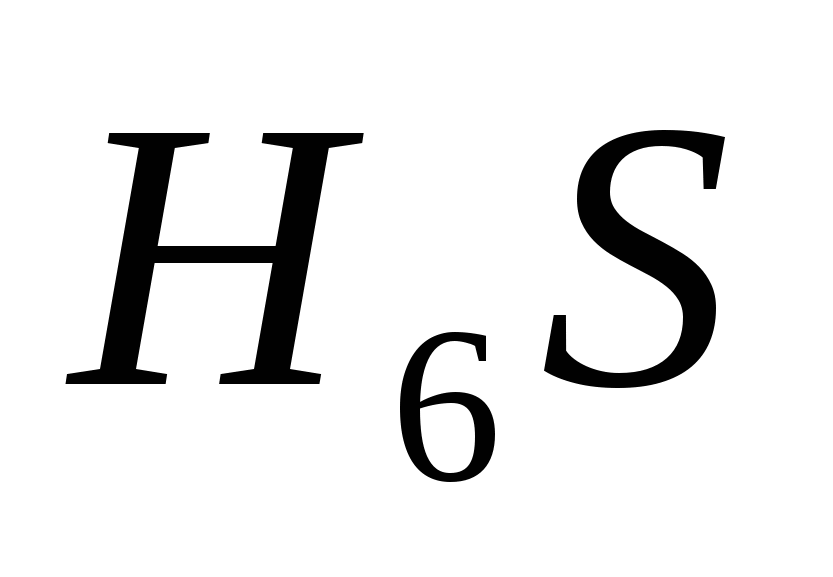 e)
e)  .
.
5. Glavna snaga ljetnih plovnih putova mijenja se sljedećim redoslijedom:
a) 
b) 
v) 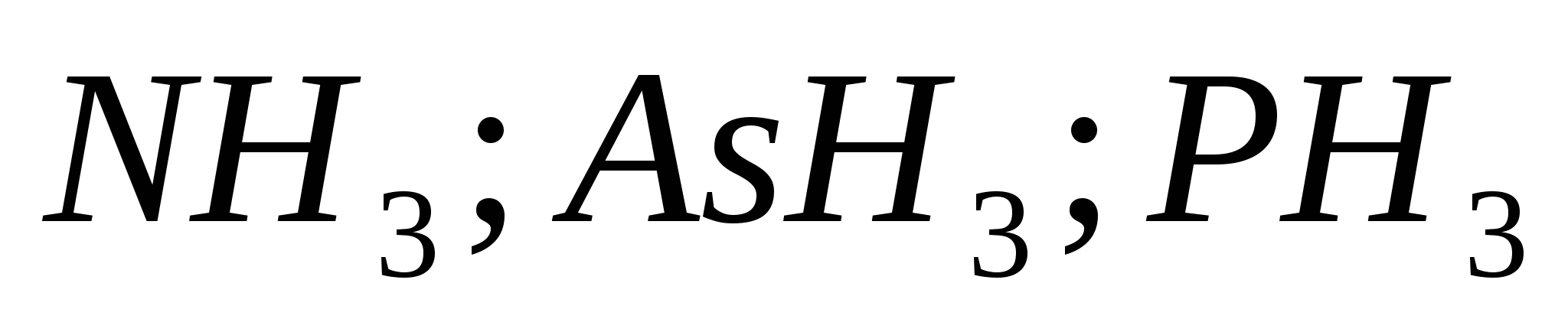
G) 
6. Za prianjanje na klor možete koristiti koncentrirane otopine:
a)  , b)
, b) 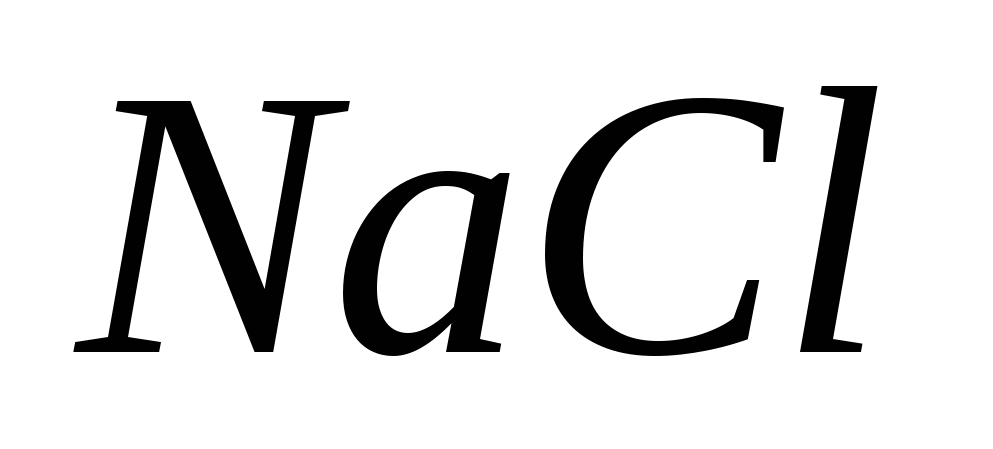 , v)
, v)  , G)
, G)  .
.
7. Koncentrirana sirchan kiselina je oksidirajuća moć za rakhunok atoma:
a)  , b)
, b)  , v)
, v)  .
.
NAPOMENA: 9-10 točnih pogleda - "5"; 7-8- "4"; 5-6- "3"; manje od 5-2
ETAP "Teorija"
ja ryven (do "3")
Zapišite tipične reakcije za karakterizaciju snage razrijeđene klorovodične kiseline.
Zapišite specifične reakcije kako biste okarakterizirali snagu serky oksida (VI).
Zapišite tipične reakcije za karakterizaciju snage natrijeve kiseline.
Zapišite relevantne reakcije da okarakterizirate snagu fosforovog (V) oksida.
Zapišite reakcionarne odgovore koji karakteriziraju moć Amerike.
II ryven (na "4")
Zapišite formule nemetalnih ljetnih izvora vode u drugom razdoblju. Objasnite kako i zašto dolazi do promjene snage kiseline.
Zapišite formule za druge nemetalne okside u trećem razdoblju. Objasnite kako i zašto dolazi do promjene snage kiseline.
Zapišite formule najkiselih elemenata u III razdoblju. Objasnite kako i zašto dolazi do promjene snage kiseline.
Zapišite formule hlapljivih nemetala na bazi vode VI pidskupine. Objasnite kako i zašto dolazi do promjene snage kiseline.
Zapišite formule najkiselih kiselina elemenata VA pidgrupe. Objasnite kako i zašto dolazi do promjene snage kiseline.
III razina (na "5")
Odredite kisela i kisela svojstva klorovodične i dušične kiseline. Molimo potvrdite jednostavne reakcije.
Odrediti oksidativnu i kiselinsku snagu sivog oksida (IV) i oksida u ugljiku (IV). Molimo potvrdite jednostavne reakcije.
Promijenite oksidativnu i kiselu snagu vode i fluoridne vode. Molimo potvrdite jednostavne reakcije.
Odredite kiselost koncentrirane i razrijeđene dušične kiseline. Molimo potvrdite jednostavne reakcije.
Odredite kiselost oksida u ugljiku (II) i oksida u ugljiku (IV). Molimo potvrdite jednostavne reakcije.
ETAP "Problem Rozrakhunkova"
ja ryven (do "3")
II ryven (na "4")
Uz interakciju 37 g kalcijevog hidroksida s amonijevim sulfatom, uklanja se 15 g amonijaka. Izračunajte maseni dio ulaznog amiak%.
Kada spalyuvanny u kiselo 62 g fosfora, 130 g fosfora (V) oksida se skine. Izračunajte maseni udio ulaza u fosforov oksid (V)%.
Koliko vam je grama od 10% potrebno natrijevog hidroksida da neutralizirate 8,96 litara vode s klorom?
Filteri od litara ugljičnog dioksida mogu se urezati u pakiranja vapnjaka od 10 kg, a 20% kućica se može ukloniti.
Koliko grama opsade postaviti za prolazak 11,2 litre ugljičnog dioksida kroz 900 g šipke s 10% hidroksida?
III razina (na "5")
Koliki je volumen 80% dušične kiseline (pl. 1,46 g / ml) potreban za "razchinennya" 32 g meda?
Yaka masa će biti potrebna za reakciju s previše koncentriranom dušičnom kiselinom za uklanjanje 4 l (n.u.) dušikovog (IV) oksida;
Kada se "razbije" u koncentraciji klorovodične kiseline, 20 g legure zlata s 4,2 l (n.u.) sivog oksida (IV). Visnite maseni udio u% legure.
Zbroj plina u kloru i volumena od 1 l propušten je kroz otopinu kalcijevog jodida. Vidio sam 5,08 r joda u tsomu. Potražite djelić (%) plinovitog klora u opakoj sumi.
Količina silicija i vugile mase 10 g prelila se preko previše koncentriranog raspona natrijevog hidroksida. Kao rezultat reakcije vidjelo se 5,6 litara vode (n.o.). Visnite maseni udio silicija (%) na tsíy sumíshí.
