Azufre Sulfuro de hidrógeno y sulfuros
4.doc
240Azufre Sulfuro de hidrógeno, sulfuros, hidrosulfuros. Óxidos de azufre (IV) y (VI). Ácido sulfúrico y ácido sulfúrico y sus sales. Esteres del ácido sulfúrico. Tiosulfato de sodio
4.1. Azufre
El azufre es uno de los pocos elementos químicos que las personas han utilizado durante varios milenios. Está ampliamente distribuido en la naturaleza y se encuentra tanto en el estado libre (azufre nativo) como en los compuestos. Los minerales que contienen azufre se pueden dividir en dos grupos: sulfuros (piritas, brillos, maniquíes) y sulfatos. El azufre nativo se encuentra en grandes cantidades en Italia (isla de Sicilia) y en los Estados Unidos. En la CEI, los depósitos de azufre nativo se encuentran en la región del Volga, en los estados de Asia Central, en Crimea y en otras áreas.
Los minerales del primer grupo incluyen plomo PbS, cobre brillo Cu 2 S, plata brillo - Ag 2 S, zinc blenda - ZnS, cadmio snag - CdS, pirita o hierro pirita - FeS 2, calcopirita - CuFeS 2, cinabrio - HgS.
Los minerales del segundo grupo incluyen el yeso CaSO 4 2H 2 O, mirabilita (sal de Glauber) - Na 2 SO 4 10H 2 O y kizerite - MgSO 4 H 2 O.
El azufre se encuentra en los animales y las plantas, como parte de las moléculas de proteínas. Los compuestos orgánicos de azufre se encuentran en el petróleo.
Obteniendo
1. Cuando el azufre se obtiene a partir de compuestos naturales, por ejemplo, a partir del azufre pirítico, se calienta a altas temperaturas. La pirita de azufre se descompone para formar sulfuro de hierro (II) y azufre:
2. El azufre se puede obtener por oxidación del sulfuro de hidrógeno por la falta de oxígeno por la reacción:
2H 2 S O 2 = 2S 2H 2 O
3. Hoy en día, la recuperación de azufre por reducción de dióxido de carbono del dióxido de azufre SO 2 es un subproducto común en la fundición de metales a partir de minerales de azufre:
SO 2 C = CO 2 S
4. Los gases residuales de los hornos metalúrgicos y de coque contienen una mezcla de dióxido de azufre y sulfuro de hidrógeno. Esta mezcla se pasa a alta temperatura sobre el catalizador:
H 2 S SO 2 = 2H 2 O 3S
^ Propiedades fisicas
El azufre es un color amarillo limón duro y quebradizo. Es prácticamente insoluble en agua, pero bien soluble en anilina CS 2 en disulfuro de carbono y algunos otros disolventes.
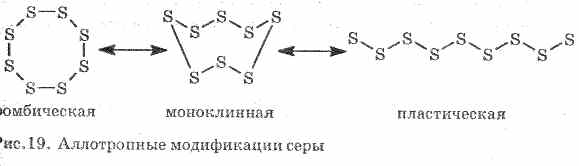
Mala conducción de calor y corriente eléctrica. El azufre forma varias modificaciones alotrópicas:
1 . ^ Azufre rombico (los más estables), los cristales tienen la forma de octaedros.
Cuando se calienta el azufre, su color y su viscosidad cambian: primero, se forma el amarillo claro, y luego a medida que aumenta la temperatura, se oscurece y se vuelve tan viscoso que no sale del tubo, con más calentamiento, la viscosidad desciende nuevamente y, a 444, 6 ° C de azufre .
2. ^ Azufre monoclínico - modificación en forma de agujas de color amarillo oscuro, obtenida enfriando lentamente el azufre fundido.
3. Azufre plasticose forma si el azufre calentado a ebullición se vierte en agua fría. Se estira fácilmente como la goma (ver fig. 19).
El azufre natural consiste en una mezcla de cuatro isótopos estables: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Propiedades quimicas
Un átomo de azufre, que tiene un nivel de energía externa incompleto, puede unir dos electrones y exhibir un grado
Oxidación -2. El azufre exhibe dicho estado de oxidación en compuestos con metales e hidrógeno (Na 2 S, H 2 S). Cuando el retroceso o el agotamiento de los electrones en el átomo del elemento más electronegativo, el grado de oxidación de azufre puede ser 2, 4, 6.
El azufre es relativamente inerte en el frío, pero a medida que aumenta la temperatura, su reactividad aumenta. 1. Con los metales, el azufre exhibe propiedades oxidantes. Cuando estas reacciones forman sulfuros (con oro, platino e iridio no reaccionan): Fe S = FeS
2. En condiciones normales, el azufre no reacciona con el hidrógeno y, a 150–200 ° C, se produce una reacción reversible:
3. En reacciones con metales y con hidrógeno, el azufre se comporta como un agente oxidante típico, y en presencia de agentes oxidantes fuertes presenta propiedades reductoras.
S 3F 2 = SF 6 (no reacciona con el yodo)
4. La combustión del azufre en oxígeno procede a 280 ° C y en aire a 360 ° C. Esto forma una mezcla de SO 2 y SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Cuando se calienta sin aire, el azufre se combina directamente con el fósforo y el carbono, mostrando propiedades oxidantes:
2P 3S = P 2 S 3 2S C = CS 2
6. Al interactuar con sustancias complejas, el azufre se comporta principalmente como un agente reductor:
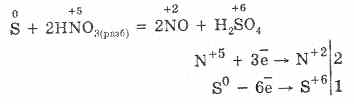
7. El azufre es capaz de reacciones de desproporción. Así, al hervir el polvo de azufre con álcalis, se forman sulfitos y sulfuros:
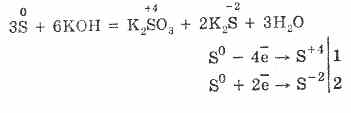
Aplicación
El azufre es ampliamente utilizado en la industria y la agricultura. Aproximadamente la mitad de su producción se consume para producir ácido sulfúrico. El azufre se utiliza para la vulcanización del caucho: en este caso, el caucho se convierte en caucho.
En forma de azufre (polvo fino), el azufre se utiliza para combatir las enfermedades del viñedo y el algodón. Se utiliza para obtener pólvora, cerillas, composiciones luminosas. En medicina, preparado ungüento de azufre para el tratamiento de enfermedades de la piel.
4.2. Sulfuro de hidrógeno, sulfuros, hidrosulfuros
El sulfuro de hidrógeno es un análogo del agua. Su formula electronica
Muestra que dos p-electrones del nivel externo del átomo de azufre están involucrados en la formación de enlaces H-S-H. La molécula de H2S tiene una forma angular, por lo que es polar.
^ Estar en la naturaleza
El sulfuro de hidrógeno se encuentra en la naturaleza en los gases volcánicos y en las aguas de algunas fuentes minerales, como Pyatigorsk, Matsesta. Está formado por la descomposición de sustancias orgánicas que contienen azufre de diversos residuos animales y vegetales. Esto explica el olor desagradable característico de las aguas residuales, pozos y vertederos.
Obteniendo
1. El sulfuro de hidrógeno se puede obtener mediante la conexión directa de azufre con hidrógeno mediante calentamiento:
2. Pero generalmente se obtiene por la acción del ácido clorhídrico o sulfúrico diluido sobre el sulfuro de hierro (III):
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Esta reacción a menudo se lleva a cabo en el aparato Kipp.
^ Propiedades fisicas
En condiciones normales, el sulfuro de hidrógeno es un gas incoloro con un fuerte olor característico a huevos podridos. Muy venenosa, la inhalación se une a la hemoglobina, causando parálisis, lo cual no es saludable.
Ko lleva a la muerte. En bajas concentraciones, menos peligrosas. Es necesario trabajar con él en armarios de escape o con dispositivos herméticamente cerrados. El contenido permitido de H2S en las instalaciones de producción es de 0.01 mg por 1 litro de aire.
El sulfuro de hidrógeno es relativamente bien soluble en agua (a 20 ° С 2.5 volúmenes de sulfuro de hidrógeno se disuelven en 1 volumen de agua).
Una solución de sulfuro de hidrógeno en agua se llama agua de sulfuro de hidrógeno o ácido de sulfuro de hidrógeno (detecta las propiedades de un ácido débil).
^ Propiedades quimicas
1, cuando se calienta fuertemente, el sulfuro de hidrógeno se descompone casi por completo para formar azufre e hidrógeno.
2. El sulfuro de hidrógeno gaseoso se quema en el aire con una llama azul con la formación de óxido de azufre (IV) y agua:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Con una falta de oxígeno, se forman azufre y agua: 2H 2 S O 2 = 2S 2H 2 O
3. El sulfuro de hidrógeno es un agente reductor bastante fuerte. Esta importante propiedad química se puede explicar de la siguiente manera. En una solución de H2S, es relativamente fácil donar electrones a las moléculas de oxígeno del aire:
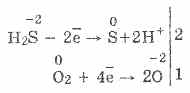
Al mismo tiempo, el oxígeno en el aire oxida el sulfuro de hidrógeno a azufre, lo que hace que el agua del sulfuro de hidrógeno sea turbia:
2H 2 S O 2 = 2S 2H 2 O
Esto explica el hecho de que el sulfuro de hidrógeno no se acumula en grandes cantidades en la naturaleza cuando la materia orgánica se descompone: el oxígeno del aire lo oxida y lo convierte en azufre libre.
4, el sulfuro de hidrógeno reacciona vigorosamente con soluciones halógenas, por ejemplo:
H 2 S I 2 = 2HI S El azufre se libera y la solución de yodo se decolora.
5. Varios oxidantes reaccionan vigorosamente con el sulfuro de hidrógeno: bajo la acción del ácido nítrico, se forma azufre libre.
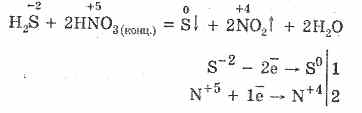
6. Una solución de sulfuro de hidrógeno es ácida debido a la disociación:
H 2 SH HS - HS - H S -2
La primera etapa suele prevalecer. Es un ácido muy débil: más débil que el ácido del carbón, que generalmente desplaza el H 2 S de los sulfuros.
Sulfuros e hidrosulfuros
El ácido fluorhídrico, como dibásico, forma dos filas de sales:
Sulfuros medios (Na2S);
Ácido - hidrosulfuros (NaHS).
Estas sales se pueden obtener mediante la interacción de hidróxidos con sulfuro de hidrógeno: 2NaOHH 2 S = Na 2 S 2H 2 O
La interacción directa de azufre con metales:
La reacción de intercambio de sales con H2S o entre sales:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Los hidrosulfuros son casi todos solubles en agua.
Los sulfuros de metales alcalinos y alcalinotérreos también son fácilmente solubles en agua, incoloros.
Los sulfuros de metales pesados son prácticamente insolubles o ligeramente solubles en agua (FeS, MnS, ZnS); Algunos de ellos no se disuelven en ácidos diluidos (CuS, PbS, HgS).
Como sales de un ácido débil, los sulfuros en soluciones acuosas están altamente hidrolizados. Por ejemplo, los sulfuros de metales alcalinos, cuando se disuelven en agua, tienen una reacción alcalina:
Na 2 S НОНNaHS NaOH
Todos los sulfuros, como el sulfuro de hidrógeno en sí, son agentes reductores vigorosos:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
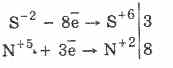
Algunos sulfuros tienen un color característico: CuS y PbS - negro, CdS - amarillo, ZnS - blanco, MnS - rosa, SnS - marrón, Al 2 S 3 - naranja. El análisis cualitativo de los cationes se basa en las diferentes solubilidades de los sulfuros y los diferentes colores de muchos de ellos.
^ 4.3. Óxido de azufre (IV) y ácido sulfúrico
El óxido de azufre (IV), o el dióxido de azufre, en condiciones normales, es un gas incoloro con un fuerte olor sofocante. Cuando se enfría a -10 ° C, se licua en un líquido incoloro.
Obteniendo
1. Bajo condiciones de laboratorio, el óxido de azufre (IV) se obtiene a partir de sales de ácido sulfuroso por la acción de ácidos fuertes sobre ellos:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. También el dióxido de azufre se forma por la interacción del ácido sulfúrico concentrado cuando se calienta con metales poco activos:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. El óxido de azufre (IV) también se forma cuando el azufre se quema en el aire o el oxígeno:
4. En condiciones industriales, el SO 2 se obtiene tostando pirita con FeS 2 o minerales de azufre de metales no ferrosos (blenda de zinc ZnS, brillo de plomo PbS, etc.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
La fórmula estructural de la molécula SO 2:
Cuatro átomos de azufre y cuatro electrones de dos átomos de oxígeno participan en la formación de enlaces en la molécula de SO 2. La repulsión mutua de los pares de electrones de unión y el par de electrones solitarios del azufre le da a la molécula una forma angular.
Propiedades quimicas
1. El óxido de azufre (IV) muestra todas las propiedades de los óxidos de ácido:
Interacción agua
Interacción con los álcalis.
Interacción con óxidos básicos.
2. El óxido de azufre (IV) se caracteriza por sus propiedades reductoras:
S 4 O 2 O 0 2 S2S 6 O -2 3 (en presencia de un catalizador, cuando se calienta)
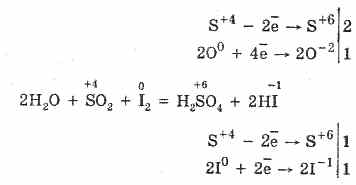
Pero en presencia de agentes reductores fuertes, el SO 2 se comporta como un agente oxidante:
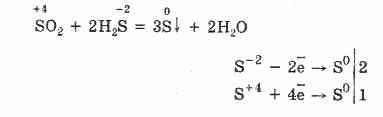
La dualidad redox del óxido de azufre (IV) se explica por el hecho de que el azufre tiene un estado de oxidación de 4, y por lo tanto, al renunciar a 2 electrones, puede oxidarse a S 6 y al tomar 4 electrones, se puede reducir a S °. La manifestación de estas u otras propiedades depende de la naturaleza del componente reactivo.
El óxido de azufre (IV) es altamente soluble en agua (40 volúmenes de SO 2 se disuelven en 1 volumen a 20 ° C). En este caso, se forma el ácido sulfuroso que existe solo en solución acuosa:
SO 2 H 2 ОH 2 SO 3
La reacción es reversible. En solución acuosa, el óxido de azufre (IV) y el ácido sulfúrico se encuentran en equilibrio químico, que se puede desplazar. Con la unión del H 2 SO 3 (neutralización del ácido).
Usted) la reacción procede en la dirección de la formación del ácido sulfuroso; Al eliminar el SO 2 (soplando a través de una solución de nitrógeno o calentamiento), la reacción avanza hacia los materiales de partida. La solución de ácido sulfúrico siempre contiene óxido de azufre (IV), que le da un fuerte olor.
El ácido sulfúrico tiene todas las propiedades de los ácidos. En solución se disocia en pasos:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Térmicamente inestable, volátil. El ácido sulfuroso, como dibásico, forma dos tipos de sales:
Sulfitos medios (Na 2 SO 3);
Ácido - hidrosulfito (NaHSO 3).
Los sulfitos se forman cuando el álcali está completamente neutralizado por el ácido:
H2SO3 2NaOH = Na2SO3 2H2O
Los hidrosulfitos se obtienen con una falta de álcali:
H 2 SO 3 NaOH = NaHSO 3 H 2 O
El ácido sulfúrico y sus sales poseen propiedades oxidantes y reductoras, lo que está determinado por la naturaleza del compañero de reacción.
1. Así, bajo la acción de los oxigenos de oxígeno se oxidan a sulfatos:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
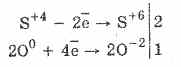
La oxidación del ácido sulfuroso por bromo y permanganato de potasio procede aún más fácilmente:
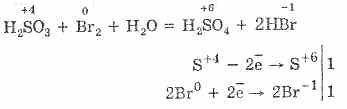
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
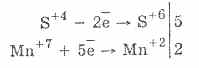
2. En presencia de agentes reductores más vigorosos, los sulfitos exhiben propiedades oxidativas:
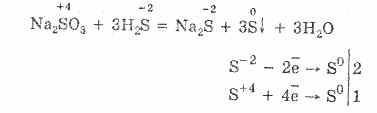
Casi todos los hidrosulfitos y sulfitos de metales alcalinos se disuelven a partir de sales de ácido sulfuroso.
3. Dado que el H 2 SO 3 es un ácido débil, la acción de los ácidos sobre los sulfitos y los hidrosulfitos resulta en la liberación de SO 2. Este método se suele utilizar al obtener SO 2. en condiciones de laboratorio:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Los sulfitos solubles en agua se hidrolizan fácilmente, como resultado de lo cual la concentración de iones OH - aumenta en la solución:
Na 2 SO 3 NONaHSO 3 NaOH
Aplicación
El óxido de azufre (IV) y el ácido sulfúrico decoloran muchos tintes, formando con ellos compuestos incoloros. Este último puede descomponerse de nuevo cuando se calienta o en la luz, como resultado de lo cual se restaura el color. Por lo tanto, el efecto blanqueador del SO 2 y el H2O3 es diferente del efecto blanqueador del cloro. Por lo general, el azufre (IV) blanquea la lana, la seda y la paja.
El óxido de azufre (IV) mata muchos microorganismos. Por lo tanto, para destruir hongos de moho, fumigan sótanos, bodegas, barriles de vino, etc. También se utiliza en el transporte y almacenamiento de frutas y bayas. En grandes cantidades, el óxido de azufre IV) se utiliza para producir ácido sulfúrico.
Una aplicación importante es la solución de hidrosulfito de calcio CaHSO 3 (licor de sulfito), que se utiliza para tratar la madera y la pulpa de papel.
^ 4.4. Óxido de azufre (VI). Acido sulfurico
El óxido de azufre (VI) (ver tabla 20) es un líquido incoloro que se solidifica a una temperatura de 16.8 ° C a una masa cristalina sólida. Absorbe la humedad muy fuertemente, formando ácido sulfúrico: SO 3 H 2 O = H 2 SO 4
Tabla 20. Propiedades de los óxidos de azufre
La disolución de los óxidos de azufre (VI) en agua se acompaña de la liberación de una cantidad significativa de calor.
El óxido de azufre (VI) es muy soluble en ácido sulfúrico concentrado. Una solución de SO 3 en un ácido anhidro se llama oleum. Los oleums pueden contener hasta un 70% de SO 3.
Obteniendo
1. El óxido de azufre (VI) se obtiene por oxidación del dióxido de azufre con oxígeno en presencia de catalizadores a una temperatura de 450 ° C (ver Producción de ácido sulfúrico):
2SO 2 O 2 = 2SO 3
2. Otra forma de oxidar SO 2 a SO 3 es usar óxido nítrico (IV) como agente oxidante:
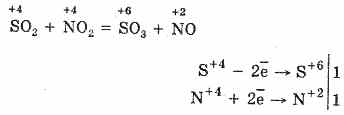
El óxido nítrico resultante (II) cuando interactúa con el oxígeno atmosférico de manera fácil y rápida se convierte en óxido nítrico (IV): 2NO O 2 = 2NO 2
Que puede ser utilizado nuevamente en la oxidación de SO 2. Por lo tanto, el NO 2 actúa como un portador de oxígeno. Este método de oxidación de SO 2 a SO 3 se llama nitroso. La molécula de SO 3 tiene la forma de un triángulo, en el centro del cual
El átomo de azufre se encuentra:
Dicha estructura se debe a la repulsión mutua de los pares de electrones de unión. Un átomo de azufre ha proporcionado seis electrones externos para su formación.
Propiedades quimicas
1. SO 3 - óxido de ácido típico.
2. El óxido de azufre (VI) tiene las propiedades de un agente oxidante fuerte.
Aplicación
El óxido de azufre (VI) se utiliza para producir ácido sulfúrico. Lo más importante es el método de contacto de obtención.
Ácido sulfúrico. Por este método, puede obtener H 2 SO 4 de cualquier concentración, así como oleum. El proceso consta de tres etapas: obtención de SO 2; oxidación de SO 2 a SO 3; obteniendo H 2 SO 4.
El SO 2 se obtiene quemando la pirita FeS 2 en hornos especiales: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Para acelerar el tostado, la pirita se muele previamente, y para una combustión más completa del azufre, se inyecta significativamente más aire (oxígeno) del que requiere la reacción. El gas que sale del horno se compone de óxido de azufre (IV), oxígeno, nitrógeno, compuestos de arsénico (de impurezas en pirita) y vapor de agua. Se llama gas tostado.
El gas tostado se limpia a fondo, ya que incluso un pequeño contenido de compuestos de arsénico, así como el polvo y la humedad, envenenan el catalizador. El gas se limpia de los compuestos de arsénico y el polvo, pasándolo a través de precipitadores electrostáticos especiales y una torre de lavado; La humedad es absorbida por el ácido sulfúrico concentrado en una torre de secado. El gas purificado que contiene oxígeno se calienta en un intercambiador de calor de hasta 450 ° C y entra en el aparato de contacto. Dentro del aparato de contacto hay estantes de celosía llenos de catalizador.
Anteriormente, se utilizaba platino metálico triturado finamente como catalizador. Posteriormente, fue reemplazado por compuestos de vanadio: óxido de vanadio (V) V 2 O 5 o vanadil sulfato VOSO 4, que es más barato que el platino y se envenena más lentamente.
La reacción de oxidación de SO 2 a SO 3 es reversible:
2SO 2 O 2 2SO 3
Un aumento en el contenido de oxígeno en el gas de calcinación aumenta el rendimiento del óxido de azufre (VI): a una temperatura de 450 ° C, generalmente alcanza el 95% o más.
El óxido de azufre formado (VI) se alimenta luego por un método de contracorriente a una torre de absorción, donde es absorbido por ácido sulfúrico concentrado. A medida que se satura, primero se forma ácido sulfúrico anhidro y luego oleum. En el futuro, el oleum se diluye al 98% de ácido sulfúrico y se entrega a los consumidores.
La fórmula estructural del ácido sulfúrico:
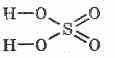
^ Propiedades fisicas
El ácido sulfúrico es un líquido pesado, incoloro y aceitoso que cristaliza a 10.4 ° C, casi el doble. ( = 1.83 g / cm 3) es más pesado que el agua, sin olor, no volátil. Extremadamente higroscópico. La humedad se absorbe con la liberación de grandes cantidades de calor, por lo que no se puede verter agua en el ácido sulfúrico concentrado; habrá una salpicadura de ácido. Para el
El ácido sulfúrico se debe agregar al agua en pequeñas porciones.
El ácido sulfúrico anhidro disuelve hasta un 70% del óxido de azufre (VI). Cuando se calienta, elimina el SO 3 hasta que se forma una solución con una fracción de masa de H 2 SO 4 del 98.3%. El H 2 SO 4 anhidro casi no conduce la corriente eléctrica.
^ Propiedades quimicas
1. Se mezcla con agua en cualquier proporción y forma hidratos de diferente composición:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3 H 2 O, H 2 SO 4 4 H 2 O, H 2 SO 4 6,5 H 2 O
2. El ácido sulfúrico concentrado carboniza la materia orgánica - azúcar, papel, madera, fibra, quitándoles los elementos del agua:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
El carbón formado interactúa parcialmente con el ácido:
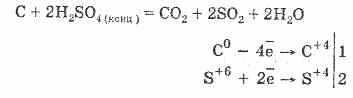
La deshidratación del gas se basa en la absorción de agua por el ácido sulfúrico.
Como un ácido no volátil fuerte, el H 2 SO 4 desplaza a otros ácidos de las sales secas:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Sin embargo, si se agrega H 2 SO 4 a las soluciones de sal, no se produce un desplazamiento ácido.
H 2 SO 4 - ácido dibásico fuerte: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2- 4
Tiene todas las propiedades de los ácidos fuertes no volátiles.
El ácido sulfúrico diluido se caracteriza por todas las propiedades de los ácidos no oxidantes. A saber: interactúa con los metales que se encuentran en la serie electroquímica del voltaje de los metales hasta el hidrógeno:
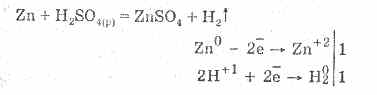
La interacción con los metales se debe a la reducción de los iones de hidrógeno.
6. El ácido sulfúrico concentrado es un agente oxidante energético. Cuando se calienta, la mayoría de los metales se oxidan, incluidos los de las series electroquímicas de tensiones después del hidrógeno, que no reaccionan solo con platino y oro. Dependiendo de la actividad del metal, los productos de reducción pueden ser S -2, S ° y S 4.
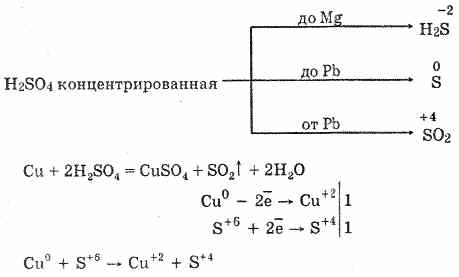
En el frío, el ácido sulfúrico concentrado no interactúa con metales tan fuertes como el aluminio, el hierro y el cromo. Esto se debe a la pasivación de los metales. Esta característica se usa ampliamente cuando se transporta en un contenedor de hierro.
Sin embargo, cuando se calienta:
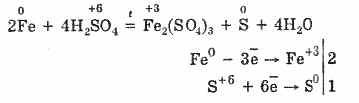
Así, el ácido sulfúrico concentrado interactúa con los metales debido a la reducción de los átomos formadores de ácido.
Una reacción cualitativa al ion sulfato SO 2-4 es la formación de un precipitado cristalino blanco de BaSO 4, insoluble en agua y ácidos:
SO 2- 4 Ba 2 BaSO 4
Aplicación
El ácido sulfúrico es el producto más importante de la principal industria química dedicada a la producción de
Ácidos orgánicos, álcalis, sales, abonos minerales y cloro.
Para una variedad de aplicaciones, el ácido sulfúrico ocupa el primer lugar entre los ácidos. La mayor cantidad de ella se consume para obtener fertilizantes de fosfato y nitrógeno. Al ser no volátil, el ácido sulfúrico se utiliza para producir otros ácidos: clorhídrico, fluorhídrico, fosfórico y acético.
Mucho de esto va para la purificación de productos derivados del petróleo (gasolina, queroseno, aceites lubricantes) de impurezas dañinas. En ingeniería mecánica, el ácido sulfúrico limpia la superficie del metal de los óxidos antes del recubrimiento (niquelado, cromado, etc.). El ácido sulfúrico se utiliza en la fabricación de explosivos, fibras artificiales, tintes, plásticos y muchos otros. Se utiliza para llenar las pilas.
Las sales de ácido sulfúrico son importantes.
^ Sulfato de sodioEl Na 2 SO 4 cristaliza a partir de soluciones acuosas en forma de un hidrato de Na 2 SO 4 10H 2 O, que se llama sal de Glauber. Se utiliza en medicina como laxante. El sulfato de sodio anhidro se utiliza en la fabricación de refrescos y vidrio.
^ Sulfato de amonio(NH 4) 2 SO 4 - fertilizante nitrogenado.
Sulfato de potasioK 2 SO 4 - Fertilizante de potasio.
Sulfato de calcio CaSO 4 se encuentra en la naturaleza como un mineral de yeso CaSO 4 2H 2 O. Cuando se calienta a 150 ° C, pierde algo de agua y entra en un hidrato de 2CaSO 4 H 2 O, llamado yeso quemado o alabastro. Cuando se mezcla con agua en una masa pastosa, el alabastro se endurece nuevamente después de un tiempo, convirtiéndose en CaSO 4 2H 2 O. El yeso se usa ampliamente en la construcción (yeso).
^ Sulfato de magnesioEl MgSO 4 se encuentra en el agua de mar, causando su sabor amargo. El hidrato cristalino, llamado sal amarga, se usa como laxante.
Vitriolo- nombre técnico de los hidratos cristalinos de los sulfatos metálicos Fe, Cu, Zn, Ni, Co (las sales deshidratadas no son vitriales). Sulfato de cobreCuSO 4 5H 2 O es una sustancia tóxica azul. Las plantas se rocían con una solución diluida y las semillas se siembran antes de sembrar. Hierro vitrioloFeSO 4 7H 2 O es una sustancia de color verde claro. Se utiliza para controlar plagas de plantas, tintas, pinturas minerales, etc. Sulfato de zincZnSO 4 7H 2 O se utiliza en la producción de tintas minerales, en sittoprechatanii, medicina.
^ 4.5. Esteres del ácido sulfúrico. Tiosulfato de sodio
Los ésteres de ácido sulfúrico incluyen sulfatos de dialquilo (RO 2) SO 2. Estos son líquidos de alto punto de ebullición; menos soluble en agua; En presencia de álcali, se forman alcohol y sales de ácido sulfúrico. Los sulfatos de dialquilo inferior son agentes alquilantes.
Dietil sulfato(C 2 H 5) 2 SO 4. Punto de fusión -26 ° С, punto de ebullición 210 ° С, soluble en alcoholes, insoluble en agua. Obtenido por reacción de ácido sulfúrico con etanol. Es el agente etilante en síntesis orgánica. Penetra en la piel.
Sulfato de dimetilo(CH 3) 2 SO 4. Punto de fusión -26.8 ° С, punto de ebullición 188.5 ° С. Soluble en alcoholes, malo - en agua. Reacciona con amoníaco en ausencia de solvente (con una explosión); Azufre algunos compuestos aromáticos, como los ésteres de fenol. Se obtiene por interacción del 60% de oleum con metanol a 150 ° C. Es un agente de metilación en síntesis orgánica. Carcinogénico, afecta a los ojos, piel, órganos respiratorios.
^ Tiosulfato de sodio Na 2 S 2 O 3
Sal del ácido tiosulfúrico en la que dos átomos de azufre tienen diferentes estados de oxidación: 6 y -2. Sustancia cristalina, bien soluble en agua. Disponible en forma de Na 2 S 2 O 3 5H 2 O cristalino, comúnmente conocido como hiposulfito. Obtenido por la interacción del sulfito de sodio con azufre durante la ebullición:
Na 2 SO 3 S = Na 2 S 2 O 3
Al igual que el ácido tiosulfúrico, es un agente reductor fuerte. Se oxida fácilmente con cloro a ácido sulfúrico:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
El uso de tiosulfato de sodio para la absorción de cloro (en las primeras máscaras de gas) se basó en esta reacción.
Se produce una oxidación ligeramente diferente del tiosulfato de sodio, agentes oxidantes débiles. Esto forma sales de ácido tetratiónico, por ejemplo:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
El tiosulfato de sodio es un subproducto en la producción de NaHSO 3, colorantes azufrados, en la purificación de gases industriales a partir de azufre. Se utiliza para eliminar trazas de cloro después del blanqueo de tejidos, para extraer plata de los minerales; es un fijador en fotografía, un reactivo en yodometría, un antídoto para el envenenamiento con compuestos arsénicos, mercurio, un agente antiinflamatorio.
El elemento químico azufre se encuentra en el grupo VIА, período 3 PSCE. En la capa de electrones externa del átomo de azufre hay 6 electrones. Mostrando las propiedades del agente oxidante en la formación de sustancias con metales e hidrógeno, el azufre adquiere el estado de oxidación -2 (toma 2 electrones).
En la composición de compuestos que contienen oxígeno, el azufre exhibe estados de oxidación +4 y +6. Así, el azufre se caracteriza por estados de oxidación -2; 0; +4; +6.
En la naturaleza, el azufre se encuentra en su estado nativo y en la composición de los minerales. Por ejemplo, el azufre contiene brillo de plomo (el componente principal es sulfuro de plomo PbS) y brillo de cobre (el componente principal es sulfuro de cobre Cu 2 S).
El azufre forma algunas sustancias simples - modificaciones alotrópicas. El azufre rómbico es más estable a temperatura ambiente (Fig. 1). Esta sustancia consta de moléculas S 8. El azufre rómbico es amarillo y se funde a una temperatura de + 112.8 ° C.
La figura 1. Modificación rómbica del azufre.
Cuando se calienta, el azufre rombal se convierte gradualmente en una masa viscosa de color marrón oscuro. Esta es otra modificación alotrópica del azufre - azufre plástico. El azufre plástico consiste en moléculas lineales de azufre S n.
El azufre en las reacciones químicas con metales e hidrógeno desempeña el papel de un agente oxidante. Su grado de oxidación disminuye de 0 a -2. En la reacción con oxígeno, el azufre actúa como agente reductor, aumentando su grado de oxidación de 0 a +4.
Considere ejemplos de interacciones que involucran azufre.
Cuando el azufre interactúa con el hidrógeno, se forma sulfuro de hidrógeno:
Cuando el zinc interactúa con el azufre, se forma sulfuro de zinc:
El azufre se quema en oxígeno con la formación de óxido de azufre (IV) (Fig. 2):

La figura 2. Quemar azufre en oxigeno.
Considerar las propiedades de los compuestos de azufre con estado de oxidación "-2". Tales compuestos incluyen sulfuro de hidrógeno y sulfuros - sales de ácido de sulfuro de hidrógeno.
El sulfuro de hidrógeno es un gas con olor a huevos podridos. Se quema en el aire. Además, con una falta y un exceso de oxígeno, la combustión se produce de manera diferente.
En un exceso de oxígeno, el sulfuro de hidrógeno se quema para formar óxido de azufre (IV) y agua:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Con la falta de oxígeno, se produce una combustión incompleta de sulfuro de hidrógeno con la liberación de azufre: 2H 2 S + O 2 = 2S + 2H 2 O.
El sulfuro de hidrógeno es altamente soluble en agua. La solución resultante es un ácido de sulfuro de hidrógeno débil. Las sales de sulfuro de hidrógeno se llaman sulfuros. El ácido fluorhídrico y los sulfuros solubles en agua entran en reacciones de intercambio.
La interacción del ácido sulfhídrico y el cloruro de cobre (II) forma sulfuro de cobre (II) insoluble y ácido clorhídrico: H2S + CuCl2 = CuS + 2HCl.
Cuando el sulfuro de potasio interactúa con el nitrato de zinc, se forman precipitados de sulfuro de zinc y se forma nitrato de potasio: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Referencias
- Orzhekovsky P.A. Colección de tareas y ejercicios en química: 9º grado: al libro de texto P.A. Orzhekovsky y otros. "Química. Grado 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel - M: AST: Astrel, 2007. (págs. 91-97)
- Orzhekovsky P.A. Química: 9º grado: estudios. Para imagen general. institución / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - M: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Química: 9º grado: estudios para general. institución / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Quimica: neorgan. química Órgano Química: estudios. para 9 cl. / G.E. Rudzitis, F.G. Feldman - M .: Educación, Libros de texto de Moscú OJSC, 2009.
- Khomchenko I.D. Recopilación de tareas y ejercicios en química para bachillerato. - M.: RIA "New Wave": Editor Umerenkov, 2008.
- Enciclopedia para niños. Volumen 17. Química / Capítulo. ed. V.A. Volodin, Ved. cientifico ed. I. Leenson. - M .: Avanta +, 2003.
- Una colección única de recursos educativos digitales (experiencias de video sobre el tema) ().
- Versión electrónica de la revista "Química y Vida" ().
La tarea
- c. 136 No. 3; p.140 №№ 2-4 del libro de texto P.A. Orzhekovsky "Química: noveno grado" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M .: Astrel, 2013.
Sulfuros (del lat. azufre, azufre - azufre)
compuestos de azufre con más elementos electropositivos; Pueden considerarse sales de ácido sulfhídrico (ver Ácido sulfhídrico) H 2 S. Hay dos series C: el promedio (normal) de la fórmula general M 2 S y el ácido (hidrosulfuros) de la fórmula general MHS, donde M es un metal monovalente. C. Los metales alcalinos son incoloros, solubles en agua. Sus soluciones acuosas son altamente hidrolizadas y alcalinas. Bajo la acción de los ácidos diluidos emiten H2S. C. Los metales alcalinotérreos son incoloros, ligeramente solubles en agua. El H2S se emite en el aire húmedo. Otras propiedades son similares a las de los metales alcalinos S. Tanto esos como otros S. se oxidan fácilmente a sulfatos. C. Los metales pesados son prácticamente insolubles en agua. Casi todas son negras o marrón-negras (con la excepción de ZnS blanco, MnS rosáceo, CdS amarillo, Sb 2 S 3 naranja-rojo, SnS 2 amarillo). La relación desigual de C. a ácidos y C. amonio se utiliza en el análisis químico. I.K. Malina.
Gran enciclopedia soviética. - M .: Enciclopedia soviética. 1969-1978 .
Vea lo que "Sulfuros" están en otros diccionarios:
Compuestos de azufre con metales y algunos no metales. Los sulfuros metálicos son sales del ácido sulfhídrico H2S: medio (por ejemplo, Na2S) y ácidos, o hidrosulfuros (NaHS). Al quemar sulfuros naturales, se obtienen metales no ferrosos y SO2. Sulfuros de fósforo y ... ... Gran Diccionario Enciclopédico
Enciclopedia moderna
Sulfuros - SULFIDOS, sulfuros inorgánicos de compuestos de azufre con metales y algunos no metales. Incluido en minerales de sulfuro; utilizado como fósforos (por ejemplo, CdS, ZnS). Sulfuro de molibdeno, lubricantes sólidos de titanio. Sulfuros de fósforo ... ... Diccionario enciclopédico ilustrado
- (Nuevo lat., del latín. azufre azufre). Compuestos de algún cuerpo con azufre, correspondientes a óxidos o ácidos. Diccionario de palabras extranjeras incluidas en el idioma ruso. Chudinov, AN, 1910. SULFIDES Novolatinsk., De Lat. azufre, azufre. Conexión ... Diccionario de palabras extranjeras de la lengua rusa.
1. Compuestos naturales de azufre de metales y algunos no metales. En la quimica Las relaciones son consideradas como sales de ácido sulfhídrico H2S. Un número de elementos forman polisulfuros con azufre, que son sales del ácido poli-sulfuroso H2Sx. El principal ... ... Enciclopedia geologica
Sulfuros - - compuestos de azufre con metales y algunos no metales; Sulfuros metálicos sales de ácido sulfhídrico H2S. [Diccionario terminológico para hormigón y hormigón armado. FSUE "SIC" Construcción "NIIZHB y A. A. Estación de metro Gvozdeva, Moscú, 2007. 110 p.] ... ... Enciclopedia de términos, definiciones y explicaciones de materiales de construcción.
SULFOS, s, u sulfuro, un marido (espec.) Compuestos químicos de azufre con metales y ciertos no metales. Orgánico con Naturales s. | adj sulfuro, oh, oh Diccionario Ozhegova. S.I. Ozhegov, N.Yu. Shvedov. 1949 1992 ... Diccionario Ozhegova
Los sulfuros, R2S (radical aromático R), se obtienen más fácilmente agregando gota a gota una solución de diazo sales a 60 70 ... Enciclopedia de Brockhaus y Efron
SULFIDES - (1) en química inorgánica, tales compuestos de elementos con azufre, en los cuales los átomos de azufre tienen un estado de oxidación de 2. En química. Las relaciones se consideran como sales de ácido de sulfuro de hidrógeno débil (solución acuosa de H2S). Muchos S. son naturales ... ... Enciclopedia Politécnica Grande
Oh; mn (unidades de sulfuro, y; m.). [de lat. azufre azufre] Chem. Compuestos de azufre con metales y algunos no metales. C. titanio. Orgánico con Naturales s. (clase de minerales). ◁ Sulfuro, th, oh. Con mezclas mixtas. De mineral de mineral. * * * Sulfuros de compuestos de azufre ... Diccionario enciclopedico
- (del latín azufre azufre) una clase de compuestos químicos que son compuestos metálicos (así como varios no metales B, Si, P, As) con azufre (S), donde tiene un estado de oxidación de -2. Puede ser considerado como sales de sulfuro de hidrógeno ... ... Wikipedia
Los libros
- Depósitos de uranio del tipo de desacuerdo en el Fanerozoico, Andrei Borisovich Khalezov. Las características de los depósitos de uranio en las estructuras del río paleo-valle en las superficies de desacuerdo estructural y estratigráfico se consideran en el ejemplo de tres regiones de la región de los Urales con diferentes ...
Azufre - El elemento del 3er período y el grupo VIA del sistema periódico, número de serie 16, se refiere a calcogenos La fórmula electrónica del átomo [10 Ne] 3s 2 3p 4, estados de oxidación característicos 0, II, + IV y + VI, el estado S VI se considera estable.
Escala de oxidación del azufre:
La electronegatividad del azufre es 2.60, se caracteriza por sus propiedades no metálicas. En los compuestos de hidrógeno y oxígeno está contenido en varios aniones, forma ácidos que contienen oxígeno y sus sales, compuestos binarios.
En la naturaleza decimoquinto Elemento químico de prevalencia (el séptimo entre los no metales). Se encuentra en forma libre (nativa) y relacionada. Un elemento vital para los organismos superiores.
Azufre s. Sustancia simple. Amarillo cristalino (α-rómbico y β-monoclínico,
a 95.5 ° C) o amorfo (plástico). En los sitios de la red hay moléculas de S 8 (ciclos tipo "corona" no planares), el azufre amorfo consiste en cadenas Sn. Sustancia de bajo punto de fusión, la viscosidad del líquido pasa a través de un máximo a 200 ° C (la brecha de las moléculas S 8, el entrelazado de las cadenas S n). En un par - moléculas S 8, S 6, S 4, S 2. A 1500 ° C, aparece azufre monoatómico (en las ecuaciones químicas por simplicidad, cualquier azufre se representa como S).
El azufre no se disuelve en el agua y, en condiciones normales, no reacciona con él, es muy soluble en el disulfuro de carbono CS 2.
El azufre, especialmente en polvo, tiene una alta actividad cuando se calienta. Reacciona como un agente oxidante con metales y no metales:
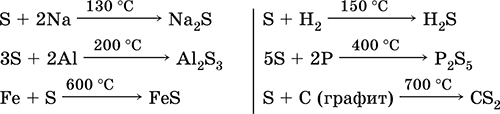
que tal agente reductor - Con flúor, oxígeno y ácidos (al hervir):
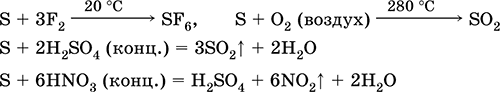
El azufre sufre desmantelamiento en soluciones alcalinas:
3S 0 + 6KOH (conc.) = 2K 2 S ‑II + K 2 S IV O 3 + 3H 2 O
A altas temperaturas (400 ° C), el azufre desplaza el yodo del yoduro de hidrógeno:
S + 2НI (g) = I 2 + H 2 S,
pero en solución la reacción va por el camino opuesto:
I 2 + H 2 S (p) = 2 HI + S ↓
Obteniendo: en industria fundido a partir de depósitos naturales de azufre nativo (utilizando vapor de agua), liberado durante la desulfuración de los productos de gasificación de carbón.
El azufre se utiliza para sintetizar el disulfuro de carbono, el ácido sulfúrico, los tintes sulfurosos (tinas), en la vulcanización del caucho, como un medio para proteger las plantas contra el mildiú polvoriento y para tratar enfermedades de la piel.
Sulfuro de hidrógeno H2S. Ácido libre de oxígeno. Gas incoloro con olor sofocante, más pesado que el aire. La molécula tiene la estructura de un tetraedro doble incompleto [:: S (H) 2]
(sp 3 - hibridación, el ángulo del gato H - S - H está lejos de ser tetraédrico). Inestable cuando se calienta por encima de 400 ° C. Es ligeramente soluble en agua (2.6 l / 1 l de H 2 O a 20 ° C), una solución saturada es decimolar (0.1 M, "agua de sulfuro de hidrógeno"). Un ácido muy débil en solución, prácticamente no se disocia en la segunda etapa a los iones S 2 (la concentración máxima de S 2 -1 es igual a 1 10 –13 mol / l). Cuando está de pie en el aire, la solución se vuelve turbia (inhibidor - sacarosa). Está neutralizado por álcalis, no completamente, por hidrato de amoniaco. Agente reductor fuerte. Entra en reacciones de intercambio iónico. Agente de sulfuración, precipita de una solución de sulfuros de diferentes colores con muy baja solubilidad.
Reacciones cualitativas - la sedimentación de sulfuros, así como la combustión incompleta de H2S con la formación de un depósito de azufre amarillo sobre un objeto frío introducido en la llama (espátula de porcelana). Un subproducto del refino de petróleo, gas natural y horno de coque.
Se utiliza en la producción de azufre, compuestos orgánicos e inorgánicos que contienen azufre como reactivo analítico. Extremadamente venenoso. Las ecuaciones de las reacciones más importantes:
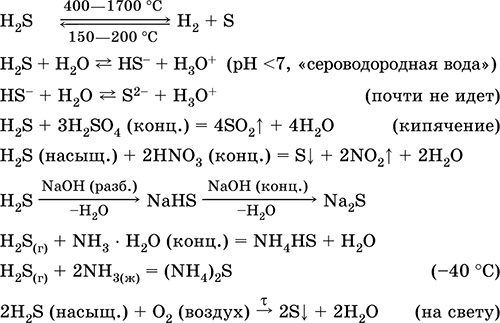

Obteniendo: en industria - síntesis directa:
H 2 + S = H 2 S(150–200 ° C)
o por calentamiento de azufre con parafina;
en el laboratorios - Desplazamiento de sulfuros por ácidos fuertes.
FeS + 2НCl (conc.) = FeCl 2 + H 2 S
o hidrólisis completa de compuestos binarios:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Sulfuro de sodio Na 2 S. Sal libre de oxígeno. Blanco, muy higroscópico. Se derrite sin descomposición, térmicamente estable. Es bien soluble en agua, hidrolizado por aniones, crea un medio altamente alcalino en solución. Cuando está de pie en el aire, la solución se vuelve turbia (azufre coloidal) y se vuelve amarilla (tinte de polisulfuro). Agente reductor típico. Se une azufre. Entra en reacciones de intercambio iónico.
Reacciones cualitativas en el ion S 2–– deposición de sulfuros metálicos de varios colores, de los cuales MnS, FeS, ZnS se descomponen en HCl (s).
Se utiliza en la producción de tintes azufrados y celulosa, para eliminar el vello de las pieles durante el curtido del cuero, como reactivo en química analítica.
Las ecuaciones de las reacciones más importantes:
Na 2 S + 2НCl (dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (conc.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (hasta 50 ° C)
Na 2 S + 4HNO 3 (conc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (sat.) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (por encima de 400 ° C)
Na2S + 4H2O2 (conc.) = Na2SO4 + 4H2O
S 2‑ + M 2+ = MnS (corporal) ↓; FeS (negro) ↓; ZnS (blanco) ↓
S 2‑ + 2Ag + = Ag 2 S (negro)
S 2‑ + M 2+ = CdS (amarillo) ↓; PbS, CuS, HgS (negro) ↓
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (corr. - negro)
3S 2‑ + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Obteniendo en el industria - calcinación del mineral mirabilita Na 2 SO 4 10H 2 O en presencia de agentes reductores:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, cat. Fe 2 O 3)
Na 2 SO 4 + 4C (coque) = Na 2 S + 4CO (800–1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600–700 ° C)
Sulfuro de aluminio Al 2 S 3. Sal libre de oxígeno. Blanco, el enlace Al - S es predominantemente covalente. Se derrite sin descomposición bajo la presión excesiva de N 2, se sublima fácilmente. Se oxida en el aire cuando se calcina. Completamente hidrolizado con agua, no precipita de la solución. Descompuesto por ácidos fuertes. Se utiliza como una fuente sólida de sulfuro de hidrógeno puro. Las ecuaciones de las reacciones más importantes:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (puro)
Al 2 S 3 + 6НCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (conc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (aire) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
Obteniendo: interacción del aluminio con azufre fundido en ausencia de oxígeno y humedad:
2Al + 3S = AL 2 S 3(150–200 ° C)
Hierro (II) sulfuro de FeS. Sal libre de oxígeno. Negro y gris con un tinte verde, refractario, se descompone cuando se calienta en un vacío. En estado húmedo es sensible al oxígeno en el aire. Insoluble en agua. No precipita tras la saturación de soluciones de sales de hierro (II) con sulfuro de hidrógeno. Descompuesto por los ácidos. Se utiliza como materia prima en la producción de hierro, una fuente sólida de sulfuro de hidrógeno.
La composición del compuesto de hierro (III) de Fe 2 S 3 no se conoce (no se recibe).
Las ecuaciones de las reacciones más importantes:
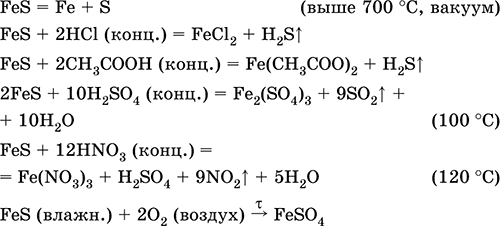
Recibiendo
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 Fes + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Cl + H 2 S
Disulfuro de hierro FeS 2. Conexión binaria. Tiene la estructura iónica Fe 2+ (–S - S–) 2‑. Amarillo oscuro, térmicamente estable, se descompone en el encendido. Insoluble en agua, no reacciona con ácidos diluidos, álcalis. Se descompone por agentes oxidantes ácidos, tostados en el aire. Se utiliza como materia prima en la producción de hierro, azufre y ácido sulfúrico, un catalizador en la síntesis orgánica. En la naturaleza - minerales minerales pirita y marcasita.
Las ecuaciones de las reacciones más importantes:
FeS 2 = FeS + S (por encima de 1170 ° C, vacío)
2FeS 2 + 14H 2 SO 4 (conc., Montañas) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS2 + 18HNO3 (conc.) = Fe (NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
4FeS 2 + 11O 2 (aire) = 8SO 2 + 2Fe 2 O 3 (800 ° C, tostado)
Hidrosulfuro de amonio NH 4 HS. Sal ácida libre de oxígeno. Blanco, fundido bajo presión. Extremadamente volátil, térmicamente inestable. Se oxida en el aire. Es bien soluble en agua, hidrolizado por catión y anión (prevalece), crea un ambiente alcalino. La solución se vuelve amarilla en el aire. Se descompone por los ácidos, en una solución saturada agrega azufre. Los álcalis no se neutralizan, la sal media (NH 4) 2 S no existe en la solución (para las condiciones de obtención de la sal media, consulte el encabezado "H 2 S"). Se utiliza como componente de reveladores fotográficos, como reactivo analítico (precipitador de sulfuro).
Las ecuaciones de las reacciones más importantes:
NH 4 HS = NH 3 + H 2 S (por encima de 20 ° C)
NH 4 HS + HCl (dec.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (conc.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (sat. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS
Obteniendo: saturación de solución concentrada de NH 3 con sulfuro de hidrógeno:
NH 3 H 2 O (conc.) + H 2 S (g) = NH 4 HS + H 2 O
En química analítica, una solución que contiene cantidades iguales de NH 4 HS y NH 3 H 2 O se considera convencionalmente como una solución de (NH 4) 2 S y la fórmula de sal promedio se usa para escribir las ecuaciones de reacción, aunque el sulfuro de amonio se hidroliza completamente en agua a NH 4 HS y NH 3 H 2 O.
Dióxido de azufre. Sulfitos
Dióxido de azufre SO 2. Óxido de ácido. Gas incoloro con un olor acre. La molécula tiene la estructura de un triángulo incompleto [: S (O) 2] (sp 2 - hibridación), contiene σ, π - enlaces S = O. Fácilmente licuado, térmicamente estable. Es soluble en agua (~ 40 l / 1 l H 2 O a 20 ° C). Forma un polihidrato con las propiedades de un ácido débil, los productos de la disociación - iones HSO 3 - y SO 3 2−. Ion HSO 3 - tiene dos formas tautoméricas - simétrico (no ácido) con la estructura del tetraedro (sp 3 - hibridación), que predomina en la mezcla, y asimétrico (ácido) con la estructura de un tetraedro incompleto [: S (O) 2 (OH)] (sp 3 - hibridación). El ion SO 3 2‑ también es tetraédrico [: S (O) 3].
Reacciona con álcalis, hidrato de amoniaco. Agente reductor típico, agente oxidante débil.
Reacción cualitativa - Decoloración del "agua de yodo" marrón amarillento. Intermedio en la producción de sulfitos y ácido sulfúrico.
Se utiliza para blanquear lana, seda y paja, conservar y almacenar frutas, como desinfectante, antioxidante y refrigerante. Venenoso
El compuesto de H 2 SO 3 (ácido sulfuroso) no se conoce (no existe).
Las ecuaciones de las reacciones más importantes:
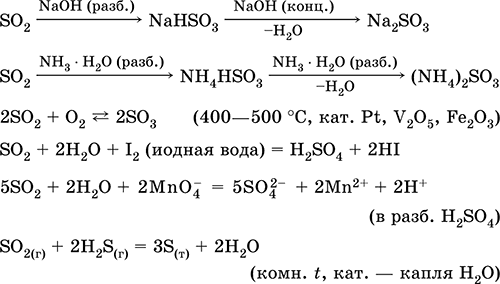
Disolución en agua y propiedades ácidas:
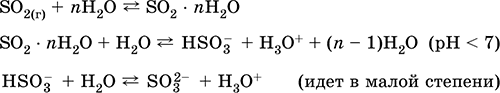
Obteniendo: en la industria - la quema de azufre en aire enriquecido con oxígeno y, en menor medida, el tostado de minerales de sulfuro (SO2 - gas asociado durante el tostado de pirita):
S + O 2 = SO 2(280–360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, tostado)
en el laboratorio - El desplazamiento de sulfitos con ácido sulfúrico:
BaSO 3 (t) + H 2 SO 4 (conc.) = BaSO 4 ↓ + SO 2 + H 2 O
Sulfito de sodio Na 2 SO 3. Salino Blanco Cuando se calienta en el aire, se descompone sin fundirse, se derrite bajo la sobrepresión de argón. En estado húmedo y en solución sensible al oxígeno en el aire. Es soluble en agua, hidrolizada por aniones. Descompuesto por los ácidos. Agente reductor típico.
Reacción cualitativa en el ion SO 3 2 - la formación de un precipitado blanco de sulfito de bario, que se transfiere a la solución con ácidos fuertes (HCl, HNO 3).
Se utiliza como reactivo en química analítica, un componente de soluciones fotográficas, un neutralizador de cloro en el blanqueo de tejidos.
Las ecuaciones de las reacciones más importantes:
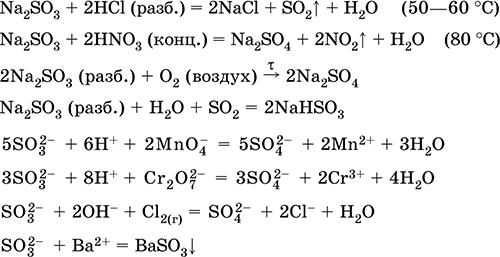
Recibiendo
Na 2 CO 3 (conc.) + SO 2 = Na 2 SO 3 + CO 2
Ácido sulfúrico. Sulfatos
Ácido sulfúrico H2SO4. Ácido oxoico. Líquido incoloro, muy viscoso (aceitoso), muy higroscópico. La molécula tiene una estructura tetraédrica distorsionada (sp 3 гиб hibridación), contiene enlaces σ covalentes S - OH y enlaces σπ S = O. El ion SO 4 2‑ tiene una estructura tetraédrica correcta. Tiene un amplio rango de temperatura del estado líquido (~ 300 grados). Cuando se calienta por encima de 296 ° C, se descompone parcialmente. Se destila como una mezcla azeotrópica con agua (la fracción de masa del ácido es 98.3%, el punto de ebullición es 296–340 ° C), se descompone completamente con un calentamiento más fuerte. Mezclas ilimitadas con agua (con fuertes exo-Efecto). Ácido fuerte en solución, neutralizado por álcali e hidrato de amoniaco. Convierte los metales en sulfatos (con un exceso de ácido concentrado en condiciones normales, se forman hidrosulfatos solubles), pero los metales Be, Bi, Co, Fe, Mg y Nb se pasivan en el ácido concentrado y no reaccionan con él. Reacciona con óxidos e hidróxidos básicos, descompone sales de ácidos débiles. Oxidante débil en una solución diluida (debido a H I), fuerte - en una solución concentrada (debido a S VI). El pozo disuelve el SO 3 y reacciona con él (se forma un líquido aceitoso pesado - oleum contiene H 2 S 2 O 7).
Reacción cualitativa en SO 4 2 ion - precipitación de sulfato de bario blanco BaSO 4 (el precipitado no se convierte en una solución de ácidos clorhídrico y nítrico, en contraste con el precipitado blanco BaSO 3).
Se utiliza en la producción de sulfatos y otros compuestos de azufre, fertilizantes minerales, explosivos, colorantes y medicamentos, en síntesis orgánica, para la "apertura" (la primera etapa del procesamiento) de minerales y minerales de importancia industrial, en la refinación de productos derivados del petróleo, electrólisis del agua, como electrolito de baterías de plomo. . Venenosa, provoca quemaduras en la piel. Las ecuaciones de las reacciones más importantes:
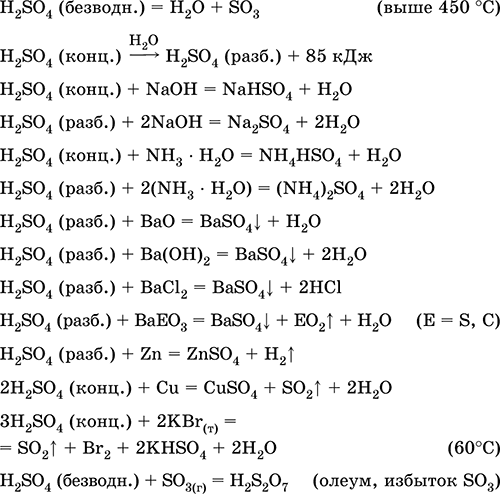
Obteniendo en el industria:
a) síntesis de SO 2 a partir de azufre, minerales de sulfuro, sulfuro de hidrógeno y minerales de sulfato:
S + O 2 (aire) = SO 2(280–360 ° C)
4FeS 2 + 11O 2 (aire) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, tostado)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (coque) = CaO + SO 2 + CO (1300–1500 ° C)
b) la conversión de SO 2 a SO 3 en el aparato de contacto:
c) síntesis de ácido sulfúrico concentrado y anhidro:
H 2 O (Coll. H 2 SO 4) + SO 3 = H 2 SO 4(conc., anhid.)
(la absorción de SO 3 por agua pura con la producción de H 2 SO 4 no se lleva a cabo debido al fuerte calentamiento de la mezcla y la descomposición inversa de H 2 SO 4, ver más arriba);
d) síntesis oleum - una mezcla de H 2 SO 4 anhidro, H 2 S 2 O 7 de ácido disárico y exceso de SO 3. El SO 3 disuelto garantiza la ausencia de agua en el oleum (el H 2 SO 4 se forma inmediatamente cuando entra el agua), lo que permite su transporte seguro en tanques de acero.
Sulfato de sodio Na 2 SO 4. Salino Blanco, higroscópico. Se derrite y hierve sin descomposición. Forma hidrato cristalino (mineral). mirabilita perdiendo agua fácilmente nombre técnico La sal de Glauber. Es soluble en agua, no hidrolizada. Reacciona con H 2 SO 4 (conc.), SO 3. Restaurado por hidrógeno, coque cuando se calienta. Entra en reacciones de intercambio iónico.
Se utiliza en la fabricación de pinturas para vidrio, celulosa y minerales, como medicamento. Contenido en salmuera de lagos salados, en particular en el golfo de Kara-Bogaz-Gol del mar Caspio.
Las ecuaciones de las reacciones más importantes:
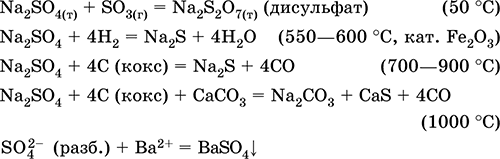
Hidrosulfato de potasio KHSO 4. Sal de oxol agria. Blanco, higroscópico, pero no forma hidratos cristalinos. Cuando se calienta se derrite y se descompone. Es bien soluble en agua, el anión se disocia en solución, el medio de solución es fuertemente ácido. Está neutralizado por los álcalis.
Se utiliza como componente de los flujos en la metalurgia, una parte integral de los fertilizantes minerales.
Las ecuaciones de las reacciones más importantes:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (hasta 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (dil.) + KOH (conc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450–700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350–500 ° C, M = Al, Cr)
Obteniendo: tratamiento del sulfato de potasio en el ácido sulfúrico frío (con más del 60%)
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
Sulfato de calcio CaSO 4. Salino Blanco, muy higroscópico, refractario, se descompone cuando se calcina. El CaSO 4 natural se encuentra en forma de un mineral muy común. yeso CaSO 4 2H 2 O. A 130 ° C, el yeso pierde algo de agua y entra a yeso quemado2CaSO 4 H 2 O (nombre técnico alabastro). El yeso completamente deshidratado (200 ° C) responde al mineral anhidritaCaSO 4. Es ligeramente soluble en agua (0.206 g / 100 g H2O a 20 ° C), la solubilidad disminuye cuando se calienta. Reacciona con H 2 SO 4 (conc.). Recuperado por coque durante la fusión. Define la mayor parte de la dureza "constante" del agua dulce (para más detalles, ver 9.2).
Las ecuaciones de las reacciones más importantes: 100-128 ° C.
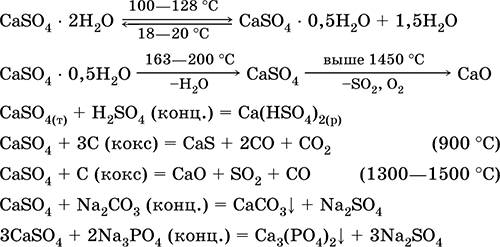
Se utiliza como materia prima en la producción de SO 2, H 2 SO 4 y (NH 4) 2 SO 4, como flujo en metalurgia, relleno de papel. El mortero de unión preparado a partir de yeso quemado se "acumula" más rápido que la mezcla basada en Ca (OH) 2. El endurecimiento es proporcionado por la unión de agua, la formación de yeso en forma de masa de piedra. El yeso quemado se utiliza para hacer moldes de yeso, formas y productos arquitectónicos y decorativos, tabiques y paneles y pisos de piedra.
Sulfato de aluminio y potasio KAl (SO 4) 2. Sal doble oxol. Blanco, higroscópico. Con fuerte calor se descompone. Forma hidrato cristalino - alúmina potásica alumbre. Moderadamente soluble en agua, hidrolizado por catión aluminio. Reacciona con álcalis, hidrato de amoniaco.
Se utiliza como mordiente en teñido de telas, curtido de cuero, coagulante en purificación de agua dulce, un componente de las composiciones de tamaño de papel y un agente hemostático externo en medicina y cosmetología. Está formado por la co-cristalización de sulfatos de aluminio y potasio.
Las ecuaciones de las reacciones más importantes:
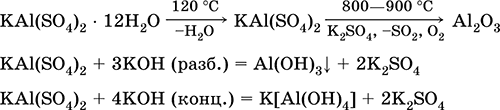
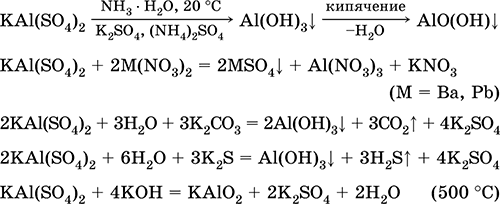
Sulfato de cromo (III) - potasio KCr (SO 4) 2. Sal doble oxol. Rojo (hidrato púrpura oscuro, nombre técnico alumbre de potasio). Cuando se calienta se descompone sin fundirse. Es fácilmente soluble en agua (el color azul grisáceo de la solución corresponde al aquacomplex 3+), se hidroliza por el catión cromo (III). Reacciona con álcalis, hidrato de amoniaco. Agente oxidante y reductor débil. Entra en reacciones de intercambio iónico.
Reacciones cualitativas a iones Cr 3+: reducción a Cr 2+ u oxidación a CrO 4 2‑ amarillo.
Se utiliza como agente bronceador para el cuero, un mordiente en teñidos, un reactivo en una fotografía. Está formado por la co-cristalización de cromo (III) y sulfatos de potasio. Las ecuaciones de las reacciones más importantes:
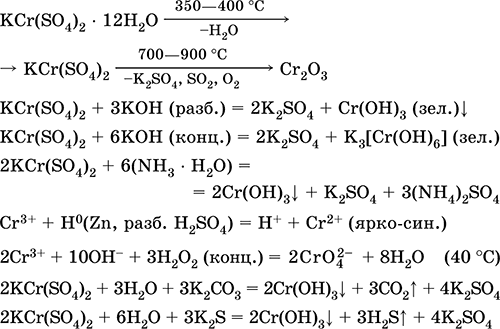
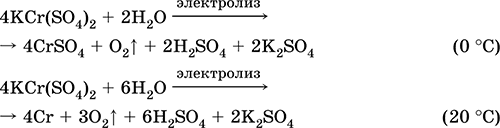
Manganeso (II) sulfato de MnSO 4. Salino El blanco, cuando se calcina, se funde y se descompone. Hidrato cristalino MnSO 4 5H 2 O - rojo - rosa, nombre técnico vitriolo de manganeso. Es soluble en agua, el color rosa claro (casi incoloro) de la solución corresponde al aquacomplex 2+; Hidrolizado por catión. Reacciona con álcalis, hidrato de amoniaco. El agente reductor débil reacciona con los agentes oxidantes típicos (fuertes).
Reacciones cualitativas al ion Mn 2+: una conducción con el ion MnO 4 y la desaparición del color violeta de este último, la oxidación de Mn 2+ a MnO 4 y la aparición de un color violeta.
Se utiliza para obtener Mn, MnO 2 y otros compuestos de manganeso, como micronutriente y reactivo analítico.
Las ecuaciones de las reacciones más importantes:
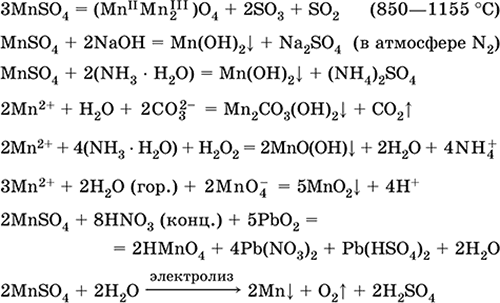
Recibiendo
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Hierro (II) sulfato de FeSO 4. Salino Blanco (hidrato verde claro, nombre técnico vitriolo de hierro),higroscópico. Se descompone cuando se calienta. Es soluble en agua, en pequeña medida hidrolizado por catión. Se oxida rápidamente en solución por el oxígeno en el aire (la solución se vuelve amarilla y se vuelve turbia). Reacciona con agentes oxidantes de ácidos, álcalis, hidrato de amoniaco. Agente reductor típico.
Se utiliza como componente de pinturas minerales, electrolitos en la galvanoplastia, conservantes de la madera, fungicidas, medicamentos contra la anemia. En el laboratorio, más a menudo se toma como sal doble Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( sal mora) Más resistente al aire.
Las ecuaciones de las reacciones más importantes:
![]()
Recibiendo
Fe + H 2 SO 4 (dec.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. Grupo VA no de metales
Nitrógeno Amoniaco
Nitrógeno - un elemento del segundo período y el VA - grupo del sistema periódico, número de serie 7. Fórmula electrónica atómica [2 He] 2s 2 2p 3, estados de oxidación característicos 0, –III, + III y + V, con menos frecuencia + II, + IV y otros El estado Nv se considera relativamente estable.
Escala de oxidación de nitrógeno:
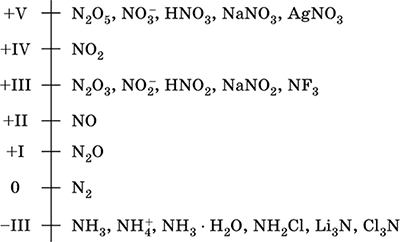
El nitrógeno tiene una electronegatividad alta (3.07), la tercera después de F y O. Muestra propiedades típicas no metálicas (ácidas). Forma varios ácidos que contienen oxígeno, sales y compuestos binarios, así como el catión de amonio NH 4 + y sus sales.
En la naturaleza decimoséptimo Elemento de prevalencia química (noveno entre los no metales). Un elemento vital para todos los organismos.
Nitrógeno N 2. Sustancia simple. Consiste en moléculas no polares con un enlace σππ muy estable N ≡ N, lo que explica la inercia química del nitrógeno en condiciones normales. Un gas incoloro e inodoro que se condensa en un líquido incoloro (a diferencia del O 2).
El componente principal del aire: 78.09% en volumen, 75.52% en peso. Del aire líquido, el nitrógeno hierve sobre el oxígeno O 2. Es ligeramente soluble en agua (15,4 ml / 1 l de H2O a 20 ° C), la solubilidad del nitrógeno es menor que la del oxígeno.
A temperatura ambiente, el N 2 reacciona solo con litio (en una atmósfera húmeda), formando nitruro de litio Li 3 N, los nitruros de otros elementos se sintetizan con un fuerte calentamiento:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
En una descarga eléctrica, el N 2 reacciona con el flúor y en muy poca cantidad con el oxígeno:
Una reacción reversible para producir amoníaco tiene lugar a 500 ° C, bajo una presión de hasta 350 atm y necesariamente en presencia de un catalizador (Fe / F 2 O 3 / FeO, en el laboratorio de Pt):
De acuerdo con el principio de Le Chatelier, un aumento en el rendimiento de amoníaco debe ocurrir con un aumento de la presión y una disminución de la temperatura. Sin embargo, la velocidad de reacción a bajas temperaturas es muy baja, por lo que el proceso se realiza a 450–500 ° C, alcanzando un rendimiento del 15% de amoníaco. Los N 2 y H 2 sin reaccionar regresan al reactor y, por lo tanto, aumentan el grado de reacción.
El nitrógeno es químicamente pasivo con respecto a los ácidos y álcalis, no es compatible con la combustión.
Obteniendo en el industria - destilación fraccionada de aire líquido o la eliminación de oxígeno del aire por medios químicos, por ejemplo, por la reacción 2C (coque) + O 2 = 2CO por calentamiento. En estos casos, se produce nitrógeno, que también contiene impurezas de gases nobles (principalmente argón).
En laboratorios Se pueden obtener pequeñas cantidades de nitrógeno químicamente puro mediante una reacción de combinación con calentamiento moderado:
N ‑III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60–70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
Se utiliza para la síntesis de amoníaco, ácido nítrico y otros productos que contienen nitrógeno, como un entorno inerte para procesos químicos y metalúrgicos y para el almacenamiento de sustancias inflamables.
Amoníaco NH 3. Compuesto binario, el grado de oxidación del nitrógeno es - III. Gas incoloro con un olor característico agudo. La molécula tiene la estructura de un tetraedro incompleto [: N (H) 3)] (hibridación sp 3 гиб). La presencia de nitrógeno en la molécula de NH 3 de un par de donantes de electrones en un orbital híbrido sp 3 provoca una reacción de adición característica del catión hidrógeno, con la formación de un catión. amonio NH 4 +. Licuado a presión a temperatura ambiente. En estado líquido se asocia debido a los enlaces de hidrógeno. Térmicamente inestable Es soluble en agua (más de 700 l / 1 l de H 2 O a 20 ° C); la proporción en la solución saturada es = 34% en masa y = 99% en volumen, pH = 11.8.
Altamente reactivo, propenso a reacciones de adición. Surge en el oxígeno, reacciona con los ácidos. Presenta propiedades reductoras (debido a N -III) y oxidantes (debido a HI). Secado sólo con óxido de calcio.
Reacciones cualitativas - la formación de "humo" blanco en contacto con HCl gaseoso, el ennegrecimiento del papel humedecido con una solución de Hg 2 (NO 3) 2.
Producto intermedio en la síntesis de HNO 3 y sales de amonio. Se utiliza en la fabricación de soda, fertilizantes nitrogenados, colorantes, explosivos; El amoníaco líquido es un refrigerante. Venenoso
Las ecuaciones de las reacciones más importantes:
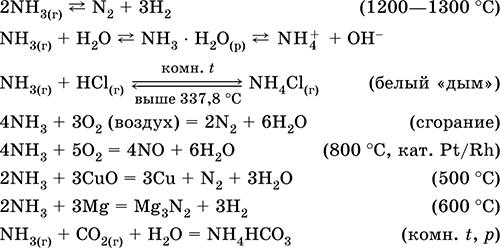
Obteniendo: en laboratorios - Desplazamiento del amoníaco de las sales de amonio cuando se calienta con cal sodada (NaOH + CaO):
o hervir una solución acuosa de amoníaco, seguido de secado del gas.
En industria El amoníaco se sintetiza a partir de nitrógeno (véase) con hidrógeno. Producido por la industria, ya sea en forma licuada o en forma de una solución acuosa concentrada bajo el nombre técnico agua de amoniaco.
Amonio Hidrato NH 3 H 2 O. Compuesto intermolecular. Blanco, en la red cristalina son moléculas de NH3 y H2O, unidas por un débil enlace de hidrógeno H3N ... HON. Presente en una solución acuosa de amoníaco, una base débil (los productos de disociación, el catión NH 4 y el anión OH). El catión de amonio tiene una estructura tetraédrica π regularmente (hibridación sp 3). Térmicamente inestable, completamente descompuesto al hervir la solución. Neutralizado por ácidos fuertes. Muestra propiedades reductoras (debido a N III) en una solución concentrada. Entra en la reacción de intercambio iónico y complejación.
Reacción cualitativa - La formación de "humo" blanco en contacto con HCl gaseoso.
Se utiliza para crear un medio alcalino débil en solución, durante la precipitación de hidróxidos anfóteros.
La solución de amoniaco 1M contiene principalmente hidrato de NH 3 H 2 O y solo el 0,4% de NH 4 + y iones OH (debido a la disociación del hidrato); por lo tanto, el iónico "hidróxido de amonio NH4OH" prácticamente no está contenido en la solución, no hay tal compuesto en el hidrato sólido. Las ecuaciones de las reacciones más importantes:
NH3H2O (conc.) = NH3 + H2O (en ebullición con NaOH)
NH 3 H 2 O + HCl (dec.) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (conc.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (conc.) + ЗBr 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40–50 ° C)
2 (NH 3 H 2 O) (conc.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (conc.) + Ag 2 O = 2OH + 3H 2 O
4 (NH3H2O) (conc.) + Cu (OH) 2 + (OH) 2 + 4H2O
6 (NH3H2O) (conc.) + NiCl2 = Cl2 + 6H2O
La solución de amoniaco diluido (3-10% - -) a menudo se llama amoniaco liquido (el nombre fue inventado por los alquimistas), y la solución concentrada (18.5–25%) agua de amoniaco (producido por la industria).
