Ίσες αντιδράσεις που χαρακτηρίζουν την ισχύ του διαλυμένου θειικού οξέος. Κατάλογος γευμάτων εξετάσεων από κλάδους
Το μαύρισμα της επιφάνειας παλαιών πινάκων, γραμμένων με ελιές, στην αποθήκη της οποίας εισέρχεται λευκός μόλυβδος (PbCO3), συνδέεται με διαλύματα θειούχου μαύρου μολύβδου (II) μέσω της παρουσίας νερού που κυκλοφορεί στην ατμόσφαιρα. Εάν λερώσετε την επιφάνεια με νερό με υπεροξείδιο, τότε παρατηρείται η αντίδραση του διαλύματος θειικού μολύβδου (II) με λευκό χρώμα:
PbS + 4H2O2 = PbSO4 + 4H2O.
Με αυτόν τον τρόπο αποκαθιστούν μαυρισμένους παλιούς πίνακες ζωγραφισμένους με ελιές.
Zastosuvannya ξινό και sirki
Τις περιοχές στασιμότητας της ξινιάς αντιπροσωπεύει η μικρή 61.
επιτρέψτε το vicoristovuvati yogo για μόλυνση πόσιμο νερόεκείνη η πηγή των βιομηχανικών λυμάτων· ως απολυμαντικό zasib στην ιατρική. Το όζον είναι νικηφόρο και γιακ vidbіlyuyuchiy zasib.
Syrka vicorist για την παραγωγή θειικού οξέος, την παρασκευή syrnikiv, τις πυρκαγιές της Βεγγάλης, την καταπολέμηση των shkidniks του ισχυρού κράτους, και για να ενσταλάξει την εξύψωση τέτοιων παθήσεων. Η Serka γνωρίζει zastosuvannya κατά την παραγωγή τσίχλας, barniki και χρωστικών, ινών τεμαχίων, φωτοφόρων και άλλων.
Mal. 61. Φιλί

Για το ξινό στα κόπρανα, που είναι από τα μικρότερα στοιχεία, το στάδιο οξείδωσης -2 είναι πιο χαρακτηριστικό, τα άτομα θείου, σεληνίου και τελουρίου εμφανίζουν το στάδιο οξείδωσης -2, +2, +4 και +6.
Τα οξείδια της δύναμης της ξινής και του θείου εκδηλώνονται στις αντιδράσεις τους με μέταλλα, νερό και άλλα αμέταλλα.
Έρευνα και εργασία
1. Διπλώστε φόρμουλες με οξύτητα με κάλιο, ασβέστιο και αλουμίνιο. Υποδείξτε το στάδιο οξείδωσης του στοιχείου του δέρματος και ονομάστε την ασθένεια.
2. Razrahuyte κλάσμα μάζας sirka σε θειούχο αλουμίνιο.
3. Το όνομα "kysen" -οξυγόνο σημαίνει «που παράγει οξέα». Σημειωσε χημικούς τύπουςνα σας φέρει οξέα, στην αποθήκη των οποίων να αφήσετε το στοιχείο. Ονομάστε οξέα.
4. Ξέρετε τι είδους αλοτροπικές τροποποιήσεις ξινό και ξινό; Γιατί βρωμάνε ένα ένα;
5. Το Kisen, το οποίο εισπνέεται από έναν άνθρωπο, αναδύεται από την αιμοσφαιρίνη του αίματος. Φαίνεται ότι η αιμοσφαιρίνη με βάρος 1 g έρχεται με όγκο (n.a.) 1,35 cm3 3 . Η ποσότητα της αιμοσφαιρίνης στο αίμα των υγιών ατόμων είναι 140 g/dm3. Ο συνολικός όγκος αίματος είναι 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlіkіst ξινό, yоu mаzhe opinetytsya στο αίμα ι άνθρωποι.
6. Προσδιορίστε το κλάσμα μάζας του οξέος sirkovodnoy σε όρους, που αφαιρέθηκε σε περίπτωση χωριστού όγκου sirvodnyu (n.a.) 8,96 dm 3 σε νερό με μάζα 500 γρ.
7. Διευρύνετε τους συντελεστές στα επιθετικά σχήματααντιδράσεις εξέχουσες οξείδιο:
α) H2S + Cl2 + H2O → H2SO4 + HCl; β) H2S + Br2 → S + HBr;
γ) H2 S + O2 → S + H2 O.
Στο δερματική αντίδραση υποδηλώνει οξειδωτικό παράγοντα.
§ 39. Kisnevmisnі spoluki sirka
Στο Το z'ednannyah με ξινό sirka δείχνει το στάδιο της οξείδωσης+4 και +6.
Οξείδιο Sirka(IV). Θειικό οξύ
Το οξείδιο (IV) - SO2 (συρχιστικό αέριο) - είναι ένα αέριο χωρίς βαρέλι με έντονη χαρακτηριστική οσμή, το οποίο βγαίνει όταν ο αέρας είναι ζεστός:
S + O2 = tSO2.

Ένα από τα πιο πρόσφατα ζαστοσουβάνια του σίρκα ήταν δεμένο με τον υποκαπνισμό του σίρκα της ζωής, που θα έπρεπε να καεί. Όπως έγραψε ο αρχαίος ιστορικός Πλίνιος πρεσβύτερος τον 1ο αιώνα π.Χ. ε., «οι μυρωδιές της εστίας της σίρκας μπορούν να προστατεύσουν από κάθε είδους γοητεία και να διώξουν μακριά όλα τα κακά πνεύματα». Τα απολυμαντικά και οι βακτηριοκτόνες ιδιότητες του οξειδίου του θείου (IV) είναι αντικαταστάτες και μεταδοτικές. Το αέριο θείο τροφοδοτείται κατά την επεξεργασία λαχανικών, φρούτων και φρούτων προκειμένου να αποφευχθεί η σήψη τους.
Απελευθέρωση θειικού αερίου κοντά στο νερό (έως 40 όγκοι SO2 ανά 1 όγκο νερού) - μη λεκιασμένη, διπλής βάσης θειικό οξύόπως διατίθεται μόνο στη λιανική:
SO2 + H2 O H2 SO3.
Το θειικό οξύ είναι ένα ασθενές οξύ, σε υδατικά διαλύματα διασπάται σε στάδια συχνά με διαλύματα υδροθειωδών και θειωδών ιόντων:
H+ + HSO – , | – H+ + SO2–. |
||||
Το θειώδες οξύ επιδεικνύει χημική κυριαρχία, θειώδες για τα οξέα: αλληλεπιδρά με βασικά οξείδια, βάσεις, αντιδρά με την ανταλλαγή αλάτων άλλων οξέων, ζώκρεμα, παχύρρευστο ασθενές ανθρακικό οξύ από άλατα:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Οξείδιο Sirka(VI).
Το οξείδιο (VI) διαθέτει, οξειδωτικό οξείδιο (IV) παρουσία καταλύτη σε θερμοκρασία περίπου 500 C:
τ, γάτα.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
Για τα μεγαλύτερα μυαλά, το οξείδιο του θείου (VI) SO3 είναι ένα οξύ χωρίς βαρέλι, το οποίο, σε θερμοκρασίες κάτω των 17 ° C, μετατρέπεται σε λευκή κρυσταλλική ομιλία. Το Ce είναι ένα τυπικό οξείδιο οξέος, το οποίο αλληλεπιδρά με το νερό, δημιουργώντας ισχυρό θειικό οξύ:
SO3 + H2O = H2SO4.
Σιρκανικό οξύ
Ο γραφικός τύπος και το μοντέλο του μορίου του θειικού οξέος υποδεικνύεται στο μικρό 62.
Mal. 62. Γραφικός τύπος και μοντέλο του μορίου του θειικού οξέος
Στο κύκλους αναπαραγωγής θειικό οξύ· ισχυρός ηλεκτρολύτης,
і Η διάσταση її εκφράζεται ως εξής:
H2 SO4 → 2Н+ + SO4 2– .
Φυσική ισχύς θειικού οξέος
Θειικό οξύ - βάζο (αντοχής 1,83 g/cm3), λιπαρό, άοσμο, άοσμο. Θα πάει στο νερό με κάποιου είδους μπουκάλια νερού.
Η διαδικασία διανομής H2SO4 σε χημική ποσότητα 1 mol συνοδεύεται από 92 kJ θερμότητας, η οποία μπορεί να συγκριθεί με τα μεγέθη των θερμικών επιδράσεων σε χημικές αντιδράσεις. Βλέποντας μεγάλη ποσότητα θερμότητας στην αλληλεπίδραση του θειικού οξέος με το νερό είναι απόδειξη της εγκατάστασης ορυκτών βλαστών μεταξύ δύο ποταμών ενυδάτωσης τύπου H2 SO4 n H2 O.
Για παράδειγμα, H2SO4H2O; H2SO4 2H2O; H2 SO4 3H2 O και ούτω καθεξής.
κανένα ї οξέα και υδρίτες δεν επιτρέπουν ιξώδες її ως ισχυρός υδατοαπωθητικός παράγοντας, για παράδειγμα, για ξήρανση αερίων.
Το ράντισμα του sumishi με ποικίλο θειικό οξύ σε νερό μπορεί να συνοδεύεται από ψεκασμό. Θυμηθείτε τι δεν μπορείς να ρίξεις νερό για να ξινίσει
Το Lotі, γλίστρησε με αδιάκοπη ανάμιξη, ρίξτε οξύ στο νερό.
Χημική ισχύςθειικό οξύ. Σουλφάτι
Σουλφάτι. Διαλυμένο θειικό οξύ αποκαλύπτει όλα τα χαρακτηριστικά γνωρίσματα των οξέων κυριαρχίας: αλληλεπίδραση με μέταλλα, τα οποία πρέπει να είναι ενεργά έως και μία ημέρα. με βασικά και αμφοτερικά οξείδια, με βάσεις και άλατα. Ποιανού τα άλατα καθιζάνουν: μέση -θειικό, για παράδειγμα K 2 SO 4 i ξινό -
υδροθειικό, για παράδειγμα KΝSO4.
Η πλειοψηφία των θειικών και υδροθειικών αλάτων διακρίνεται καλά από νερό, πλούσιο σε αυτά κρυστάλλινος. Deyakі κρυσταλλοειδή άλατα θειικού οξέος και ονομάζονται βιτριόλη: midny vitriol CuSO4 ∙5H2 O, ρινικό βιτριόλι FeSO4 ∙7H2 O και σε.
Για την όξινη εκδήλωση του θειικού οξέος και των αλάτων її σε τριαντάφυλλα νερού, χρησιμοποιούνται άλατα βαρίου:
Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
Ως αποτέλεσμα της αντίδρασης, δημιουργείται μια λευκή καθίζηση θειικού βαρίου.
Πιστοποιητικό εργαστηρίου 6
Παρακολούθηση των χημικών δυνάμεων του αραιωμένου θειικού οξέος
Έχετε πέντε δοκιμαστικούς σωλήνες στον ορίζοντα: μέταλλο (ψευδάργυρος ή άλλο μέταλλο κατά την επιλογή του αναγνώστη), βασικό οξείδιο, υδροξείδιο του νατρίου, ανθρακικό νάτριο, χλωριούχο βάριο. Προσθέστε μερικές σταγόνες φαινολοφθαλεΐνης στην ποσότητα υδροξειδίου του νατρίου και αλλάξτε τη δόση. Προσθέστε 1-2 cm3 αραιωμένου θειικού οξέος στον δοκιμαστικό σωλήνα δέρματος. (Προσοχή! Εάν η αντίδραση με το βασικό οξείδιο προχωρήσει σωστά, επιταχύνετε την υπερθέρμανση κατά μισό λουτρό αλκοόλης.)
Τι φυλάς; Ποια είναι τα σημάδια που πρέπει να πούμε για την υπέρβαση των χημικών αντιδράσεων; Να αποθηκεύει ίσες χημικές αντιδράσεις σε μοριακή και ιοντική μορφή. Τι είδους αντίδραση κάνατε; Για τη συλλογή του visnovok σχετικά με τη χημική ισχύ του διαλυμένου θειικού οξέος.
Συμπυκνωμένο θειικό οξύє ισχυρός οξειδωτικός παράγοντας, χαμηλότερα αραιωμένο. Όταν αλληλεπιδρά με πυκνό θειικό οξύ
το νερό δεν φαίνεται με τα μέταλλα.
W μέταλλα, που στέκονται δίπλα στο νερό (χρυσός και πλατίνα), η αντίδραση προχωρά με οξείδιο του θείου (IV) SO 2 :
Cu + 2H2 SO4(συμπ.) = t CuSO4 + SO2 + 2H2O.
Στην αντίδραση με μέταλλα, τα οποία βρίσκονται στο εύρος δραστηριότητας μέχρι το νερό, το πυκνό θειικό οξύ μπορεί να αναχθεί σε οξείδιο του θείου (IV) SO2, θείο S ή νερό H2S εναποτίθεται στη δραστηριότητα του μετάλλου και του νου κατά τη διάρκεια της αντίδραση. Για παράδειγμα:
4Zn + 5H2 SO4(κινήτες) = t 4ZnSO4 + H2S+ 4H2O.
Ας μαντέψουμε, είναι κρύο, αλουμίνιο και άλλοι διάκονοι, για τα μεγαλύτερα μυαλά, περνούν από συμπυκνωμένο θειικό οξύ.
Το θειικό οξύ συγκεντρώνεται σε αλληλεπίδραση με απλά αμέταλλα ομιλίας, για παράδειγμα με θείο:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Οξειδωτικό πλούσια αναδιπλούμενο βιολογικά λάχανα, το θειικό οξύ καίει χαρτί, ύφασμα, ξύλο, ρούχα και shkir. Επομένως, να είστε προσεκτικοί με το πυκνό θειικό οξύ.
Το θειικό οξύ συμπυκνώνεται για να αφαιρέσει άλλα, πτητικά οξέα και τα άλατά τους. Για παράδειγμα:
NaCl (tv) + H2 SO4 (συμπ.) = t NaНSO4 + HCl.
Στη Δημοκρατία της Λευκορωσίας, το συριακό οξύ δονείται από τη BAT "Gomel Chemical Plant", BAT "Grodno Azot".
Περιοχές στασιμότητας του θειικού οξέος
Οι βρωμιές παρουσιάζουν το μικρό 63.
Mal. 63. Στάση θειικού οξέος
Το θειικό οξύ H2SO4 είναι μια άοσμη, λιπαρή, ελαιώδης πατρίδα.
Το θειικό οξύ διαλύεται σε αλληλεπίδραση με μέταλλα, έτσι ώστε να μπορεί να είναι ενεργό έως και μία ημέρα. με οξείδια μετάλλων? με τα βασικα? από άλατα.
Με την αλληλεπίδραση του πυκνού θειικού οξέος με τα μέταλλα, το νερό δεν φαίνεται.
Για την όξινη εκδήλωση του θειικού οξέος και των αλάτων її σε τριαντάφυλλα νερού, χρησιμοποιούνται άλατα βαρίου.
Έρευνα και εργασία
1. Γράψτε τους τύπους για τα οξείδια και τα σισνικά οξέα σας. Να αναφέρετε το βαθμό οξείδωσης των ατόμων του sirka σε αυτά.
2. Vznachete masu s_rki, scho κάηκε στο ξινό, yakshcho στο sire είδε 29,69 kJ θερμότητας. Ποια είναι η χημική ποσότητα του οξειδίου του θείου (VI) που καθιζάνει; Η θερμική επίδραση της αντίδρασης του θερμού αέρα γίνεται 296,9 kJ/mol.
3. Koristuyuchis τραπέζι rozchinnosti άλατα, οξέα και βάσεις στο νερό, αποθηκεύστε 2 ίσες αντιδράσεις αραιωμένο θειικό οξύ με άλατα. Γράψε ένα ταίρι
v μοριακή και ιοντική εμφάνιση.
4. Razrahuyte τη μάζα και τη χημική ποσότητα του θειικού βαρίου, το οποίο διαλύεται όταν αραιώνεται με θειικό οξύ με βάση το νιτρικό βάριο με μάζα 200 g, κλάσμα μάζας Ba (NO 3 )2 έχουν κόστος 10%.
5. Αντιγράψτε από το κείμενο της παραγράφου ίσες αντιδράσεις, που χαρακτηρίζουν τη χημική ισχύ του πυκνού θειικού οξέος. Προσδιορίστε το βαθμό οξείδωσης των ατόμων στο sirka στο її spolukah. Η δερματική αντίδραση δείχνει έναν οξειδωτικό παράγοντα.
6. Οποιοσδήποτε όγκος πυκνού θειικού οξέος (= 1,83 g/cm 3) με κλάσμα μάζας H2SO4 98% της απαιτούμενης κατανομής μέσης μάζας 6,4 r?
7. Δώστε τους συντελεστές για τα σχήματα εξισορρόπησης των αρχικών οξειδωτικών-οξειδωτικών αντιδράσεων:
α) HBr + H2SO4 → Br2 + SO2 + H2O; β) CaSO4 → CaO + SO2 + O2;
γ) K2S + HClO → K2SO4 + HCl.
Η δερματική αντίδραση δείχνει έναν οξειδωτικό παράγοντα.
§ 40. Κατανόηση της παραγωγής ενός προϊόντος χημικής αντίδρασης
Chemіchnі rіvnyannya, skladі z urakhuvannymi mіchіchnі vіlkії mаsi rіchіvіn, επιτρέψτε razrahunki, zоkrema count masu, сhіmіchnu kіlkіst kіlkіst στο προϊόν αντίδρασης. Στην πράξη, πολλές αντιδράσεις αντιστρέφονται, μέρος του λόγου χρησιμοποιείται ως αποτέλεσμα εξάτμισης, διαχωρισμού ή υιοθέτησης υποπροϊόντων. Σε αυτό το προϊόν, η αντίδραση θα πρέπει να είναι μικρότερη, χαμηλότερη, θα ήταν λιγότερο πιθανό να συμβεί έως ότου η αντίδραση είναι ομοιόμορφη. Με αυτόν τον τρόπο, εάν θεωρητικά γίνει αποδεκτό ως ακίνδυνο για την ίση αντίδραση της μάζας ή η χημική ποσότητα του προϊόντος είναι 100%, τότε στην πραγματική διαδικασία η παραγωγή του προϊόντος θα είναι μικρότερη από 100%.
Υποδηλώνεται στο γινόμενο της αντίδρασης με το γράμμα του ελληνικού αλφαβήτου (tsya) και εμφανίζεται σε μέρη του ενιαίου chi vіdsotkah.
Υπερβολική χημική αντίδραση στο προϊόν - η τιμή που προσθέτει στην ποσότητα βάρους (όγκος, χημική ποσότητα) που πράγματι αφαιρέθηκε από το προϊόν στο βάρος (obsyagu, χημική ποσότητα) του προϊόντος, που υπολογίζεται για την ίση αντίδραση:
Σε όλες αυτές τις παραλλαγές, θα βρείτε την ίδια τιμή για την έξοδο του προϊόντος της χημικής αντίδρασης. Για παράδειγμα, ως συνήθως, για την αντίδραση της οξείδωσης του οξειδίου του θείου (IV) σε οξείδιο του θείου (VI)
2SO2 + O2 2SO3
vihіd γίνει 80% (ή 0,8), tse σημαίνει ότι με οξείδιο του θείου (IV) βάρος 64 g (όγκος 22,4 dm3, χημική ποσότητα 1 mol) όγκος 22,4 dm3, χημική ποσότητα 1 mol) και μάζα 80 g ∙ 0,8 = 6 g (όγκος 17,9 dm3, χημική ποσότητα
Από το μέγεθος της παραγωγής των αγαθών στην πραγματική διαδικασία παραγωγής, βιαστείτε στο vysnovok για povnotі perevorennya syrovini, vitratah energії, nebhіdnіst εισαγωγή πρόσθετων λειτουργιών και іn.
Ας ρίξουμε μια ματιά σε μερικά παραδείγματα rozrahunkiv από την έννοια του "εκτός του προϊόντος της αντίδρασης".
πισινό 1. Ως αποτέλεσμα του ζεματίσματος της sirka με μάζα 48 g, αφαιρέθηκε οξείδιο sirka(IV) με όγκο (n.a.) 28,6 dm3. Προσδιορίστε τη λήξη του προϊόντος αντίδρασης.
m(S) = 48 g | 1. Σημαντική χημική ποσότητα sirka, |
||||
V πρακτική (SO2) = 28,6 dm3 | αντέδρασε: | ||||
Κυρία) | |||||
(SO2)=; | n(S) | ||||
ΚΥΡΙΑ) | 32 g/mol |
||||
2. Σχετικά ίση αντίδραση με οξείδιο του θείου (IV): S + O2 = SO2.
3. Γνωρίζουμε τη θεωρητική ποσότητα του οξειδίου του θείου (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Κατανόηση του προϊόντος μιας χημικής αντίδρασης |
4. Γνωρίζουμε τη θεωρητική τιμή του οξειδίου του θείου(IV):
V theor (SO2) \u003d n theor (SO2) V m \u003d 1,5 mol 22,4 mol / dm3 \u003d 33,6 dm3.
5. Razrahuymo εκτός του προϊόντος αντίδρασης:
Vidpovіd: vyhіd στην αντίδραση του φαρμάκου dorіvnyuє 85%.
Παράδειγμα 2. Επιλέξτε τη μάζα του πυρίτη FeS2, η οποία είναι απαραίτητη για ζωντάνια προκειμένου να ληφθεί το οξείδιο (IV) με όγκο (n.a.) 8,96 dm3, έτσι ώστε η έξοδος του προϊόντος της αντίδρασης να γίνει 90%.
V(SO2) = 8,96 dm3 | 1. Σημαντική θεωρητική αξία του οξειδίου του θείου(IV): |
|||||||||||
(SO2) = 90% | V πρακτική | V πρακτική | ||||||||||
m (FeS2) =? | Αστέρια V θεωρία = | |||||||||||
V θεωρ | ||||||||||||
Vtheor (SO2) = | V πρακτική (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Γνωρίζουμε τη θεωρητική χημική ποσότητα του οξειδίου του θείου (IV): |
||||||||||||
n θεωρία (SO 2) | V theor (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Συγκριτικά ίση με την αντίδραση του οξειδίου του θείου(IV) και της χημικής ποσότητας πυρίτη, η οποία είναι απαραίτητη για το vipal:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Σημαντικά μασουπυρίτης, που είναι απαραίτητος για να δώσει vipal: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Ένδειξη: για την κατοχή οξειδίου του θείου (IV), απαιτείται πυρίτης με μάζα 24 g.

Υπερβολική χημική αντίδραση στο προϊόν - η τιμή που αυξάνει την ποσότητα βάρους (obsyagu, χημική ποσότητα) που αφαιρέθηκε πραγματικά από το προϊόν στη μάζα (obsyagu, χημική ποσότητα) του προϊόντος, που υπολογίζεται για την ίση αντίδραση. Εμφανίζεται σε μέρη του ενός και μερικών εκατοντάδων.
Έρευνα και εργασία
1. Γιατί το πρακτικό αποτέλεσμα του προϊόντος της αντίδρασης να ακούγεται λιγότερο, θεωρητικά λιγότερο από το κόστος της ίσης αντίδρασης;
2. Στην αντίδραση του sirka με υδατικό χημικό λογισμό 1 mol, το sirkovodny διαλύθηκε με χημικό λογισμό 0,85 mol. Προσδιορίστε τη λήξη του προϊόντος αντίδρασης.
3. Ως αποτέλεσμα, η αλληλεπίδραση χλωριούχου βαρίου με μάζα 200 g από θειικό οξύ καταβυθίστηκε με θειικό βάριο με μάζα 100 g.
4. Προσδιορίστε τον όγκο (n.a.) αυτής της χημικής ποσότητας οξειδίου του θείου (IV), η οποία, έχοντας διαλυθεί κατά την καύση του θείου, με βάρος 64 g, που σημαίνει ότι το προϊόν της αντίδρασης είναι 75% πιο υγιές.
5. Υπολογίστε τη μάζα του καμένου sirka, καθώς και παραλείψτε το οξείδιο sirka (IV), όγκος (n.a.) 89,6 dm3 3 να γίνει το 80% του θεωρητικά εφικτού.
6. Προφανώς, το scho εξέπεσε στο οξείδιο του θείου (VI), το οποίο αφαιρέθηκε κατά την οξείδωση του οξειδίου του θείου (IV),
ακριβότερο 85%. Προσδιορίστε τη μάζα, τον όγκο (n.a.) και τη χημική ποσότητα του οξειδίου του θείου (IV), η οποία, αφού εισέλθει στην αντίδραση, απομακρύνοντας έτσι το οξείδιο του θείου (VI) κατ' όγκο (n.a.) 2,24 dm3.
7. Επιλέξτε το κλάσμα μάζας του αλατιού στη σύνθεση, το οποίο αφαιρείται στην περίπτωση της κατανομής midi, με μάζα 3,2 g και θειικό οξύ με μάζα 192 g, έτσι ώστε η απόδοση του προϊόντος αντίδρασης να γίνει 85%. .
§ 41. Άζωτο και φώσφορος
Το άζωτο Ν και ο φώσφορος P αναμιγνύονται στην ομάδα VA του περιοδικού συστήματος. Το Mish'yak As, το αντιμόνιο Sb και το βισμούθιο Bi μπορούν να φανούν πριν από την ομάδα του περιοδικού συστήματος. Το άζωτο και ο φώσφορος είναι αμέταλλα, το mish'yak και το αντιμόνιο μεταφέρονται στο napіvmetalіv και το βισμούθιο βρίσκεται στα μέταλλα.
Άτομα Budova σε αυτό το στάδιο οξείδωσης
Τα άτομα των στοιχείων της ομάδας VA έχουν 5 ηλεκτρόνια το καθένα στο εξωτερικό ενεργειακό επίπεδο, η ηλεκτρονική διαμόρφωση του εξωτερικού ενεργειακού τους επιπέδου ns 2 np 3 για παράδειγμα: άζωτο - 2s 2 2p 3 φώσφορο - 3s 2 3p 3.
7Ν↓ | 15p↓ |
Διευθυντής.
- Γιατί η βικλικάνα είναι τέτοια αλλαγή; Σε ποια κυριαρχία του διχρωμικού βασίζεται η διαβίωση του χρωμίου sumishi για σκεύη γαντιών;
- Ρίξτε 5-6 σταγόνες διχρωμικό κάλιο και 3 σταγόνες θειικό οξύ σε ένα δοκιμαστικό σωλήνα. Προσθέστε 2 σταγόνες ιωδιούχου καλίου και αραιώστε τον δοκιμαστικό σωλήνα με 10 σταγόνες νερό. Μεταφέρετε με μια πιπέτα σε άλλο δοκιμαστικό σωλήνα ένα μέρος του και προσθέστε μια σταγόνα άμυλο. Τι έχει αλλάξει για το άμυλο; Γιατί; Αναδίπλωση του OVR και του zvnyati με την ηλεκτρονική-ιονική μέθοδο.
- Σημαντικό χαρακτηριστικό του στοιχείου 15 R. Κυριαρχία αλλοτροπικών τροποποιήσεων στο φώσφορο. Αλληλεπίδραση φωσφόρου με απλές και αναδιπλούμενες ομιλίες.
Στα φαρμακευτικά προϊόντα, το οξείδιο του υδραργύρου (II) είναι zastosovuetsya ως κατώτερο αντισηπτικό zasib για παρασκευή οφθαλμικές αλοιφές, το yak διαθέτει ένα αραιωμένο διάλυμα υδροξειδίου του νατρίου σε ένα εμπορικό άλας υδραργύρου.Όλες οι εργασίες πραγματοποιούνται στο σκοτάδι.
Διευθυντής.
1. Γράψτε την κατάλληλη αντίδραση στο οξείδιο του υδραργύρου (II). Εξηγήστε γιατί είναι απαραίτητο να κάνετε λειτουργίες στο σκοτάδι;
3. Βασικοί νόμοι της χημείας.
Το Vikoristannya με ψευδάργυρο στην ιατρική βασίζεται στην τάρτα γιόγκα, αντισηπτική δράση. 0,25% θειικός ψευδάργυρος είναι ιξώδες για την παρασκευή οφθαλμικών σταγόνων μαζί με 2% βορικό οξύ.
Διευθυντής.
- Παρασκευάστε διάλυμα θειικού ψευδαργύρου 0,25% σε όγκο 100 ml (ρ = 1,02 g/ml).
- Δημιουργήστε μια μεταμόρφωση
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Ομοιοπολικός κρίκος, ραντεβού, βλέπετε, ο μηχανισμός του διαφωτισμού, η εξουσία. Σθένος. Στάδιο οξείδωσης.
· Ο φαρμακοποιός πρέπει να ελέγχει το ιξώδες του σκευάσματος φυσιολογικού ορού με τη μέθοδο της υπερμαγγανατομετρίας.
Διευθυντής.
1. Να γράψετε παρόμοια αντίδραση και σύγκριση με την ηλεκτρονική-ιονική μέθοδο.
2. Υπολογίστε την ποσότητα 0,5% (ρ = 1,004 g/ml) ποσότητας υδροξειδίου του νατρίου που απαιτείται για την αντίδραση με 0,1 Μ ποσότητα χλωρίου (III) ποσότητα 20 ml.
3. Περιοδικός νόμος περιοδικό σύστημαστο φως vchennya για τη ζωή του ατόμου.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє but vilno vіd vіd domіshok sulfіdіv midi, vugіllya, πυριτικό οξύ, mish'yaku.
Διευθυντής.
1. Ζητήστε έναν τρόπο να ασφαλίσετε την είσοδο στο σπίτι. Obguruntuvati vіdpovіd.
3. Ο κύριος τύπος χημικού δεσμού. Η φύση θα κάνει μια χημική σύνδεση.
· Για τον οργανισμό του υπερμαγγανικού є otrastami, їkh zneshkodzhennya ξοδεύουν z vokoristannyam 3% υδατικό διάλυμα H 2 Pro 2 οξινισμένο οφθαλμικό οξύ.
Διευθυντής.
1. Γράψτε μια παρόμοια απάντηση. Διερευνήστε την αντίδραση με τη μέθοδο των ιόντων ηλεκτρονίων
- Oksidi, διορισμός, ταξινόμηση, ονοματολογία, εξουσία και τρόποι κατοχής.
· Η ανάλυση του λόγου στην παρασκευή του σάλιου πραγματοποιείται με τη μέθοδο της υπερμαγγανατομετρίας, με βάση την ικανότητα του Fe2+ να οξειδώνεται σε Fe3+. Το κάτω μέρος του εισπνεόμενου αέρα διαχωρίζεται από το θειικό οξύ κατά τη θέρμανση και μετά την ψύξη, τιτλοδοτείται με 0,1 N υπερμαγγανικού καλίου.
Διευθυντής.
1. Να γράψετε τις ίσες αντιδράσεις, που αποτελούν τη βάση του ορισμού.
2. Ετοιμάστε 200 ml KMnO 4 0,1 N (ο συντελεστής ισοδυναμίας εξαρτάται από την αντίδραση).
3. Οξύτητα, ονομασία, ταξινόμηση, ονοματολογία, αρχή, μέθοδοι κατοχής.
· Το φαρμακοποιητικό νιτρικό φάρμακο αφαιρέθηκε από την επόμενη σειρά: το κράμα χαλκού-αργύρου διαχωρίζεται από το νιτρικό οξύ, προκειμένου να καθαριστεί η απομάκρυνση των νιτρικών από τα σπίτια, κατακρημνίζεται με υδροχλωρικό οξύ. Η πολιορκία, που είναι viishov, αποκαθίσταται με ψευδάργυρο στο ξινό μέσο, και συρρικνώνεται, zvilnene στα σπίτια, ξαναψεκάζεται σε νιτρικό οξύ.
Διευθυντής.
- Γράψτε τις αντιδράσεις rіvnyannya іdpovіdnyh.
- Αντιδράσεις Vikonaty akіsnі σε Cl-, Br-, J anioni με ποικιλία νιτρικών srіbla, που αποτελούν τη βάση της επιβεβαίωσης της ορθότητας των παρασκευασμάτων χλωριδίων, ιωδιδίων, βρωμιούχου καλίου.
- Τεκμηριώστε, διορίστε, ταξινομήστε, ονοματολογία, εξουσία, μεθόδους κατοχής.
9. Νιτρικά srіbla zastosovuєtsya zvnіshno σε erozіyah, vyrazkah, γόστρωμα επιπεφυκίτιδα σε viglyadі 2,5 και 10% παροχή νερού.
Διευθυντής.
- Παρασκευάστε διάλυμα AgNO 3 2% με όγκο 50 ml (ρ= 1,015 g/ml). Τι είδους μυαλά χρειάζονται για να φροντίσουν αυτό το rozchin;
- Δημιουργήστε μια μεταμόρφωση
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Αλάτι, ονομασία, ταξινόμηση, ονοματολογία, εξουσία, μέθοδοι κατοχής.
· Ο φαρμακοποιός θα πρέπει να πραγματοποιήσει την ταυτοποίηση του φαρμακοποιητικού φαρμάκου θειικό βάριο.
Διευθυντής.
1. Ποια είναι η μέθοδος του θειικού βαρίου στην ιατρική; Γιατί το θειικό βάριο είναι κράμα με ανθρακικό νάτριο πριν από τις αντιδράσεις ταυτοποίησης; Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις.
2. Αντιδράσεις Viconati και ταυτοποίηση αλάτων BaSO4, CaSO4, Na2SO4.
3. Complex spoluky, προσδιορισμός, budov για τον A. Werner, η φύση του χημικού δεσμού, ταξινόμηση, ονοματολογία, διάσταση. Zastosuvannya σύνθετο spoluk στην ιατρική και τη χημική ανάλυση.
· Ένας φαρμακοποιός, όταν εργαζόταν με συγκέντρωση αμμωνίας, έχοντας επιτρέψει μεγάλη ζημιά στον εξοπλισμό ασφαλείας - έχοντας πραγματοποιήσει την εργασία στη λεκιασμένη ντουλάπα χωρίς αυξημένη πρόσφυση.
Διευθυντής.
- Ποιες είναι οι συνέπειες που μπορούν να χρησιμοποιηθούν όταν εργάζεστε με συγκέντρωση αμμωνίας χωρίς πρόσθετο εξοπλισμό ασφαλείας; Η ιατρική βοήθεια Yaku pershu είναι απαραίτητη σε περίπτωση δηλητηριασμένων ατμών αμμωνίας.
- Δημιουργήστε μια τέτοια μεταμόρφωση.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Γράψτε την εξίσωση των αντιδράσεων για τη μοριακή και ιοντική εμφάνιση και για την OVR - δείτε με τη μέθοδο της ισορροπίας ηλεκτρονίων.
- Χημική κινητική. Η ταχύτητα της χημικής αντίδρασης. Η επίδραση διαφόρων παραγόντων στην ταχύτητα των χημικών αντιδράσεων.
· Zі spoluk άζωτο στην ιατρική zastosovuyutsya αμμωνία σε νερό, αλάτι, αμμώνιο, οξείδιο δινιτρογόνου και νιτρώδους νατρίου.
Διευθυντής.
- Ποια είναι η μέθοδος της νικηφόρας χορήγησης στο άζωτο; Να γράψετε τους τύπους αυτών των ομιλιών και τις ίσες αντιδράσεις που χαρακτηρίζουν τις κύριες δυνάμεις.
- Γράψτε την ίση αντίδραση νιτρικού νατρίου με υπερμαγγανικό κάλιο στο όξινο μέσο. Διερευνήστε την αντίδραση με τη μέθοδο nap_reactions
- Μη αναστρέψιμοι και λυκάνθρωποι χημικές αντιδράσεις. Χημικός ζηλωτής. Μαζικός νόμος για ίσα συστήματα. Σταθερά καθαρής θέσης. Η αρχή του Le Chatelier.
· Ο φαρμακοποιός πρέπει να πραγματοποιεί την ταυτοποίηση αλάτων θειικού νατρίου, χλωριούχου νατρίου, διττανθρακικού νατρίου.
Διευθυντής.
- Αντιδράσεις Vikonaty akіsnі σε ιόντα SO 4 2-, Cl-, HCO 3-.
- Razrahuvati, skіlki gram_v κρυσταλλοένυδρο Na 2 SO 4 10H 2 O είναι απαραίτητο ο φαρμακοποιός να παρασκευάσει σε νερό με μάζα 500 g, για να πάρει 5% Na 2 SO 4 ;
- Αντιδράσεις οξειδίου-νερού. Οι κύριες διατάξεις της ηλεκτρονικής θεωρίας των αντιδράσεων που προάγουν την οξείδωση. Τα σημαντικότερα οξειδωτικά και οδηγοί. Αντιδράσεις Zrivnyannya οξειδίου-νερού με τη μέθοδο της ηλεκτρονικής ισορροπίας και την ιοντο-ηλεκτρονική μέθοδο.
Η περιεκτικότητα σε κάλιο του θειικού οξέος φαίνεται να είναι πλούσια σε φάρμακα ξένα για τον οργανισμό (ξενοβιοτικά) - φαρμακευτικά σκευάσματαεκείνους τους μεταβολίτες με τα διαλύματα κάποιων μικρών ομιλιών - συζυγών, που αποβάλλονται εύκολα από τον οργανισμό.
Διευθυντής.
- Αφαιρέστε την ισχύ του καλίου του θειικού οξέος με διαφορετικό τρόπο, αντικαταστάτης στον αντιδραστικό πίνακα. Γράψτε τις αντιδράσεις rіvnyannya іdpovіdnyh.
- Προσθέστε τις μοριακές ισότητες των αντιδράσεων που εκφράζονται με τέτοιες γρήγορες ιοντικές ισότητες:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Συστήματα διασποράς, ονομασία, ταξινόμηση. Εναιωρήματα, αερολύματα, γαλακτώματα. Επιλογή χονδροειδών διασκορπισμένων συστημάτων στην ιατρική και τη φαρμακευτική.
Ο φαρμακοποιός πρέπει να πάρει 5% θειικό οξύ.
Διευθυντής.
- Ποια είναι η εναπόθεση της οξειδωτικής ιδιότητας του ανιόντος SO 4 2 στη συγκέντρωση του οξέος; Να γράψετε την εξίσωση των αντιδράσεων που χαρακτηρίζουν την ισχύ του διαλυμένου και του πυκνού οξέος.
- Παρασκευάστε διάλυμα θειικού οξέος 5% πλένοντας 50 ml θειικού οξέος με κλάσμα μάζας H 2 SO 4 30%.
- Koloidni razchini, ταξινόμηση, ονομασία, μοριακή κινητικήαυτή η οπτική δύναμη, otrimannya. Η σταθερότητα των στηλών. Πήξη. Πεπτοποίηση. Budova mycel. Διάλυση.
· Το Sirka, που εισέρχεται στην αποθήκη αμινοξέων, οξειδώνεται στους οργανισμούς. Στην περίπτωση του ενδογενούς θειικού οξέος, λαμβάνει μέρος στα εξωγενή σπόρια - φαινόλη, κρεσόλη και ινδόλη.
Διευθυντής.
- Περιγράψτε τη δύναμη του θειικού οξέος και παρακάμψτε τους κανόνες εργασίας με τα οξέα.
- Για να διαλυθεί, ποιος όγκος θειικού οξέος με κλάσμα μάζας H 2 SO 4 25% και πάχος 1,18 g / ml πρέπει να ληφθεί για εξουδετέρωση με υδροξείδιο του καλίου, όγκου 50 ml, με κλάσμα μάζας ΚΟΗ 12% και πάχος 1,1 g/ml
- Η αληθινή διαφορά, ο προσδιορισμός, η βασική κατανόηση, η ουσία της διαδικασίας της διαφοροποίησης. Διάχυση. Ωσμωση. Οσμωτική μέγγενη.
· Σε βιομηχανικές περιοχές, όπου υπάρχει μεγάλη βούγκλια, συχνά πέφτουν όξινα ξύλα.
Διευθυντής.
- Με τι είσαι χημική αποθήκηοξύ dosch κοντά σε περιοχές tsikh; Πώς φτιάχνεις κρασί; Γράψτε ίσες αντιδράσεις.
- Διπλώστε τα μοριακά και βραχυπρόθεσμα ιόντα ίσα με την υδρόλυση των αλάτων προώθησης:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Ο περίπλους είναι εγκατεστημένος στη φύση μεγάλα νούμεραγια βιοχημικές διεργασίες rahunok και εκδίκηση σε μεταλλικά νερά pro sirchanih.
Διευθυντής.
- Η δύναμη της ημέρας.
- Δημιουργήστε έναν μετασχηματισμό:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Να γράψετε την εξίσωση των αντιδράσεων για τη μοριακή και ιοντική εμφάνιση.
- Διάσταση οξέων, βάσεων, αλάτων, νερού. Οξεοβασική ίση σε rozchinah. Νερό Ionny dobutok, που προσδιορίζει το pH.
· Επίσημο φαρμακευτικό παρασκεύασμα sirka є sirka, με επένδυση (Sulfur praecipitafum).
Διευθυντής.
- Περιγράψτε τη δύναμη του ελεύθερου sirka και τις αλοτροπικές τροποποιήσεις του sirka.
- Δημιουργήστε έναν μετασχηματισμό:
Αντιδράσεις Zrivnyati με τη μέθοδο της ηλεκτρονικής ισορροπίας.
- Υδρόλυση. Η ουσία της διαδικασίας υδρόλυσης. Υδρόλυση διαφορετικών τύπων αλάτων. Βήμα υδρόλυσης. Εισροή διαφόρων παραγόντων στο στάδιο της υδρόλυσης.
· Ο φαρμακοποιός διεξάγει την αντίδραση ταυτοποίησης διαλύματος υπεροξειδίου του νερού 3%: μέχρι 1 ml του τελικού διαλύματος, προσθέστε 1 ml αραιωμένου θειικού οξέος, 1 ml αιθέρα και 0,5 ml διχρωμικού καλίου, ως αποτέλεσμα, η μπάλα Ο αιθέρας μετατρέπεται σε μπλε χρώμα παρουσία του οξέος 6
Διευθυντής.
- Vikonaty αντίδραση іdentifіkatsії υπεροξείδιο vodny.
- Γράψτε ίσο προσδιορισμό υπεροξειδίου του νερού και ισορροπίας με τη μέθοδο της ηλεκτρονικής ισορροπίας.
- Το χαρακτηριστικό χαρακτηριστικό των στοιχείων της επικεφαλής υποομάδας της ομάδας VII και του μισού τους. Ιατρικός βιολογικής σημασίαςαλογόνα.
· Το Kisen είναι ένα φαρμακευτικό σκεύασμα και περιγραφές στο GF. Yogo zastosovuyut για εισπνοή για διάφορους τύπους όξινης πείνας.
20. Διευθυντής.
- Να γράψετε τις ίσες αντιδράσεις των οίκων που αποκαλύφθηκαν CO, 2, NO, NO2.
- Γράψτε τις ίσες αντιδράσεις, που αποτελούν τη βάση της εργαστηριακής μεθόδου αφαίρεσης οξέος. Επαγωγή αντίδρασης με τη μέθοδο του ισοζυγίου ηλεκτρονίων
- Χλώριο, χλωριούχο νερό, υδροχλωρικό οξύ, χλωριούχο. Φυσική και χημική δύναμη του χλωρίου και του yogo spoluk. Ιατροβιολογική σημασία των αλογόνων.
· Ένας φαρμακοποιός εξετάζει την εγκυρότητα των φαρμάκων που βασίζονται σε χλωριούχο νάτριο, βρωμιούχο νάτριο και ιωδιούχο νάτριο.
Διευθυντής.
- Για τέτοιους σκοπούς, τα άλατα ιξώδους χρησιμοποιούνται στη φαρμακευτική και την ιατρική.
- Αντιδράσεις Vikonaty akіsnі σε anioni Cl-, Br-, J-.
- Φυσική και χημική δύναμη του όξινου χλωρίου. Otrimannya. Zastosuvannya.
· Μία από τις βιομηχανικές μεθόδους εξαγωγής ιωδίου για φαρμακευτικούς σκοπούς είναι η διαδικασία λήψης ιωδίου από νερά γεώτρησης. Το ιωδίδιο, το οποίο βρίσκεται κοντά σε νερά γεώτρησης, οξειδώνεται σύμφωνα με το σχήμα:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Διευθυντής.
- Πώς να παρασκευάζετε το ιώδιο και πώς να το χρησιμοποιείτε στην ιατρική.
- Διερευνήστε την αντίδραση που κρύβεται πίσω από την εμμονή με το ιώδιο με τη μέθοδο της αντίδρασης.
- Ένα κρίσιμο χαρακτηριστικό των χαλκογόνων. Δυναμικότητα ξινό και γιόγκο μισό. Ιατροβιολογική σημασία της ξινίλας.
· Ο φαρμακοποιός καθορίζει την ορθότητα των σκευασμάτων χλωριούχων νατρίου, καλίου και ασβεστίου.
Διευθυντής.
- Για τέτοιους σκοπούς, οι βίκορες χρησιμοποιούνται σε φαρμακευτικά παρασκευάσματα.
- Αντιδράσεις Βικονάτη _ταυτοποίηση αυτών των αλάτων.
- Μισό ξινό με νερό. Φυσικές και χημικές δυνάμεις του νερού. Υπεροξείδιο του νερού, κυριαρχία, συμφόρηση στην ιατρική. Η σημασία του νερού στη ζωή των οργανισμών.
· Zі spoluk halogenіv z ξινό λιγότερο υποχλωριώδες για να γίνει ενδιαφέρον για την ιατρική ως απολυμαντικό.
Διευθυντής.
- Με ποια δύναμη υποχλωριώδους βασίζεται η ημέρα απολύμανσης; Γράψτε τις αντιδράσεις rіvnyannya іdpovіdnyh.
- Razrahuvati, skіlki gramіv λουτρό χλωρίου πρέπει να ληφθούν για otrimannya 2 λίτρα ενεργού χλωρίου.
- Sirka και її από το πάτωμα. Αλοτροπία της ελεύθερης σίρκας. Φυσική και χημική δύναμη των αλάτων sirka, sirkovodnya, sirkovodnya και її.
· Σε περίπτωση ανεπαρκούς οξύτητας του χυμού του κελύφους, συνταγογραφείται εσωτερικά αραιωμένο χλωροϋδρικό οξύ.
Διευθυντής.
- Αναφέρετε τους γενικούς κανόνες για την εργασία με οξέα.
- Razrahuvat, skіlki ml 36,5% - μια ποικιλία (ρ = 1,19 g / ml) υδροχλωρικού οξέος και είναι απαραίτητο να ληφθεί για την παρασκευή 100 ml. 8,2% - ω (ρ=1,040 g/ml) οξύ.
- Φυσική και χημική ισχύς οξειδίων του θείου, θειικού οξέος, θειικού οξέος. Θειώδες άλας. Σουλφάτι. Δύναμη, εμμονή, zastosuvannya.
· Στη φαρμακευτική, ένα από τα τυπικά μεγέθη είναι το 33% οξικό κάλιο, το οποίο είναι ένας τρόπος διανομής ανθρακικού καλίου σε 30% - οξικό οξύ.
Διευθυντής.
1. Γράψτε την εξίσωση της αντίδρασης για τη μοριακή και ιοντική εμφάνιση.
- Σημαντικό χαρακτηριστικό των στοιχείων της υποομάδας κεφαλής της ομάδας V. Η κυριαρχία του ελεύθερου αζώτου. Η αξία του αζώτου στη ζωή των οργανισμών.
· Συνταγές ομιλιών, που είναι ισχυρές βάσεις και ασθενή οξέα. Για την εφαρμογή του GFH ως σταθεροποιητή, προστίθενται 0,1 n διαλύματος υδροξειδίου του νατρίου σε 4 ml ανά 1 λίτρο προϊόντος.
Διευθυντής.
- Να γράψετε την εξίσωση για την αντίδραση υδρόλυσης του άλατος CH3COONa.
- Razrahuvat, skilki γραμμάρια NaOH είναι απαραίτητο να καλέσετε για να πάρετε 500ml 0,1n μέγεθος. Προετοιμάστε όλα τα σχέδια για την πιο πρόσφατη τεχνολογία ασφάλειας.
- αμμωνία. Αλάτι αμμώνιο. εξουσία. Zastosuvannya στην ιατρική και τη φαρμακευτική.
· Ένας φαρμακοποιός ετοιμάζει μια αλοιφή για συνταγή: 1 g ανθρακικού καλίου και 0,5 g τετραβορικού νατρίου αναμιγνύονται σε 70 ml απεσταγμένου νερού, 10 g στεαρίνης αναμιγνύονται με 15 g ελαίου βαζελίνης και προστίθενται με ένα λεπτό ρεύμα όταν αναμειγνύονται με χλιαρό νερό να ανθρακωθούν. .
Διευθυντής.
- Τι είδους ομιλίες διευθετούνται μετά από ποιες zmishuvannya; Όπως η μέση έχει τακτοποιηθεί και γιατί; Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις.
- Προετοιμασία τεχνοχημικού vag για ρομπότ. Πάρτε 1 g ανθρακικού καλίου σε τεχνοχημικές εγκαταστάσεις.
- Οξείδιο του αζώτου. Νιτρώδες οξύ και άλατα її. Φυσική και χημική δύναμη. Ιατροβιολογική σημασία του αζώτου
· Είναι απαραίτητο ο φαρμακοποιός να παρασκευάσει 0,05% υπερμαγγανικό κάλιο σε όγκο 200 ml για ξέπλυμα άδειου στόματος και λαιμού.
Διευθυντής.
- Με ποια αρχή βασίζεται το υπερμαγγανικό κάλιο στο yogo likuvalna diya; Yakі spoluky μαγγάνιο zastosovuetsya in χαρούμενους σκοπούς?
- Είναι απαραίτητο να προσθέσετε γραμμάρια κλιμάκωσης KMnO 4 για να παραγγείλετε 200 ml 0,05% KMnO 4 (ρ= 0,9994 g/ml). Δείξτε την τεχνική προετοιμασίας αυτού του σχεδίου.
- Budov μόρια νιτρικού οξέος. Φυσική και χημική δύναμη του νιτρικού οξέος και των αλάτων її. Ιατρική-βιολογική σημασία του αζώτου και του її spoluk.
· Στα φαρμακευτικά προϊόντα, το οξείδιο του υδραργύρου (II), το οποίο είναι ιξώδες ως αντισηπτικό zasib, αποσυνδέεται από το υδροξείδιο του νατρίου σε ένα άλας υδραργύρου (II) του εμπορίου.
Διευθυντής.
1. Γράψτε την κατάλληλη αντίδραση στο οξείδιο του υδραργύρου (II). Γιατί πρέπει να γίνονται αντιδράσεις στους νάνους;
3. Βασικοί νόμοι της χημείας.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Το υπερχρωμικό οξύ, το οποίο διαλύεται με το cioma, το H 2 CrO 6 είναι το μπλε χρώμα. Η μόλυνση με μπλε οξύ επιβεβαιώνει την αποτελεσματικότητα του παρασκευάσματος H2O2.
Διευθυντής.
- Αντίδραση Zrivnyati tsyu με ηλεκτρονική-ιονική μέθοδο.
- Yakі spoluky χρώμιο δείχνουν οξειδωτική δύναμη, και yakі - vodnovlyuvalnі;
- Η κυριαρχία της φωσφίνης, των οξειδίων του φωσφόρου και των φωσφορικών οξέων, η κατοχή τους. Ιατροβιολογική σημασία του φωσφόρου
· Sumish οξείδιο του μαγνησίου (85%) και υπεροξείδιο του μαγνησίου (15%) - ένα φάρμακο γνωστό ως «υπεροξείδιο του μαγνησίου», το οποίο zastosovuyut σε βλεννογονο-εντερικές διαταραχές.
Διευθυντής.
- Εξηγήστε το αντιόξινο και το βακτηριοκτόνο φάρμακο. Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις.
- Razrahuvat, skilki γραμμάρια MgO και MgO 2 που πρέπει να πάρετε για να προετοιμάσετε 100 g αυτού του φαρμάκου. Ζητήστε τεχνοχημικές 10 g οξειδίου του μαγνησίου.
- Το χαρακτηριστικό χαρακτηριστικό των στοιχείων της ομάδας IV της κύριας υποομάδας. Μπούντοβα, Φυσική δύναμηαλότροπα στον άνθρακα. Χημική ισχύς του ελεύθερου άνθρακα.
· Αποσυνθέστε το διττανθρακικό νάτριο (πόσιμο σόδα) για να zastosovat στη θέα του ξεπλύματος, ξεπλύματος με φλεγόμενες παθήσεις των ματιών, των βλεννογόνων της ανώτερης αναπνευστικής οδού.
Διευθυντής.
- Σε ποια δύναμη διττανθρακικού νατρίου έχει τις ρίζες του στην αντισηπτική δράση; Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις. Μπορείτε να νικήσετε ως αντισηπτικό zasib tetraborate sodium Na 2 B 4 O 7 ∙ 10H 2 Pro;
- Παρασκευάστε 5% NaHC03 σε όγκο 50 ml (=1,036 g/ml).
- Μόρια Budov, φυσικές και χημικές δυνάμεις του ξινιού από το κάρβουνο. Η ιατροβιολογική σημασία του άνθρακα και της γιόγκα.
· Αντιόξινα παρασκευάσματα, τα οποία εκδικούνται το διττανθρακικό νάτριο, αντικαταστάτη σε περίπτωση διαφόρων ασθενειών, οι οποίες συνοδεύονται από αυξημένη οξύτητα, tobto. αλκαλική ύφεσις αίματος.
Διευθυντής.
- Με ποια δύναμη αλατιού λειτουργούν τα αντιόξινα σκευάσματα; Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις. Μπορούν να χρησιμοποιηθούν άλλες ομιλίες για αυτούς τους σκοπούς;
- Δημιουργήστε έναν μετασχηματισμό:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Να γράψετε την εξίσωση των αντιδράσεων για τη μοριακή και ιοντική εμφάνιση.
Αντιδράσεις Viconati Na 2 CO 3 → NaCl → NaNO 3.
- Πυρίτιο και μισό yogo, γνώση της φύσης, otrimannya, φυσική και χημική δύναμη. Ιατρική-βιολογική σημασία του πυριτίου.
· Χορηγείται εσωτερικά διάλυμα NaCl 2,5% για την έκπλυση της αποχέτευσης όταν είναι μολυσμένο με AgNO 3.
Διευθυντής.
1. Σε τι βασίζεται το NaCl; Το Vidpovіd επιβεβαιώθηκε από ίσες αντιδράσεις.
3. Το κύριο χαρακτηριστικό των στοιχείων της κύριας υποομάδας της ομάδας III. Ισχυρό δάσος και yogo spoluk. Ιατρική-βιολογική σημασία στην ιατρική.
· Για την ανάπτυξη σπάνιων φαρμακευτικών μορφών, αναγνωρισμένων για ενέσιμα, αντικαθεστωτικών ισοτονικών ποικιλιών.
Διευθυντής.
1. Τι είναι ισοτονική ποικιλία; Γιατί η γιόγκα ονομάζεται ισοτονική;
3. Αλουμίνιο και γιόγκα από το πάτωμα, dominion, otrimannya. Ιατρική και βιολογική σημασία του αλουμινίου.
· 3% υδατικό διάλυμα υπεροξειδίου του νερού zastosovuyut ως αποτελεσματικό βακτηριοκτόνο zasib.
Διευθυντής.
1. Ποια είναι η βάση του βακτηριοκτόνου και του αίματος νωτιαίου υπεροξειδίου του νερού. Ποιες ξένες εισόδους είναι απαραίτητο να κοπούν όταν εργάζεστε με perhydrol;
2. Razrahuvati, skilki ml. υπερυδρόλη (30% υδατικό διάλυμα H 2 Pro 2, ρ = 1,1 g / ml) πρέπει να λαμβάνεται για τη λήψη 500 ml ενός διαλύματος 3% (ρ = 1,005 g / ml). Για να προετοιμάσετε tsey rozchin z dotrimannym tekhnіki bezpeka.
3. Μέταλλα της υποομάδας κεφαλής της ομάδας II. Χαρακτηριστικό Zagalna, otrimannya, φυσική και χημική δύναμη. Άλατα ασβεστίου και μαγνησίου. Σκληρότητα νερού. Usunennia zhorstkostі νερό. Ιατρική-βιολογική σημασία των στοιχείων στην κύρια υποομάδα της ομάδας II.
· Η σύγχρονη φαρμακοβιομηχανία παράγει φαρμακευτικά σκευάσματα σύμφωνα με το συνολικό στρατόπεδο, τον τύπο των διασκορπισμένων συστημάτων, τον τρόπο εισαγωγής στον οργανισμό.
Διευθυντής.
1. Ποια συστήματα ονομάζονται διασκορπισμένα;
Πώς ταξινομούνται τα διασκορπισμένα συστήματα;
Μοιάζουν με διασκορπισμένα συστήματα που διανέμουν φαρμακευτικά σκευάσματα; Δώστε συγκεκριμένα παραδείγματα.
- Αφαιρέστε το υδροζόλ κολοφωνίου αντικαθιστώντας το κατάστημα λιανικής.
- Το χαρακτηριστικό χαρακτηριστικό των μετάλλων της λακκούβας, η εμμονή, η φυσική και χημική δύναμη. Τα πιο σημαντικά μέρη των σεληνιακών μετάλλων. Ιατρική-βιολογική σημασία των μετάλλων της λακκούβας
· Στη θέα των διαφορών του νερού σε διάφορες ομιλίες, zastosovuyutsya rіdkі φαρμακευτικές μορφές, που μπορεί να είναι αμοιβαία αμοιβαία.
Διευθυντής.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Τι είδους υπάλληλοι μπορούν να κρατούν τις ομιλίες;
- Παρασκευάστε 5% CuSO 4 με όγκο 100 ml (ρ = 1,051 g / ml) με μπλε βιτριόλι CuSO 4 ∙ 5H 2 O
- Το χαρακτηριστικό χαρακτηριστικό των d - στοιχείων. Μέταλλα πλευρικών υποομάδων του 1ου ομίλου και spoluk. Ιατρική και βιολογική σημασία.
· Στη Ρωσία γίνεται ηλεκτροκατεργασία χυμού και φρέσκου βοτάνου με χαμηλούς χυμούς και άγριας συροβίνας: μούρα, φρούτα, ριζικές καλλιέργειες λαχανικών, διάφορα όργανα πλασμάτων με τη μέθοδο να βλέπεις τους χυμούς (εσωτερικά ανακατεμένους) σε ιθαγενή ματιά. Ο εσωτερικός χώρος είναι μια στήλη από λευκά, νουκλεϊκά οξέα, υδατάνθρακες, τανίνες
Διευθυντής.
1. Τι είδους διαφορές ονομάζονται στηλοειδή μοτίβα; Πώς ταξινομούνται οι βρωμιές; Αριθμήστε τις δυνάμεις των στηλών. Ποια διαδικασία βρίσκεται στη βάση του να δούμε χυμούς από δροσερό syrovina;
2. Αφαιρέστε το υδροξείδιο του υδρολύματος του φυσιολογικού ορού (III) με υδρόλυση FeCl. 3. Γράψτε το σχήμα του μυκηλίου.
- Μέταλλα δευτερογενών υποομάδων της ομάδας II, γενικά χαρακτηριστικά, budova, φυσική και χημική ισχύς. Ιατρική και βιολογική σημασία.
· Κατά την παρασκευή δισκίων με βάση το εκχύλισμα ρίζας βαλεριάνας, δεν συνιστάται η χρήση ανθρακικού μαγνησίου βικοριστάτη ως κύριο ενισχυτικό, γιατί μπορεί να προκαλέσει εξουδετέρωση του izovalerianic acid και ruynuvannya valtrativ - rechovina, ακόμη πιο ευαίσθητα στο έγχυμα των λιβαδιών.
Διευθυντής.
1. Εξηγήστε την εκδήλωση της ισχύος της λακκούβας στο ανθρακικό μαγνήσιο. Να γράψετε την εξίσωση της αντίδρασης για τη μοριακή και ιοντική εμφάνιση. Ποιες υπενθυμίσεις μπορεί να χρησιμοποιηθεί το vicorist για την παρασκευή δισκίων με εκχύλισμα βαλεριάνας;
2. Δημιουργήστε έναν μετασχηματισμό:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Να γράψετε την εξίσωση των αντιδράσεων για τη μοριακή και ιοντική εμφάνιση.
3. Γενικά χαρακτηριστικά στοιχείων των VI, VII ομάδων πλευρικών υποομάδων. Κυριαρχία οξειδίων του χρωμίου, του μαγγανίου και των μερών τους. Ιατρική και βιολογική σημασία.
· Η χρήση του ιξώδους αερίου διοξειδίου του άνθρακα στη φαρμακευτική παραγωγή για την εξαγωγή βιολογικά ενεργών ομιλιών από φαρμακευτική δροσερή συροβίνη.
Διευθυντής.
- Σε ποιες κυριαρχίες στο ανθρακικό οξύ είναι η διατήρηση της γιόγκα σε αυτούς τους σκοπούς;
- Δημιουργήστε έναν μετασχηματισμό:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Να γράψετε τις αντιδράσεις ανταλλαγής ιόντων σε μοριακή και ιοντική μορφή.
- Ο χαρακτηριστικός χαρακτηρισμός των στοιχείων της VIII ομάδας της δευτερεύουσας υποομάδας. Η κυριαρχία της αίθουσας και το yogo spoluk. Ιατρική και βιολογική σημασία.
Κατάλογος γευμάτων εξετάσεων από κλάδους
Βασικές έννοιες και νόμοι της χημείας. Μια τέτοια ρύθμιση στη ζωή του ατόμου.
Περιοδικός νόμος και περιοδικό σύστημα Δ.Ι. Ο Mendeliev στο φως της ζωής του ατόμου.
Ραντεβού, δείτε, κατανοήστε, διαφωτίστε, τη φύση του χημικού δεσμού.
Ραντεβού, μηχανισμός διαφώτισης, δύναμη του ομοιοπολικού δεσμού. Σθένος. Στάδιο οξείδωσης.
Oksidi: διορισμός, ταξινόμηση, ονοματολογία, εξουσία και μέθοδοι κατοχής.
Οξέα: ονομασία, ταξινόμηση, ονοματολογία, ισχύς και μέθοδοι κατοχής.
Τεκμηριώστε: διορισμός, ταξινόμηση, ονοματολογία, εξουσία και μέθοδοι κατοχής.
Άλατα: ονομασία, ταξινόμηση, ονοματολογία, εξουσία και μέθοδοι κατοχής.
Complex spoluky: ραντεβού, budova μετά τον Werner, tipi, ονοματολογία.
Η ταχύτητα της χημικής αντίδρασης. Αξιωματούχοι, scho vplyvayut swidk_st χημική αντίδραση.
Μη αναστρέψιμες και αναστρέψιμες χημικές αντιδράσεις. Χημικός ζηλωτής. Η αρχή του M. Chatelier. Σταθερά καθαρής θέσης.
Αντιδράσεις οξειδίου: οι πιο σημαντικές, οι κύριες έννοιες, η ημέρα οξείδωσης και ανανέωσης, οι σημαντικότεροι οξειδωτικοί παράγοντες και οι ηγέτες της αντίδρασης.
Συστήματα διασποράς: χαρακτηρισμός, ταξινόμηση. Χονδροειδή συστήματα: εναιωρήματα, αερολύματα, γαλακτώματα.
Koloidni razchiny: vyznachennya, κυριαρχία, εμμονή, budova mycel.
Αληθινές διαφορές: προσδιορισμός, βασική κατανόηση, ουσία της διαδικασίας διαφοροποίησης. Διάχυση. Ωσμωση. Οσμωτική μέγγενη.
Οι κύριες διατάξεις της θεωρίας της ηλεκτρικής διάστασης. Ο μηχανισμός της ηλεκτρικής διάστασης. Βήμα αυτή τη σταθερά διάστασης.
Διάσταση οξέων, βάσεων, αλάτων. Διάσπαση της διαφοράς pH.
Η ουσία της υδρόλυσης. Υδρόλυση διαφορετικών τύπων αλάτων. Βήμα υδρόλυσης.
Ο χαρακτηριστικός χαρακτηρισμός των στοιχείων της κύριας υποομάδας της ομάδας VII. Ιατροβιολογική σημασία των αλογόνων
Χλώριο, χλωριούχο νερό και υδροχλωρικό οξύ. Otrimanya, κυριαρχία. Χλωριούχο.
Kisnevі spolukiχλώριο.
Ένα κρίσιμο χαρακτηριστικό των χαλκογόνων. Kisen ta Yogo στα μισά του δρόμου. Ιατροβιολογική σημασία της ξινίλας.
Η κυριαρχία είναι κατά το ήμισυ όξινη με το νερό (νερό, υπεροξείδιο του νερού). Zastosuvannya H 2 Pro 2 στην ιατρική. Αξία μολύβδου.
Σίρκα. Αλοτροπία της ελεύθερης σίρκας. Χημεία της δύναμης του κόσμου. Περίπλους. Serkovodny οξύ και άλατα її.
Φυσική και χημική ισχύς οξειδίων του θείου, θειικών και θειικών οξέων, αλάτων θειικού οξέος, θειικών οξέων, η στασιμότητα τους.
Το χαρακτηριστικό γνώρισμα των στοιχείων της κύριας υποομάδας της ομάδας V. Άζωτο και ισχύς.
Η κυριαρχία της αμμωνίας και των αλάτων αμμωνίου. Zastosuvannya στην ιατρική και τη φαρμακευτική.
Οξείδιο του αζώτου. Νιτρώδες οξύ και άλατα її. Φυσική και χημική δύναμη, stosuvannya.
Φυσική και χημική δύναμη του νιτρικού οξέος. μην ξοδεύετε. Ιατρική-βιολογική σημασία του αζώτου και του її spoluk.
Χαρακτηριστικά του στοιχείου 15 R. Βαρύς φώσφορος: αλοτροπία, φυσική και χημική δύναμη, εμμονή.
Φωσφίνη. Οξείδια του φωσφόρου και του φωσφορικού οξέος: δύναμη, εμμονή. Ιατροβιολογική σημασία του φωσφόρου
Το χαρακτηριστικό χαρακτηριστικό των στοιχείων της ομάδας IV της κύριας υποομάδας. Vuglets: Budova και φυσική κυριαρχία, alotropy vugletsyu, χημική κυριαρχία.
Kisnevі spoluky vugletsiu: Μόρια Budova, φυσική και χημική κυριαρχία. Η ιατροβιολογική σημασία του άνθρακα και της γιόγκα σπολούκ.
Πυρίτιο και μισό γιόγκο: γνώση της φύσης, του ανδρισμού, της φυσικής και χημικής δύναμης. Ιατρική-βιολογική σημασία του πυριτίου.
Η κύρια υποομάδα της ομάδας ІІІ: το κύριο χαρακτηριστικό των στοιχείων. Βόριο και γιόγκα από το πλάι: otrimannya, φυσική και χημική δύναμη, zastosuvannya στην ιατρική.
Φόντα αλουμινίου και γιόγκα: εμμονή, φυσική και χημική δύναμη. Ιατρική και βιολογική σημασία του αλουμινίου.
Μέταλλα της κεφαλής υποομάδας της 2ης ομάδας: χαρισματικά χαρακτηριστικά, εμμονή, φυσική και χημική δύναμη. Άλατα ασβεστίου και μαγνησίου. Σκληρότητα νερού. Usunennia zhorstkostі νερό. Ιατρική-βιολογική σημασία των στοιχείων στην κύρια υποομάδα της ομάδας II.
Luzhnі έριξε: φιλανθρωπικό χαρακτηριστικό, εμμονή, κυριαρχία, το πιο σημαντικό spoluchy. Ιατρική και βιολογική σημασία.
Ο χαρακτηριστικός χαρακτηρισμός των d-στοιχείων. Μέταλλα της δευτεροβάθμιας υποομάδας του 1ου ομίλου. Pojdnannya midi, sribla. Ιατρική και βιολογική σημασία.
Μέταλλα των πλευρικών υποομάδων της ομάδας II: κρίσιμο χαρακτηριστικό της ζωής, φυσική και χημική δύναμη. Ιατρική και βιολογική σημασία.
Πλευρικές υποομάδες VI, VII της ομάδας: το χαρακτηριστικό χαρακτηριστικό των στοιχείων της υποομάδας, η κυριαρχία του χρωμίου, του μαγγανίου και του μισού τους. Ιατρική και βιολογική σημασία.
Μια υποομάδα της ομάδας VIII: ένα γενικό χαρακτηριστικό των στοιχείων της υποομάδας, η δύναμη της αίθουσας και το yogo spoluk. Ιατρική και βιολογική σημασία.
Επίλυση.Στο δερμάτινο τραπέζι μπροστά στους μαθητές υπάρχει ένα σχέδιο μαθήματος, ένα σχέδιο για την αλληλεπίδραση του νιτρικού οξέος με τα μέταλλα, ένα σύνολο αντιδραστηρίων και δοκιμές για τη στερέωση του στριμμένου υλικού.
Οξείδιο του αζώτου
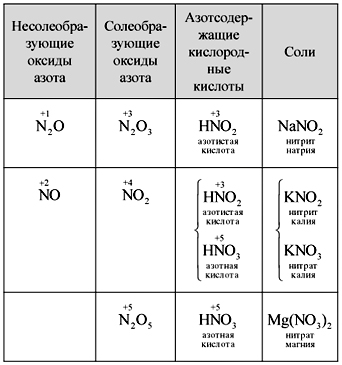
Δάσκαλος.Μαντέψτε και γράψτε τον τύπο για τα οξείδια του αζώτου. Το Yaki Oksi λέγεται αλατούχο, το yaki - μη φυσιολογικό; Γιατί;
Μάθετε να γράφετε ανεξάρτητα τους τύπους πέντε οξειδίων του αζώτου, να τους ονομάσετε, να προσδιορίσετε την ομίχλη αζώτου των οξέων kisnevy και να καθορίσετε την αντιδραστικότητα μεταξύ οξειδίων και οξέων. Ένας από τους μαθητές είναι γραμμένος στο dosh (πίνακας).
τραπέζι
Ρύθμιση οξειδίων, οξέων και αλάτων του αζώτου
Πιστοποιητικό επίδειξης:
αλληλεπίδραση οξειδίου του αζώτου (IV) με νερό
Δάσκαλος. Στο σκάφοςΟΧΙ 2 προσθέστε λίγο νερό και ανακατέψτε το και μετά προσπαθήστε να αφαιρέσετε τους λεκέδες με λακκούβα.
Τι φυλάσσεται; Rozchin chervonіє μέσω δύο οξέων που έχουν κατακαθίσει.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Βήμα οξείδωσης αζώτουΟΧΙ 2 καλή επιτυχία +4 λοιπόν. είναι ενδιάμεσο μεταξύ +3 και +5, γιακ στο rozchini stiykish, ότι στο οξείδιο του αζώτου (IV) δίνονται δύο οξέα - νιτρικό νιτρώδες.
Αποθήκη του μορίου Budova
Δάσκαλος.Γράψτε τον μοριακό τύπο του νιτρικού οξέος στον πίνακα, υπολογίστε το μοριακό βάρος και τον βαθμό οξείδωσης των στοιχείων. Διπλώστε δομικούς και ηλεκτρονικούς τύπους.
Μάθετε να δημιουργείτε τέτοιους τύπους (Εικ. 1).
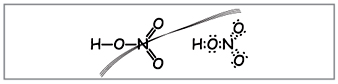
Δάσκαλος.Προφανώς, μέχρι αυτούς τους τύπους, δέκα ηλεκτρόνια είναι τυλιγμένα γύρω από το άζωτο, αλλά δεν μπορείτε να το χρησιμοποιήσετε, γιατί. Το άζωτο βρίσκεται σε μια άλλη περίοδο, και όσο το δυνατόν περισσότερο στην εξωτερική σφαίρα, στη νέα, μπορεί να υπάρχουν λιγότερα από τα υψηλότερα ηλεκτρόνια. Αυτή η επιπολαιότητα έχει εδραιωθεί, οπότε ας υποτεθεί ότι μεταξύ του ατόμου αζώτου και ενός ατόμου, δημιουργείται ένας ομοιοπολικός δεσμός πίσω από τον μηχανισμό δότη-δέκτη(Εικ. 2).
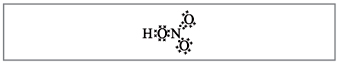
Mal. 2. Ηλεκτρονικός τύπος νιτρικού οξέος.
Τα ηλεκτρόνια του ατόμου του αζώτου σημειώνονται με μαύρες κουκκίδες
Ο ίδιος δομικός τύπος νιτρικού οξέος μπορεί να αναπαρασταθεί ως εξής(Εικ. 3) :
Mal. 3. Δομικός τύπος νιτρικού οξέος
(σύνδεση δότη-δέκτη των ενδείξεων με βέλος)
Ωστόσο, από την τελευταία διαδρομή προέκυψε ότι ο υποκείμενος σύνδεσμος διαιρείται ομοιόμορφα μεταξύ δύο ατόμων οξύτητας. Ο βαθμός οξείδωσης σε άζωτο στο νιτρικό οξύ είναι +5 και το σθένος (για να δώσουμε σεβασμό) είναι περισσότερο από το μισό, περισσότερο από το μισό του υψηλού ηλεκτρονικού στοιχήματος.
Φυσική δύναμη του νιτρικού οξέος
Δάσκαλος.Πριν είστε μπουκάλια με αραιωμένο και συμπυκνωμένο νιτρικό οξύ. Περιγράψτε τις φυσικές δυνάμεις που μπορείτε να προβλέψετε.
Μάθετε να περιγράφετε το νιτρικό οξύ ως πηγή σημασίας για το νερό, κιτρινωπό χρώμα, με πικάντικη οσμή. Νιτρικό οξύ Roschin χωρίς χρώμα και άοσμο.
Δάσκαλος. Θα προσθέσω ότι το σημείο βρασμού του νιτρικού οξέος είναι +83 ° C, το σημείο πήξης είναι -41 ° C, tobto. για τα μεγάλα μυαλά της πατρίδας. Η έντονη μυρωδιά και αυτές που όταν σωθούν δεν θα καούν, εξηγούνται από το γεγονός ότι το οξύ είναι συμπυκνωμένο, είναι χαμηλής αντοχής και ελαφρύ ή όταν θερμαίνεται συχνά διαστέλλεται.
Χημική ισχύς οξέος
Δάσκαλος. Μαντέψτε τι είδους ομιλίες να αλληλεπιδράσουν με οξέα;(Μάθετε να ονομάζετε.)
Πριν αντιδράσετε, προσπαθήστε να καταγράψετε τις αντιδράσεις και σημειώστε τις προειδοποιήσεις σας (οι αντιδράσεις θα πρέπει να καταγράφονται υπό το φως του TED).
Και τώρα είμαστε άγριοι στις συγκεκριμένες δυνάμεις του νιτρικού οξέος.
Έχουμε εκφράσει ότι το οξύ, όταν σωθεί, φέρεται τώρα από τη χημική αντίδραση:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Μελετήστε ανεξάρτητα καταγράψτε την ηλεκτρονική ισορροπία της αντίδρασης.)
«Θάψτε γκάζι», που φαίνεται(NO2) οξύ farbuy.
Είναι ιδιαίτερα απαραίτητο να διενεργηθεί οξύ φέρνοντάς το σε μέταλλο. Γνωρίζετε ότι παλιά αφαιρούσαν το νερό από διάφορα οξέα, αλλά όταν αλληλεπιδρούν με το νιτρικό οξύ, αυτό δεν αφαιρείται.
Κοιτάξτε το διάγραμμα στο γραφείο σας, το οποίο δείχνει πώς φαίνονται τα αέρια στην αντίδραση οξέων διαφόρων συγκεντρώσεων με μέταλλα.(Ρομπότ με διάγραμμα.)
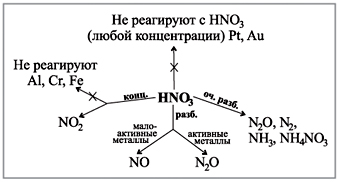
Πιστοποιητικό επίδειξης:
αλληλεπίδραση πυκνού νιτρικού οξέος με υδρόμελι
Ακόμη πιο αποτελεσματική είναι η επίδειξη της αντίδρασης του νιτρικού οξέος (συγκ.) με σκόνη midi ή λεπτοκομμένα κομμάτια μέλι βελάκι:
Μάθετε να καταγράφετε ανεξάρτητα την ηλεκτρονική ισορροπία της αντίδρασης:
Κατοχή οξέος
Δάσκαλος. Το μάθημα θα είναι ακατανόητο, σαν να μην μπορούμε να δούμε τη διατροφική κατοχή νιτρικού οξέος.
Εργαστηριακή μέθοδος: diya συμπυκνωμένο θειικό οξύ σε νιτρικό (Εικ. 5).
NaNO3+H2SO4=NaHSO4+HNO3.
Στη βιομηχανία το οξύ λαμβάνεται κυρίως με τη μέθοδο της αμμωνίας.
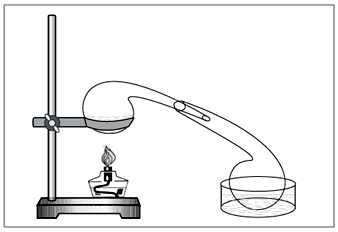
Mal. 5. Για την απόσυρση του νιτρικού οξέος στο εργαστήριο dos
χτυπημένα με το χέρι παλιά χημικά γυάλινα σκεύη - μια ανταπόκριση
Η μέθοδος συγκράτησης οξέος με άζωτο και οξύ σε θερμοκρασία άνω των 2000 ° C (ηλεκτρικό τόξο) δεν αφαίρεσε καμία ειδική διαστολή.
Στη Ρωσία, η ιστορία της εισαγωγής του νιτρικού οξέος συνδέεται με το όνομα του χημικού-τεχνολόγου Ivan Ivanovich Andreev (1880–1919).
Vin y 1915 έχοντας δημιουργήσει το πρώτο εργοστάσιο για την αναγωγή του οξέος με αμμωνία και την εφαρμογή της μεθόδου διαστολής σε εργοστασιακή κλίμακα το 1917. Το πρώτο εργοστάσιο buv zbudovaniya κοντά στο Ντόνετσκ.
Αυτή η μέθοδος περιλαμβάνει μερικά βήματα.
1) Παρασκευή sumish αμμωνίας-σκόνης.
2) Η οξείδωση της αμμωνίας είναι και πάλι ξινή σε ένα φύλλο πλατίνας:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Περαιτέρω οξείδωση σε οξείδιο του αζώτου (II) σε οξείδιο του αζώτου (IV):
2NO + O2 = 2NO2.
4) Προσδιορισμός οξειδίου του αζώτου (IV) σε υδατικό οξύ:
3NO2+H2O=2HNO3+NO.
Καθώς γίνεται διάκριση παρουσία ξινής, όλο το μονοξείδιο του αζώτου (IV) μετατρέπεται σε νιτρικό οξύ.
5) Το τελευταίο βήμα στην απομάκρυνση του νιτρικού οξέος είναι ο καθαρισμός των αερίων, όπως η ατμόσφαιρα, και των οξειδίων του αζώτου. Αποθήκευση αερίων: έως 98% άζωτο, 2-5% οξύ και 0,02-0,15% οξείδια του αζώτου. (Το άζωτο χρησιμοποιείται αρχικά για την οξείδωση της αμμωνίας.) Εάν τα οξείδια του αζώτου σε αυτά τα αέρια είναι περισσότερα από 0,02%, τότε οι καταλυτικές αναβαθμίσεις σε άζωτο γίνονται επίτηδες, επειδή τόσο μικρές ποσότητες αυτών των οξειδίων οδηγούν σε μεγάλα περιβαλλοντικά προβλήματα .
Μετά από όλα όσα ειπώθηκαν, η ανάρτηση είναι διατροφική: χρειαζόμαστε οξύ τώρα;
Οξύ στασιμότητα
Δάσκαλος.Το νιτρικό οξύ του vicorist χρησιμοποιείται για ζύμωση: νιτρικό dobriv και νιτρικό αμινοξέα στην πρώτη γραμμή (πώς το παίρνετε;); ομιλίες vibukhov (γιατί;); barvnikov; nitrativ, για το yakі timetsya στο επόμενο μάθημα.
Επισυνάπτεται στο υλικό
Εμπειρία μετωπικής τάξης
– Γιατί ο ρυθμός οξείδωσης του αζώτου στο νιτρικό οξύ είναι +5 και το σθένος του chotiri;
- Με ποια μέταλλα δεν μπαίνει στην αντίδραση το νιτρικό οξύ;
- Πρέπει να γνωρίζετε το υδροχλωρικό οξύ και το νιτρικό οξύ, υπάρχουν τρία μέταλλα στο τραπέζι - χαλκός, αλουμίνιο και κρύο. Πώς κατηγορείς και γιατί;
Δοκιμή
Επιλογή 1
1. Ποια σειρά αριθμών δείχνει τη διαφορά μεταξύ ηλεκτρονίων για ενέργεια ίση σε άτομα αζώτου;
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Ολοκληρώστε την εξίσωση των πρακτικών αντιδράσεων:
1) HNO 3 (rozb.) + Cu …;
2) Zn + HNO 3 (συγ.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3 ... .
3. Πείτε μου πώς να απεικονίσω ένα από τα στάδια της διαδικασίας εργοστασιακή παραγωγήνιτρικό οξύ.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Η αρνητική κατάσταση οξείδωσης εκδηλώνεται από το άζωτο στα ακόλουθα:
1) Ν2Ο; 2) ΟΧΙ? 3) NO2; 4) Na 3 N.
5. Αλληλεπιδράσεις ρινισμάτων χαλκού με πυκνό νιτρικό οξύ για παραγωγή έως ότου σβήσει:
1) NO2; 2) ΟΧΙ? 3) Νο. 2; 4) ΝΗ3.
Επιλογή 2
1. Η τιμή του υψηλότερου σθένους για το άζωτο είναι μία:
1) 1; 2) 2; 3) 5; 4) 4.
2. Μπορείτε να γράψετε τον συνδυασμό συμπυκνωμένου νιτρικού οξέος με επιθετικά μέταλλα: νάτριο, αλουμίνιο, ψευδάργυρος, σίδηρος, χρώμιο.
3. Επιλέξτε ομιλία, όπως η syrovina για την εξαγωγή νιτρικού οξέος:
1) άζωτο και νερό.
2) αμμωνία, επαναλαμβανόμενο νερό.
3) ξοδεύω.
4. Το πυκνό νιτρικό οξύ δεν αντιδρά με:
1) διοξείδιο του άνθρακα.
2) υδροχλωρικό οξύ.
3) άνθρακας?
4) υδροξείδιο του βαρίου.
5. Με την αλληλεπίδραση αραιωμένου οξέος με μαγνήσιο, διαπιστώνεται:
1) NO2; 2) ΟΧΙ? 3) Ν2Ο; 4) NH4NO3.
Vіdpovіdі στις δοκιμές Επιλογή 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Επιλογή 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Πικάπ Tririvny Zalik 11 κατηγορίας
Θέμα: " ΝΕΜΕΤΑΛ"
Φόρμα μαθήματος:αίθουσα
Tsіl: επανεξετάστε τις γνώσεις που απέκτησαν οι μαθητές σχετικά με το θέμα: «Νέμεταλα»; μάθετε για υψηλή ισχύμη μεταλλικό που їх spoluk; να συνεχίσει να διαμορφώνει τις δεξιότητες της γνώσης stosuvannya σε μη τυπικές καταστάσεις και καταστάσεις ζωής, σε νίκες ατομικών και διαφοροποιημένων εργασιών.
διευθυντής:
1. Επαληθεύστε τις γνώσεις και εμπεδώστε τις γνώσεις των επιστημόνων για τους μη ρίπτες αυτού του μισού. αποδεχτείτε την ανάπτυξη της νοητικής σκέψης λογικά και την ελευθερία του χημικού ορυχείου. η μετάβαση από την τυπική - λογική υιοθέτηση του υλικού από αυτούς στην μεταφορικά λογική ιδέα με τη βοήθεια διαφορετικών, εφικτών και μη τυποποιημένων εργασιών.
2. Να αναπτύξουν τις συνήθειες της προσοχής, την εκδήλωση της συγγνώμης, την αγάπη της ημέρας, το vminnya για να δει το smut, να δικαιώσει τα γεγονότα που είναι στρεβλά, να εκφράσει λογικά τις σκέψεις και robiti του visnovka. διαβάστε rozіrkovuvati, robiti απογοητεύστε, προβλέπετε.
3. Υιοθετήστε τη διαμόρφωση των κύριων ιδεών που βλέπουν το φως μέσα από την εκπαιδευτική δραστηριότητα και τη δημιουργικότητα της αυτοδυναμίας των μαθητών.
4. Vikhovuvati vminnya pratsyuvati ανεξάρτητα από zastosuvannyam εαυτό-αυτόν τον αμοιβαίο έλεγχο. Εμφάνιση zv'yazok από αυτούς που ζουν για τη ζωή. Vihovuvati επιστημονική svetoglyad με βάση την εξουσία vzaimozv'yazku και τη ζωή.
Κατέχοντας αυτό το αντιδραστικό:δοκιμαστικοί σωλήνες, λυχνίες αλκοόλης, δοκιμαστικοί σωλήνες, syrniki και άλλοι τύποι: ; ;
; ;
;
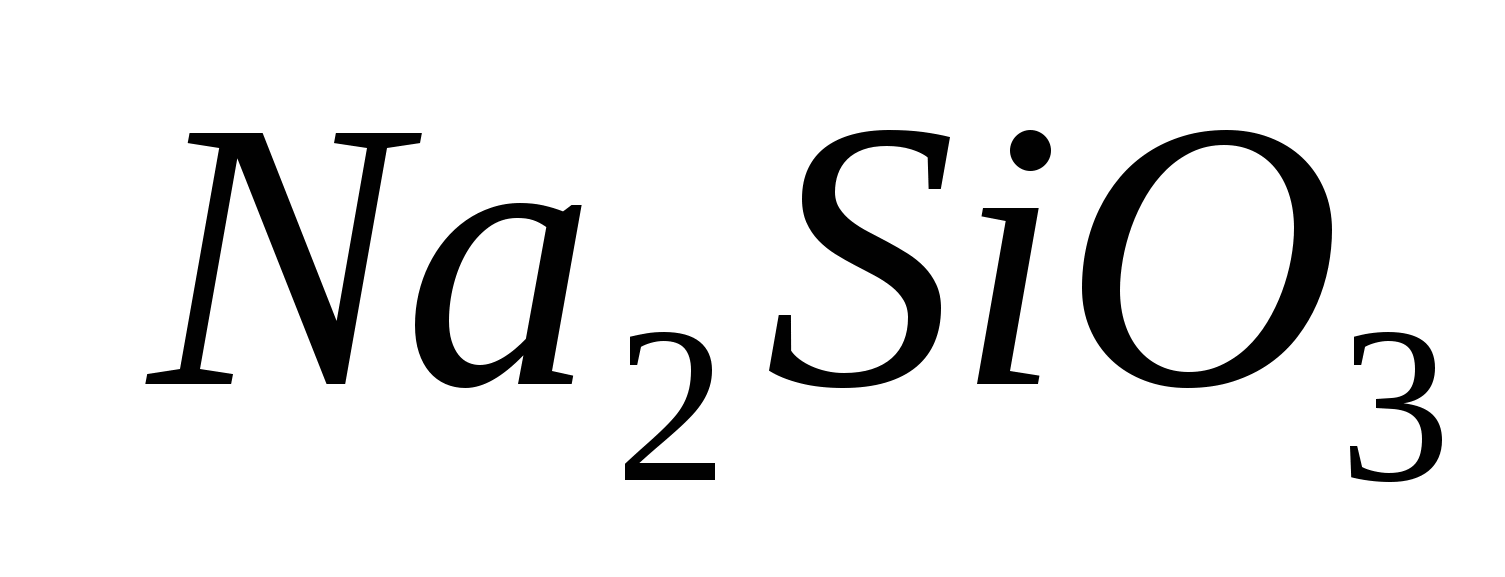 .
.
Προετοιμασία για την αίθουσα.
Ο δάσκαλος προετοιμάζει την εργασία τριών ίσων πτυχών του επιθετικού είδους: τεστ, θεωρητική διατροφή, yakіsnі και rozrahunkovі zavdannya, zavdannya για τη μεταμόρφωση των ομιλιών.
Ο δάσκαλος προετοιμάζει τους μαθητές, πώς αναθεωρούν την εργασία.
Για 1 - 2 του μήνα αναρτάται ενημερωτικό δελτίο στο γραφείο μέχρι την πόρτα.
Το φύλλο διαδρομής είναι ορατό στο δέρμα. Το μαύρο της εργασίας στα στάδια φαίνεται στα φύλλα διαδρομής.
ΦΥΛΛΟ ΔΙΑΔΡΟΜΗΣ.
F.I. μάθηση
Ονομασία της σκηνής
Ο αριθμός των σταδίων
αριθμός παραγγελίας
Υπογραφή του κριτή
Το πρόβλημα του Rosrakhun
Αναγνώριση
Μετενσάρκωση
Κρυφό μάθημα.
Μάθετε να εισέρχεστε στην τάξη με φύλλα διαδρομής, 5 λευκά φύλλα, με στυλό και πηγαίνετε στη σκηνή, ονομασίες για το Νο. 1. Μάθετε να κλέβετε την εργασία για ίσο δίπλωμα και εγγυηθείτε για το νέο γράμμα chi us, στο στάδιο του « αναγνώριση ομιλιών» περνούν το πείραμα.
Στο στάδιο του δέρματος, προστίθενται 7 - 8 πτερύγια, επανελέγχονται, τοποθετούνται στο φύλλο διαδρομής rіven, αρ.
Η βαθμολογία ορίζεται ως ο αριθμητικός μέσος όρος όλων των σταδίων.
ΠΡΟΣΘΕΣΗ
«Αναγνώριση ομιλιών»
1 rіven
1. Φέρτε την παρουσία του ιόντος 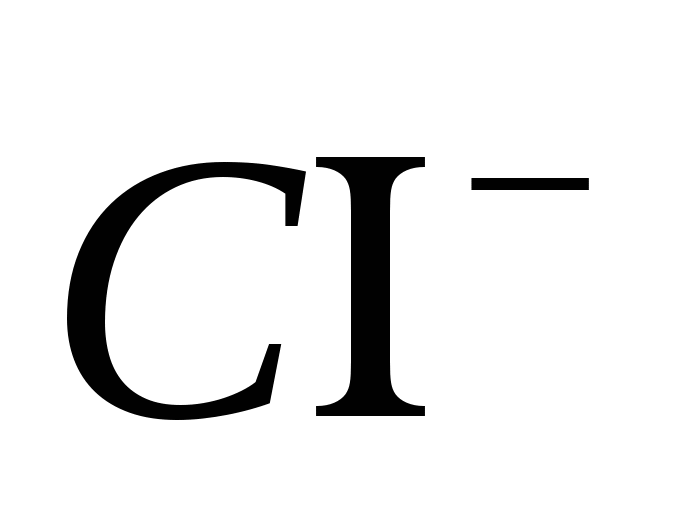
2. Φέρτε την παρουσία του ιόντος 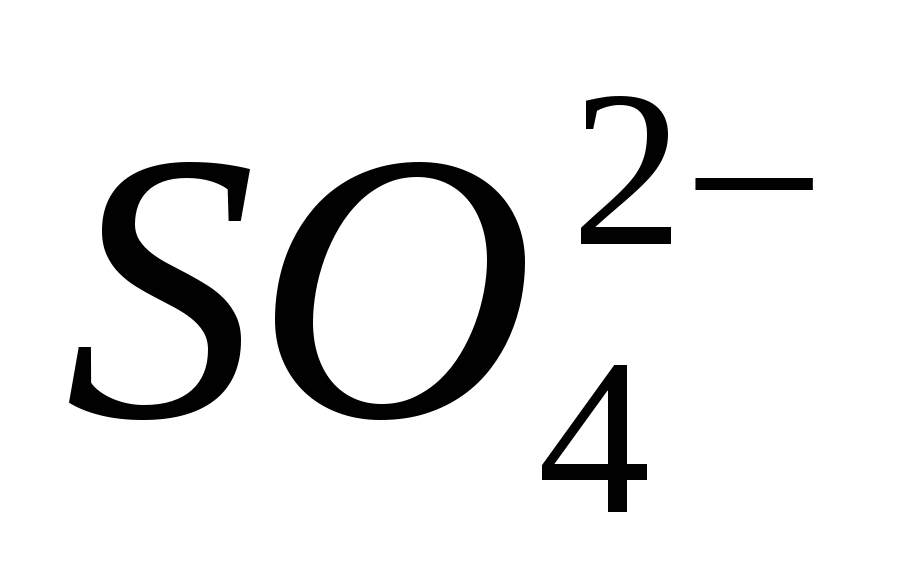
3. Φέρτε την παρουσία του ιόντος 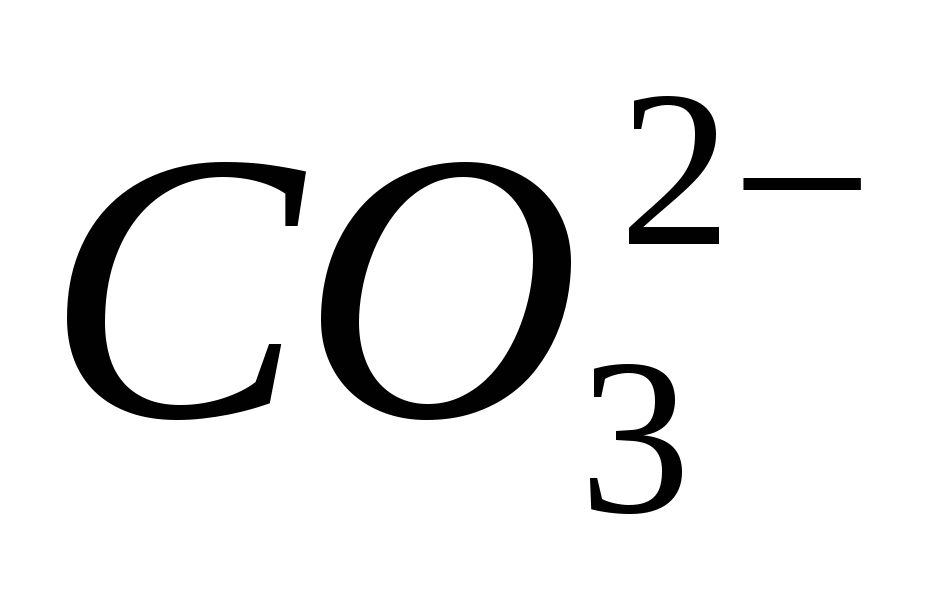
4. Φέρτε την παρουσία του ιόντος 
5. Φέρτε την παρουσία του ιόντος 
2 rіven
1. Αναγνωρίστε τη διαφορά για τη βοήθεια ενός αντιδραστηρίου:
2. Αναγνωρίστε τη διαφορά για τη βοήθεια ενός αντιδραστηρίου:
3. Αναγνωρίστε τη διαφορά για τη βοήθεια ενός αντιδραστηρίου:
4. Αναγνωρίστε τη διαφορά για τη βοήθεια ενός αντιδραστηρίου:  ;
;
5. Αναγνωρίστε τη διαφορά για τη βοήθεια ενός αντιδραστηρίου:
3 ριβεν
1. Αναγνώριση χωρίς αντιδραστήρια πρόσθετων:
2. Αναγνώριση χωρίς αντιδραστήρια πρόσθετων:
3. Αναγνώριση χωρίς αντιδραστήρια πρόσθετων:
4. Αναγνώριση χωρίς αντιδραστήρια πρόσθετων:
5. Αναγνώριση χωρίς αντιδραστήρια πρόσθετων:
Σκηνή "Μετατροπή ομιλιών"
1 rіven
1. Σταματήστε την αντίδραση
2. Τερματίστε την αντίδραση
3. Ολοκληρώστε την αντίδραση
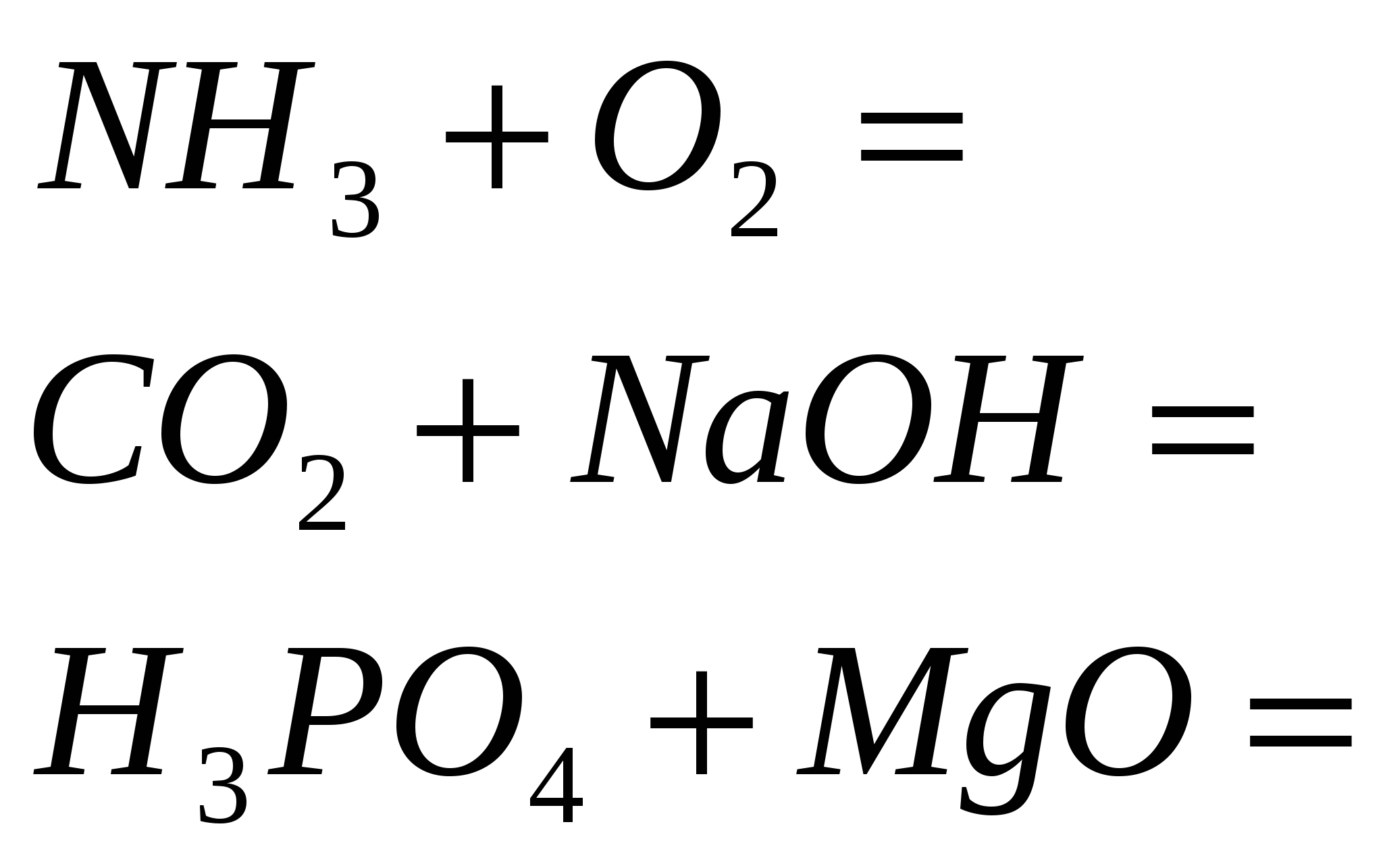
4. Ολοκληρώστε την αντίδραση
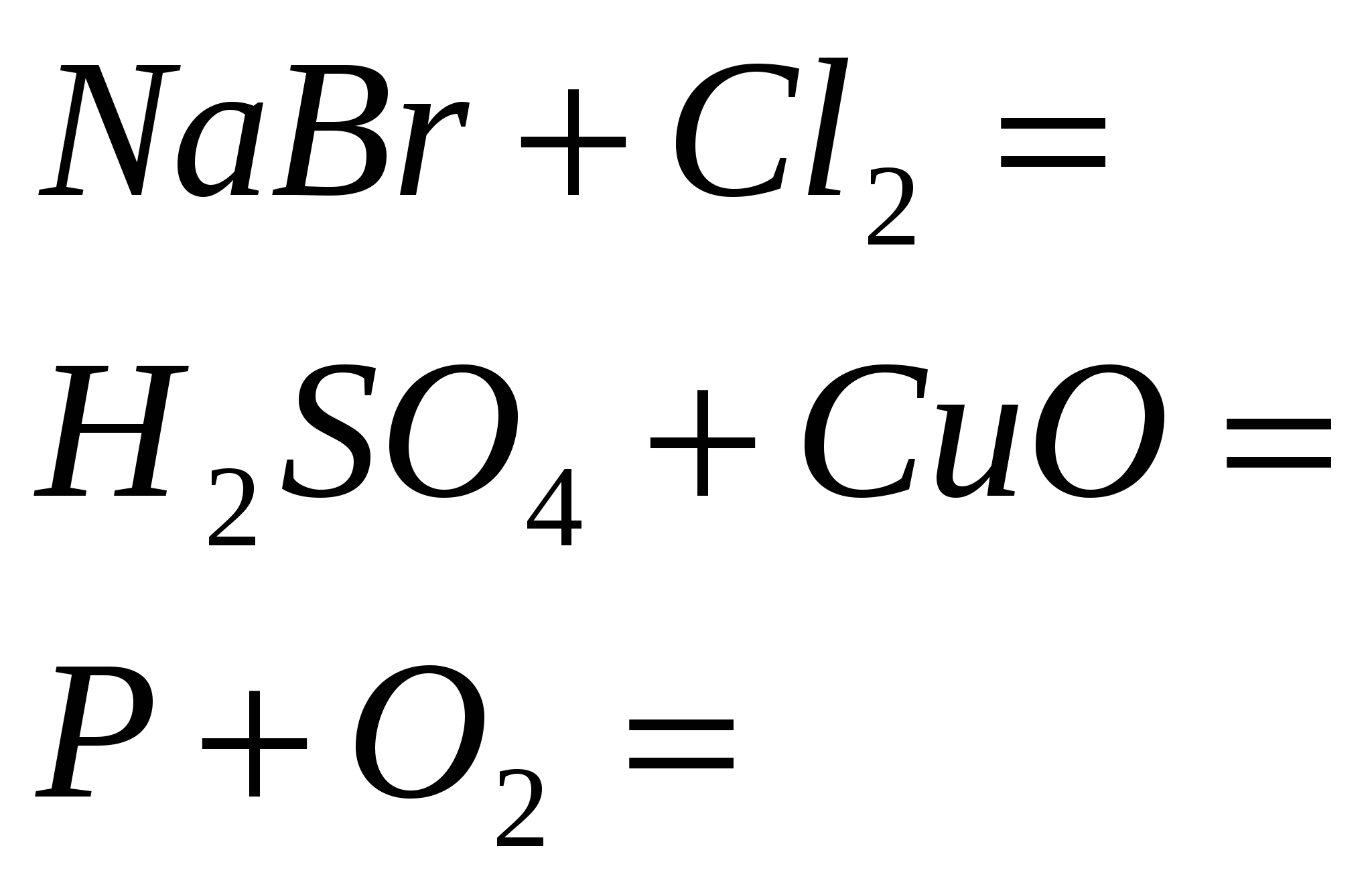
5. Ολοκληρώστε την αντίδραση
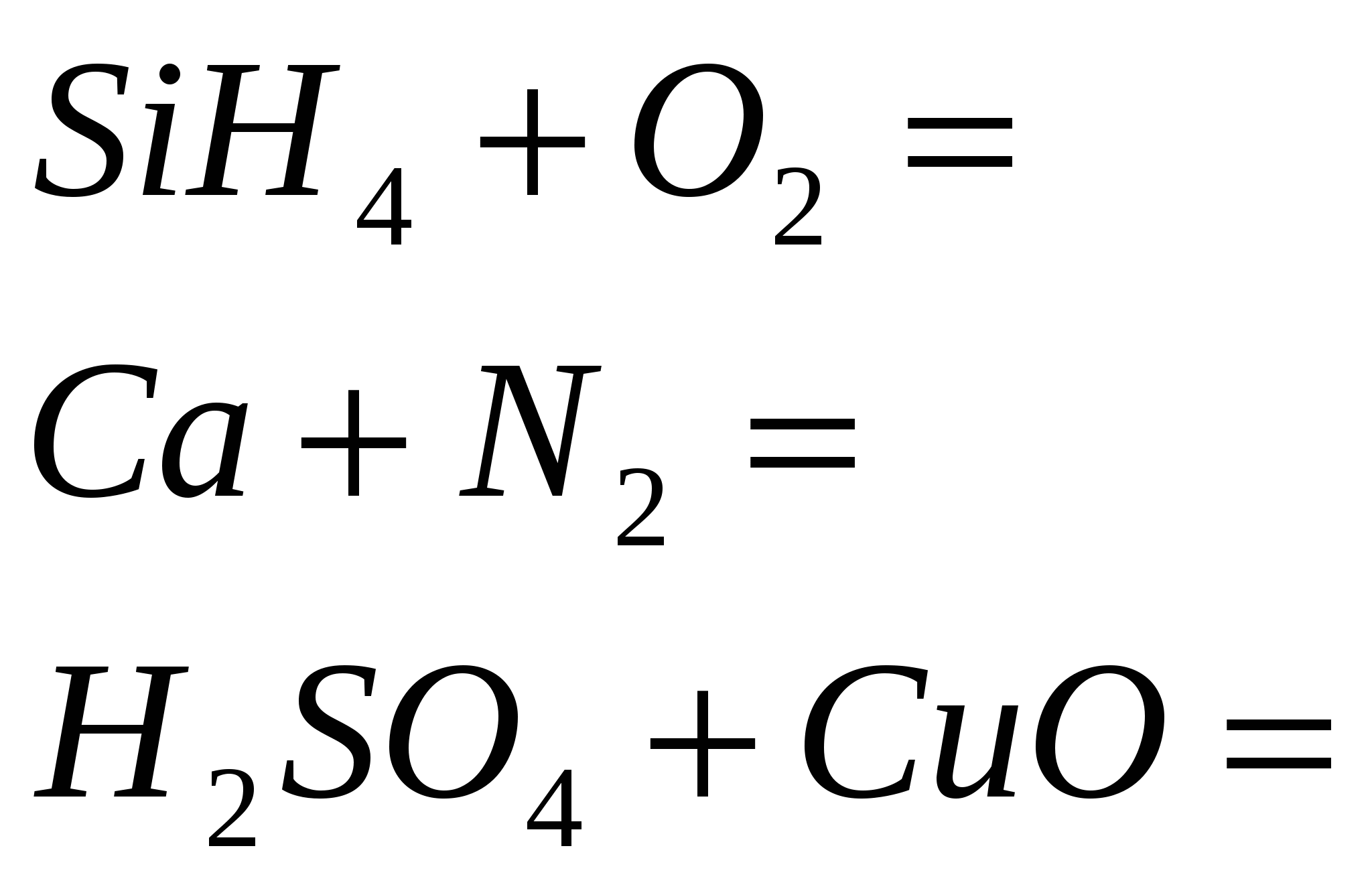
2 rіven
Δημιουργήστε έναν μετασχηματισμό:
3rіven
Δημιουργήστε έναν μετασχηματισμό:
3.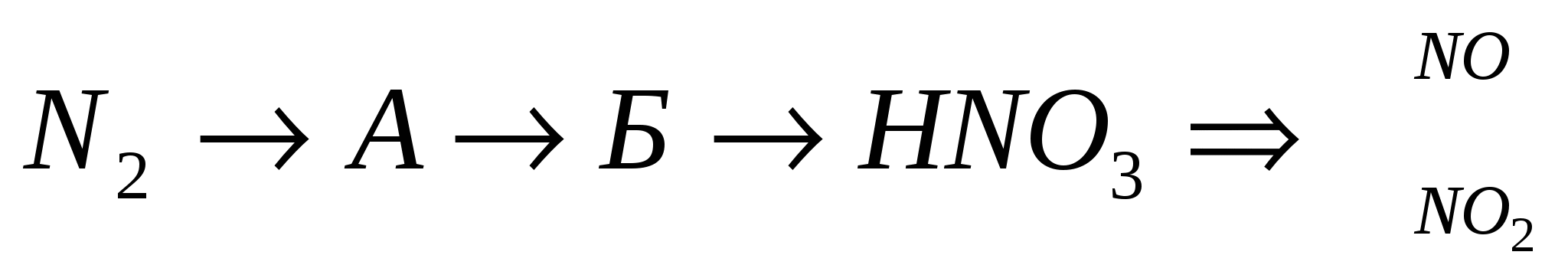
Στάδιο "Δοκιμή"
Επιλογή 1
α) Ο, β) S, γ) Cl, δ) Γ, ε) Si.
ένα) 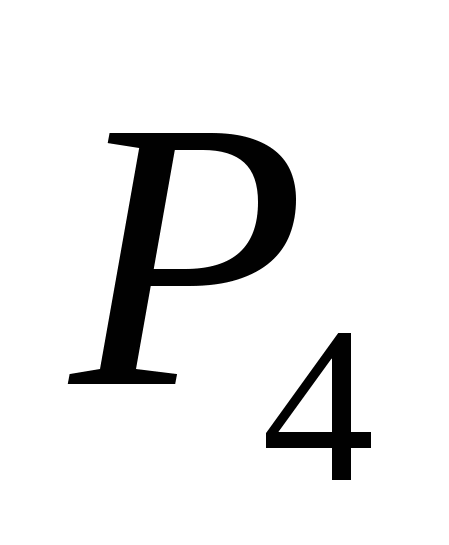 , β) Γ , γ)
, β) Γ , γ) 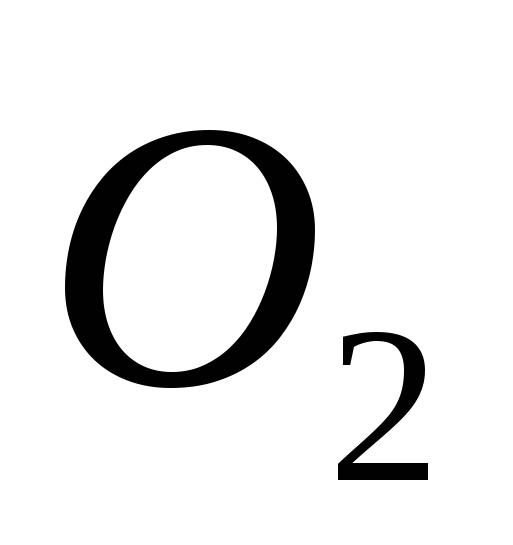 , Ζ)
, Ζ) 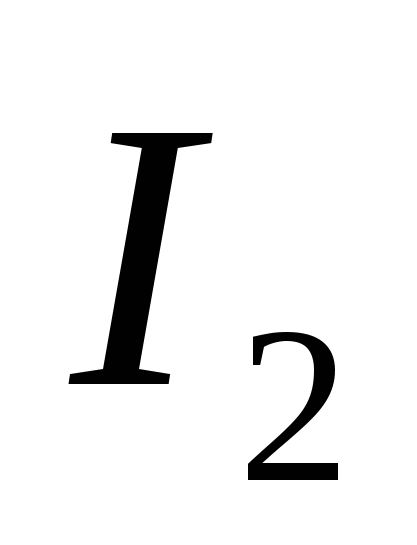 μι)
μι) 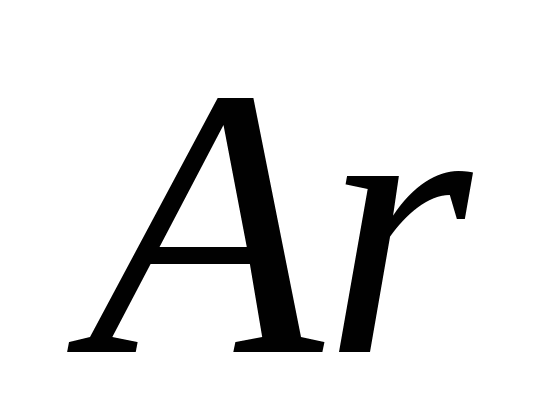 .
.
ένα)  , β)
, β) 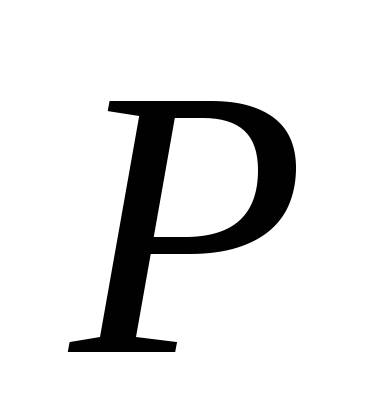 , v)
, v)  , Ζ)
, Ζ)  μι)
μι)  .
.
4. Ηλεκτρονικός τύπος του στοιχείου. Yogo flying vodnev spoluk:
ένα)  , β)
, β)  , v)
, v)  , Ζ)
, Ζ)  .
.
5. Η ισχύς των υδραλογονικών οξέων αυξάνεται σε μια σειρά:
ένα) ![]()
σι) 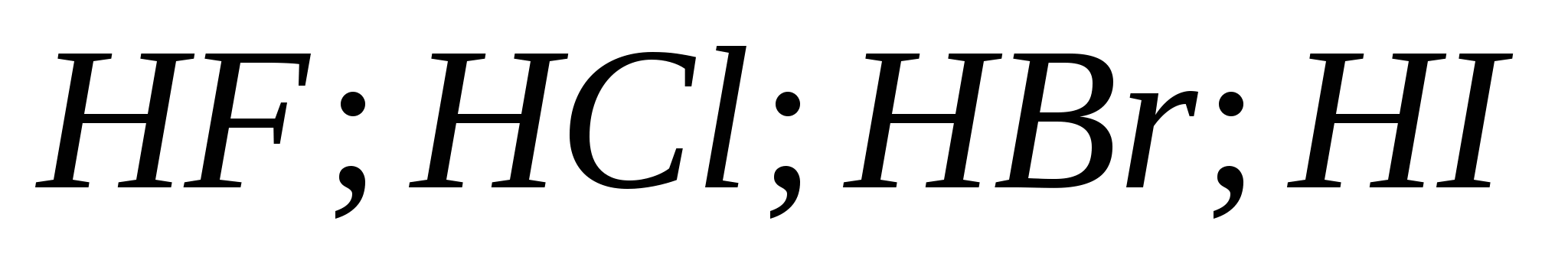
v) 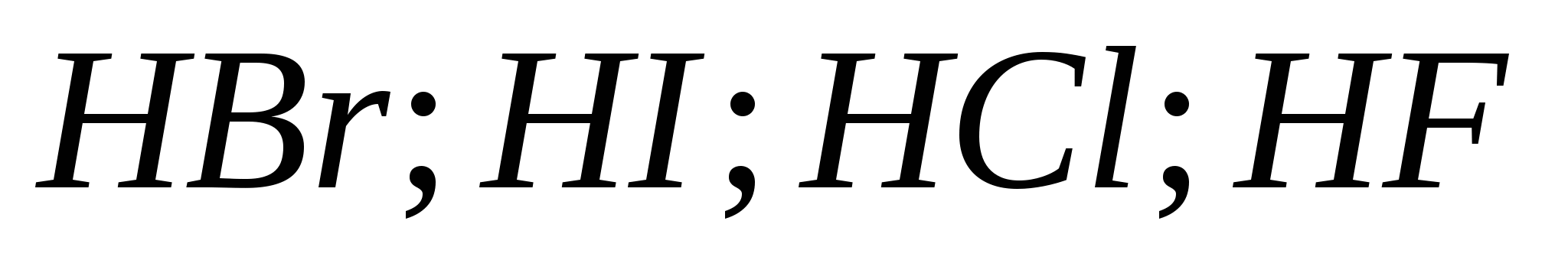
ΣΟΛ) 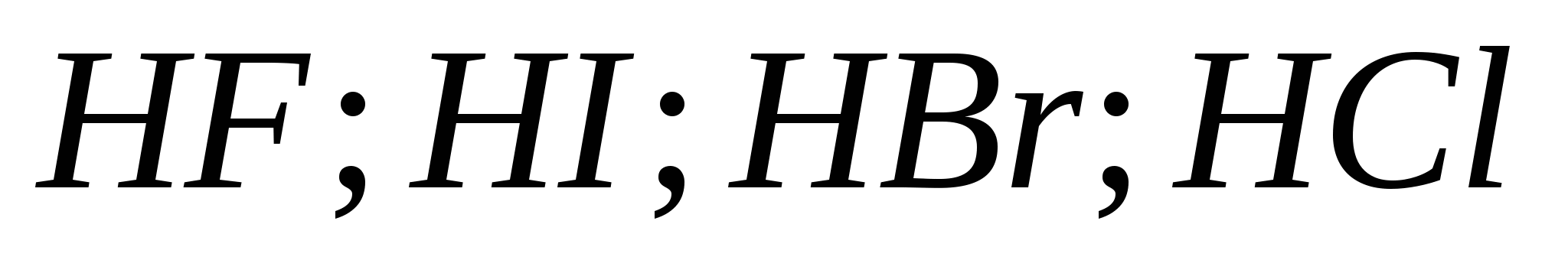
6. Από τα αλογόνα μπλοκαρίστηκε ο λόγος στα μαχόμενα παιδιά:
α) φθόριο. β) χλώριο; γ) ιώδιο; δ) βρώμιο.
7. Το σπασμένο θειικό οξύ δείχνει οξειδωτική ισχύ για την αναλογία των ατόμων:
ένα)  , β)
, β)  , v)
, v)  .
.
8. Το οξείδιο του αζώτου V μπορεί να συνδυαστεί:
ένα)  , β)
, β)  , v)
, v)  , Ζ)
, Ζ) 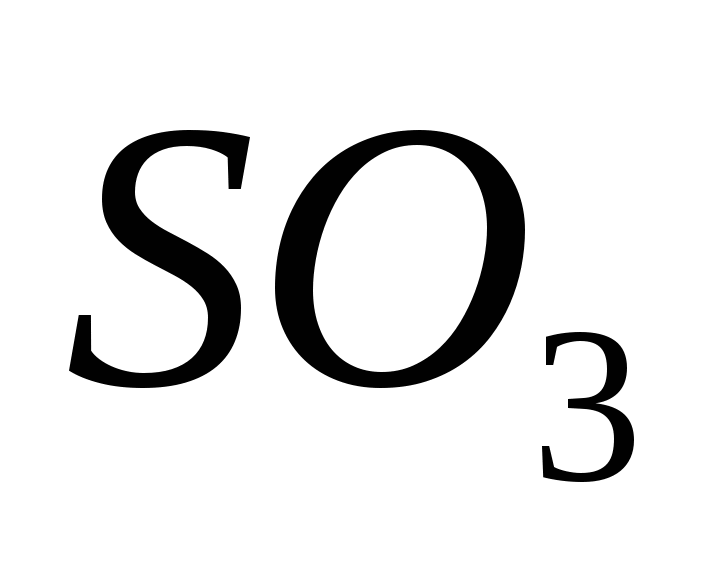 μι)
μι)  .
.
9. Αντίδραση: φέρτε τέτοια ισχύ στην αμμωνία:
α) οξειδωτικό, β) περιττό, γ) όξινο, δ) βασικό.
10. Η ισχύς των οξέων στη σειρά
α) αλλαγή, β) αύξηση, γ) σταδιακή αύξηση, μετά αλλαγή. δ) πέφτουν αργά, μετά αναπτύσσονται, ε) δεν αλλάζουν.
Επιλογή 2
Ατομικοί κρύσταλλοι grati μαμά απλές ομιλίες, εγκεκριμένες:
ένα)  , β)
, β)  , v)
, v)  , Ζ)
, Ζ)  μι)
μι)  .
.
2. Αέρια για κανονικές αποχετεύσεις є:
ένα)  , β)
, β)  , v)
, v) 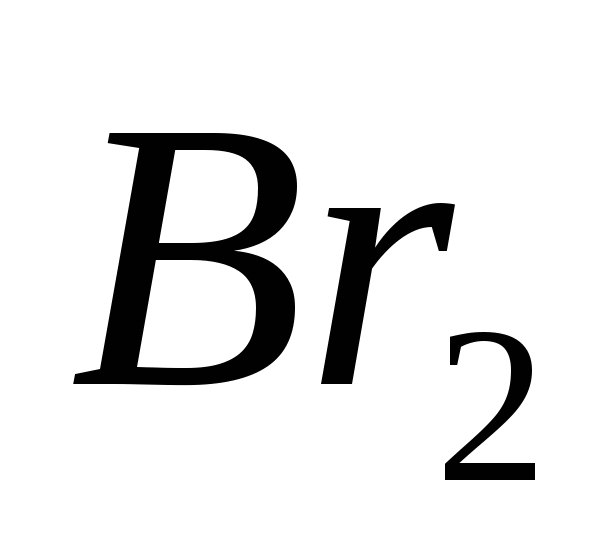 , Ζ)
, Ζ)  μι)
μι) 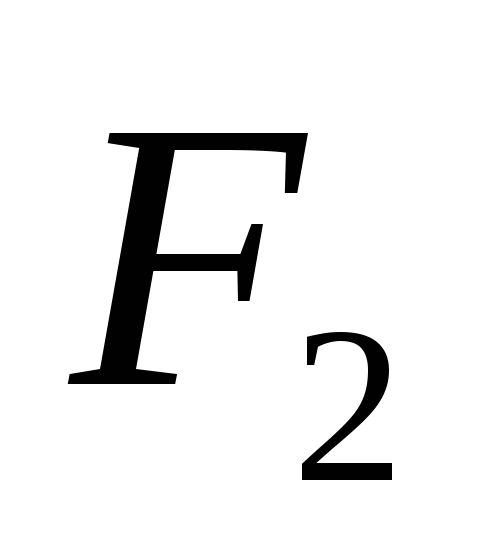 .
.
3. Οι αλοτροπικές τροποποιήσεις αποτελούν τα ακόλουθα στοιχεία:
ένα)  , β)
, β)  , v)
, v)  , Ζ)
, Ζ)  μι)
μι)  ,
,
4. Ηλεκτρονικός τύπος του στοιχείου. Yogo flying vodnev spoluk:
ένα)  , β)
, β)  , v)
, v)  , Ζ)
, Ζ)  μι)
μι)  .
.
5. Η κύρια δύναμη των καλοκαιρινών νερών αλλάζει στη σειρά:
ένα) 
σι) 
v) 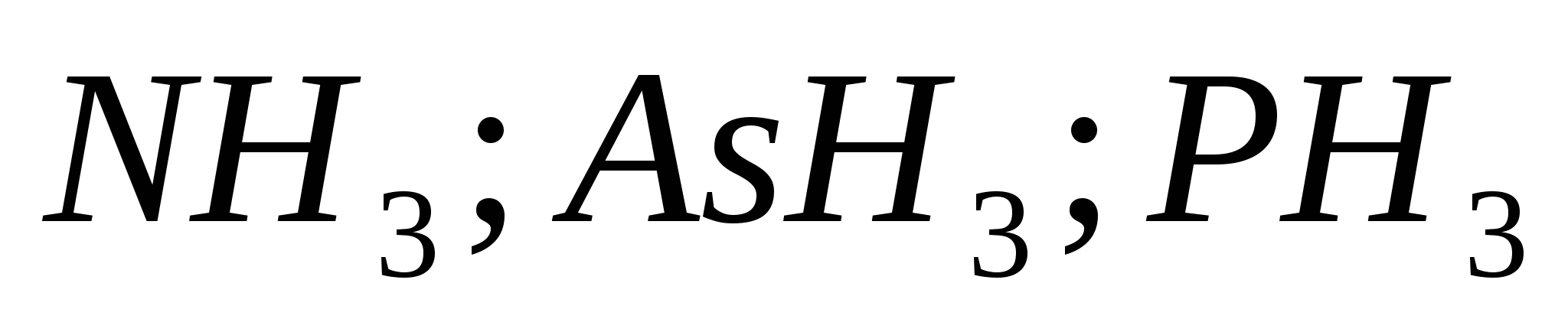
ΣΟΛ) 
6. Για το χλώριο σε γλάστρα, μπορείτε να νικήσετε διαφορετικές συγκεντρώσεις:
ένα)  , β)
, β) 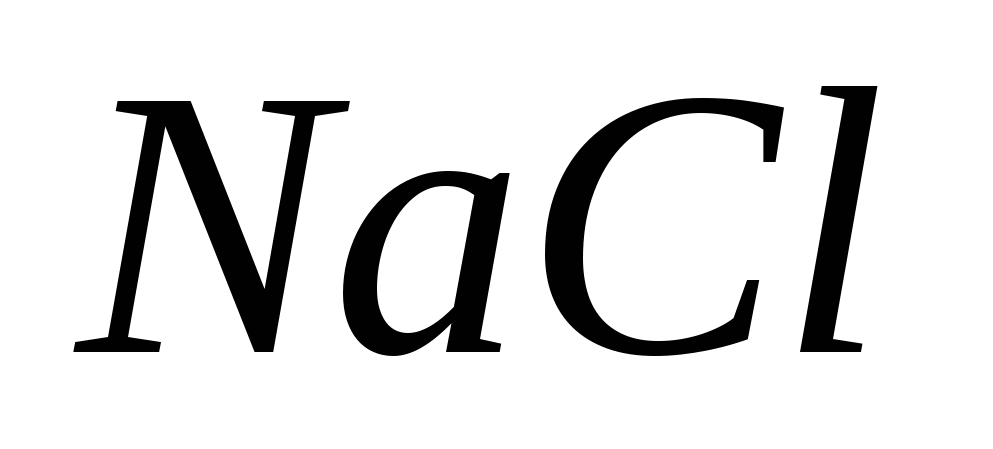 , v)
, v)  , Ζ)
, Ζ)  .
.
7. Το πυκνό θειικό οξύ παρουσιάζει οξειδωτική ισχύ για το εύρος των ατόμων:
ένα)  , β)
, β)  , v)
, v)  .
.
ΣΗΜΕΙΩΣΗ: 9-10 σωστές απαντήσεις - "5"; 7-8-"4"; 5-6-"3"; λιγότερο από 5-2
Σκηνή "Θεωρία"
Irіven (στο "3")
Γράψτε το επίπεδο των αντιδράσεων που χαρακτηρίζουν την ισχύ του αραιωμένου θειικού οξέος.
Γράψτε τον ρυθμό αντίδρασης που χαρακτηρίζει την ισχύ του οξειδίου του θείου (VI).
Να γράψετε την εξίσωση των αντιδράσεων που χαρακτηρίζουν την ισχύ του υδροχλωρικού οξέος.
Να γράψετε την εξίσωση των αντιδράσεων που χαρακτηρίζουν την ισχύ του οξειδίου του φωσφόρου (V).
Να γράψετε ίσες αντιδράσεις που χαρακτηρίζουν τη δύναμη της αμμωνίας.
II rіven (στο "4")
Να γράψετε τους τύπους των θερινών νερών των αμέταλλων την ΙΙ περίοδο. Εξηγήστε πώς και γιατί αλλάζουν αυτές οι όξινες δυνάμεις.
Να γράψετε τους τύπους των υψηλότερων οξειδίων των μη μετάλλων στην III περίοδο. Εξηγήστε πώς και γιατί αλλάζουν αυτές οι όξινες δυνάμεις.
Να γράψετε τους τύπους των σημαντικότερων οξέων των στοιχείων στην ΙΙΙ περίοδο. Εξηγήστε πώς και γιατί αλλάζουν αυτές οι όξινες δυνάμεις.
Να γράψετε τους τύπους των πτητικών υδάτων των μη μετάλλων της υποομάδας VI. Εξηγήστε πώς και γιατί αλλάζουν αυτές οι όξινες δυνάμεις.
Να γράψετε τους τύπους των σημαντικότερων οξέων των στοιχείων της υποομάδας VA. Εξηγήστε πώς και γιατί αλλάζουν αυτές οι όξινες δυνάμεις.
III rіven (στο "5")
Εξισορροπήστε την οξειδωτική και όξινη δύναμη των θειικών και νιτρικών οξέων. Η Vidpovid επιβεβαιώνει με ίσες αντιδράσεις.
Εξισορροπήστε την οξειδωτική και όξινη ισχύ του οξειδίου του θείου (IV) και του οξειδίου του άνθρακα (IV). Η Vidpovid επιβεβαιώνει με ίσες αντιδράσεις.
Εξισορροπήστε την οξειδωτική και όξινη δύναμη του νερού και του φθοριοϋδριδίου. Η Vidpovid επιβεβαιώνει με ίσες αντιδράσεις.
Εξισορροπήστε την οξειδωτική και όξινη ισχύ του συμπυκνωμένου και αραιωμένου νιτρικού οξέος. Η Vidpovid επιβεβαιώνει με ίσες αντιδράσεις.
Εξισώστε την οξειδωτική και όξινη ισχύ του οξειδίου του άνθρακα (II) και του οξειδίου του άνθρακα (IV). Η Vidpovid επιβεβαιώνει με ίσες αντιδράσεις.
Στάδιο "Το έργο του Rozrahun"
Irіven (στο "3")
II rіven (στο "4")
Κατά την αλληλεπίδραση με 37 g υδροξειδίου του ασβεστίου με θειικό αμμώνιο, αφαιρέθηκαν 15 g αμμωνίας. Υπολογίστε το κλάσμα μάζας της αμμωνίας που παράγεται.
Όταν το spalyuvanni σε ξινό 62 g φωσφόρου, αφαιρέθηκαν 130 g οξειδίου του φωσφόρου (V). Υπολογίστε το κλάσμα μάζας της παραγωγής του οξειδίου του φωσφόρου (V).
Πόσα γραμμάρια υδροξειδίου του νατρίου 10% χρειάζεστε για να εξουδετερώσετε 8,96 λίτρα νερού χλωρίου;
Μερικά λίτρα διοξειδίου του άνθρακα μπορούν να χρησιμοποιηθούν για την αποθήκευση 10 κιλών ατμού, που θα καλύψει το 20% των σπιτιών.
Πόσα γραμμάρια πολιορκίας καθιζάνουν για τη διέλευση 11,2 λίτρων διοξειδίου του άνθρακα μέσω 900 g υδροξειδίου του βαρίου 10%;
III rіven (στο "5")
Τι όγκος νιτρικού οξέος 80% (πληθ. 1,46 g/ml) απαιτείται για την «κατανομή» των 32 g midi;
Πόση μάζα midi θα χρειαστεί για την αντίδραση με υπερβολικά συμπυκνωμένο νιτρικό οξύ για να ληφθούν 4 λίτρα (N.O.) μονοξειδίου του αζώτου (IV), έτσι ώστε το κλάσμα όγκου της παραγωγής γιόγκα να γίνει 96%;
Όταν «μεταβλήθηκε» η συγκέντρωση θειικού οξέος σε 20 g κράματος χρυσού, φάνηκαν 4,2 l (n.o.) οξειδίου του θείου (IV). Προσδιορίστε το κλάσμα μάζας σε % midi για αυτό το κράμα.
Αέρια αθροίσματος χλωρίου και νερού με όγκο 1 λίτρου διήλθαν μέσω της κατανομής ιωδιούχου καλίου. Έχω δει 5,08 r ιωδίου. Προσδιορίστε το κλάσμα όγκου (%) του αερίου χλωρίου στο άθροισμα των καυσαερίων.
Το πυρίτιο Sumish και το vugillya με μάζα 10 g υποβλήθηκαν σε επεξεργασία με ένα υπερβολικά συμπυκνωμένο διάλυμα υδροξειδίου του νατρίου. Μετά την αντίδραση, φάνηκαν 5,6 λίτρα νερού (ν.δ.). Προσδιορίστε το κλάσμα μάζας του πυριτίου (%) για αυτό το άθροισμα.
