Oltingugurt. Vodorodli sulfid va sulfidlar
4.doc
240Oltingugurt. Vodorod sulfidi, sulfidlar, gidroksidlar. Oltingugurt oksidi (IV) va (VI). Sülfürik kislota va sülfürik kislota va ularning tuzlari. Sülfürik kislota esterleri. Natriy tiosulfat
4.1. Oltingugurt
Oltingugurt insonlarning bir necha ming yillar davomida ishlatgan oz sonli kimyoviy elementlaridan biridir. U tabiatda keng tarqalgan bo'lib, erkin holatda ham (tabiiy sulfat) va aralashmalarda ham mavjud. Kükürt o'z ichiga olgan minerallarni ikki guruhga bo'linadi - sülfitler (piritler, pırıltılar, mo'ylovlar) va sülfatlar. Mahalliy oltingugurt ko'p miqdorda Italiya (Sitsiliya oroli) va AQShda topilgan. MDH hududida mahalliy kükürtlü depozitlar Volga mintaqasida, Markaziy Osiyoda, Qrim va boshqa sohalarda mavjud.
Birinchi guruhdagi minerallar orasida qo'rg'oshin porlashi PbS, mis yorqinligi Cu 2S, kumush yorqinligi - Ag 2S, sink svitasi - ZnS, kadmiyum snag - CdS, pirit yoki temir pirit - FeS 2, kalkopirit - CuFeS 2, kinnabar - HgS kiradi.
Ikkinchi guruhning minerallari orasida CaSO 4 2H 2 O giperstili, mirabilit (Glauber tuzi) - Na2SO410H2O, kizerit - MgS04H2O kiradi.
Oltingugurt protein molekulalarining bir qismi sifatida hayvonlarda va o'simliklarda topiladi. Organik oltingugurt aralashmalari neftdan topilgan.
Ishga kirishish
1. Oltingugurt tabiiy aralashmalardan olinganida, masalan, piridik oltingugurtdan yuqori haroratga qizdiriladi. Oltingugurt piriti temir (II) sulfid va oltingugurt hosil qilish uchun ajralib chiqadi:
2. Kükürt, reaktsiya bilan kislorod yo'qligi bilan vodorod sülfidin oksidlanish yo'li bilan erishiladi:
2H 2 S O 2 = 2S 2H 2 O
3. Hozirgi kunda oltingugurt dioksidi SO2 ning karbonat angidridini kamaytirish bilan oltingugurtni qayta tiklash oltingugurt rudalari metallini eritishda keng tarqalgan yon mahsulot hisoblanadi:
SO 2 C = CO 2 S
4. Metallurgik va koks nonvoyxonalarning chiqindi gazlari oltingugurt dioksidi va vodorod sulfidining aralashmasidan iborat. Ushbu aralash katalizator ustida yuqori haroratda o'tkaziladi:
H 2 S S0 2 = 2H 2 O 3S
^ Jismoniy xususiyatlar
Oltingugurt qattiq, mo'rt limon sarig'i. Suvda amalda suvsiz, ammo uglerod disulfide va ba'zi boshqa erituvchilarda CS 2 anilinda yaxshi eriydi.
Zaif issiqlik va elektr tokini o'tkazadi. Oltingugurt bir nechta allotropik o'zgarishlarni hosil qiladi:
1 . ^ Rombik oltingugurt (eng barqaror), kristallar oktaedraning shakliga ega.
Oltingugurt qizdirilganda uning rangi va viskozitesi o'zgaradi: birinchi bo'lib, ochiq sariq shakllanadi, so'ngra harorat oshib boradi va qarama-qarshilik paydo bo'ladi, u quvurdan chiqmaydi, keyinchalik isitiladi, viskozite yana qaytadi va 444, 6 ° S da oltingugurt qaynatiladi .
2. ^ Monokliner oltingugurt - eritilgan oltingugurtni asta-sekin sovitish natijasida olingan quyuq sariq ignalar shaklida modifikatsiya qilish.
3. Plastik kükürtqaynab turgan oltingugurt sovuq suvga quyilsa hosil bo'ladi. Kauchuk singari osongina cho'zilgan (Qarang: 19-rasm).
Tabiiy oltingugurt to'rtta izotopning aralashmasidan iborat: 32 16 S, 33 16 S, 34 16 S, 36 16 S
^ Kimyoviy xossalari
Tugallanmagan tashqi energiya darajasiga ega bo'lgan oltingugurtli atom ikkita elektronni birlashtirib, bir daraja ko'rsatishi mumkin
Oksidlanish -2. Oltingugurt bu kabi oksidlanish holatini metallar va vodorodli (Na2S, H2S) aralashmalarda namoyish etadi. Elektronni ko'proq elektrenosensiv elementning atomiga qaytarish yoki kamaytirishda oltingugurt oksidlanishining darajasi 2, 4, 6 bo'lishi mumkin.
Sovuqda oltingugurt nisbatan nisbiy, ammo harorat oshib borishi bilan uning reaktivligi oshadi. 1. Metallar bilan oltingugurt oksidlanish xususiyatlarini namoyish etadi. Ushbu reaktsiyalar sulfid hosil qilganda (oltin, platina va iridiyum reaktsiyalarda emas): Fe S = FeS
Normal sharoitda oltingugurt vodorod bilan reaksiyaga kirishmaydi va 150-200 ° C da teskari reaksiya paydo bo'ladi:
3. Metaller bilan reaksiyaga kirishishda va vodorod bilan oltingugurt odatda oksidlovchi vosita sifatida o'zini tutadi va kuchli oksidlovchi moddalar mavjudligida kamaytirish xususiyatlari mavjud.
S 3F 2 = SF 6 (yod bilan reaksiyaga kirmaydi)
4. Kisloroddagi oltingugurtning yonishi 280 ° C da, havoda esa 360 ° S da. Bu SO 2 va SO 3 aralashmasidir:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Havo isitilganda oltingugurt to'g'ridan-to'g'ri fosfor, uglerod bilan oksidlovchi xususiyatlarni namoyon qiladi:
2P 3S = P 2 S 3 2S S = CS 2
6. Murakkab moddalar bilan o'zaro aloqada bo'lganda, oltingugurt, asosan, kamaytirish agenti bo'lib hisoblanadi:
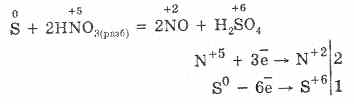
7. Kükürt, nomutanosiblik reaktsiyalariga qodir. Shunday qilib, oltingugurtli oltingugurt kukuni qaynatganda, sulfit va sulfid hosil bo'ladi:
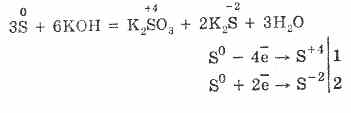
Dastur
Sulfat sanoat va qishloq xo'jaligida keng qo'llaniladi. Ishlab chiqarishning yarmidan ko'pi sulfat kislota ishlab chiqariladi. Kükürt kauçuğun vulkanizasyonu uchun ishlatiladi: bu holda kauchuk kauçuka aylanadi.
Oltingugurt (nozik chang) shaklida oltingugurt uzumzorlar va paxta kasalliklariga qarshi kurashda qo'llaniladi. Barmoqlar, matolar, yorqin kompozitsiyalarni olish uchun ishlatiladi. Tibbiyotda teri kasalliklarini davolash uchun tayyorlangan oltingugurt moyi.
4.2. Vodorod sulfidi, sulfidlar, gidroksidlar
Vodorod sulfidi suvning analogiyidir. Uning elektron formulasi
H-S-H kontsentratsiyasining hosil bo'lishida oltingugurt atomining tashqi darajasining ikki p-elektronining ishtirok etishi ko'rsatilgan. H 2 S molekulasi burchakli shaklga ega, shuning uchun u kutuplidir.
^ Tabiatda bo'lish
Vodorod sulfidi tabiatda vulkanik gazlar va Pyatigorsk, Matsesta kabi mineral manbalardagi suvlarda topiladi. U turli hayvonlardan va o'simlik qoldiqlaridan oltingugurt o'z ichiga olgan organik moddalarning parchalanishi natijasida hosil bo'ladi. Bu kanalizatsiyaning xushbichimlik yomon hidini, suv omborlarini va chiqindixonalarni tushuntiradi.
Ishga kirishish
1. Vodorod sulfidi oltingugurtni vodorod bilan bevosita isitish orqali to'g'ridan-to'g'ri ulash yo'li bilan olish mumkin:
2. Odatda temir (III) sulfidda xlorid yoki sulfat kislotaning aralashmasi bilan erishiladi:
2HCl FeS = FeCl 2H 2Sg 2H FeS = Fe2H2S Ushbu reaktsiya tez-tez Kipp apparatlarida amalga oshiriladi.
^ Jismoniy xususiyatlar
Oddiy sharoitlarda vodorod sulfidi chirigan tuxumning kuchli xarakterli hidiga ega rangsiz gazdir. Juda zaharli, nafas olish gemoglobinga bog'lanib, falajga olib keladi, bu esa noto'g'ri.
Ko o'limga olib keladi. Kam kontsentratsiyalarda kamroq xavfli. U bilan ishlaydigan shkaflar yoki hermetik yopiq qurilmalar bilan ishlash kerak. Ishlab chiqarish binolarida H 2 S ning ruxsat berilgan tarkibi 1 litr havoga 0,01 mg.
Vodorod sulfidi suvda nisbatan yaxshi eriydi (20 ° S da 2,5 vodorod sulfid miqdori 1 suv hajmida eriydi).
Suvdagi vodorod sulfid eritmasiga vodorod sulfidi yoki vodorod sulfid kislotasi deyiladi (u zaif kislota xususiyatlarini aniqlaydi).
^ Kimyoviy xossalari
1, qattiq isitilganda vodorod sulfidi oltingugurt va vodorod hosil qilish uchun deyarli butunlay ajralib chiqadi.
2. Gazning vodorod sulfidi oltingugurt oksidi (IV) va suv hosil qiluvchi ko'k olovli havoda yonadi:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Kislorod, oltingugurt va suv etishmovchiligi bilan: 2H 2 S 2 2S 2S 2H 2 O hosil bo'ladi
3. Vodorod sulfidi juda kuchli reducing agent. Ushbu muhim kimyoviy xususiyat quyidagi tarzda tushuntirilishi mumkin. H 2 S eritmasida elektronni kislorod molekulalariga havola qilish juda oson:
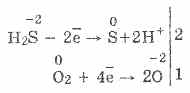
Shu bilan birga, havodagi kislorod vodorod sulfidini oltingugurt oksidlanishiga olib keladi, bu esa vodorod sulfidi suvining loyqalanishiga olib keladi:
2H 2 S O 2 = 2S 2H 2 O
Bu organik moddalar parchalanib ketganda, vodorod sulfid tabiatda juda ko'p miqdorda to'planmasligini tushuntiradi - havodan kislorod uni oltingugurtga oksidlashtiradi.
4, vodorod sulfidi halogen eritmalar bilan kuchli ta'sir ko'rsatadi, masalan:
H 2 S I 2 = 2HI S Kükürt ozod va yod eritmasi rangsiz bo'ladi.
5. Turli oksidlovchi vodorod sulfidi bilan kuchli ta'sir ko'rsatadi: azot kislotasi ta'siri ostida erkin sulfat hosil bo'ladi.
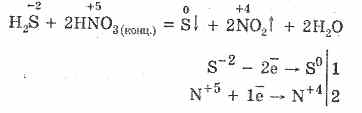
6. Dissociatsiyaga bog'liq ravishda vodorod sulfid eritmasi kislotali bo'ladi:
H 2 SH HS - HS - H S -2
Odatda birinchi bosqich g'olib chiqadi. Bu juda zaif kislota: ko'mir kislotasidan zaif, odatda sulfidlardan H 2 S ni almashtiradi.
Sulfidlar va gidroksulfidlar
Hidroflorik kislota dibazik sifatida ikki qator tuz hosil qiladi:
Markaziy sulfidlar (Na2S);
Sho'r - gidroksidlar (NaHS).
Bu tuzlarni olish mumkin: gidroksidlarning vodorod sulfidi bilan o'zaro ta'siri bo'yicha: 2NaOHH 2S = Na2S2H2O
Oltingugurtning metall bilan bevosita o'zaro ta'siri:
Tuzlarning H 2 S yoki tuzlar bilan almashinishi:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Gidrosulfidlar deyarli suvda eriydi.
Alkali va gidroksidi tuproq metallar sulfidlari suvda osonlikcha eriydi, rangsiz.
Oksidlangan metall sulfidlar suvda deyarli eriydi yoki suvda eriydi (FeS, MnS, ZnS); Ularning ba'zilari suyultirilgan kislotalarda (CuS, PbS, HgS) eriydi.
Zaif kislota tuzlari kabi, suvli eritmadagi sulfidlar yuqori darajada gidrolizlanadi. Misol uchun, gidroksidi metall sulfidlar suvda eriydi, gidroksidi reaktsiyaga ega:
Na 2 S NONN NaOH NaOH
Barcha sulfidlar, masalan, vodorod sulfidlari, kuchli reducing agentlardir:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
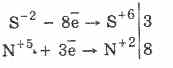
Ba'zi sulfidlar o'ziga xos rangga ega: CuS va PbS - qora, CdS - sariq, ZnS - oq, MnS - pushti, SnS - jigarrang, Al 2 S 3 - to'q sariq rang. Kationlar sifatini tahlil qilish sulfidlarning turli xil eruvchanliklari va ularning ko'pchiligining ranglariga asoslangan.
^ 4.3. Oltingugurt oksidi (IV) va sulfat kislotasi
Oddiy sharoitlarda oltingugurt oksidi (IV) yoki oltingugurt dioksidi o'tkir tovushli hid bilan rangsiz gazdir. -10 ° C gacha sovutilganda u rangsiz suyuqlikka aylanadi.
Ishga kirishish
1. Laboratoriya sharoitida oltingugurt kislotasi (IV) sulfat kislotasining tuzlaridan kuchli kislotalarning ta'siri bilan olinadi:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2SO 2 2H2O
2. Bundan tashqari, oltingugurt dioksidi past faol metallar bilan qizdirilganda konsentrlangan sulfat kislota bilan o'zaro ta'siri natijasida hosil bo'ladi:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2SO 2-4 = Cu 2 SO 2-4SO2 2H2O
3. Kükürt oksidi (IV), shuningdek, oltingugurt havoda yoki kislorodda yondirilganda ham hosil bo'ladi:
4. Sanoat sharoitida, SO 2 qovurish piriti FeS 2 bilan yoki rangli metallarning oltingugurtli rudalari (ZnS, galvanik plyonkali PbS va boshqalar) bilan olinadi:
4FeS 2 11O 2 = 2Fe 2O 3 8SO 2
SO 2 molekulasining strukturaviy formula:
SO2 molekulasida bog'lanish shakllanishida ikkita oltingugurt atomlari va ikkita kislorod atomidan to'rtta elektron ishtirok etadilar. Bog'lanish elektronlari juftlari va yagona elektron jufti o'zaro juftlikning molekulaga burchak shaklini beradi.
Kimyoviy xossalari
1. Oltingugurt oksidi (IV) kislotaning oksidlarining barcha xususiyatlarini namoyish etadi:
Suv bilan shovqin
Alkali bilan o'zaro ta'siri
Asosiy oksidlar bilan o'zaro ta'siri.
2. Oltingugurt oksidi (IV) quyidagi xususiyatlarni kamaytiradi:
S 4 O 2 O 0 2 2S 6 O -2 3 (qizdirilganda katalizator borligida)
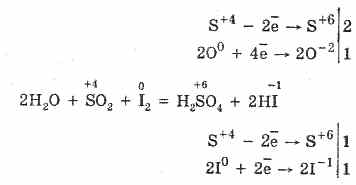
Ammo kuchli reducing agentlarining mavjudligida SO 2 oksidlovchi agent sifatida ishlaydi:
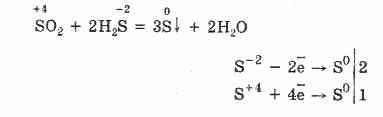
Oltingugurtning (IV) oksidining redoksli ikkilikligi, oltingugurtning 4 oksidlanish holatiga ega ekanligi bilan izohlanadi va shuning uchun u 2 elektrondan voz kechishi S 6 ga oksidlanib, 4 elektronni olib, S ° ga tushirishi mumkin. Bu yoki boshqa xususiyatlarning namoyon bo'lishi reaktiv komponentning xususiyatiga bog'liq.
Suv kislotasi (IV) suvda juda katta miqdorda eriydi (40 sm SO2 miqdori 20 ° S da 1 soat ichida eriydi). Bunday holda faqat suvli eritmada mavjud bo'lgan sulfat kislota hosil bo'ladi:
SO 2 H 2 O 2H 2 SO 3
Reaktsiya qaytib keladi. Suvli eritmada oltingugurt oksidlari (IV) va sulfat kislota kimyoviy muvozanatda bo'ladi va ularni almashtirish mumkin. H 2 SO 3 (kislotani zararsizlantirish
Siz) reaksiya sulfat kislota hosil bo'lishiga qarab davom etadi; SO 2 ni olishda (azotli eritma yoki isitish orqali eritib) reaktsiya boshlang'ich materiallarga to'g'ri keladi. Sülfürik kislota eritmasi doimo oltingugurt oksidini (IV) o'z ichiga oladi, bu esa uni o'tkir hid bilan ta'minlaydi.
Sülfürik kislotasi kislotalarning barcha xususiyatlariga ega. Eritmada bu bosqichlar bilan ajralib turadi:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2-3
Termal beqaror, uchuvchan. Sulfat kislota dibazik sifatida ikki xil tuz hosil qiladi:
Markaziy sulfitlar (Na2S03);
Sho'r - gidroksulfit (NaHSO3).
Sulfidlar gidroksidi kislota bilan to'liq neytrallashganida hosil bo'ladi:
H 2 SO 3 2NaOH = Na2S03 2H2O
Hidrosulfitler gidroksidi etishmovchiligi bilan olinadi:
H 2 SO 3 NaOH = NaHS03H2O
Sülfürik kislota va uning tuzlari, oksidlovchi va indirgeme xususiyatlariga ega, bu reaksiya sherigining tabiati bilan belgilanadi.
1. Shunday qilib, kislorod sulfitlari ta'sirida sulfatga oksidlanadi:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
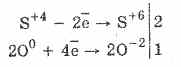
Brom va kaliy permanganatning sulfat kislota oksidlanishini yanada osonlashtiradi:
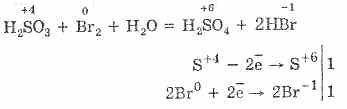
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
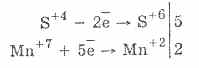
2. Batafsil kuchli moddalar mavjud bo'lganda, sulfitlar oksidlovchi xususiyatlarga ega:
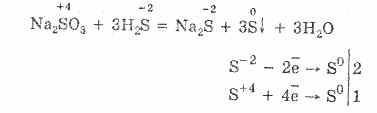
Deyarli barcha gidroliferlar va gidroksidi metall sulfatlari oltingugurtli kislotalarning tuzlaridan eriydi.
3. H 2 SO 3 zaif kislota ekanligi sababli, kislotalarning sulfit va gidrosulfitlarga ta'siri SO 2 ning chiqishi bilan yakunlanadi. Ushbu usul odatda SO2 olishda ishlatiladi laboratoriya sharoitida:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Suvda eruvchan sulfitlar osonlik bilan gidrolizga o'tadi, natijada eritmadagi OH-ionlari kontsentratsiyasi oshadi:
Na 2SO 3NONNNHSa3 NaOH
Dastur
Oltingugurt oksidi (IV) va sulfat kislota rangsiz birikmalar hosil qiluvchi ko'p bo'yoqlar rangini o'zgartiradi. Ikkinchisi isitilganda yoki nurda qaytadan parchalanishi mumkin, natijada rangi tiklanadi. Shuning uchun SO2 va H 2 SO 3 ning oqlanish ta'siri xlorning oqlanish ta'siridan farq qiladi. Odatda, oltingugurt (IV) rxid jun, ipak va somonni oqartiradi.
Oltingugurt oksidi (IV) ko'p mikroorganizmlarni o'ldiradi. Shuning uchun mog'or qo'ziqorinlarini yo'q qilish uchun ular xom kilerlarni, kilerlarni, vino barrellarini va hokazolarni fumigate qiladi. Shuningdek, ular meva va rezavorlar tashishda va saqlashda ishlatiladi. Ko'p miqdorda oltingugurt oksidi IV) sulfat kislota ishlab chiqarish uchun ishlatiladi.
Yog'och va qog'oz pulpasini davolashda ishlatiladigan kaltsiy gidrosulfit CaHSO 3 (sulfatli likyor) ning muhim echimidir.
^ 4.4. Oltingugurt oksidi (VI). Sülfürik kislota
Oltingugurt oksidi (VI) (20-jadvalga qarang) 16,8 ° S haroratda qattiq kristalli massaga qattiq rangsiz suyuqlik hosil qiladi. SO 3 H 2 O = H 2 SO 4 tarkibida oltingugurt kislotasini hosil qiladigan namlikni juda kuchli emiradi
Jadval 20. Sulfat oksidlarining xususiyatlari
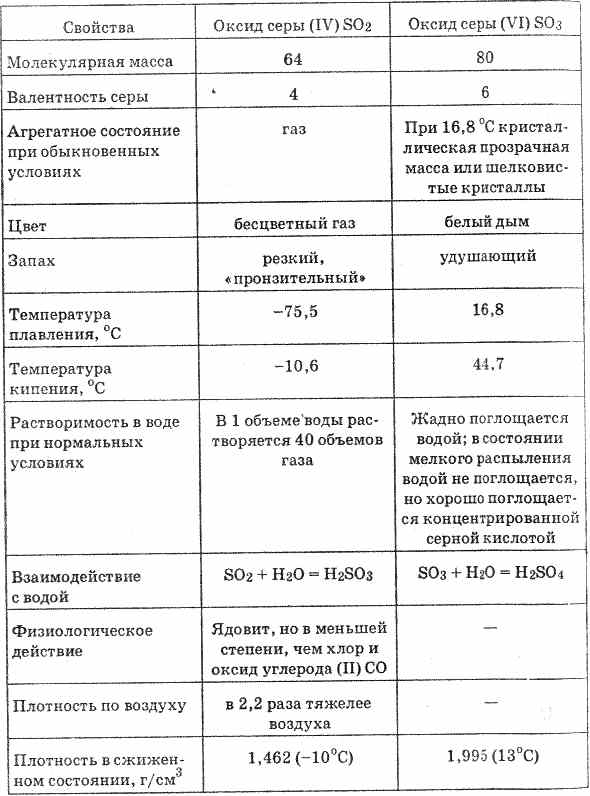
Suvdagi oltingugurt oksidlarini (VI) eritib yuborishda suv miqdori ko'payadi.
Sülfür oksidi (VI) joyga jamlanganda sülfürik kislota juda eriydi. Suvsiz kislota ichida SO 3 eritmasi oleum deb ataladi. Oleumlarda 70% SO 3 bo'lishi mumkin.
Ishga kirishish
1. Oltingugurt oksidi (VI) oltingugurt dioksidni kislorod bilan oksidlanish natijasida 450 ° S haroratda katalizatorlar mavjud bo'lganda olinadi (qarang Sülfürik kislotasi ishlab chiqarish):
2SO 2O 2 = 2SO 3
2. SO2 dan SO3 ga oksidlanishning yana bir usuli - nitrat (IV) oksidi oksidlovchi agent sifatida foydalanish:
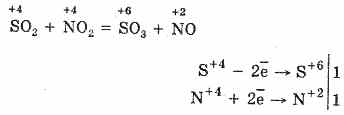
Natijada paydo bo'lgan nitrat oksid (II) atmosferada kislorod bilan ta'sirlanganda osonlik bilan va tezda nitrat oksidi (IV) ga aylanadi: 2NO O 2 = 2NO 2
Qaysi yana SO2 oksidlanishida ishlatilishi mumkin. Shuning uchun NO 2 kislorod tashuvchisi sifatida ishlaydi. SO2 dan SO3 ga oksidlanishning bu usuli azot deb ataladi. SO 3 molekulasi markazida uchburchak shakliga ega
Sulfat atomlari mavjud:
Bunday strukturaga bog'laydigan elektron juftlarining o'zaro repulsatsiyasi sabab bo'ladi. Oltingugurt atomlari hosil bo'lishida oltita tashqi elektronni ta'minladi.
Kimyoviy xossalari
1. SO 3 - odatda kislota oksidi.
2. Oltingugurt oksidi (VI) kuchli oksidlovchi moddalarning xususiyatlariga ega.
Dastur
Sülfürik kislota ishlab chiqarish uchun oltingugurt oksidi (VI) ishlatiladi. Eng muhimi, olishning aloqa usuli
Sülfürik kislota. Ushbu usul bilan siz H 2 SO 4 har qanday kontsentratsiyani va oleumni olishingiz mumkin. Jarayon uch bosqichdan iborat: SO2ni olish; SO2 dan SO3 ga oksidlanish; H 2 SO 4 olish.
SO 2 maxsus po'latlarda Fe2 2 piritini yondirish yo'li bilan olinadi: 4FeS 2 11O 2 = 2Fe 2O 3 8SO 2
Qovurishni jadallashtirish uchun pirit er osti holatiga tushadi va oltingugurtdan to'liqroq yonish uchun reaktsiya talab qilinganidan ko'ra ko'proq havo (kislorod) AOK qilinadi. Olovni qoldiruvchi gaz oltingugurt (IV) oksidi, kislorod, azot, arsenik birikmalaridan (piritdagi aralashmalardan) va suv bug'idan iborat. Qovurilgan gaz deb nomlanadi.
Qovurilgan gaz mo''tadil tozalaydi, chunki arsenik birikmalarining oz miqdori, shuningdek chang va namlik katalizatorni zaharlaydi. Gaz arsenik aralashmalari va changdan tozalanadi, maxsus elektrostatik cho'kmalar va yuvish minorasidan o'tadi; namlik sho'r yuvish minorasida konsentrlangan sulfat kislota tomonidan so'riladi. Kislorodli tozalangan gaz 450 ° S gacha bo'lgan issiqlik almashinuvgichda isitiladi va aloqa apparati ichiga kiradi. Kontakt apparatlar ichida katalizator bilan to'ldirilgan panjaralar mavjud.
Oldinroq katalizator sifatida ingichka metalllangan platina ishlatilgan. Keyinchalik u vanadiyli birikmalar - vanadiyli oksidi (V) V 2 O 5 yoki vanadil sulfat VOSO 4 bilan almashtirildi, bu platinadan arzonroq va yana zaharlangan.
SO 2 dan S03 oksidlanishining reaktsiyasi teskari:
2SO 2O 2 2SO 3
Kalsinlanish gazida kislorod miqdori ortishi oltingugurt oksidining (VI) rentabelligini oshiradi: 450 ° S haroratda, odatda 95% yoki undan ko'p bo'ladi.
Keyinchalik hosil bo'lgan oltingugurt oksidi (VI) keyinchalik konsentrlangan sulfat kislota tomonidan so'riladi, bir absorbsiya minorasiga qarshi oqim usuli bilan oziqlanadi. Doyguncha suvsiz sulfat kislota shakllanadi, keyin esa oleum bo'ladi. Kelajakda oleum 98% sulfat kislotaga suyultiriladi va iste'molchilarga etkazib beriladi.
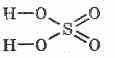
Sülfürik kislota tizimli formula:
^ Jismoniy xususiyatlar
Sülfürik kislota, og'ir, rangsiz, yog'li suyuqlikdir, u 10,4 ° C da deyarli ikki baravar kristallanadi ( = 1,83 g / sm 3) suvdan, hidsiz, uchuvchan bo'lmagan suvdan og'irroqdir. Juda gigroskopik. Namlik katta miqdordagi issiqlikni chiqarib yuboradi, shuning uchun siz konsentratsiyalangan sulfat kislota suvini to'kata olmaysiz - kislota shovqini bo'ladi. Uchun
Suv kislotasi kichik qismlarga suv qo'shilishi kerak.
Suvsiz sulfat kislota oltingugurt oksidi (VI) ning 70 foizigacha eriydi. Qizdirilganda SO 3 ni 98,3% dan H 2 SO 4 massa ulushiga ega bo'lgan eritma hosil bo'lguncha chiqaradi. Suvsiz H 2 SO 4 deyarli elektr tokini o'tkazmaydi.
^ Kimyoviy xossalari
1. Har qanday nisbatda suv bilan aralashadi va turli xil tarkibdagi hidratlar hosil qiladi:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6,5 H 2 O
2. Konsentrlangan sulfat kislota organik moddalarni karbonatlashtiradi - shakar, qog'oz, yog'och, tolalar, ulardan suv elementlarini tortib olish:
C12H22O11H2SO4 = 12CH2S04NH2O
Yaratilgan ko'mir kislota bilan qisman ta'sir qiladi:
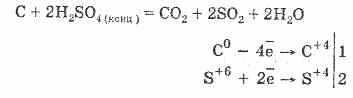
Gaz dehidratsiyasi sulfat kislotasi bilan suvning emirilishiga asoslanadi.
Kuchli uchuvchan bo'lmagan kislota sifatida H 2 SO 4 boshqa kislotalarni quruq tuzlardan ajratadi:
NaNO3H2S04 = NaHsO4HNO3
Ammo, agar H 2 SO 4 tuz eritmalari qo'shilsa, kislota almashinuvi bo'lmaydi.
H 2 SO 4 - kuchli dibasik kislota: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2-4
U o'zgaruvchan kuchli kislotalarning barcha xususiyatlariga ega.
Seytalangan sulfat kislota oksidlovchi kislotalarning barcha xossalari bilan xarakterlanadi. Masalan: meteorodlarning elektrokimyoviy ketma-ketlikdagi vodorodgacha bo'lgan metallar bilan o'zaro ta'siri:
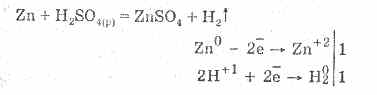
Metalllarning o'zaro ta'siri vodorod ionlarining kamayishi bilan bog'liq.
6. Konsentrlangan sulfat kislota baquvvat oksidlovchi moddadir. Qizdirilgach, ko'pgina metallarni, shu jumladan vodoroddan keyin elektrokimyoviy stress bosimining ketma-ketligini oksidlaydi, faqat platina va oltin bilan reaksiyaga kirmaydi. Metallning faolligiga qarab, reaktsiya mahsuloti S -2, S ° va S 4 bo'lishi mumkin.
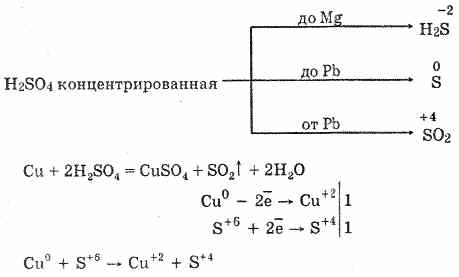
Sovuq, konsentrlangan sulfat kislota alyuminiy, temir va xrom kabi kuchli metallar bilan ta'sir qilmaydi. Bu metalllarning passivatsiyasi bilan bog'liq. Bu xususiyat temir dazmolni tashishda keng qo'llaniladi.
Biroq, isitish vaqtida:
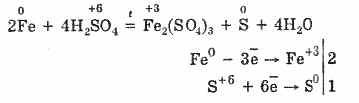
Shunday qilib, konsentrlangan sulfat kislota kislota hosil qiluvchi atomlarning kamayishiga bog'liq metallarga ta'sir ko'rsatadi.
Sulfat ionining SO 2-4 ga sifatli reaktsiyasi suv va kislotalarda erimaydigan BaSO 4 ning oq kristall cho'kma hosil bo'lishi:
SO 2- 4 Ba 2 BaSO 4
Dastur
Sülfürik kislota, asosiy bo'lmagan kimyo sanoatining eng muhim mahsuloti bo'lib,
Organik kislotalar, alkaliler, tuzlar, mineral o'g'itlar va xlor.
Turli xil ilovalar uchun kislotalar orasida sulfat kislota birinchi o'rinda turadi. Ularning katta qismi fosfor va azotli o'g'it olish uchun sarflanadi. Kislota bo'lmagan sulfat kislota boshqa kislotalarni ishlab chiqarish uchun ishlatiladi - gidroklorik, gidroflorik, fosforik va sirkatik.
Ko'p narsa neft mahsulotlarini - benzin, kerosin, soqol yog'larini - zararli moddalardan tozalashga qaratilgan. Mashinasozlikda sulfat kislota metall yuzani qoplamadan oldin oksidlardan tozalash (nikel qoplamasi, krom qoplama va boshqalar). Sulfat kislota portlovchi moddalar, sun'iy tolalar, bo'yoqlar, plastmassalar va boshqalarni ishlab chiqarishda qo'llaniladi. Bu batareyalarni to'ldirish uchun ishlatiladi.
Sülfürik kislota tuzlari muhim ahamiyatga ega.
^ Natriy sulfatNa 2SO 4 gidroksidi eritmasidan Na 2 SO 4 10H 2 O gribatidi shaklida kristallanadi, bu Glauber tuzi deb ataladi. Bu dori-darmonlar ichaklarda ishlatiladi. Suvli natriy sulfat soda va shisha ishlab chiqarishda qo'llaniladi.
^ Ammoniy sulfat(NH 4) 2SO 4 - azotli o'g'it.
Kaliy sulfatK 2 SO 4 - kaliy o'g'itlari.
Kaltsiy sulfat CaSO 4 gips mineral CaSO 4 2H 2O shaklida tabiatda uchraydi. 150 ° Cgacha qizdirilganda suvning bir qismini yo'qotadi va kuygan gips yoki alabaster deb nomlangan 2CaSO 4H 2 O hidratiga tushadi. Qovurilgan massaga suv bilan aralashtirilganda alabaster biroz vaqtdan keyin sertleşir va CaSO 4 2H 2 O ga aylanadi. Gips qurilishda (gips) keng tarqalgan bo'lib qo'llaniladi.
^ Magnezium sulfatMgSO 4 dengiz suvida uchraydi va uning achchiq ta'miga olib keladi. Achchiq tuz deb nomlangan kristalli hidrat laksatif sifatida ishlatiladi.
VitriolFe, Cu, Zn, Na, Co (metallsiz sulfatlar) metall kationlarining kristalli gidratlarining texnik nomi (vitriyal emas). Mis sulfatCuSO 4 5H 2 O - ko'k toksik moddadir. O'simliklar suyultirilgan eritma bilan püskürtülür va urug'lar ekish oldidan ekiladi. Temir kauchukFeSO 4 7H2 O - ochiq yashil moddadir. O'simliklar, siyoh, mineral bo'yoqlar va h.k. zararkunandalariga qarshi kurashish uchun ishlatiladi. Sink sulfatiZnSO 4 7H 2 O mineral moylar ishlab chiqarishda, sittoprechatanii, tibbiyotda ishlatiladi.
^ 4.5. Sülfürik kislota esterleri. Natriy tiosulfat
Sülfürik kislota Ester, dialkil sulfat (RO 2) SO2'yi o'z ichiga oladi. Ular yuqori qaynoq suyuqliklar; suvda eruvchan eritma; gidroksidi, spirtli va sülfürik kislota tuzlari mavjud bo'lganda hosil bo'ladi. Pastki dialkil sulfat, alkilleyici moddalardir.
Dietil sulfat(C2H5) 2SO 4. Erish nuqtasi -26 ° S, qaynash nuqtasi 210 ° S, suvda erimaydigan spirtli eruvchan. Sülfürik kislota o'rganish bilan reaksiyaga kirish orqali olingan. Organik sintezda etilatuvchi vosita bormi? Teriga kiradi.
Dimetil sulfat(CH3) 2SO 4. Erish nuqtasi -26.8 ° S, qaynash nuqtasi 188.5 ° S. Spirtli ichimliklarda eriydi, yomon - suvda. Ammiak bilan reaktsiyani hal qiluvchi yo'qligi (portlash bilan); Oltingugurtda fenolli esterlar kabi ba'zi aromatik birikmalar mavjud. U 60% oleumning metanol bilan 150 ° S darajasidagi o'zaro ta'sirida olinadi. Bu organik sintezda metilatlovchi vositadir. Karsinogen, ko'zlari, terisini, nafas olish organlarini ta'sir qiladi.
^ Natriy tiosulfat Na 2 S 2 O 3
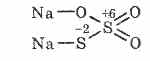
Ikkita oltingugurt atomining turli oksidlanish holatiga ega bo'lgan tiosulfat kislotasi tuzi: 6 va -2. Suvda yaxshi eriydigan kristal moddalar. Na 2 S 2 O 3 5H 2 O kristalining shaklida mavjud bo'lib, odatda hiposülfit deb nomlanadi. Natriy sulfitning qaynayotganda oltingugurt bilan o'zaro ta'siri natijasida olingan:
Na 2 SO 3 S = Na 2 S 2 O 3
Tiyosülfirik kislota kabi, kuchli reducing agenti xlor bilan sulfat kislota oson oksidlanadi:
Na2S2O3.4Cl2.5H2O = 2H2S02NaCl6HCl
Xlor absorbsiyasini natriy tiosulfatdan foydalanish (birinchi gaz maskalari) bu reaktsiyaga asoslangan.
Bir oz boshqacha oksidlanish natriy tiosulfatning zaif oksidlovchi moddalar shaklida bo'ladi. Bu tetration kislotaning tuzlarini hosil qiladi, masalan:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Natriy tiosulfat natriy oksidi 3, oltingugurt bo'yoqlari ishlab chiqarishda, sanoat gazlarini oltingugurtdan tozalashda yon mahsulot hisoblanadi. Matodan sayrdan keyin xlor izlarini olib tashlash, rudalardan kumushni olish uchun ishlatiladi; fotosuratda fiksatchi, iodometriyada reagent, mars kislotasi bilan zaharlanish uchun antidot, simob, yallig'lanishga qarshi vosita.
Oltingugurtning kimyoviy elementi VIA-guruhida, 3 PSCE davrida joylashgan. Oltingugurt atomining tashqi elektron qatlamida 6 elektron mavjud. Metil va vodorodli moddalarni shakllantirishda oksidlovchi moddalarning xususiyatlarini ko'rsatish, oltingugurt oksidlanish holatini -2 (2 elektron oladi) oladi.
Kislorodli birikmalar tarkibida oltingugurt +4 va +6 oksidlanish holatini ko'rsatadi. Shunday qilib, oltingugurt Oksidlanish holati -2 bilan xarakterlanadi; 0; +4; +6.
Tabiatda oltingugurt ona holatida va minerallar tarkibida uchraydi. Misol uchun, oltingugurtda qo'rg'oshin porlashi (asosiy komponent sulfid kislotasi PbS) va mis porloq (asosiy komponent - mis sulfidi Cu 2 S).
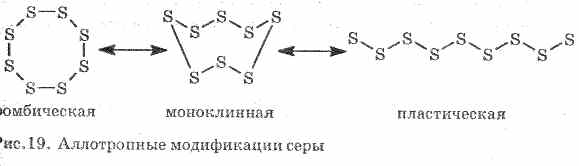
Oltingugurt bir nechta oddiy moddalarni hosil qiladi - allotropik o'zgarishlar. Rombik oltingugurt xona haroratida eng barqaror (1-rasm). Ushbu modda S 8 molekulasidan iborat. Rombik oltingugurt sariq va 112,8 ° S haroratda eriydi.
Shakl. 1. Oltingugurtning rombik modifikatsiyasi
Isitgichda rombik oltingugurt asta-sekin viskoz qora jigarrang massaga aylanadi. Bu oltingugurt - plastik oltingugurtning boshqa allotropik modifikatsiyasi. Plastik kükürt, S n doğrusal oltingugurt molekulalarini o'z ichiga oladi.
Metallar va vodorod bilan kimyoviy reaksiyalarda oltingugurt oksidlovchi razvedka rolini bajaradi. Oksidlanish darajasi 0 dan -2 ga kamayadi. Kislorod bilan reaksiyaga kirganda, oltingugurt oksidlanish darajasini 0 dan +4 ga oshirib, kamaytiruvchi modda sifatida ishlaydi.
Oltingugurt bilan bog'liq bo'lgan o'zaro ta'sirlarni misollarni ko'rib chiqing.
Oltingugurt vodorod bilan ta'sirlanganda vodorod sulfidi hosil bo'ladi:
Sink kükürt bilan ta'sir qilganda, rux sulfidi hosil bo'ladi:
Oltingugurt kislorodda oltingugurt oksidi (IV) shakllanishi bilan yonadi: (2-rasm):

Shakl. 2. Kisloroddagi oltingugurtni yoqish
Oltingugurt birikmalarining xususiyatlarini oksidlanish holati "-2" bilan ko'rib chiqing. Bunday birikmalar vodorod sulfid va sulfidlarni o'z ichiga oladi - vodorod sulfid kislotasi tuzlari.
Vodorod sulfidi - bu chirigan tuxumlarning hidiga ega bo'lgan gazdir. Havoda kuyadi. Bundan tashqari, kislorod etishmovchiligi va ortiqcha bo'lishi bilan birga yonish turli xil bo'ladi.
Kisloroddan ortiq miqdorda vodorod sulfidi oltingugurt oksidi (IV) va suv hosil qilish uchun yonadi:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Kislorod etishmovchiligi tufayli, vodorod sulfidining to'liq bo'lmagan yonishi oltingugurtni chiqarib tashlaydi: 2H 2 S + O 2 = 2S + 2H 2 O.
Vodorod sulfidi suvda juda katta eriydi. Olingan eritma zaif vodorod sulfid kislotasi. Vodorod sulfidi tuzlari sulfid deyiladi. Hidroflorik kislota va suvda eruvchan sulfidlar almashinuv reaktsiyalariga kiradi.
Vodorod sulfid kislotasi va mis (II) kloridning o'zaro ta'siri erimaydigan mis (II) sulfid va xlorid kislota hosil qiladi: H 2 S + CuCl2 = CuS + 2HCl.
Kaliy sulfid sink nitrat bilan o'zaro ta'sir qilganda sink sülfid çökeltileri va kaliy nitrat hosil qiladi: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Adabiyotlar ro'yxati
- Orzhekovsky P.A. Kimyo bo'yicha vazifalar va mashg'ulotlar to'plami: 9-sinf: P.A. Orzhekovskiy va boshqalar. "Kimyo. 9-sinf / P.A. Orzhekovskiy, N.A. Titov, F.F. Hegel - M: AST: Astrel, 2007. (91-97 bet)
- Orzhekovsky P.A. Kimyo: 9-sinf: tadqiqotlar. umumiy tasvir uchun. muassasa / P.A. Orzhekovskiy, L.M. Meshcheryakova, L.S. Pontak - M .: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kimyo: 9-sinf: umumiy tadqiqotlar. muassasa / P.A. Orzhekovskiy, L.M. Meshcheryakova, M.M. Shalashov. - M .: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kimyo: neorgan. kimyo Organ Kimyo: tadqiqotlar. 9-sinf uchun. / G.E. Rudzitis, F.G. Feldman. - M.: Ta'lim, Moskva darsliklari, 2009.
- Xomchenko I.D. O'rta maktabda kimyo fanidan mashg'ulotlar va mashg'ulotlar to'plami. - M .: RIA "Yangi to'lqin": Nashriyotchi Umerenkov, 2008.
- Bolalar uchun entsiklopediya. 17. Kimyo / Bo'lim. ed. V.A. Volodin, Ved. ilmiy ed. I. Leenson. - M: Avanta +, 2003 yil.
- Raqamli ta'lim resurslarining yagona to'plami (mavzu bo'yicha videomateriallar) ().
- "Kimyo va hayot" jurnali elektron versiyasi ().
Uy vazifasi
- v. №3; P. 14-sonli darslikdan №№ 2-4-son. Orzhekovskiy "Kimyo: 9-sinf" / P.A. Orzhekovskiy, L.M. Meshcheryakova, M.M. Shalashov. - M: Astrel, 2013.
Sulfidlar (oltingugurt, oltingugurt - oltingugurtdan)
qo'shimcha elektropozitiv elementlarga ega oltingugurt birikmalari; vodorod sulfid kislotasining tuzlari sifatida qarash mumkin (Qarang Vodorod sulfidi kislotasiH 2 S. Ikki S seriyasi mavjud: M 2 S umumiy formulasining o'rtacha (an'anaviy) va MHS umumiy formulasi kislotasi (gidroksulfidlari), bu erda M monovallent metaldir. C. gidroksidi metallar rangsiz, suvda eruvchan. Suvli eritmalar yuqori darajada gidrolizlanadi va gidroksidi hisoblanadi. Suvli kislotalarning ta'siri ostida H 2 S chiqariladi. C. gidroksidi tuproq metallar rangsiz, suvda bir oz eriydi. H 2 S nemli havoga chiqariladi, boshqa xususiyatlar esa S. gidroksidi metallar bilan o'xshash. Bu va boshqalar S. sulfatlarga osongina oksidlanadi. S og'ir metallar suvda deyarli erimaydi. Ularning deyarli barchasi qora yoki qora-jigarrang (oq ZnS, pinkish MnS, sariq CdS, apelsin-qizil Sb 2 S 3, sariq SnS 2 tashqari). Kimyoviy tahlilda C ning kislotalar va C. ammoniyga teng bo'lmagan darajasi qo'llaniladi. I.K. Malina.
Buyuk Sovet ensiklopediyasi. - M: Sovet ensiklopediyasi. 1969-1978 .
"Sulphides" ning boshqa lug'atlarda nima ekanligini ko'rib chiqing:
Oltingugurt aralashmalari metallar va ba'zi bir nodir metallar bilan. Metall sulfidlar vodorod sulfid kislota H2S ning tuzlari: o'rta (masalan, Na2S) va kislotali yoki gidroksidlar (NaHS). Tabiiy sulfidlarni yoqib, rangli metallar va SO2 olinadi. Fosforli sulfidlar va ... Katta entsiklopedik lug'at
Zamonaviy entsiklopediya
Sulfidlar - SULFIDlar, oltingugurt birikmalarining noorganik sulfidlari metallar va ba'zi bir nodir metallar bilan. Sulfidli rudalarda mavjud; fosfor sifatida ishlatiladi (masalan, CdS, ZnS). Molibden sulfidi, titaniumli qattiq yog'lar. Fosforli sulfidlar ... ... Illustrated entsiklopedik lug'ati
- (yangi lot., lotincha oltingugurt oltingugurt). Ba'zi tananing oltingugurtli, kislota yoki kislotalarga mos keladigan birikmalari. Rus tiliga kiritilgan xorijiy so'zlarning lug'ati. Chudinov, AN, 1910. SULFIDES Novolatinsk. Lotdan. oltingugurt, oltingugurt. Ulanish ... ... Rus tilining xorijiy so'zlari lug'ati
1. Metalllarning tabiiy oltingugurt birikmalari va ayrim nodir metallar. Kimyoviy munosabatlari vodorod sulfid kislota H2S ning tuzlari sifatida qabul qilinadi. Bir qator elementlar poliulfid kislotasi H2Sx tuzlari bo'lgan oltingugurtli polusfidlarni hosil qiladi. Asosiy ... Geologiya ensiklopediyasi
Sulfidlar - metallar va ba'zi bir nometall bo'lmagan oltingugurt birikmalari; vodorod sulfid kislota H2S ning metall sulfidlari tuzlari. Beton va beton konstruktsiyalar terminologiyasi. FSUE "SIC" Qurilish "NIIZHB va A. A. Gvozdeva metro stantsiyasi, Moskva, 2007. 110 p.] ... ... Qurilish materiallari atamalari, ta'riflari va izohlari ensiklopediyasi
SULPHES, s, u sulfid, a, er (Masalan.) Oltingugurtning kimyoviy birikmalari va ba'zi metalli metallar. Organik bilan Natural s. | adj sulfid, oh, oh. Ozhegova so'zi. S.I. Ozhegov, N.Yu. Shvedov. 1949 yil 1992 ... Ozhegova so'zi
Sulfidlar, R2S (R-aromatik radikal), 60 dan 70 gacha diazo tuzlari eritmasiga tomchi tomchi qo'shib osonlik bilan olinadi ... Brokxaus va Efron ensiklopediyasi
SULFIDES - (1) noorganik kimyo tarkibida oltingugurtli elementlarning tarkibiga kiradi, unda oltingugurt atomlarining oksidlanish holati 2 bo'ladi. munosabatlar zaif vodorod sulfid kislota tuzlari (H2S ning suvli eritmasi) sifatida qabul qilinadi. Ko'pchilik S. tabiiy ... Katta Politexnika entsiklopediyasi
Oh; mn (birliklar sulfidi va m.). [lat. oltingugurt oltingugurt] Chem. Oltingugurt aralashmalari metallar va ba'zi bir nodir metallar bilan. C. titan. Organik bilan Natural s. (foydali qazilmalar sinfi). ◁ Sulfid, th, oh. Aralashmalar bilan. Javhara rudaidan. * * * oltingugurt birikmalarining sulfidlari ... Entsiklopedik lug'at
- oltingugurt (S) ga ega bo'lgan metall aralashmalari (shuningdek, bir nechta metall bo'lmagan B, Si, P, As) bo'lgan kimyoviy birikmalar sinfidan. (2-oksidlanish holati mavjud). Vodorod sulfidining tuzlari ... ... Vikipediya deb qarash mumkin
Kitoblar
- "Fanerozoy" dagi kelishmovchilikning uran konlari, Andrey Borisovich Xolzov. Strukturaviy va stratigrafik kelishmovchilik yuzalarida daryo paleo-vodiysi tarkibidagi uran konlarining xususiyatlari Ural viloyatining uchta hududi misolida turli xil ...
Oltingugurt - davriy tizimning 3-davr elementi va VIA guruhi, seriya raqami 16 ga mos keladi kalsogenler. Atomning elektron formulasi [10 Na] 3s 2 3p 4, 0, -II, + IV va + VI ning xarakterli oksidlanish holatlarini bildiradi.
Oltingugurt oksidlanish shkalasi:
Oltingugurtning elektrodegativligi 2.60 dir, u metall bo'lmagan xususiyatlarga ega. Vodorod va kislorod birikmalarida turli xil anionlar mavjud bo'lib, u kislorodli kislotalar va ularning tuzlarini, ikkilik birikmalar hosil qiladi.
Tabiatda - o'n beshinchi kimyoviy tarqalish elementi (noaniq metallar orasida ettinchi). Bu bepul (mahalliy) va tegishli shaklda topilgan. Yuqori organizmlar uchun muhim element.
Sulfat shahri Rabva mahallasi Oddiy modda. Kristalli sariq (a-rombik va b-monoklinik,
95,5 ° S da) yoki amorf (plastik). Qo`rqichlardagi S 8 molekulalari (reja bo'lmagan "korona" turdagi sikllar), amorf oltingugurt S n zanjirlaridan iborat. Past erituvchi modda suyuqlikning viskozitesi maksimal 200 ° S dan oshadi (S 8 molekulalarining bo'shlig'i, zanjirlar S n ning interlacing). Bir juftlikda S 8, S 6, S 4, S 2 molekulalari. 1500 ° C da mono- tonik oltingugurt paydo bo'ladi (kimyoviy tenglamalarda soddalashtirish uchun har qanday oltingugurt S sifatida ifodalanadi).
Sulfat suvda erimaydi va normal sharoitlarda reaksiyaga kirmaydi, u uglerod disulfide CS 2 da yaxshi eriydi.
Oltingugurt, ayniqsa changlangan, qizdirilganda yuqori faollikga ega. Metall va metall bo'lmagan oksidlovchi moddalar sifatida reaksiyaga kirishadi:
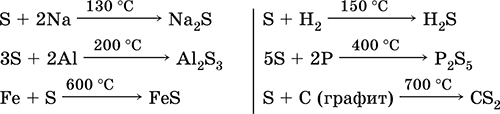
qanday kamaytirish agenti - florin, kislorod va kislotalar bilan (qaynayotganda):
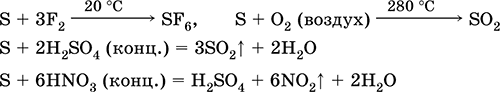
Oltingugurt gidroksidi eritmasida dismutatsiyaga uchraydi:
3S 0 + 6KOH (kons.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
Yuqori haroratlarda (400 ° C) oltingugurt vodorod yodidan yod ajratadi:
S + 2NI (g) = I 2 + H 2 S,
ammo eritmada reaksiya teskari yo'nalishda bo'ladi:
I 2 + H 2 S (p) = 2 HI + S ↓
Ishga kirishish: In sanoat ko'mir qazib chiqarish mahsulotlarini kalsifikatsiyalash jarayonida chiqarilgan, tabiiy kukunli tabiiy qobiqlardan (suv bug'idan foydalangan holda) erigan.
Sülfür, uglerod disülfürünü, sülfürik kislota, sülfür (bo'yoq) bo'yoqlari, chang zülkinden o'simliklarni himoya qilish va teri kasalliklarini davolash vositasi sifatida kauçuğun vulkanizasyonunda sentezlenmesinde ishlatiladi.
Vodorod sulfidi H 2S. Kislorodsiz kislota. Rangsiz gaz, havodan og'irroq bo'lgan tovushli hid bilan. Molekulyar ikkita tugallanmagan tetraedr [:: S (H) 2]
(Sp 3 - hibridizasyon, H - S - H kriko burchagi tetrahedraldan uzoqdir). 400 ° C atrofida qizdirilganda beqaror. Suvda bir oz eriydi (2.6 l / 1 l H 2 O 20 ° C), to'yingan eritma dekimolyar (0,1 M, "vodorod sulfidli suv"). Eritmada juda zaif kislota deyarli ikkinchi bosqichda S2-ionlariga bo'linmaydi (S 2 -1 maksimal kontsentratsiyasi 1 10 -13 mol / l teng). Havoda turganda, eritma bulutli bo'ladi (inhibitor - sakkaroz). Ammiak hidrat bilan butunlay emas, alkaliler tomonidan neytrallanadi. Kuchli kamaytirish agenti. U ion almashinuvi reaktsiyalariga kiradi. Sulfatlashtiruvchi modda juda kam eruvchanligi bor turli rangli sulfid eritmasidan hosil bo'ladi.
Sifatli reaktsiyalar - sulfidlarning cho'kindi jinsi, shuningdek, olovga (chinni spatula) kiritilgan sovuq bir ob'ektdagi sariq oltingugurt konining shakllanishi bilan H 2 S ning to'liq yonishi. Neft, tabiiy va quduqli pechlar gazini qayta ishlovchi mahsulot.
Bu analitik reagent sifatida oltingugurt, noorganik va organik oltingugurt o'z ichiga olgan birikmalar ishlab chiqarishda ishlatiladi. Juda zaharli. Eng muhim reaktsiyalar tenglamalari:
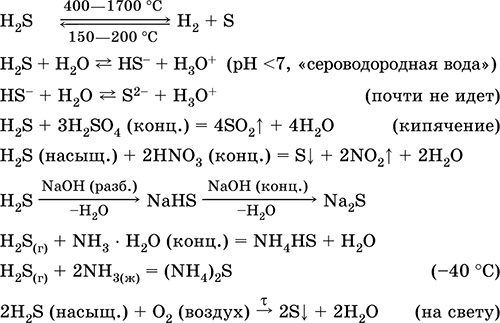

Ishga kirishish: In sanoat - to'g'ridan-to'g'ri sintez:
H 2 + S = H 2 S(150-200 ° S)
yoki kerosin bilan oltingugurtni isitish yo'li bilan;
ichida laboratoriyalar - Sulfidlarni kuchli kislotalar bilan almashtirish
FeS + 2NCl (kons.) = FeCl2 + H 2 S
yoki ikkitomonlama birikmalarning to'liq gidrolizlanishi:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Natriy sulfid Na2S. Kislorodsiz tuz. Oq, juda gigroskopik. Ayrışmasiz eritmalar, termal stabildir. Suvda yaxshi eriydi, anion bilan gidrolizlanadi, eritmada yuqori gidroksidi muhit hosil qiladi. Havoda turganda, eritma bulutli bo'ladi (kolloid oltingugurt) va sariqqa aylanadi (polusulfid bo'yoq). Odatda kamaytirish agenti. Oltingugurtni ushlab turadi. U ion almashinuvi reaktsiyalariga kiradi.
Sifatli reaktsiyalar S 2 - har xil rangli metall sulfidlarning birikmasi, ularning MnS, FeS, ZnS HCl (lar) ga ajralib chiqadi.
Bu kerosinlar va tsellyuloza mahsulotlarini ishlab chiqarishda, terining tannarxida sochlarning olib tashlanishida, analitik kimyada reagent sifatida ishlatiladi.
Eng muhim reaktsiyalar tenglamalari:
Na 2S + 2NCl (dek.) = 2NaCl + H 2 S
Na 2S + 3H 2SO 4 (conc) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (50 ° S gacha)
Na 2 S + 4HNO 3 (kons.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ˚ C)
Na 2 S + H 2 S (sat.) = 2NaHS
Na 2S (t) + 2O 2 = Na2S04 (400 ° Cdan yuqori)
Na 2 S + 4H 2 O 2 (kons.) = Na 2 SO 4 + 4H 2 O
S 2- + M2 + = MnS (koral) ↓; FeS (qora) ↓; ZnS (oq) ↓
S 2- + 2Ag + = Ag 2 S (qora) ↓
S 2- + M 2+ = CdS (sariq) ↓; PbS, CuS, HgS (qora) ↓
3S 2- + 2Bi 3+ = Bi 2 S 3 (to'g'ri - qora) ↓
3S 2- + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Ishga kirishish ichida sanoat - mineralni kalsifikatsiyalash mirabilit Na 2 SO 4 10H 2 O retseptorlari mavjud bo'lganda:
Na 2 SO 4 + 4H 2 = Na 2S + 4H 2 O (500 ° S, moy Fe 2O 3)
Na 2 SO 4 + 4C (qfyib) = Na2S + 4CO (800-1000 ° S)
Na 2 SO 4 + 4CO = Na2S + 4SO 2 (600-700 ° C)
Alyuminiy sulfid Al 2 S 3. Kislorodsiz tuz. Oq, Al - S aloqasi asosan kovalan. N2 ning ortiqcha bosimi ostida parchalanmasdan eriydi, osongina sublimatsiya qilinadi. Kuydirilgan paytda havoda oksidlanadi. Suv bilan to'liq gidrolizlanadi, eritmadan cho'kmaydi. Kuchli kislotalar bilan ajralib turadi. U toza vodorod sulfidining mustahkam manbai sifatida ishlatiladi. Eng muhim reaktsiyalar tenglamalari:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (sof)
Al 2 S 3 + 6NCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (kons.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (havo) = 2Al 2 O 3 + 6SO 2 (700-800 ° S)
Ishga kirishish: kislorodsiz va namliksiz alyuminiyning eritilgan oltingugurt bilan o'zaro ta'siri:
2Al + 3S = AL 2 S 3(150-200 ° S)
Temir (II) sulfid FeS. Kislorodsiz tuz. Yashil rangli qora va kulrang, refrakter, vakuumda qizdirilganda parchalanadi. Islom holatida havoda kislorodga sezgir bo'ladi. Suvda erimaydi. Temir (II) tuzlarining eritmalarini vodorod sulfid bilan to'yinganligiga to'lamaydi. Kislotalar bilan ajralib turadi. Bu temir ishlab chiqarishda xom ashyo sifatida ishlatiladi, vodorod sulfidining mustahkam manbai.
Fe 2 S 3 temir (III) tarkibiy tarkibi ma'lum emas (qabul qilinmagan).
Eng muhim reaktsiyalar tenglamalari:
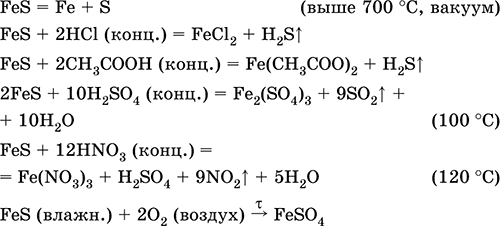
Qabul qilish:
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 Fes + 3H 2 O (700-1000 ° S)
FeCl 2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Cl + H 2 S
Temir disulfid FeS 2. Ikkilik aloqa. Fe 2+ (-S-S-) 2-ion tuzilishi mavjud. To'q sariq, issiqlik bilan barqaror, olovda parchalanadi. Suvda erimaydigan, suyultirilgan kislotalar, gidroksidi bilan reaksiyaga kirishmaydi. Havoda qovurilgan kislota-oksidlovchi moddalar bilan ajralib turadi. Organik sintezda katalizator bo'lgan temir, oltingugurt va sulfat kislota ishlab chiqarishda xom ashyo sifatida ishlatiladi. Tabiatda - rudali minerallar pirit va markazit.
Eng muhim reaktsiyalar tenglamalari:
FeS 2 = FeS + S (1170 ° C dan yuqori, vakuum)
2FeS 2 + 14H 2 SO 4 (kons., Tog'lar) = Fe 2 (SO 4) 3 + 15SO 2 + 14N 2 O
FeS 2 + 18HNO 3 (kons.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (havo) = 8SO 2 + 2Fe 2 O 3 (800 ° S, qovurish)
NH 4 HS ammoniy gidroksidi. Kislorodsiz kislota tuzi. Oq, bosim ostida eriydi. Juda beqaror, issiqlik jihatidan beqaror. Havoda oksidlanadi. Suvda yaxshi eriydi, katyon va anion bilan gidrolizlanadi (dominant), gidroksidi muhit hosil qiladi. Eritma havoda sariq rangga aylanadi. U kislotalar bilan parchalanadi, to'yingan eritmada oltingugurt qo'shadi. Alkalislar neytrallanmagan, eritmada o'rta tuz (NH 4) 2 S mavjud emas (o'rta tuzni olish shartlari bo'yicha, "H 2 S" sarlavhasini ko'ring). Analitik reagent (sulfid cho'ktiruvchi) sifatida foto ishlab chiquvchilarning komponenti sifatida ishlatiladi.
Eng muhim reaktsiyalar tenglamalari:
NH 4 HS = NH 3 + H 2 S (20 ° C dan yuqori)
NH 4 HS + HCl (qaror) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (kons.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (satr H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
Ishga kirishishNH3 ning konsentrlangan eritmasini vodorod sulfid bilan to'yinganligi:
NH 3H 2 O (kons.) + H 2 S (g) = NH 4 HS + H 2 O
Analitik kimyada odatdagidek (NH4) 2S eritmasi sifatida NH4H va NH3H2O teng miqdorda eritma taklif etiladi va ammoniy sulfid suvda NH 4H va NH ga butunlay gidroliz qilinishiga qaramay, reaksiya tenglamalarini yozishda o'rtacha tuz formulasi ishlatiladi 3H 2 O.
Oltingugurt dioksidi. Sulfitlar
Sulfid dioksid SO 2. Kislota oksidi. O'tkir hidli rangsiz gaz. Molekulyar to'liq bo'lmagan uchburchakning strukturasiga ega [S (O) 2] (sp 2 - hibridizatsiya), s, p - sintez S = O. Suyultirilgan, issiqda barqaror. Suvda eriydi (~ 40 l / l l H 2 O 20 ° S da). Zaif kislota xususiyatiga ega bo'lgan polihidrat hosil qiladi, dissotsiatsiya mahsulotlari - HSO 3 va SO 3-ionlari. Ion HSO 3 - ikki tautomerik shaklga ega - nosimmetrik (kislotali bo'lmagan) tetraedr (sp 3 - hibridizatsiya) tuzilishi bilan ajralib turadi va assimetrik emas (kislotali) tetraedr [[S (0) 2 (OH)] (sp 3 - hibridizatsiya) tuzilishiga ega. Ion SF 3 - 2 - tetraedral [: S (O) 3].
Alkalis, ammiak hidrat bilan reaksiyaga kiradi. Odatda kamaytiruvchi modda, zaif oksidlovchi agent.
Sifatli reaktsiya - sariq-jigarrang "yodlangan suv" ning rangsizligi. Sulfit va sulfat kislota ishlab chiqarishda oraliq.
Jun, ipak va somonni oqartirish, mevani saqlash va saqlash uchun, dezinfektsiyalovchi, antioksidant, sovutuvchi sifatida ishlatiladi. Zaharli.
H 2 SO 3 (sulfat kislota) birikmasi ma'lum emas (mavjud emas).
Eng muhim reaktsiyalar tenglamalari:
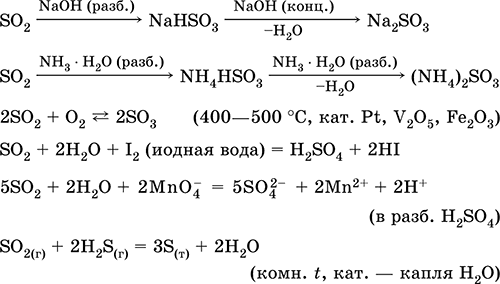
Suvda va kislotali xususiyatlarda ajralib chiqish:
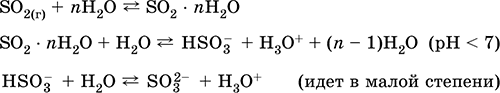
Ishga kirishish: sanoatda - kislorod bilan boyitilgan havodagi oltingugurtning yonishi va kamroq darajada sulfidli rudalarni kavlash (SO 2 - piritni qovurish davrida bog'liq gaz):
S + O 2 = SO 2(280-360 ° S)
4FeS 2 + 11O 2 = 2Fe 2O 3 + 8 SO 2(800 ° S, qovurish)
laboratoriyada - sülfitlarning oltingugurt kislotasi bilan almashinishi:
BaSO 3 (t) + H 2 SO 4 (kons.) = BaSO 4 ↓ + SO 2 + H 2 O
Natriy sulfat Na 2 SO 3. Tuzli Oq rang Havoda isitilganda u eritmasdan parchalanadi, argon ostida ortiqcha bosim ostida eriydi. Nam havoda va kislorodga sezgir bo'lgan eritmada. Suvda eriydi, anion bilan gidrolizlanadi. Kislotalar bilan ajralib turadi. Odatda kamaytirish agenti.
Sifatli reaktsiya IO SO 3 2 - bariy sulfitning oq cho'kmasi shakllanishi, u kuchli eritmalarga (HCl, HNO3) solinadi.
Analitik kimyada reaktiv sifatida ishlatiladi, foto echimlarining komponentlari, matolarni sayqallashda xlorni neytrallashtiruvchi vosita.
Eng muhim reaktsiyalar tenglamalari:
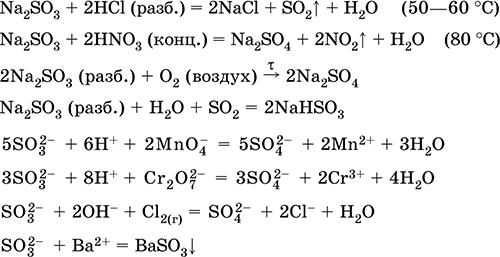
Qabul qilish:
Na 2 CO 3 (kons.) + SO 2 = Na 2 SO 3 + CO 2
Sülfürik kislota. Sulfatlar
Sulfat kislota H 2 SO 4. Oxo kislotasi. Rangsiz suyuq, juda yopishqoq (yog'li), juda higroskopik. Molekulyar buzilgan tetraedral tuzilishga ega (sp 3 gib hybridizatsiya), kovalent s - bog'lanishlari S - OH va s - bog'lanishlari S = O bo'ladi. Ion SF4-2 - to'g'ri - tetraedral tuzilishga ega. Suyuq holatning keng haroratli diapazoni (~ 300 daraja) mavjud. 296 ° C atrofida qizdirilganda u qisman ajralib chiqadi. Suv bilan azeotropik aralashmasi sifatida distillangan (kislotaning massa ulushi 98,3%, qaynash nuqtasi 296-340 ° S), kuchli isitish bilan butunlay ajralib chiqadi. Cheksiz suv bilan aralashadi (kuchli exo-Effekt). Qattiq kislota eritmasida, gidroksidi va ammiak hidrat bilan zararsizlantiriladi. Metalllarni sulfatlarga o'zgartiradi (odatdagi sharoitlarda eritilgan kislotani ortiqcha eritganda, eruvchan gidrosulfatlar hosil bo'ladi), lekin Be, Bi, Co, Fe, Mg va Nb metallar konsentrlangan kislotada passivlanadi va u bilan reaksiyaga kirishmaydi. Asosiy oksidlar va gidroksidlar bilan reaksiya qiladi, zaif kislotalarning tuzlarini ajraltiradi. Zaif oksidlovchi eritmada (H I ga bog'liq), kuchli - konsentrlangan eritmada (S VI tufayli). SO 3 eritib, u bilan reaksiyaga kirishadi (yog'li suyuqlik hosil bo'ladi - oleum H 2 S 2 O 7 o'z ichiga oladi).
Sifatli reaktsiya SO 4 2- ionida - oq bariy sulfat BaSO 4 yog'inining yog'lanishi (cho'kma BaSO 3 oq cho'kmasi farqli o'laroq, xlorid va nitrat kislotalarning eritmasiga aylantirilmaydi).
Sulfat va boshqa oltingugurt birikmalari, mineral o'g'itlar, portlovchi moddalar, bo'yoqlar va preparatlar, organik sintezda, sanoat ahamiyatiga ega rudalar va minerallarni "ochish" uchun (neftni qayta ishlashda, suvni elektrolizlashda) qo'rg'oshin batareyalari elektrolitlari sifatida ishlatiladi. . Zaharli, terining kuyishiga sabab bo'ladi. Eng muhim reaktsiyalar tenglamalari:
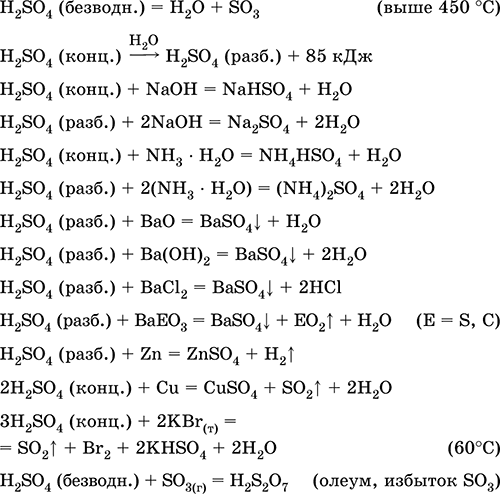
Ishga kirishish ichida sanoat:
a) SO2 ning oltingugurt, sulfid rudalari, vodorod sulfid va sulfat rudalari sintezi:
S + O 2 (havo) = SO 2(280-360 ° S)
4FeS 2 + 11O 2 (havo) = 8 SO 2 + 2Fe 2 O 3 (800 ° S, qovurish)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 ° S)
CaSO 4 + S (ildiz) = CaO + SO 2 + CO (1300-1500 ° S)
b) aloqa apparatida SO 2 dan SO 3 ga konveksiya:
v) joyga jamlanganda va suvsiz sulfat kislota sintezi:
H 2 O (Koll H 2 SO 4) + SO 3 = H 2 SO 4(konts., anhid.)
(aralashmaning kuchli isishi va H 2 SO 4 ning teskari dekompozitsiyasi tufayli yuqorida ko'rsatilgan) SO 2 ning SO 3 ning sof suv bilan emirilishi H 2 SO 4 ishlab chiqarish bilan amalga oshirilmaydi;
d) sintez oleum - Suvsiz H 2 SO 4, disarik kislota H 2 S 2 O 7 va ortiqcha SF 3 aralashmasidir. Eritilgan SO 3 oleum suvsizligini ta'minlaydi (suv kirganda H 2 SO 4 darhol hosil qilinadi), bu uni temir tanklarda xavfsiz tashish imkonini beradi.
Natriy sulfat Na2SO 4. Tuzli Oq, gigroskopik. Ayrışmasiz eritiladi va qaynatiladi. Kristalli hidrat hosil qiladi (mineral mirabilite) suvni oson yo'qotish; texnik nomi Glauberning tuzi. Hidroliz qilinmagan suvda eriydi. H 2 SO 4 (kons.), SO 3 bilan reaksiyaga kiradi. Vodorod, koka yordamida isitiladi. U ion almashinuvi reaktsiyalariga kiradi.
U preparat sifatida shisha, tsellyuloza va mineral bo'yoqlarni ishlab chiqarishda qo'llaniladi. Tuz ko'llarida, xususan, Kaspiy dengizining Qora-Bogaz-Gol ko'rfazida joylashgan.
Eng muhim reaktsiyalar tenglamalari:
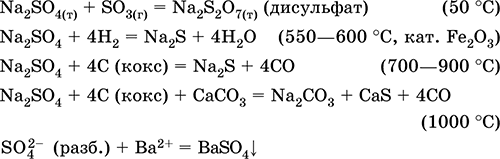
Kaliy gidroksidning KHSO 4. Nordon oksol tuzi. Oq, higroskopik, ammo kristalli hidratlar hosil qilmaydi. Issiq isitilganda eriydi va parchalanadi. Suvda yaxshi eriydi, anion eritmada ajralib chiqadi, eritma vositasi kuchli kislotaga ega. Bu gidroksidi bilan neytrallanadi.
Metallurgiyada, mineral o'g'itlarning ajralmas qismida oqsillarning bir qismi sifatida ishlatiladi.
Eng muhim reaktsiyalar tenglamalari:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (240 ° S gacha)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 ° S)
KHSO 4 (til.) + KOH (kons.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450-700 ° S)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° S, M = al, Cr)
Ishga kirishish: sovuqda (6% dan ortiq) sulfat kislota kaliy sulfatini davolash
K 2 SO 4 + H 2 SO 4 (kons.) = 2 KHSO 4
Kaltsiy sulfat CaSO 4. Tuzli Oq, juda higroskopik, refraktsion, kalsifikatsiya qilinganida parchalanadi. Tabiiy CaSO 4 juda keng tarqalgan mineral shaklida topilgan gips CaSO 4 2H 2 O. 130 ˚ C gips suvning bir qismini yo'qotadi va ichiga kiradi yonib ketgan gips2CaSO 4H 2O (texnik nom alabaster). To'liq suvsiz (200 ° C) gips minerallarga javob beradi anhidritCaSO 4. Suvda bir oz eriydi (2020 ° S da 0,206 g / 100 g H 2 O), qizdirilganda eruvchanlik pasayadi. H 2 SO 4 (kons.) Bilan reaksiya. Sintez paytida koks tomonidan qayta tiklanadi. Toza suvning "qattiq" qattiqligini aniqlaydi (qo'shimcha ma'lumot uchun, 9.2 ga qarang).
Eng muhim reaktsiyalar tenglamalari: 100-128 ° S
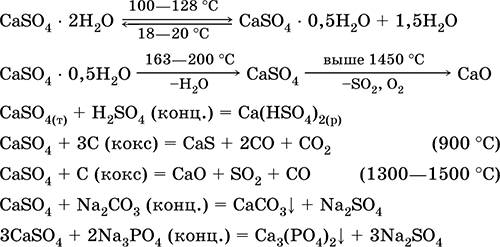
U SO 2, H 2 SO 4 va (NH 4) 2SO 4 ishlab chiqarishda xom ashyo sifatida ishlatiladi, metallurgiyada oqma, qog'oz to'ldiruvchisi. Kuydirilgan gipsdan tayyorlangan birikma ohaklari Ca (OH) 2 ga asoslangan aralashdan tezroq hosil bo'ladi. Qattiqlashish suv bilan birikib, tosh massasi shaklida gips hosil bo'lishi bilan ta'minlanadi. Gipsli gips gipslar, arxitektura va dekorativ shakllar va mahsulotlar, devor va paneli, toshli zovurlar uchun ishlatiladi.
Alyuminiy kaliy sulfat KAl (SO 4) 2. Ikkita qoshiq tuzi. Oq, gigroskopik. Kuchli issiqlik bilan ajralib turadi. Kristalli hidratlar shakllari - alumina kaliy alumini. Suvda o'rtacha darajada eriydi, alyuminiy kation bilan gidrolizlanadi. Alkalis, ammiak hidrat bilan reaksiyaga kiradi.
U matolarni bo'yash, terini terish, toza suv bilan tozalashda koagulant, qog'oz o'lchamlarini yaratuvchi kompozitsion komponentlar va tibbiyot va kosmetologiya sohasida tashqi gemostatik agent sifatida ishlatiladi. Bu alyuminiy va kaliy sulfatlarning birgalikda kristalizatsiyasi orqali hosil bo'ladi.
Eng muhim reaktsiyalar tenglamalari:
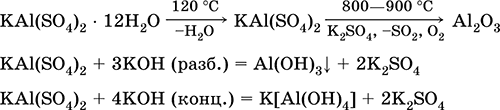
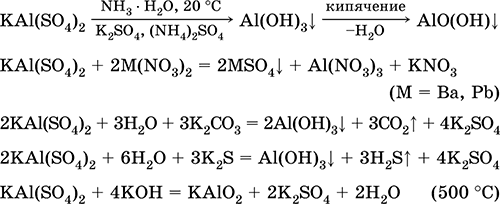
Krom (III) sulfat - kaliy KCr (SO 4) 2. Ikkita qoshiq tuzi. Qizil (quyuq binafsha hidrat, texnik nom kaliy alum). Issiqlikda eritmasdan ajralib chiqadi. Suvda osonlik bilan eriydi (eritmaning kulrang-ko'k rangi sucul suyuqlikning 3+ ga to'g'ri keladi), xrom (III) katyosida gidrolizlanadi. Alkalis, ammiak hidrat bilan reaksiyaga kiradi. Zaif oksidlovchi va kamaytiruvchi agent. U ion almashinuvi reaktsiyalariga kiradi.
Sifatli reaktsiyalar Cr 3+ ioni - Cr2 + ga pasayish yoki sariq CrOga 2- oksidlanish.
U terini terini ochish vositasi, matolarni bo'yashda mordan, fotosuratda reagent sifatida ishlatiladi. U krom (III) va kaliy sulfatlarning birgalikda kristalizatsiyasi orqali hosil bo'ladi. Eng muhim reaktsiyalar tenglamalari:
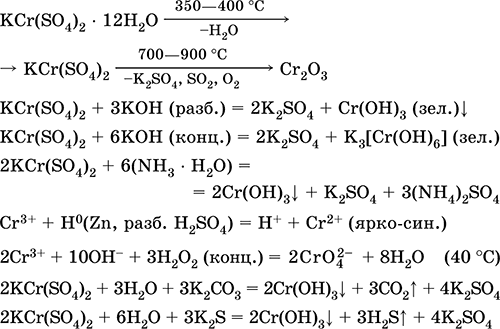
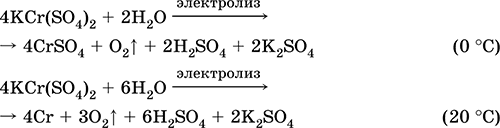
Marganets (II) sulfat MnSO 4. Tuzli Oq, kuydirilgan, eriydi va parchalanadi. Kristalli hidr MnSO 4 5H 2 O - qizil - pushti, texnik nom marganets vitriolasi. Suvda eriydi, eritmaning pushti rangli (deyarli rangsiz) rangi akkompleksga mos keladi; katyon tomonidan hidrolize qilingan. Alkalis, ammiak hidrat bilan reaksiyaga kiradi. Zaif kamaytiruvchi agent odatda (kuchli) oksidlovchi moddalar bilan reaksiyaga kirishadi.
Sifatli reaktsiyalar Mn 2+ ioniga - MnO4 ioni bilan almashinish va ikkinchisining binafsha rangi yo'qolishi, Mn 2+ ning MnO 4 ga oksidlanishi va binafsha rangning ko'rinishi.
Mikronutrient va analitik reagent sifatida Mn, MnO2 va boshqa marganets birikmalarini olish uchun ishlatiladi.
Eng muhim reaktsiyalar tenglamalari:
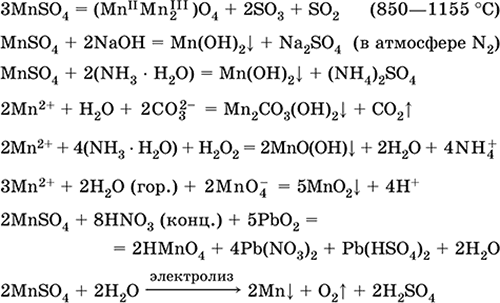
Qabul qilish:
2MnO 2 + 2H 2SO 4 (kons.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Temir (II) sulfat FeSO 4. Tuzli Oq (yorug'likni yashil, texnik nom temir vitriol),higroskopik. Isitgandan keyin ajralib chiqadi. Suvda eriydi, katektsiya bilan gidrolizlanadi. Havoda kislorod bilan tez eruvchan eritiladi (eritma sariqqa aylanib, bulutli bo'ladi). Kislota-oksidlovchi moddalar, gidroksidi, ammiak hidrat bilan reaksiyaga kiradi. Odatda kamaytirish agenti.
U mineral bo'yoqlarning tarkibiy qismi, galvanik elektrolitlar, yog'ochni saqlovchi, fungitsid, antiemiya preparati sifatida ishlatiladi. Laboratoriyada, odatda, er-xotin tuz Fe (NH 4) 2 (SO 4) 2 6H 2 O ( tuz mora) Havoga nisbatan ancha chidamli.
Eng muhim reaktsiyalar tenglamalari:
![]()
Qabul qilish:
Fe + H 2 SO 4 (qaror) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. VA-guruh metall bo'lmagan
Azot Ammiak
Azot - davriy tizimning VA-guruhi, ketma-ket raqami 7, VA-guruh elementi. Atomic elektron formulasi [2H] 2s 2 2p 3, Oksidlanish holatlarini 0, -III, + III va + V, kamroq + II, + IV boshqalar; N v holati nisbatan barqaror deb hisoblanadi.
Azotning oksidlanish o'lchovi:
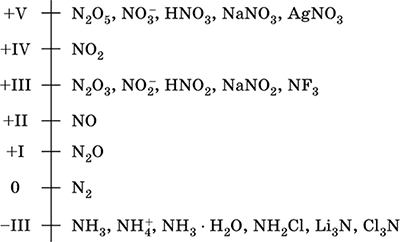
Azotning yuqori elektrodgativligi (3.07), F va O dan keyin esa uchinchi bo'ladi. Odatda metall bo'lmagan (kislotali) xususiyatlarni ko'rsatadi. Turli xil kislorodli kislotalar, tuzlar va ikkilamchi birikmalar, shuningdek NH 4 + ammoniy kationi va uning tuzlari hosil qiladi.
Tabiatda - o'n ettinchi kimyoviy tarqalish elementi (metall bo'lmaganlar orasida to'qqizinchi). Barcha organizmlar uchun muhim element.
Azot N 2. Oddiy modda. Bu juda barqaror bo'lmagan ko'p bo'lmagan bog'lanishli molekulalardan iborat bo'lib, bu N = N bo'lgan, bu normal sharoitlarda azotning kimyoviy inertligini tushuntiradi. Rangsiz, hidsiz rangsiz suyuqlikka aylanadi (O 2 dan farqli o'laroq).
Havoning asosiy komponenti: og'irligi bo'yicha 78,09%, og'irligi 75,52%. Suyuq havodan azot kislorod O 2 ustidan qaynatiladi. Suvda bir oz eriydi (15.4 ml / 1 l H 2 O 20 ° C), azotning piksellar sonini kisloroddan kamroq bo'ladi.
Xona haroratida N 2 faqat lityum (nam muhitda) bilan reaksiyaga kirishadi, lityum nitridi Li 3 N hosil qiladi, boshqa elementlarning nitridi kuchli isitish bilan sintezlanadi:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
Elektr deşarjida N 2 kislorod bilan juda kam darajada flor bilan reaksiyaga kirishadi:
Ammiak ishlab chiqarish uchun qaytariladigan reaksiya 350 ° S gacha bo'lgan bosim ostida 500 ° S da va katalizatorlar (Pt laboratoriyasida Fe / F 2 O 3 / FeO) mavjud bo'lishi shart.
Le Chatelier printsipiga muvofiq, ammiak rentabellikining ortishi bosimning oshishi va haroratning pasayishi bilan yuzaga keladi. Biroq, past haroratlarda reaktsiya tezligi juda past, shuning uchun jarayon 450-500 ° C darajasida amalga oshiriladi, ammiakning 15% hosil bo'lishiga erishiladi. Reaksiyaga etmagan N 2 va H 2 reaktorga qaytib, reaksiya darajasini oshiradi.
Azot kislotalar va alkalilerga nisbatan kimyoviy jihatdan passiv, yonishni qo'llab-quvvatlamaydi.
Ishga kirishish ichida sanoat - kimyoviy vositalar bilan, masalan, 2C (koks) + O 2 = 2CO reaktsiyasi bilan, suyuq havoni fraksiya distillash yoki havodan kislorodni ajratish. Bunday hollarda azot ishlab chiqariladi, bu ham nobel gazlarning aralashmalari (asosan argon) mavjud.
In laboratoriyalar Kichkina kimyoviy toza azot miqdorini o'rtacha isitish bilan kombinatsiyalashgan reaktsiya orqali olish mumkin:
N -III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60-70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
U ammiak, azot kislotasi va boshqa azot tarkibidagi mahsulotlarni kimyoviy va metallurgiya jarayonlari va yonuvchan moddalarni saqlash uchun inertsiz muhit sifatida sintez qilish uchun ishlatiladi.
Ammiak NH 3. Ikkilik birikma, azot oksidlanish darajasi - III. O'tkir xarakterli hidli rangsiz gaz. Molekulyar tugallanmagan tetraedr [[N (H) 3)] (sp 3 gib-hibridizatsiyasi) ning tuzilishiga ega. Sp 3 - gibrid orbitadagi elektron donor juftligi NH 3 molekulaidagi azotning mavjudligi vodorod katyonining xarakterli qo'shimcha reaktsiyasiga olib keladi, bu esa katyarning hosil bo'lishi ammiak NH 4 +. Xona haroratida bosim ostida suyultiriladi. Suyuq holatda vodorod bog'lanishlari bilan bog'liq bo'ladi. Termal jihatdan beqaror. Suvda eriydi (20 ° C da 700 L / l L H 2 O dan ortiq); to'yingan eritmadagi nisbati = 34% massa va = 99% gacha, pH = 11,8 ni tashkil qiladi.
Yuqori reaktiv, qo'shimcha reaktsiyaga moyil. Kislorodda paydo bo'ladi, kislotalar bilan reaksiyaga kirishadi. U (N -III tufayli) va oksidlanishni (H I) xususiyatlarini kamaytiradi. Faqat kaltsiy oksidi bilan quritilgan.
Sifatli reaktsiyalar - Hg 2 (NO 3) 2 eritmasi bilan nordonlangan gazning qorayishi, gazli HCl bilan aloqa qilishda oq "tutun" shakllanishi.
HNO3 va ammoniy tuzlari sintezida oraliq mahsulot. Soda, azotli o'g'itlar, bo'yoqlar, portlovchi moddalarni ishlab chiqarishda ishlatiladi; suyuq ammiak suyuqlikdir. Zaharli.
Eng muhim reaktsiyalar tenglamalari:
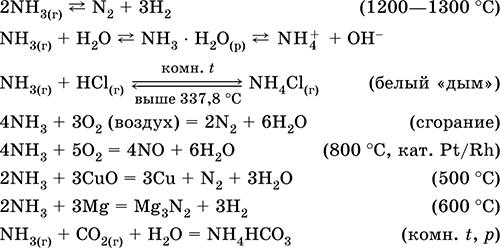
Ishga kirishish: In laboratoriyalar - sodali ohakli (NaOH + CaO) qizdirilganda ammiakning ammoniy tuzlaridan eritmasi:
yoki ammiakning suvli eritmasidan qaynatiladi, keyinchalik gazni quritadi.
In sanoat ammiak azot (vd) dan vodorod bilan sintezlanadi. Sanoat tomonidan suyultirilgan shakldagi yoki texnik nom ostida konsentrlangan suvli eritma shaklida ishlab chiqariladi ammiak suvi.
Ammiak gidroati NH 3 H 2 O. Molekulalararo birikma. Oq, kristall panjarada NH 3 va H 2 O molekulalari bor, ular zaif vodorod bog'lanishi bilan H 3 N ... HON. Ammiakning suvli eritmasida, zaif bazasi (dissosiatsiya mahsuloti - NH 4-chi kation va OH anioni) mavjud. Ammoniy kationining muntazam p-tetrahedral tuzilishi (sp 3 - hibridizatsiya) mavjud. Issiqlik bilan qarama-qarshilik, eritmani qaynatish orqali butunlay parchalanadi. Kuchli kislotalar tomonidan zararsizlantiriladi. Konsentrlangan eritmaning xususiyatlarini kamaytiradi (N III tufayli). U ion almashinuvi va komplekslashning reaktsiyasiga kiradi.
Sifatli reaktsiya - gazli HCl bilan aloqa qiluvchi oq "tutun" hosil bo'lishi.
Amfoterik gidroksidlarning yog'ingarchilik vaqtida eritmada zaif gidroksidi muhit yaratish uchun ishlatiladi.
1M ammiak eritmasi asosan NH3H2O hidrat va faqat 0,4% NH 4 + va OH - ionlarini (gidratning ajralishi natijasida) o'z ichiga oladi; shuning uchun ionning "ammoniy gidroksid NH 4 OH" eritmasida deyarli mavjud emas, qattiq hidratda bunday birikma yo'q. Eng muhim reaktsiyalar tenglamalari:
NH 3 H 2 O (kons.) = NH 3 + H 2 O (NaOH bilan qaynatish)
NH3H2O + HCl (dec.) = NH4Cl + H2O
3 (NH3H2O) (conc.) + CrCl3 = Cr (OH) 3 ↓ + 3NH4Cl
8 (NH3H2O) (kons.) + ZBr 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40-50 ° S)
2 (NH3H2O) (kons.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH3H2O) (kons.) + Ag 2 O = 2OH + 3H 2 O
4 (NH3H2O) (kons.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH3H2O) (kons.) + NiCl2 = Cl2 + 6H2O
Seyyultirilgan ammiak eritmasi (3-10% - vaqt) ko'pincha deyiladi suyuq ammiak (nom alhemchilar tomonidan kashf qilindi) va konsentrlangan eritma (18,5-25%), ammiak suvi (sanoat tomonidan ishlab chiqarilgan).
