Polovično. Faze oksidacije žvepla v rastlinah. Formule polkroga. Sirka. Obkrožitev. sulfid
Sirka, njena fizikalna in kemična moč. Biološki pomen sirka, її zastosuvannya (demerkurizacija).
Žveplo v naravi
domača sirka
PbS - svinčeni blisk
Cu 2S- midny blisk
ZnS - cinkova mešanica
FeS 2 - pirit, sirčanski pirit, mačje zlato
H 2S- obtočna voda (v mineralnih vodah in zemeljskem plinu)
CaSO 4*2H2O- mavec
MgSO 4*7H2O- gіrka sіl (angleščina)
Na 2 SO 4 * 10 H 2 O- Glauberjeva moč (mirabilit)
Fizična moč
Trden kristalni govor rumene barve, nerazločen v vodi, voda ne urinira (plava na površini), t ° kip = 445 ° С.
Ena od posebnih fizičnih moči sirke -flotacija, Zgradba zrnatega prahu sirke se razblini, nato pa se kot njeni veliki kristali potopijo v vodo. Na desni v tem, da sirka ne urinira z vodo, njeni delci pa so obrezani na površini vode za rahunke, ki so se nanje prilepile suhe čebulice.Tse vlastivist vikoristovuyut in vіddіlennі native іrki vіd domіshok. Rudo zdrobijo, prelijejo z vodo, od spodaj pa jih vsake toliko prepihnejo, sirko odcedijo, hiše pa pustijo en dan.alotropija
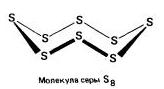
Za sirko je značilna papalina alotropnih modifikacij, in najpogostejši pogledi:rombična (kristal) , monoklinika(Golchasta) і plastike .
rombična (a - sirka) - S8
t ° pl. = 113°C; str \u003d 2,07 g / cm 3. Največja modifikacija.
Monoklinika (b - sirka) - S8
temno rumene glave, t ° pl. = 119°C; str = 1,96 g/cm3. Stojite pri temperaturi nad 96 ° C; pri divjih glavah se spremeni v romb.
Plastični S n
rjava humanoidna (amorfna) masa. Nestle, ko se strdi, se spremeni v romb.
ODSTRANITEV PLASTIČNEGA CIRCA
Budova atom Sirki
Porazdelitev elektronike po ravneh in podravneh
glavni mlin
1s 2 2s 2 2p 6 3s 2 3p 4
Distribucija elektronike po
orbitale (preostala kroglica)koraki
oksidacijavalenca
V glavnem
Prvi tabor prebujanja
Še en tabor prebujanja
otrimannya sirki
1. Promissory metoda - taljenje rude za dodatno vodno paro.
2. Nepopolnoma oksidirana sіrkovodnya (ko ni dovolj kislo).
2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Wakenroderjeva reakcija
2H 2 S + SO 2 \u003d 3S + 2H 2 O
Kemija moči sveta
Sirka - oksidant S 0 + 2→S-2 | Sirka - vodnik: S - 4 g→ S+4; S - 6 g→ S+6 |
1. Medsebojno sodelovanje zіusima s kositrom in luzhnozemeljnimi kovinami, middu, živo srebro, srіblombrez ogrevanja: 2 Na+S→ Na 2 S DOSVID S + Hg = HgS Živo srebro je zelo hlapno. Ne stavi. Ta reakcija je osnova za uporabo živega srebra, na primer iz zlomljenega medicinskega termometra. Kraj, iz katerega je nemogoče potegniti kapljice živega srebra, da bi cvrčal z vrtinčnim prahom. Sirka in živo srebro vstopita v reakcijo, ko sta zaprta. Posledično se vzpostavi kemično inerten in nevarčen govor. Ta proces se imenuje demerkurizacija 2. Medsebojno sodelovanjec druge kovine (krim Au, Pt) pri premikanju t °: 2Al + 3S t → Al2S3 Zn+S t
°
→
ZnS DOSVID Cu+S t
→
CuS DOSVID 3. Interakcija Sirki zs pravimi nekovinami binarni spoluk: H2+S→ H 2 S 2P+3S→ P 2 S 3 C+2S→ CS2 | 1. Interakcija sirke s kislim: S+O2 t ° → S +4 O 2 2 S + 3 O 2 t°; pt → 2 S +6 O 3 2. Medsebojno sodelovanjec halogeni (smetana do joda): S + Cl2→ S +2 Cl 2 ** Medsebojno sodelovanjekisline - oksidanti: S + 2H 2 SO 4 (konc.)→ 3S +4 O 2 + 2H 2 O S + 6HNO 3 (konc.)→ H 2 S + 6 O 4 + 6NO 2 + 2H 2 O ** Nesorazmerne reakcije: 4. 3S0 + 6KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
zastosuvannya
Vulkanizacija gume, odstranjevanje ebonita, obdelava žveplove kisline, smodnika, v boju proti shkidnikom kmetijskega stanja, za medicinske namene (sirčani mazilo za zdravljenje kožnih bolezni), za zdravljenje žveplove kisline itd.
Domača nalogaodstavek 21; desno 1, 3, 4 strani. 99-100.
dopolnilna gradnja
Končaj izenačenje reakcij, r Koeficiente nastavite z metodo elektronskega ravnotežja, navedite oksid, vodo.
št. 2. Ustvarite transformacijo za shemo:
Tse tsikavo ...
- Količina mleka v telesu osebe, ki tehta 70 kg - 140 g.
- Dobu ljudje potrebujejo 1 g sirke.
- Siroy bogat grah, kvasola, bela plastika, pšenica, meso, ribe, sadje in mango.
- Sirka za vstop v skladišče hormonov, vitaminov, beljakovin, vode v hrustancu, v laseh, nohtih. Ko v telesu primanjkuje sirke, se pojavi jok nohtov in ščetk, izpadanje las.
Poskrbite za svoje zdravje!Ti veš..
- Polovica sirke lahko služi kot zdravilni pripravki;
- Sirka - osnova mazila za zdravljenje glivičnih bolezni kože, za boj proti krastam. Natrijev tiosulfat Na 2S2O3 boj proti njej.
- Bogate soli žveplove kisline in vode za upočasnitev kristalizacije: ZnSO 4 × 7H 2 O in CuSO 4 × 5H 2 O. Njihov zastosovuyt kot antiseptik zasobi za obraskuvannya roslin in izbokline žita v boju proti skіdniks podeželskega stanja.
- Zimski vitriol FeSO 4×7H2 O vikorist z anemijo.
- BaSO4 zastosovuyt z radiografskimi ugotovitvami kanala in črevesja.
- Aluminij kalijev galon KAI (SO 4) 2×12H2 O - krvno-spinalni zasib v poroznosti.
- Mineral Na 2 SO 4 × 10H 2 O nosite ime "Glauberjeva moč" v čast odkritju nemškega kemika Glauberja I.R. Nisem imel trenutka, da bi kaj pojedel; Eden od mestnih prebivalcev kaže jogo na džerel. Tako kot le nekaj vin, ko sem spil girko slane vode, sem jo takoj zasadil. Glauber je končal vodo, iz nje je kristalizirala moč Na 2 SO 4 × 10H 2 O. Okužba її zastosovuyut kot ročna prtljaga v medicini, ko napolnite bombažne papirnate tkanine. Močno je tudi poznati stagnacijo v skladiščnem skladišču.
- Drevo lahko spodbuja gradnjo od tal do tal in spodbuja glinenje elementa iz susidnih ros.
- Urar je videl govor - albucid, їdke z'єdnanny sirki. Tsya govor se bori proti raku, dviguje stare, pred boleznijo srca.
V podskupino halkogenov spada sirka - drugi element, ki gradi veliko število rodov rude. Zelo razširjeni so tudi sulfati, sulfidi, oksidi in druge polbarve, pomembne v industriji in naravi. Zato lahko v tem članku vidimo, kakšen je smrad, kaj je sama sirka, je samo govor.
Sirka in njena značilnost
Ta element ima lahko enak položaj v periodnem sistemu.
- Šosta skupina, glavna podskupina.
- Tretje manjše obdobje.
- Atomska masa - 32,064.
- Zaporedna številka je 16, protoni in elektroni so prav tako 16.
- Dvignite se do nekovinskih elementov.
- V formulah se bere, kot "eu", ime elementa je sirka, latinsko žveplo.
V naravi obstaja vrsta stabilnih izotopov z masnimi števili 32,33,34 in 36. V naravi je najbolj razširjen danski element. Da bi dosegli biogene elemente, torej kako vstopiti v skladišče pomembnih organskih molekul.
Elektronski atom Budova
Pol ducata golše pojasnjuje svoje razlike v značilnostih elektronskega življenja atoma. Izraža se z žaljivo formulo konfiguracije: 1s 2 2s 2 2p 6 3s 2 3p 4.
Urejanje stvari je več kot stacionarna postaja elementa. Vendar je očitno, da bi atomu prinesli dodatno energijo, potem je mogoče razpršiti elektrone na 3p in 3s-pogone z oddaljenim chervish prehodom v 3d, ki ostane prost. Posledično se ne spremeni samo valenca atoma, temveč vse možne oksidacijske stopnje. Število govorov se občutno poveča, tako kot število različnih govorov za sodelovanje sirke.
Faze oksidacije žvepla v rastlinah
Ogledate si lahko kopijo glavnih možnosti za ta zaslon. Za sirka tse:
Od teh je najbolj redko viden S +2, ostale vrtnice pa so povsod. Stopnja oksidacije sirke v tleh je kemična aktivnost in oksidacijska zgradba celotnega govora. Tako, na primer, z'ednannya s -2 - ce sulfid. Nanje gledamo kot na tipičen oksidacijski element.
Višja kot je vrednost stopnje oksidacije v tleh, bolj izrazite oksidacijske lastnosti bodo vodile govor. Nekdo se zlahka zmoti, da lahko uganeš dve bazični kislini, ki naredita sirko:
- H 2 SO 3 - sirčist;
- H 2 SO 4 - Sirchan.
Zdi se, da ostaja bogato stabilen, močnejši, da energija pri visoki koncentraciji še bolj resno gradi na oksidacijo.
preprost govor
Kakor je preprost govor sirke, je rumen, lep kristal enake, pravilne, prijazno oblikovane oblike. Če želite samo eno od treh oblik, potem obstajata dve glavni vrstici govora. Persha, monoklinična in rombična - ce in zhovte je nemogoče gojiti v bližini vode, ampak le v ekoloških prodajalcih. Krykhkistyu in čudovita oblika strukture, ki jo predstavlja videz krone, sta osupljiva. Tališče je blizu 110 0 C.
Če pri segrevanju takšne modifikacije ne zamudite naslednjega trenutka, lahko takoj pokažete še en mlin - plastični obroč. Vaughn je humana, viskozna barva rjave barve, ki se ob nadaljnjem segrevanju ali ostrem hlajenju spet spremeni v rombično obliko.
Če govorite o kemično čistem sirki, odrezanem s potjo filtracije bagatorasis, potem gre za svetlo rumene majhne kristale, tenditnі in zovsіm nerazchinnі v vodi. Zdatni se ukvarjajo s stikom z vodo in kislim vremenom. Vіdrіznyayutsya za doseganje visoke kemične aktivnosti.

Znanje v naravi
V naravi rastejo naravni rodovi, iz katerih se vidi polovično in odmaknjeno kot preprost govor. Poleg tega se bo maščevala:
- v mineralih, rudah in gorskih kamninah;
- v organizmih bitij, roslin in ljudi, da bi vstopili v skladišče bogatih organskih molekul;
- v zemeljskih plinih, nafti in vugill;
- v oljnem skrilavcu in naravnih vodah.
Ali lahko naštejete nekaj najbogatejših mineralov na svetu:
- cinobar;
- pirit;
- sfalerit;
- antimonit;
- galena in drugi.
Velik del začinjene sirke je na virobnitstvu žveplove kisline. Še en del je zmagovit za medicinske namene, stanje v državi, industrijske procese za proizvodnjo govorov.
Fizična moč
Lahko opišete, koliko točk.
- V vodi ni drugače, v ogljikovem disulfidu ali terpentinu – dobro je biti drugačen.
- Pri trivialnem drgnjenju se nabere negativni naboj.
- Tališče postane 110 0 C.
- Temperatura vrelišča 190 0 C.
- Ko doseže 300 0 C, preide na podeželje, zlahka se drobi.
- Čisti govor še bolje gradi samozaposlenost vnetljivo moč.
- Sam po sebi vonj praktično ni mogoč, vendar čez dan sirki vidijo oster vonj po gnilih jajcih. Tako gre, kot in deyakі plinom podobni binarni predstavniki.
Fizična moč tega govora je bila ljudem znana že od nekdaj. Sirka je zaradi svoje vnetljivosti prevzela tako ime. V vojnah so zmagovale zadušljive in goreče viparske zmage, kot da so nastale pri sežiganju rastline, kot da bi se boril proti sovražnikom. Poleg tega je kislina za usodo sirke tudi vodja malega pomembnega zadolžnega pomena.

Kemična moč
Tema: "Sirka in її spoluky" v šolskem tečaju kemije ne traja ene lekcije, ampak kilko. Adzhe jih še bogatejši. To je razloženo s kemično aktivnostjo tega govora. Lahko pokaže tako okside moči z močnejšimi sredstvi (kovine, bor in drugi), kot tudi z več nekovinami.
Vendar pa ne glede na takšno dejavnost, le s fluorom interakcije gredo z velikimi umi. Za vse ostale je potrebno ogrevanje. Označite lahko nekaj kategorij govorov z nekakšno ustvarjalno igro:
- kovina;
- nemetalci;
- travniki;
- močne oksidacijske kisline - sirčan in dušikova.
Pol sirka: drugačen
Raznolikost le-teh bo razložena z neenakimi vrednostmi stopnje oksidacije glavnega elementa - sirka. Torej lahko vidite papalino glavnih vrst govorov za ta znak:
- z'ednannya zі stopnja oksidacije -2;
No, če pogledate razred in ne indikator valence, potem ta element ustvarja takšne molekule, kot so:
- kisline;
- oksid;
- sol;
- binarne plošče z nekovinami (premogov sulfid, kloridi);
- organski govori.
Zdaj pa si poglejmo glavne in jih dobro izkoristimo.

Govor s stopnjo oksidacije -2
Ekipe kroga 2 - vse konformacije s kovinami, pa tudi z:
- premog;
- voda;
- fosfor;
- silicij;
- mish'yak;
- bor.
V tem razpoloženju deluje kot oksidant, tako da so vsi elementi pretirano zaščiteni in so bolj elektropozitivni. Oglejmo si najpomembnejše od njih.
- Sirkovooglets - CS 2. Prozora domovina z značilno sprejemajočo aromo po etru. Є strupena, vnetljiva in vibuhaє z govorom. Vykoristovuetsya kot trgovec na drobno, poleg tega za več vrst olj, maščob, nekovin, srebrovega nitrata, smol in gume. Prav tako je pomemben del izdelave kosovnega šiva - viskoze. V obrtništvu se sintetizira v velikih kulturah.
- Sirkovoden ali sulfidna voda - H 2 S. Plin, ki ne more biti zabarvlennya in sladki koren za uživanje. Vonj je oster, zelo nesprejemljiv, spominja na gnilo jajce. Otruyny, ignorira dichal center, zato se zdi, da so midi. Temu, ko se zlomi, pride do zadušitve in smrti. Široko se uporablja v medicini, v organski sintezi, pri proizvodnji žveplove kisline in tudi pri kakovosti energijsko bogatega sirovina.
- Kovinski sulfidi se pogosto uporabljajo v medicini, pri proizvodnji žveplove kisline, otrimann farb, pri pripravi luminoforjev in drugih aplikacijah. Formula je Me x S y.

Z'ednannya s stopnjo oksidacije +4
Spoki sirki 4 - tse pomemben oksid i vіdpovіdnі yomu soli in kisline. Ves smrad je treba zaključiti s širokimi ploščami, ki imajo lahko v industriji en pomen. Lahko delujejo kot oksidanti, vendar pogosteje kažejo moč avtoritete.
Formule z razpolovno dobo s stopnjo oksidacije +4 napredujejo:
- oksid - žveplov plin SO 2;
- kislina - žveplo H 2 SO 3;
- soli lahko dajo splošno formulo Me x (SO 3) y.
Eden najpogosteje uporabljenih je anhidrid. Vin je brezbarvni govor, ki diši po goreči sireni. V velikih druženjih nastane ob izbruhih vulkanov, jogo je trenutno enostavno prepoznati po vonju.
Raztopi se v vodi z raztopino, ki zlahka razprši kislino - žveplovo kislino. Obnašanje, kot tipična utvoryuє soli, v yakі vstopijo ob pogledu na sulfit-ion SO 3 2-. Zei anhidrid je glavni plin, ki se vlije v neprijetno atmosfero. Isto vino lije v luč
Z'ednannya, pri kateri ima sirka stopnje oksidacije +6
Pred tem lahko vidimo najprej sirhanin anhidrid in sirhanovo kislino z njenimi solmi:
- sulfati;
- hidrosulfati.
Ker je atom sirke v njih v nadjezikovni oksidaciji, je moč teh popolnoma razumljena. Smrdi so močni oksidanti.
Žveplov oksid (VI) - sirchany anhidrid - je leteča brezbarvnu domovina. Za riž je značilna močna zgradba, ki vpija vlago. Dimit na prostem. Ko ga razredčimo v vodi, damo eno najmočnejših mineralnih kislin - sirchan. Koncentracija rozčin je pomembna oljnata rahlo rumenkasta domovina. Če se v žveplovi kislini nahaja anhidrid, potem bo to še posebej z'ednannya, imenovano oleum. Vіn vikoristovuєtsya v trgovini s proizvodnjo kisline.
Med solmi - sulfati - je lahko velika vrednost enaka, kot so:
- mavec CaSO 4 2H 2 O;
- barit BaSO 4;
- mirabilit;
- svinčev sulfat in drugi.
Smrad pozna zastosuvannya v vsakdanjem življenju, kemični sintezi, medicini, pri pripravi optičnih naprav in očal ter navdihuje živilsko industrijo.
Hidrosulfati se pogosto uporabljajo v metalurgiji in de-vikorati kot fluks. In tudi sam smrad pomaga pri prevajanju bogato zloženih oksidov v različne sulfatne oblike, ki so zmagovite v različnih sortah.
Vivchennya sirka v šolskem tečaju kemije
Če je bolj verjetno, da bodo znanstveniki pridobili znanje o tistih, ki so taka sirka, yakі її avtoritete, kaj sirka predstavlja? 9. razred - najslabše obdobje. Ni storž sam, če je otrokom vse novo in neznano. To je srednja točka v razvoju kemijske znanosti, če bodo temelji, postavljeni prej, pripomogli k boljšemu razumevanju teme. Zato se na prvi pogled ti obroki sami po sebi vidijo kot prijatelj maturantskega razreda pivrichchya. S tem je celotna tema razdeljena na nekaj blokov, v tem primeru je lekcija "Z'ednannya sirki. 9. razred" v nekaterih primerih.
To je razloženo z njihovim številom. Ogledamo si tudi hrano o proizvodnji žveplove kisline v industriji. Na splošno bo ta tema predstavljena sredi 3. letnika.
In os sirke je za izobrazbo kriva šele v 10. razredu, če se gleda na prehranjevanje z organskimi snovmi. Muči se tudi smrad po biologiji v višjih razredih. Starost Sirka za vstop v skladišče organskih molekul, kot so:
- tioalkohol (Merkaptani);
- beljakovine (struktura mrežnice, na kateri lahko tvorite disulfidne lise);
- tioaldehid;
- tiofenoli;
- tioferi;
- sulfonske kisline;
- sulfoksid in drugi.
Vidijo se kot posebna skupina organožveplovih spojin. Smrad je lahko pomemben ne le v bioloških procesih živih bitij, ampak tudi v industriji. Na primer, sulfonske kisline so osnova številnih zdravilnih pripravkov (aspirin, sulfanamid ali streptocid).
Poleg tega je hitra sirka komponenta takega z'ednana, kot je deyak:
- amino kisline;
- fermenti;
- vitamini;
- hormoni.
Pri sobni temperaturi žveplo vstopi v reakcije samo z živim srebrom. Z dvigom temperature se aktivnost znatno poveča. Sirka pri segrevanju neselektivno reagira z bagatmo preprostih govorov, z malo vina inertnih plinov, dušika, selena, telurija, zlata, platine, iridija in joda. Sulfid v dušik in zlato se odvaja po posredni poti.
Interakcija s kovinami
Sirka kaže okside moči, posledično se v medsebojni igri vzpostavijo sulfidi:
Interakcija z vodo vidbuvaetsya pri 150-200 ° С:
H 2 + S = H 2 S.
Interakcija s Kisnemom
Gori pri kisli pri 280 ° C, na ognju pri 360 ° C, pri čemer se ugotovi vsota oksidov:
S + O 2 \u003d SO 2;
2S + 3O 2 \u003d 2SO 3.
Interakcije s fosforjem in premogom
Ko se segreje brez dostopa, sirka reagira s fosforjem, ogljikom in kaže moč oksida:
2P + 3S = P 2 S 3;
Interakcije s fluorom
Prisotnost močnih oksidantov kaže pomembno moč:
S + 3F 2 = SF 6.
Interakcija z zložljivimi govori
Pri povezovanju z zložljivimi govori se sirka uporablja kot vodnik:
S + 2HNO 3 \u003d 2NO + H 2 SO 4.
nesorazmerna reakcija
Sirka zdatna pred reakcijo nesorazmerja, pri interakciji s travnikom se usedajo sulfidi in sulfiti:
3S + 6KOH \u003d K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. otrimannya sirki
Z avtohtone rude
Pri segrevanju pirita brez dostopa zraka
FeS 2 \u003d FeS + S.
Oksidirana sirvodnja z neobarvano kislo
2H 2 S + O 2 \u003d 2S + 2H 2 O.
3 plini, ki vstopijo v metalurške in koksarne, ko se segrejejo v prisotnosti katalizatorja
H 2 S + SO 2 \u003d 2H 2 O + 3S.
1.8. dan cirkusa
Vodnev z'ednannya sirka - dan cirkusa H 2 S . Obkrožitev je kovalentna vez. Molekula vode je podobna molekuli vode, atom sirke je v stanju sp 3-hibridizacije, protein na vodi v molekuli vode ne tvori vodnih vezi med seboj. Atom sirke je manj elektronegativen, nižji atom je kisel, večja je ekspanzija in posledično manjši naboj. Valenčni rez HSH postane 91,1 °, dolžina povezave H - S doseže 0,133 nm.
Fizična moč
V primeru normalnih umov je obtočni dan plin brez sodov, z močnim značilnim vonjem po gnilih jajcih. T pl \u003d -86 ° C, T kip \u003d -60 ° C, gnilo v vodi, pri 20 ° C 2,58 ml H 2 S porazdelimo v 100 g vode. V naravi ga vidimo v skladiščih vulkanskih plinov, usede se z razpadom rastočih in živih organizmov. Prijazno razmažem po vodi, med širjenjem naredim šibko sirkovodno kislino.
Kemična moč
V vodi ima lahko vodni cikel moč šibke dvobazične kisline:
H 2 S \u003d HS - + H +;
HS - \u003d S 2 + H +.
Sirkovoden gori na nebu blakytnym polum'yam. S posredniškim dostopom se bo ponovno vzpostavil brezplačno:
2H 2 S + O 2 \u003d 2H 2 O + 2S.
V primeru nadzemnega dostopa je treba goro sirkovodnja pripeljati, dokler se ne raztopi z žveplovim oksidom (IV):
2H 2 S + 3O 2 \u003d 2H 2 O + 2SO 2.
Obkrožitev lahko prinese moč. Odpadna voda se v vodi lahko oksidira v žveplo, žveplov plin in žveplovo kislino.
Na primer, vino ne vsebuje bromove vode:
H 2 S + Br 2 \u003d 2HBr + S.
interakcija s klorovo vodo:
H2S + 4Cl2 + 4H2O \u003d H2SO4 + 8HCl.
Strumine je mogoče žgati z nadomestnim svinčevim dioksidom, saj reakcijo spremljajo velike vizije toplote:
3PbO 2 + 4H 2 S \u003d 3PbS + SO 2 + 4H 2 O.
Medsebojno sodelovanje z žveplovim plinom vikoristovuetsya za pridobivanje žveplovega plina, ki vključuje metalurško proizvodnjo in proizvodnjo žveplove kisline:
SO 2 + 2H 2 S \u003d 3S + 2H 2 O.
S tem procesom je bilo povezano z osvetlitvijo avtohtone sirke med vulkanskimi procesi.
Z enournim prehodom žveplovega plina in krožeče vode se tiosulfat vzpostavi skozi odprtino travnika:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Obkrožitev z normalnimi mislimi je neploden in celo strupen plin z značilnim vonjem po gnilih jajcih.
Za jogo, v laboratorijskih mislih, začnite dodajati razredčeno klorovodikovo kislino sulfidu:
Drug način za odstranitev sir-vode je dodajanje hladne vode aluminijevemu sulfidu:
Obkrožitev, vzeta na ta način, se zdi čistejša.
Obkrožitev je kovalentna vez. Te molekule imajo ukrivljeno strukturo, podobno strukturi molekul vode (razdelek 2.2). Vendar na površini vode molekule vode med seboj ne tvorijo vodnih vezi. Na desni, v tem, da je atom sirke manj električno negativen, je spodnji atom kisel, vendar je atom večji. Zato je atom sirke lahko bogato manj nabit, atom je kisel. Skozi prisotnost vode zv'yazkіv sirkovodny lahko zniža temperaturo vrenja, nižje vode. Prisotnost vodnih zvokov v sirkovodnih razlagamo na enak način kot gnilobo v vodi.
V vodi ima lahko vodni cikel moč šibke dvobazične kisline:
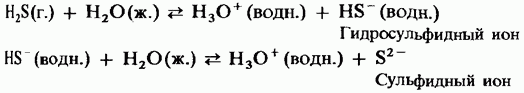
Obkrožitev gori sredi črnih pol-luč. Z vmesnim dostopom gorski zrak spremljajo vizije prostega zraka, ko se kondenzira na hladni površini plovila:
V primeru dostopa do sveta ponovite gorski dan dneva, da proizvedete žveplov dioksid, dokler se ne raztopi:
Obkrožitev lahko prinese moč. Vino na primer pretvori bromovo vodo in spremeni ione v ione
Obkrožitev kot dvobazična kislina lahko vsebuje dve vrsti soli - sulfidne in hidrosulfidne (div. Vishche). Sulfidi lužnih kovin se nahajajo v vodah lužnih kovin. Tse vydbuvaetsya kot posledica hidrolize:
Nerafinirani sulfidi drugih kovin se lahko oborijo iz vodnih dispergiranih soli teh kovin, ki prehajajo skozi sulfid drugih kovin. Na primer, ko gredo sirkovodnya skozi razpoke, da bi se jim maščevali, poravnajo črno obleganje sulfida
Tsya reakcija vikoristovuєtsya v obliki analitičnega testa za dan.
kisikov oksid
Sirka utvoryu kalčki oksidi, med njimi sta lahko najpomembnejša dva: sirka dioksid in sirka trioksid
Sirka dioksid je alkalni plin brez sodov z ostrim, zadušljivim vonjem. V laboratorijskih mislih lahko jogo odvzamemo, sežgemo žveplo v prahu ali v kislini, dodamo toplo razredčeno kislino v nekakšno sulfitno sol ali segrejemo koncentrirano žveplovo kislino v sredini:
Dioksid žveplovega kislinskega oksida. Vin se zlahka razprši z vodo, zaradi česar je žveplova kislina. Tsya kislina ionizira manj pogosto in je potem šibka kislina:
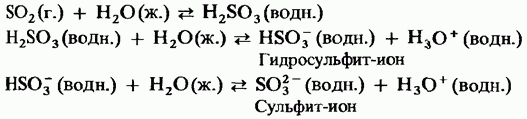
Ko plinasto podoben žveplov dioksid prehajamo skozi natrijev hidroksid, se natrijev sulfit raztopi. Natrijev sulfit, ki reagira s presežkom žveplovega dioksida, raztopi natrijev hidrosulfit in reagira podobno kot reakcija ogljikovega dioksida z vodo bombažnih semen.
I plinu podoben dioksid sirka, in yogo voda rozchin є vіdnovnikami. Na primer, plinu podoben žveplov dioksid je oksid z raztopljenim sulfatom, žveplova kislina pa je spojina -ion-ion
Žveplov dioksid se v industrijskih glavah odstranjuje, ko se nahaja na površini žveplove ali sulfidne rude, vikorist pa je vmesni produkt v procesu odstranjevanja žveplove kisline (razdelek 7. poglavje). Sirka dioksid se uporablja v celulozni industriji, za proizvodnjo tekstila, pa tudi za predelavo sadja in zelenjave z nepomembno letino.
Žveplov dioksid ima pomembno vlogo v fermentirani atmosferi in predvsem pri osvetljevanju kislega lesa. V ozračju se vina oksidirajo v žveplov trioksid:
Pri normalnih mislih ta proces poteka pravilno, vendar ga je v prisotnosti vinskega katalizatorja mogoče znatno zmanjšati, podobno kot se uporablja v kontaktnem procesu za odstranjevanje žveplove kisline. Majhna količina soli in mangana, ki sta prisotna v ozračju, lahko katalizira oksidacijo žveplovega dioksida. Raztopina trioksida ponovno reagira z vodo in zato se kaže mračnost, saj nosi kisle lese (razdel. Tudi pogl. 12).
Trden žveplov trioksid je polimorfna spojina. Dve najpomembnejši obliki Persha med njimi sta trimeri s ciklično strukturo (slika 15.24, a); prozorni kristali. ima lahko aciklično polimerno strukturo (slika 15.24, b); je ob pogledu golchastih kristalov. temperatura taljenja. V prisotnosti vode se korak za korakom spremeni v oblike Obidvi in vre pri 45 ° C. Hlapi žveplovega trioksida nastanejo iz izoliranih simetričnih ravnih molekul.
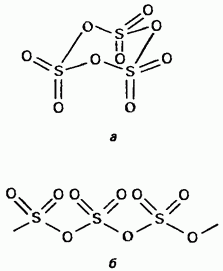
Mal. 15.24. Cirkazijev trioksid, aciklična struktura, b - aciklična struktura.
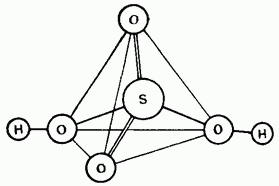
Mal. 15.25. Struktura molekule žveplove kisline.
V laboratorijskih glavah se žveplov trioksid izloča s segrevanjem sulfata
Sіrky trioksid ima lahko močno izraženo kislo moč. Vino eksotermno reagira z vodo in gasi žveplovo kislino:
Sirka trioksid je močan oksidant. Na primer, vino oksidira vodikov bromid v prosti brom.
Sirhanova kislina
Žveplova kislina je brezbarvna oljna kislina. To je eden najpomembnejših industrijskih kemičnih izdelkov. Njeno promyslové otrimannya za dodaten kontaktni postopek in zastosuvannya, opisano v pogl. 7.
Nerazredčena žveplova kislina je kovalentna spojina. Njene molekule so lahko tetraedrične Budov (slika 15.25).
Žveplova kislina vre in razpade pri 340 ° C, gasi žveplov trioksid in vodo
Temperatura vrelišča je visoka in viskoznost žveplove kisline je visoka, verjetno zaradi prisotnosti vodnih vezi med atomi vode in atomi kisline susidnіh molekul.
Žveplova kislina je močna dvobazična kislina. V vodi bo vedno bolj ioniziral in zadovoljil hidrosulfatne in sulfatne ione:
Žveplova kislina sodeluje pri vseh reakcijah, značilnih za kisline. Reagira s kovinami, raztaplja sulfatne kovine in vodo, v reakcijah s karbonati raztopi sulfate, ogljikov dioksid in vodo, v reakcijah s substrati in travniki pa raztopi sulfate ali hidrosulfate.
Koncentrirana žveplova kislina burno reagira z vodo. Iz tega razloga je treba žveplovo kislino razredčiti tako, da jo vlijete v vodo in ne v razsutem stanju. Tsya kislina je higroskopna, torej dobra glina za ponovitev vologa. Zato se vicor uporablja za sušenje plinov, saj z njim ne reagirajo in jih prehajajo skozi žveplovo kislino. Sporidnost žveplove kisline na vodne talne obloge je velika, katera žveplova kislina lahko služi kot dehidracijsko sredstvo; pod vplivom koncentrirane žveplove kisline:
kristali črnita pentahidrat sulfat raztopijo brezvodni sulfat
ogljikovi hidrati, na primer saharoza, so zogleneli:
papir je premazan tudi s koncentrirano žveplovo kislino, ki je s kislino premazana na celulozna vlakna;
etanol se pretvori v etilen:
(Dehidracija etanola z dodatno žveplovo kislino, ki se izvaja kontrolno
ume, proizvajajo do prevzema etoksietana (dietil etra) in reakcija zmaga za eliminacijo etoksietana v industrijskem obsegu);
vsota klorobenzena in trikloroetanala (klorala) je dehidrirana (razdelek 16.3).
Koncentrirana žveplova kislina je močan oksidant. Vaughn oksidira kovine in nekovine. na primer
Kot drug primer, ki ponazarja oksidacijsko moč koncentrirane žveplove kisline, na primer oksidacijo ionov v ione, pa tudi bromidnih ionov v prosti brom v žaljivih reakcijah:
Nareshti, žveplova kislina kot vir žvepla v organski kemiji (razdelek 17. poglavje).
Sulfati, sulfiti in tiospoluki
Sulfatni ion ima tetraedrično strukturo, podobno strukturi molekule žveplove kisline.
sol Sulfati se raztopijo v reakcijah razredčene žveplove kisline s kovinami, njihovimi oksidi, hidroksidi in karbonati. Za malo barijevega sulfata in drugih sulfatov v vodi. Kalcijev sulfat ima lahko majhno količino v vodi. Sulfati palčke, dokler se ne segrejejo. Vinyatki in tsomu vіdnoshenі є іlki sulfatizalіza. Na primer, ko se segreje, se sulfat razširi v raztopljeni oksid soli:
Za detekcijo sulfatnih ionov v vsakem primeru dodamo vodno raztopino barijevega klorida. Ob prisotnosti sulfatnih ionov v naslednjem območju se posledično opazi bela oborina barijevega sulfata:
Sulfati je lahko veliko pomemben zastosuvan. Na primer, magnezijev sulfat (angleško sіl, gіrka sіl) vikorist za proizvodnjo vibukhovih govorov, za pripravo syrniki in vognestіy tkanin. Število rozchins tsієї sol vikoristovuєtsya v medicinski praksi kot anti-sol zasіb.
Natrijev tiosulfat lahko štejemo za analog natrijevega sulfata z enim atomom substitucije na atom žvepla. Med podobnimi Thiospoluki je bilo še eno ugibanje - kalijev tiocianat. Vino je močan analog kalijevega cianata. Kalijev tiocianat je mogoče odstraniti s spajanjem kalijevega cianida z žveplom:
Kalijev tiocianat vicorates v kislinski analizi za odkrivanje ionov
Oh, ponovimo!
1. Pri prehodu v nižji del VI kategorije se trdnost njenih elementov postopoma spreminja iz nekovinskih v kovinske.
2. Elementi skupine VI lahko zdatnіst zadnіvatsya z vodo in reakcionarnimi kovinami, utavlyayuschie z'єdnannya, v katerih lahko smrad stupіnіnі oksidacije -2.
3. Kisen ima visoko elektronegativnost in moč močnega oksidanta.
4. Ozon je močnejši oksidant, manj kisika.
5. Kisen ima izjemno pomembno vlogo v bioloških sistemih, sodeluje pri dihalnih in presnovnih procesih (izmenjava govora).
6. Oksid zadovoljuje z drugimi polži binarnih polžev, oksidi različnih vrst:

7. Vodni peroksid je močan oksidant.
8. Sirka se lahko uporablja v dekalnih enantiotropnih oblikah.
9. Za pridobivanje sirke iz podzemnih nahajališč je vzpostavljen proces Frache, pri katerem se stiska ponavljanje in pregrevanje pare.
10. Sirka utvoryu spoluchy, v kateri se nahajajo v taboriščih s stopnjami oksidacije +2, +4, +6 in -2.
11. Sirkovoden - šibka dvobazična kislina in voda.
12. Plinu podoben dioksid sirke in jodne vode rozchin-vdnovniki.
13. Serica trioksid ima močno kislinsko in oksidno moč.
14. Žveplova kislina je močna dvobazična kislina, sušilno sredstvo, dehidracijsko sredstvo in močno oksidacijsko sredstvo.
15. Molekule žveplove kisline in sulfatnih ionov imajo tetraedrsko strukturo.