Кальци ба магнийн нэгдлүүд
Өчигдөр тогтоогдсон өндөглөдөг хэр их кальци агуулагдаж байгааг тогтоосны дараа "уух уу, уухгүй байх уу?" Гэсэн асуулт гарч ирэв. Ихэнх эрчүүдтэй адил би шинжлэх ухааны үүднээс бүх зүйлийг олж мэдээд, өөрөө өөрийгөө олж мэдэн, шалгаж үзээд, эмэгтэй хүний үгийг мэдэрч эхэлдэг. Тиймээс би өндөглөг болон кальцийн талаар олдсон мэдээллийн үндсэн дээр бодлоо хуваалцах болно.
Хэрэглээний тухай мэдээллийг интернетэд цуглуулж, хоол хүнсний нэмэлт болгон ашиглах өндөгний хальс Эмч нарын нэг удаад өндөгний хальс дахь кальцийн карбонат нь усанд уусдаггүй тул бие махбодид шингээж авах боломжгүй байдаг.
Үүнээс гадна найзынхаа нөхрийн тухай ярихдаа, жирэмснийхээ үеэр эмч нар түүнийг буталсан өндөгний хальстай гэж мэдсэн эмчдээ хэлэхэд кальци агуулсан цогцолборыг зааж өгөв.
Үнэн бол хаана байна?
Үнэн хэрэгтээ, кальцийн карбонат CaCO3 (яг энэ хэлбэрээр, кальци нь өндөгний хальсанд ордог) нь ус болон архины хэрэглээнд уусдаггүй.
Кальцийн шингээлтийг зайлшгүй хийх урьдчилсан нөхцөл нь түүний усны уусамтгай чанар юм.
Гэхдээ бидний хоол боловсруулах суурь нь ходоодны гаралтай гидрохлорын хүчил юм.
Энэ бол бидний гэдсэнд тохиолддог зүйл юм.
СООКО + + 2HCl (давсны хүчил) = СаCl2 (кальцийн хлорид) + Co2 + H20
Гэхдээ кальцийн хлорид нь усанд уусдаг. Энэ нь кальцийг шингээдэг энэ хэлбэрээр байна!
Эмч нарыг мэдэхгүй байна уу? Эсвэл тэд зүгээр л зальт хүн бөгөөд биднийг эм тараадаг!
Үүнээс гадна, энэ урвалын үед ходоодны хүчлийг бууруулдаг. Өндөр хүчиллэгээр өвчилсөн хүмүүст юу чухал вэ.
Жишээ нь миний эхнэр, тэр хүчиллэг ихтэй, өдөр бүр бага зэрэг буталсан өндөг гаргадаг бөгөөд энэ нь нэг дор хоёр асуудлыг шийдэж кальци дутагдалтай, түүний хүчиллэгийг бууруулдаг. Гэвч өндөгний хальсан нунтаг унтраасан нимбэгний шүүс Ууж чаддаггүй - дотор муухай байдаг Одоо би яагаад гэдгийг ойлгож байна.
Дээр үзсэнээр кальцийн карбонатаас кальцийг шингээхэд ходоодны шүүс их хүчиллэгээр шаарддаг.
Бодит амьдрал дээр ходоодны хүчиллэг байдал нь бага эсвэл тэг байх үед тохиолддог. Энэ нөхцөл байдал нь хөгшрөлтийн үед онцгой шинж чанартай байдаг бөгөөд кальцийн хэрэгцээ нь остеопорозоос урьдчилан сэргийлэхэд онцгой өндөр байдаг. Жишээлбэл, 50 жилийн дараа хїмїїсийн 40 орчим хувь нь хїчиллэг бага байдаг. Эдгээр нөхцөлд кальцийн карбонатыг шингээх нь давсны хүчлийн ходоодонд уусахыг шаарддаг бөгөөд 2% хүртэл буурдаг.
Магадгүй ахмад хүмүүс кальци дутагдалтай холбоотой өвчинд нэрвэгдэх магадлал илүү их байдаг - энэ нь ердийн хэлбэрээрээ үүнийг шингээх боломжгүй юм.
Эдүгээ буталсан өндөглөгийг хүлээн авах олон жорыг нимбэгний шүүсээр яагаад хэрэглэхийг зөвлөдөг.
Нимбэгний хүчилд нимбэгний шүүс нэмэхэд кальцийн карбонат (CaCo3) нь нимбэгийн хүчил (C6H8O7) урвалд ордог бөгөөд бид кальцийн цитрат (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Энд байна. Мөн ходоодны давсны хүчил шаарддаггүй кальцийн цитрат нь 44% байдаг. Үүний үр дүнд хүчил багатай нөхцөлд кальцийн цитрат карбонатаас 11 дахин их кальци дээр бие махбодид орж ирдэг!
Мөн кальцийн цитрат нь бидэнд мөнгө зардаг алдартай эм юм. Тэд үүнийг хийдэг, зөвхөн тэд нимбэгний шүүс биш, харин citric хүчил!
Дашрамд хэлэхэд кальцийн карбонат (бидний хэрчсэн өндөгний хальс) нь бүртгэгдсэн хүнсний нэмэлт юм. E170, кальцийн цитрат (бидний нимбэгний шүүстэй цөцгийтэй өндөглөдөг өндөглөдөг) нь бүртгэгдсэн хүнсний нэмэлт юм. E333! Тэд кальцийн эзлэх хувийг нэмэгдүүлэхийн тулд олон төрлийн хүнсний бүтээгдэхүүн, ялангуяа сүүн бүтээгдэхүүн, түүний дотор сүүг нэмдэг.
Тэгвэл яагаад илүү төлөх вэ!
Дүгнэлт хэрэв өндөр хүчиллэг байдаг бол хүчиллэг чанар багатай хэрчмээр өндөгний хальс ашиглах нь зүйтэй болов уу. Хэрэв та нимбэгний шүүстэй өндөгний хальсан бүрхүүлийг унтраавал илүү дээр юм.
Мөн үүнээс гадна,
Шөнийн цагаар бие махбодоос ашигт малтмалын давсыг хурдасгах нь (яснаас үүсэх резорсецын процессын хурдатгал). Тиймээс үдийн ба оройны дараа кальцийн бэлдмэлийг хэрэглэнэ.Энэ нь шөнийн хоёр дахь хагаст кальцийг түргэсгэхээс сэргийлж, ялангуяа гэдэс дотроо буурсан түвшин (эсвэл байхгүй) юм. Кальцийн эмийн эмчилгээний үйл ажиллагааны сөрөг хамаарал бүхий эерэг үр дүнг мөн тэмдэглэвэл: Бага тунгаар энэ biometall өндөртэй харьцуулахад илүү шингээнэ.
Үүнтэй холбоотой Өдөрт хэд хэдэн удаа эмийг илүү оновчтой болгох.
Бид уншдаг, бид ярилцдаг. Энэ сэдэвтэй холбоотой цөөн хэдэн өгүүлэл байна.
__________________________________________________________________________________________________________
Кальцийн кальци ба кальцийн карбонат
Эх сурвалж< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Кальцийн цитрат.
Кальцийн цитрат нь хүний биед чухал үүрэг гүйцэтгэдэг кальцийн маш сайн эх сурвалж юм. Учир нь энэ нь олон ферментийн үйл явц, цусны бүлэгнэлтэд нөлөөлдөг. Кальцийн дутагдал нь ясны эмгэг, остеопороз үүсгэдэг. Бага насны хүүхдүүдийн хувьд шүдний эрүүл мэндэд сайн байдаг, насанд хүрэгчид цусны даралтыг тогтворжуулахын тулд тогтмол кальци хэрэглэдэг.
АНУ-ын Хавдар судлалын үндэсний хүрээлэнгийн мэдээлснээр Е-333 нэмэлт нь колонийн хавдар болон бусад хавдраас урьдчилан сэргийлэх боломжтой. Үүнээс гадна, кальцийн коррелиуд нь анагаах ухаанд хүнд металлыг зайлуулах зорилгоор эмэнд хэрэглэгддэг.
Кальцийн цитрат нь хүний бие дэх кальцийн тээврийн хамгийн чухал хэлбэрүүдийн нэг бөгөөд кальцийн карбонат (E-170 нэмэлт) үр дүнтэй эмэнд хэрэглэгддэг. Үүнтэй адилаар кальцийн цитратыг хүнсний нэмэлт тэжээл (хоолны нэмэлт бүтээгдэхүүн) хэлбэрээр ашигладаг.
Хүнсний салбарт E-333 нэмэлтийг тогтворжуулагч, бэлгэвч, хүчиллэг зохицуулагч, өнгөт тохируулагч байдлаар ашигладаг.
Тогтворжуулагчийн хувьд хүнсний нэмэлт Е-333 нь өтгөрүүлсэн сүү, тос, бяслаг үйлдвэрлэлд ашиглагддаг. Житри, вазелин, лаазалсан жимс E-333 нэмэлтийг хүчиллэг зохицуулагч болгон ашигладаг. Кальцийн коррелиуд нь кальцийг сүү, сүүн бүтээгдэхүүн, гурил, гурилан бүтээгдэхүүн, зөөлөн ундаагаар баяжуулахад өргөн хэрэглэгддэг.
Гаднах төрхөөрөө кальцийн цитрат нь цагаан нунтаг юм. Усанд уусдаг. Кальцийн цитратын молекул томъёо: Ca3 (C6H5O7) 2. И-333 кальцийн гидроксидоор нимбэгийн хүчлээр харилцан үйлчилнэ.
Шинж чанар ба технологийн чиг үүрэг:
Хүнсний нэмэлт тэжээлүүд:
- И-333
- И-333
- Кальцийн цитрат
- Кальцийн кальци
- Monocalcium цитрат
- Dicalcium цитрат
- Tricalcium цитрат
_____________________________________________________________________________________________
Кальци шитрат
Хорьдугаар зууны дунд үед. Биохими, физиологичид, биофизикчид, эм зүйн мэргэжилтнүүд, эмч нар бие эрхтний болон биеийн тогтолцооны үйл ажиллагааг зохицуулахдаа кальцийн үүргийг судлах сонирхлыг нэмэгдүүлснээр эхэлсэн. Кальцийн ионууд булчингийн эсийг өдөөх, буулгах, эсийн мембраны нэвчилтийг зохицуулах, эс хоорондын харилцан үйлчлэл, цусны бүлэгнэл, гормоны шүүрэл, зууч, ферментийг зохицуулах үйл ажиллагаанд оролцдог; эс дотрох дохио хувиргагч функцийг гүйцэтгэх, энерги зэрэг дотоод эсийн бодисын солилцооны зохицуулалтын үйл явцад оролцох. Калиомиоцит ба кальцийн ионуудын судасны гадаргуу дээр эсийн цитозолоос 1000 дахин их байдаг. Экстеллелт эсээс цитоплазмыг тусгай кальцийн сувгаар нэвтрэн, бүх эрхтнүүдийн физиологийн үйл явц, бүх эрхтнүүдийн эсүүд, судасны ая, систолийн эрчим, диастол зэрэгт нөлөөлдөг.
Кальци нь ясны эд эс үүсэх, хэвийн бүтэц, үйл ажиллагааг хадгалахад чухал үүрэг гүйцэтгэдэг. Тусгай уургуудаас гадна кальцийн ионууд нь ясны хатуулаг, уян хатан байдлыг хангадаг.
Энэ бүхэн нь анагаах ухаанд үндэслэн давсууд дээр үндэслэн кальцийн бэлдмэлийг боловсруулах, нэвтрүүлэх онолын суурь болж байсан. Одоогоор эмчилгээний дадал нь глицеросфат, глюконат, карбонат, лактат, цитрат, хлорид, фосфат, бусад олон төрлийн кальцийн давс хэрэглэдэг.
Мансууруулах бодисын CALCIUM CITRATE-ийн фармакокинетик шинж чанаруудтай. Кальцийг уусмалын ионжуулсан хэлбэрээр гэдэснээс шингээдэг. Уг эмийг татан буулгах нь ходоодны хүчиллэг орчинд илүү сайн байдаг. Исэлдсэн ионжуулсан кальци нь бүх эдэд сайн нэвтэрч, их хэмжээний саадтай нэвтэрч, хөхний сүүгээр дамждаг. Шээсээр ихэвчлэн 20% орчим шээс ялгардаг. Кальцитын цитратын чухал шинж чанар нь бөөрний чулууг үүсгэх чадвар багатай бөгөөд энэ нь удаан хугацааны туршид хэрэглэж буй давс юм. Энэ нь цитратын давс нь шээсэн дэх оксалатын хэмжээг бууруулдагтай холбоотой юм.
Биологийн үнэлгээ нь хурд, хүрэх хэмжээгээр тодорхойлогдоно идэвхитэй найрлага Эмчилгээний тунгаар шингээж аваад эмчилгээний арга хэмжээ авах боломжтой.
Шөнийн цагаар бие махбодоос ашигт малтмалын давсыг хурдасгах нь (яснаас үүсэх резорсецын процессын хурдатгал). Тиймээс оройн хоол болон үдээс хойш кальцийн бэлдмэлийг шөнийн хоёрдугаар хагаст кальцийн алдагдлыг багасгах, ялангуяа шөнийн хоёр дахь хагас нь кальцийн алдагдлыг бууруулахад хүргэдэг. Кальцийн фармактеристик үйл ажиллагааны сөрөг тунг-хамаарах нөлөө: энэ biometall өндөр тунгаар бодвол бага тунгаар шингээдэг. Үүнтэй холбоотойгоор эмийг өдөрт хэд хэдэн удаа хэрэглэх нь илүү оновчтой байдаг. Өөр өөр насны бүлгийн хувьд кальцийн хэрэглээний физиологийн хэм хэмжээ (хүснэгт) байдаг.
Хүснэгт
Кальцийн янз бүрийн насны хүмүүсийг хэрэглэхийг зөвлөж байна
(Канадын Osteoporosis нийгэмлэгээс)
Кальцийн ионыг шингээнэ Д амин дэм, хлорт хүчил, лактоз, нимбэгийн хүчил, хоол хүнс, фосфор, магни, уураг агуулсан хоол хүнс, тос, өндөг, сүү, загас, сагамхай тос, байцаа гэх мэт
Кальцийн шингээлт нь муудах, хоолонд уураг дутуу, цагаан хоолны дэглэмийг хатуу сахих, магнийн дутагдал, фосфор, үхрийн хүчил (сорра, rhubarb, бууцай) баялаг хоол хүнсээр доройтож байна.
Кальцийн шингээлт нь хоол боловсруулах эрхтний өвчнүүд (гастрит, цочмог үрэвсэл, колит, пепсины шарх), нойр булчирхай (чихрийн шижин, панкреатит), бусад дотоод шүүрлийн эрхтнүүдийн эмгэгүүдэд сөргөөр нөлөөлдөг.
Зарим мансууруулах бодис, ялангуяа глюкокортикоидууд, бэлгийн дааврын хэрэглээ нь системийн хэрэглээтэй, левотироксин нь кальцийн ионыг шингээж өгдөг.
Шинжлэх ухааны судалгааны үр дүн (Оношопориозын Канадын нийгэмлэгийн мэдээлэлд) ясны сийрэгжилтээс урьдчилан сэргийлэх, эмчлэхэд бусад ашигт малтмалын нэмэлт хэрэглээ (магни, цайр, зэс зэрэг) хэрэглэж болох үндэслэлгүй нотолгоо байхгүй болно.
Украин болон бусад орнуудад хийгдсэн эмнэлзүйн судалгаануудаас үзэхэд энэ эмийг олон өвчний эмчилгээнд үр дүнтэй гэж баталсан. Кальцийн цитрат нь янз бүрийн өвчний үед урьдчилан сэргийлэх зорилгоор хэрэглэдэг.
Ахмад настаар ясны сийрэгжилттэй өвчтөнд CALCIUM CITRATE эмчилгээг өдөрт 2-6 шахмалаар хоногт 3-4 удаа тунгаар тарина. Эмийн бэлдмэлийг хоолны өмнө эсвэл 1-1.5 цагийн турш хэрэглэж, 3 сарын турш хэрэглэнэ. Эдгээр өвчтөнд өдөрт 400-800 ОУН-ийн витамин D3-ийг зааж өгөх ба хоол хүнсэн дэх тосны, сүү, загас, өндөг зэргийг оруулна.
CALCIUM CITRATE нь зөвхөн насанд хүрэгчдэд төдийгүй хүүхэд, өсвөр насныханд зориулсан ясны эрдэс бодисын нягтралыг нэмэгдүүлж, ясны массыг ихэсгэх, шүдний паалан бэхжүүлэх зэрэгт тохирсон тунг тохируулах тун юм. 6 сартай хїїхдїїдэд хагас шахам шахам шахмалаар (250 мг) (6-12 сартайдаа шахмал, бага хэмжээгээр уусан), єдєрт 2 удаа шахмалаар 1 удаа, 1 нас хїртэл - 10 жил - 1-2 шахмал, 10-18 нас - өдөрт 2-3 шахмал.
Кальцитын цитратыг тодорхойлох хугацаа:
Янз бүрийн гаралтай цус алдалт, жирэмслэлт, саалийн үед цочмог гипокалеми үүсэх, бие махбодийн кальцийн ионыг нэмэгдүүлэх шаардлагатай;
хоол боловсруулах замын өвчин дэх кальцийн шингээлтийг зөрчиж, бөөр болон гэдэсний замаар кальцийн ялгаралтыг ихэсгэх;
гипопаратиоризм, янз бүрийн эх үүсэх, харшлын эмгэг, харшлын хүндрэлүүд, эм уух, судасны ханын нэвчдэс нэмэгдэж, цусны бүлэгнэлтийн бууралтыг багасгах.
Калкиумын CITRATE нь глюкокортикоид, жирэмслэлтээс хамгаалах бэлдмэл, левотироксиныг хэрэглэх үед хэрэглэнэ. Сүүлийн гурван тохиолдолд мансууруулах бодис хэрэглэсний дараа өдөрт 6 удаа 1 эм ууна.
Кальцийн цитрат нь зарим тохиолдолд шивнэх шинж тэмдгүүд байдаг (өтгөн хатах, гүйлгэх, дотор муухайрах, бөөлжих, хоолны дуршил буурах, гэдэс өвдөх), полиури үүсч болно.
CALCIUM CITRATE-ийг нэгэн зэрэг хэрэглэх нь хөнгөнцагаан агуулсан антацидыг хэрэглэхийг зөвлөдөггүй. Энэ нь бусад кальцийн бэлдмэлүүдтэй зэрэгцэн зохицуулахыг хүсдэггүй.
Эцэст нь хэлэхэд бид CALCIUM CITRATE-ийн эерэг фармакологийн шинж чанарыг тэмдэглэж болно:
кальцийн давстай цитрат нь сайн хооллолт, шингэцэнд шингэдэг бөгөөд энэ нь кальцийг сайн шингээхэд хүргэдэг бөгөөд энэ нь мансууруулах бодисын идэвхи, эмчилгээний хэрэглээЭнэ нь эмнэлзүйн олон судалгаануудын үр дүнгээр нотлогддог.
Бөөрний чулуужихад бага эрсдэлтэй эмийг хэрэглэх үед кальцийн сульфатыг удаан хугацаагаар хэрэглэдэг.
I.S. Чехман, Анагаах ухааны их сургуулийн Клиникийн эм зүйч, Үндэсний Шинжлэх Ухааны Академийн холбогдох гишүүн, Украйны Анагаах Ухааны Академийн Академи, ШУТИС-ийн хүндэт ажилтан, профессор
Хуудас 1
Хүчилтөрөгчтэй карбонатын урвалыг карбонатын дээж болгон ашиглаж болно. Нүүрстөрөгчийн хүчил нь маш сул, тогтворгүй хүчил юм. Энэ нь түүний давснаас бага зэрэг дэгдэмхий, хүчтэй хүчлүүдээр шахагдаж болно.
Үүнтэй адилаар хүчлүүдтэй кальцийн карбонатын урвал явагдана.
Карбонатын давсны хүчилтэй карбонатын уусмал нь кальци хлорид, магнийн хлоридыг өгч усанд сайн уусгаж, өөр өөр концентрацитай уусмалын хэвээр байна. Энэ төрлийн коллекторын урвалын хэмжээ нь даралт болон температураас хамаардаг.
Карбонатыг давсны хүчилтэй урвалд оруулсны үр дүнд кальцийн хлорид болон магнийн усанд сайн уусдаг ба өөр өөр концентрацитай уусмалын хэлбэрээр үлддэг.
Хатаасан бус натрийн карбонатыг урвал руу оруулах нь илүү өндөр даралт шаарддаг бөгөөд катализаторын хэмжээг нэмэгдүүлнэ.
Жагсаалтанд орсон буюу ажигласан үзэгдлүүдийн тайлбар: хүхрийн хүчилтэй кальцийн карбонат яагаад эхлээд хүчирхийлж эхлээд дараа нь зогсдог. Хуурай аммонийн карбонатын хүчил халах үед хоолойноос алга болно.
Портланд цементийн тогтвортой байдалд кальцийн карбонатын үр нөлөөг хөнгөн цагааны агуулсан клинкерийн эрдэстэй карбонатын урвалаар тайлбарлаж болно. Ийнхүү цементийн чулуунаас үүсэх хөнгөнцагааны бүрэлдэхүүн хэсэг нь хүрээлэн буй орчны сульфаттай холбоо тогтоохоосоо өмнө химийн бодисын үүрэг гүйцэтгэдэг.
Барийн карбонатын зарим хэрэглээ нь сульфат ион агуулсан барийн карбонатын уусмалаар үүсдэг барийн сульфатын практик дээр үндэслэдэг. Тиймээс, шатаахын өмнө тоосгон хатаах үед шавранцар дахь гипс, магнийн сульфатын талсжилтын улмаас гадаргуу дээр цагаан цэцэг үүсдэг. Үүнээс сэргийлэхийн тулд барийн карбонатыг шаварлаг бодис дээр нэмж, сульфатын ионы хур тунадас үүсгэдэг.
Хатуу хатуу химийн шинжилгээний талаархи онолын хувьд онолын хувьд боломжтой урвалын жишээ болох кальцийн карбонатын хариу урвал нь кальцийн силикат үүсэхэд хүргэдэг. Тэрээр энэ жишээг дагалдан газрын гүний дулааны метаморфос гэж нэрлэдэг ба ердийн температур хангалтгүй, учир нь кальцийн карбонат ба цахиурын хүчлийг лабораторийн нөхцөлд зөвхөн 500С-ийн температурт ажиглаж болно.
Энэ процесст цэр үүсгэх зардлыг багасгахын тулд Кимима болон Тарс нь аммонийн карбонатын уусмалыг (аммонийн нитратын оронд) ашиглахыг санал болгож, баяжуулсан аммонийн карбонатыг шохойгоор баяжуулсантай холбоотой.
Температур өсөх тусам урвал нь илүү шүлтлэг силикат үүсэхэд чиглэгддэг. Гибсон, Торн-11 нь азотын урсгал дахь 726-805С-ийн температурт кварцтай натрийн карбонатын хариу урвалаар ortho-силикат нь хангалттай хэмжээний натрийн карбонат агуулдаг нь тогтоогджээ. Урвалын хурд нь цаг хугацаа, дээжийн хэмжээ, хийн урсгалын хурд, урвалын найрлага дахь найрлагаас хамаарна. Gibson, Ward нар дунд зэргийн натрийн силикатууд байдаг гэж үздэг.
Натрийн карбонатыг хэт их давсны хүчлээр титрлэхэд хэрэглэнэ. Шинжилгээний бүтээгдэхүүнд хүхрийн хэмжээг натрийн карбонатын хэмжээгээр тооцоолно.
Мөн кальцийн карбонат ба тэдгээр химийн нэгдэл харилцан үйлчлэлцдэг.
Кальцийн карбонат
CaCO₃ кальцийн карбонатын сүлжээCaCO₃ нь дэлхий дээрх хамгийн түгээмэл элемент юм: шохой, шохойн чулуу, гантиг гэх мэт. Тиймээс хүний биед үзүүлэх хор хөнөөл нь ихээхэн чухал ач холбогдолтой юм. Учир нь кальцийн карбонатыг хүнс үйлдвэрлэхэд өргөнөөр хэрэглэдэг учраас байгалийн цагаан будгаар хийдэг. CaCO₃ нь мөн цаас, хуванцар, барилгын болон бусад олон салбарт ашигладаг.
Кальцийн карбонат нь нунтаг эсвэл хатуу хэлбэрт цагаан бодис (хатуу талст) юм. Тэр устай урвалд орж чадах боловч бүрэн уусдаггүй. Тиймээс ус нь булингартай бөгөөд цагаан тунадас үүсдэг. Гэхдээ устай урвалд орох үед бид уусдаг хүчил давс, кальцийн бикарбонат авах болно.
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
Кальцийн карбонат яаж үүссэнийг авч үзье.
Кальцийн карбонатын ихэнхийг байгалийн эх үүсвэрээс авдаг. Тиймээс кальцийн карбонатыг хэрэглэхийн тулд цэвэр эх үүсвэрийг ихэвчлэн гантиг ашиглана.
 Микеланжело Буживотигийн гантиг хөшөө
Микеланжело Буживотигийн гантиг хөшөө
Гэхдээ лабораторийн нөхцөлд кальцийн карбонатыг кальцийн оксидыг шохойжуулж авч болно. Кальцинг нь шаталтын ерөнхий ойлголтыг хэлнэ. Үүнээс үүдэн химийн бодис нь шинэ шинж чанарыг олж авдаг. Тэсэлгээ нь хайлж хүрэхүйц хангалттай өндөр температурт явагддаг.
Ус нь кальцийн оксидтой холилдож, урвал нь гидроксид үүсгэдэг. Дараа нь техникчид нүүрстөрөгчийн давхар ислийг авч, өмнө нь гаргаж авсан уусмалаар дамжуулж гардаг. Тунамал тунадас нь кальцийн карбонат юм.
CaO + H₂O = Ca (OH);
Ca (OH) + CO₂ = CaCO₃ + H₂O
Хэрэв бид өндөр температурт карбонтой хүчил, кальцийн давсыг халааж (900-1000 ° С) бол химийн процессын үр дүнд нүүрстөрөгчийн давхар исэл (нүүрстөрөгчийн давхар исэл), мөн кальцийн оксид CaO - шохойн чулууг барилгын ажилд ашигласан болно:
CaCO₃ = CaO + CO₂
Хэрвээ температур өндөр (1500 ° C) бол урвалын бүтээгдэхүүн нь кальцийн карбид болон нүүрстөрөгчийн дан исэл юм.
Давсны хүчил
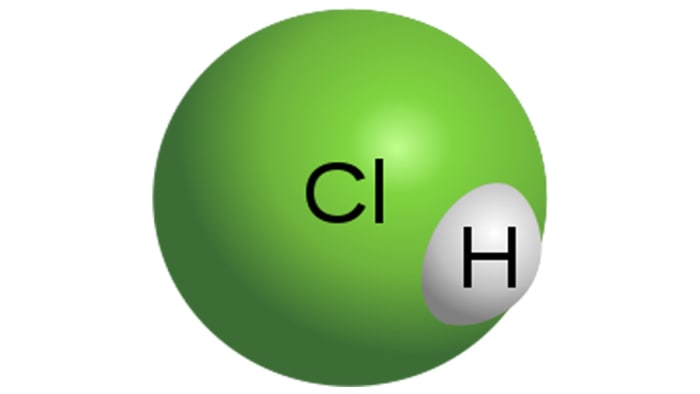 Давсны хүчлийн молекул
Давсны хүчлийн молекул
HCl нь устөрөгчийн хлоридыг усанд уусгаж гаргаж авсан хүчтэй монобазын хүчил юм. Энэ нь өнгөгүй шингэн юм. Техникийн хүчил нь жишээ нь төмрийн бохирдолоос болж цайвар шар өнгөтэй болдог. HCl-ийн шинж чанар нь уусмалд байгаа устөрөгчийн хлоридын концентрацаас хамаарна.
Давсны хүчлийн давсны хүчилийг хлорид гэж нэрлэдэг. Энэ бодис нь маш идэмхий учраас маш болгоомжтой байхыг шаарддаг. Хэдийгээр жижиг дусал арьс дээр унадаг боловч химийн хүчтэй шатаахаас зайлсхийх боломжгүй. Тиймээс хүчтэй хүчлүүдтэй ажиллахдаа саармагжуулагчдыг үргэлж авч явахыг зөвлөж байна: сул шүлтлэг уусмал, (жигд сод) гэх мэт. Энэ нь нүд, амьсгалын тогтолцоонд сөргөөр нөлөөлдөг концентрацитай хүчилтэй HCl уурыг агуулсан савыг нээхэд тохиромжтой гэдгийг санах нь зүйтэй. Тиймээс химийн туршилт хийхэд маск болон нүдний шил хэрэглэх нь дээр.
Гидрохлорт хүчил авах
Устөрөгч хлоридын хий усаар ууссан байна. Устөрөгчийн хлоридыг өөрөө дараах байдлаар гаргаж авдаг: устөрөгчийг хлороор шатааж, ингэснээр синтетик хүчил үүснэ. Эсвэл хлорт хүчлийг хлоржуулсан нүүрсустөрөгч хлоржуулсан үед олон тооны химийн туршилтаар олж авсан хажуугийн хий ашиглан давсны хүчил гаргаж авч болно. Ийм аргаар олж авсан хүчиллэгийг хуйвалдаан гэж нэрлэдэг.
Эм, аж үйлдвэр, химийн урвалын үед давсны хүчил хэрэглэнэ.
Устөрөгчийн хлоридын үнэртэй өнгөгүй хүчил нь металуудтай сайн урвалд ордог. Redox урвал явагдана. Урвалын процесс дахь буурах бодисууд нь метал атом, исэлдүүлэгч бодисууд нь устөрөгчийн катионууд юм.
Металлтай химийн урвал ихэвчлэн устөрөгчийг зайлуулдаг. Металлын үйл ажиллагаанаас хамаарах харилцан үйлчлэлийн эрчим нь хамаардаг. Тухайлбал, шүлтийн метал лити нь хүчтэй урвалд ордог бол энэ элементийн хүчтэй исэлдсэн хальснаас болж хөнгөнцагааны урвал сул байдаг.
Давсны хүчил ба цайр:
2HCl + Zn = ZnCl₂ + H₂
Давсны хүчил ба төмөр:
2HCl + Fe = FeCl₂ + H₂
Давсны хүчил ба магнийн:
2HCl + Mg = MgCl₂ + H₂
 Магнийн хлорид нь замыг мөснөөс цэвэрлэхэд ашигладаг
Магнийн хлорид нь замыг мөснөөс цэвэрлэхэд ашигладаг
Металл оксидоор хүчил үүсгэдэг давс ба ус:
CuO + 2HCl = CuCl₂ + H₂O
Давсны хүчил ба кальцийн карбонатын урвал
Туршилтын хувьд:
туршилтын хоолой;
химийн pipette;
хатуу кальцийн карбонат (гантиг);
давсны хүчил;
бээлий;
маск.
Анхаар! Энэ туршлагыг туршиж үзээрэй!
Сайн агааржуулалт сайтай талбайд туршилтыг явуулах, давсны хүчилтэй ажиллахад болгоомжтой байх хэрэгтэй.
Хэд хэдэн ширхэг гантиг савыг нэмж, зарим нэг давсны хүчлийг пипеткээр нэмнэ. Үүний үр дүнд бөмбөлөгүүд үүсэх шуурхай хариу үйлдэл гарах болно. Нүүрстөрөгчийн давхар исэл ялгардаг. Энэ нь солилцооны урвал бөгөөд түүний бүтээгдэхүүн нь нүүрстөрөгчийн давхар исэл, ус руу задардаг бөгөөд сул дорой, тогтворгүй нэгдэл, нүүрстөрөгчийн хүчил юм. Давсны хүчил дэх кальцийн карбонатыг задлах урвалын тэгшитгэл:
CaCO₃ + 2HCl (шингэлсэн) → CaCl₂ + CO₂ + H₂O
- магнийн элементийн шинж чанар: электрон бүтэц, боломжит исэлдэлтийн төлөв байдал, үндсэн нэгдлүүд: исэл, гидроксид, давс. Нүүрстөрөгчжүүлэлт, барилгын ажилд ямар үүрэгтэй вэ?
MgCO 3 = MgO + CO 2
Програм.
Аж үйлдвэрт рефрактор, цемент, газрын тосны бүтээгдэхүүний цэвэршүүлэлт, резинэн үйлдвэрлэлд дүүргэгчийг ашигладаг. Хэт хөнгөн магнийн исэл нь газрын гадаргууг, тухайлбал, электроникийн үйлдвэрт маш нарийн ширхэгтэй зүслэг байдлаар ашигладаг.
Ходоодны шүүсний хүчиллэгийг их хэмжээгээр хэрэглэсэн тохиолдолд энэ нь давсны хүчлийг их хэмжээгээр агуулдаг тул эмийг хэрэглэнэ. Ходоодыг санамсаргүйгээр ходоодонд суллах үед шатамхай магнеияг хэрэглэнэ.
Хүнсний үйлдвэрлэлд E530 хүнсний нэмэлт болгон бүртгэгдсэн байна.
Энэ нь туйлын тусгал юм. Өргөн хүрээний спектрийн хамтлагт байгаа цацрагийн коэффициент бүхий бодис. Боломжтой цагаан стандарт болгон ашиглаж болно.
Магнийн гидроксид - Гол метал гидроксид нь магни юм. Сул талгүй сул суурь.
Стандарт нөхцөлд магний гидроксид нь өнгөгүй зургаан өнцөгт хэлбэртэй байна. 350 ° С-аас дээш температурт магнийн исэл болон ус руу задардаг. Нүүрсхүчлийн давхар исэл, агаараас авах усыг гол магнийн карбонат үүсгэдэг. Магнийн гидроксид нь усанд уусдаггүй боловч аммонийн давсанд уусдаг. Энэ бол сул суурь юм. Энэ нь байгальд тохиолддог эрдэс бруцит хэлбэртэй байдаг.
Хүлээн авсан.
Шүлттэй уусдаг магнийн давсуудын харилцан үйлчлэл:
Ерөнхийдөө:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
Жишээ нь:
MgCl 2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
Шатаж буй доломиттой магнийн хлоридын уусмалын харилцан үйлчлэл:
MgCl 2 + CaO × MgO + 2H 2 O = 2 Mg (OH) 2 ¯ + CaCl 2
Усны ууртай металл магнийн харилцан үйлчлэл:
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Химийн шинж чанар
Бүх сул суурьтай магнийн гидроксид нь дулаан тогтворгүй байдаг. 350 ° С хүртэл халаана.
Давс, ус (саармагжуулах урвал) үүсгэхийн тулд хүчлүүдтэй харилцан үйлчилнэ.
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
Хүчиллэг исэлүүдтэй харилцан үйлчлэлцэх нь давс, усыг үүсгэнэ:
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
Гидроксимагенат үүсэх үед шүлтлэг халуун төвлөрсөн уусмалуудтай харилцан үйлчлэлцэх:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
Програм.
Магнийн гидроксид нь хүчиллэг бодисын солилцоонд зориулсан хүхэрт диоксидыг (flocculant), термопластик полимер (полиолефинс, PVC) дөл тэсвэртэй, магнийн исэл, элсэн чихэр боловсруулалт хийх зориулалттай шүдний бүрэлдэхүүн хэсэг болгон ашигладаг.
Анагаах ухаанд энэ нь ходоодны хүчлийг саармагжуулах анагаах ухаан болгон ашигладаг ба түүнчлэн маш хүчтэй шингээгч юм.
Европын Холбоонд магнийн гидроксидыг хүнсний нэмэлт E528 гэж бүртгэв.
Магнийн давс.
Ихэнх магнийн давс их хэмжээгээр уусдаг. Ion Mg 2+ нь уусмалыг гашуун амттай болгодог. MgF2-ээс бусад магни halides нь маш их гигроскопик бөгөөд агаарт цус шүүрдэг.
Магнийн хлорид MgCl 2 (магнийн хлорид) нь усгүй хайлмаг 718 °. Усны ул мөр дээр агаарт "утаа" үүсгэдэг бөгөөд энэ нь HCl болон MgO-д задардаг. 1, 2, 4, 6, 8 ба 12 усны молекултай өнгөгүй талстыг усан уусмалаас суллана. Температурын хязгаараас -3.4-аас 116.7 °, MgCl2 × 6H 2 0 талст нь гидролиний гидрат нь тогтвортой, изочофит ашигт малтмал байдлаар хийгддэг ба далайн давслаг ууршилтаар их хэмжээгээр хуримтлагддаг. Магнийн хлорид нь давхар давс үүсгэдэг бөгөөд үүнээс эрдэс карнеллит KCl × MgCl 2 × 6H 2 O - магнийн ба калийн хлоридын эх үүсвэр нь маш чухал юм.
Програм.
1. Магнийн хлорид нь магнийн металл магнийн үйлдвэрлэлд голчлон хэрэглэгддэг ба MgCl 2 × 6H 2 0 магнийн цементийг авахад ашигладаг.
2. Мөсөн болон цасан бүрхүүлийг нэмэлт бодис болгон ашиглахад ашиглана. Цастай урвалын үр дүнд хайлж эхэлдэг. Энэ нь 3-р аюул (дунд зэрэг аюултай бодис), идэмхий идэмхий шинж чанартай.
Магнийн бикарбонат - Mg (HCO 3) 2 магнийн болон нүүрстөрөгчийн хүчиллэг давс нь зөвхөн усан уусмал дээр байдаг.
Хүлээн авсан.
Магнийн карбонатыг түдгэлзүүлэх замаар нүүрстөрөгчийн давхар ислийг дамжуулах:
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
Физик шинж чанар.
Магнийн бикарбонат нь зөвхөн усан уусмалаар л байдаг.
Ус дахь магнийн бикарбонат байгаа нь түр зуурын хатуулаг үүсгэдэг.
Химийн шинж чанар
Уусмалыг баяжуулах үед магнийн бикарбонат задардаг:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
Магнийн гидрофосфат (яльгүй шингэрүүлсэн магнийн фосфат) - магни, фосфорын хүчил дэх хүчиллэг давс MgHPO 4, усанд бага зэрэг уусдаг томъёотой, талстыг гидрат хэлбэрээр үүсгэдэг.
Хүлээн авсан.
Магнийн исэл буюу магнийн карбонат дээр ортосфосфорын хүчилд үзүүлэх нөлөө:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
Натрийн ортофосфатыг магнийн хлорид дээр ялгах үйлдэл:
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
Дигидро фосфат магнийн задрал:
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
Физик шинж чанар.
Магнийн устөрөгчийн фосфор нь талстын гидрат болох цагаан талст хэлбэртэй: 225 ° С хүртэл температурт, MgHPO4 монитрат нь үүсдэг. H 2 O, 2.32 г / см3 нягт, 36 ° С температурт MgHPO4 trihydrate үүснэ. 3H2O, нягтрал 2.10г / см3, өрөөний температур MgHPO4 гептахидрим үүснэ. 7H 2 О.
Химийн шинж чанар.
Пирофососфат руу халсан бол:
Програм.
Хүнсний нэмэлт E343-д хэрэглэсэн.
Магнийн гидрийн фосфат - Магнийн болон ортосфорын хүчлийн хүчиллэг давс Mg (H 2 PO 4) 2, өнгөгүй гигроскопийн талстыг усанд уусдаг, талстыг гидрат хэлбэрээр агуулдаг.
Хүлээн авсан.
Орхрофосфорын хүчлээр гидроксид буюу магнийн оксидыг устгах:
Физик шинж чанар.
Магнийн дигидроген фосфат өнгөгүй талстууд үүсдэг.
Mg (H 2 PO 4) 2-ын кристалл гидрат найрлагатай. nH 2 O, энд n = 2, 4, 6.
Магнийн карбид - MgС 2 томъѐогоор магнийн болон нүүрстөрөгчийн органик бус органик нэгдлүүд. Түүнчлэн магнийн карбидийг Mg 2C-ийн томъёогоор тодорхойлно.
Хүлээн авсан.
Магнийн хайлуур жонш болон кальцийн карбидыг шингээх:
Магнийн нунтаг дээр ацетилен урсах:
Пентейнийг 650 ° С-д магнийн нунтагаар нөхөн сэргээж, илүү нарийн төвөгтэй карбидын Mg 2 С 3-ийг авч болно.
Химийн шинж чанар.
Mg2C3 завсрын карбид үүсэх үед халах үед:
Устай харилцан үйлчлэх:
Магнийн карбонат, магнийн карбонат, MgCO 3 - нүүрс хүчлийн магнийн давс.
Үл хөдлөх хөрөнгө
Цагаан талст, нягтшил 3,037 г / см3. 500 ° С-ийн хувьд мэдэгдэхүйц бөгөөд 650 ° C-т MgO болон CO2-д бүрэн задардаг. Усанд агуулагдах магнийн карбонатын уусамтгай байдал бага (22 мг / л-ээс 25 0С-т) ба температурын өсөлтөөс болж буурдаг. CO 2 нь MgCO 3-ийн усан уусмалаар ханасан үед Mg (HCO 3) 2 бикарбонат үүссэний улмаас ууснэ. CO2-ийн илүүдэл байхгүй тохиолдолд усан уусмалаас үүсэх үндсэн магнийн карбонатуудыг ялгана. Олон тооны металлын карбонатууд бүхий магнийн карбонат нь давхар давс үүсгэдэг бөгөөд үүнд байгалийн эрдэс долгион MgCO 3 CaCO 3 ордог.
Тархалт.
Магнийн карбонатыг эрдэс магнийн хэлбэрээр өргөн тархсан байдаг.
Програм.
Үндсэн магнийн карбонат 3MgCO 3 · Mg (OH) 2 · 3H 2 O (цагаан магнийн гэж нэрлэгддэг) нь дулаан тусгаарлах материалын үйлдвэрлэлд зориулсан резинэн хольцоор дүүргэгч болгон ашигладаг.
Магнийн карбонат нь шил, цемент, тоосго үйлдвэрлэхэд зайлшгүй шаардлагатай.
Магнийн нитрат Mg (NO 3) 2 - өнгөгүй гигроскоплик кристал бүхий куб lattice; хайлуулах цэг 426 ° C (задралын үед). Усанд уусамтгай байдал (100 г тутамд): 73.3 (20 ° C), 81.2 (40 ° C), 91.9 (60 ° C). Мөн этилийн спирт, метанол, шингэн NH3 уусдаг. Концентрациас үл хамааран nona-, hexa ба усанд уусмалууд усан уусмалаас талсжсан байдаг.
Магсиум нь фосфатезид зайлшгүй шаардлагатай хлорофиллын нэг хэсэг бөгөөд олон ферментийн идэвхийг нэмэгдүүлж, фосфорын дамжуулагч байдлаар ажилладаг. Өндөр давсжилт, бага цахилгаан дамжуулалт нь усалгааны усыг давсны агууламж өндөртэй усалгааны усыг тэжээл, үржил шимийг ашиглахад тохиромжтой байдаг. Бордоо нь хүнсний ногоо, жимс жимсгэнэ, жимс жимсгэнэ, усан үзэм, ургамлын үндэс, фолийн тэжээлд хэрэглэгддэг. пиротехникийн найрлага дахь исэлдүүлэгч.
Нүүрстөрөгч- нүүрстөрөгчийн давхар исэл бүхий уусмалыг хангаж байна. Барилгад ашигласан.
Ашигт малтмалын карбонатжилт - Силикат дахь силикат хүчийг карбонатаар үүсгэхийн тулд нүүрстөрөгчийн хүчлээр солино. Карбонатаас тунамал чулуулаг дахь чулуулаг үүсгэдэг эрдсүүд нь кальцит (шохойн spar) CaCO3 юм. Magnesite - MgCO3 ба dolomite - CaMg (CO3) 2 нь бага байдаг. Дотор нь цэвэр ус, нүүрсхүчлийн хүчил агуулаагүй, кальцит бага хэмжээгээр (литр ус 0.03 г) ууссан; Магниит нь бараг л уусдаггүй. Хэрэв ус нь нүүрстөрөгчийн давхар ислийг агуулдаг бол кальцитийн уусмал нь Ca (HCO3) 2 уусдаг хүчиллэг кальцийн карбонат үүсэхэд амархан уусдаг.
Нүүрстөрөгч гэдэг нь C0 2 агаарт ил гарсан үед Портланд цемент дээр бетонд тохиолддог өөрчлөлт юм. Кальцийн гидроксидын Ca (OH) 2 чийгийн нөлөөнд онцгой нөлөө үзүүлдэг. Нүүрстөрөгчийн давхар ислийг шингээхэд кальцийн гидроксидыг кальцийн карбонат болгон хувиргадаг. Кальцийн карбонат нь усанд уусдаггүй бөгөөд үр дүн нь бетоны гадаргуу дээрх нүхийг (нягт, ус нэвтэрдэггүй бетон гэсэн утгатай) хаадаг.
Ихэвчлэн бетон дахь нүхний усны рН нь 10.5-11.5 хооронд хэлбэлздэг. Хэрэв карбонжилт нь 9 ба түүнээс бага бол арматурыг зэврүүлэх боломжтой. Тиймээс нүүрсжүүлэлтийн давхаргын зузаан нь арматурыг хамгаалахад чухал хүчин зүйл болдог: нүүрстөрөгчжүүлэх гүн нь гангийн зэврэлтээс илүү аюултай байдаг. Карбонатын гүнийг бетоныг фенолфталеинаар эмчилж болно. Фенолфталеины үйл ажиллагааны доорхи шүлтлэг шинж чанарыг ягаан өнгөний илрэл байдлаар харуулсан бол карбонатлаг бетон нь түүний анхны өнгө хадгалагдана.
Өндөр чанартай нягт бетон нь маш удаан явагддаг. 50 жилийн туршид үйл ажиллагаа явуулсны дараа ч 5-10 мм-ээс их гүнд нүүрстөрөгчжүүлэлт хийх магадлал багатай юм. Нөгөө талаас, бага хүч чадлаар нэвчих чадвартай бетоны нүүрстөрөгчжүүлэлтийн гүн нь 10-аас доош жилийн хугацаанд 25 мм-ийн зузаантай байдаг. Туршлагаас харахад бага чанартай бетон бүтээгдэхүүн нь нүүрстөрөгчжүүлэлт хийхэд хялбар байдаг.
- кальцийн элементийн шинж чанар: электрон бүтэц, боломжит исэлдэлтийн төлөв байдал, үндсэн нэгдлүүд: исэл, гидроксид, давс.
Кальци - 2-р бүлгийн гол дэд бүлгийн элемент, ДНХ Mendeleev-ийн химийн элементүүдийн дөрөв дэх үе, атомын дугаар 20-тэй. Энэ нь Ca (латри кальци) тэмдгээр тэмдэглэгдсэн. Цахим бүтцүүд 1 2 2 2 2 2х 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, исэлдэлтийн төлөв +2, 0. Шүлтийн газрын металыг хамаарна.
Энгийн бодис кальци нь мөнгөний өнгөтэй зөөлөн, химийн идэвхтэй шүлтлэг металл юм. Аж үйлдвэрийн үйлдвэрлэл: хайлсан кальцийн хлоридын электролиз.
Кальцийн исэлдүүлэгч CaO - үндсэн исэл, шохойн чулуу. Цагаан, гигроскоп. Галын үед тогтворгүй, тогтворгүй, тогтворгүй. Устай хүчтэй урвалд ордог (өндөр экспо-нөлөөтэй) нь хүчтэй шүлтлэг уусмал үүсгэдэг бөгөөд процессыг шохойн гулгуур гэж нэрлэдэг. Хүчил, металл исэл, метал бус хүчлээр үйлчилнэ. Энэ нь бусад кальцийн нэгдэл, барилгын материалын нэг бүрдэл хэсгүүдийг нэгтгэхэд хэрэглэгддэг.
Үйлдвэрлэлийн үйлдвэрлэл - шохойн чулууг шатаах (900-1200 оС)
Кальцийн гидроксид Ca (OH) 2 - Усан шохой, үндсэн гидроксид. Дундаж халаагуураар задалдаг. Цагаан, гигроскоп. Агаараас чийг, нүүрстөрөгчийн давхар ислийг шингээдэг. Хүйтэн бага зэрэг уусдаг. ус, тэр ч байтугай бага бол - буцалж буй усан дотор. Тодорхой шийдэл (шохойн ус) нь гидроксидын хур тунадаснаас болж үүлэрхэг болдог (түдгэлзүүлэлтийг шохойн сүү гэж нэрлэдэг). Чанарын урвал гэдэг нь шохойн усаар дамжуулан нүүрстөрөгчийн диоксидыг дамжуулах CaCO3 тунадас болон уусмал руу шилжих явдал юм. Хүчил болон хүчилтэй исэлд уусдаг тул ионы солилцооны урвал руу ордог.
Энэ нь шохойн зуурмаг (элс + slaked шохой + ус) бэлтгэх ажилд хэрэглэгддэг. Энэ нь чулуу, тоосгон холбох материал, гипс хийх, барилгын бусад зориулалтаар хангадаг. Ийм уусмалыг хатууруулах нь агаараас ялгарах CO2-ын шингээлтээс шалтгаална.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H 2 SO 4 → CaSO 4 + 2H 2 O,
Хэрэв тунадас үүссэн бол давсны хүчлийг давтан хийнэ.
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 ↓ + 2NaOH
Кальцийн давс.
Кальцийн сульфат (CaSO 4) - органик биш бодис, хүхрийн хүчлийн кальцийн давс.
Байгальдаа CaSO 4 dihydrate гэж байдаг уу? 2H2O (гипс, селенит) ба усгүй төлөвт - аниидрит.
Кальцийн хлорид, CaCl2 - давсны хүчил дэх кальцийн давс.
Өндөр гигроскопийн шинж чанарыг агуулдаг. Шийдэл (100 гр H2O тутамд): 74 (20 ° C) ба 159 (100 ° C). Кальцийн хлоридын усан уусмал бага температурт (20% -18.57 ° C, -48 ° C-д 30%) хөлддөг.
CaCl2 · 6H2O-ийн гидрат хэлбэрээр, 29.8 ° C хүртэл тогтвортой; Өндөр температурт 4, 2, 1 H2O молекулууд нь ханасан уусмалаас гардаг. CaCl2 * 6H2O (58.8%) нь цас эсвэл мөстэй (41.2%) холилдсон үед температур нь -55 ° C (криодитратын цэг) -р буурдаг.
Кальцийн хлорид нь сод үйлдвэрлэхэд дайвар бүтээгдэхүүнээр олддог.
Химийн лабораторийн хувьд кальцийн хлоридыг хатаах хоолойд дүүргэгч болгон ашиглаж, агаар мандлын усны уур, хатаалтын хийнээс саванд байгаа бодисыг ялгах зориулалттай кальцийн хлорид гэж нэрлэдэг.
Кальцийн хлорид нь цементийг тохируулах хурдасгуур болгон ашигладаг.
Кальцийн карбонат (кальцийн карбонат) - органик бус химийн нэгдэл, нүүрстөрөгчийн хүчил ба кальцийн давс. Химийн томъёо -CaCO 3. Кальцит, арагонит, ваттерит зэрэг ашигт малтмалын хэлбэрээр олддог нь шохойн чулуу, гантиг, шохойн гол бүрэлдэхүүн хэсэг нь өндөгний бүрхүүлийн нэг хэсэг юм. Ус болон этанолонд уусдаггүй.
Шавар, төрөл бүрийн чигжээс - Эдгээр нь бүгд их хэмжээний кальцийн карбонат агуулдаг. Мөн кальцийн карбонат нь гэр ахуйн химийн бодис үйлдвэрлэхэд чухал бүрэлдэхүүн хэсэг юм.
Кальцийн карбонатыг мөн хүрээлэн буй орчны бохирдолтой тэмцэх, кальцийн карбонатын тусламжтайгаар цэвэрлэх системд өргөн хэрэглэгддэг тул хөрсний хүчиллэг суурь тэнцвэрийг сэргээдэг.
- Барилгын ажилд кальци, магнийн исэл ба гидроксидын хэрэглээг харуулсан жишээнүүд.
Кальцийн исэл ба гидроксид:
Whitewashing өрөө авах
Модон хашаа, торхны цорго зэргийг whitewash хийх - эвдрэл, галыг унтраахаас хамгаалах.
Шохойн зуурмаг бэлтгэхийн тулд. Шохойг эртний цаг үеэс хойш өрлөг болгоход ашигладаг. Хольцыг гол төлөв энэ хэсэгт бэлтгэнэ: элс буюу гурваас дөрвөн хэсэг нь кальцийн гидроксид (устай шохой), усыг холих нэг хэсгийг нэмнэ. Энэ тохиолдолд урвал нь Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O урвалаар хатуурна. Энэ нь экзотермик урвал бөгөөд энерги суллах нь 27 ккал (113 кЖ) юм.
Урвалын хариу урвалаар ус нь сулардаг. Энэ нь сөрөг хүчин зүйл юм, шохойн зуурмагаар барьсан өрөөнүүдэд өндөр чийгшил удаан үргэлжилдэг. Үүнтэй холбогдуулан кальцийн гидроксидыг давж гарах хэд хэдэн давуу талуудаас болоод цемент нь үүнийг шийдэхийн тулд үүнийг бетон болгон ашиглаж байна. Үүнээс гадна өндөр температурт нөлөөлж, нүүрсхүчлийн давхар ислийг шингээдэг тул зуухыг тавихад хэрэглэхэд хүлээн зөвшөөрөх боломжгүй юм.
Силикат бетоныг бэлтгэх зорилгоор. Силикат бетоны найрлага нь шохойн зуурмагийн найрлагатай адил боловч кальцийн исэл, кварцын элсний холимгийг усаар цэвэрлээгүй боловч 9-15 атмосферийн даралттай автоклавт хэт халсан (174.5-197.4 ° C) усны ууртай.
Силикат тоосго үйлдвэрлэхэд.
Оксид ба магнийн гидроксид:
цемент үйлдвэрлэхэд галд тэсвэртэй материалын хосолсон систем (магнезитын барилгын самбар) үйлдвэрлэх. Магнийн исэл (идэмхий магниит) нь MgCl2 уусмалаар холилдож, агаарт хүчтэй хатах чадвартай байдаг.
- байгалийн усны хатуулаг: тодорхойлолт, хатуулгийн төрөл, усны хатуулгийг арилгах арга: физик, химийн (урвалын тэгшитгэл), физик-химийн бодис.
Уусмал дахь кальци, магнийн агууламж ихтэй усыг хатуу ус гэж нэрлэнэ. Энэ нь кальци, магнийн агууламж багатай эсвэл бага хэмжээний устай зөөлөн ус юм.
Эдгээрийн эхнийх нь кальци, магнийн бикарбонат агуулсан, хоёрдугаарт кальци, магнийн хүчлийн хүчлүүд, сульфат, хлоридын давсны агууламжтай холбоотой юм. Карбонатын хатуулагтай усыг удаан хугацаанд буцалгахад CaCO3-ээс бүрдсэн тунадас үүсэх бөгөөд CO2-ийг чөлөөлөх болно.
Эдгээр бодисууд нь кальцийн карбонатын задралын үр дүнд үүсдэг:
Тиймээс карбонатын хөшүүн чанарыг түр зуурын хөшүүн гэж нэрлэдэг. Түр зуур хатуу хучилт нь нэг цагийн турш буцалсан үед уснаас зайлуулсан бикарбонатын агуулгаар тодорхойлогдоно. Ийм буцламжилтын дараа үлдсэн хөшгийг тогтмол хөшүүн гэж нэрлэдэг.
Усны хатуулаг нь усанд агуулагдах кальци, магнийн ионуудын милливаливилтын нийлбэрээр илэрхийлэгдэнэ. Хүчитгэсэн нэг миллиавкар нь 20,04 мг / л буюу 12.16 мг / л агууламжтай тохирч байна.
Байгалийн усны хатуулаг өөр өөр байдаг. Энэ нь өөр өөр усан сангуудаас ялгаатай бөгөөд голын эрэг дээр жил бүр өөрчлөгддөг (үерийн үед хамгийн бага). Далайн усны хатуулаг нь гол мөрөн, нуураас хамаагүй өндөр. Ийнхүү Хар тэнгисийн ус нийт хатуулаг нь 65.5 мкк / л байна. Дэлхийн далай дахь усны хатуулгийн дундаж утга нь 130.5 мкк / л (нэг мкк / л-ээс 22.5 мкк / л) байна.
Их хэмжээний кальци, магнийн давсны усанд байгаа ус нь техникийн олон зорилгод усыг тохиромжгүй болгодог. Тиймээс хатуу устай уурын зуухыг удаан хугацаагаар хооллох нь тэдний хана аажмаар nakiii-ийн өтгөн царцдасаар бүрхэгдсэн байдаг. Уурын зуухны хана нь дулаан дамжуулалтыг ихээхэн хэмжээгээр бууруулж, ингэснээр шатахууны хэрэглээг нэмэгдүүлнэ. Үүнээс гадна халаалтын хоолой болон уурын зуухны ханан дээр хагарах, хагарахаас сэргийлж болно.
Хатуу ус савангаар уусдаг саванд хөөс өгөхгүй натрийн давс тосны хүчил - палмит ба stearic - нэг хүчилд уусдаг кальцийн давс болгон хувиргадаг:
Жишээ нь, будах үед технологийн зарим үйл явцыг хийхдээ хатуу усыг ашиглаж болохгүй.
Усны байнгын хатуулаг нь голчлон сульфат, кальци, магнийн хлоридуудтай тул буцалгана. Түр зуурын (зөөврийн) ба тогтмол хатуулгийн нийлбэр нь усны нийт хатуулаг юм.
Хулгайллыг тодорхойлох олон янзын арга байдаг.
Тэдний хоёрыг авч үзье:
1) давсны хүчлийг титрлэх уусмал ашиглан түр зуурын хатуулгийг тодорхойлох
2) нийт хазайлтыг тодорхойлох цогцолборын арга.
Метил улбаран дэргэд ус давсны хүчлээр дээжийг титрлэх явцад биикарбонатын задрал нь түр зуурын хатуулаг үүсгэдэг:
Тодорхойлох арга. Туршилтын 100 мл-ийг соруураар соруураар эсвэл хэмжих цилиндрээр авч, 2-3 дусал метил улбар шарыг 0,1 ба түүнээс дээш тоогоор нэмнэ. Улбар шар өнгө үүсэх хүртэл HCl уусмал болно.
Тооцооллын үр дүнгийн тооцоо. 1 мл 0.1 н. HCl-ийн уусмал 0.1 / 1000 г-экв эсвэл 0.1 мг-экв Ca 2+ байна. V (HCl) нь 0,1 Вт (HCl) / 1000 гр-экв эсвэл 0,1 Вт (HCl) мг-эккл Ca2 + байна. 0.1 V (HCl) mEq нь V A. 1 мл дэхь эквивалент жинг илэрхийлэх миллиграм-тэй тэнцүү байдлыг илэрхийлэхийн тулд V А-аар олсон утгыг хувааж, үүнийг 1000-аар үржүүлнэ. Үүнд: усны судалгаагаар хатуулаг дараахь хэмжээтэй тэнцүү байна:
![]()
Арилгах арга.
Дулаан зөөлрүүлэх Усыг буцалгахад тулгуурлан температур тогтворгүй кальци, магнийн бикарбонатын үр дүнд задарснаар задардаг:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
Буцалгах нь түр зуур (карбонат) хатуулгуудыг арилгадаг. Амьдрал дээр програм хайх.
Урвалж зөөлрүүлэх. Энэ арга нь содны үнс Na2CO3 эсвэл усаригдсан шохой Ca (OH) 2-ийг нэмэхэд дээр үндэслэнэ. Үүний зэрэгцээ кальци, магнийн давс нь уусдаггүй нэгдэлд орж, улмаар тунадас үүсдэг.
Жишээ нь, усархаг шохой нэмэх нь кальцийн давсгүй уусмал карбонатыг хувиргахад хүргэдэг:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Усны нийт хатуулагыг арилгах хамгийн сайн урвалж бол ихэнхдээ ахуйн болон аж үйлдвэрийн бүтээгдэхүүний нэг хэсэг болох натри ортофосфат Na3PO4 юм.
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Кальци, магнийн ортофосфатууд нь усанд маш бага уусдаг тул механик шүүлтүүрээр амархан тусгаарлагддаг. Энэ арга нь харьцангуй их усны хэрэглээнд үндэслэнэ. Яагаад гэвэл энэ нь хэд хэдэн тусгай асуудлыг шийдвэрлэхэд оршино.
Катионац. Энэ аргыг ионы солилцооны мөхлөгт ачаалалтай (ихэвчлэн ион солилцооны давирхай) ашигласан дээр үндэслэнэ. Устай харьцах ийм ачаалал нь хатуулгийн давс (кальци, магни, төмөр, манган) -ыг шингээдэг. Үүний оронд ионы хэлбэрээс хамаарч энэ нь натри, устөрөгчийн ионыг өгдөг. Эдгээр аргууд нь Na-катиаци ба H-катиаци гэж нэрлэгддэг. Усны хатуулгийг зөв сонгосон тохиолдолд усны хатуулаг нэг үе шаттай натрийн катиациос 0,05-0.1 ° W хүртэл буурч, хоёр үе шаттай ачааг 0.01 ° В хүртэл бууруулна. Аж үйлдвэрт ион солилцооны шүүлтүүр нь кальци, магнийн ионыг натри, калийн ионоор сольж зөөлөн ус үйлдвэрлэдэг.
Урвуу осмосизм. Энэ аргыг хагас задралын мембран (ихэвчлэн полиамид) усаар дамжуулдаг. Хатуулгийн давстай хамт бусад давсны ихэнхийг арилгадаг. Цэвэрлэгээний үр ашгийг 99.9% -д хүргэнэ.
Нанофилит (мембраны нүхний нэрлэсэн диаметр нь нанометрийн нэгжтэй тэнцүү) ба picofiltration (мембраны нүхний нэрлэсэн голч нь зурагтай нэгжтэй тэнцүү).
Энэ аргын дутагдалтай талыг тэмдэглэх хэрэгтэй:
Урвуу осмосын мембран руу нийлүүлсэн усыг урьдчилан цэвэрлэх хэрэгтэй;
Үйлдвэрлэсэн 1 литр ус харьцангуй өндөр өртөгтэй (үнэтэй тоног төхөөрөмж, үнэтэй мембранууд);
Боловсруулсан усны эрдэсжилт бага (ялангуяа picofiltration үед). Ус бараг нэрсэн байна.
Электродиализ Энэ нь цахилгаан талбайн үйл ажиллагааны дор уснаас давсыг зайлуулахад суурилдаг. Уусдаг бодисын ионыг зайлуулах тусгай мембранаас үүсдэг. Урвуу осмосын технологийг ашиглахтай адилаар хатуулгийн ионоос гадна бусад давсыг зайлуулах.
Хатуулгийн давснаас бүрэн цэвэр ус нэрж болно.
