Zolfo. Acido solfidrico e solfuri
4.doc
240Zolfo. Acido solfidrico, solfuri, idrosolfuri. Ossidi di zolfo (IV) e (VI). Acido solforico e acido solforico e loro sali. Esteri di acido solforico. Tiosolfato di sodio
4.1. zolfo
Lo zolfo è uno dei pochi elementi chimici che le persone hanno usato per diversi millenni. È ampiamente distribuito in natura e si trova sia nello stato libero (zolfo nativo) che nei composti. I minerali contenenti zolfo possono essere divisi in due gruppi: solfuri (piriti, glitters, manichini) e solfati. Lo zolfo nativo si trova in grandi quantità in Italia (isola di Sicilia) e negli Stati Uniti. Nella CSI, i giacimenti di zolfo nativo si trovano nella regione del Volga, negli stati dell'Asia centrale, in Crimea e in altre zone.
I minerali del primo gruppo includono piombo lucentezza PbS, rame lucido Cu 2 S, argento lucido - Ag 2 S, blenda zinco - ZnS, cadmio intrappolamento - CdS, pirite o ferro pirite - FeS 2, calcopirite - CuFeS 2, cinabro - HgS.
I minerali del secondo gruppo comprendono il gesso CaSO 4 2H 2 O, la mirabilite (sale di Glauber) - Na 2 SO 4 10H 2 O e la kerite - MgSO 4 H 2 O.
Lo zolfo si trova negli animali e nelle piante, come parte delle molecole proteiche. I composti organici dello zolfo si trovano nel petrolio.
reception
1. Quando lo zolfo è ottenuto da composti naturali, ad esempio dallo zolfo piritico, viene riscaldato a temperature elevate. La pirite di zolfo si decompone per formare solfuro di ferro (II) e zolfo:
2. Lo zolfo può essere ottenuto per ossidazione dell'idrogeno solforato per la mancanza di ossigeno dalla reazione:
2H 2 S O 2 = 2S 2H 2 O
3. Al giorno d'oggi, il recupero dello zolfo mediante la riduzione del biossido di zolfo dell'anidride solforosa SO 2 è un sottoprodotto comune nella fusione dei metalli dai minerali di zolfo:
SO 2 C = CO 2 S
4. I gas di scarico dei forni metallurgici e di coca cola contengono una miscela di anidride solforosa e idrogeno solforato. Questa miscela viene fatta passare ad alta temperatura sopra il catalizzatore:
H 2 S SO 2 = 2H 2 O 3S
^ Proprietà fisiche
Lo zolfo è un colore giallo limone duro e fragile. È praticamente insolubile in acqua, ma è ben solubile nell'anilina CS 2 nel disolfuro di carbonio e in alcuni altri solventi.
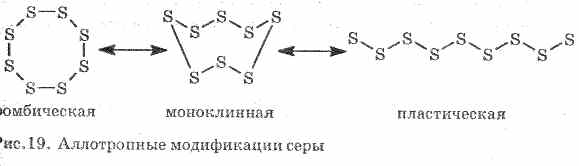
Scadente conduce calore e corrente elettrica. Lo zolfo forma diverse modifiche allotropiche:
1 . ^ Zolfo rombico (più stabile), i cristalli hanno la forma di ottaedro.
Quando lo zolfo viene riscaldato, il suo colore e la sua viscosità cambiano: dapprima si forma un giallo chiaro, e quando la temperatura aumenta, si scurisce e diventa così viscoso che non esce dal tubo, con ulteriore riscaldamento, la viscosità cala di nuovo, e a 444, 6 ° С bolle di zolfo .
2. ^ Zolfo monoclino - modifica sotto forma di aghi gialli scuri, ottenuti raffreddando lentamente lo zolfo fuso.
3. Zolfo di plasticaformata se lo zolfo riscaldato ad ebollizione viene versato in acqua fredda. Facilmente stirato come la gomma (vedi fig. 19).
Lo zolfo naturale consiste in una miscela di quattro isotopi stabili: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Proprietà chimiche
Un atomo di zolfo, con un livello di energia esterna incompleto, può attaccare due elettroni e mostrare un grado
Ossidazione -2. Lo zolfo presenta tale stato di ossidazione in composti con metalli e idrogeno (Na 2 S, H 2 S). Quando il rinculo o l'esaurimento degli elettroni nell'atomo dell'elemento più elettronegativo, il grado di ossidazione dello zolfo può essere 2, 4, 6.
Lo zolfo è relativamente inerte al freddo, ma con l'aumento della temperatura la sua reattività aumenta. 1. Con i metalli, lo zolfo presenta proprietà ossidanti. Quando queste reazioni formano solfuri (con oro, platino e iridio non reagisce): Fe S = FeS
2. In condizioni normali, lo zolfo non reagisce con l'idrogeno e a 150-200 ° C si verifica una reazione reversibile:
3. Nelle reazioni con metalli e con idrogeno, lo zolfo si comporta come un tipico agente ossidante, e in presenza di forti agenti ossidanti presenta proprietà riducenti.
S 3F 2 = SF 6 (non reagisce con iodio)
4. La combustione di zolfo in ossigeno procede a 280 ° C, e in aria a 360 ° C. Questo forma una miscela di SO 2 e SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Se riscaldato senza aria, lo zolfo si combina direttamente con il fosforo, il carbonio, mostrando proprietà ossidanti:
2P 3S = P 2 S 3 2S C = CS 2
6. Quando si interagisce con sostanze complesse, lo zolfo si comporta principalmente come agente riducente:
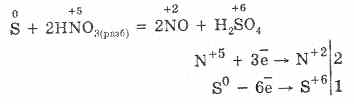
7. Lo zolfo è capace di reazioni sproporzionate. Quindi, quando si fa bollire la polvere di zolfo con alcali, si formano solfiti e solfuri:
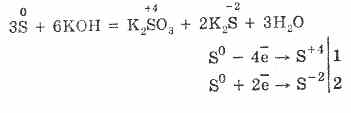
applicazione
Lo zolfo è ampiamente usato nell'industria e nell'agricoltura. Circa la metà della sua produzione viene consumata per produrre acido solforico. Lo zolfo è usato per la vulcanizzazione della gomma: in questo caso la gomma viene trasformata in gomma.
Sotto forma di zolfo (polveri fini) lo zolfo viene usato per combattere le malattie del vigneto e del cotone. È usato per ottenere polvere da sparo, fiammiferi, composizioni luminose. In medicina, preparato unguento di zolfo per il trattamento delle malattie della pelle.
4.2. Acido solfidrico, solfuri, idrosolfuri
L'idrogeno solforato è un analogo dell'acqua. La sua formula elettronica
Mostra che due p-elettroni del livello esterno dell'atomo di zolfo sono coinvolti nella formazione di legami H-S-H. La molecola H 2 S ha una forma angolare, quindi è polare.
^ Essere nella natura
L'idrogeno solforato si trova in natura nei gas vulcanici e nelle acque di alcune fonti minerali, come Pyatigorsk, Matsesta. È formato dal decadimento di sostanze organiche contenenti zolfo da vari residui di animali e piante. Questo spiega il caratteristico odore sgradevole di acque reflue, pozzi neri e discariche.
reception
1. L'idrogeno solforato può essere ottenuto per collegamento diretto di zolfo con idrogeno mediante riscaldamento:
2. Di solito si ottiene per azione dell'acido cloridrico diluito o dell'acido solforico sul solfuro di ferro (III):
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Questa reazione viene spesso eseguita nell'apparato Kipp.
^ Proprietà fisiche
In condizioni normali, l'idrogeno solforato è un gas incolore con un forte odore caratteristico di uova marce. Molto tossico, l'inalazione si lega all'emoglobina, provocando la paralisi, che non è salutare.
Ko conduce alla morte. A basse concentrazioni, meno pericoloso. È necessario lavorare con esso in armadi di scarico o con dispositivi chiusi ermeticamente. Il contenuto ammissibile di H 2 S nei locali di produzione è di 0,01 mg per 1 litro di aria.
L'idrogeno solforato è relativamente ben solubile in acqua (a 20 ° С 2,5 volumi di idrogeno solforato si sciolgono in 1 volume d'acqua).
Una soluzione di idrogeno solforato in acqua è chiamata acqua solfidrico o acido solfidrico (rileva le proprietà di un acido debole).
^ Proprietà chimiche
1, Quando fortemente riscaldato, l'idrogeno solforato si decompone quasi completamente per formare zolfo e idrogeno.
2. L'idrogeno solforato gassoso brucia nell'aria con una fiamma blu con formazione di ossido di zolfo (IV) e acqua:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Con la mancanza di ossigeno, si formano zolfo e acqua: 2H 2 S O 2 = 2S 2H 2 O
3. L'idrogeno solforato è un agente riducente piuttosto forte. Questa importante proprietà chimica può essere spiegata come segue. In una soluzione di H 2 S, è relativamente facile donare elettroni alle molecole di ossigeno dell'aria:
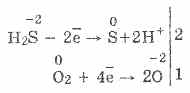
Allo stesso tempo, l'ossigeno nell'aria ossida l'idrogeno solforato in zolfo, il che rende l'acqua solfidrico idratata:
2H 2 S O 2 = 2S 2H 2 O
Questo spiega il fatto che l'idrogeno solforato non si accumula in quantità molto grandi in natura quando la materia organica decade - l'ossigeno dell'aria lo ossida per liberare lo zolfo.
4, l'idrogeno solforato reagisce vigorosamente con soluzioni alogene, ad esempio:
H 2 S I 2 = 2HI S Lo zolfo viene liberato e la soluzione di iodio si scolorisce.
5. Vari ossidanti reagiscono vigorosamente con l'idrogeno solforato: sotto l'azione dell'acido nitrico si forma zolfo libero.
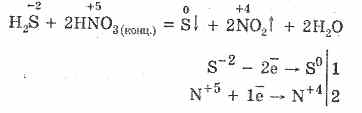
6. Una soluzione di idrogeno solforato è acida a causa della dissociazione:
H 2 SH HS - HS - H S -2
Il primo stadio di solito prevale. È un acido molto debole: più debole dell'acido di carbone, che di solito sposta H 2 S dai solfuri.
Solfuri e idrosolfuri
L'acido fluoridrico, come dibasico, forma due file di sali:
Medio - solfuri (Na 2 S);
Sour - hydrosulfides (NaHS).
Questi sali possono essere ottenuti: mediante l'interazione di idrossidi con idrogeno solforato: 2NaOHH 2 S = Na 2 S 2H 2 O
L'interazione diretta dello zolfo con i metalli:
La reazione di scambio di sali con H 2 S o tra sali:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Gli idrosolfuri sono quasi tutti solubili in acqua.
I solfuri di metalli alcalini e alcalino-terrosi sono anche facilmente solubili in acqua, incolori.
I solfuri di metalli pesanti sono praticamente insolubili o leggermente solubili in acqua (FeS, MnS, ZnS); Alcuni di loro non si dissolvono in acidi diluiti (CuS, PbS, HgS).
Come sali di un acido debole, i solfuri in soluzioni acquose sono fortemente idrolizzati. Ad esempio, i solfuri di metalli alcalini, quando sciolti in acqua, hanno una reazione alcalina:
Na 2 S НОНNaHS NaOH
Tutti i solfuri, come l'idrogeno solforato stesso, sono agenti riducenti vigorosi:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
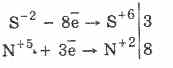
Alcuni solfuri hanno un colore caratteristico: CuS e PbS - nero, CdS - giallo, ZnS - bianco, MnS - rosa, SnS - marrone, Al 2 S 3 - arancione. L'analisi qualitativa dei cationi si basa sulle diverse solubilità dei solfuri e sui diversi colori di molti di essi.
^ 4.3. Ossido di zolfo (IV) e acido solforico
L'ossido di zolfo (IV), o anidride solforosa, in condizioni normali, è un gas incolore con un forte odore soffocante. Una volta raffreddato a -10 ° C, si liquefa in un liquido incolore.
reception
1. In condizioni di laboratorio, l'ossido di zolfo (IV) è ottenuto da sali di acido solforoso mediante l'azione di acidi forti su di essi:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
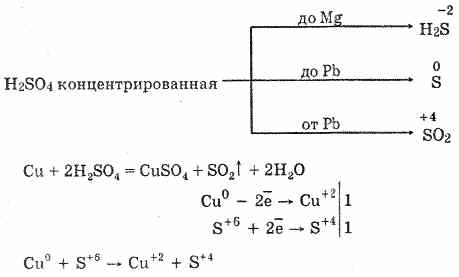
2. Anche l'anidride solforosa è formata dall'interazione dell'acido solforico concentrato quando riscaldato con metalli a bassa attività:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. L'ossido di zolfo (IV) si forma anche quando lo zolfo viene bruciato in aria o ossigeno:
4. In condizioni industriali, l'SO 2 si ottiene arrostendo pirite con FeS 2 o minerali di zolfo di metalli non ferrosi (blenda zinco ZnS, piombo lucido PbS, ecc.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
La formula strutturale della molecola SO 2:
Quattro atomi di zolfo e quattro elettroni di due atomi di ossigeno partecipano alla formazione di legami nella molecola di SO 2. La reciproca repulsione delle coppie di elettroni di legame e la coppia di zolfo di elettroni solitari conferisce alla molecola una forma angolare.
Proprietà chimiche
1. L'ossido di zolfo (IV) presenta tutte le proprietà degli ossidi acidi:
Interazione dell'acqua
Interazione con alcali,
Interazione con ossidi di base.
2. L'ossido di zolfo (IV) è caratterizzato da proprietà riducenti:
S 4 O 2 O 0 2 2S 6 O -2 3 (in presenza di un catalizzatore, quando riscaldato)
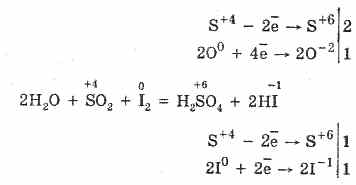
Ma in presenza di forti agenti riducenti, SO 2 si comporta come un agente ossidante:
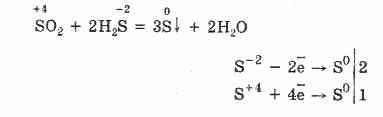
La dualità redox dell'ossido di zolfo (IV) è spiegata dal fatto che lo zolfo ha uno stato di ossidazione di 4 in esso, e quindi può, cedendo 2 elettroni, essere ossidato a S 6, e prendendo 4 elettroni, può essere ridotto a S °. La manifestazione di queste o altre proprietà dipende dalla natura del componente reattivo.
L'ossido di zolfo (IV) è altamente solubile in acqua (40 volumi di SO 2 si dissolvono in 1 volume a 20 ° С). In questo caso si forma acido solforoso che esiste solo in soluzione acquosa:
SO 2 H 2 ОH 2 SO 3
La reazione è reversibile. In soluzione acquosa, l'ossido di zolfo (IV) e l'acido solforoso sono in equilibrio chimico, che può essere spostato. Con il legame di H 2 SO 3 (neutralizzazione dell'acido
Tu) la reazione procede nella direzione della formazione di acido solforoso; quando si rimuove SO 2 (soffiando attraverso una soluzione di azoto o di riscaldamento), la reazione procede verso i materiali di partenza. La soluzione di acido solforico contiene sempre ossido di zolfo (IV), che gli conferisce un forte odore.
L'acido solforico ha tutte le proprietà degli acidi. In soluzione si dissocia in passaggi:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Termicamente instabile, volatile. L'acido solforoso, come dibasico, forma due tipi di sali:
Medio - solfiti (Na 2 SO 3);
Sour - hydrosulfite (NaHSO 3).
I solfiti si formano quando l'alcali è completamente neutralizzato dall'acido:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
Hydrosulphites sono ottenuti con una mancanza di alcali:
H 2 SO 3 NaOH = NaHSO 3 H 2 O
L'acido solforico e i suoi sali possiedono sia proprietà ossidanti che riducenti, il che è determinato dalla natura del partner di reazione.
1. Quindi, sotto l'azione dei solfiti di ossigeno sono ossidati ai solfati:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
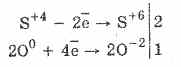
L'ossidazione dell'acido solforoso da parte del bromo e del permanganato di potassio procede ancora più facilmente:
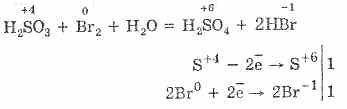
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
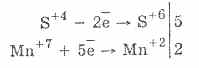
2. In presenza di agenti riducenti più vigorosi, i solfiti presentano proprietà ossidanti:
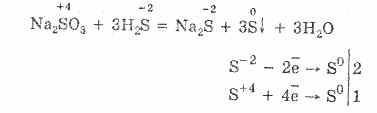
Quasi tutti gli idrosolfiti e i solfiti di metalli alcalini si dissolvono da sali di acido solforoso.
3. Poiché H 2 SO 3 è un acido debole, l'azione degli acidi su solfiti e idrosolfiti determina il rilascio di SO 2. Questo metodo viene solitamente utilizzato quando si ottiene SO 2 in condizioni di laboratorio:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. I solfiti solubili in acqua subiscono facilmente idrolisi, a seguito della quale la concentrazione di ioni OH aumenta nella soluzione:
Na 2 SO 3 NONNaHSO 3 NaOH
applicazione
L'ossido di zolfo (IV) e l'acido solforoso scoloriscono molti coloranti, formando con essi composti incolori. Quest'ultimo può scoppiare di nuovo quando riscaldato o alla luce, a seguito del quale il colore viene ripristinato. Pertanto, l'effetto sbiancante di SO 2 e H 2 SO 3 è diverso dall'effetto sbiancante del cloro. Solitamente, lo zolfo (IV) rxid sbianca lana, seta e paglia.
L'ossido di zolfo (IV) uccide molti microrganismi. Pertanto, per distruggere i funghi della muffa, essi affumicano le cantine, le cantine, le botti di vino, ecc., E vengono utilizzati anche per il trasporto e lo stoccaggio di frutta e bacche. In grandi quantità, l'ossido di zolfo IV) viene utilizzato per produrre acido solforico.
Un'importante applicazione è la soluzione di calcio all'idrosolfito CaHSO 3 (solfito), che viene utilizzato per il trattamento del legno e della pasta di carta.
^ 4.4. Ossido di zolfo (VI). Acido solforico
L'ossido di zolfo (VI) (vedi tab. 20) è un liquido incolore che si solidifica a una temperatura di 16,8 ° С in una massa cristallina solida. Assorbe l'umidità molto forte, formando acido solforico: SO 3 H 2 O = H 2 SO 4
Tabella 20. Proprietà degli ossidi di zolfo
La dissoluzione degli ossidi di zolfo (VI) nell'acqua è accompagnata dal rilascio di una quantità significativa di calore.
L'ossido di zolfo (VI) è molto solubile in acido solforico concentrato. Una soluzione di SO 3 in un acido anidro è chiamata oleum. I grassi possono contenere fino al 70% di SO 3.
reception
1. L'ossido di zolfo (VI) è ottenuto per ossidazione del biossido di zolfo con ossigeno in presenza di catalizzatori a una temperatura di 450 ° С (vedere Produzione di acido solforico):
2SO 2 O 2 = 2SO 3
2. Un altro modo per ossidare SO 2 in SO 3 è usare ossido nitrico (IV) come agente ossidante:
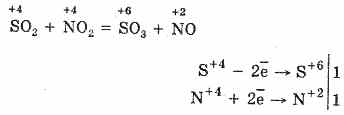
L'ossido di azoto risultante (II) quando interagisce con l'ossigeno atmosferico si trasforma facilmente e rapidamente in ossido nitrico (IV): 2NO O 2 = 2NO 2
Che può essere nuovamente utilizzato nell'ossidazione di SO 2. Pertanto, NO 2 funge da vettore di ossigeno. Questo metodo di ossidazione di SO 2 in SO 3 è chiamato nitroso. La molecola di SO 3 ha la forma di un triangolo, al centro del quale
L'atomo di zolfo si trova:
Una tale struttura è dovuta alla reciproca repulsione delle coppie di elettroni di legame. Un atomo di zolfo ha fornito sei elettroni esterni per la loro formazione.
Proprietà chimiche
1. SO 3 - ossido di acido tipico.
2. L'ossido di zolfo (VI) ha le proprietà di un forte agente ossidante.
applicazione
L'ossido di zolfo (VI) è usato per produrre acido solforico. Il più importante è il metodo di contatto per ottenere
Acido solforico Con questo metodo, è possibile ottenere H 2 SO 4 di qualsiasi concentrazione, così come oleum. Il processo consiste in tre fasi: ottenendo SO 2; ossidazione di SO 2 in SO 3; ottenendo H 2 SO 4.
SO 2 si ottiene bruciando la pirite FeS 2 in forni speciali: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Per accelerare la tostatura, la pirite è pre-macinata, e per una combustione più completa dello zolfo, viene iniettata molta più aria (ossigeno) di quella richiesta dalla reazione. Il gas che esce dal forno è costituito da ossido di zolfo (IV), ossigeno, azoto, composti di arsenico (da impurità nelle piriti) e vapore acqueo. Si chiama gas torrefazione.
Il gas di torrefazione subisce una pulizia accurata, poiché anche un piccolo contenuto di composti di arsenico, oltre a polvere e umidità, avvelena il catalizzatore. Il gas viene pulito da composti di arsenico e polvere, facendolo passare attraverso speciali precipitatori elettrostatici e una torre di lavaggio; l'umidità viene assorbita dall'acido solforico concentrato in una torre di essiccazione. Il gas purificato contenente ossigeno viene riscaldato in uno scambiatore di calore fino a 450 ° C ed entra nell'apparato di contatto. All'interno dell'apparato di contatto sono scaffali a reticolo riempiti con catalizzatore.
In precedenza, il platino metallico finemente triturato veniva usato come catalizzatore. Successivamente, è stato sostituito da composti di vanadio - ossido di vanadio (V) V 2 O 5 o vanadyl solfato VOSO 4, che è più economico del platino e più lentamente avvelenato.
La reazione di ossidazione di SO 2 a SO 3 è reversibile:
2SO 2 O 2 2SO 3
Un aumento del contenuto di ossigeno nel gas calcinabile aumenta la resa di ossido di zolfo (VI): a una temperatura di 450 ° C, raggiunge solitamente il 95% o più.
L'ossido di zolfo formato (VI) viene quindi alimentato con un metodo in controcorrente a una torre di assorbimento, dove viene assorbito dall'acido solforico concentrato. Man mano che si satura, si formano prima acido solforico anidro e poi oleum. In futuro, l'oleum viene diluito al 98% di acido solforico e consegnato ai consumatori.
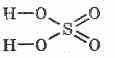
La formula strutturale dell'acido solforico:
^ Proprietà fisiche
L'acido solforico è un liquido pesante, incolore, oleoso che cristallizza a 10,4 ° C, quasi il doppio ( = 1,83 g / cm 3) è più pesante dell'acqua, inodore, non volatile. Estremamente igroscopico. L'umidità assorbe con il rilascio di grandi quantità di calore, quindi non puoi versare l'acqua all'acido solforico concentrato - ci sarà uno spruzzo di acido. Per il
L'acido solforico deve essere aggiunto all'acqua in piccole porzioni.
L'acido solforico anidro scioglie fino al 70% di ossido di zolfo (VI). Una volta riscaldato, rimuove SO 3 fino a formare una soluzione con una frazione di massa di H 2 SO 4 di 98,3%. L'H 2 SO 4 anidro quasi non conduce corrente elettrica.
^ Proprietà chimiche
1. Si mescola con acqua in qualsiasi proporzione e forma idrati di diversa composizione:
H 2 SO 4 H 2 O, H 2 SO 4 2 H 2 O, H 2 SO 4 3 H 2 O, H 2 SO 4 4 H 2 O, H 2 SO 4 6.5 H 2 O
2. L'acido solforico concentrato carbonizza la sostanza organica - zucchero, carta, legno, fibre, togliendo loro gli elementi dell'acqua:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Il carbone formato interagisce parzialmente con l'acido:
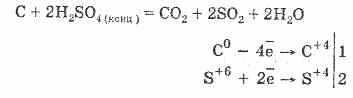
La disidratazione del gas si basa sull'assorbimento di acqua da parte dell'acido solforico.
Come un forte acido non volatile, H 2 SO 4 sposta altri acidi dai sali secchi:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Tuttavia, se si aggiunge H 2 SO 4 alle soluzioni saline, non si verifica spostamento di acido.
H 2 SO 4 - acido dibasico forte: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2- 4
Ha tutte le proprietà degli acidi forti non volatili.
L'acido solforico diluito è caratterizzato da tutte le proprietà degli acidi non ossidanti. Vale a dire: interagisce con i metalli che si trovano nella serie elettrochimica della tensione dei metalli fino all'idrogeno:
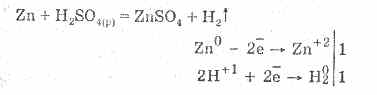
L'interazione con i metalli è dovuta alla riduzione degli ioni idrogeno.
6. L'acido solforico concentrato è un agente ossidante energetico. Quando riscaldato, ossida la maggior parte dei metalli, compresi quelli delle serie elettrochimiche di stress dopo l'idrogeno, non reagisce solo con platino e oro. A seconda dell'attività del metallo, i prodotti di riduzione possono essere S -2, S ° e S 4.
Nel freddo, l'acido solforico concentrato non interagisce con metalli così forti come l'alluminio, il ferro e il cromo. Ciò è dovuto alla passivazione dei metalli. Questa funzione è ampiamente utilizzata quando viene trasportata in un contenitore di ferro.
Tuttavia, quando riscaldato:
Pertanto, l'acido solforico concentrato interagisce con i metalli a causa della riduzione degli atomi formanti acido.
Una reazione qualitativa allo ione solfato SO 2-4 è la formazione di un precipitato cristallino bianco di BaSO 4, insolubile in acqua e acidi:
SO 2- 4 Ba 2 BaSO 4
applicazione
L'acido solforico è il prodotto più importante dell'industria chimica principale impegnata nella produzione di
Acidi organici, alcali, sali, fertilizzanti minerali e cloro.
Per una varietà di applicazioni l'acido solforico è al primo posto tra gli acidi. La maggior parte di essa viene consumata per ottenere fertilizzanti fosfatici e azotati. Essendo non volatile, l'acido solforico viene utilizzato per produrre altri acidi - cloridrico, fluoridrico, fosforico e acetico.
Gran parte di ciò è destinato alla purificazione dei prodotti petroliferi - benzina, cherosene, oli lubrificanti - dalle impurità nocive. Nell'ingegneria meccanica, l'acido solforico pulisce la superficie metallica dagli ossidi prima del rivestimento (nichelatura, cromatura, ecc.). L'acido solforico è utilizzato nella produzione di esplosivi, fibre artificiali, coloranti, materie plastiche e molti altri. È usato per riempire le batterie.
I sali di acido solforico sono importanti.
^ Solfato di sodioNa 2 SO 4 cristallizza da soluzioni acquose nella forma di un idrato di Na 2 SO 4 10H 2 O, che è chiamato sale di Glauber. È usato in medicina come lassativo. Il solfato di sodio anidro viene utilizzato nella produzione di soda e vetro.
^ Solfato di ammonio(NH 4) 2 SO 4 - fertilizzante azotato.
Solfato di potassioK 2 SO 4 - concime di potassio.
Solfato di calcio Il CaSO 4 si trova in natura sotto forma di minerale di gesso CaSO 4 2H 2 O. Quando viene riscaldato a 150 ° C, perde parte dell'acqua e va in un idrato di 2CaSO 4 H 2 O, chiamato gesso bruciato o alabastro. Quando viene mescolato con acqua in una massa pastosa, l'alabastro si indurisce di nuovo dopo un po 'di tempo, trasformandosi in CaSO 4 2H 2 O. Il gesso è ampiamente usato nella costruzione (intonaco).
^ Magnesio solfatoL'MgSO 4 si trova nell'acqua di mare, causando il suo sapore amaro. L'idrato cristallino, chiamato sale amaro, è usato come lassativo.
vetriolo- nome tecnico di idrati cristallini di solfati metallici Fe, Cu, Zn, Ni, Co (i sali disidratati non sono sostanze vitali). Solfato di rameCuSO 4 5H 2 O è una sostanza tossica blu. Le piante vengono spruzzate con una soluzione diluita e i semi vengono seminati prima della semina. Vetriolo di ferroFeSO 4 7H 2 O è una sostanza verde chiaro. Utilizzato per controllare i parassiti di piante, inchiostri, vernici minerali, ecc. Solfato di zincoZnSO 4 7H 2 O viene utilizzato nella produzione di inchiostri minerali, in sittoprechatanii, medicina.
^ 4.5. Esteri di acido solforico. Tiosolfato di sodio
Gli esteri di acido solforico comprendono dialchil solfati (RO 2) SO 2. Questi sono alti liquidi bollenti; più basso solubile in acqua; in presenza di alcali si formano alcol e sali dell'acido solforico. I dialchil solfati inferiori sono agenti alchilanti.
Dietil solfato(C 2 H 5) 2 SO 4. Punto di fusione -26 ° С, punto di ebollizione 210 ° С, solubile in alcoli, insolubile in acqua. Ottenuto facendo reagire acido solforico con etanolo. È l'agente etilante nella sintesi organica. Penetra la pelle.
Dimetil solfato(CH 3) 2 SO 4. Punto di fusione -26,8 ° С, punto di ebollizione 188,5 ° С. Solubile in alcoli, cattivo - in acqua. Reagisce con ammoniaca in assenza di solvente (con un'esplosione); Zolfo alcuni composti aromatici, come gli esteri fenolici. È ottenuto per interazione del 60% di oleum con metanolo a 150 ° С. È un agente metilante in sintesi organica. Cancerogeno, colpisce gli occhi, la pelle, gli organi respiratori.
^ Tiosolfato di sodio Na 2 S 2 O 3
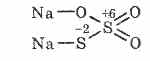
Sale di acido tiosolfurico in cui due atomi di zolfo hanno differenti stati di ossidazione: 6 e -2. Sostanza cristallina, ben solubile in acqua. Disponibile sotto forma di Na 2 S 2 O 3 5H 2 O cristallino, comunemente indicato come iposolfito. Ottenuto dall'interazione del solfito di sodio con zolfo durante la bollitura:
Na 2 SO 3 S = Na 2 S 2 O 3
Come l'acido tiosolfurico, è un forte agente riducente, facilmente ossidabile dal cloro all'acido solforico:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
L'uso di tiosolfato di sodio per l'assorbimento del cloro (nelle prime maschere antigas) si basava su questa reazione.
Ossidazione leggermente diversa si verifica sodio tiosolfato agenti ossidanti deboli. Questo forma i sali di acido tetrathionic, per esempio:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Il tiosolfato di sodio è un sottoprodotto nella produzione di NaHSO 3, coloranti di zolfo, nella purificazione dei gas industriali dallo zolfo. È usato per rimuovere le tracce di cloro dopo i tessuti sbiancanti, per estrarre l'argento dai minerali; è un fissativo in fotografia, un reagente in iodometria, un antidoto per avvelenamento con composti di arsenico, mercurio, un agente antinfiammatorio.
Lo zolfo elemento chimico si trova nel gruppo VIА, periodo 3 PSCE. Sullo strato di elettroni esterni dell'atomo di zolfo ci sono 6 elettroni. Mostrando le proprietà dell'agente ossidante nella formazione di sostanze con metalli e idrogeno, lo zolfo acquisisce lo stato di ossidazione -2 (prende 2 elettroni).
Nella composizione di composti contenenti ossigeno, lo zolfo mostra stati di ossidazione +4 e +6. Pertanto, lo zolfo è caratterizzato da stati di ossidazione -2; 0; 4; 6.
In natura, lo zolfo si trova nel suo stato nativo e nella composizione dei minerali. Ad esempio, lo zolfo contiene piombo lucido (il componente principale è piombo solfuro PbS) e rame lucido (il componente principale è il solfuro di rame Cu 2 S).
Lo zolfo forma alcune sostanze semplici - modificazioni allotropiche. Lo zolfo rombico è più stabile a temperatura ambiente (figura 1). Questa sostanza è composta da molecole di S 8. Lo zolfo rombico è giallo e si scioglie a una temperatura di + 112,8 ° C.
Fig. 1. Modifica rombica dello zolfo
Quando riscaldato, lo zolfo rombico si trasforma gradualmente in una massa viscosa marrone scuro. Questa è un'altra modifica allotropica dello zolfo - zolfo di plastica. Lo zolfo di plastica è costituito da molecole di zolfo lineare S n.
Lo zolfo nelle reazioni chimiche con metalli e idrogeno svolge il ruolo di un agente ossidante. Il suo grado di ossidazione diminuisce da 0 a -2. Nella reazione con l'ossigeno, lo zolfo agisce come agente riducente, aumentando il suo grado di ossidazione da 0 a +4.
Considera esempi di interazioni che coinvolgono lo zolfo.
Quando lo zolfo interagisce con l'idrogeno, si forma l'idrogeno solforato:
Quando lo zinco interagisce con lo zolfo, si forma il solfuro di zinco:
Lo zolfo brucia in ossigeno con la formazione di ossido di zolfo (IV) (Fig. 2):

Fig. 2. Zolfo in fiamme in ossigeno
Considerare le proprietà dei composti dello zolfo con lo stato di ossidazione "-2". Tali composti includono acido solfidrico e solfuri - sali dell'acido acido solfidrico.
L'idrogeno solforato è un gas con l'odore di uova marce. Brucia nell'aria. Inoltre, con una mancanza e un eccesso di ossigeno, la combustione procede in modo diverso.
In un eccesso di ossigeno, l'acido solfidrico brucia per formare ossido di zolfo (IV) e acqua:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Con la mancanza di ossigeno, la combustione incompleta dell'idrogeno solforato si verifica con il rilascio di zolfo: 2H 2 S + O 2 = 2S + 2H 2 O.
L'idrogeno solforato è altamente solubile in acqua. La soluzione risultante è un acido acido solfidrico debole. I sali di idrogeno solforato sono chiamati solfuri. L'acido fluoridrico e i solfuri idrosolubili entrano nelle reazioni di scambio.
L'interazione tra acido idrogeno solforato e cloruro di rame (II) forma solfuro di rame (II) insolubile e acido cloridrico: H 2 S + CuCl 2 = CuS + 2HCl.
Quando il solfuro di potassio interagisce con il nitrato di zinco, si formano precipitati solfuro di zinco e nitrato di potassio: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
riferimenti
- Orzhekovsky P.A. Raccolta di compiti ed esercizi in chimica: 9 ° grado: al libro di testo P.A. Orzhekovsky e altri. "Chimica. Grado 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2007. (pagina 91-97)
- Orzhekovsky P.A. Chimica: 9 ° grado: studi. per immagine generale. stabilita. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Chimica: 9 ° grado: studi per generale. stabilita. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Chimica: neorgan. la chimica. Autorità. Chimica: studi. per 9 cl. / G.E. Rudzitis, F.G. Feldman. - M.: Education, Moscow Textbooks OJSC, 2009.
- Khomchenko I.D. Raccolta di compiti ed esercizi in chimica per la scuola superiore. - M.: RIA "New Wave": editore Umerenkov, 2008.
- Enciclopedia per bambini. Volume 17. Chimica / Capitolo. Ed. VA Volodin, Ved. scientifica. Ed. I. Leenson. - M.: Avanta +, 2003.
- Una singola raccolta di risorse educative digitali (esperienze video sull'argomento) ().
- Versione elettronica della rivista "Chemistry and Life" ().
compito
- a. 136 n. 3; p.140 № 2-4 dal libro di testo P.A. Orzhekovsky "Chimica: 9 ° grado" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013.
solfuri (dal lat zolfo, zolfo - zolfo)
composti di zolfo con più elementi elettropositivi; possono essere considerati come sali dell'acido dell'acido solfidrico (Vedi Acido idrogeno solforato) H 2 S. Esistono due serie C: la media (normale) della formula generale M 2 S e l'acido (idrosolfuri) della formula generale MHS, dove M è un metallo monovalente. C. I metalli alcalini sono incolori, solubili in acqua. Le loro soluzioni acquose sono altamente idrolizzate e alcaline. Sotto l'azione di acidi diluiti emettono H 2 S. C. I metalli alcalino-terrosi sono incolori, leggermente solubili in acqua. H 2 S viene emesso in aria umida Altre proprietà sono simili ai metalli di S. alcali. Sia quelli che altri S. sono facilmente ossidati ai solfati. C. i metalli pesanti sono praticamente insolubili in acqua. Quasi tutti sono neri o neri-marroni (con l'eccezione di ZnS bianco, MnS rosato, CdS giallo, Sb 2 S 3 rosso arancio, SnS 2 giallo). Il rapporto disuguale tra C. e acidi e C. ammonio è utilizzato nell'analisi chimica. I.K. Malina.
Grande Enciclopedia Sovietica. - M.: Enciclopedia sovietica. 1969-1978 .
Scopri cosa sono "solfuri" in altri dizionari:
Composti di zolfo con metalli e alcuni non metalli. I solfuri metallici sono sali dell'acido idrogeno solforato H2S: medio (ad esempio Na2S) e acido o idrosolfuri (NaHS). Bruciando solfuri naturali si ottengono metalli non ferrosi e SO2. Fosforo solforato e ... ... Grande dizionario enciclopedico
Enciclopedia moderna
solfuri - SULFIDI, solfuri inorganici di composti dello zolfo con metalli e alcuni non metalli. Incluso in minerali di solfuro; usato come fosforo (ad esempio, CdS, ZnS). Solfuro di molibdeno, lubrificanti solidi al titanio. Solfuri di fosforo ... ... Dizionario enciclopedico illustrato
- (nuovo lat., dal latino zolfo sulfur). Composti di alcuni corpi con zolfo, corrispondenti a ossidi o acidi. Dizionario di parole straniere incluso nella lingua russa. Chudinov, AN, 1910. SULFIDES Novolatinsk., Da Lat. zolfo, zolfo. Connessione ... ... Dizionario di parole straniere della lingua russa
1. Composti di zolfo naturale di metalli e alcuni non metalli. Nella chimica le relazioni sono considerate come sali dell'acido idrogeno solforato H2S. Un certo numero di elementi forma polisolfuri con zolfo, che sono sali dell'acido poli solfureo H2Sx. Il principale ... ... Enciclopedia geologica
solfuri - - composti dello zolfo con metalli e alcuni non metalli; sali di solfuri metallici di acido idrogeno solforato H2S. [Dizionario terminologico per calcestruzzo e cemento armato. Vendo "SIC" Costruzioni "NIIZHB e A. A. Gvozdeva stazione della metropolitana, Mosca, 2007. 110 p.] ... ... Enciclopedia di termini, definizioni e spiegazioni di materiali da costruzione
SULPHES, s, u solfuro, a, marito (Spec.). Composti chimici di zolfo con metalli e alcuni non metalli. Organico con Naturale s. | adj. solfuro, oh, oh Dizionario Ozhegova. SI Ozhegov, N. Yu. Shvedova. 1949 1992 ... Dizionario Ozhegova
Solfuri, R2S (radicale aromatico R), si ottengono più facilmente aggiungendo goccia a goccia una soluzione di sali di diazo a 60 70 ... Enciclopedia di Brockhaus e Efron
solfuri - (1) in chimica inorganica, tali composti di elementi con zolfo, in cui gli atomi di zolfo hanno uno stato di ossidazione di 2. In chimica. le relazioni sono considerate come sali dell'acido acido solfidrico debole (soluzione acquosa di H2S). Molti S. sono naturali ... ... Grande enciclopedia politecnica
s; pl. (unità solfuro e; m.). [dal lat. zolfo di zolfo] Chem. Composti di zolfo con metalli e alcuni non metalli. C. titanio. Organico con Naturale s. (classe di minerali). ◁ solfuro, th, oh. Con miscele miste Dal minerale metallifero. * * * solfuri di composti di zolfo ... Dizionario enciclopedico
- (dal latino zolfo di zolfo) una classe di composti chimici che sono composti di metallo (nonché un numero di non metalli B, Si, P, As) con zolfo (S), dove ha uno stato di ossidazione di -2. Può essere considerato come sali di idrogeno solforato ... ... Wikipedia
libri
- Depositi di uranio del tipo di disaccordo nel Fanerozoico, Andrei Borisovich Khalezov. Le caratteristiche dei depositi di uranio nelle strutture del fiume paleo-valle sulle superfici di disaccordo strutturale e stratigrafico sono considerate sull'esempio di tre regioni della regione degli Urali con differenti ...
zolfo - L'elemento del 3 ° periodo e il gruppo VIA del sistema Periodico, numero di serie 16, si riferisce a calcogeni. La formula elettronica dell'atomo [10 Ne] 3s 2 3p 4, gli stati caratteristici di ossidazione 0, -II, + IV e + VI, lo stato S VI è considerato stabile.
Scala di ossidazione dello zolfo:
L'elettronegatività dello zolfo è 2,60, è caratterizzata da proprietà non metalliche. Nei composti dell'idrogeno e dell'ossigeno è contenuto in vari anioni, forma acidi contenenti ossigeno e i loro sali, composti binari.
In natura - quindicesimo elemento di prevalenza chimica (il settimo tra non metalli). Si trova nel modulo gratuito (nativo) e correlato. Un elemento vitale per gli organismi superiori.
Zolfo S. Sostanza semplice Giallo cristallino (α-rombico e β-monoclino,
a 95,5 ° C) o amorfo (plastica). Nei siti del reticolo ci sono molecole S 8 (cicli di tipo "corona" non planari), lo zolfo amorfo consiste di catene S n. Sostanza a basso punto di fusione, la viscosità del liquido passa attraverso un massimo a 200 ° C (il divario di molecole S 8, l'intreccio di catene S n) In una coppia - molecole S 8, S 6, S 4, S 2. A 1500 ° C compare lo zolfo monoatomico (nelle equazioni chimiche per semplicità, qualsiasi zolfo è rappresentato come S).
Lo zolfo non si scioglie in acqua e in condizioni normali non reagisce con esso, è ben solubile nel disolfuro di carbonio CS 2.
Lo zolfo, specialmente in polvere, ha un'alta attività quando riscaldato. Reagisce come un agente ossidante con metalli e non metalli:
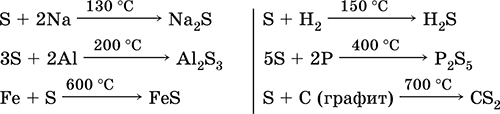
che dire? agente riducente - con fluoro, ossigeno e acidi (quando bolle):
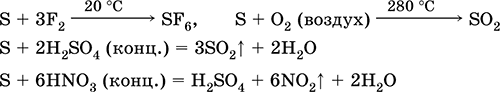
Lo zolfo subisce lo smantellamento in soluzioni alcaline:
3S 0 + 6KOH (conc.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
A temperature elevate (400 ° C) lo zolfo sposta lo iodio da ioduro di idrogeno:
S + 2ÍI (g) = I 2 + H 2 S,
ma in soluzione la reazione va nella direzione opposta:
I 2 + H 2 S (p) = 2 HI + S ↓
reception: in industria fuso dai depositi naturali di zolfo nativo (usando vapore acqueo), rilasciato durante la desolforazione dei prodotti di gassificazione del carbone.
Lo zolfo è usato per sintetizzare il disolfuro di carbonio, l'acido solforico, i coloranti solforosi (vat), la vulcanizzazione della gomma, come mezzo per proteggere le piante dall'oidio e per il trattamento delle malattie della pelle.
Acido solfidrico H 2 S. Acido privo di ossigeno. Gas incolore con un odore soffocante, più pesante dell'aria. La molecola ha la struttura di un tetraedro doppio incompleto [:: S (H) 2]
(sp 3 - ibridizzazione, l 'angolo del jack H - S - H è lontano dal tetraedrico). Instabile se riscaldato sopra i 400 ° C. È leggermente solubile in acqua (2,6 l / 1 l H 2 O a 20 ° C), una soluzione satura è decimolare (0,1 M, "acqua di idrogeno solforato"). Un acido molto debole in soluzione, praticamente non si dissocia dal secondo stadio agli ioni S 2- (la concentrazione massima di S 2 -1 è pari a 1 10 -13 mol / l). Quando si trova in aria, la soluzione diventa torbida (inibitore - saccarosio). È neutralizzato dagli alcali, non completamente - dall'ammoniaca idrato. Forte agente riducente. Entra nelle reazioni di scambio ionico. Agente solfuro, precipitato da una soluzione di solfuri di diverso colore con bassissima solubilità.
Reazioni qualitative - sedimentazione di solfuri, nonché combustione incompleta di H 2 S con formazione di un deposito di zolfo giallo su un oggetto freddo introdotto nella fiamma (spatola di porcellana). Un sottoprodotto di raffinazione del petrolio, gas naturale e cokeria.
Viene utilizzato nella produzione di composti contenenti zolfo, inorganici e organici contenenti zolfo come reagente analitico. Estremamente velenoso. Le equazioni delle reazioni più importanti:
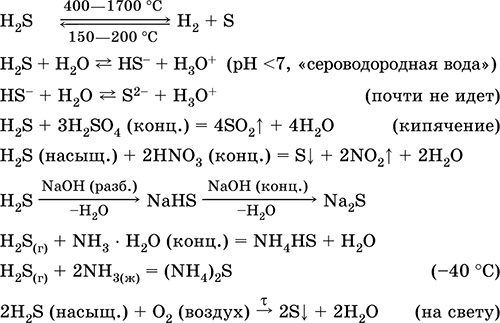

reception: in industria - sintesi diretta:
H 2 + S = H 2 S(150-200 ° C)
o riscaldando zolfo con paraffina;
nel laboratorio - dislocazione di solfuri da parte di acidi forti
FeS + 2НCl (conc.) = FeCl 2 + H 2 S
o completa idrolisi di composti binari:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Solfuro di sodio Na 2 S. Sale senza ossigeno. Bianco, molto igroscopico. Si scioglie senza decomposizione, termicamente stabile. È ben solubile in acqua, idrolizzato dall'anione, crea un mezzo altamente alcalino in soluzione. Quando si trova in aria, la soluzione diventa torbida (zolfo colloidale) e diventa gialla (colorante polisolfuro). Tipico agente riducente. Allega zolfo. Entra nelle reazioni di scambio ionico.
Reazioni qualitative su S 2 - deposizione di solfuri metallici variamente colorati, di cui MnS, FeS, ZnS sono decomposti in HCl (s).
Viene utilizzato nella produzione di coloranti di zolfo e cellulosa, per rimuovere i peli delle pelli durante l'abbronzatura della pelle, come reagente nella chimica analitica.
Le equazioni delle reazioni più importanti:
Na 2 S + 2НCl (dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (conc.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (fino a 50 ° C)
Na 2 S + 4HNO 3 (conc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (sat.) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (sopra i 400 ° C)
Na 2 S + 4H 2 O 2 (conc.) = Na 2 SO 4 + 4H 2 O
S 2- + M 2+ = MnS (corporale) ↓; FeS (nero) ↓; ZnS (bianco) ↓
S 2- + 2Ag + = Ag 2 S (nero) ↓
S 2- + M 2+ = CdS (giallo) ↓; PbS, CuS, HgS (nero) ↓
3S 2- + 2Bi 3+ = Bi 2 S 3 (corr. - nero) ↓
3S 2- + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
reception nel industria - calcinazione del minerale mirabilite Na 2 SO 4 10H 2 O in presenza di agenti riducenti:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, cat. Fe 2 O 3)
Na 2 SO 4 + 4C (coke) = Na 2 S + 4CO (800-1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600-700 ° C)
Alluminio solfuro Al 2 S 3. Sale senza ossigeno. Bianco, il legame Al - S è prevalentemente covalente. Si scioglie senza decomposizione sotto l'eccessiva pressione di N 2, è facilmente sublimabile. È ossidato in aria quando calcinato. Completamente idrolizzato con acqua, non precipita dalla soluzione. Scomposto da acidi forti. È usato come una solida fonte di idrogeno solforato. Le equazioni delle reazioni più importanti:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (puro)
Al 2 S 3 + 6НCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (conc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (aria) = 2Al 2 O 3 + 6SO 2 (700-800 ° C)
reception: interazione dell'alluminio con zolfo fuso in assenza di ossigeno e umidità:
2Al + 3S = AL 2 S 3(150-200 ° C)
FeS di solfuro di ferro (II). Sale senza ossigeno. Nero e grigio con una tinta verde, refrattaria, si decompone quando riscaldato nel vuoto. Nello stato umido è sensibile all'ossigeno nell'aria. Insolubile in acqua. Non precipita a causa della saturazione di soluzioni di sali di ferro (II) con idrogeno solforato. Scomposto da acidi. È usato come materia prima nella produzione di ferro, una solida fonte di idrogeno solforato.
Il composto di ferro (III) composizione di Fe 2 S 3 non noto (non ricevuto).
Le equazioni delle reazioni più importanti:
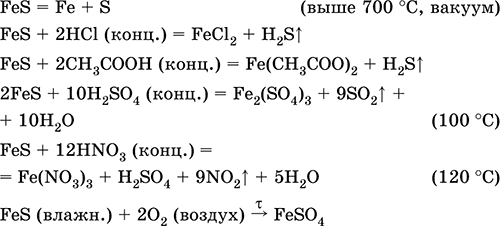
Ricezione:
Fe + S = FeS (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 FeS + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = FeS ↓ + 2NH 4 Cl + H 2 S
Ferro disolfuro FeS 2. Connessione binaria Ha la struttura ionica Fe 2+ (-S - S-) 2-. Giallo scuro, termicamente stabile, si decompone all'accensione. Insolubile in acqua, non reagisce con acidi diluiti, alcali. È decomposto da agenti ossidanti acidi, tostati all'aria. È usato come materia prima nella produzione di ferro, zolfo e acido solforico, un catalizzatore in sintesi organica. In natura - minerali minerali pirite e marcasite.
Le equazioni delle reazioni più importanti:
FeS 2 = FeS + S (sopra 1170 ° C, vuoto)
2FeS 2 + 14H 2 SO 4 (conc., Montagne) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (conc.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (aria) = 8SO 2 + 2Fe 2 O 3 (800 ° C, torrefazione)
Idrosolfuro di ammonio NH 4 HS. Sale acido privo di ossigeno. Bianco, fuso sotto pressione. Estremamente volatile, termicamente instabile. Si ossida in aria. È ben solubile in acqua, idrolizzato da cationi e anioni (prevale), crea un ambiente alcalino. La soluzione diventa gialla nell'aria. È decomposto dagli acidi, in una soluzione satura aggiunge zolfo. Gli alcali non sono neutralizzati, il sale medio (NH 4) 2 S non esiste nella soluzione (per le condizioni di ottenimento del sale medio, vedere l'intestazione "H 2 S"). Viene utilizzato come componente di photo developers, come reagente analitico (precipitatore di solfuro).
Le equazioni delle reazioni più importanti:
NH 4 HS = NH 3 + H 2 S (oltre 20 ° C)
NH 4 HS + HCl (dec.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (conc.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (sat H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
reception: saturazione della soluzione concentrata di NH 3 con idrogeno solforato:
NH 3 H 2 O (conc.) + H 2 S (g) = NH 4 HS + H 2 O
In chimica analitica, una soluzione contenente quantità uguali di NH 4 HS e NH 3 H 2 O viene convenzionalmente considerata come una soluzione di (NH 4) 2 S e la formula media del sale viene utilizzata nella scrittura delle equazioni di reazione, sebbene il solfuro di ammonio sia completamente idrolizzato in acqua in NH 4 HS e NH 3 H 2 O.
Anidride solforosa solfiti
Anidride solforosa SO 2. Ossido acido Gas incolore con un odore pungente. La molecola ha la struttura di un triangolo incompleto [: S (O) 2] (sp 2 - ibridazione), contiene σ, π - legami S = O. Facilmente liquefatto, termicamente stabile. È solubile in acqua (~ 40 l / 1 l H 2 O a 20 ° C). Forma un poliidrato con le proprietà di un acido debole, i prodotti di dissociazione ioni HSO 3 - e SO 3 2-. Ion HSO 3 - ha due forme tautomeriche - simmetrico (non acido) con la struttura del tetraedro (sp 3 - ibridazione), che predomina nella miscela, e asimmetrico (acido) con la struttura di un tetraedro incompleto [: S (O) 2 (OH)] (sp 3 - ibridizzazione). Lo ione SO 3 2- è anche tetraedrico [: S (O) 3].
Reagisce con alcali, ammoniaca idrato. Tipico agente riducente, agente ossidante debole.
Reazione qualitativa - decolorazione di "acqua di iodio" di colore giallo-marrone. Intermedio nella produzione di solfiti e acido solforico.
È usato per sbiancare lana, seta e paglia, conservare e conservare frutta, come disinfettante, antiossidante, refrigerante. Toxic.
Il composto di H 2 SO 3 (acido solforoso) non è noto (non esiste).
Le equazioni delle reazioni più importanti:
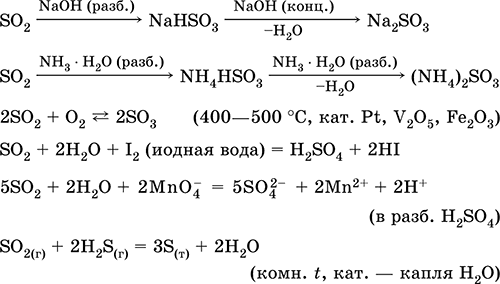
Dissoluzione in acqua e proprietà acide:
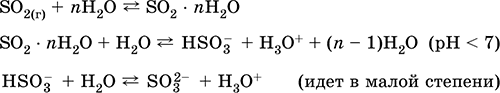
reception: nell'industria - la combustione di zolfo in aria arricchita con ossigeno e, in misura minore, la tostatura di minerali di solfuro (SO 2 - gas associato durante la tostatura della pirite):
S + O 2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, torrefazione)
in laboratorio - lo spostamento di solfiti con acido solforico:
BaSO 3 (t) + H 2 SO 4 (conc.) = BaSO 4 ↓ + SO 2 + H 2 O
Solfito di sodio Na 2 SO 3. Oksosol. Bianco. Quando riscaldato nell'aria si decompone senza sciogliersi, si scioglie sotto la sovrapressione di argon. Nello stato umido e in soluzione sensibile all'ossigeno nell'aria. È solubile in acqua, idrolizzato dall'anione. Scomposto da acidi. Tipico agente riducente.
Reazione qualitativa su SO SO 3 2- - la formazione di un precipitato bianco di solfito di bario, che viene trasferito nella soluzione con acidi forti (HCl, HNO 3).
È usato come reagente nella chimica analitica, un componente di soluzioni fotografiche, un neutralizzatore di cloro nello sbiancamento dei tessuti.
Le equazioni delle reazioni più importanti:
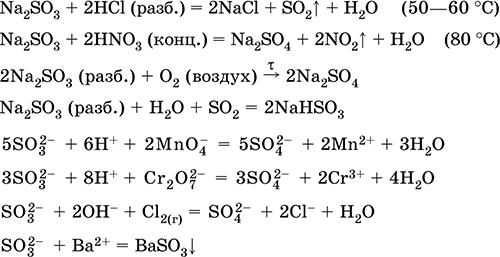
Ricezione:
Na 2 CO 3 (conc.) + SO 2 = Na 2 SO 3 + CO 2
Acido solforico solfati
Acido solforico H 2 SO 4. Acido ossoico Liquido incolore, molto viscoso (oleoso), molto igroscopico. La molecola ha una struttura tetraedrica distorta (sp 3 гиб di ibridazione), contiene legami σ covalenti S - OH e σπ - legami S = O. Lo ione SO 4 2- ha una struttura correttamente tetraedrica. Ha un ampio intervallo di temperatura dello stato liquido (~ 300 gradi). Se riscaldato sopra i 296 ° C si decompone parzialmente. Viene distillato sotto forma di miscela azeotropica con acqua (la frazione di massa dell'acido è del 98,3%, il punto di ebollizione è 296-340 ° C), si decompone completamente con un riscaldamento più forte. Illimitato si mescola con l'acqua (con forza exo-Effetto). Forte acido in soluzione, neutralizzato da alcali e ammoniaca idrato. Converte i metalli in solfati (con un eccesso di acido concentrato in condizioni normali, si formano idrosolfati solubili), ma i metalli Be, Bi, Co, Fe, Mg e Nb sono passivati nell'acido concentrato e non reagiscono con esso. Reagisce con ossidi e idrossidi basici, decompone i sali di acidi deboli. Ossidatore debole in soluzione diluita (a causa di H I), forte - in una soluzione concentrata (a causa di S VI). Bene scioglie SO 3 e reagisce con esso (si forma un liquido oleoso pesante - oleum, contiene H 2 S 2 O 7).
Reazione qualitativa su SO 4 2- ione - precipitazione del solfato di bario bianco BaSO 4 (il precipitato non viene convertito in una soluzione di acido cloridrico e nitrico, in contrasto con il precipitato bianco BaSO 3).
Viene utilizzato nella produzione di solfati e altri composti solforati, fertilizzanti minerali, esplosivi, coloranti e droghe, in sintesi organica, per "apertura" (la prima fase di lavorazione) di minerali e minerali di importanza industriale, nella raffinazione di prodotti petroliferi, elettrolisi dell'acqua, come elettrolita di batterie al piombo . Velenoso, provoca ustioni cutanee. Le equazioni delle reazioni più importanti:
reception nel industria:
a) sintesi di SO 2 da zolfo, minerali di solfuro, idrogeno solforato e minerali di solfato:
S + O 2 (aria) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (aria) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, torrefazione)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 ° C)
CaSO 4 + С (coca) = CaO + SO 2 + CO (1300-1500 ° C)
b) la conversione di SO 2 in SO 3 nell'apparato di contatto:
c) sintesi di acido solforico concentrato e anidro:
H 2 O (Coll. H 2 SO 4) + SO 3 = H 2 SO 4(conc., anid.)
(l'assorbimento di SO 3 da parte di acqua pura con produzione di H 2 SO 4 non viene effettuato a causa del forte riscaldamento della miscela e della decomposizione inversa di H 2 SO 4, vedi sopra);
d) sintesi oleum - una miscela di H 2 SO 4 anidro, acido disarico H 2 S 2 O 7 e eccesso di SO 3. SO 3 disciolto assicura l'assenza di oleum (H 2 SO 4 si forma immediatamente quando entra acqua), che consente di trasportarlo in sicurezza in serbatoi di acciaio.
Solfato di sodio Na 2 SO 4. Oksosol. Bianco, igroscopico. Si scioglie e bolle senza decomposizione. Forme idrato cristallino (minerale mirabilite) facilmente perdendo acqua; nome tecnico Il sale di Glauber. È solubile in acqua, non idrolizzato. Reagisce con H 2 SO 4 (conc.), SO 3. Restaurato dall'idrogeno, coca cola quando riscaldato. Entra nelle reazioni di scambio ionico.
Viene utilizzato nella fabbricazione di vernici per vetro, cellulosa e minerali come farmaco. Contenuta in salamoia laghi, in particolare nel Golfo di Kara-Bogaz-Gol del Mar Caspio.
Le equazioni delle reazioni più importanti:
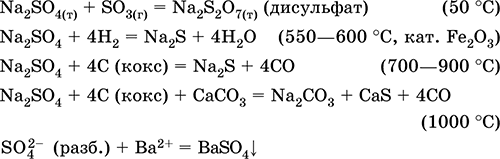
Idrosolfato di potassio KHSO 4. Sale di oxol aspro. Bianco, igroscopico, ma non forma idrati cristallini. Quando riscaldato si scioglie e si decompone. È ben solubile in acqua, l'anione subisce dissociazione in soluzione, il mezzo di soluzione è fortemente acido. È neutralizzato dagli alcali.
È usato come componente di fondenti nella metallurgia, parte integrante dei fertilizzanti minerali.
Le equazioni delle reazioni più importanti:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (fino a 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 ° C)
KHSO 4 (dil.) + KOH (conc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450-700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
reception: trattamento del solfato di potassio nel freddo (con più del 6O%) di acido solforico
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
Solfato di calcio CaSO 4. Oksosol. Bianco, molto igroscopico, refrattario, si decompone quando calcinato. Il CaSO naturale 4 si trova sotto forma di un minerale molto comune gesso CaSO 4 2H 2 O. A 130 ° C, il gesso perde parte dell'acqua e va dentro intonaco bruciato2CaSO 4 H 2 O (nome tecnico Alabaster). Il gesso completamente disidratato (200 ° C) risponde al minerale anidriteCaSO 4. È leggermente solubile in acqua (0,206 g / 100 g di H 2 O a 20 ° C), la solubilità diminuisce se riscaldata. Reagisce con H 2 SO 4 (conc.). Recuperato dalla coca durante la fusione. Definisce la maggior parte della durezza "costante" dell'acqua dolce (per maggiori dettagli, vedere 9.2).
Le equazioni delle reazioni più importanti: 100-128 ° C
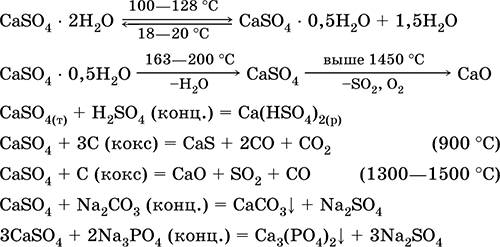
È utilizzato come materia prima nella produzione di SO 2, H 2 SO 4 e (NH 4) 2 SO 4, come fondente nella metallurgia, riempitivo di carta. La malta legante preparata da gesso bruciato "imposta" più velocemente rispetto alla miscela basata su Ca (OH) 2. L'indurimento è fornito dal legame dell'acqua, la formazione del gesso sotto forma di massa di pietra. Il gesso bruciato viene utilizzato per realizzare calchi in gesso, forme e prodotti architettonici e decorativi, pareti divisorie e pannelli e pavimenti in pietra.
Alluminio solfato di potassio KAl (SO 4) 2. Doppio sale di oxol. Bianco, igroscopico. Con il forte calore si decompone. Forme idrato cristallino - allume di allume di potassio. Moderatamente solubile in acqua, idrolizzato dal catione di alluminio. Reagisce con alcali, ammoniaca idrato.
È usato come mordente nei tessuti di tintura, pelle conciata, coagulante nella purificazione dell'acqua dolce, un componente delle composizioni di ridimensionamento della carta e un agente emostatico esterno in medicina e cosmetologia. È formato dalla co-cristallizzazione di alluminio e solfati di potassio.
Le equazioni delle reazioni più importanti:
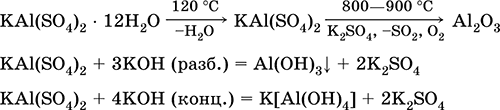
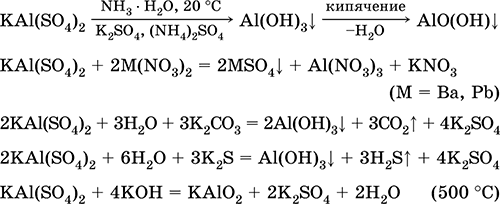
Solfato di cromo (III) - KCr di potassio (SO 4) 2. Doppio sale di oxol. Rosso (idrato viola scuro, nome tecnico allume di potassio). Quando riscaldato si decompone senza sciogliersi. È facilmente solubile in acqua (il colore grigio-blu della soluzione corrisponde al aquacomplex 3+), è idrolizzato dal catione di cromo (III). Reagisce con alcali, ammoniaca idrato. Ossidatore debole e agente riducente. Entra nelle reazioni di scambio ionico.
Reazioni qualitative a Cr 3+ ione - riduzione a Cr 2+ o ossidazione a giallo CrO 4 2-.
È usato come agente abbronzante per la pelle, un mordente nei tessuti di tintura, un reagente in una fotografia. È formato dalla co-cristallizzazione di cromo (III) e solfati di potassio. Le equazioni delle reazioni più importanti:
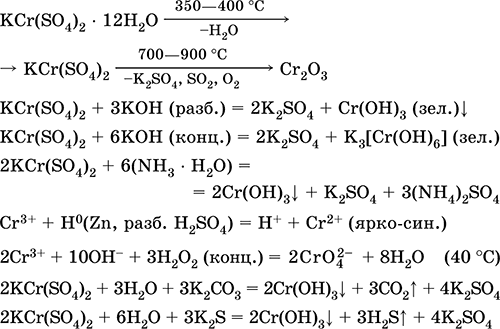
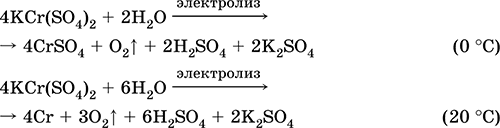
Manganese (II) solfato MnSO 4. Oksosol. Il bianco, quando calcinato, si scioglie e si decompone. Idrato cristallino MnSO 4 5H 2 O - rosso - rosa, nome tecnico vetriolo di manganese. È solubile in acqua, il colore rosa chiaro (quasi incolore) della soluzione corrisponde al aquacomplex 2+; idrolizzato mediante catione. Reagisce con alcali, ammoniaca idrato. L'agente riducente debole reagisce con gli agenti ossidanti tipici (forti).
Reazioni qualitative allo ione Mn 2+ - una conduzione con lo ione MnO 4 e la scomparsa del colore viola di quest'ultimo, l'ossidazione di Mn 2+ a MnO 4 e l'aspetto di un colore violetto.
Viene utilizzato per ottenere Mn, MnO 2 e altri composti di manganese, come reagente micronutriente e analitico.
Le equazioni delle reazioni più importanti:
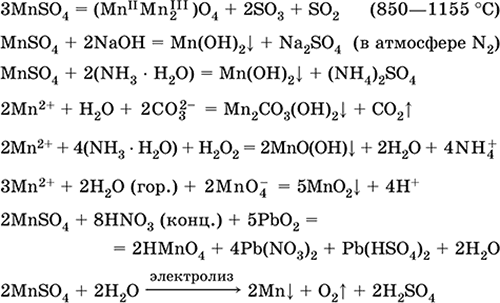
Ricezione:
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Solfato di ferro (II) FeSO 4. Oksosol. Bianco (idrato verde chiaro, nome tecnico ferro vetriolo),igroscopico. Si decompone quando riscaldato. È solubile in acqua, in piccola parte idrolizzato dal catione. Viene rapidamente ossidato in soluzione dall'ossigeno presente nell'aria (la soluzione diventa gialla e diventa torbida). Reagisce con agenti acidificanti, alcali, ammoniaca idrata. Tipico agente riducente.
È usato come componente di pitture minerali, elettroliti in galvanoplastica, conservanti del legno, fungicidi, farmaci anti-anemia. In laboratorio, più spesso è preso come il doppio sale Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( sale mora) più resistente all'aria.
Le equazioni delle reazioni più importanti:
![]()
Ricezione:
Fe + H 2 SO 4 (dec.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. Non-metalli del gruppo VA
Azoto. ammoniaca
azoto - un elemento del 2 ° periodo e il gruppo VA del sistema Periodico, numero di serie 7. Formula dell'elettrone atomico [2 He] 2s 2 2p 3, stati di ossidazione caratteristici 0, -III, + III e + V, meno spesso + II, + IV e ecc.; Lo stato N è considerato relativamente stabile.
Scala di ossidazione dell'azoto:
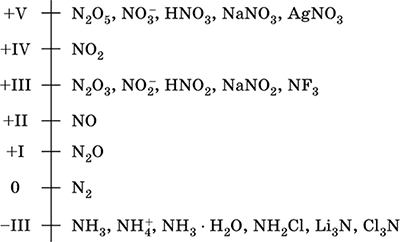
L'azoto ha un'elevata elettronegatività (3.07), la terza dopo F e O. Mostra le tipiche proprietà non metalliche (acide). Forma vari acidi contenenti ossigeno, sali e composti binari, nonché il catione di ammonio NH 4 + e i suoi sali.
In natura - diciassettesimo elemento di prevalenza chimica (nono tra non metalli). Un elemento vitale per tutti gli organismi.
Azoto N 2. Sostanza semplice Consiste di molecole non polari con un legame σππ molto stabile N ≡ N, questo spiega l'inerzia chimica dell'azoto in condizioni normali. Un gas incolore e inodore che si condensa in un liquido incolore (a differenza di O 2).
Il componente principale dell'aria: 78,09% in volume, 75,52% in peso. Dall'aria liquida, l'azoto bolle sull'ossigeno O 2. È leggermente solubile in acqua (15,4 ml / 1 l H 2 O a 20 ° C), la solubilità dell'azoto è inferiore a quella dell'ossigeno.
A temperatura ambiente, N 2 reagisce solo con litio (in un'atmosfera umida), formando nitruro di litio Li 3 N, i nitruri di altri elementi sono sintetizzati con forte riscaldamento:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
In una scarica elettrica, N 2 reagisce con fluoro e in misura molto piccola con l'ossigeno:
Una reazione reversibile per produrre ammoniaca avviene a 500 ° C, sotto pressione fino a 350 atm e necessariamente in presenza di un catalizzatore (Fe / F 2 O 3 / FeO, nel laboratorio Pt):
Secondo il principio di Le Chatelier, si dovrebbe verificare un aumento della resa di ammoniaca con un aumento della pressione e una diminuzione della temperatura. Tuttavia, la velocità di reazione alle basse temperature è molto bassa, quindi il processo viene eseguito a 450-500 ° C, raggiungendo una resa del 15% di ammoniaca. L'N 2 e l'H 2 non reagiti ritornano al reattore e quindi aumentano il grado di reazione.
L'azoto è chimicamente passivo rispetto agli acidi e agli alcali, non supporta la combustione.
reception nel industria - distillazione frazionata di aria liquida o rimozione di ossigeno dall'aria con mezzi chimici, ad esempio mediante reazione 2C (coke) + O 2 = 2CO mediante riscaldamento. In questi casi viene prodotto azoto, che contiene anche impurità di gas nobili (principalmente argon).
il laboratorio piccole quantità di azoto chimicamente puro possono essere ottenute con una reazione combinata con riscaldamento moderato:
N -III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60-70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
È utilizzato per la sintesi di ammoniaca, acido nitrico e altri prodotti contenenti azoto, come ambiente inerte per processi chimici e metallurgici e stoccaggio di sostanze infiammabili.
Ammoniaca NH 3. Composto binario, il grado di ossidazione dell'azoto è - III. Gas incolore con un forte odore caratteristico. La molecola ha la struttura di un tetraedro incompleto [: N (H) 3)] (sp 3 гиб-hybridization). La presenza di azoto nella molecola di NH 3 di una coppia di donatori di elettroni in un sp 3 - orbitale ibrido provoca una caratteristica reazione di addizione del catione di idrogeno, con la formazione di un catione ammonio NH 4 +. Liquefatto sotto pressione a temperatura ambiente. Nello stato liquido è associato a causa di legami di idrogeno. Termicamente instabile. È solubile in acqua (più di 700 l / 1 l di H 2 O a 20 ° C); la proporzione nella soluzione satura è = 34% in massa e = 99% in volume, pH = 11,8.
Reazioni altamente reattive, inclini alle aggiunte. Sorge in ossigeno, reagisce con acidi. Presenta proprietà riducenti (dovute a N-III) e ossidanti (dovute a H I). Asciugato solo con ossido di calcio.
Reazioni qualitative - formazione di "fumo" bianco a contatto con HCl gassoso, annerimento della carta inumidita con una soluzione di Hg 2 (NO 3) 2.
Prodotto intermedio nella sintesi di HNO 3 e sali di ammonio. Utilizzato nella produzione di soda, fertilizzanti azotati, coloranti, esplosivi; l'ammoniaca liquida è un refrigerante. Toxic.
Le equazioni delle reazioni più importanti:
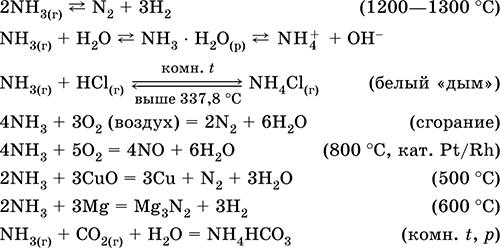
reception: in laboratorio - spostamento di ammoniaca dai sali di ammonio quando riscaldato con soda lime (NaOH + CaO):
o bollire una soluzione acquosa di ammoniaca, seguita dall'essiccazione del gas.
il industria l'ammoniaca viene sintetizzata dall'azoto (vedi) con l'idrogeno. Prodotto dall'industria in forma liquefatta o sotto forma di soluzione acquosa concentrata sotto il nome tecnico acqua di ammoniaca.
Ammoniaca idrata NH 3 H 2 O. Composto intermolecolare. Bianco, nel reticolo cristallino sono le molecole di NH 3 e H 2 O, legate da un legame idrogeno debole H 3 N ... HON. Presente in una soluzione acquosa di ammoniaca, una base debole (i prodotti di dissociazione - il catione NH 4 - e l'anione OH -). Il catione di ammonio ha una struttura π-tetraedrica regolarmente (sp 3 - ibridazione). Termicamente instabile, completamente decomposto facendo bollire la soluzione. Neutralizzato da acidi forti. Mostra le proprietà riducenti (dovute a N III) in una soluzione concentrata. Entra nella reazione dello scambio ionico e della complessazione.
Reazione qualitativa - la formazione di "fumo" bianco a contatto con HCl gassoso.
È usato per creare un mezzo alcalino debole in soluzione, durante la precipitazione di idrossidi anfoteri.
La soluzione di ammoniaca 1M contiene principalmente NH 3 H 2 O idrato e solo lo 0,4% di NH 4 + e OH - ioni (a causa della dissociazione dell'idrato); così, l'idrossido di ammonio "NH 4 OH" ionico non è praticamente contenuto nella soluzione, non vi è tale composto nell'idrato solido. Le equazioni delle reazioni più importanti:
NH 3 H 2 O (conc.) = NH 3 + H 2 O (bollente con NaOH)
NH 3 H 2 O + HCl (dec.) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (conc.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (conc.) + З Br 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40-50 ° C)
2 (NH 3 H 2 O) (conc.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (conc.) + Ag 2 O = 2OH + 3H 2 O
4 (NH 3 H 2 O) (conc.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH 3 H 2 O) (conc.) + NiCl 2 = Cl 2 + 6H 2 O
Viene spesso chiamata soluzione di ammoniaca diluita (3-10% - tempo) ammoniaca liquida (il nome è stato inventato dagli alchimisti) e la soluzione concentrata (18,5-25%) acqua di ammoniaca (prodotto dall'industria).
