Kénvegyületek. A kén oxidációjának mértéke a vegyületekben. A kénvegyületek képletei. Kén. Hidrogén-szulfid. szulfidok
Kén, fizikai és kémiai tulajdonságai. A kén biológiai értéke, alkalmazása (demercurization).
Cera a természetben
Natív kén
PbS - ólom ragyog
Cu 2 másodperc - réz ragyogás
ZnS - cink keverék
FeS 2 - pirit, kén-pirit, macska arany
H 2 másodperc - hidrogén-szulfid (ásványi forrásokban és földgázban)
CaSO 4 * 2H2O- gipsz
MgSO 4 * 7H2O - keserű só (angol)
Na2S04 * 10H20 - Glauber só (mirabilite)
Fizikai tulajdonságok
A szilárd kristályos anyag sárga, vízben oldhatatlan, nem nedves vízzel (a felületen úszik), t ° kip = 445 ° С.
A kén egyik különleges fizikai tulajdonságalebegésa finom kénpor úszó képessége, mivel a nagy kristályok vízben süllyednek. Az a tény, hogy a kén nem nedvesedik vízzel, és a részecskék a víz felszínén maradnak, mert kis légbuborékok ragadnak meg.Ezt a tulajdonságot a natív kén szennyeződésektől való elválasztására használják. Csiszoljuk az ércet, töltsük fel vízzel, és fújjuk le alulról levegővel, kén lebeg, és a szennyeződések az alján maradnak.allotrópia
A ként számos allotróp módosítás jellemzi., de a leghíresebb módosítások a következők:rombikus (Kristályos) , monoklin (Tű) és műanyag .
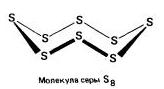
Rombos (a - kén) - S 8
t ° pl. = 113 ° C; ρ = 2,07 g / cm3. A legstabilabb módosítás.
Monoklin (b - kén) - S 8
sötét sárga tűkt ° pl. = 119 ° C; ρ = 1,96 g / cm3. 96 ° C feletti hőmérsékleten stabil; normál körülmények között rombuszossá válik.
műanyag S n
barna gumiszerű (amorf) tömeg. Az instabil, ha megszilárdul, rombuszossá válik.
MŰSZAKI GYÁRTÁS
A kénatom szerkezete
Elektronok elhelyezése szintek és alszintek szerint
Földállapot
1s 2 2s 2 2p 6 3s 2 3p 4
Elektron elhelyezés
orbiták (utolsó réteg)fokú
oxidációvegyérték
Alapállapotban
Első gerjesztett állapot
Második izgatott állapot
Kéntermelés
1. Ipari módszer - olvasztás az ércből vízgőzzel.
2. A hidrogén-szulfid hiányos oxidációja (oxigénhiány miatt).
2H 2S + O 2 = 2S + 2H 2O
3. Wackenroder reakciója
2H 2S + SO 2 = 3S + 2H 2O
Kén kémiai tulajdonságai
A kén oxidálószer S 0 + 2º→ S -2 | kén - redukálószer: S - 4ē→ S + 4; S - 6ē→ S +6 |
1. A kén kölcsönhatása aminden alkáli- és alkáliföldfém, réz, higany, ezüst fűtés nélkül: 2 Na + S→ Na 2S ÉLMÉNY S + Hg = HgS A higany nagy volatilitással rendelkezik. A párok mérgezőek. Ez a reakció a higany eltávolításának és ártalmatlanításának alapja, például egy törött orvosi hőmérőből. Azok a helyek, amelyekből a higanycseppeket nem lehet kivonni, kénpor borítja. A kén és a higany megérintésével reagál. Ennek eredményeként kémiailag inert és ártalmatlan anyag képződik. Ezt a folyamatot demercurizációnak nevezik. 2. A kén kölcsönhatásac egyéb fémek (kivéve:. \\ tAu, Pt) emelkedett t ° -on: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS TAPASZTALAT Cu + S t
→
CuS tapasztalat 3. Kén kölcsönhatás néhány nemfém képződik bináris vegyületek: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. A kén és az oxigén kölcsönhatása: S + O 2 t ° → S + 4O 2 2 S + 3O 2 t °; pt → 2 S + 6 O 3 2. A kén kölcsönhatásac halogének (a jód kivételével): S + Cl2→ S + 2CI 2 ** A kén kölcsönhatása savak - oxidálószerek: S + 2H 2SO 4 (konc.)→ 3S + 4O 2 + 2H 2O S + 6HNO 3 (conc)→ H 2S + 6O 4 + 6NO 2 + 2H 2O ** Disproporcionálási reakciók: 4. 3S 0 + 6 KOH→ K 2S + 4O 3 + 2 K 2S -2 + 3H 2O |
kérelem
Gumi vulkanizálása, ebonit megszerzése, mérkőzések előállítása, puskapor, mezőgazdasági kártevők elleni küzdelemben, orvosi célokra (kén-kenőcs a bőrbetegségek kezelésére), kénsav előállításához, stb.
házi feladat21. bekezdés; gyakorlatok 1, 3, 4 pp. 99-100.
További kategóriák
Végezze el a reakcióegyenleteket, p a koefficienseket az elektronikus mérleg módszerével rendezze, adja meg az oxidálószert, a redukálószert.
№2. Végezze el az átalakítást a rendszer szerint:
Ez érdekes ...
- Az emberi testben lévő kéntartalom 70 kg - 140 g.
- Egy személy naponta 1 g ként igényel.
- Borsó, bab, zabpehely, búza, hús, hal, gyümölcs és mangólé gazdag kénben.
- A kén a hormonok, vitaminok, fehérjék része, a porcszövetben, a hajban, a körmökben. A testben a kén hiánya miatt a körmök és a csontok törékenyek, a hajhullás.
Nézd meg az egészségedet!Tudja ..
- A kénvegyületek gyógyszerekként szolgálhatnak;
- Kén - alapja a kenőcsnek a gombás bőrbetegségek kezelésében, a rüh elleni küzdelemben. Na nátrium-tioszulfát 2 S 2 O 3 elleni küzdelem.
- A kénsav számos sója kristályosodó vizet tartalmaz: ZnSO 4 × 7H 2O és CuSO 4 × 5H 2 A. Ezeket antiszeptikumokként használják a növények permetezésére és a gabonaféléknek a mezőgazdasági kártevők elleni küzdelemben való megkötésére.
- Vas-vitriol FeSO 4 × 7H 2 O-t használnak az anaemia kezelésére.
- BaSO 4 a gyomor és a belek röntgenvizsgálatára használják.
- Alumínium kálium-alumínium KAI (SO 4) 2 × 12H 2 O - hemosztatikus vágásokkal.
- Ásványi Na2S04 × 10H 2 O-t Glauber-sónak hívják Glauber I. R. Glauber német kémikus tiszteletére, aki a VIII. Században felfedezte, és hirtelen megbetegedett az út során. Nem tudott semmit enni, a gyomra nem volt hajlandó enni. Az egyik helyiek a forráshoz küldték. Amint ivott a keserű sós vizet, azonnal elkezdett enni. Glauber megvizsgálta ezt a vizet. 2 SO 4 × 10H 2 A. Most gyógyszerként hashajtószerként használják, pamutszövetek festésére. A sót az üveg gyártásához is használják.
- A cickafarknak nagyobb a képessége, hogy kinyerje a ként a talajból, és ösztönözze az elem elnyelését a szomszédos növényekkel.
- A fokhagyma egy anyagot bocsát ki - albucid, maró kénvegyületet. Ez az anyag megakadályozza a rákot, lassítja az öregedést, megakadályozza a szívbetegségeket.
A kalkogén alcsoport a ként tartalmazza - ez a második az olyan elemek közül, amelyek képesek nagyszámú ércbetétet képezni. A szulfátok, szulfidok, oxidok és más kénvegyületek nagyon elterjedtek, fontosak az iparban és a természetben. Ennélfogva ebben a cikkben azt vizsgáljuk, hogy mi az, ami maga a kén, az egyszerű anyag.
Kén és jellemzői
Ez az elem a rendszeres rendszerben a következő pozícióval rendelkezik.
- A hatodik csoport, a fő alcsoport.
- A harmadik kis időszak.
- Az atomtömeg 32,064.
- A sorszám 16, a protonok és az elektronok száma megegyezik, és 16 neutron is van.
- Nem fém elemekre vonatkozik.
- A képlet "es", a kénelem, a latin kén neve.
A természetben négy stabil izotóp található 32,33,34 és 36 tömegszámmal. Ez az elem a természetben a hatodik leggyakoribb. A tápanyagokhoz tartozik, a fontos szerves molekulák részeként.
Az atom elektronikus szerkezete
A kénvegyületek sokféleségüknek az atom elektronikus szerkezetének jellemzőihez tartoznak. Ezt a következő konfigurációs képlettel fejezzük ki: 1s 2 2s 2 2p 6 3s 2 3p 4.
A fenti eljárás csak az elem álló helyzetét tükrözi. Azonban ismert, hogy ha egy atomot tájékoztatnak a további energiáról, akkor az elektronok elválaszthatók a 3p és 3s alszinteken, a következő, 3d-s átmenetre, amely szabad marad. Ennek eredményeként nemcsak az atom valenciája változik, hanem az összes lehetséges oxidációs állapot is. Számuk jelentősen növekszik, mint a különböző kéntartalmú anyagok száma.
A kén-oxidáció fokai a vegyületekben
Ennek a mutatónak több fő lehetősége van. A kén esetében:
Ezek közül az S + 2 a leggyakoribb, a többit mindenhol szétszórják. A kén kémiai oxidációjának mértéke a vegyületek kémiai aktivitásától és oxidatív képességétől függ. Például a -2-es vegyületek szulfidok. Ezekben az elemekben, amelyeket figyelembe vessünk, egy tipikus oxidálószer.
Minél magasabb az oxidációs fok a vegyületben, annál kifejezettebb az anyag oxidáló képessége. Ez könnyen látható, ha felidézzük a két bázikus savat, amelyek a kénformák:
- H 2SO 3 - kénsav;
- H 2SO 4 - kén.
Ismert, hogy az utóbbi sokkal stabilabb, erős vegyület, amely nagy koncentrációban nagyon súlyos oxidációs képességgel rendelkezik.
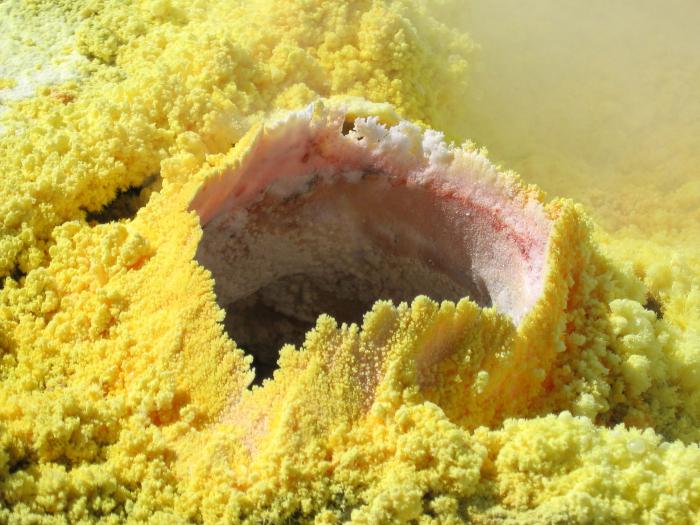
Egyszerű anyag
Egyszerű anyagként a kén sárga, szép, rendszeres, hosszúkás alakú kristályt képvisel. Bár ez csak az egyik formája, mert két fő anyag van. Az első, monoklinikus vagy rombos, sárga, amely nem oldható vízben, hanem csak szerves oldószerekben. A törékeny és a szerkezet szép formája, korona formájában jelenik meg. Olvadáspont - körülbelül 110 0 ° C.
Ha nem hagyja ki a közbenső időt, amikor ilyen átalakítást végez, akkor észlelhet egy másik állapotot - műanyag ként. Ez egy gumiszerű, barna színű viszkózus oldat, amely további melegítés vagy gyors hűtés után ismét rombos formává alakul.
Ha kémiailag tiszta kénről beszélünk, amelyet ismételt szűréssel nyerünk, akkor világos, sárga kristályok, törékenyek és vízben teljesen oldhatatlanok. A levegőben lévő nedvességgel és oxigénnel érintkezve gyulladhat. Meglehetősen magas a kémiai aktivitás.

A természetben
A természetben vannak természetes lerakódások, amelyekből kénvegyületeket nyerünk ki, és maga is egyszerű anyag. Ezenkívül tartalmazza:
- ásványokban, ércekben és sziklákban;
- az állatok, növények és emberek testében számos szerves molekula részeként;
- földgázokban, olajban és szénben;
- éghető palánkon és természetes vizeken.
A legtöbb kéntartalmú ásványi anyag a következő:
- cinóber;
- pirit;
- sphalerite;
- antimonitos;
- galena és mások.
A ma előállított kén nagy része szulfát előállításra kerül. Másik része orvosi célokra, mezőgazdaságra, ipari gyártási folyamatokra szolgál.
Fizikai tulajdonságok
Ezek több ponton is leírhatók.
- Vízben oldhatatlan, szén-diszulfid vagy terpentin - jól oldódik.
- Hosszabb ideig tartó súrlódás esetén negatív töltés keletkezik.
- Az olvadáspont 110 ° C.
- Forráspont 190 ° C.
- A 300 ° C-ot elérve folyékonyvá, könnyen mozgathatóvá válik.
- A tiszta anyag nagyon jól meggyullad az éghető tulajdonságokat.
- A szagnak szinte nincs hatása, de a kén hidrogénvegyületei rothadt tojások éles szagát bocsátják ki. Mint néhány gáznemű bináris képviselő.
Az érintett anyag fizikai tulajdonságai az ókor óta ismertek. Pontosan annak gyúlékonysága miatt a kén ilyen nevet kapott. Háborúkban elfojtó és mérgező füstöket alkalmaztak, amelyek ennek a vegyületnek az égése során képződnek, mint ellenség elleni fegyver. Emellett a kénnel járó savak mindig is fontos ipari jelentőségűek voltak.

Kémiai tulajdonságok
Tárgy: "Kén és vegyületei" egy iskolai kémia tanfolyamon nem vesz egy órát, hanem többet. Végtére is, sok közülük. Ez az anyag kémiai aktivitásának köszönhető. Mind az oxidáló tulajdonságokat erősebb redukálószerekkel (fémek, bór stb.), Mind a nem-fémekkel csökkenti.
Ennek ellenére, annak ellenére, hogy csak a fluor, a kölcsönhatás normál körülmények között megy végbe. Minden más fűtést igényel. Számos olyan anyagcsoport létezik, amelyekkel a kén kölcsönhatásba léphet:
- fémek;
- nem-fémek;
- lúgok;
- erős oxidáló savak - kénsav és nitrogén.
Kénvegyületek: fajták
Sokféleségüket a főelem - kén - oxidációs fokának egyenlőtlen értéke magyarázza. Tehát több fő típusú anyagot is kiválaszthat a funkcióhoz:
- oxidációs állapotú vegyületek;
Ha figyelembe vesszük az osztályokat, és nem a valencia mutatóját, akkor ez az elem olyan molekulákat képez, mint:
- sav;
- oxidok;
- só;
- bináris vegyületek nemfémekkel (szén-diszulfid, kloridok);
- szerves anyag.
Most fontolja meg a főbbeket, és adjon példákat.

Oxidációs állapotú anyagok -2
A 2 kénvegyületek a fémekkel alkotott konformációi, valamint:
- szénatom;
- hidrogénatom;
- foszfor;
- szilícium;
- arzén;
- bór.
Ezekben az esetekben oxidálószerként működik, mivel az összes felsorolt elem elektropozitívabb. Tekintsük a legfontosabbakat.
- Széndiszulfid - CS 2. Tiszta folyadék jellegzetes, kellemes éterrel. Mérgező, gyúlékony és robbanásveszélyes. Oldószerként és a legtöbb olaj, zsír, nemfém, ezüst-nitrát, gyanták és gumik esetében. Ez is fontos szerepet játszik a rayon - rayon gyártásában. Nagy mennyiségben szintetizált iparágban.
- Hidrogén-szulfid vagy hidrogén-szulfid - H2S A gáz, amelynek nincs színe és édes íze. A szag éles, rendkívül kellemetlen, rothadt tojást emlékeztet. A mérgező, lenyomja a légzőközpontot, mivel rézionokat köt. Ezért, ha mérgez, megfojtja és meghal. Széles körben alkalmazzák az orvostudományban, a szerves szintézisekben, a kénsav előállításában és az energiahatékony nyersanyagként is.
- A fém-szulfidokat széles körben használják az orvostudományban, a szulfáttermelésben, a festékek előállításában, a foszforok gyártásában és más helyeken. Az általános képlet Me x S y.

Oxidációs állapotú vegyületek +4
A 4 kénvegyületek főleg oxidok és a megfelelő sók és savak. Mindannyian igen gyakori vegyületek, amelyek bizonyos értéket képviselnek az iparban. Ezek oxidálószerként működhetnek, de gyakrabban mutatnak redukáló tulajdonságokat.
A +4 oxidációs állapotú kénvegyületek képletei a következők:
- oxid - kén-dioxid SO 2;
- sav - kénsav H2S03;
- a sók általános képlete Me x (SO 3) y.
Az egyik leggyakoribb vagy anhidrid. Ez egy színtelen anyag, egy égett meccs szaga. A vulkánok kitörése során keletkezett nagy klaszterekben ebben a pillanatban könnyen meghatározható a szag.
Vízben feloldódik egy könnyen bomló sav, kénsav képződésével. Olyan tipikus sóformákként viselkedik, amelyek szulfit-ion SO3 2- formájában vannak. Ez az anhidrid a fő gáz, amely befolyásolja a környező légkör szennyezését. Ez az oktatásra hatással van, az iparban szulfátgyártásban használják.
Azok a vegyületek, amelyekben a kén oxidációs állapota +6
Ezek közé tartoznak mindenekelőtt kénsav-anhidrid és kénsav a sókkal:
- szulfátok;
- hidrogén-szulfát.
Mivel ezekben a kénatomok nagy mértékben oxidáltak, ezeknek a vegyületeknek a tulajdonságai meglehetősen magyarázhatók. Ezek erős oxidálószerek.
A (VI) kén-oxid - szulfurhidrid - illékony, színtelen folyadék. Jellemző jellemzője az erős szárító képesség. A szabadban dohányzik. Vízben oldva az egyik legerősebb ásványi sav - kénsav -. A koncentrált oldat nehéz olajos, enyhén sárgás folyadék. Ha az anhidrid kénsavban feloldódik, akkor kap egy speciális vegyületet, az oleumot. Alkalmazzák az iparban sav előállításához.
A sók között - szulfátok - olyan vegyületek, mint:
- gipsz CaSO 4 · 2H 2O;
- barit BaSO 4;
- a sók;
- ólom-szulfát és mások.
Az építőiparban, kémiai szintézisben, gyógyászatban, optikai eszközök és szemüveg gyártásában, sőt az élelmiszeriparban is használják.
A hidroszulfátokat széles körben használják a kohászatban, ahol fluxusként használják őket. Ezenkívül számos komplex oxidot oldanak oldható szulfát formákká, amelyeket az érintett iparágakban használnak.
A kén vizsgálata az iskolai kémia tanfolyamán
Mikor a legjobb, ha a diákok megtanulják, mi a kén, milyen tulajdonságai vannak, mi a kénvegyület? 9. osztály - a legjobb időszak. Ez nem a kezdet, amikor minden új és érthetetlen a gyerekek számára. Ez a kémiai tudomány tanulmányozásának középpontja, amikor a korábban lefektetett alapok segítenek a téma teljes megértésében. Ezért ezeknek a kérdéseknek a megfontolására a felső osztály második felét osztják szét. Ugyanakkor az egész téma több blokkra oszlik, amelyben a „Kénvegyületek. 9. osztály” lecke külön-külön áll.
Ennek oka a sokaság. Szintén külön foglalkozott a kénsav előállításának kérdésével az iparágban. Általában ez a téma átlagosan 3 óra.
A kén azonban csak a 10. osztályba kerül, ha az ökológiai kérdéseket figyelembe vesszük. A középiskolában a biológia is hatással van rá. Végül is, a kén olyan szerves molekulák része, mint:
- thyspirits (tiolok);
- fehérjék (tercier szerkezet, amelyen a diszulfid hidak képződése);
- tioaldehidek;
- tiofenolokból;
- tioészterek;
- szulfonsavak;
- szulfoxidok és más.
A szerves kénvegyületek egy speciális csoportjában különböznek. Ezek nemcsak az élő lények biológiai folyamataiban, hanem az iparban is fontosak. Például a szulfonsavak sok gyógyszer (aszpirin, szulfonamid vagy sztreptocid) alapját képezik.
Ezenkívül a kén az olyan vegyületek állandó összetevője, mint néhány:
- aminosavak;
- enzimek;
- vitaminok;
- hormonok.
Szobahőmérsékleten a kén csak higanyval reagál. A hőmérséklet emelkedésével jelentősen nő az aktivitása. Fűtéskor a kén közvetlenül reagál sok egyszerű anyaggal, kivéve az inert gázokat, a nitrogént, a szelént, a tellúrot, az aranyat, a platinát, az iridiumot és a jódot. A nitrogén és az arany szulfidjait közvetve kapjuk.
Fémekkel való kölcsönhatás
A kén oxidáló tulajdonságokkal rendelkezik, a kölcsönhatás eredményeként szulfidok képződnek:
Hidrogén kölcsönhatás 150-200 ° C-on fordul elő:
H 2 + S = H 2S
Az oxigénnel való kölcsönhatás
A kén oxigénben 280 ° C-on ég, 360 ° C-on levegőben, és oxidok keveréke keletkezik:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Foszfor és szén kölcsönhatása
Levegő nélkül melegítve a kén reakcióba lép a foszfortartalmú szénnel, oxidatív tulajdonságokkal rendelkezik:
2P + 3S = P 2S 3;
Fluor-kölcsönhatás
Erős oxidálószerek jelenlétében csökken tulajdonságai vannak:
S + 3F 2 = SF 6.
Kölcsönhatás összetett anyagokkal
Komplex anyagokkal való kölcsönhatás esetén a kén redukálószerként viselkedik:
S + 2HNO 3 = 2NO + H 2SO 4.
Disproporcionális reakció
Az alkáli-szulfidokkal és szulfitokkal való kölcsönhatás során a kén képes diszproporcionális reakciókra.
3S + 6KOH = K 2S + 4O 3 + 2K 2S -2 + 3H 2O.
1.7. Kéntermelés
A natív ércekből
A pirit levegővel való fűtése nélkül
FeS 2 = FeS + S.
A hidrogén-szulfid oxigénhiányos oxidációja
2H 2S + O 2 = 2S + 2H 2O.
A kohászati és kokszolókemencékből származó gázok katalizátor jelenlétében történő melegítésekor
H 2S + SO 2 = 2H20 + 3S.
1.8. Hidrogén-szulfid
Hidrogén-kén-vegyület - hidrogén-szulfid H 2 S . A hidrogén-szulfid kovalens vegyület. A molekula szerkezete hasonló a vízmolekula szerkezetéhez, a kénatom sp 3 hibridizáció állapotában van, de a vízzel ellentétben a hidrogén-szulfid molekulák nem képeznek hidrogénkötéseket egymás között. A kénatom kevésbé elektronegatív, mint az oxigénatom, nagyobb méretű, és ennek következtében alacsonyabb töltési sűrűsége van. A HSH valensszög 91,1 °, a H-S kötés hossza 0,133 nm.
Fizikai tulajdonságok
Normál körülmények között a hidrogén-szulfid színtelen gáz, erős, rothadt tojások illatával. T pl = -86 ° C T kip = -60 ° C, vízben rosszul oldódó, 20 ° C-on, 2,58 ml H 2 S oldódik 100 g vízben, nagyon mérgező, belélegezve paralízist okoz, ami halálos lehet. A természetben a vulkáni gázok összetételében szabadul fel, melyet a növényi és állati szervezetek bomlása okoz. Vízben oldódik, oldva gyenge hidrogén-szulfid-savat képez.
Kémiai tulajdonságok
A vizes oldatban a hidrogén-szulfid gyenge kétbázisú sav tulajdonságai:
H 2S = HS - + H +;
HS - = S 2- + H +.
A hidrogén-szulfid a levegőben ég kék láng. Korlátozott levegő-hozzáféréssel szabad kén képződik:
2H 2S + O 2 = 2H20 + 2S.
A túlzott levegőhozzáféréssel a hidrogén-szulfid elégetése kén-oxid (IV) kialakulásához vezet:
2H 2S + 3O 2 = 2H20 + 2S02.
A hidrogén-szulfidnak csökkent tulajdonságai vannak. A körülményektől függően a hidrogén-szulfid vizes oldatban kén, kén-dioxid és kénsavvá oxidálható.
Például a brómvizet elfedi:
H 2S + Br 2 = 2HBr + S.
kölcsönhatásba lép a klórvízzel:
H 2S + 4CI 2 + 4H 2O = H 2SO 4 + 8HCI.
Az ólom-dioxiddal hidrogén-szulfidot lehet meggyújtani, mivel a reakciót nagy hőkioldódás kísérte:
3Pb02 + 4H2S = 3PbS + SO 2 + 4H 2O.
A hidrogén-szulfid és a kén-dioxid kölcsönhatása a kohászati és szulfátgyártási hulladékgázokból származó kén előállítására: \\ t
SO 2 + 2H 2S = 3S + 2H 2O.
A natív kén képződése a vulkáni folyamatokban ehhez a folyamathoz kapcsolódik.
A kén-dioxid és a hidrogén-szulfid egyidejű átvitele az alkáli oldaton keresztül, tioszulfát keletkezik:
4SO 2 + 2H 2S + 6NaOH = 3Na 2S 2O 3 + 5H 2O.
A hidrogén-szulfid normál körülmények között színtelen és nagyon mérgező gáz, amely rothadt tojások jellegzetes szaga.
A laboratóriumban a szulfidhoz általában híg sósavat adunk.
A hidrogén-szulfid előállításának másik módja, hogy hideg vizet adunk alumínium-szulfidhoz:
Az így kapott hidrogén-szulfid tisztább.
A hidrogén-szulfid kovalens vegyület. A molekulák görbült szerkezete hasonló a vízmolekulák szerkezetéhez (lásd a 2.2. Szakaszt). A vízzel ellentétben a hidrogén-szulfid molekulák nem képeznek hidrogénkötéseket egymással. Az a tény, hogy a kénatom kevésbé elektronegatív, mint az oxigénatom, de nagyobb méretű. Ezért a kénatom sokkal alacsonyabb töltési sűrűségű, mint az oxigénatom. A hidrogénkötések hiánya miatt a hidrogén-szulfid forráspontja alacsonyabb, mint a víz. A hidrogén-szulfidok hidrogénkötéseinek hiánya is magyarázza a vízben való rossz oldhatóságát.
A vizes oldatban a hidrogén-szulfid gyenge kétbázisú sav tulajdonságai:
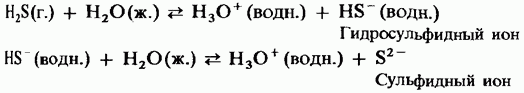
A hidrogén-szulfid kék lánggal ég a levegőben. Korlátozottan levegővel való hozzáféréssel a hidrogén-szulfid elégetése szabad kén kibocsátással jár, amely a hajó hideg felületén kondenzálódik:
A túlzott levegőhozzáféréssel a hidrogén-szulfid elégetése kén-dioxid képződéséhez vezet:
A hidrogén-szulfidnak csökkent tulajdonságai vannak. Például a brómvizet elszínezi és csökkenti az ionokat ionokra.
A hidrogén-szulfid kétbázisos savként két sor sót - szulfidokat és hidroszulfidokat - képezhet (lásd fent). Az alkálifém-szulfidok vízben oldódnak, hogy lúgos oldatokat képezzenek. Ez a hidrolízis eredményeként következik be:
Más fémek oldhatatlan szulfidjai kicsaphatók ezeknek a fémeknek a sóinak vizes oldatából, amikor az oldaton hidrogén-szulfidot vezetünk. Például, ha hidrogén-szulfidot vezetünk ionokat tartalmazó oldatban, fekete szulfid csapadék képződik
Ezt a reakciót hidrogén-szulfid analitikai mintaként alkalmazzuk.
Kén-oxidok
A kén több oxidot képez, amelyek közül kettő a legfontosabb: kén-dioxid és kén-trioxid.
A kén-dioxid egy sűrű, színtelen gáz, éles, fojtó szaggal. Laboratóriumi körülmények között kén keletkezhet levegőben vagy oxigénben, meleg híg savoldatot adva valamilyen szulfit sóhoz, vagy a tömény kénsavat rézzel melegítve:
Kén-dioxid sav-oxid. Könnyen oldódik vízben, kénsavat képezve. Ez a sav csak részlegesen ionizált, ezért gyenge sav:
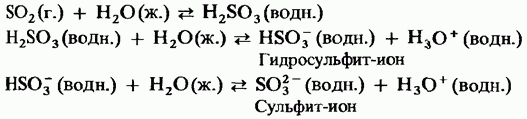
A kén-dioxid-gáz nátrium-hidroxid-oldattal történő átadásával nátrium-szulfit keletkezik. A nátrium-szulfit, amely a kén-dioxid feleslegével reagál, nátrium-hidroszulfitot képez, ezek a reakciók hasonlóak a szén-dioxid reakciójához mészvízzel.
Mind a gáz halmazállapotú kén-dioxid, mind a vizes oldat redukálószerek. Például a gáz halmazállapotú kén-dioxid csökkenti az oxidot, hogy szulfátot képezzen, és a kénsav csökkenti az iont az ionra
A kén-dioxidot ipari körülmények között a kén- vagy szulfidércek levegőben történő pörkölésével nyerik, és köztes termékként használják a kénsav előállítása során (lásd 7. fejezet). Kén-dioxidot használnak a cellulóziparban, a szövetek fehérítésére, valamint a gyümölcsök és zöldségek feldolgozására a hosszú távú tárolás során.
A kén-dioxid jelentős szerepet játszik a légköri szennyezésben és különösen a savas esőképződésben. A légkörben kén-trioxiddá oxidálódik:
Normál körülmények között ez az eljárás viszonylag lassan megy végbe, de katalizátor jelenlétében jelentősen felgyorsulhat, ahogy a kénsav előállítására szolgáló érintkezési folyamatban történik. Úgy tűnik, hogy a légkörben lévő vas- és mangánvegyületek kis mennyisége katalizálja a kén-dioxid oxidációját. A keletkező kén-trioxid a levegő nedvességével reagál, és ezért felhők tűnnek savas esővel (lásd még a 12. fejezetet).
A szilárd kén-trioxid egy polimorf vegyület. Két legfontosabb formája: ezek közül az első a ciklikus szerkezetű trimer (15.24. Ábra, a); a kristályok átlátszóak. aciklusos polimer szerkezettel rendelkezik (15.24. ábra, b); tűk formájában létezik. Olvadáspont A nedvesség jelenlétében fokozatosan mindkét forma 45 ° C-on forral. A kén-trioxid gőz izolált, szimmetrikus lapos molekulákból áll.
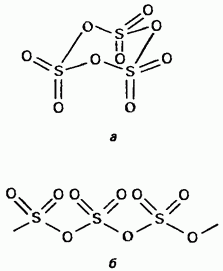
Ábra. 15.24. Kén-trioxid, a - ciklikus szerkezet, b - aciklusos szerkezet.
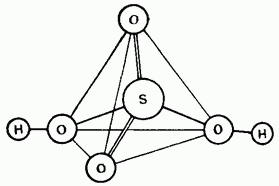
Ábra. 15.25. A kénsav molekula szerkezete.
Laboratóriumi körülmények között kén-trioxidot kapunk a szulfát melegítésével
A kén-trioxidnak erős savas tulajdonságai vannak. Exoterm reakcióba lép a vízzel, hogy kénsavat képezzen:
A kén-trioxid erős oxidálószer. Például a hidrogén-bromidot szabad brómdá oxidálja.
Kénsav
A kénsav színtelen, olajos maró folyadék. Az egyik legfontosabb ipari vegyipari termék. Ipari termelését az érintkezési folyamat és alkalmazás alkalmazásával Ch. 7.
A nem hígított kénsav kovalens vegyület. Molekulái tetraéderes szerkezetűek (15.25. Ábra).
A kénsav 340 ° C-on forralja, és kén-trioxidot és vizet képez
A kénsav magas forráspontja és magas viszkozitása nyilvánvalóan a hidrogénatomok és a szomszédos molekulák oxigénatomjai közötti hidrogénkötéseknek köszönhető.
A kénsav erős, kétbázisú sav. Vízben teljesen ionizált, hidroszulfát- és szulfátionokat képezve:
A kénsav a savakra jellemző valamennyi reakcióban részt vesz. Fémekkel reagál, ezeknek a fémeknek és hidrogénnek a szulfátjait képezve, a karbonátok reakciójában szulfátokat, szén-dioxidot és vizet képez, és bázisokkal és lúgokkal való reakcióban szulfátokat vagy hidroszulfátokat képez.
A koncentrált kénsav nagyon erősen reagál vízzel. Ezért a kénsavat mindig hígítsa vízbe öntéssel, és nem fordítva. Ez a sav higroszkópos, vagyis képes nedvesség felszívására a levegőből. Ezért olyan gázok szárítására használják, amelyek nem reagálnak vele, és kénsavon áthaladnak. A kénsav vízhez való affinitása olyan nagy, hogy a kénsav dehidratálószerként szolgálhat; koncentrált kénsav hatására:
a szulfát pentahidrát kék kristályai vízmentes szulfátot képeznek
szénhidrátok, például szacharóz,
a papírt a koncentrált kénsav hatására is szétzúzza, amit a savnak a cellulózszálakra gyakorolt hatása okoz;
az etanol etilénké alakul:
(etanol dehidratálása kénsavval, szabályozottan végrehajtva
az etoxi-etán (dietil-éter) képződéséhez vezet, és ezt a reakciót etoxi-etán előállítására használják ipari méretben);
klór-benzol és triklór-etán (klór) keveréke dehidratálódik (lásd a 16.3. szakaszt).
A koncentrált kénsav erős oxidálószer. A fémeket és a nemfémeket oxidálja. Például
A koncentrált kénsav oxidatív tulajdonságait bemutató egyéb példákban az ionok ionokká oxidálódását, valamint a bromid ionokat szabad brómra mutatjuk be a következő reakciókban:
Végül kénsavat használnak szulfatálószerként a szerves kémiában (lásd 17. fejezet).
Szulfátok, szulfitok és tio vegyületek
A szulfát-ion tetraéderes szerkezete hasonló a kénsav-molekula szerkezetéhez.
Sót. A szulfátokat híg kénsav és fémek, oxidjaik, hidroxidjaik vagy karbonátjaik reakciójában képződnek. A bárium-szulfát kivételével és a maradék szulfátok vízben oldódnak. A kalcium-szulfát vízben kevéssé oldódik. A szulfátok általában ellenállnak a hőnek. Az egyetlen kivétel a vas-szulfátok. Például a szulfát bomlik hevítés közben, hogy vas-oxidot képezzen:
A szulfátionok bármely oldatban történő kimutatásához a bárium-klorid vizes oldatát adjuk hozzá. Ha a vizsgálati oldatban szulfátionok vannak jelen, ennek eredményeképpen fehér bárium-szulfát csapadék képződik.
A szulfátok számos fontos felhasználási területtel rendelkeznek. Például a magnézium-szulfátot (brit só, keserű só) használják robbanóanyagok gyártásához, mérkőzések és tűzálló anyagok gyártásához. A só telített oldatát az orvosi gyakorlatban gyulladásgátló szerként alkalmazzák.
A nátrium-tioszulfát nátrium-szulfát analógjának tekinthető, amelyben egy oxigénatomot kénatom helyettesít. Az ilyen tioszvegyületek közül meg kell említeni egy másik - kálium-tiocianátot. Kálium-cianát kén analógja. A kálium-tiocianát a kálium-cianid kénnel történő fuzionálásával nyerhető:
A kálium-tiocianátot az ionok kimutatására kvalitatív elemzésben használják, ha ezek az ionok jelen vannak a vizsgálati oldatban, akkor kálium-tiocianát oldat hozzáadásával vér-vörös szín keletkezik a komplex ion kialakulása miatt.
Szóval ismételje meg újra!
1. A VI csoport aljára történő elmozduláskor az elemei tulajdonságai fokozatosan nem fémből fémesre változnak.
2. A VI. Csoport elemei képesek hidrogénnel és reaktív fémekkel kombinálni, olyan vegyületeket képezve, amelyek oxidációs állapota -2.
3. Az oxigén nagy elektronegativitással és erős oxidálószer tulajdonságokkal rendelkezik.
4. Az ózon még erősebb oxidálószer, mint az oxigén.
5. Az oxigén rendkívül fontos szerepet játszik a biológiai rendszerekben, részt vesz a légzési és anyagcsere-folyamatokban (anyagcsere).
6. Az oxigén bináris vegyületeket, különböző típusú oxidokat képez más vegyületekkel:

7. A hidrogén-peroxid erős oxidálószer.
8. A szabad formában lévő kén több enantiotrop formában is létezhet.
9. A föld alatti lerakódásokból származó kén kivonására a Frash-eljárást alkalmazzák, amely sűrített levegőt és túlhevített gőzt használ.
10. A kén olyan vegyületeket képez, amelyekben oxidációs állapotban +2, +4, +6 és -2 áll.
11. Hidrogén-szulfid - gyenge kétbázisú sav és redukálószer.
12. Gáznemű kén-dioxid és vizes oldatot redukáló szerei.
13. A kén-trioxid erősen kifejezett sav- és oxidáló tulajdonságokkal rendelkezik.
14. A kénsav erős, kétbázisú sav, szárító, dehidratáló és erős oxidálószer.
15. A kénsav-molekulák és a szulfát-ionok tetraéderes szerkezetűek.