Spojevi kalcija i magnezija
Dakle, nakon što je jučer utvrdilo koliko je kalcija sadržano u smrvljenoj ljusci, pojavilo se pitanje "piti ili ne piti?". Kao i većina muškaraca, dolazim do svega sa znanstvenog stajališta i dok ga ne vidim sam, otkrijem, provjerim, osjećam riječ za ženu. Stoga ću svoje misli podijeliti na temelju informacija o ljusci i kalciju.
Prikupljanje informacija na internetu o upotrebi ljuske jaja kao dodatka hrani više je puta naišlo na kritičke primjedbe liječnika da kalcijev karbonat sadržan u ljusci jajeta nije topiv u vodi i da ga tijelo ne može apsorbirati.
Štoviše, priča o supruzi mog prijatelja podsjetila se da je tijekom trudnoće rekla svom liječniku, koji je primijetio da je uzimala zgnječene jajne školjke - liječnik ju je odvratio i propisao neku vrstu kompleksa koji sadrži kalcij.
Gdje je istina?
Doista, kalcijev karbonat CaCO3 (upravo u ovom tipu, kalcij je u ljusci jajeta) nije topiv u vodi i alkoholu.
Stvarno neophodan preduvjet za apsorpciju kalcija je njegova topljivost u vodi.
Ali zapamtite da je osnova naše probave klorovodična kiselina koja se izlučuje u želucu.
I to se događa u našem želucu:
CaCO3 + 2HCl (klorovodična kiselina) = CaCl2 (kalcijev klorid) + Co2 + H20
No, kalcijev klorid je savršeno topljiv u vodi !!! U ovom obliku kalcij se apsorbira!
Ne poznajete liječnike? Ili su jednostavno lukavi i prodaju nam lijekove!
Osim toga, tijekom ove reakcije dolazi do smanjenja kiselosti u želucu. Što je važno za osobe koje pate od visoke kiselosti.
Primjer je moja žena, ona ima visoku kiselost, a svaki dan uzima malo zgnječene ljuske, što rješava dva problema odjednom i kompenzira nedostatak kalcija i smanjuje joj kiselost. No, prah jajne ljuske je ugasio sok od limuna ne može piti - tu je mučnina! I sada razumijem zašto.
Kao što smo vidjeli gore, za apsorpciju kalcija iz kalcijevog karbonata potreban je želučani sok s visokom kiselošću.
U stvarnom životu, vrlo često se javlja situacija kada je kiselost želuca niska ili nula. Ta je situacija osobito karakteristična za starije osobe, kada je potreba za kalcijem posebno visoka za prevenciju osteoporoze. Na primjer, nakon 50 godina, niska kiselost se javlja u oko 40% ljudi. Pod tim uvjetima, apsorpcija kalcijevog karbonata, koji zahtijeva otopinu klorovodične kiseline u želucu, pada na 2%.
Možda je to odgovor na pitanje zašto starije osobe češće pate od bolesti povezanih s nedostatkom kalcija - jednostavno ih ne mogu asimilirati u svom uobičajenom obliku.
Sada razmislite zašto se mnogi recepti za primanje slomljene ljuske jaja preporučuju da se ugasi sokom od limuna.
Kada dodamo limunov sok u slomljenu limunsku kiselinu, kalcijev karbonat (CaCo3) reagira s limunskom kiselinom (C6H8O7) i dobivamo kalcijev citrat (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Evo ga. A apsorpcija kalcij citrata, koja ne zahtijeva solnu kiselinu u želucu, iznosi 44%. Kao rezultat, u uvjetima niske kiselosti, kalcij citrat ulazi u tijelo u 11 puta više kalcija nego iz karbonata!
I kalcijev citrat je već poznati lijek koji nam se prodaje za novac! I oni to rade, samo ne koriste sok od limuna, već limunsku kiselinu!
Usput, kalcijev karbonat (naša isjeckana ljuska) je registrirani aditiv za hranu. P170i kalcijev citrat (naša isjeckana ljuska od ljuske izlivena s limunovim sokom) je registrirani dodatak hrani. E333! Dodaju se mnogim prehrambenim proizvodima, osobito mliječnim proizvodima, uključujući mlijeko, kako bi se povećao postotak kalcija!
Pa zašto platiti više!
Zaključak, ako imate visoku kiselost - vjerojatno je bolje koristiti samo isjeckane ljuske jaja, ako je kiselost niža, vjerojatno je bolje ugasiti prah ljuske jajeta s limunovim sokom.
I više,
Noću se ubrzano oslobađaju mineralne soli iz tijela (cirkadijansko ubrzanje resorptivnih procesa u kosti). Stoga, pripravke kalcija treba uzeti nakon ručka i navečer.To će spriječiti ubrzani gubitak kalcija u drugoj polovici noći, osobito s njegovom smanjenom razinom (ili odsutnošću) u crijevima. Negativan doza ovisan učinak farmakoterapijske aktivnosti kalcija također je zabilježen: u malim dozama ovaj se biometal apsorbira bolje nego u visokim.
U vezi s tim racionalnije je uzimati lijek nekoliko puta dnevno.
Čitamo, raspravljamo. Slijedi nekoliko članaka o ovoj temi.
__________________________________________________________________________________________________________
Kalcijev citrat u odnosu na kalcijev karbonat
Izvor< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Kalcijev citrat.
Kalcij citrat je izvrstan izvor apsorbiranog kalcija, koji igra vrlo važnu ulogu u tijelu, jer utječe na mnoge enzimske procese i zgrušavanje krvi. Nedostatak kalcija dovodi do krhkosti kostiju i osteoporoze. Za malu djecu, to je dobro za zdravlje zuba, odrasli trebaju redoviti unos kalcija kako bi stabilizirali krvni tlak.
Prema Nacionalnom institutu za rak (SAD), dodatak E-333 može potencijalno spriječiti rak debelog crijeva i druge vrste raka. Osim toga, kalcij citrati se koriste u medicini za uklanjanje teških metala iz tijela.
Budući da je kalcij citrat jedan od najvažnijih transportnih oblika kalcija u ljudskom tijelu, on se u medicini koristi zajedno s manje učinkovitim kalcijevim karbonatom (aditiv E-170) za obnavljanje rezervi kalcija u tijelu. Iz istog razloga, kalcijev citrat se koristi u obliku dijetetskih dodataka (dodataka prehrani).
U prehrambenoj industriji, aditiv E-333 koristi se kao stabilizator, konzervans, regulator kiselosti, za fiksiranje boja.
Kao stabilizator, prehrambeni aditiv E-333 koristi se u proizvodnji kondenziranog mlijeka, vrhnja, krem sira. U džemovima, želeu i konzerviranom voću, E-333 se koristi kao regulator kiselosti. Kalcijevi citrati također se široko koriste za obogaćivanje kalcija u mlijeku i mliječnim proizvodima, pekarskim i brašno proizvodima i bezalkoholnim pićima.
Izgleda da je kalcijev citrat bijeli prah s izraženim kiselim okusom. Topivo u vodi. Molekularna formula kalcijevog citrata: Ca3 (C6H5O7) 2. Dobije se E-333 interakcijom limunske kiseline s kalcijevim hidroksidom.
Svojstva i tehnološke funkcije:
Moguća imena dodataka prehrani:
- E-333
- E-333
- Kalcijev citrat
- Kalcijevi citrati
- Monokalcijev citrat
- Dikalcijev citrat
- Tricalcijev citrat
_____________________________________________________________________________________________
Kalcij citrat
Sredinom dvadesetog stoljeća. počela je vrsta "buma": biokemičari, fiziolozi, biofizičari, farmakolozi i kliničari počeli su pokazivati povećano zanimanje za proučavanje uloge kalcija u reguliranju aktivnosti organa i tjelesnih sustava. Utvrđeno je da su kalcijevi ioni uključeni u ekscitaciju i kontrakciju mišićnih stanica, regulaciju propusnosti stanične membrane, međustanične interakcije, zgrušavanje krvi, izlučivanje hormona, medijatore, enzime; obavljaju funkciju signalnog pretvarača koji ulazi u stanicu, sudjeluju u procesima regulacije unutarstaničnog metabolizma, uključujući energiju. Na površini membrane kardiomiocita i posuda slobodnih iona kalcija je 1000 puta više nego u citosolu stanica. Iz izvanstaničnog prostora prodiru u citoplazmu kroz posebne kalcijeve kanale, utječući na različite fiziološke procese i funkcije stanica svih organa, vaskularni tonus, intenzitet sistole, dijastolu.
Kalcij ima važnu ulogu u formiranju koštanog tkiva i očuvanju njegove normalne strukture i funkcije. Uz posebne proteine, kalcijevi ioni osiguravaju tvrdoću i elastičnost kostiju.
Sve to poslužilo je kao teoretski temelj za razvoj i uvođenje pripravaka kalcija na bazi njegovih soli u medicinsku praksu. Trenutno se u medicinskoj praksi koriste kalcijeve soli kao glicerofosfat, glukonat, karbonat, laktat, citrat, klorid, fosfat i mnoge druge.
Farmakokinetika lijeka CALCIUM CITRATE ima svoje osobine. Kalcij se apsorbira iz crijeva u topljivom, ioniziranom obliku. Otapanje lijeka pojavljuje se bolje u kiseloj sredini želuca. Otopljeni ionizirani kalcij dobro prodire u sva tkiva, prodire u placentarnu barijeru, prelazi u majčino mlijeko. Izlučuje se uglavnom u izmetu, oko 20% - s urinom. Važna značajka kalcija citrata je niska sposobnost stvaranja bubrežnih kamenaca, što je važno kod dugotrajne uporabe ove soli. To je zbog činjenice da citratna sol smanjuje količinu oksalata u urinu.
Bioraspoloživost se određuje brzinom i opsegom do kojeg aktivni sastojak koja se apsorbira iz doznog oblika, ona postaje dostupna na mjestu predviđenog terapijskog djelovanja.
Noću se ubrzano oslobađaju mineralne soli iz tijela (cirkadijansko ubrzanje resorptivnih procesa u kosti). Stoga, pripravke kalcija treba uzeti nakon ručka i navečer, što će spriječiti ubrzani gubitak kalcija u drugoj polovici noći, pogotovo s njegovom smanjenom razinom (ili odsutnošću) u crijevu. Zabilježen je negativan učinak farmakoterapijskog djelovanja kalcija ovisan o dozi: taj se biometal bolje apsorbira u niskim dozama nego u visokim dozama. U tom smislu, racionalnije je uzimati lijek nekoliko puta dnevno. Za različite dobne skupine postoje različite fiziološke norme unosa kalcija (tablica).
stol
Preporučena stopa unosa kalcija kod ljudi različite dobi
(prema kanadskom društvu za osteoporozu)
Vitamin D, klorovodična kiselina, laktoza, limunska kiselina, prisutnost proteina u hrani, fosfor, magnezij, kao i neke namirnice kao što su maslac, jaja, mlijeko, riba, bakalar, kupus i sl., Doprinose apsorpciji kalcijevih iona.
Upijanje kalcija se pogoršava: nedostatak bjelančevina u hrani, strogo poštivanje vegetarijanske prehrane, nedostatak magnezija, fosfora, hrana bogata oksalnom kiselinom (kiseljak, rabarbara, špinat).
Apsorpcija kalcija usporava bolesti probavnih organa (gastritis, enteritis, kolitis, peptički ulkus), gušteraču (dijabetes, pankreatitis), patologije drugih endokrinih organa.
Treba naglasiti da neki lijekovi, osobito glukokortikoidi, hormonska kontracepcijska sredstva za sustavnu uporabu, levotiroksin također pogoršavaju apsorpciju kalcijevih iona.
Prema rezultatima znanstvenih istraživanja (podaci Kanadskog društva za osteoporozu) ne postoje uvjerljivi dokazi na temelju kojih bi se mogla preporučiti dodatna konzumacija drugih minerala (magnezij, cink, bakar itd.) Za prevenciju ili liječenje osteoporoze.
Rezultati kliničkih ispitivanja provedenih u Ukrajini i drugim zemljama potvrdili su visoku učinkovitost ovog lijeka u liječenju mnogih bolesti. Kalcij citrat se također koristi u profilaktičke svrhe kod raznih bolesti.
Kod osteoporoze kod starijih osoba, osteomalacija CALCIUM CITRATE se propisuje 2-6 tableta dnevno, dijeleći dnevnu dozu na 3-4 doze. Lijek se uzima prije obroka ili 1 do 1,5 sati nakon obroka, tijekom 3 mjeseca. Takvim pacijentima također treba propisati vitamin D3 od 400-800 IU dnevno, a također uključuju i ulje, mlijeko, ribu i jaja u prehrani.
CALCIUM CITRATE je optimalni oblik doziranja za dobivanje kalcija ne samo za odrasle, već i za djecu, kao i za adolescente, jer pomaže u povećanju mineralne gustoće kosti, povećanju koštane mase, ojačanju dentina i zubne cakline. Djeci mlađoj od 6 mjeseci propisuju se 1/2 tablete (250 mg) (drobljene, otopljene u maloj količini mlijeka), u dobi od 6 do 12 mjeseci - također 1/2 tablete 2 puta dnevno, u dobi od 1 godine - 10 godina - 1-2 tablete, 10-18 godina - 2-3 tablete dnevno.
Indikacije za određivanje kalcija citrata su:
hipokalcemija zbog krvarenja različitog podrijetla, kao i tijekom trudnoće i dojenja, s ozljedama - za popunu povećane tjelesne potrebe za kalcijevim ionima;
narušavanje apsorpcije kalcija kod bolesti probavnog trakta i povišena razina izlučivanja kalcija kroz bubrege i crijeva;
hipoparatireoidizam, dehidracija organizma različite geneze, alergijske bolesti i alergijske komplikacije tijekom uzimanja lijekova, povećana permeabilnost krvnih žila, smanjenje zgrušavanja krvi.
CALCIUM CITRATE se mora propisati kod uzimanja glukokortikoida, oralnih kontraceptiva, levotiroksina. U posljednja tri slučaja lijek se uzima 1 tableta 6 puta dnevno nakon obroka.
Kalcijev citrat se u pravilu dobro podnosi, ponekad dispeptički simptomi (konstipacija ili proljev, mučnina, povraćanje, gubitak apetita, bolovi u trbuhu), može se pojaviti poliurija.
Ne preporučuje se istovremena uporaba CALCIUM CITRATE s antacidima koji sadrže aluminij zbog smanjenja njihove učinkovitosti. Nepoželjno ga je propisati istovremeno s drugim pripravcima kalcija.
U zaključku možemo primijetiti pozitivna farmakološka svojstva CALCIUM CITRATE:
citratna kalcijeva sol dobro se otopi i apsorbira u probavnom traktu, što dovodi do dobre apsorpcije kalcija u tijelu i, sukladno tome, djelotvornosti lijeka u profilaktičkom ili terapijska primjenato potvrđuju rezultati mnogih kliničkih ispitivanja.
Nizak rizik od stvaranja kamena u bubrezima pri uzimanju lijeka povećava vrijednost kalcij sulfata uz produljenu uporabu.
IS Chekman, voditelj Odsjeka za farmakologiju s kolegijem Klinička farmakologija Nacionalnog medicinskog sveučilišta, dopisni član Nacionalne akademije znanosti i Akademije medicinskih znanosti Ukrajine, počasni profesor znanosti i tehnologije, profesor
Stranica 1
Reakcija karbonata s kiselinama može se koristiti kao uzorak za karbonate. Ugljična kiselina je vrlo slaba i nestabilna kiselina. Može se istisnuti iz svojih soli djelovanjem manje hlapljivih i jačih kiselina.
Slično tome, nastaju reakcije kalcijevog karbonata s kiselinama.
Reakcija karbonata s klorovodičnom kiselinom daje kalcijev klorid i magnezijev klorid, koji se dobro otope u vodi i ostaju u obliku otopine različitih koncentracija. Brzina reakcije ovog kolektora ovisi uglavnom o tlaku i temperaturi.
Kao rezultat reakcije karbonata s klorovodičnom kiselinom kalcijev klorid i magnezija, dobro topljiv u vodi i ostaje u obliku otopine različitih koncentracija.
Uvođenje ne-sušenog natrijevog karbonata u reakciju zahtijeva viši tlak i povećanje količine katalizatora.
Objašnjenje navedenih pojava ili promatranih pojava: zašto reakcija kalcijevog karbonata sa sumpornom kiselinom započinje najprije silovito, a zatim prestaje. Zašto kada se grije suha tvar amonij karbonata nestane iz cijevi.
Blagotvorni učinak kalcijevog karbonata na stabilnost portland cementa može se objasniti reakcijom karbonata s klinkernim mineralima koji sadrže aluminij. Tako je aluminatna komponenta cementnog kamena kemijski vezana prije nego što dođe u kontakt sa sulfatima okoline.
Neke primjene barijevog karbonata temelje se na praktičnoj netopivosti barijevog sulfata, koji nastaje reakcijom barijevog karbonata sa supstancama koje sadrže sulfatne ione. Dakle, prilikom sušenja cigle prije paljenja, na njenoj površini pojavljuje se bijelo cvjetanje uzrokovano kristalizacijom gipsa ili magnezijevog sulfata sadržanog u glini. Da bi se to spriječilo, u glinu je dodan barijev karbonat koji uzrokuje taloženje sulfatnog iona.
U svom uvodu u kemiju krutina, Hedwal, kao primjer teoretski moguće reakcije, dovodi do reakcije kalcijevog karbonata sa Si02, što rezultira stvaranjem kalcijevog silikata. On prati ovaj primjer primjećujući da kod takozvanih geotermalnih metamorfoza uobičajena temperatura nije dovoljna, jer se reakcija između kalcijevog karbonata i silicijeve kiseline može vidjeti u laboratorijskim uvjetima samo na temperaturama od 500 ° C.
Kako bi se smanjio trošak nastanka flegma u ovom procesu, Klima i Ward predložili su upotrebu otopine amonijevog karbonata (umjesto amonijevog nitrata) i stvaranje sluzi zbog reakcije obogaćenog amonijevog karbonata s vapnom.
Kako temperatura raste, reakcija se pomiče prema formiranju više alkalnog silikata. Gibson i Ward11 o reakciji natrijevog karbonata s kvarcom na temperaturi od 726 do 805 ° C u struji dušika pokazali su da se orto-silikat formira u prisutnosti dovoljne količine natrijevog karbonata. Brzina reakcije ovisi o vremenu, veličini uzorka, brzini protoka plina i sastavu reakcijske smjese. Gibson i Ward tvrde da postoje natrijevi silikati srednjeg stupnja.
Višak natrijevog karbonata titrira se klorovodičnom kiselinom. Količina sumpora u analiziranom produktu se izračuna pomoću količine reagiranog natrijevog karbonata.
I kalcijev karbonat i kako ovi kemijski spojevi djeluju.
Kalcijev karbonat
CaCO2 rešetka kalcijevog karbonataCaCO₃ je vrlo čest spoj u svijetu, a sastoji se od: krede, vapnenca, mramora itd. Stoga je vrijedno spomenuti da je uloga ove tvari za ljude vrlo značajna, jer se kalcijev karbonat naširoko koristi u prehrambenoj industriji, kao prirodna bijela boja. CaCO₃ se također koristi u proizvodnji papira, plastike, u građevinarstvu iu mnogim drugim područjima.
Kalcijev karbonat je bijela tvar (kruti kristali) u praškastom ili krutom obliku. On može reagirati s vodom, ali ne i potpuno otopljen u njemu. Zbog toga voda postaje mutna, u njoj je bijeli talog. No, ako se reakcija s vodom odvija u prisutnosti, tada ćemo dobiti topljivu kiselinsku sol, kalcijev bikarbonat:
CaCO2 + CO₂ + H20 → Ca (HCO)
Razmotrite kako se proizvodi kalcijev karbonat.
Većina kalcijevog karbonata dobiva se iz prirodnih izvora. Dakle, da biste dobili kalcijev karbonat za, u pravilu, koristiti čist izvor, često mramora.
 Mramorni kip Davida Michelangelo Buonarroti
Mramorni kip Davida Michelangelo Buonarroti
Ali u laboratorijskim uvjetima kalcijev karbonat se može dobiti kalciniranjem kalcijevog oksida. Kalcinacija se odnosi na opći pojam gorenja, zbog čega kemikalije dobivaju nova svojstva. Pečenje se provodi na dovoljno visokoj temperaturi, ne dosežući taljenje.
Voda se miješa s nastalim kalcijevim oksidom, reakcija proizvodi hidroksid. Zatim tehničari dobiju ugljični dioksid, koji se propušta kroz prethodno dobivenu otopinu. Nastali talog je kalcijev karbonat:
CaO + H20 = Ca (OH);
Ca (OH) + CO2 = CaC02 + H20
Ako zagrijavamo sol ugljične kiseline i kalcija na visoku temperaturu (900 - 1000 ° C), tada ćemo kao rezultat kemijskog procesa dobiti ugljični dioksid (ugljični dioksid), kao i kalcijev oksid CaO - vapno koji se koristi u izgradnji:
CaCO2 = CaO + CO2
Ako je temperatura još viša (1500 ° C), tada će reakcijski produkti biti kalcijev karbid i ugljični monoksid.
Klorovodična kiselina
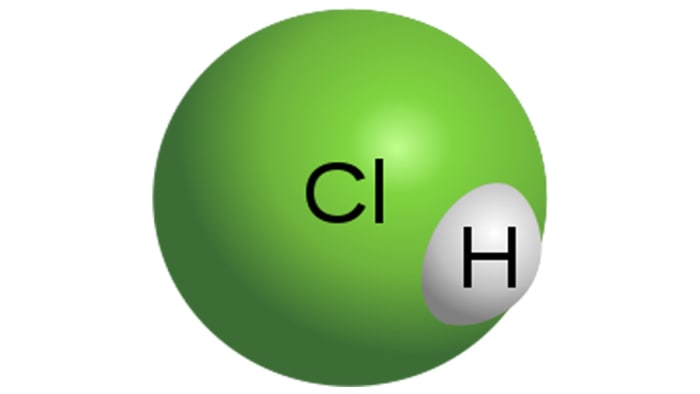 Molekula klorovodične kiseline
Molekula klorovodične kiseline
HCl je jaka monobazična kiselina, koja se dobiva otapanjem klorovodika u vodi. To je bezbojna tekućina, iako tehnička kiselina može imati žutu nijansu, na primjer, zbog nečistoće željeza. Svojstva HCl izravno ovise o koncentraciji klorovodika u otopini.
Soli klorovodične kiseline nazivaju se kloridi. Ova tvar je vrlo kaustična, stoga zahtijeva pažljivo rukovanje: čak i ako na kožu padne mala kap, tada se ne može izbjeći jaka kemijska opeklina. Stoga, kada radite s jakim kiselinama, preporučljivo je uvijek nositi neutralizatore sa sobom: slabe alkalne otopine, (soda za pečenje), itd. Važno je upamtiti da se pri otvaranju spremnika s koncentriranom kiselinom stvaraju pare HCl, koje nepovoljno utječu na oči i dišni sustav. Stoga bi u kemijskim pokusima bilo najbolje koristiti respirator i zaštitne naočale.
Dobivanje klorovodične kiseline
Plinoviti klorovodik se otopi u vodi. Sam klorid vodika dobiva se kako slijedi: vodik se spaljuje u kloru, čime se dobiva sintetska kiselina. Alternativno, klorovodična kiselina se može dobiti korištenjem bočnih plinova, koji se dobivaju u brojnim kemijskim pokusima, na primjer, kada su klorirani ugljikovodici klorirani. Na taj način dobivena kiselina se naziva abgas.
Nanesite klorovodičnu kiselinu u medicini, industriji, ali i na kemijske reakcije.
Bezbojna kiselina s oštrim mirisom klorovodika dobro reagira s metalima. Nastaje redoks reakcija. Reducirajuća sredstva u reakcijskom postupku su atomi metala, a oksidacijska sredstva su kationi vodika.
Uglavnom kemijske reakcije s metalima praćene su otpuštanjem vodika. Intenzitet interakcije ovisi o aktivnosti metala, na primjer, litij alkalnog metala reagira burno, dok je reakcija s aluminijem slaba zbog jakog oksidnog filma ovog elementa.
Klorovodična kiselina i cink:
2HCl + Zn = ZnCl2 + H3
Klorovodična kiselina i željezo:
2HCl + Fe = FeCl2 + H3
Klorovodična kiselina i magnezij:
2HCl + Mg = MgCl2 + H3
 Magnezij klorid koji se koristi za čišćenje cesta od leda
Magnezij klorid koji se koristi za čišćenje cesta od leda
S oksidima metala, kiselina tvori sol i vodu:
CuO + 2HCl = CuCl2 + H20
Reakcija klorovodične kiseline i kalcijevog karbonata
Za eksperiment će trebati:
epruveta za ispitivanje;
kemijska pipeta;
kruti kalcijev karbonat (mramor);
klorovodična kiselina;
rukavice;
respirator.
Upozorenje! Ne pokušavajte ovo iskustvo sami!
Provedite pokus u dobro prozračenom prostoru, budite oprezni pri radu s klorovodičnom kiselinom.
Dodajte nekoliko komada mramora u posudu i pipetirajte neku klorovodičnu kiselinu. Kao rezultat toga, pojavit će se trenutna reakcija s nastankom mjehurića - oslobađa se ugljični dioksid. To je reakcija razmjene, čiji su proizvodi: slab i nestabilan spoj, ugljična kiselina, koja se raspada u ugljični dioksid i vodu. Jednadžba reakcije otapanja kalcijevog karbonata u klorovodičnoj kiselini:
CaCO2 + 2HCl (razr.) → CaCl2 + CO2 + H20
- svojstvo elementa magnezija: elektronska struktura, moguća oksidacijska stanja, bazični spojevi: oksid, hidroksid, soli. Što je karbonizacija i kakva je njezina uloga u izgradnji.
MgCO3 = MgO + COz
Primjena.
U industriji se koristi za proizvodnju vatrostalnih materijala, cementa i pročišćavanja naftnih derivata, kao punilo u proizvodnji gume. Ultra-lagani magnezijev oksid koristi se kao vrlo fini abrazivni materijal za čišćenje površina, posebno u elektroničkoj industriji.
U medicini se koristi u slučaju povećane kiselosti želučanog soka, jer je uzrokovana prekomjernim sadržajem klorovodične kiseline. Spaljeni magnezij također se uzima kada se kiselina slučajno ispusti u želudac.
U prehrambenoj industriji registriran je kao prehrambeni aditiv E530.
To je apsolutni reflektor - tvar s koeficijentom refleksije jednak onom u širokom spektralnom pojasu. Može se koristiti kao dostupan bijeli standard.
Magnezijev hidroksid - Glavni metalni hidroksid je magnezij. Slaba netopljiva baza.
Pod standardnim uvjetima, magnezijev hidroksid je bezbojna heksagonalna rešetka. Na temperaturama iznad 350 ° C razgrađuje se na magnezijev oksid i vodu. Apsorbira ugljični dioksid i vodu iz zraka u glavni magnezijev karbonat. Magnezijev hidroksid je praktički netopljiv u vodi, ali topljiv u amonijevim solima. To je slaba baza. Pojavljuje se u prirodi u obliku mineralnog brucita.
Uzimajući.
Interakcija topljivih magnezijevih soli s alkalijama:
Općenito:
Mg 2+ + 2OH - = Mg (OH) 2p
primjeri:
MgCl2 + 2NaOH = Mg (OH) 2p + 2NaCl
Mg (NO3) 2 + 2KOH = Mg (OH) 2p + 2KNO3
Interakcija otopine magnezijevog klorida s izgaranjem dolomita:
MgCl2 + CaO × MgO + 2H2O = 2 Mg (OH) 2p + CaCl2
Interakcija metalnog magnezija s vodenom parom:
Mg + 2H2O = Mg (OH) 2 ¯ + H2 -
Kemijska svojstva
Kao i sve slabe baze, magnezijev hidroksid je termički nestabilan. Raspada se pri zagrijavanju na 350 ° C:
Djeluje s kiselinama u obliku soli i vode (reakcija neutralizacije):
Mg (OH) 2 + 2HCl = MgCl2 + 2H20
Mg (OH) 2 + H2S04 = MgS04 + 2H20
Interakcija s kiselim oksidima u obliku soli i vode:
Mg (OH) 2 + S03 = MgS04 + H20
Interakcija s vrućim koncentriranim otopinama alkalija s formiranjem hidroksimagnezata:
Mg (OH) 2 + 2NaOH = Na2
Mg (OH) 2 + Sr (OH) 2 = Sr
Primjena.
Magnezij hidroksid se koristi za vezanje sumpornog dioksida, kao flokulanta za obradu otpadnih voda, kao usporivač plamena u termoplastičnim polimerima (poliolefini, PVC), kao dodatak u deterdžentima, za proizvodnju magnezijevog oksida, rafiniranja šećera, kao komponente zubnih pasti.
U medicini se koristi kao lijek za neutralizaciju kiseline u želucu, kao i vrlo jak laksativ.
U Europskoj uniji, magnezij hidroksid je registriran kao dodatak hrani E528.
Magnezijeve soli.
Većina magnezijevih soli je vrlo topiva u vodi. Ion Mg 2+ daje otopinama gorak okus. Magnezijevi halidi, osim MgF2, vrlo su higroskopni - krvare u zraku.
Magnezij klorid MgCl2 (magnezijev klorid) bezvodni tali se na 718 °. U prisutnosti tragova vode u zraku "puši" - razgrađuje se na HCl i MgO. Bezbojni kristalni hidrati s 1, 2, 4, 6, 8 i 12 molekula vode oslobađaju se iz vodene otopine. U temperaturnom rasponu od –3,4 do 116,7 °, kristalni hidrat MgCl 2 × 6H 2 0 je stabilan, što se prirodno javlja kao mineral bischofite, au velikim količinama se dobiva isparavanjem morskih rasola. Magnezijev klorid tvori dvostruke soli, od kojih je izuzetno važan mineral karnalit KCl × MgCl 2 × 6H 2 O - izvor magnezija i kalijevog klorida.
Primjena.
1. Magnezijev klorid se koristi uglavnom u proizvodnji metalnog magnezija, za dobivanje magnezijevih cementa koristi se MgCl2 × 6H20.
2. Koristi se za obradu leda i snježnog pokrivača kao dodatka. Kao rezultat reakcije sa snijegom, uzrokuje taljenje. Ima 3. klasu opasnosti (umjereno opasne tvari) i agresivna korozivna svojstva.
Magnezijev bikarbonat - kisela sol magnezija i ugljična kiselina formule Mg (HCO 3) 2, postoji samo u vodenim otopinama.
Uzimajući.
Prijenos ugljikovog dioksida kroz suspenziju magnezijevog karbonata:
MgCO3 + CO2 + H20 = Mg (HC03) 2
Fizička svojstva.
Magnezijev bikarbonat postoji samo u vodenim otopinama.
Prisutnost magnezijevog bikarbonata u vodi uzrokuje njegovu privremenu krutost.
Kemijska svojstva
Kada se koncentrira otopina, magnezij bikarbonat se raspada:
Mg (HC03) 2 = MgC03 + C02- + H20
Magnezijev hidrofosfat (disupstituirani magnezijev fosfat) - kisela sol magnezija i fosforna kiselina formule MgHPO 4, slabo topljiva u vodi, tvori kristalne hidrate.
Uzimajući.
Učinak ortofosforne kiseline na magnezijev oksid ili magnezijev karbonat:
MgO + H3P04 = MgHP04 + H20
MgC03 + H3P04 = MgHP04 + C02- + H20
Djelovanje disupstituiranog natrijevog ortofosfata na magnezijev klorid:
MgCl2 + 2Na2HP04 = MgHP04 + 2NaCl
Raspad magnezija dihidrogen fosfata:
Mg (H2PO4) 2 = MgHP04 + H3P04
Fizička svojstva.
Magnezijev hidrogen fosfat tvori bijele kristale, koji su kristalni hidrati: na temperaturama do 225 ° C nastaje monohidrat MgHPO4. H 2 O, gustoća 2,32 g / cm3, na temperaturi od 36 ° C, nastaje MgHPO4 trihidrat. 3H2O, gustoća 2,10 g / cm3, s sobnoj temperaturi Nastaje MgHPO4 heptahidrat. 7H2O.
Kemijska svojstva.
Kada se zagrijava ulazi u pirofosfat:
Primjena.
Koristi se u dodatku prehrani E343.
Magnezij dihidrogen fosfat - kisela sol metala magnezija i ortofosforne kiseline s formulom Mg (H 2 PO 4) 2, bezbojni higroskopni kristali, topljivi u vodi, tvore kristalne hidrate.
Uzimajući.
Otapanje hidroksida ili magnezijevog oksida u ortofosfornoj kiselini:
Fizička svojstva.
Magnezij dihidrogen fosfat tvori bezbojne kristale.
Formirani kristalni hidratni sastav Mg (H 2 PO 4) 2. nH2O, gdje je n = 2, 4, 6.
Magnezijev karbid - binarni anorganski spoj magnezija i ugljika s formulom MgS2. Također poznat magnezijev karbid s formulom Mg2C.
Uzimajući.
Sinteriranje magnezijevog fluorida i kalcijevog karbida:
Tekući acetilen preko magnezijevog praha:
Obnavljanjem pentana s magnezijevim prahom na 650 ° C može se dobiti više kompleksnog karbida Mg2C3.
Kemijska svojstva.
Kada se zagrijava razgrađuje s nastankom intermedijera karbida Mg2C3:
Interakcija s vodom:
Magnezijev karbonatmagnezijevog karbonata, MgCO3 - magnezijeve soli ugljične kiseline.
Svojstva.
Bijeli kristali, gustoća 3,037 g / cm3. Na 500 ° C je primjetan, a na 650 ° C potpuno se razgrađuje na MgO i CO2. Topivost magnezijevog karbonata u vodi je neznatna (22 mg / l na 25 ° C) i smanjuje se s povećanjem temperature. Kada je CO2 zasićen vodenom suspenzijom MgC03, posljednji se otapa zbog stvaranja Mg (HC03) 2 bikarbonata. Iz vodenih otopina u odsutnosti suviška CO 2 emitiraju se bazični magnezijevi karbonati. Kod karbonata brojnih metala, magnezijev karbonat tvori dvostruke soli, koje uključuju prirodni mineral dolomit MgCO3 · CaCO3.
Prevalencija u prirodi.
Magnezijev karbonat je široko rasprostranjen u prirodi u obliku mineralnog magnezita.
Primjena.
Osnovni magnezijev karbonat 3MgCO3 · Mg (OH) 2 · 3H2O (tzv. Bijeli magnezij) koristi se kao punilo u gumenim smjesama za proizvodnju materijala za toplinsku izolaciju.
Magnezij karbonat je neophodan u proizvodnji stakla, cementa, cigle.
Magnezijev nitrat Mg (NO3) 2 - bezbojni higroskopni kristali s kubičnom rešetkom; talište 426 ° C (s raspadom). Topivost u vodi (g na 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Također je topljiv u etanolu, metanolu, tekućem NH3. Ovisno o koncentraciji, iz vodenih otopina kristaliziraju nona-, heksa- i dihidrati.
Komponenta složenih gnojiva, budući da je magnezij dio klorofila, koji je potreban za fotosintezu, povećava aktivnost mnogih enzima i djeluje kao fosforni transporter. Visoka topljivost i niska električna vodljivost čine proizvod iznimno prikladnim za folijarno hranjenje i fertirigaciju, osobito kada se koriste vode za navodnjavanje s visokom koncentracijom soli. Gnojivo se koristi za korijensku i folijarnu prehranu povrća, bobičastog voća, voćnih kultura, grožđa; oksidaciju u pirotehničkim sastavima.
karbonizacija- zasićenje bilo koje otopine ugljičnim dioksidom. Koristi se u građevinarstvu.
Mineralna karbonacija - silicijeva kiselina u silikatima zamijenjena je ugljičnom kiselinom u karbonate. Od karbonata, mineralni kamen u sedimentnim stijenama je kalcit (krečnjak) CaCO3. Magnezit - MgCO3 i dolomit - CaMg (CO3) 2 su rjeđi. čista vodane sadrži ugljičnu kiselinu, kalcit se otopi u maloj količini (0,03 g po litri vode); magnezit je praktički netopljiv. Ako voda sadrži ugljični dioksid, kalcit se lako otapa formiranjem kiselog kalcijevog karbonata, topljivog u vodi - Ca (HCO3) 2.
Karbonizacija je promjena koja se javlja u betonu na portland cementu kada je izložena zraku C0 2. Posebno je pogođen kalcijev hidroksid Ca (OH) 2 u prisutnosti vlage. Kalcijev hidroksid se pretvara u kalcijev karbonat kada apsorbira ugljični dioksid. Kalcijev karbonat slabo je topljiv u vodi i kao rezultat ima tendenciju hermetičkog zatvaranja pora na površini betona (što znači gusti, vodonepropusni beton).
Tipično, pH porne vode u betonu kreće se od 10,5 do 11,5. Ako se zbog karbonizacije smanji na 9 i ispod, tada je moguća korozija armature. Stoga je debljina karboniziranog sloja važan čimbenik u zaštiti armature: što je karbonizacija dublja, veća je i opasnost od korozije čelika. Dubina karbonacije može se odrediti tretiranjem betona fenolftaleinom. Prisutnost alkalnih svojstava pod djelovanjem fenolftaleina pokazuje ružičasta boja, dok gazirani beton zadržava svoju izvornu boju.
Visoko kvalitetni gusti beton prolazi kroz karbonizaciju vrlo sporo. Malo je vjerojatno da će karbonizacija biti promatrana na dubini većoj od 5-10 mm čak i nakon rada tijekom 50 godina. S druge strane, dubina karbonizacije slabo propusnog betona može doseći 25 mm za manje od 10 godina. Iskustvo pokazuje da su betonski proizvodi niske kvalitete posebno osjetljivi na karbonizaciju.
- obilježje kalcijevog elementa: elektronska struktura, moguća oksidacijska stanja, glavni spojevi: oksid, hidroksid, soli.
kalcijum - element glavne podskupine druge skupine, četvrto razdoblje periodnog sustava kemijskih elemenata DI Mendeleev, s atomskim brojem 20. Označeno simbolom Ca (lat. Calcium). Elektronska struktura 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, stanje oksidacije +2, 0. Odnosi se na zemnoalkalijske metale.
Jednostavna tvar kalcij je mekana, kemijski aktivna zemnoalkalna metala srebrno-bijele boje. Industrijska proizvodnja: elektroliza rastaljenog kalcijevog klorida.
Kalcijev oksid CaO - bazični oksid, vapno. Bijela, higroskopna. Vatrostalni, termički nestabilni, hlapljivi tijekom paljenja. Snažno reagira s vodom (s visokim egzo efektom), formira jako alkalnu otopinu, proces se naziva gašenje vapna. Reagira s kiselinama, metalnim oksidima, nemetalima. Koristi se za sintezu drugih kalcijevih spojeva, koji su sastavni dio veznih materijala u graditeljstvu.
Proizvodnja u industriji - pečenje vapnenaca (900 - 1200 o C)
Kalcijev hidroksid Ca (OH) 2 - hidrirani vapno, bazični hidroksid. Razgrađena s umjerenim grijanjem. Bijela, higroskopna. Upija vlagu i ugljični dioksid iz zraka. Malo topljiv na hladnoći. vode, još manje - u kipućoj vodi. Bistra otopina (vapnena voda) brzo postaje zamagljena zbog taloženja hidroksida (suspenzija se zove mlijeko vapna). Kvalitativna reakcija je prijenos ugljičnog dioksida kroz vapnenu vodu s pojavom CaCO3 sedimenta i njegovim prelaskom u otopinu. Reagira s kiselinama i kiselim oksidima, ulazi u reakcije ionske izmjene.
Koristi se u gradnji za pripremu vapnenog žbuka (pijesak + gašeno vapno + voda), koji služe kao vezivni materijal za zidove od kamena i opeke, dorade (žbukanje) i druge građevinske svrhe. Stvrdnjavanje takvih otopina posljedica je apsorpcije CO2 iz zraka.
Ca (OH) 2 + CO2 → CaCO3 + H20
Ca (OH) 2 + H2S04 → CaSO4 + 2H2O,
Reagira s solima ako nastane talog:
Ca (OH) 2 + Na2S03 → CaS03 + 2NaOH
Kalcijeve soli.
Kalcijev sulfat (CaS04) - anorganski spoj, kalcijeva sol sumporne kiseline.
Nalazi se u prirodi kao CaSO 4 dihidrat? 2H2O (gips, selenit) i bezvodni anhidrit.
Kalcijev klorid, CaCl2 - kalcijeva sol klorovodične kiseline.
Posjeduje visoka higroskopna svojstva. Topljivost (g na 100 g H20): 74 (20 ° C) i 159 (100 ° C). Vodene otopine kalcijevog klorida zamrzavaju se na niskim temperaturama (20% na -18,57 ° C, 30% na -48 ° C).
Stvara hidrat CaCl2 · 6H20, stabilan do 29,8 ° C; pri višim temperaturama iz zasićene otopine ispadaju kristalni hidrati s 4, 2 i 1 molekulom H20. Kada se CaCl2 * 6H2O (58,8%) pomiješa sa snijegom ili ledom (41,2%), temperatura pada na -55 ° C (kriohidratna točka).
Kalcijev klorid se dobiva kao nusproizvod u proizvodnji sode.
U kemijskom laboratoriju, kalcijev klorid se koristi kao punilo za cijevi za sušenje, koje se nazivaju i kalcijev klorid, a namijenjeno je izoliranju tvari u posudi od atmosferske vodene pare i za sušenje plinova.
Kalcijev klorid se također koristi kao ubrzivač za vezivanje cementa;
Kalcijev karbonat (kalcijev karbonat) - anorganski kemijski spoj, sol ugljične kiseline i kalcij. Kemijska formula - CaCO 3. U prirodi, nalazi se u obliku minerala - kalcit, aragonit i vaterit, glavni sastojak vapnenca, mramora, krede, dio je ljuske jaja. Netopljiv u vodi i etanolu.
Kit, razne brtvila - svi sadrže kalcijev karbonat u značajnim količinama. Također, kalcijev karbonat je bitna komponenta u proizvodnji kućanskih kemikalija.
Kalcijev karbonat se također široko koristi u sustavima čišćenja, kao sredstvo za suzbijanje onečišćenja okoliša, a uz pomoć kalcijevog karbonata obnavlja se kiselinsko-bazna ravnoteža tla.
- Primjeri koji ilustriraju upotrebu oksida i hidroksida kalcija i magnezija u konstrukciji.
Kalcijev oksid i hidroksid:
Kada su u sobi za bijeljenje.
Kada bijeljenje drvenih ograda i razmazivanje rogova - za zaštitu od truljenja i požara.
Za pripremu vapnene žbuke. Vapno se od davnina koristi za zidanje zidova. Smjesa se obično priprema u tom omjeru: tri ili četiri dijela pijeska (težinski) dodaju se jednom dijelu smjese kalcijevog hidroksida (hidratiziranog vapna) i vode. Kada se to dogodi, reakcija se stvrdnjava: Ca (OH) 2 + CO2 → CaCO3 H2 + H2O. To je egzotermna reakcija, oslobađanje energije je 27 kcal (113 kJ).
Kao što se može vidjeti iz reakcije, tijekom nje se oslobađa voda. To je negativan čimbenik, budući da u prostorijama izgrađenim vapnenom žbukom dugo vremena ostaje visoka vlažnost. U tom smislu, kao i zbog brojnih drugih prednosti u odnosu na kalcijev hidroksid, cement ga je praktički zamijenio kao vezivo za građevinska rješenja. Štoviše, to je također neprihvatljivo za uporabu pri polaganju peći, jer se pod utjecajem visokih temperatura oslobađa ugušeni ugljični dioksid.
Za pripremu silikatnog betona. Sastav silikatnog betona identičan je sastavu vapnene žbuke, ali se priprema drugom metodom - mješavina kalcijevog oksida i kvarcnog pijeska se ne tretira s vodom, već s pregrijanom (174,5-197,4 ° C) vodenom parom u autoklavu pri tlaku od 9-15 atmosfera.
U proizvodnji silikatnih opeka.
Oksid i magnezijev hidroksid:
za proizvodnju kombiniranih sustava vatrostalnih materijala (magnezitne gradbene ploče), za proizvodnju cementa. Magnezij oksid (kaustični magnezit) koristi se kao vezivo, koje se, kada se pomiješa s otopinom MgCl2, može brzo otvrdnuti i dobiti čvrstoću u zraku.
- tvrdoća prirodnih voda: definicija, tipovi tvrdoće, metode uklanjanja tvrdoće vode: fizikalne, kemijske (jednadžbe reakcije), fizikalno-kemijske.
Prirodna voda koja sadrži veliku količinu kalcijevih ili magnezijevih soli u otopini naziva se tvrda voda za razliku od meke vode koja sadrži malo ili nimalo soli kalcija i magnezija.
Prvi je posljedica prisutnosti kalcijevih i magnezijevih bikarbonata, a drugi prisutnosti soli jakih kiselina, sulfata ili klorida kalcija i magnezija. Uz produljeno vrenje vode s karbonatnom tvrdoćom, u njoj se pojavljuje talog koji se sastoji uglavnom od CaCO3, a istodobno se oslobađa CO2.
Obje ove tvari pojavljuju se kao rezultat raspadanja kalcijevog karbonata:
Stoga se karbonatna krutost naziva i privremena krutost. Kvantitativno, privremena krutost karakterizirana je sadržajem bikarbonata koji se izvlači iz vode kada se kuha jedan sat. Krutost koja ostaje nakon takvog ključanja naziva se konstantna krutost.
Tvrdoća vode izražava se sumom miliekvivalenata iona kalcija i magnezija sadržanih u vodi. Jedan miliekvivalent krutosti odgovara sadržaju od 20,04 mg / l ili 12,16 mg / l.
Tvrdoća prirodnih voda uvelike varira. Različita je u različitim akumulacijama, au istoj rijeci varira tijekom cijele godine (minimalna tijekom poplave). Tvrdoća mora mora znatno je veća od rijeka i jezera. Dakle, crnomorska voda ima ukupnu tvrdoću od 65,5 meq / l. Prosječna vrijednost tvrdoće vode u svjetskom oceanu je 130,5 meq / l (uključujući 22,5 meq / l po meq / l).
Prisutnost značajne količine soli kalcija ili magnezija u vodi čini vodu neprikladnom za mnoge tehničke svrhe. Dakle, uz produljeno hranjenje parnim kotlovima s tvrdom vodom, njihovi zidovi postupno postaju prekriveni gustom kore od nakiii. Takva kora već na debljini sloja u velikoj mjeri smanjuje prijenos topline zidovima kotla i time dovodi do povećanja potrošnje goriva. Osim toga, može uzrokovati stvaranje mjehura i pucanja kako u cijevima za grijanje tako i na zidovima samog kotla.
Tvrda voda ne daje pjenu sapunom, jer se topljive natrijeve soli masnih kiselina - palmitinske i stearinske - sadržane u sapunu pretvaraju u netopive kalcijeve soli istih kiselina:
Tvrda voda ne može se koristiti pri izvođenju nekih tehnoloških procesa, na primjer, prilikom bojanja.
Stalna tvrdoća vode posljedica je prisutnosti u njoj uglavnom sulfata i klorida kalcija i magnezija te se ne eliminira ključanjem. Zbroj privremene (uklonjive) i konstantne tvrdoće je ukupna tvrdoća vode.
Postoje različiti načini određivanja krutosti.
Razmotrite dvije od njih:
1) određivanje vremenske krutosti pomoću titrirane otopine klorovodične kiseline
2) kompleksometrijska metoda za određivanje ukupne krutosti.
Tijekom titracije uzorka vode klorovodičnom kiselinom u prisutnosti metil-naranče dolazi do raspadanja bikarbonata, što uzrokuje privremenu krutost:
Metoda određivanja. 100 ml ispitivane vode uzme se u konusnu tikvicu s pipetom ili mjernim cilindrom, dodaju se 2-3 kapi metil-naranče i titriraju s 0,1 i. Otopine HCl dok se ne pojavi narančasta boja.
Analiza rezultata proračuna. 1 ml 0,1 n. Otopina HCl odgovara 0,1 / 1000 g-eq ili 0,1 mg-eq Ca2 +. V (HCl) odgovara 0,1 V (HCl) / 1000 g-eq ili 0,1 V (HCl) mg-eq Ca2 +. 0,1 V (HCl) mEq je u volumenu V A. Da bi se izrazila krutost u miligramu-ekvivalentima po 1 l vode, treba podijeliti vrijednost dobivenu s V A i pomnožiti je s 1000, tj. Tvrdoća vode koja se ispituje je:
![]()
Metode eliminacije.
Toplinsko omekšavanje. Na temelju vrenja vode, kao posljedica termički nestabilnih kalcijevih i magnezijevih bikarbonata razgrađuju se formiranjem razmjera:
Ca (HCO3) 2 → CaCO3 CO2 + CO2 + H2O.
Kuhanje uklanja samo privremenu (karbonatnu) tvrdoću. Pronalazi primjenu u životu.
Omekšavanje reagensa, Metoda se temelji na dodavanju Na2CO3 natrijevog karbonata ili hidriranog vapna Ca (OH) 2 u vodu. U isto vrijeme, soli kalcija i magnezija prelaze u netopljive spojeve i kao rezultat se talože.
Na primjer, dodavanje hidriranog vapna dovodi do konverzije kalcijevih soli u netopljivi karbonat:
Ca (HC03) 2 + Ca (OH) 2 → 2CaCO3 + 2H20
Najbolji reagens za uklanjanje ukupne tvrdoće vode je natrijev ortofosfat Na3PO4, koji je dio većine kućanskih i industrijskih proizvoda:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 6 + 6NaHCO3
3MgS04 + 2Na3PO4 → Mg3 (PO4) 2 + 3Na2S04
Kalcij i magnezij ortofosfati su vrlo slabo topljivi u vodi i stoga se lako odvajaju mehaničkom filtracijom. Ova metoda je opravdana relativno visokom potrošnjom vode, jer uključuje rješavanje brojnih specifičnih problema: filtraciju sedimenta, preciznu dozu reagensa.
Razmjena kation. Metoda se temelji na primjeni ionsko-izmjenjivog zrnatog punjenja (najčešće ionsko-izmjenjivačkih smola). Takvo opterećenje pri kontaktu s vodom apsorbira katione soli tvrdoće (kalcij i magnezij, željezo i mangan). Umjesto toga, ovisno o ionskom obliku, on daje ione natrija ili vodika. Ove metode nazivaju se Na-kationizacija i H-kationizacija. Uz pravilno odabrano ionsko-izmjenjivačko opterećenje, tvrdoća vode se smanjuje s jednostupanjskom natrijevom kationizacijom na 0,05-0,1 ° W, s dvostupanjskim opterećenjem - do 0,01 ° W. U industriji, ionsko-izmjenjivački filteri zamjenjuju ione kalcija i magnezija natrijevim i kalijevim ionima, stvarajući meku vodu.
Reverzna osmoza. Metoda se temelji na prolasku vode kroz polupropusnu membranu (obično poliamid). Zajedno sa solima tvrdoće, većina ostalih soli se uklanja. Učinkovitost čišćenja može doseći 99,9%.
Postoji nanofiltracija (nominalni promjer rupa membrane je jednaka jedinicama nanometara) i picofiltracija (nominalni promjer rupa membrane jednak je jedinicama pikometara).
Kao nedostatke ove metode treba napomenuti:
Potreba za predobradom vode koja se dostavlja membrani reverzne osmoze;
Razmjerno visoki trošak 1 litre vode koja se proizvodi (skupa oprema, skupe membrane);
Mala mineralizacija proizvedene vode (posebno kod picofiltracije). Voda postaje gotovo destilirana.
Elektrodijalizna. Temelji se na uklanjanju soli iz vode pod djelovanjem električnog polja. Uklanjanje iona otopljenih tvari nastaje zbog posebnih membrana. Kao i kod tehnologije reverzne osmoze, osim iona tvrdoće, dolazi do uklanjanja drugih soli.
Može se destilirati potpuno čista voda iz soli tvrdoće.
