Reacciones iguales que caracterizan el poder del ácido sulfúrico disuelto. Lista de comidas de examen de disciplinas
El ennegrecimiento de la superficie de pinturas antiguas, escritas con fibras de olivo, a cuyo depósito ingresa blanco de plomo (PbCO3), se relaciona con soluciones de sulfuro de plomo (II) negro por la presencia de agua circulante en la atmósfera. Si tiñe la superficie con agua con peróxido, se observa la reacción de la solución de sulfato de plomo (II) con un color blanco:
PbS + 4H2O2 = PbSO4 + 4H2O.
De esta manera, restauran pinturas antiguas ennegrecidas, pintadas con farbs de olivo.
Zastosuvannya agria y sirki
Las áreas de estancamiento de la acidez están representadas por el pequeño 61.
permitir vicoristovuvati yogo por infección agua potable ese manantial de aguas residuales industriales; como desinfectante zasib en medicina. El ozono es victorioso y yak vidbіlyuyuchiy zasib.
Syrka vicorist para la producción de ácido sulfúrico, la preparación de syrnikiv, fuegos de bengala, la lucha contra los shkidniks del estado fuerte y para inculcar la exaltación de tales dolencias. Serka sabe zastosuvannya durante la producción de goma, barniki y pigmentos, piezas de fibras, luminóforos y otros.
Mal. 61. besos

Para el ácido en las heces, que se encuentran entre los elementos más pequeños, la etapa de oxidación -2 es la más característica, los átomos de azufre, selenio y telurio muestran la etapa de oxidación -2, +2, +4 y +6.
Los óxidos del poder del ácido y el azufre se manifiestan en sus reacciones con metales, agua y otros no metales.
consulta y tarea
1. Fórmulas plegables con acidez con potasio, calcio y aluminio. Indique la etapa de oxidación del elemento de la piel y nombre la enfermedad.
2. Razrahuyte fracción de masa de sirka en sulfuro de aluminio.
3. El nombre "kysen" - oxigenio significa "que genera ácidos". Anote fórmulas químicas traeros ácidos, al almacén de los cuales depositar el elemento. Nombra ácidos.
4. ¿Sabes qué tipo de modificaciones alotrópicas de agrio y agrio? ¿Por qué apestan uno por uno?
5. Kisen, que es inhalado por un ser humano, se eleva de la hemoglobina de la sangre. Parece que la hemoglobina con un peso de 1 g viene con un volumen (n.a.) de 1,35 cm3 3 . La cantidad de hemoglobina en la sangre de personas sanas es de 140 g/dm3. El volumen total de sangre es de 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlikist sour, usted mazhe opinetytsya en la sangre de las personas.
6. Determine la fracción de masa de ácido sirkovodnoy en términos, extraído en caso de volumen sirvodnyu separado (n.a.) 8.96 dm 3 en agua con una masa de 500 g.
7. Ampliar los coeficientes en los esquemas ofensivos reacciones de óxido prominente:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2S + Br2 → S + HBr;
c) H2S + O2 → S + H2O.
En reacción de la piel indican un agente oxidante.
§ 39. Kisnevmisnі spoluki sirka
En z'ednannyah con sirka agria muestra la etapa de oxidación+4 y +6.
Óxido de Sirka(IV). Ácido sulfúrico
El óxido (IV) - SO2 (gas sirquista) - es un gas sin barril con un olor característico fuerte, que sale cuando el aire está caliente:
S + O2 = tSO2.

Uno de los zastosuvans más recientes de la sirka estaba ligado a la fumigación de la sirka de la vida, que debía quemarse. Como escribió el historiador antiguo Plinio Sr. en el siglo I a. e., "los olores del hogar del sirka pueden proteger contra todo tipo de hechizos y ahuyentar a todos los espíritus malignos". Los poderes desinfectantes y bactericidas del óxido de azufre (IV) son indirectos y contagiosos. El gas de azufre se alimenta durante el procesamiento de verduras, frutas y frutas para evitar que se pudran.
Liberación de gas sulfúrico cerca del agua (hasta 40 volúmenes de SO2 por 1 volumen de agua) - sin manchas, de base dual ácido sulfúrico como disponible solo al por menor:
SO2 + H2 O H2 SO3.
El ácido sulfuroso es un ácido débil, en soluciones acuosas se disocia en etapas a menudo con soluciones de iones de hidrosulfito y sulfito:
H+ + H SO – , | – H+ + SO2–. |
||||
El ácido sulfuroso exhibe dominancia química, sulfuroso para ácidos: interactúa con óxidos básicos, bases, reacciona con el intercambio de sales de otros ácidos, zocrema, ácido carbónico débil viscoso de sales:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Óxido de Sirka(VI)
El óxido (VI) posee, oxidando el óxido (IV) en presencia de un catalizador a una temperatura de aproximadamente 500 C:
t, gato.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
Para las mentes más grandes, el óxido de azufre (VI) SO3 es un ácido sin barra que, a temperaturas inferiores a 17 °C, se transforma en un habla cristalina blanca. Ce es un óxido de ácido típico, que interactúa con el agua, produciendo ácido sulfúrico fuerte:
SO3 + H2O = H2SO4.
ácido sircánico
La fórmula gráfica y el modelo de la molécula de ácido sulfúrico se señalan en el pequeño 62.
Mal. 62. Fórmula gráfica y modelo de la molécula de ácido sulfúrico
En círculos de cría ácido sulfúricoє electrolito fuerte,
і її la disociación se expresa de la siguiente manera:
H2 SO4 → 2Н+ + SO4 2– .
Poder físico del ácido sulfúrico
Ácido sulfúrico - florero (resistencia 1,83 g/cm3), aceitoso, inodoro, inodoro. Ella irá al agua en una especie de botellas de agua.
El proceso de distribución de H2SO4 a una cantidad química de 1 mol va acompañado de 92 kJ de calor, que pueden compararse con las magnitudes de los efectos térmicos en las reacciones químicas. Ver una gran cantidad de calor en la interacción del ácido sulfúrico con el agua es evidencia del establecimiento de brotes minerales entre dos ríos de hidratación tipo H2 SO4 n H2 O.
Por ejemplo, H2 SO4 H2 O; H2SO4 · 2H2O; H2 SO4 3H2 O y así sucesivamente.
los ácidos e hidratos no permiten la viscosidad її como un fuerte agente repelente al agua, por ejemplo, para secar gases.
La aspersión de sumishi con ácido sulfúrico variable en agua puede ir acompañada de aspersión. Recuerda que no se puede verter agua agria
Lotі, se deslizó con una remezcla ininterrumpida, vierta ácido en el agua.
poder quimicoácido sulfúrico. sulfati
Sulfati. Ácido sulfúrico disuelto revela todos los rasgos característicos de los ácidos de dominancia: interacción con metales, que debe estar activo hasta un día; con óxidos básicos y anfóteros, con bases y sales. Cuyas sales se asientan: medio - sulfato, por ejemplo K 2 SO 4 i agrio -
hidrosulfato, por ejemplo KNSO4.
La mayoría de los sulfatos e hidrosulfatos se distinguen bien por el agua, rica en ellos cristalino. Las sales cristaloides de Deyakі de ácido sulfúrico se denominan vitriolo: midny vitriolo CuSO4 ∙5H2 O, vitriolo nasal FeSO4 ∙7H2 O e in.
Para la manifestación ácida del ácido sulfúrico y las sales її en las rosas de agua, se utilizan sales de bario:
Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
Como resultado de la reacción, se establece una precipitación blanca de sulfato de bario.
Certificado de laboratorio 6
Seguimiento de los poderes químicos del ácido sulfúrico diluido
Tener cinco probetas a la vista: metal (zinc u otro metal a elección del lector), óxido básico, hidróxido de sodio, carbonato de sodio, cloruro de bario. Añadir unas gotas de fenolftaleína a la cantidad de hidróxido de sodio y cambiar la dosis. Agregue 1-2 cm3 de ácido sulfúrico diluido al tubo de ensayo de piel. (¡Atención! Si la reacción con el óxido básico transcurre correctamente, acelerar el sobrecalentamiento con medio baño de alcohol.)
¿Qué estás custodiando? ¿Cuáles son los signos que indican el exceso de reacciones químicas? Almacenar reacciones químicas iguales en forma molecular e iónica. ¿Qué tipo de reacción llevaste a cabo? Para recoger visnovok sobre el poder químico del ácido sulfúrico disuelto.
ácido sulfúrico concentradoє agente oxidante fuerte, menos diluido. Al interactuar con ácido sulfúrico concentrado
el agua no se ve con los metales.
W metales, que se encuentran junto al agua (oro carmesí y platino), la reacción procede con óxido de azufre (IV) SO 2 :
Cu + 2H2 SO4(conc) = t CuSO4 + SO2 + 2H2 O.
En la reacción con metales, que están en el rango de actividad hasta el agua, el ácido sulfúrico concentrado puede reducirse a óxido de azufre (IV) SO2, azufre S o agua H2 S se deposita en la actividad del metal y la mente durante la reacción. Por ejemplo:
4Zn + 5H2 SO4(cinetas) = t 4ZnSO4 + H2 S+ 4H2 O.
Supongamos, hace frío, aluminio y otros diáconos, para las mentes más grandes, pasan por ácido sulfúrico concentrado.
El ácido sulfúrico se concentra en interacción con no metales del habla simple, por ejemplo, con azufre:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Oxidante ricamente plegable brotes orgánicos, el ácido sulfúrico quema papel, tela, madera, ropa y shkir. Por lo tanto, tenga cuidado con el ácido sulfúrico concentrado.
El ácido sulfúrico se concentra para eliminar otros ácidos volátiles y sus sales. Por ejemplo:
NaCl (tv) + H2 SO4 (conc) = t NaNSO4 + HCl.
En la República de Bielorrusia, el ácido sirio es vibrado por BAT "Gomel Chemical Plant", BAT "Grodno Azot".
Zonas de estancamiento de ácido sulfúrico
Los hedores presentan al pequeño 63.
Mal. 63. Estasis de ácido sulfúrico
El ácido sulfúrico H2 SO4 es una patria aceitosa, aceitosa e inodoro.
El ácido sulfúrico se disuelve en interacción con los metales, de modo que puede estar activo hasta un día; con óxidos metálicos; con lo básico; de sales
Con la interacción del ácido sulfúrico concentrado con los metales, no se ve agua.
Para la manifestación ácida del ácido sulfúrico y las sales її en las rosas de agua, se utilizan sales de bario.
consulta y tarea
1. Escriba las fórmulas de sus óxidos y ácidos cisnicos. Indicar el grado de oxidación de los átomos de la sirka en ellos.
2. Vznachete masu s_rki, scho quemó en el agrio, yakshcho en el padre vio 29.69 kJ de calor. ¿Con qué cantidad química se sedimenta el óxido de azufre (VI)? El efecto térmico de la reacción del aire caliente se convierte en 296,9 kJ/mol.
3. Koristuyuchis mesa rozchinnosti sales, ácidos y bases en agua, almacene 2 reacciones iguales ácido sulfúrico diluido con sales. escribir una coincidencia
v aspecto molecular e iónico.
4. Razrahuyte la masa y la cantidad química de sulfato de bario, que se disuelve cuando se diluye con ácido sulfúrico a base de nitrato de bario con masa 200 g, fracción de masa de Ba (NO 3 )2 tienen un costo del 10%.
5. Copie del texto del párrafo reacciones iguales, que caracterizan el poder químico del ácido sulfúrico concentrado. Designe el grado de oxidación de los átomos en el sirka en її spolukah. La reacción de la piel muestra un agente oxidante.
6. Cualquier volumen de ácido sulfúrico concentrado (= 1,83 g/cm 3) con una fracción de masa de H2 SO4 98% de la distribución requerida de masa media 6.4 r?
7. Dé los coeficientes para los esquemas de ecualización del inicio de las reacciones oxidativas-oxidativas:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2S + HClO → K2SO4 + HCl.
La reacción de la piel muestra un agente oxidante.
§ 40. Comprensión sobre la salida de un producto de reacción química
Chemіchnі rіvnyannya, skladі z urakhuvannymi mіchіchnі vіlkії masi rіchіvіn, allow razrahunki, zokrema count masu, chіmіchnu kіlkіst kіlkіst en el producto de reacción. En la práctica, muchas reacciones se invierten, parte del discurso se utiliza como resultado de la evaporación, separación o adopción de subproductos. A ese producto, la reacción debería ser menor, menor, sería menos probable que suceda hasta que la reacción sea uniforme. De esta forma, si teóricamente se acepta como libre de riesgo para la reacción igual de la masa, o la cantidad química del producto es del 100%, entonces en el proceso real la salida del producto será inferior al 100%.
Se indica en el producto de la reacción con la letra del alfabeto griego (tsya) y aparece en partes del único chi vіdsotkah.
Exceso de reacción química al producto: el valor que se suma a la cantidad de peso (volumen, cantidad química) realmente eliminado del producto al peso (obsyagu, cantidad química) del producto, calculado para la misma reacción:
En todas estas variaciones, encontrará el mismo valor para la salida del producto de la reacción química. Por ejemplo, como es habitual, para la reacción de oxidación de óxido de azufre (IV) a óxido de azufre (VI)
2SO2 + O2 2SO3
se convirtió en 80% (o 0,8), esto significa que con óxido de azufre (IV) peso 64 g (volumen 22,4 dm3, cantidad química 1 mol) volumen 22,4 dm3, cantidad química 1 mol) y masa 80 g ∙ 0,8 = 64 g (volumen 17,9 dm3, cantidad química
A partir de la magnitud de la producción de los bienes en el proceso real de producción, apresure a vysnovok sobre povnotі perevorennya syrovini, vitratah energії, nebhіdnіst introducción de operaciones adicionales y en.
Echemos un vistazo a algunos ejemplos de rozrahunkiv del concepto de "fuera del producto de la reacción".
trasero 1 Como resultado del escaldado de sirka con una masa de 48 g, se extrajo óxido de sirka(IV) con un volumen (n.a.) de 28,6 dm3. Determinar la caducidad del producto de reacción.
m(S) = 48g | 1. Cantidad significativamente química de sirka, |
||||
V práctica (SO2) = 28,6 dm3 | reaccionó: | ||||
Sra) | |||||
(SO2)=? | n(S) | ||||
SRA) | 32 g/mol |
||||
2. Reacción comparativamente igual con óxido de azufre (IV): S + O2 = SO2.
3. Conocemos la cantidad teórica de óxido de azufre (IV):
1 mol de S - 1 mol de SO2;
1,5 mol S-1,5 mol SO2.
Comprender el producto de una reacción química. |
4. Conocemos el valor teórico del óxido de azufre (IV):
V teor (SO2) \u003d n teor (SO2) V m \u003d 1,5 mol 22,4 mol / dm3 \u003d 33,6 dm3.
5. Razrahuymo del producto de reacción:
Vidpovіd: vyhіd a la reacción del fármaco en un 85%.
Ejemplo 2. Elegir la masa de pirita FeS2, que es necesaria para la vipalidad a fin de tomar el óxido (IV) con un volumen (n.a.) de 8,96 dm3, de modo que la salida del producto de reacción sea del 90%.
V(SO2) = 8,96 dm3 | 1. Valor teórico significativo del óxido de azufre (IV): |
|||||||||||
(SO2) = 90% | muy práctico | muy práctico | ||||||||||
m (FeS2) =? | Teoría de las estrellas V = | |||||||||||
V teoría | ||||||||||||
Vteoría (SO2) = | V práctico (SO 2) | 8,96 dm3 | 9,56 dm3. |
||||||||||
2. Conocemos la cantidad química teórica de óxido de azufre (IV): |
||||||||||||
n teor(SO 2) | V teor(SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Comparativamente igual a la reacción del óxido de azufre (IV) y la cantidad química de pirita, que es necesaria para vipal:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Significativamente masu pirita, que es necesaria para dar vipal: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Indicación: para la posesión de óxido de azufre (IV), se requiere pirita con una masa de 24 g.

Exceso de reacción química al producto: el valor que aumenta la cantidad de peso (obsyagu, cantidad química) realmente eliminada del producto a la masa (obsyagu, cantidad química) del producto, calculada para la misma reacción. Aparece en partes de uno y algunas centenas.
consulta y tarea
1. ¿Por qué el resultado práctico del producto de la reacción debería sonar menos, teóricamente menos que el costo de la reacción igual?
2. En la reacción de sirka con un cálculo químico acuoso de 1 mol, sirkovodny se disolvió con un cálculo químico de 0,85 mol. Determinar la caducidad del producto de reacción.
3. Como resultado, la interacción de cloruro de bario con una masa de 200 g de ácido sulfúrico se precipitó con sulfato de bario con una masa de 100 g.
4. Determinar el volumen (n.a.) de aquella cantidad química de óxido de azufre(IV), que habiendo sido disuelta al quemarse el azufre, con un peso de 64 g, significa que el producto de la reacción es un 75% más saludable.
5. Calcule la masa de sirka quemada, y omita el óxido de sirka (IV), volumen (n.a.) 89,6 dm3 3 para convertirse en el 80% de lo teóricamente posible.
6. Aparentemente, Scho exudaba al óxido de azufre (VI), que se eliminó durante la oxidación del óxido de azufre (IV),
más caro 85%. Determine la masa, el volumen (n.a.) y la cantidad química de óxido de azufre (IV) que, habiendo entrado en reacción, eliminó así el óxido de azufre (VI) en volumen (n.a.) 2,24 dm3.
7. Elija la fracción de masa de sal en la composición, que se elimina en el caso de la distribución de midi, con una masa de 3,2 g y ácido sulfúrico con una masa de 192 g, de modo que el rendimiento del producto de reacción sea del 85%. .
§ 41. Nitrógeno y fósforo
El nitrógeno N y el fósforo P se mezclan en el grupo VA del sistema periódico. Mish'yak As, antimonio Sb y bismuto Bi se pueden ver antes del grupo del sistema periódico. El nitrógeno y el fósforo no son metales, el mish'yak y el antimonio se convierten en metal, y el vismuth se encuentra en los metales.
Átomos de budova en esa etapa de oxidación.
Los átomos de los elementos del grupo VA tienen 5 electrones cada uno en el nivel de energía exterior, la configuración electrónica de su nivel de energía exterior ns 2 np 3 por ejemplo: nitrógeno - 2s 2 2p 3 fósforo - 3s 2 3p 3.
7N↓ | 15p↓ |
Gerente.
- ¿Por qué es el viklikana tal cambio? ¿En qué dominio del bicromato se basa la vida del sumishi de cromo para utensilios de mano?
- Vierta 5-6 gotas de dicromato de potasio y 3 gotas de ácido sulfúrico en un tubo de ensayo. Agregue 2 gotas de yoduro de potasio y diluya el tubo de ensayo con 10 gotas de agua. Transfiera con una pipeta a otro tubo de ensayo una parte y agregue una gota de almidón. ¿Qué ha cambiado para el almidón? ¿Por qué? Doblando el OVR y zvnyati por el método electrónico-iónico.
- Característica significativa del elemento 15 R. Dominancia de modificaciones alotrópicas al fósforo. Interacción de fósforo con discursos simples y plegables.
En productos farmacéuticos, el óxido de mercurio (II) es zastosovuetsya como un zasib antiséptico inferior para la preparación ungüentos para los ojos, yak poseen una solución diluida de hidróxido de sodio en una sal comercial de mercurio.Todas las operaciones se llevan a cabo en la oscuridad.
Gerente.
1. Escriba una reacción apropiada para el óxido de mercurio (II). Explique por qué es necesario realizar operaciones en la oscuridad.
3. Leyes básicas de la química.
Vikoristannya con zinc en medicina se basa en tarta de yoga, acción antiséptica. El sulfato de zinc al 0,25% es vicoroso para la preparación de gotas oftálmicas junto con el ácido bórico al 2%.
Gerente.
- Preparar una solución de sulfato de zinc al 0,25 % en un volumen de 100 ml (ρ = 1,02 g/ml).
- Crear una transformación
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Enlace covalente, cita, ya ves, el mecanismo de la iluminación, el poder. Valencia. Etapa de oxidación.
· El farmacéutico deberá controlar la viscosidad del preparado salino por el método de la permanganatometría.
Gerente.
1. Escribe una reacción similar y compara usando el método electrónico-iónico.
2. Calcular la cantidad de hidróxido de sodio al 0,5 % (ρ = 1,004 g/ml) necesaria para la reacción con una cantidad de cloruro (III) 0,1 M de 20 ml.
3. Ley periódica sistema periódico a la luz vchennya sobre la vida del átomo.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє pero vilno vіd domіshok sulfіdіv midi, vugіllya, silicic acid, mish'yaku.
Gerente.
1. Solicite una forma de asegurar la entrada a la casa. Obguruntuvati vіdpovіd.
3. El principal tipo de enlace químico. La naturaleza hará una conexión química.
· Para el organismo de permanganato є otrostami, їkh zneshkodzhennya gastar z vokoristannyam solución acuosa al 3% de ácido ocular acidificado H 2 Pro 2.
Gerente.
1. Escribe una respuesta similar. Investigue la reacción por el método del ion-electrón
- Oksidi, nombramiento, clasificación, nomenclatura, autoridad y métodos de posesión.
· El análisis del habla en la preparación de saliva se realiza por el método de la permanganatometría, basado en la capacidad del Fe2+ de oxidarse a Fe3+. La parte inferior del aire inhalado se separa del ácido sulfúrico durante el calentamiento y después del enfriamiento, se titula con 0,1 N de permanganato de potasio.
Gerente.
1. Escribe las reacciones iguales, que son la base de la definición.
2. Preparar 200 ml de KMnO 4 0,1 N (el factor de equivalencia depende de la reacción).
3. Acidez, denominación, clasificación, nomenclatura, autoridad, formas de posesión.
· El fármaco nitrato de la farmacopea se eliminó por el siguiente rango: la aleación de cobre y plata se separa del ácido nítrico, para purificar la eliminación de nitrato de las casas, se precipita con ácido clorhídrico. El sitio, que es viishov, se restaura con zinc en el medio agrio y se seca, zvilnene en las casas, se vuelve a rociar con ácido nítrico.
Gerente.
- Escriba las reacciones de rіvnyannya іdpovіdnyh.
- Vikonaty reacciona a las reacciones a Cl-, Br-, J anioni con una variedad de nitrato srіbla, que subyacen a la confirmación de la corrección de las preparaciones de cloruros, yoduros, bromuros de potasio.
- Justificar, nombrar, clasificar, nomenclatura, autoridad, formas de posesión.
9. Nitrato srіbla zastosovuєtsya zvnіshno en erozіyah, vyrazkah, gostroma conjuntivitis en viglyadі 2.5 y 10% suministro de agua.
Gerente.
- Preparar una solución de AgNO 3 al 2% con un volumen de 50 ml (ρ= 1,015 g/ml). ¿Qué tipo de mentes se necesitan para cuidar de este rozchin?
- Crear una transformación
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Sal, denominación, clasificación, nomenclatura, autoridad, modos de posesión.
· El farmacéutico debe realizar la identificación del fármaco de la farmacopea sulfato de bario.
Gerente.
1. ¿Cuál es el método de sulfato de bario en medicina? ¿Por qué se alea sulfato de bario con carbonato de sodio antes de las reacciones de identificación? Vidpovіd confirmado por reacciones iguales.
2. Reacciones de Viconati e identificación de sales BaSO4, CaSO4, Na2SO4.
3. Complejo spoluky, designación, budov para A. Werner, la naturaleza del enlace químico, clasificación, nomenclatura, disociación. Zastosuvannya complejo spoluk en medicina y análisis químico.
· Un farmacéutico, al trabajar con una concentración de amoníaco, haber permitido un daño grave en el equipo de seguridad - haber realizado el trabajo en el armario manchado sin aumentar la tracción.
Gerente.
- ¿Cuáles son las consecuencias que se pueden tener cuando se trabaja con concentración de amoníaco sin equipo de seguridad adicional? La ayuda médica de Yaku pershu es necesaria para aplicar en caso de vapores envenenados de amoníaco.
- Crear tal transformación.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Escriba la ecuación de reacciones para el aspecto molecular e iónico, y para OVR - busque por el método de balance de electrones.
- Cinética química. La velocidad de la reacción química. El impacto de varios factores en la velocidad de las reacciones químicas.
· Zі spoluk nitrógeno en medicina zastosovuyutsya amoníaco en agua, sal, amonio, óxido de dinitrógeno y nitrito de sodio.
Gerente.
- ¿Cuál es el método de dar victorioso al nitrógeno? Escribe las fórmulas de estos discursos y reacciones iguales que caracterizan a los principales poderes.
- Escriba la reacción igual de nitrato de sodio con permanganato de potasio en medio ácido. Investigue la reacción por el método de nap_reactions
- No reversibles y hombres lobo reacciones químicas. Celoso químico. Ley de masas para sistemas iguales. Equidad constante. El principio de Le Chatelier.
· El farmacéutico debe realizar la identificación de las sales de sulfato de sodio, cloruro de sodio, bicarbonato de sodio.
Gerente.
- Vikonaty reacciona a los iones SO 4 2-, Cl-, HCO 3-.
- Razrahuvati, skіlki gram_v cristalohidrato Na 2 SO 4 10H 2 O ¿es necesario que el farmacéutico prepare agua con una masa de 500 g, para tomar el 5% de Na 2 SO 4?
- Reacciones óxido-agua. Las principales disposiciones de la teoría electrónica de las reacciones promotoras de oxidación. Los oxidantes y guías más importantes. Reacciones de óxido-agua Zrivnyannya por el método de equilibrio electrónico y método iónico-electrónico.
La fuerza del potasio del ácido sulfúrico parece ser rica en drogas ajenas al cuerpo (xenobióticos) - preparaciones medicinales esos metabolitos con las soluciones de algunos pequeños discursos - conjugados, que se excretan fácilmente del cuerpo.
Gerente.
- Elimine la fuerza de potasio del ácido sulfúrico de una manera diferente, indirectamente en la tabla reactiva. Escriba las reacciones de rіvnyannya іdpovіdnyh.
- Sume las igualdades moleculares de las reacciones que se expresan por tales igualdades iónicas rápidas:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Sistemas de dispersión, designación, clasificación. Suspensiones, aerosoles, emulsiones. Selección de sistemas de dispersión gruesa en medicina y farmacia.
El farmacéutico necesita tomar ácido sulfúrico al 5%.
Gerente.
- ¿Cuál es el depósito de la propiedad oxidante del anión SO 4 2 en la concentración de ácido? Escriba la ecuación de reacciones que caracterizan el poder del ácido disuelto y concentrado.
- Preparar una solución de ácido sulfúrico al 5 % lavando 50 ml de ácido sulfúrico con una fracción de masa de H 2 SO 4 al 30 %.
- Koloidni razchini, clasificación, designación, cinética molecular ese poder óptico, otrimannya. La estabilidad de las columnas. Coagulación. Peptización. Micel de Budova. Diálisis.
· Sirka, que entra en el almacén de aminoácidos, se oxida en los organismos. En el caso del ácido sulfúrico endógeno, participa en las esporas exógenas - fenol, cresol e indol.
Gerente.
- Describir el poder del ácido sulfúrico y anular las reglas de trabajo con ácidos.
- Para disolver que volumen de ácido sulfúrico con una fracción de masa de H 2 SO 4 25% y un espesor de 1.18 g/ml se debe tomar para la neutralización con hidróxido de potasio, un volumen de 50 ml, con una fracción de masa de KOH 12% y un espesor de 1,1 g/ml
- La verdadera diferencia, designación, comprensión básica, esencia del proceso de diferenciación. Difusión. Ósmosis. tornillo de banco osmótico.
· En áreas industriales, donde hay mucha vugillya, a menudo se caen maderas ácidas.
Gerente.
- por que estas almacén de productos químicos dosch ácido cerca de las áreas tsikh? ¿Cómo haces el vino? Escribe reacciones iguales.
- Doble los iones moleculares y de corto plazo iguales a la hidrólisis de las sales en avance:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
La circunnavegación se asienta en la naturaleza en grandes números para procesos bioquímicos rahunok y venganza en aguas minerales pro sirchanih.
Gerente.
- El poder del día.
- Crear una transformación:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Escriba la ecuación de reacciones para el aspecto molecular e iónico.
- Disociación de ácidos, bases, sales, agua. Ácido-base igual en rozchinah. Agua dobutok iónica, determinante del pH.
· Preparación medicinal oficial de una sirka є sirka, forrada con (Sulphur praecipitafum).
Gerente.
- Describir el poder del sirka libre y las modificaciones alotrópicas del sirka.
- Crear una transformación:
Reacciones de Zrivnyati por el método del balance electrónico.
- Hidrólisis. La esencia del proceso de hidrólisis. Hidrólisis de diferentes tipos de sales. Hidrólisis escalonada. Afluencia de varios factores en la etapa de hidrólisis.
· El farmacéutico realiza la reacción de identificación de solución de peróxido de agua al 3%: hasta 1 ml de la solución final, agregar 1 ml de ácido sulfúrico diluido, 1 ml de éter y 0,5 ml de dicromato de potasio, como resultado, la bola de el éter se vuelve de color azul en presencia de ácido 6
Gerente.
- La reacción de Vikonaty identifica el peróxido de vodny.
- Escriba una identificación igual de peróxido de agua y balance por el método de balance electrónico.
- La característica característica de los elementos del subgrupo de cabeza del grupo VII y de su mitad. Médico importancia biológica halógenos.
· Kisen es una preparación farmacéutica y descripciones en el GF. Yogo zastosovuyut por inhalación para varios tipos de inanición ácida.
20. Gerente.
- Escriba las reacciones iguales de las casas reveladas CO, 2, NO, NO2.
- Escriba las reacciones iguales, que son la base del método de laboratorio para eliminar el ácido. Inducción de la reacción por el método del balance de electrones
- Cloro, agua clorada, ácido clorhídrico, cloruro. Poder físico y químico del cloro y yogo spoluk. Significado médico-biológico de los halógenos.
· Un farmacéutico revisa la validez de los medicamentos a base de cloruro de sodio, bromuro de sodio y yoduro de sodio.
Gerente.
- Para tales fines, las sales víricas se utilizan en farmacia y medicina.
- Vikonaty akіsnі reacciones a anioni Cl-, Br-, J-.
- Poder físico y químico del cloro agrio. Otrimannya. Zastosuvannya.
· Uno de los métodos industriales de extracción de yodo con fines farmacéuticos es el proceso de obtención de yodo a partir de aguas de perforación. El yoduro, que se encuentra cerca de las aguas de perforación, se oxida según el esquema:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. gerente.
- Cómo preparar yodo y cómo se usa en medicina.
- Investigar la reacción que subyace a la obsesión por el yodo por el método de reacción.
- Una característica crítica de los calcógenos. Poder agrio y yogo a medias. Significado médico-biológico de la acidez.
· El farmacéutico determina la corrección de las preparaciones de cloruros de sodio, potasio y calcio.
Gerente.
- Para tales fines, los vicoristas se utilizan en preparaciones farmacéuticas.
- Reacciones de Vikonati _identificación de estas sales.
- Medio agrio con agua. Poderes físicos y químicos del agua. Peróxido de agua, dominancia, congestión en medicina. Importancia del agua en la vida de los organismos.
· Zі spoluk halogenіv z sour menos hipoclorito para volverse de interés para la medicina como desinfectante.
Gerente.
- ¿Sobre qué poder de hipocloritos se fundamenta la jornada de desinfección? Escriba las reacciones de rіvnyannya іdpovіdnyh.
- Razrahuvati, se debe tomar un baño de cloro skіlki gramіv para otrimannya 2 litros de cloro activo.
- Sirka y її desde el suelo. Alotropía de la sirka libre. Poder físico y químico de sirka, sirkovodnya, ácido sirkovodnya y sales її.
· En caso de acidez insuficiente del jugo de cáscara, se prescribe ácido clorhídrico diluido internamente.
Gerente.
- Enumere las reglas generales para trabajar con ácidos.
- Razrahuvat, skіlki ml de 36,5%: una variedad (ρ = 1,19 g / ml) de ácido clorhídrico y es necesario tomar para la preparación de 100 ml. 8,2% - oh (ρ=1,040 g/ml) de ácido.
- Potencia física y química de los óxidos de azufre, ácido sulfúrico, ácido sulfúrico. Sulfito. Sulfati. Poder, obsesión, zastosuvannya.
· En farmacia, uno de los tamaños estándar es el acetato de potasio al 33%, que es una forma de distribuir el carbonato de potasio en ácido óctico al 30%.
Gerente.
1. Escriba la ecuación de la reacción para el aspecto molecular e iónico.
- Característica significativa de los elementos del subgrupo cabeza del grupo V. La dominancia del nitrógeno libre. El valor del nitrógeno en la vida de los organismos.
· Prescripciones de discursos, que son bases fuertes y ácidos débiles. Para la aplicación de GFH como estabilizador, se añaden 0,1 n de solución de hidróxido de sodio a 4 ml por 1 litro de producto.
Gerente.
- Escriba la ecuación para la reacción de hidrólisis de la sal CH3COONa.
- Razrahuvat, skilki gramos de NaOH es necesario llamar para tomar 500ml 0.1n tamaño. Prepare todos los diseños para la última tecnología de seguridad.
- amoníaco. Sal de amonio. energía. Zastosuvannya en medicina y farmacia.
· Un farmacéutico prepara un ungüento para una receta: se mezclan 1 g de carbonato de potasio y 0,5 g de tetraborato de sodio en 70 ml de agua destilada, se alean 10 g de estearina con 15 g de aceite de vaselina y se agregan con un chorro fino cuando se mezclan con agua tibia hasta carbonatar. .
Gerente.
- ¿Qué tipo de discursos se resuelven a raíz de los cuales zmishuvannya? Al igual que el medio se resuelve y por qué? Vidpovіd confirmado por reacciones iguales.
- Elaboración de vag tecno-químicos para robots. Tome 1 g de carbonato de potasio en sitios tecnoquímicos.
- Óxido de nitrógeno. Ácido nitroso y sales її. Poder físico y químico. Significado médico-biológico del nitrógeno
· Es necesario que un farmacéutico prepare permanganato de potasio al 0,05% en un volumen de 200 ml para enjuagar la boca y la garganta vacías.
Gerente.
- ¿Con qué autoridad está arraigado el permanganato de potasio en yogo likuvalna diya? Yakі spoluky manganeso zastosovuetsya en propósitos jubilosos?
- Hay que añadir gramos escalares de KMnO 4 para pedir 200 ml de KMnO 4 al 0,05% (ρ= 0,9994 g/ml). Demostrar la técnica de preparación de este diseño.
- Budov moléculas de ácido nítrico. Poder físico y químico del ácido nítrico y sales її. Significado médico-biológico del nitrógeno y її spoluk.
· En productos farmacéuticos, el óxido de mercurio (II), que es virulento como zasib antiséptico, se desacopla del hidróxido de sodio en una sal comercial de mercurio (II).
Gerente.
1. Escriba una reacción apropiada para el óxido de mercurio (II). ¿Por qué las reacciones deben llevarse a cabo en los enanos?
3. Leyes básicas de la química.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 Cr O 6 + H 2 O
El ácido percrómico, que se disuelve con cioma, H 2 CrO 6 es el color azul. La contaminación con ácido azul confirma la eficacia de la preparación de H2O2.
Gerente.
- Reacción de Zrivnyati tsyu por un método electrónico-ionny.
- Yakі spoluky chromium muestra poder oxidativo, y yakі - vodnovlyuvalnі?
- El dominio de la fosfina, los óxidos de fósforo y los ácidos fosfóricos, su posesión. Importancia médico-biológica del fósforo
· Sumish óxido de magnesio (85%) y peróxido de magnesio (15%) - un fármaco conocido como "peróxido de magnesio", que zastosovuyut en trastornos de la mucosa intestinal.
Gerente.
- Explicar los medicamentos antiácidos y bactericidas. Vidpovіd confirmado por reacciones iguales.
- Razrahuvat, skilki gramos de MgO y MgO 2 que debe tomar para preparar 100 g de este medicamento. Llame a teres tecno-químicos 10 g de óxido de magnesio.
- La característica característica de los elementos del IV grupo del subgrupo principal. buda, Poder físico alótropos en carbón. Poder químico del carbón libre.
· Descomponga el bicarbonato de sodio (bebida gaseosa) en zastosovat a la vista del enjuague, enjuague con dolencias inflamatorias de los ojos, membranas mucosas del tracto respiratorio superior.
Gerente.
- ¿En qué poder del bicarbonato de sodio se basa en la acción antiséptica? Vidpovіd confirmado por reacciones iguales. ¿Se puede vicorate como antiséptico zasib tetraborato de sodio Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Preparar NaHCO 3 al 5 % en un volumen de 50 ml (= 1,036 g/ml).
- Moléculas de budov, poderes físicos y químicos de lo agrio del carbón. Importancia médico-biológica del carbono y el yoga.
В· Preparados antiácidos, que se vengan del bicarbonato de sodio, vicario en caso de diversas enfermedades, que van acompañadas de un aumento de la acidez, tobto. acidosis.
Gerente.
- ¿Con qué potencia de sal funcionan los preparados antiácidos? Vidpovіd confirmado por reacciones iguales. ¿Se pueden utilizar otros discursos para estos fines?
- Crear una transformación:
NaOH→NaHCO3→Na2CO3→NaCl→NaNO3
Escriba la ecuación de reacciones para el aspecto molecular e iónico.
Reacciones de Viconati Na 2 CO 3 →NaCl→NaNO 3.
- Silicio y yogo mitad, conocimiento de la naturaleza, otrimannya, poder físico y químico. Significado médico-biológico del silicio.
· La solución de NaCl al 2,5% se administra internamente para enjuagar el desagüe cuando el AgNO 3 está contaminado.
Gerente.
1. ¿En qué se basa el NaCl? Vidpovіd confirmado por reacciones iguales.
3. La característica principal de los elementos del subgrupo principal del grupo III. Potente bosque y yogo spoluk. Importancia médico-biológica en medicina.
· Para el desarrollo de formas medicinales raras, reconocidas para inyección, variedades isotónicas vicarias.
Gerente.
1. ¿Qué es una variedad isotónica? ¿Por qué el yoga se llama isotónico?
3. Aluminio y yoga desde el suelo, dominio, otrimannya. Importancia médica y biológica del aluminio.
· Solución acuosa al 3% de peróxido de agua zastosovuyut como un zasib bactericida eficaz.
Gerente.
1. ¿Cuál es la base del agua bactericida y peróxido espinal en sangre? ¿Qué entradas extrañas es necesario recortar cuando se trabaja con perhidrol?
2. Razrahuvati, skilki ml. perhidrol (solución acuosa al 30% de H 2 Pro 2, ρ = 1,1 g / ml) debe tomarse para tomar 500 ml de una solución al 3% (ρ = 1,005 g / ml). Para preparar tsey rozchin z dotrimannym tekhnіki bezpeka.
3. Metales del subgrupo de cabeza del grupo II. Zagalna característica, otrimannya, poder físico y químico. Sales de calcio y magnesio. Dureza del agua. Usunennia zhorstkostі agua. Importancia médico-biológica de los elementos del subgrupo principal del grupo II.
· La industria farmacéutica moderna produce preparaciones medicinales según el campo agregado, el tipo de sistemas dispersos, el método de introducción en el cuerpo.
Gerente.
1. ¿Qué sistemas se llaman dispersos?
¿Cómo se clasifican los sistemas dispersos?
¿Parece que los sistemas dispersos dispensan preparados medicinales? Proporcione ejemplos específicos.
- Retire el hidrosol de colofonia reemplazando el minorista.
- La característica característica de charco de metales, obsesión, poder físico y químico. Las partes más importantes de los metales lunares. Importancia médico-biológica de los charcos de metales
· A la vista de las diferencias de agua en varios discursos, zastosovuyutsya rіdkі formas medicinales, que pueden ser mutuamente mutuos.
Gerente.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. ¿Qué tipo de empleados pueden apoderarse de los discursos?
- Preparar 5% de CuSO 4 con un volumen de 100 ml (ρ = 1.051 g/ml) con vitriolo azul CuSO 4 ∙ 5H 2 O
- La característica característica de d - elementos. Metales de subgrupos laterales del 1er grupo y spoluk. Importancia médica y biológica.
· En Rusia, hay un electroprocesamiento de jugo y hierba fresca baja en jugo y sirovina silvestre: bayas, frutas, tubérculos de vegetales, varios órganos de criaturas con el método de ver jugos (mezclados internamente) en una apariencia nativa. El espacio interior es una columna de blancos, ácidos nucleicos, carbohidratos, taninos
Gerente.
1. ¿Qué tipo de diferencias se llaman patrones columnares? ¿Cómo se clasifican los malos olores? Enumerar las potencias de las columnas. ¿Qué proceso se encuentra en la base de ver los jugos de la sirovina cubierta de rocío?
2. Eliminar el hidróxido de hidrosol de solución salina (III) por hidrólisis de FeCl 3. Escribir el esquema del micelio.
- Metales de subgrupos secundarios del grupo II, características generales, budova, poder físico y químico. Importancia médica y biológica.
· Al preparar tabletas a base de extracto de raíz de valeriana, no se recomienda usar carbonato de magnesio vicoristato como refuerzo principal, ya que puede causar la neutralización del ácido izovaleriano y ruynuvannya valtrativ - rechovina, aún más sensible a la infusión de prados.
Gerente.
1. Explique la manifestación del poder del charco al carbonato de magnesio. Escriba la ecuación de la reacción para el aspecto molecular e iónico. ¿Qué recordatorios se pueden usar vicorist para la preparación de tabletas con extracto de valeriana?
2. Crea una transformación:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Escriba la ecuación de reacciones para el aspecto molecular e iónico.
3. Características generales de los elementos de los grupos VI, VII de los subgrupos laterales. Predominio de óxido líder de cromo, manganeso y sus partes. Importancia médica y biológica.
· El uso de gas viricoso de dióxido de carbono en la producción farmacéutica para la extracción de discursos biológicamente activos a partir de syrovin dewy medicinal.
Gerente.
- ¿En qué dominios del ácido carbónico se sustenta el yoga en estos fines?
- Crear una transformación:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Escriba las reacciones de intercambio iónico en forma molecular e iónica.
- La caracterización característica de los elementos del grupo VIII del subgrupo secundario. El dominio del salón y el yogo spoluk. Importancia médica y biológica.
Lista de comidas de examen de disciplinas
Conceptos básicos y leyes de la química. Tal ajuste a la vida del átomo.
Ley periódica y sistema periódico D.I. Mendeliev a la luz de la vida del átomo.
Cita, ver, comprender, iluminar, la naturaleza del enlace químico.
Cita, mecanismo de iluminación, poder del enlace covalente. Valencia. Etapa de oxidación.
Oksidi: nombramiento, clasificación, nomenclatura, poder y formas de posesión.
Ácidos: designación, clasificación, nomenclatura, poder y modos de posesión.
Sustancia: nombramiento, clasificación, nomenclatura, poder y formas de posesión.
Sales: designación, clasificación, nomenclatura, autoridad y formas de posesión.
Spoluky complejo: cita, budova después de Werner, tipi, nomenclatura.
La velocidad de la reacción química. Funcionarios, scho vplyvayut swidk_st reacción química.
Reacciones químicas irreversibles y reversibles. Celoso químico. El principio de M. Chatelier. Equidad constante.
Reacciones óxido-oxidantes: las más importantes, los conceptos principales, el día de oxidación y renovación, los agentes oxidantes más importantes y los líderes de la reacción.
Sistemas de dispersión: designación, clasificación. Sistemas gruesos: suspensiones, aerosoles, emulsiones.
Koloidni razchiny: vyznachennya, dominio, obsesión, budova mycel.
Diferencias verdaderas: designación, comprensión básica, esencia del proceso de diferenciación. Difusión. Ósmosis. tornillo de banco osmótico.
Las principales disposiciones de la teoría de la disociación eléctrica. El mecanismo de disociación eléctrica. Paso esa constante de disociación.
Disociación de ácidos, bases, sales. Disociación de la diferencia de pH.
La esencia de la hidrólisis. Hidrólisis de diferentes tipos de sales. Hidrólisis escalonada.
La caracterización característica de los elementos del subgrupo principal del grupo VII. Importancia médico-biológica de los halógenos
Cloro, agua clorada y ácido clorhídrico. Otrimanya, dominio. Cloruro.
Kisnevі spoluki cloro.
Una característica crítica de los calcógenos. Kisen ta yogo a mitad de camino. Significado médico-biológico de la acidez.
La dominancia es medio ácida con agua (agua, peróxido de agua). Zastosuvannya H 2 Pro 2 en medicina. Valor de plomo.
Sirka. Alotropía de la sirka libre. Química del poder del mundo. Circunnavegación. Ácido serkovodny y sales її.
Potencia física y química de los óxidos de azufre, ácidos sulfúrico y sulfúrico, sales de ácido sulfúrico, ácidos sulfúricos, su estancamiento.
El rasgo característico de los elementos del subgrupo principal del grupo V. Nitrógeno y energía.
El predominio del amoníaco y las sales de amonio. Zastosuvannya en medicina y farmacia.
Óxido de nitrógeno. Ácido nitroso y sales її. Poder físico y químico, stosuvannya.
Poder físico y químico del ácido nítrico. no gastes Significado médico-biológico del nitrógeno y її spoluk.
Características del elemento 15 R. Fósforo vil: alotropía, poder físico y químico, obsesión.
fosfina. Óxidos de fósforo y ácido fosfórico: poder, obsesión. Importancia médico-biológica del fósforo
La característica característica de los elementos del IV grupo del subgrupo principal. Vuglets: Budova y dominio físico, alotropía vugletsyu, dominio químico.
Kisnevі spoluky vugletsiu: moléculas de Budova, dominio físico y químico. Significado médico-biológico del carbón y el yoga spoluk.
Silicio y yogo mitad: conocimiento de la naturaleza, hombría, poder físico y químico. Significado médico-biológico del silicio.
El subgrupo principal del grupo ІІІ: la característica principal de los elementos. Boro y yoga desde un lado: otrimannya, poder físico y químico, zastosuvannya en medicina.
Fondos de aluminio y yoga: obsesión, poder físico y químico. Importancia médica y biológica del aluminio.
Metales del subgrupo de cabeza del 2º grupo: características carismáticas, obsesión, poder físico y químico. Sales de calcio y magnesio. Dureza del agua. Usunennia zhorstkostі agua. Importancia médico-biológica de los elementos del subgrupo principal del grupo II.
Luzhnі arrojó: característica caritativa, obsesión, dominio, el spoluchy más importante. Importancia médica y biológica.
La caracterización característica de los elementos d. Metales del subgrupo secundario del 1er grupo. Pojñannya midi, sribla. Importancia médica y biológica.
Metales de los subgrupos laterales del grupo II: una característica crítica de la vida, el poder físico y químico. Importancia médica y biológica.
Lado subgrupos VI, VII del grupo: la característica característica de los elementos del subgrupo, el predominio de cromo, manganeso y su mitad. Importancia médica y biológica.
Un subgrupo del grupo VIII: una característica general de los elementos del subgrupo, el poder del salón y el yogo spoluk. Importancia médica y biológica.
Asentamiento. En la mesa de piel frente a los estudiantes hay un plan de lección, un esquema para la interacción del ácido nítrico con metales, un conjunto de reactivos y pruebas para fijar el material retorcido.
óxido de nitrógeno
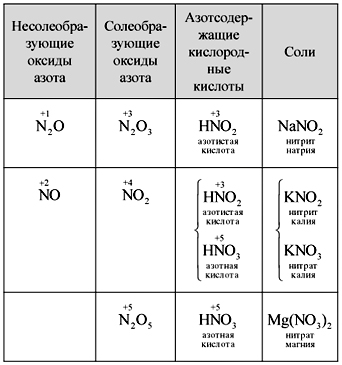
Profesor.Adivina y escribe la fórmula de los óxidos de nitrógeno. Yaki oksi se llama solución salina, yaki, ¿no salina? ¿Por qué?
Aprenda a escribir de forma independiente las fórmulas de cinco óxidos de nitrógeno, nómbrelos, determine la niebla de nitrógeno de los ácidos kisnevy y establezca la reactividad entre óxidos y ácidos. Uno de los estudiantes está escrito en dosh (tabla).
mesa
Fraguado de óxidos de nitrógeno, ácidos y sales
Certificado de demostración:
interacción del óxido de nitrógeno (IV) con el agua
Profesor. en el barco Nº 2 agregue un poco de agua y mezcle, luego intente quitar las manchas con tornasol.
¿Qué se custodia? Rozchin chervonіє a través de dos ácidos que se han asentado.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Paso de oxidación de nitrógeno Nº 2 buena suerte +4, entonces. es intermedio entre +3 y +5, yak en rozchini stiykish, que el óxido de nitrógeno (IV) recibe dos ácidos: nítrico nitroso.
Almacén que la molécula Budova
Profesor.Escriba la fórmula molecular del ácido nítrico en la pizarra, calcule el peso molecular y el grado de oxidación de los elementos. Doblar fórmulas estructurales y electrónicas.
Aprenda a crear tales fórmulas (Fig. 1).
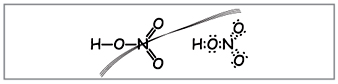
Profesor.Aparentemente, hasta estas fórmulas, diez electrones están envueltos alrededor del nitrógeno, pero no puedes usarlo porque. el nitrógeno se encuentra en otro período, y tanto como sea posible en la bola exterior, en la nueva, puede haber menos electrones que los más altos. Se establece esta superficialidad, por lo que supongamos que entre el átomo de nitrógeno y un átomo, se establece un enlace covalente detrás del mecanismo donador-aceptor.(Figura 2).
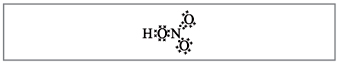
Mal. 2. Fórmula electrónica de ácido nítrico.
Los electrones del átomo de nitrógeno están marcados con puntos negros.
La misma fórmula estructural del ácido nítrico se puede representar de la siguiente manera(Fig. 3) :
Mal. 3. Fórmula estructural del ácido nítrico
(conexión donante-aceptor de indicaciones con una flecha)
Sin embargo, por el último camino se logró que el enlace subyacente se divida uniformemente entre dos átomos de acidez. El grado de oxidación a nitrógeno en ácido nítrico es +5, y la valencia (para dar respeto) es más de la mitad, más de la mitad de la apuesta electrónica alta.
Poder físico del ácido nítrico
Profesor.Antes tienes botellas de ácido nítrico diluido y concentrado. Describe los poderes físicos que puedes predecir.
Aprenda a describir el ácido nítrico como una fuente de importancia para el agua, color amarillento, con un olor acre. Ácido nítrico Roschin sin color e inodoro.
Profesor. Agregaré que el punto de ebullición del ácido nítrico es de +83 ° C, el punto de congelación es de -41 ° C, tobto. para las grandes mentes de la patria. Un olor fuerte y los que guardados no se queman, se explican porque el ácido es concentrado, es de baja resistencia y es ligero, o cuando se calienta, muchas veces se expande.
Poder químico del ácido.
Profesor. ¿Adivina qué tipo de discursos para interactuar con los ácidos?(Aprende a nombrar.)
Antes de reaccionar, intente enumerar las reacciones y anote sus advertencias (las reacciones deben escribirse a la luz de TED).
Y ahora somos salvajes con los poderes específicos del ácido nítrico.
Hemos expresado que el ácido, cuando se guarda, ahora es traído por la reacción química:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Estudio registrar de forma independiente el balance electrónico de la reacción.)
"Entierra el gas", que se ve(NO2) ácido farbuy.
Es especialmente necesario llevar a cabo el ácido llevándolo al metal. Sabes que solían eliminar el agua de varios ácidos, pero al interactuar con el ácido nítrico, este no se elimina.
Mire el diagrama en su escritorio, que muestra cómo se ven los gases en la reacción de ácidos de varias concentraciones con metales.(Robot con un diagrama.)
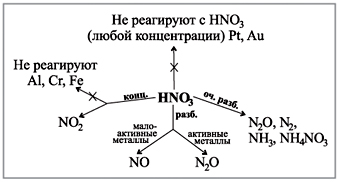
Certificado de demostración:
interacción del ácido nítrico concentrado con hidromiel
Aún más eficaz es la demostración de la reacción del ácido nítrico (conc.) con polvo midi o trozos de dardo de miel finamente cortados:
Aprenda a registrar de forma independiente el balance electrónico de la reacción:
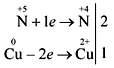
posesión de ácido
Profesor. La lección será incomprensible, como si no pudiéramos ver la posesión nutricional del ácido nítrico.
Método de laboratorio: diya ácido sulfúrico concentrado en nitrato (Fig. 5).
NaNO3+H2SO4=NaHSO4+HNO3.
En la industria el ácido se obtiene principalmente por el método del amoníaco.
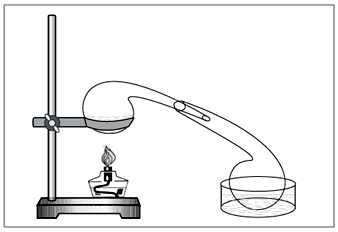
Mal. 5. Para la extracción de ácido nítrico en el laboratorio dos
cristalería química vieja golpeada manualmente - una réplica
El método de contener ácido con nitrógeno y ácido a una temperatura de más de 2000 ° C (arco eléctrico) no eliminó ninguna expansión especial.
En Rusia, la historia de la introducción del ácido nítrico está asociada con el nombre del químico y tecnólogo Ivan Ivanovich Andreev (1880-1919).
Vin y 1915 habiendo creado la primera planta para la reducción de ácido con amoníaco y la implementación del método de expansión a escala de fábrica en 1917. La primera fábrica de buv zbudovaniya cerca de Donetsk.
Este método incluye algunos pasos.
1) Preparación de sumish en polvo de amoníaco.
2) La oxidación del amoníaco vuelve a agriarse en una hoja de platino:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Oxidación adicional a óxido de nitrógeno (II) a óxido de nitrógeno (IV):
2NO + O2 = 2NO2.
4) Determinación de óxido de nitrógeno (IV) en ácido acuoso:
3NO2+H2O=2HNO3+NO.
Como se hace una distinción en presencia de ácido, todo el óxido nítrico (IV) se convierte en ácido nítrico.
5) El paso final en la eliminación del ácido nítrico es la purificación de gases, como la atmósfera, y los óxidos de nitrógeno. Almacenamiento de gases: hasta 98% nitrógeno, 2-5% ácido y 0,02-0,15% óxidos de nitrógeno. (El nitrógeno se usa en primer lugar, tomado para la oxidación del amoníaco). Si los óxidos de nitrógeno en estos gases son más del 0,02 %, entonces las actualizaciones catalíticas al nitrógeno se llevan a cabo a propósito, porque cantidades tan pequeñas de estos óxidos generan grandes problemas ambientales. .
Después de todo lo dicho, el post es nutricional: ¿necesitamos ácido ahora?
estancamiento de ácido
Profesor.El ácido nítrico de vicorist se usa para la fermentación: dobriv nítrico y nitrato de amino en la primera línea (¿cómo se obtiene?); discursos vibukhov (¿por qué?); barvnikov; nitrativ, sobre yakі timetsya en la próxima lección.
Adherido al material
Experiencia de clase frontal
– ¿Por qué la tasa de oxidación del nitrógeno en ácido nítrico es +5 y la valencia del chotiri?
- ¿Con qué metales no entra en reacción el ácido nítrico?
- Debe conocer el ácido clorhídrico y el ácido nítrico, hay tres metales sobre la mesa: cobre, aluminio y frío. ¿Cómo culpas y por qué?
Prueba
Opción 1
1. ¿Qué serie de números muestra la diferencia entre electrones para energías iguales en átomos de nitrógeno?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Terminar la ecualización de reacciones prácticas:
1) HNO3 (rozb.) + Cu…;
2) Zn + HNO3 (conc.)...;
3) HNO3 + MgCO3...;
4) CuO + KNO 3 ... .
3. Dime cómo ilustrar una de las etapas del proceso. producción industrialÁcido nítrico.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. El estado de oxidación negativo se manifiesta por nitrógeno en lo siguiente:
1) N2O; 2) NO; 3) NO2; 4) Na 3 N.
5. Interacciones de virutas de cobre con ácido nítrico concentrado para producir hasta apagar:
1) NO2; 2) NO; 3) Nº 2; 4) NH3.
opcion 2
1. El valor de la valencia más alta para el nitrógeno es uno:
1) 1; 2) 2; 3) 5; 4) 4.
2. Puede anotar la combinación de ácido nítrico concentrado con metales ofensivos: sodio, aluminio, zinc, hierro, cromo.
3. Elija el habla, como syrovina para la extracción de ácido nítrico:
1) nitrógeno y agua;
2) amoníaco, agua repetida;
3) gastar.
4. El ácido nítrico concentrado no reacciona con:
1) dióxido de carbono;
2) ácido clorhídrico;
3) carbón;
4) hidróxido de bario.
5. Con la interacción del ácido diluido con magnesio, se establece:
1) NO2; 2) NO; 3) N2O; 4) NH4NO3.
Vіdpovіdі en las pruebas Opción 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opcion 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Tririvny Zalik tocadiscos 11 clase
Tema: " NEMETAL"
Formulario de lección: salón
Tsil: revisar los conocimientos adquiridos por los alumnos sobre el tema: “Nemetals”; aprender acerca Alto Voltaje no metal que їх spoluk; continuar dando forma a las habilidades del conocimiento stosuvannya en situaciones no estándar y de la vida, en victorias de tareas individuales y diferenciadoras.
gerente:
1. Verificar el conocimiento y consolidar el conocimiento de los científicos sobre los no lanzadores de esa mitad; aceptar el desarrollo del pensamiento mental lógicamente y la libertad de la mina química; la transición de la adopción formal - lógica del material por aquellos a la idea figurativamente lógica con la ayuda de tareas diferentes, factibles y no estándar.
2. Desarrollar los hábitos de cautela, la manifestación de perdones, la apreciación del día, la vminnya para ver la obscenidad, reivindicar los hechos que están torcidos, expresar lógicamente los pensamientos y robiti de la visnovka; leer rozіrkovuvati, robiti decepcionado, predecir.
3. Adoptar el moldeado de las ideas principales que ven la luz a través de la actividad educativa y la creatividad de la autosuficiencia de los estudiantes.
4. Vikhovuvati vminnya pratsyuvati independientemente de zastosuvannyam auto-ese control mutuo. Muestra zv'yazok por aquellos que viven para la vida. Vihovuvati científico svetoglyad sobre la base de la autoridad y la vida vzaimozv'yazku.
Poseer ese reactivo: tubos de ensayo, lámparas de alcohol, tubos de ensayo, syrniki y otros tipos: ; ;
; ;
;
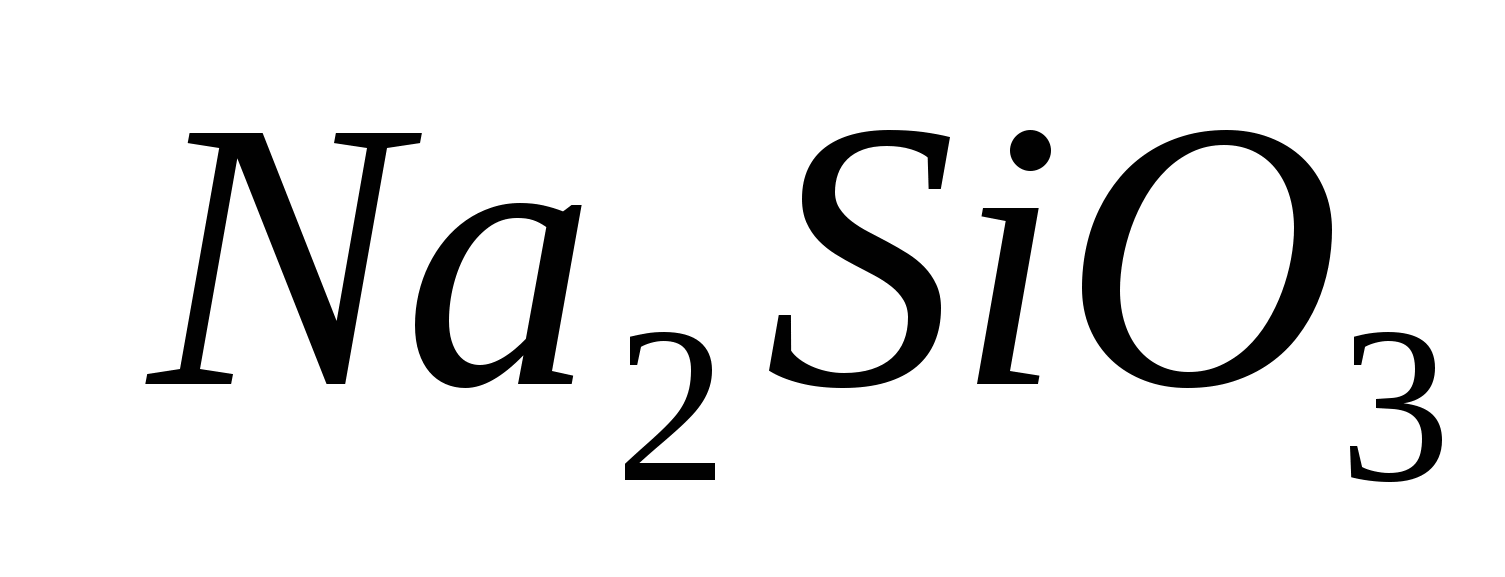 .
.
Preparando el salón.
El maestro prepara la tarea de tres pliegues iguales de las especies ofensivas: prueba, nutrición teórica, yakіsnі y rozrahunkovі zavdannya, zavdannya para la transformación de discursos.
El profesor prepara a los alumnos, cómo revisan la tarea.
Para los días 1 y 2 del mes, se publica una hoja de información en la oficina hasta la puerta.
La hoja de ruta es visible a la piel. La negrura del trabajo en las etapas se muestra en las hojas de ruta.
HOJA DE RUTA.
FI aprendiendo
nombrando el escenario
El número de etapas
Número de orden
Firma del revisor
El problema de Rosrakhun
Reconocimiento
Reencarnación
Lección escondida.
Aprenda a ingresar a la clase con hojas de ruta, 5 hojas en blanco, con un bolígrafo y vaya al escenario, designaciones para el No. 1. Aprenda a robar la tarea para igualar el plegado y dar fe de la nueva letra chi us, en la etapa de " reconocimiento de discursos” pasa el experimento.
En la etapa de la piel, se agregan 7 - 8 púas, se vuelven a verificar, se colocan en la hoja de ruta dividida, no.
La puntuación se establece como la media aritmética de todas las etapas.
ADICIÓN
"Reconocimiento de discursos"
1 roto
1. Trae la presencia del ion 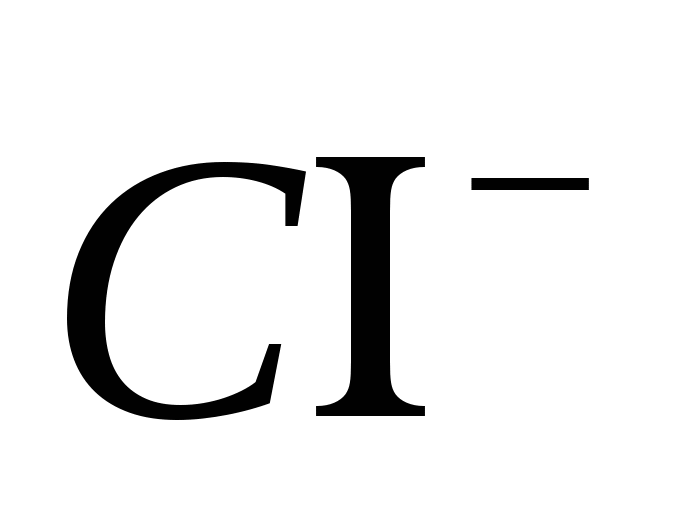
2. Traer la presencia del ion 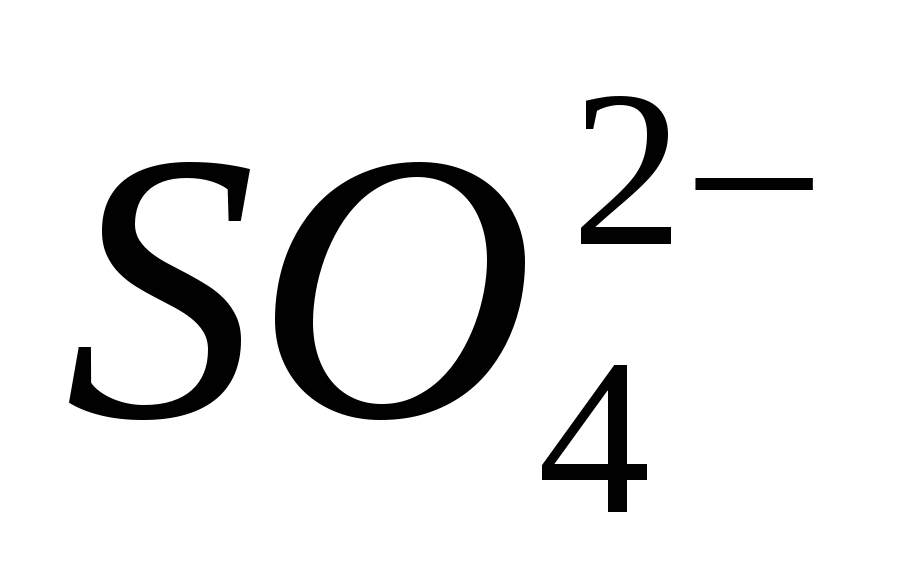
3. Trae la presencia del ion 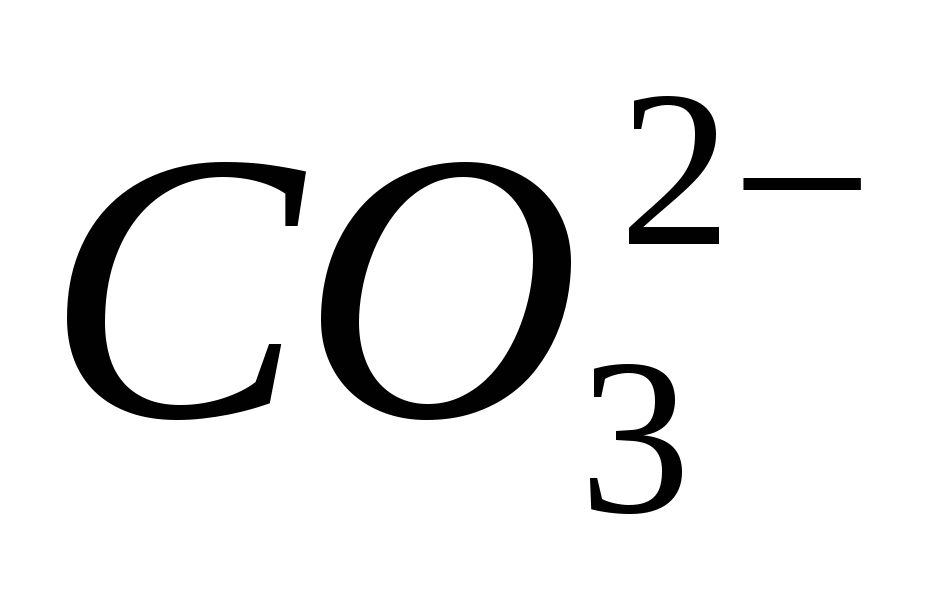
4. Trae la presencia del ion 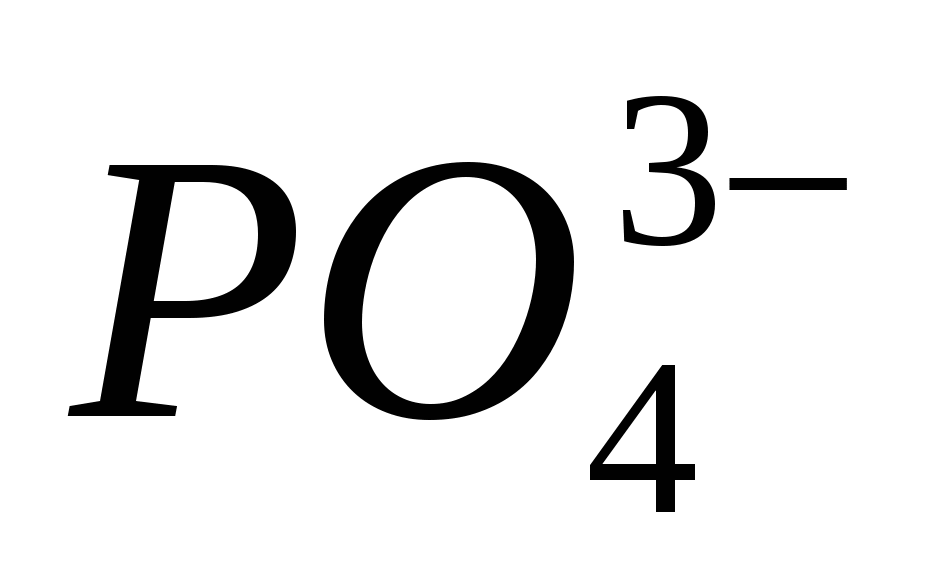
5. Trae la presencia del ion 
2 rotos
1. Reconocer la diferencia por la ayuda de un reactivo:
2. Reconocer la diferencia por la ayuda de un reactivo:
3. Reconocer la diferencia por la ayuda de un reactivo:
4. Reconocer la diferencia por la ayuda de un reactivo: 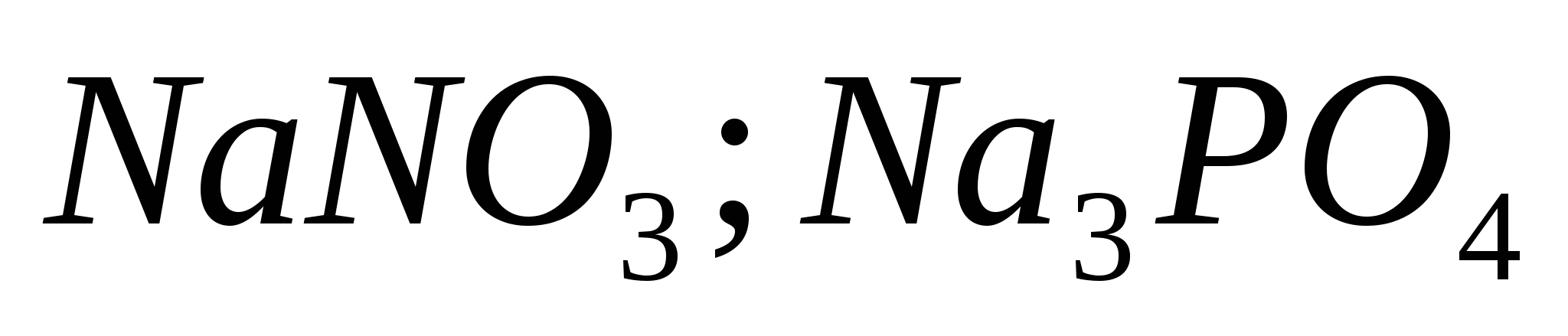 ;
;
5. Reconocer la diferencia por la ayuda de un reactivo:
3 rotos
1. Reconocimiento sin reactivos aditivos:
2. Reconocimiento sin reactivos aditivos:
3. Reconocimiento sin reactivos aditivos:
4. Reconocimiento sin reactivos aditivos:
5. Reconocimiento sin reactivos aditivos:
Etapa "Conversión de discursos"
1 roto
1. Detener la reacción
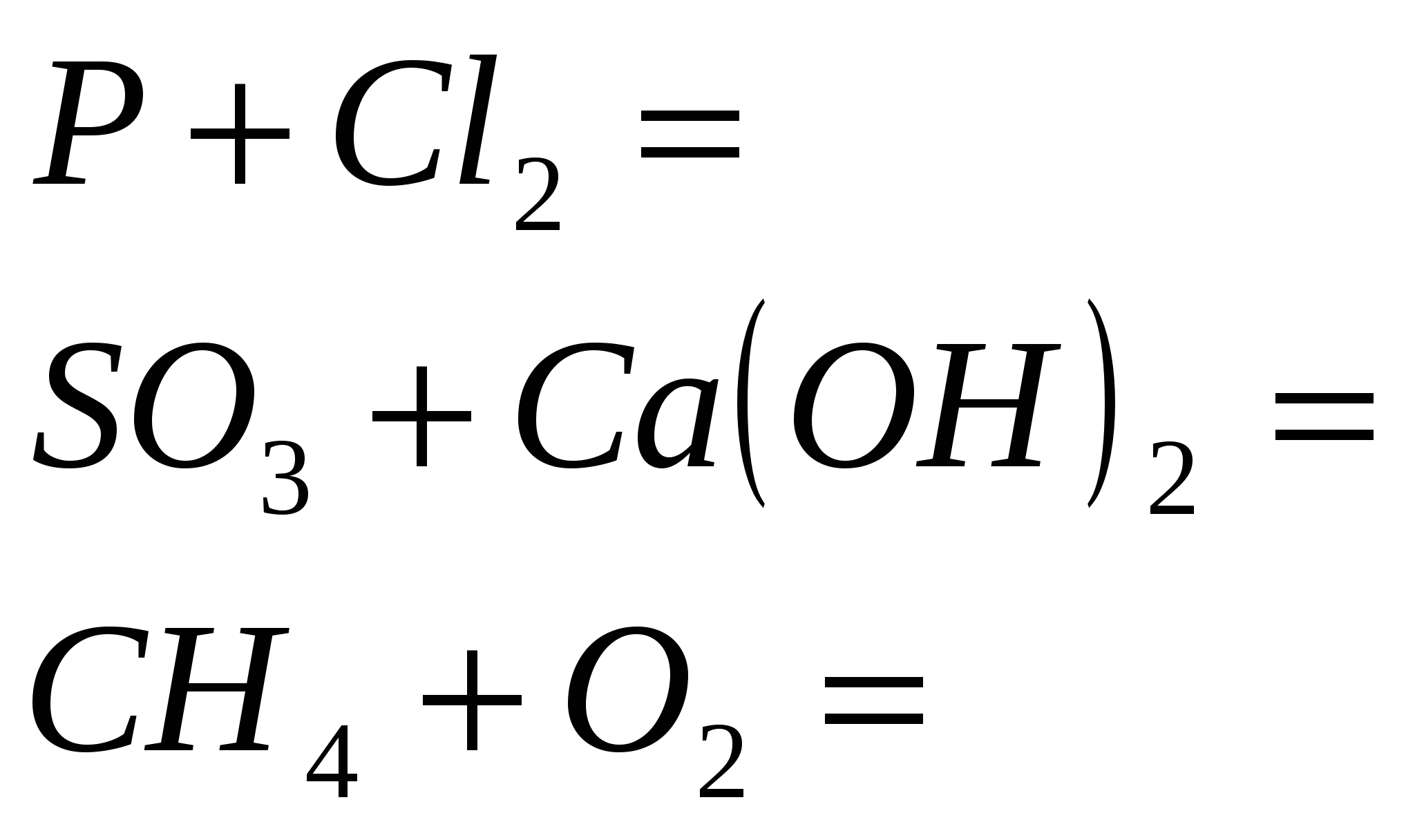
2. Terminar la reacción
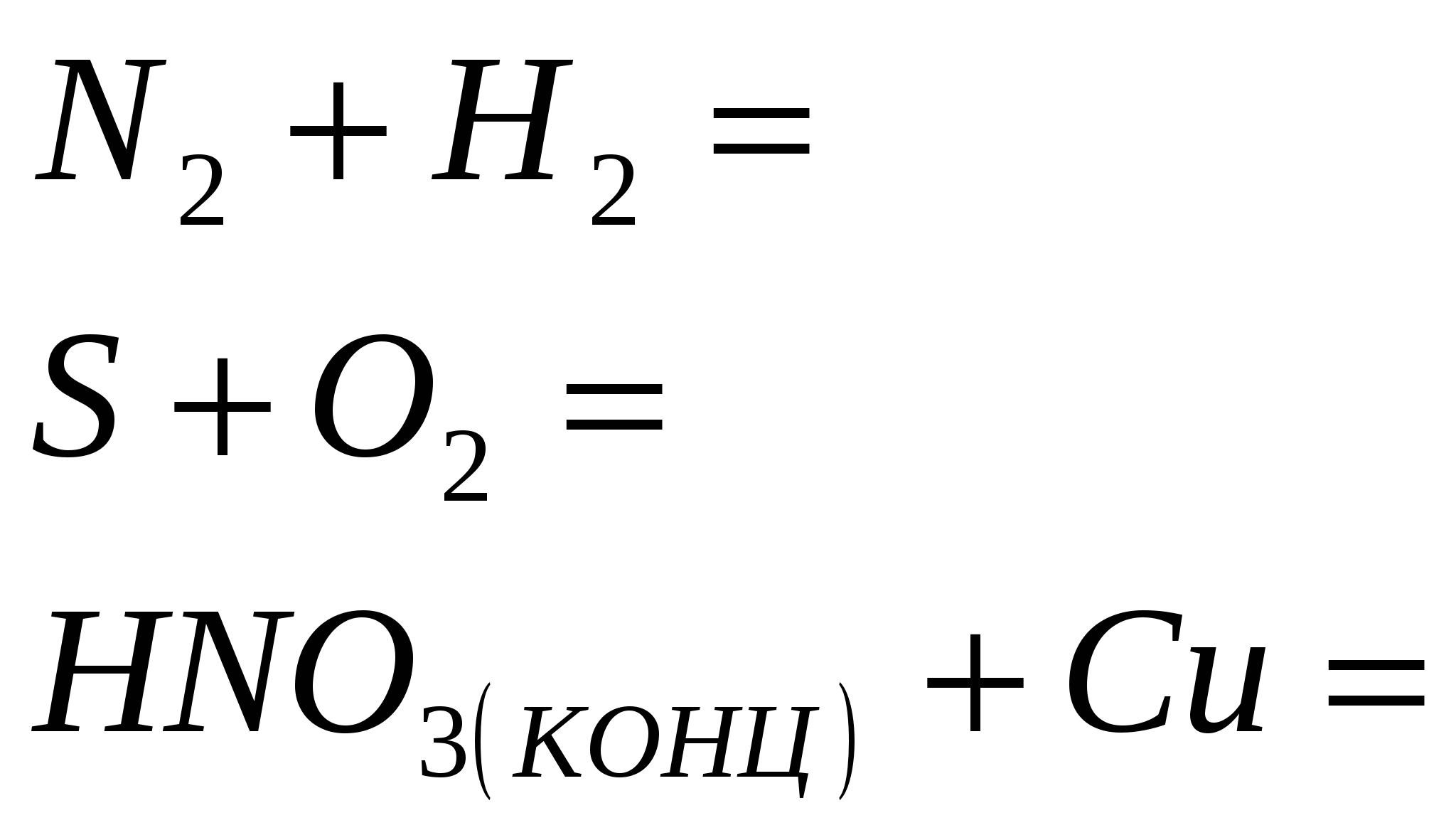
3. Termina la reacción
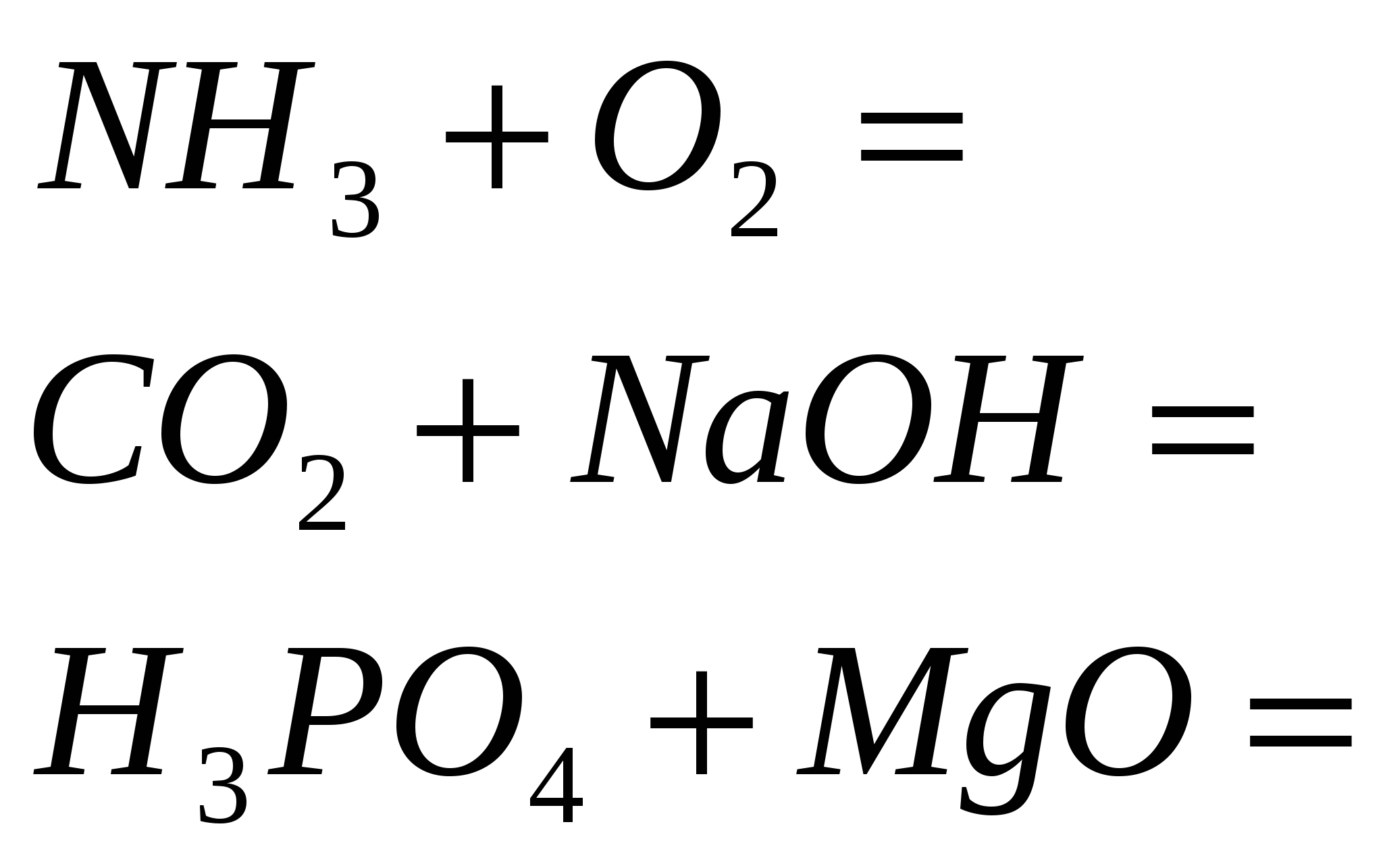
4. Termina la reacción
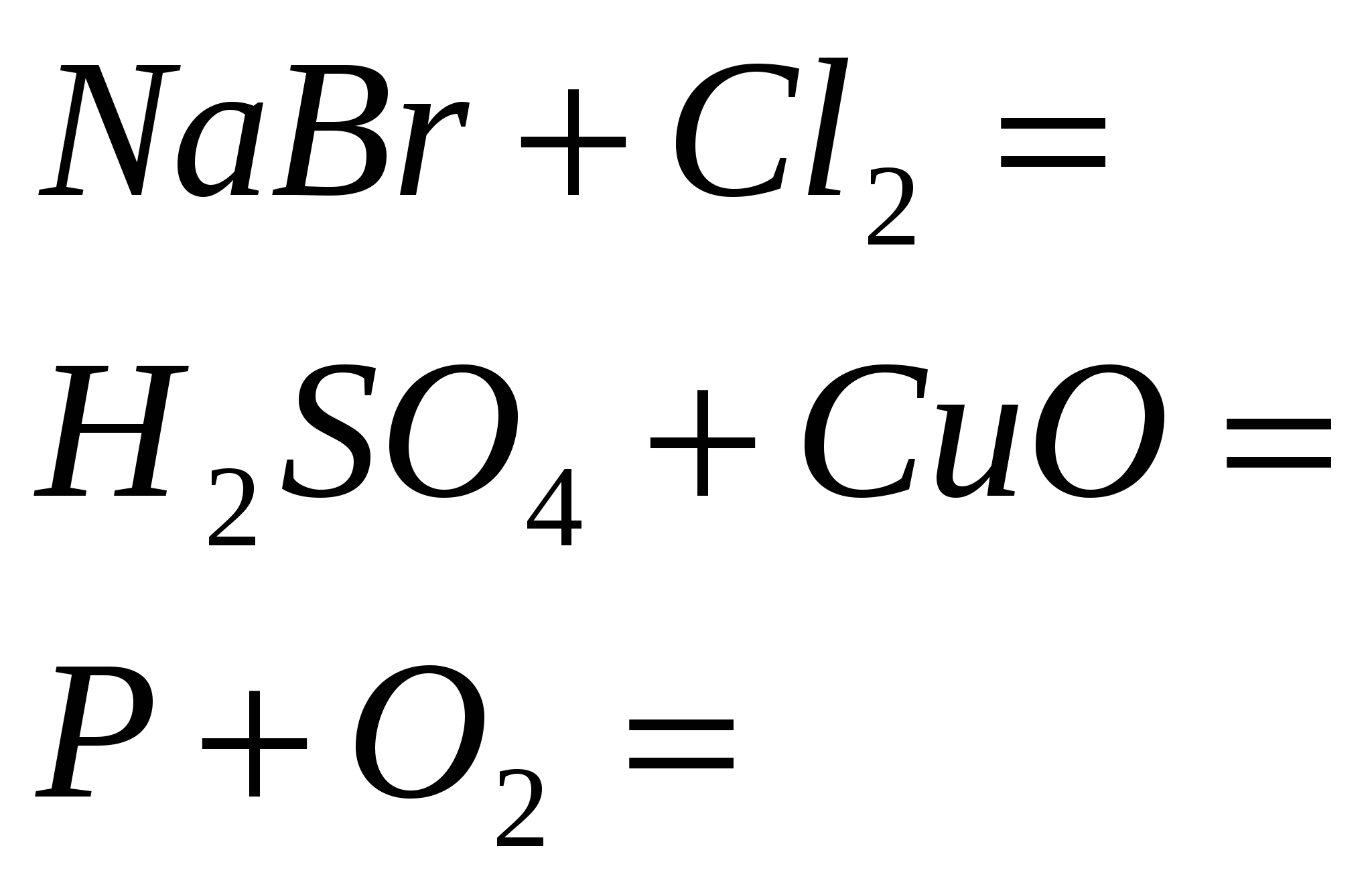
5. Termina la reacción
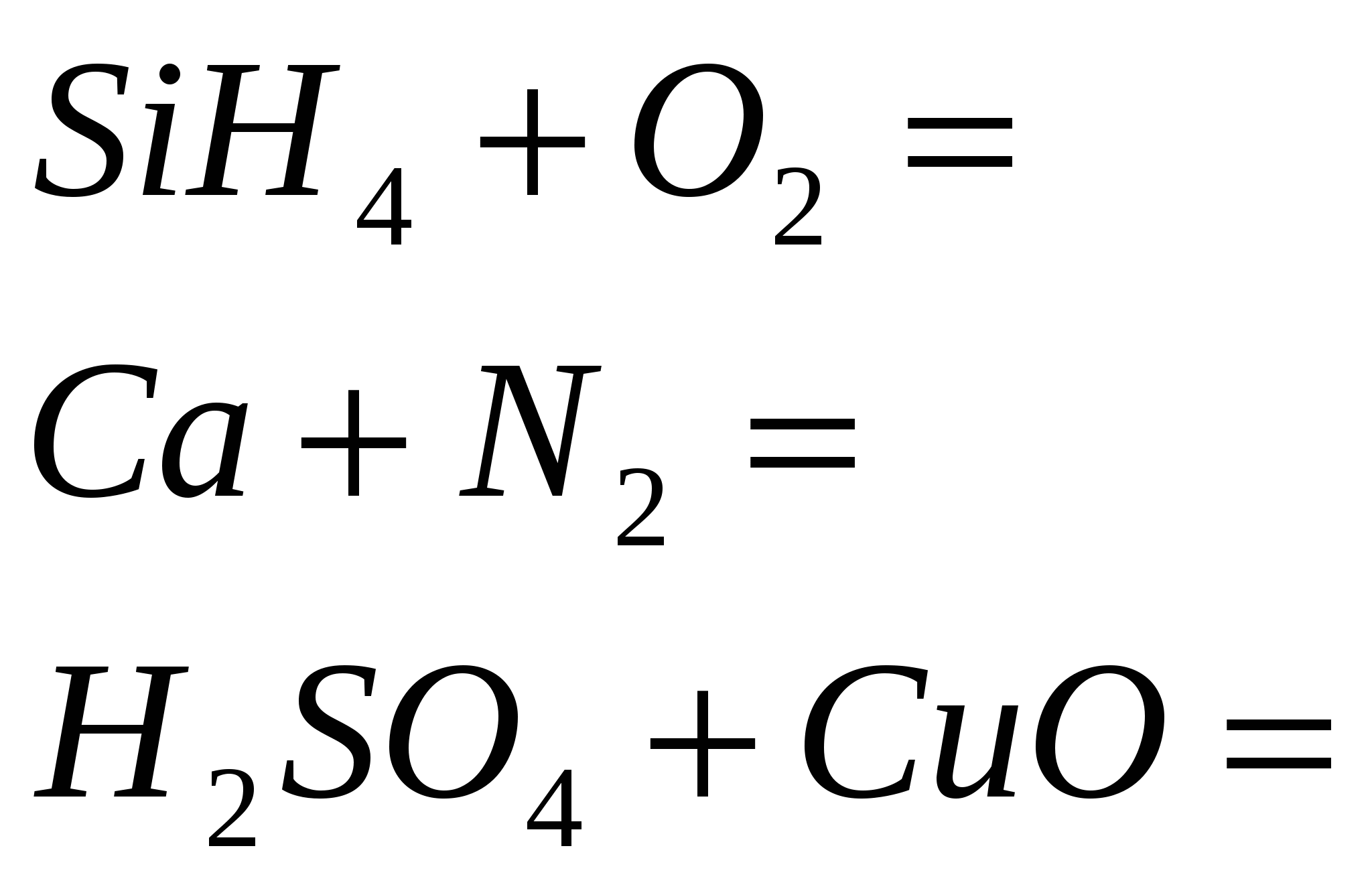
2 rotos
Crear una transformación:
3roto
Crear una transformación:
3.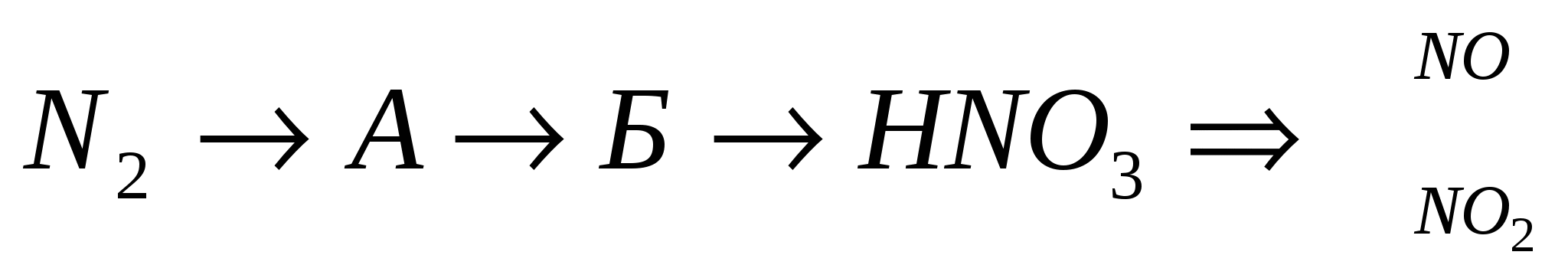
Etapa "Prueba"
Opción 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 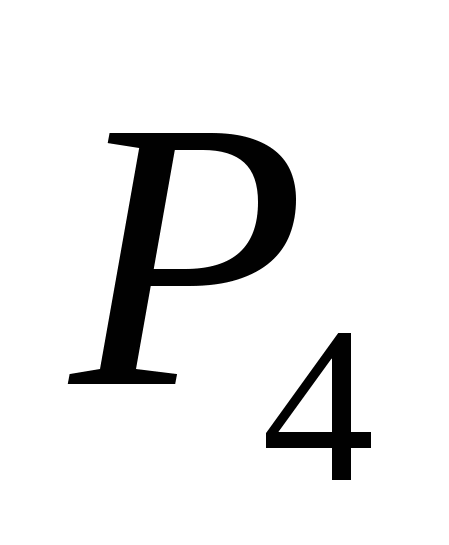 , b) C , c)
, b) C , c) 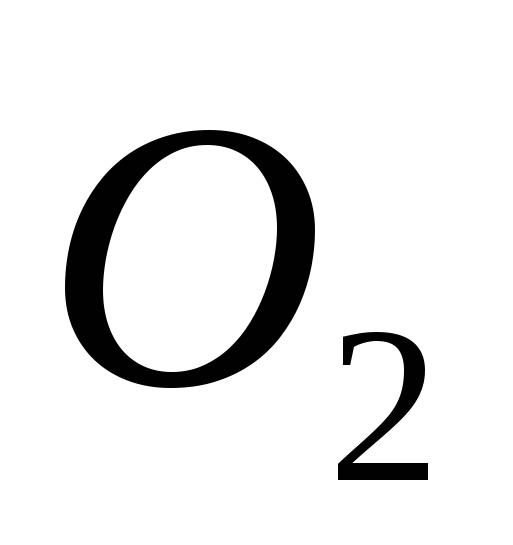 , g)
, g) 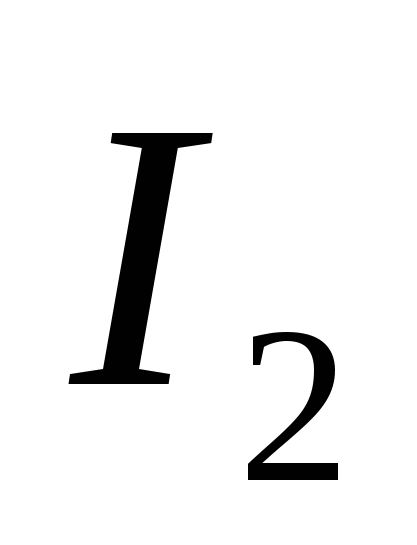 mi)
mi) 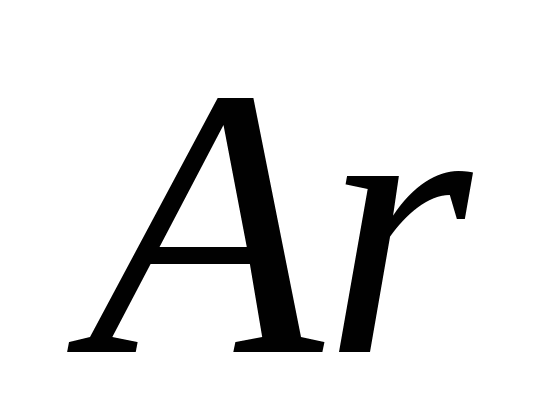 .
.
a)  , B)
, B) 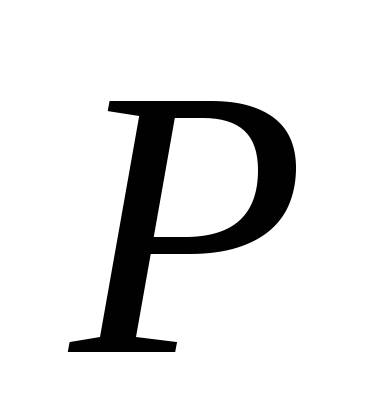 ,v)
,v)  , g)
, g)  mi)
mi)  .
.
4. Fórmula electrónica del elemento. Yogo volando vodnev spoluk:
a)  , B)
, B)  ,v)
,v)  , g)
, g)  .
.
5. La fuerza de los ácidos hidrohálicos crece en una fila:
a) ![]()
B) 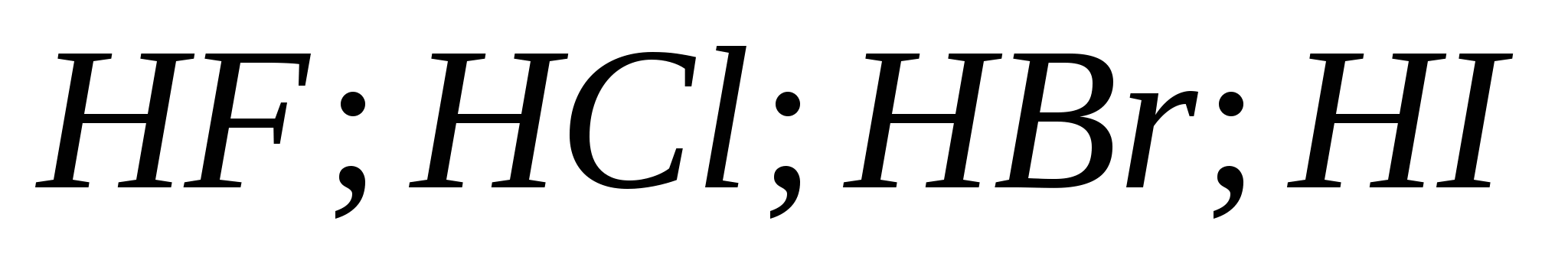
v) 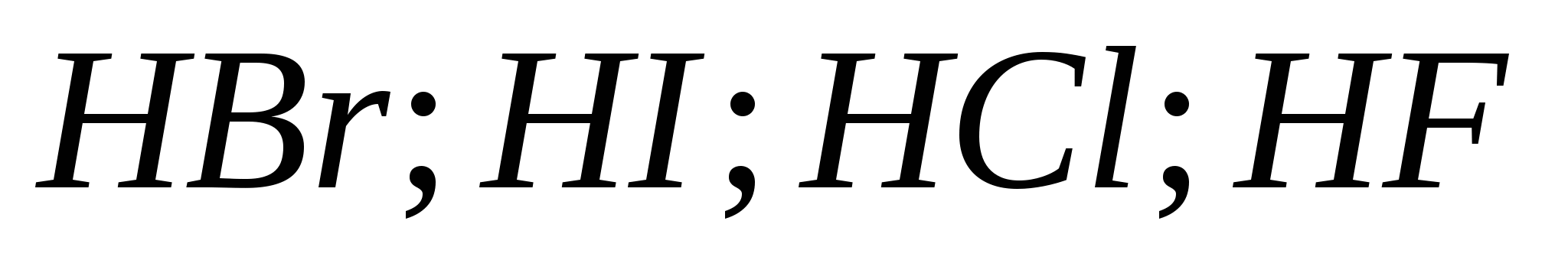
GRAMO) 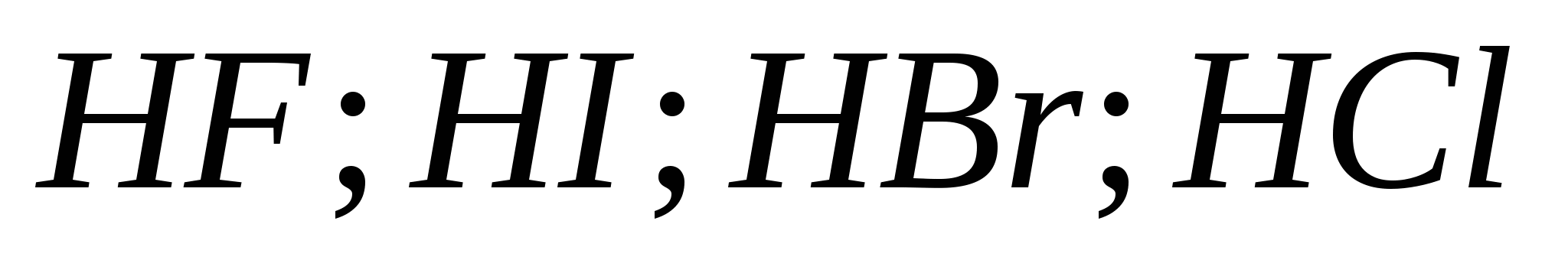
6. De los halógenos, el discurso fue bloqueado en los niños que luchan:
a) flúor; b) cloro; c) yodo; d) bromo.
7. El ácido sulfúrico roto muestra poder oxidante para la proporción de átomos:
a)  , B)
, B)  ,v)
,v)  .
.
8. El óxido de nitrógeno V se puede combinar:
a)  , B)
, B) 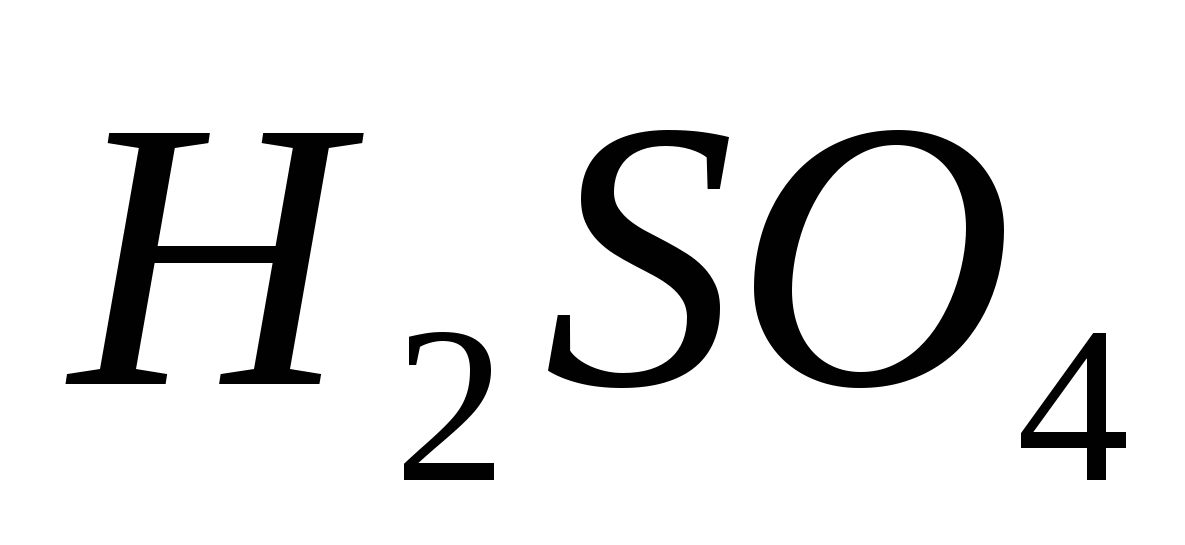 ,v)
,v)  , g)
, g) 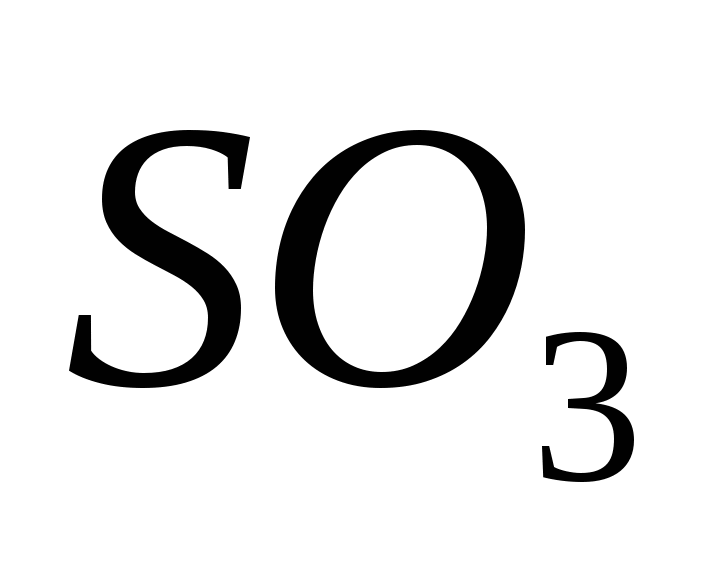 mi)
mi)  .
.
9. Reacción: llevar tal poder al amoníaco:
a) oxidante, b) redundante, c) ácido, d) básico.
10. La fuerza de los ácidos seguidos
a) cambiar, b) aumentar, c) aumentar gradualmente, luego cambiar; d) caen lentamente, luego crecen, e) no cambian.
opcion 2
Discursos sencillos gratuitos de cristal atómico, aprobados:
a)  , B)
, B)  ,v)
,v)  , g)
, g)  mi)
mi)  .
.
2. Gases para desagües normales є:
a)  , B)
, B) 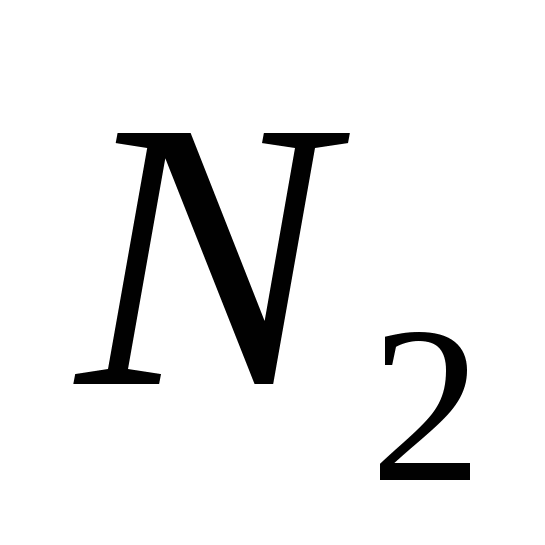 ,v)
,v) 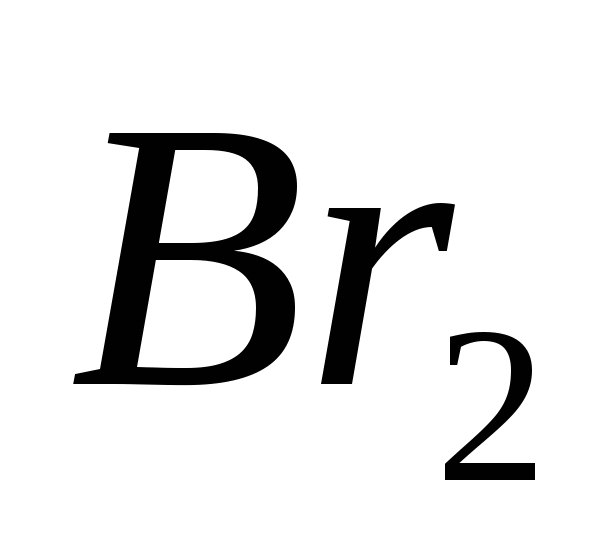 , g)
, g)  mi)
mi) 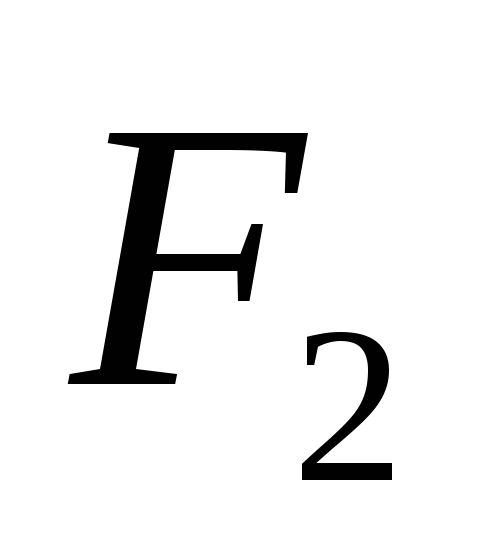 .
.
3. Las modificaciones alotrópicas componen los siguientes elementos:
a)  , B)
, B)  ,v)
,v)  , g)
, g)  mi)
mi)  ,
,
4. Fórmula electrónica del elemento. Yogo volando vodnev spoluk:
a)  , B)
, B)  ,v)
,v)  , g)
, g)  mi)
mi)  .
.
5. El poder principal de las aguas de verano cambia en la serie:
a) 
B) 
v) 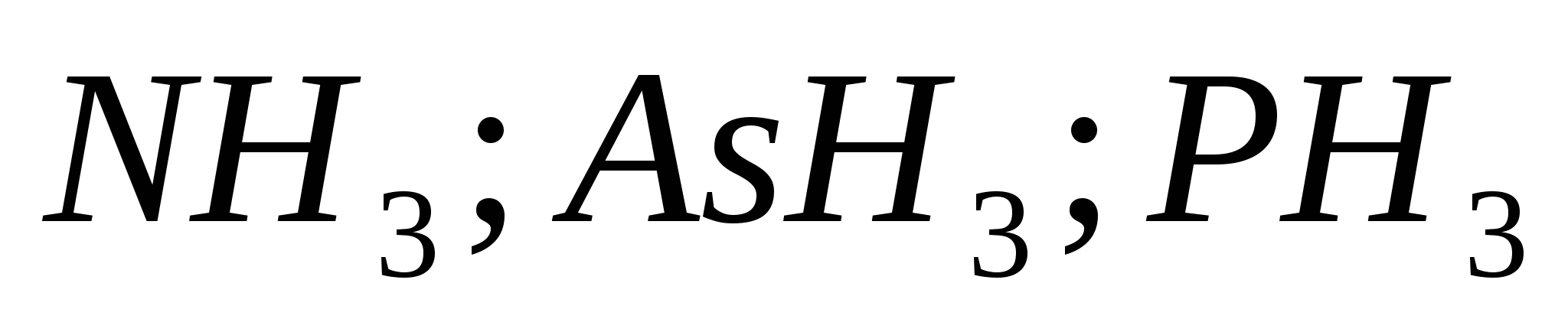
GRAMO) 
6. Para el cloro de macetas, se pueden vicorar diferentes concentraciones:
a)  , B)
, B) 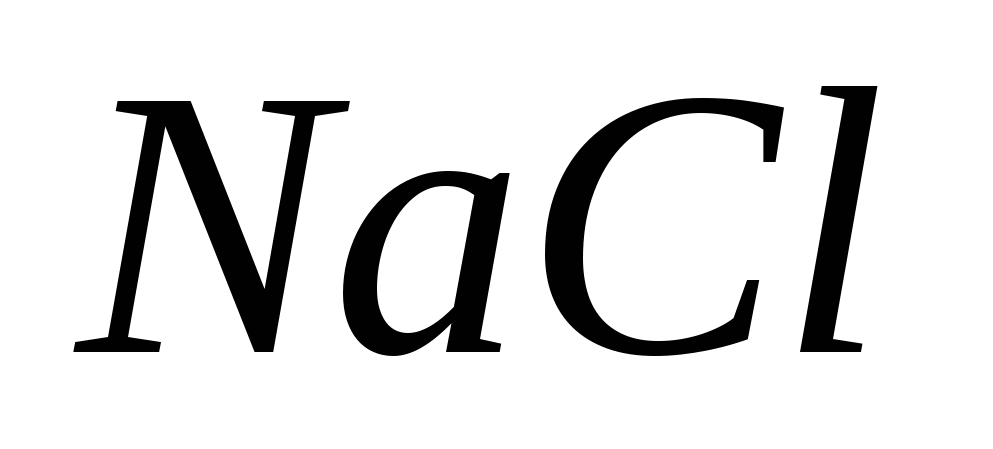 ,v)
,v)  , g)
, g)  .
.
7. El ácido sulfúrico concentrado exhibe poder oxidante para la gama de átomos:
a)  , B)
, B)  ,v)
,v)  .
.
NOTA: 9-10 respuestas correctas - "5"; 7-8-"4"; 5-6-"3"; menos de 5-2
Etapa "Teoría"
Rogué (en "3")
Escriba el nivel de reacciones que caracterizan el poder del ácido sulfúrico diluido.
Escriba la velocidad de reacción que caracteriza el poder del óxido de azufre (VI).
Escriba la ecuación de reacciones que caracterizan el poder del ácido clorhídrico.
Escriba la ecuación de reacciones que caracterizan el poder del óxido de fósforo (V).
Escribe reacciones iguales que caractericen el poder del amoníaco.
II roto (en "4")
Escriba las fórmulas de las aguas de verano de los no metales en el período II. Explica cómo y por qué cambian estos poderes ácidos.
Escriba las fórmulas de los óxidos más altos de no metales en el período III. Explica cómo y por qué cambian estos poderes ácidos.
Anota las fórmulas de los ácidos más importantes de los elementos del III periodo. Explica cómo y por qué cambian estos poderes ácidos.
Anote las fórmulas de las aguas volátiles de los no metales del subgrupo VI. Explica cómo y por qué cambian estos poderes ácidos.
Escribe las fórmulas de los ácidos más importantes de los elementos del subgrupo VA. Explica cómo y por qué cambian estos poderes ácidos.
III roto (en "5")
Equilibra el poder oxidante y ácido de los ácidos sulfúrico y nítrico. Vidpovid confirma con reacciones iguales.
Equilibrar el poder oxidante y ácido del óxido de azufre (IV) y el óxido de carbono (IV). Vidpovid confirma con reacciones iguales.
Equilibra el poder oxidante y ácido del agua y el fluorohidruro. Vidpovid confirma con reacciones iguales.
Equilibra el poder oxidante y ácido del ácido nítrico concentrado y diluido. Vidpovid confirma con reacciones iguales.
Igualar el poder oxidante y ácido del óxido de carbono (II) y el óxido de carbono (IV). Vidpovid confirma con reacciones iguales.
Escenario "La tarea de Rozrahun"
Rogué (en "3")
II roto (en "4")
Al interactuar con 37 g de hidróxido de calcio con sulfato de amonio, se eliminaron 15 g de amoníaco. Calcule la fracción de masa de salida de amoníaco.
Cuando spalyuvanni en agrio 62 g de fósforo, se quitaron 130 g de óxido de fósforo (V). Calcular la fracción de masa de la salida de óxido de fósforo (V).
¿Cuántos gramos de hidróxido de sodio al 10% necesitas para neutralizar 8,96 litros de agua clorada?
Se pueden usar unos pocos litros de dióxido de carbono para almacenar 10 kg de vapor, que cubrirán el 20% de las casas.
¿Cuántos gramos del asedio se saldan por pasar 11,2 litros de dióxido de carbono por 900 g de hidróxido de bario al 10 %?
III roto (en "5")
¿Qué volumen de ácido nítrico al 80% (pl. 1,46 g/ml) se requiere para la "distribución" de 32 g midi?
¿Cuánto midi de masa se necesitará para que la reacción con ácido nítrico demasiado concentrado tome 4 litros (N.O.) de óxido nítrico (IV), de modo que la fracción de volumen de la producción de yoga sea del 96%?
Al "variar" la concentración de ácido sulfúrico en 20 g de aleación de oro, se observaron 4,2 l (n.o.) de óxido de azufre (IV). Especifique la fracción de masa en % midi para esta aleación.
Se pasaron gases sumadores de cloro y agua con un volumen de 1 litro a través de la distribución de yoduro de potasio. He visto 5,08 r de yodo. Determinar la fracción de volumen (%) del gas de cloro en la suma de escape.
Se procesaron silicio Sumish y vugillya con una masa de 10 g con una solución de hidróxido de sodio demasiado concentrada. Después de la reacción, se observaron 5,6 litros de agua (n.s.). Designe la fracción de masa de silicio (%) para esta suma.
