Al conectar 28 g de silicio con oxígeno. Compuestos de oxigeno de silicio
Silicon.General característica. La principal diferencia con el carbono: la ausencia de enlaces p en los compuestos. Silicides. Compuestos con hidrógeno (silanos), oxidación e hidrólisis. Tetrafluoruro y tetracloruro de silicio, hidrólisis. Hexafluorosilicatos. Compuestos de oxígeno. Óxido de silicio. Ácido. Silicatos. Solubilidad e hidrólisis. Silicatos y aluminosilicatos naturales, zeolitas. Compuestos de organosilicio. Siliconas y siloxanos. Uso de compuestos de silicio en medicina.
Silicio (lat. Silicio), Si, elemento químico del Grupo IV del Sistema Periódico; número atómico 14, masa atómica 28.086. El silicio también exhibe hibridación sp3 de electrónica.
orbitales En la capa de electrones externa del átomo de silicio hay valencia 3d-
orbitales (Si: 3s23p23d0),
El silicio después del oxígeno es el elemento más común en la corteza. A diferencia del carbono en estado libre, el silicio no se encuentra en la naturaleza. Sus compuestos más comunes son óxido de silicio (IV) SiO2 y sales de ácido silícico, silicatos. Forman la concha de la corteza terrestre. Los compuestos de silicio se encuentran en plantas y animales. Por sus propiedades químicas, el silicio, al igual que el carbono, no es metálico, pero su no metalización es menos pronunciada, ya que tiene un radio atómico más grande.
Silicio forma compuestos con casi todos los metales - con icicidas (No se encuentran compuestos solo con Bi, Tl, Pb, Hg). Se obtuvieron más de 250 siliciuros, cuya composición (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, etc.) generalmente no corresponde a las valencias clásicas. Los siliciuros difieren en refractariedad y dureza; La importancia más importante es el ferrosilicio (agente reductor en la fundición de aleaciones especiales, ver Ferroaleaciones) y siliciuro de molibdeno MoSi2 (calentadores de hornos eléctricos, álabes de turbinas de gas, etc.).
Silano Bajo la acción del ácido clorhídrico sobre siliciuros, el compuesto de hidrógeno más simple de silicio es el silano SiH4:
El silano es un gas venenoso con un olor desagradable que se enciende espontáneamente. el aire
Son reactivos y son fuertes agentes reductores.
reaccionar con agua a temperatura ambiente:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluoruro El silicio es producido por fluoración de dióxido de silicio con flúor elemental.
El proceso de fluoración se lleva a cabo en dos etapas en un reactor de llama, dirigiendo el exceso de flúor elemental desde la primera etapa hasta la segunda etapa.
El resultado técnico es la producción de silicio en modo continuo con alto rendimiento y calidad de producto.
Tetrafluoruro de silicio SiF4 se forma por la acción del ácido fluorhídrico (fluorhídrico) sobre el vidrio:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Compuestos de oxigeno de silicio
El compuesto de oxígeno más importante del silicio es el dióxido de silicio SiO2 (sílice), que tiene varias modificaciones cristalinas.
La modificación a baja temperatura (hasta 1143 K) se llama cuarzo. El cuarzo tiene propiedades piezoeléctricas. Variedades naturales de cuarzo: cristal de roca, topacio, amatista. Las variedades de sílice son calcedonia, ópalo, ágata ,. jaspe, arena.
La sílice es químicamente resistente; solo se ve afectado por flúor, ácido fluorhídrico y soluciones alcalinas. Fácilmente entra en un estado vítreo (vidrio de cuarzo). El vidrio de cuarzo es frágil, muy resistente química y térmicamente. El correspondiente ácido silícico SiO2 no tiene una composición específica. Normalmente, el ácido silícico se registra como xH2O-ySiO2. Se seleccionaron los ácidos silícicos: H2SiO3 (H2O-SiO2) - meta-silicio (tres-oxo-silicio), H4Si04 (2H20-Si02) - orto-silicio (tetra-oxo-silicon), H2Si2O5 (H2O * SiO2) - dimetic silicon.
Los ácidos silícicos son sustancias poco solubles. De acuerdo con la naturaleza menos metaloide del silicio en comparación con el carbono, el H2SiO3 como electrolito es más débil que el H2CO3.
Correspondientes a los ácidos silícicos, las sales-silicatos en agua son insolubles (excepto silicatos de metales alcalinos). Los silicatos solubles son hidrolizados por la ecuación.
2SiO3 - + H20 = Si2O52- + 20H-.
Las soluciones concentradas de silicatos solubles se llaman vidrio líquido. El vidrio de ventana usual de silicato de sodio y calcio tiene una composición de Na20-CaO-6Si02. Se obtiene por reacción.
Se conoce una amplia variedad de silicatos (más precisamente, oxosilicatos). Se observa cierta regularidad en la estructura de los oxosilicatos: todos consisten en tetraedros de SiO4, que están conectados entre sí a través de un átomo de oxígeno. Las combinaciones más comunes de tetraedros son (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), que, como unidades estructurales, se pueden combinar en cadenas, cintas, redes y esqueletos (Fig. 4).
Los silicatos naturales más importantes son, por ejemplo, el talco (3MgO * H20-4Si02) y el asbesto (SmgO * H2O * SiO2). Al igual que con el SiO2, el estado vítreo (amorfo) es característico de los silicatos. Con la cristalización controlada del vidrio, es posible obtener un estado cristalino (sitalls). Sitalls se caracterizan por el aumento de la fuerza.
Además de los silicatos, los aluminosilicatos son de naturaleza generalizada. Aluminosilicatos: oxosilicatos de marco, en los que una parte de los átomos de silicio se reemplaza por Al trivalente; por ejemplo, Na12 [(Si, Al) 04] 12.
Para el ácido silícico, un estado coloidal es característico cuando las sales del ácido H2SiO3 no se ven afectadas inmediatamente. Las soluciones coloidales de ácido silícico (soles) bajo ciertas condiciones (por ejemplo, cuando se calientan) se pueden convertir en un gel de masa transparente transparente y homogéneo de ácido silícico. Los geles son compuestos de alto peso molecular con una estructura espacial muy suelta formada por moléculas de SiO2, cuyos vacíos están llenos de moléculas de H2O. Cuando se deshidrata el gel de sílice, se obtiene gel de sílice, un producto poroso con alta capacidad de adsorción.
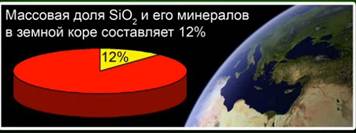
Óxido de silicio (IV) (sílice): el compuesto más común en la corteza terrestre, que representa el 12% de su masa en forma de varios minerales. Distinguir entre sílice cristalina y amorfa. La fórmula más simple para el óxido de silicio (IV) es SiO2. Se cristaliza en la red atómica.
1) Sílice cristalina: en forma de un mineral de cuarzo y sus variedades (cristal de roca, calcedonia, ágata, jaspe, pedernal); El cuarzo forma la base de las arenas de cuarzo ampliamente utilizadas en la construcción y en la industria del silicato.
2) Sílice amorfa: en la forma de la composición mineral opal SiO2 nH2O; Las formas terrestres de sílice amorfa son diatomita, Trípoli (tierra infusorial); Un ejemplo de sílice artificial anhidra amorfa es el gel de sílice, que se obtiene a partir del metasilicato de sodio:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
El gel de sílice tiene una superficie desarrollada, por lo que absorbe bien la humedad.
Gel de sílice es un gel seco formado a partir de soluciones supersaturadas de ácido silícico (nSiO2 · mH2O) a pH\u003e 5-6. Sólido sorbente hidrófilo.
Obteniendo
Se obtiene por acidificación de soluciones de silicato de metal alcalino, seguido de lavado y secado del gel formado:
Ácido silícico. SiO2 es el anhídrido de una serie de ácidos silícicos.
El ácido silícico está formado por unidades estructurales tetraédricas (en cada una de estas unidades, el átomo de silicio está en el centro del tetraedro, y los átomos de oxígeno están ubicados en la parte superior). Los enlaces estructurales, que se unen en cadenas, forman ácidos de polisilicio más estables:
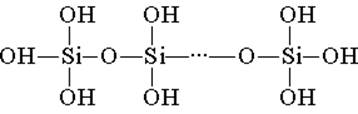
La composición de dicho compuesto se puede expresar mediante la fórmula (H2SiO3) n. Sin embargo, el ácido silícico suele estar representado por la fórmula H2SiO3. H2SiO3: el ácido es muy débil, poco soluble en agua. Cuando se calienta, se descompone fácilmente de la misma manera que el ácido carbónico:
Todos los ácidos silícicos son muy débiles (más débiles que el carbón).
Silicatos. Las sales de todos los ácidos silícicos se llaman silicatos, aunque, como norma, en la literatura educativa, los silicatos implican sales de ácido metacristalino. Su composición suele estar representada por la fórmula en forma de compuestos de óxidos de elementos. Por ejemplo, el silicato de calcio CaSiO3 se puede expresar como: CaO × SiO2.
Los silicatos de la composición R2O × nSiO2, donde R2O es óxidos de sodio o potasio, se llaman vidrio soluble, y sus soluciones acuosas concentradas se llaman vidrio líquido. El más importante es el vidrio soluble en sodio.
Al estar en el aire, las soluciones de silicatos crecen turbias, ya que el dióxido de carbono (IV) en el aire desplaza el ácido silícico de sus sales:
El ácido silícico es prácticamente insoluble en agua, esta propiedad se usa como reacción cualitativa al ion SiO32-.
Los silicatos se obtienen mediante la fusión de sílice con álcalis o carbonatos:
Solubilidad en ácido silícico. y la velocidad de su disolución depende de varios factores, de los cuales los más importantes son la modificación del dióxido de silicio, el grado de dispersión y la temperatura. Al agitar el gel de sílice con agua, el equilibrio de solubilidad se establece en unas pocas horas, en el caso del cuarzo, se necesitan muchos meses e incluso años.
SILICATOS NATURALES (Del latín. silex, género. Caso de silicis - pedernal * a. Silicatos naturales; N. Naturliche Silikate; F. Silicates Naturels; y. Silicatos naturales) - Una clase de minerales, sales de ácidos silícico, iso y heteropolicristalino. La proporción de silicatos naturales representa hasta el 75% de la masa de la corteza terrestre y alrededor del 25% de las especies minerales. En la naturaleza, se conocen más de 700 silicatos naturales, incluidos los minerales formadores de roca más importantes (feldespatos, piroxenos, anfíboles, micas, etc.)
Aluminosilicatos - un grupo de silicatos naturales y sintéticos, cuyos aniones complejos contienen silicio y aluminio. Ejemplos de aniones complejos: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, y algunas veces Ba2 + y Li + actúan como cationes.
Los aluminosilicatos naturales son los minerales más comunes, representan hasta el 50% de la masa de la corteza terrestre. Estos incluyen feldespatos (albita, ortoclasa, anortita), minerales de arcilla y mica.
Zeolitas - Estos son aluminosilicatos acuosos de calcio, sodio, potasio, bario y algunos otros elementos. El grupo de zeolitas incluye más de cuarenta minerales, que difieren en su composición (especialmente en el número de moléculas de agua en el hidrato cristalino) y, por supuesto, en las propiedades físicas y químicas. Pero casi todos los representantes de este grupo de minerales tienen una característica común: son buenos absorbentes, poseen propiedades de intercambio iónico, pueden cambiar la movilidad de los iones individuales y funcionan como tamices moleculares. Y, relativamente recientemente, estos minerales han encontrado un uso completamente inesperado: comenzaron a usarse en la agricultura.
Compuestos organosilícicos - Compuestos en cuyas moléculas existe un enlace entre el silicio y los átomos de carbono. Los compuestos de organosilicio a veces se llaman siliconas, del nombre latino de silicio "silicio". Los compuestos organosilícicos se utilizan para producir lubricantes, polímeros, gomas, gomas, fluidos de silicona y emulsiones. Los compuestos organosilícicos se utilizan en cosméticos, productos químicos para el hogar, pinturas y barnices, detergentes. Una característica distintiva de los productos basados en compuestos de organosilicio a partir de productos basados en compuestos orgánicos comunes son, por regla general, características y características de mayor rendimiento, así como la seguridad del uso humano. Los polímeros de silicona se pueden utilizar para hacer moldes en la cocina. La polimerización de compuestos de organosilicio y selladores es segura para los humanos y no requiere extracción.
Siloxanos - compuestos que contienen átomos alternados de silicio y oxígeno en una molécula. Los más altos tienen siloxanos de alto peso molecular - poliorganosiloxanos; Ver Polímeros de silicona.
Siliconas (poliorganosiloxanos): compuestos de organosilicio de alto peso molecular oxigenados con la fórmula química n, donde R = grupo orgánico (metilo, etilo o fenilo). Ahora, esta definición se adhiere muy raramente, y los poliorganosiloxanos (por ejemplo, aceites de silicona de tipo PMS, repelentes de agua de tipo NGL o cauchos de SKTN de bajo peso molecular) e incluso monómeros de organosilicio (varios silanos) también se combinan en "siliconas", borrando la distinción entre "siliconas" silicona. "
Silicio metalico  Cristal de silicio
Cristal de silicio
Silicio (Si). Este elemento químico es 1/4 de la composición de la corteza terrestre. Cuarzo, cristal de roca, arena, arcilla, granito, mica, amianto: todo esto compuestos quimicos de silicio
El silicio es un elemento intermedio (anfótero) y puede exhibir propiedades tanto metálicas como no metálicas. Puede formar compuestos químicos, tanto con metales como no metales.
Silicio puro - Una sustancia químicamente simple de color gris, dura, refractaria y quebradiza. Cristal de silicio Tiene un brillo metálico y es ampliamente utilizado en la industria de los semiconductores (es un semiconductor).
El silicio puede estirarse como en un estado cristalino ( silicio cristalino), y en estado amorfo ( silicio amorfo). El silicio cristalino se forma enfriando una solución de silicio amorfo en un metal fundido. A su vez, el silicio cristalino es un material muy quebradizo y se tritura fácilmente en un polvo amorfo. Por lo tanto, silicio amorfo Es un fragmento de cristales de silicio cristalino.
En estado libre, el silicio es bastante difícil de obtener. Su producción industrial está asociada con la recuperación de cuarzo, cuya fórmula química es SiO 2, la reacción de reducción es producida por coque caliente (carbono).
SiO 2 + C → CO 2 + Si
En el laboratorio, el silicio puro se reduce de la arena de sílice con magnesio metálico mediante la siguiente reacción:
SiO 2 + 2Mg → Si + 2MgO.
Durante esta reacción, se forma un polvo marrón de silicio amorfo. Cuando se calienta, el polvo puede reaccionar lentamente con soluciones concentradas de álcalis (por ejemplo, hidróxido de sodio NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - la sustancia compleja resultante - también llamada vidrio líquido.
Es interesante que la actividad química del silicio dependa del tamaño de sus cristales. El silicio cocristalino es menos químicamente activo que el amorfo. Este último reacciona fácilmente con flúor incluso a temperatura ordinaria, ya una temperatura de 400 - 600 ° C reacciona con oxígeno, cloro, bromo, azufre para formar los compuestos químicos correspondientes. A temperaturas muy altas, el silicio reacciona con el nitrógeno y el carbono para formar, respectivamente, nitruro y carburo de silicio.
Si intenta disolver el silicio en una mezcla de HF hidrofluoric (hidrofluoric) y HNO 3 nítrico, la reacción no continuará. Pero si realiza una reacción química con un álcali, por ejemplo, con hidróxido de potasio, la reacción tendrá lugar con la formación de una sal de ácido silícico.
Si + KOH → K 2 SiO 3 + H 2
Si se calcina en el horno sílice (arena) con coque, resulta una sustancia cristalina muy sólida. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - Sustancia muy dura y refractaria. En la industria, se produce en grandes cantidades debido a estas propiedades. Curiosamente, la red cristalina de carborundo es similar a la red de la sustancia más dura, el diamante, pero en ella los átomos de carbono individuales son reemplazados uniformemente por átomos de silicio.
A altas temperaturas, así como durante reacciones químicas bajo la acción de ácidos sobre compuestos metálicos con silicio, silano SiH 4.
Silano - Es un gas incoloro autoinflamable. Puede encenderse en el aire para formar sílice y agua.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Si el óxido de silicio SiO 2 se calienta en presencia de carbono en una corriente de cloro, se produce una reacción química con la formación de cloruro de silicio.
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Cloruro de silicio - Es un líquido, cuya temperatura de ebullición es de solo 54 0 C. El cloruro de silicio se disuelve fácilmente en agua con la formación de una solución de dos ácidos: silícico e hidroclórico.
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Si esta reacción química se produce en una atmósfera de aire húmedo, aparecerá humo espeso durante la formación de dos ácidos.
Fluoruro de silicio SiF 4: formado como resultado de una reacción química de ácido fluorhídrico y óxido de silicio
SiO 2 + 4HF → SiF 4 + 2H 2 O
El fluoruro de silicio es un gas incoloro con un olor "fuerte". Además del cloruro de silicio, en el agua este gas forma dos ácidos: silicio e fluorhídrico. Pero curiosamente, el fluoruro de silicio puede interactuar con el ácido fluorhídrico para formar ácido hexafluorosilícico cuya fórmula química es H 2 SiF 6. Sus sales y el ácido en sí son venenosos.
Silicio
Metales básicos y no metales
En esta lección estudiarás el tema de "Silicon". Considere la información sobre el silicio: su estructura electrónica, donde el silicio está en la naturaleza, estudie la alotropía del silicio, explique sus propiedades físicas y químicas. Aprenda dónde se usa el silicio en la industria y otras áreas, cómo se produce. Te familiarizarás con el sílice, el ácido silícico y sus sales: los silicatos.
Tema: Metales base y no metales.
Lección: Silicon. Gases nobles
El silicio es uno de los elementos químicos más comunes en la corteza terrestre. Su contenido es de casi el 30%. En la naturaleza, se encuentra principalmente en forma de diversas formas de dióxido de silicio, silicatos y aluminosilicatos.
El silicio es tetravalente en casi todos sus compuestos. En este caso, los átomos de silicio están en estado excitado. La figura 1.
Para entrar en este estado, uno de los electrones 3s ocupa un lugar vacío en los orbitales 3p. En este caso, en lugar de 2 electrones no apareados en el estado fundamental, el átomo de silicio en el estado excitado tendrá 4 electrones no apareados. Podrá formar 4 enlaces covalentes mediante el mecanismo de intercambio.


Los átomos de silicio no son propensos a la formación de enlaces múltiples, pero forman compuestos con enlaces simples -Si-O-. El silicio, a diferencia del carbono, no es típico de la alotropía.
Uno de la modificación alotrópica es el silicio cristalino.en el que cada átomo de silicio está en hibridación sp 3. La figura 2, 3. El silicio cristalino es una sustancia cristalina sólida, refractaria y duradera de color gris oscuro con brillo metálico. En condiciones normales - un semiconductor. A veces, el silicio amorfo también se emite como otra modificación alotrópica del silicio. Es un polvo marrón oscuro, más químicamente activo que el silicio cristalino. Si es una modificación alotrópica es un punto discutible.
Propiedades químicas del silicio.
1. Interacción con halógenos.
Si + 2F 2 → SiF 4
2. Cuando se calienta, el silicio se quema en oxígeno, se forma sílice (IV).
Si + O 2 → SiO 2
3. A altas temperaturas, el silicio interactúa con el nitrógeno o el carbono.
3Si + 2N 2 → Si 3 N 4
4. El silicio no reacciona con soluciones acuosas de ácidos. Pero se disuelve en los álcalis.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Cuando el silicio se fusiona con metales, se forman siliciuros.
Si + 2Mg → Mg 2 Si
6. El silicio no interactúa directamente con el hidrógeno, pero los compuestos de hidrógeno del silicio se pueden obtener mediante la interacción de los siliciuros con agua.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silano)
Los silanos son similares en estructura a los alcanos, pero son considerablemente reactivos. El monosilano más estable es inflamable en el aire.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Obteniendo silicio
El silicio se obtiene por reducción del óxido de silicio (IV).
SiO 2 + 2Mg → Si + 2MgO
Una de las tareas es obtener silicio de alta pureza. Para este propósito, el silicio técnico se transfiere al tetracloruro de silicio. El tetracloruro resultante se reduce a silano, y el silano se descompone en silicio e hidrógeno cuando se calienta.
El silicio puede formar dos óxidos: SiO2 - óxido de silicio (IV) y SiO - óxido de silicio (II).
SiO - óxido de silicio (II) - esta es una sustancia amorfa de color marrón oscuro, que se forma por la interacción del silicio con el óxido de silicio (IV).
Si + Sio 2 → 2 Sio.
A pesar de su estabilidad, esta sustancia casi nunca se utiliza.
SiO 2 - óxido de silicio (IV)


Esta sustancia representa el 12% de la corteza terrestre. La figura 4. Está representado por minerales como el cristal de roca, el cuarzo, la amatista, la citrina, el jaspe, la calcedonia. La figura 5
SiO 2 - óxido de silicio (IV) - una sustancia de estructura no molecular.
Su red cristalina es atómica. La figura 6. Los cristales de SiO 2 tienen la forma de un tetraedro, que están interconectados por átomos de oxígeno. La fórmula de la molécula (SiO 2) n sería más correcta. Como el SiO 2 forma una sustancia de estructura atómica y CO 2 de una estructura molecular, la diferencia en sus propiedades es obvia. El CO 2 es un gas y el SiO 2 es una sustancia cristalina transparente y sólida, insoluble en agua y refractaria.
Propiedades quimicasSiSobre 2
1. Óxido de silicio (IV) SiO2 es un óxido ácido. No reacciona con el agua. El ácido silícico no se puede obtener mediante la hidratación de SiO 2. Sus sales, silicatos, se pueden obtener haciendo reaccionar SiO 2 con soluciones alcalinas calientes.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Reacciona con carbonatos de metales alcalinos y alcalinotérreos.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Interactúa con los metales.
SiO 2 + 2Mg → Si + 2MgO
4. Reacción con ácido fluorhídrico.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Propiedades químicas del ácido silícico y silicatos.
Obtención de ácido silícico
Precipita el ácido silícico como un compuesto polimérico. Fórmulas de ácido silícico -
H 2 SiO 3 (forma meta) y H 4 SiO 4 (forma orto) - reflejan la proporción de los elementos, pero no la composición verdadera. Convencionalmente, en el plano, la composición del ácido silícico se representa como 7
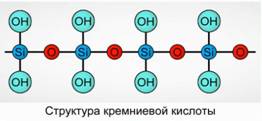
Para el ácido silícico, la fórmula H 2 SiO 3 siempre se usa.
1. H 2 Sio 3 se descompone cuando se calienta
H 2 SiO 3 H 2 O + SiO 2 (gel de sílice)
2. Interactúa con soluciones alcalinas.
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Sales de ácido silícico - silicatos - Se refieren a compuestos iónicos. Estas son sustancias sólidas incoloras. Sólo los silicatos de metales alcalinos, excepto el litio, son solubles en agua.
1. Los silicatos solubles son hidrolizados por aniones.
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. Los silicatos solubles interactúan con ácidos fuertes.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
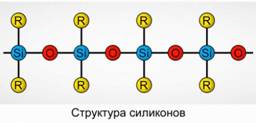
Poliorganosiloxanos (siliconas)
Los poliorganosiloxanos (siliconas) son compuestos organosilícicos de alto peso molecular oxigenados.
R 2 [ Sio] n
R es un grupo orgánico (metilo, etilo o fenilo). La base de la estructura de los siloxanos es una cadena de átomos de silicio y oxígeno alternos. Fig.8. Al variar la longitud de la cadena y los grupos orgánicos, se pueden obtener siliconas con diferentes propiedades. Al cambiar las condiciones de polimerización, puede obtener moléculas de diferentes longitudes.


Los polímeros de cadena corta son líquidos, los más largos son lubricantes valiosos. La figura 9, que conservan sus propiedades en un amplio rango de temperaturas desde
100 0 С a + 300 0 С. Las moléculas más largas forman cauchos que no pierden su elasticidad a bajas temperaturas. Poseen alta resistencia al desgaste, son químicamente inertes. La figura 10. Provoca diversas variantes de su aplicación. Se pueden usar para crear máquinas artificiales de corazón o riñón, y se pueden usar como zapatos para zapatos. Los polímeros de siloxano se usan en medicina para crear varios implantes de tejidos blandos, ya que dichos polímeros son químicamente inertes y no son rechazados por el cuerpo. No se humedecen con agua. Se utiliza en cremas. Al aplicar esta crema en sus manos, reemplazará los guantes de goma.
Jardin inorganico
En un vaso de precipitados transparente lleno de silicato de sodio, sumerja los cristales de sales coloreadas, por ejemplo, sulfato de cobre. Después de algún tiempo, se puede ver que los tubos huecos finos se formaron a partir de los cristales, que consisten en silicatos insolubles. La figura 11

Obtención de masilla "estúpida"
Se mezclan volúmenes iguales de silicato de sodio y alcohol medicinal. El precipitado se filtra y se exprime para no gotear alcohol. Esto es masilla. La figura 12. Se llama así porque fue planeado para usarlo como una masilla para ventanas. Pero resultó que tenía tales propiedades que no podía usarse para su propósito previsto. Si haces rodar la pelota y la tiras al suelo, rebotará como una pelota de goma. Si se pone sobre la mesa, se extenderá como un líquido. Si golpeas un objeto sólido, se romperá como un cuerpo sólido. Después de un tiempo, cuando el alcohol se seque, esta masilla se desmoronará.
![]()
Resumiendo la lección
En esta lección, has estudiado el tema "Silicio". Examinamos información sobre el silicio: su estructura electrónica, donde el silicio está ubicado en la naturaleza, estudiamos la alotropía del silicio y explicamos sus propiedades físicas y químicas. Aprendieron sobre dónde se usa el silicio en la industria y otras áreas, cómo se produce. Se reunió con sílice, ácido silícico y sus sales - silicatos.
Referencias
1. Rudzitis G.E. La quimica Fundamentos de la química general. Grado 11: libro de texto para instituciones educativas: nivel básico / G.E. Rudzitis, F.G. Feldman. - 14ª ed. - M.: Ilustración, 2012.
2. Popel P.P. Química: 8 cl. Libro de texto para escuelas secundarias / PP. Popel, L.S. - К.: ИЦ "Academia", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. La quimica 11º grado. Nivel basico 2ª ed., Sr. - M .: Drofa, 2007. - 220 p.
La tarea
1. №№2-4 (pág. 138) Rudzitis G.E. La quimica Fundamentos de la química general. Grado 11: libro de texto para instituciones educativas: nivel básico / G.E. Rudzitis, F.G. Feldman. - 14ª ed. - M.: Ilustración, 2012.
2. ¿Cuáles son las aplicaciones de los poliorganosiloxanos?
3. Comparar las propiedades de las modificaciones alotrópicas del silicio.
