Сполуки сърки. Стъпки на окислена вода на заден план. Формули с полусирки. Сирка. Сирводен. сулфид
Sirka, її физични и химически авторитети. Биологично значение на syrki, її zasosuvannya (демеркуризация).
Сяра в природата
родна сирка
PbS - оловен блиск
Cu 2 S- среден блиск
ZnS - цинкова смес
FeS 2 - пирит, пирит, котя злато
Х 2 S- сир вода (в минерални джерели и природен газ)
CaSO 4 * 2H2O- бедрата
MgSO 4 * 7H2O- girka sil (английски)
Na2SO4*10H2O- глауберов сил (мирабилит)
Физическа сила
Твърда кристална реч от същия цвят, нечуплива близо до водата, водата не се намокря (плуваща на повърхността), t ° бала = 445 ° С.
Една от специалните физически сили на сирка -флотацияДобротата на водата за снаждане на прах, която е страхотни кристали за потъване близо до водата. Отдясно, където водата не потъва във вода, частиците се подрязват по повърхността на водата, а други луковици се залепват за тях от ракунок.Силата на порочността, когато виждаш родни семена от къщи. Рудата е плитка, залята с вода, а отдолу се издухва от ветрове, плисък вода, а къщите се пълнят с вода на дъното.алотропия
За serki има характерно пръскане на алотропни модификации, ale nibilsh vіdomі vidosmіni:ромбичен (кристален) , моноклинна(Холчаста) і пластмаса .
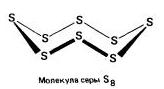
ромбична (а - сирка) - S 8
t ° pl. = 113°С; ρ = 2,07 g / cm 3. Най-добрата възможна модификация.
моноклинна (б - сирка) - S 8
тъмно оцветени глави, t ° pl. = 119°С; ρ = 1,96 g/cm3. Стек при температури до 96°С; с остроумни умове ще се трансформира в ромб.
Пластмаса S n
кафява смола (аморфна) маса. Нестийка, когато се втвърди, ще се превърне в диамант.
ОТСТРАНЯВАНЕ НА ПЛАСТМАТА
Будова атом на сирка
Разпределение на електрониката по нива и поднива
основен лагер
1s 2 2s 2 2p 6 3s 2 3p 4
Дистрибуция на електроника от
орбитали (топка за почивка)стъпка
окисленивалентност
В основния лагер
Перче избужен стан
Още един избужен стан
otrimannya sіrki
1. Promisloviy метод - viplavlenya от руда за допълнителен воден залог.
2. Не напълно окислена вода (с некиселинна киселинност).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакция на Wackenroder
2H2S + SO2 = 3S + 2H2O
Химия на силата на света
Сірка - окисляващ S 0 + 2ē→ S -2 | Сирка - водещо длъжностно лице: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Vzaєmodia sіrki siизползвайте с буйни и луг-земяни метали, миди, живак, сибломбез отопление: 2 Na + S→ Na 2 S ДОСВИД S + Hg = HgS Живакът е летлив. Ей заложи otruynі. Реакцията на Tsya лежи в основата на визуалния и магнитен живак, например от счупен медицински термометър. Mіstya, защото не е възможно да се използва петънце живак, да се поръси с прах от sіrki. Сирка и живак влизат в реакция при затваряне. Резултатът е нахална, неинтелигентна и не тъпа реч. Целият процес се нарича демеркуризация 2. Vzaєmodiya sіrki° С с най-малките метали (крим Au, Pt) при регулируемо t °: 2Al + 3S T → Al 2 S 3 Zn + S T
°
→
ЗнС ДОСВИД Cu + S T
→
CuS DOSVID 3. Vzaєmodia sіrki zdeyakim неметали за изявления binarny spoluk: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Vzaєmodіya sіrki с kisnem: S + O 2 T ° → S +4 O 2 2 S + 3 O 2 t°; т → 2 S +6 O 3 2. Vzaєmodiya sіrki° С халогени (с изключение на йод): S + Cl 2→ S +2 Cl 2 ** Взаемодия сирки зкиселини - окислители: S + 2H 2 SO 4 (конц.)→ 3S +4O2 + 2H2O S + 6HNO 3 (конц.)→ H2S +6O4 + 6NO2 + 2H2O ** Непропорционални реакции: 4. 3S0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
смучене
Вулканизация на каучук, отхвърляне на ебонит, изтриване на сирници, барут, в борбата с ученици от правителството на Силской, за медицински цели (сирчански мехлеми за отстраняване на деца от болести и др.), за отхвърляне на киселини
Начало zavdannyaпараграф 21; дясна 1, 3, 4 страна. 99-100.
dodatkovі zkhadanіya
Завършете стандартните реакции, стр Задайте производителността с помощта на метода на електронния баланс, включително окислител, предшественик.
#2. Zdіysnіt ревизия зад схемата:
Це цикаво...
- Вместо сирки в тялото на хора с тегло 70 кг - 140 г.
- Добу хората имат нужда от 1 г сирка.
- Зелен грах Багати, квас, пластмаса, пшеница, месо, риба, плодове и манго.
- Syrka влиза в склада на хормони, витамини, кръвни клетки, печели в хрущялната тъкан, в косата, nigtyah. Когато има липса на енергия в тялото, е по-вероятно да се появят хрупкавост на нощите и кисти, косопад.
Радвайте се на здравето си!Чи знаеш ви ..
- Spoluki sirki може да служи като наркотици;
- Сирка е в основата на мехлем за лечение на гъбични заболявания на шкири, за борба с крастата. Натриев тиосулфат Na 2 S 2 O 3 победител да се бори за нея.
- Много соли на солна киселина и за разтваряне на кристализационна вода: ZnSO 4 × 7H 2 O і CuSO 4 × 5H 2 О. Их zasosovuyut як антисептично използване за изглаждане на рослин и смачкване на зърно в борбата с учениците на правителството Silskoy.
- Zalizny витриол FeSO 4 × 7H 2 O використов с анемия.
- BaSO 4 zasosovyat при рентгенографски дозировки на слунка і на червата.
- Alumokalіevі galun KAI (SO 4) 2 × 12H 2 O - кръвно-гръбначен растеж в порьозност.
- Минерал Na 2 SO 4 × 10H 2 Ще го нарека "сила на Глаубер" в чест на глаукообразния химик на Глаубер И.Р. Съвсем не, но слонкерът беше проектиран да бъде приет. Един от жителите на града го е изпратил в джерела. Yak tilki vin vipiv бутилка солена вода, веднага почвата се накисва. Глаубер достига до водата, след което кристализира с Na 2 SO 4 × 10H 2 O. Contagion її zasosovyat як се носи в медицината, с farbuvannі памучно-хартиени тъкани. Можете също да го намерите в vyrobnitsvі skla.
- Дърветата могат да преместят изграждането на почвата от земята и да стимулират залепването на елемента с висящите роси.
- Chasnik vidіlyaє rechovinu - albucid Ця реч за разболяване, доверие за стари, преодоляване на сърца за разболяване.
Групата на халкогените включва сирка - редица други елементи, като голям брой рудни родове. Сулфатите, сулфидите, оксидите и изпаренията са още по-широки, важни в индустрията и природата. За това в данните на статистиката е ясно, като вонята, която дрънка, но това е самата сирка, а речта е проста.
Syrka и ее характеристики
Датският елемент може да се намери и в периодичната система.
- Шоста група, ръководител на групата.
- Трети малийски период.
- Атомна маса - 32,064.
- Серийният номер е 16, протоните и електроните от стила, неутроните също са 16.
- Допуска се до неметални елементи.
- Формулите гласят, yak "es", името на елемента е sirka, латински сяра.
В природата има chotiri стабилни изотопи с масови числа 32.33.34 и 36. Дания е най-добрият елемент за разширяване в природата. Запознайте се с биогенните елементи, за да влязат в запаса от важни органични молекули.
Електронна будова атом
Сполуките на враните са обвързани със собствената си гъвкавост с особеностите на електронния бюджет на атома. Vono завъртете формулата за офанзивна конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 4.
Редът се показва, когато стационарната мелница е инсталирана. Изглежда обаче, че ако атомът изглежда има допълнителна мощност, тогава е възможно електроните да се разделят на 3p и 3s-паралели, с по-нататъшен преход към 3d, което изглежда е валидно. В резултат на това промяната е не само във валентността на атома, но и във всички възможни етапи на окисление. Това е броят на значенията, които трябва да се увеличи, така че това е броят на думите за участието на syrka.
Стъпки на окислена вода през деня
Можете да видите няколко от основните опции за този индикатор. За сърки це:
Сред тях най-рядкото развитие е S +2 и навсякъде са розовочервени. От етапа на окислена вода в дъното до отлагане на химическата активност и окислителното здраве на цялата реч. Така, например, z'соединение з -2 - tse sulfidi. Те имат типичен окислителен елемент.
Чимът е значително ниво на окисляване в околната среда, с повече набъбване на окислително здраве в резултат на речта на володя. Лесно е за цом да се обърне, ако можете да получите две основни киселини, докато задавате syrka:
- H 2 SO 3 - сърчиста;
- H 2 SO 4 - сирчана.
Привидно останалото е по-стабилно, по-силен е денят, но володията при висока концентрация е още по-сериозна за окисляване.
обикновен разговор
Як проста реч сирка е красив кристал от същия вид жива форма. Ако искам само една от формите, тогава има два основни принципа на речта. Пърша, моноклинна или ромбична - tse і zhovte е неподходяща за намиране във водата и лишена в търговците на биологични продукти. Вижте хрупкавостта и красивата форма на структурата, представена от короната. Температура на топене - близка до 110 0 С.
Ако не пропуснете междинния момент, когато такива модификации се нагряват, тогава можете незабавно да развиете иншия лагер - пластмасова сирка. Vona е вискозен кафяв цвят, подобен на дъвка, който при нагряване или твърде студено студено отново ще се превърне в диамант.
Ако говорим за химически чистата сирка, изоставането на филтрацията на bagatoraz, значи има много малки кристали, склонност и безчувствени неравности във водата. Zdatnі се грижи за контакт с vologo и kisnіy povіtrya. Занимавам се много с химия.

Познание в природата
В природата има естествени родове, от които има половинчати, а самата тя е проста дума. Освен това няма нужда да отмъщавате:
- в минерали, руди и руди;
- в организмите на тварин, рослин и хора, така че как да влезем в склада на органични молекули;
- в природни газове, нефт и нефт;
- в нефтени шисти и естествени води.
Можете да посочите малък брой миньори, които са в списъка:
- киновар;
- пирит;
- сфалерит;
- антипари;
- galena и іnshі.
Голяма част от спечелените сезони на годината има на сирчанокишълското виробничество. Друга част е победоносна за медицински цели, правителството Silskoe, индустриални процеси, виробнит на речи.
Физическа сила
Те могат да бъдат описани в няколко точки.
- Във вода не е rozchinnaya, във въглероден дисулфид или терпентин - добре е да отидете.
- С тривиално настъргано натрупвам отрицателен заряд.
- Температурата на топене става 110 0 С.
- Температура на кипене 190 0 С.
- При достигане на 300 0 С преминава в билото, лесно се срутва.
- Чисто казано, самозаемащите горива на властта са още по-добри.
- Сама по себе си миризмата на практика не е лесна, но водата и полутортите виждат остра миризма на развалени яйца. Така себе си, както и deyaki газоподобни бинарни представители.
Физическата сила на дадената реч на Побойника е видяна от хората отдавна. Сама за своята горимост sirka і взе името така. В vikorisovyvuvuyu задушаващи и изпаряващи изпарения, тъй като те са формовани в жегата на деня, като срещу враговете. В допълнение, киселинността също е по-важна от промискуитната стойност за съдбата на маслото.

Весели авторитети
Тема: "Сирка и її сполуки" в училищния курс по химия на заем не е един урок, а килка. Aje їkh duzhe bagato. Това ще бъде обяснено с химията на тази реч. Можете да покажете силата на окисление както с по-силни заподозрени (метали, бор и іnshі), така и с повече неметали.
Те обаче не се интересуват от такава дейност, само с флуор в комбинация с всякакъв вид акъл. За всички е необходимо отопление. Възможно е да се идентифицират редица категории на речта, с които има връзка между следното:
- хвърли;
- неметали;
- ливади;
- силни окислителни киселини - сърчана и азотна.
Сполуки сърки: разноводи
Универсалността на тях ще се обясни с неравните стойности на степента на окисление на основния елемент - сирка. И така, можете да видите няколко от основните видове речи за много познания:
- z'соединение Зі степен на окисление -2;
Ако погледнете класа, а не индикатор за валентност, тогава даден елемент ще фиксира такива молекули, като:
- киселина;
- оксид;
- сол;
- binarni spoluces с неметали (сирковуглеци, хлориди);
- органична реч.
Сега можете да видите основните от тях и да сложите пръст върху тях.

Recovini със стъпка на окисление -2
Spoluki sirki 2 - tse її конформации с метали, както и с:
- във въглища;
- губим се;
- фосфор;
- силиций;
- мишяк;
- бор.
В cich vipadkah те са показани в ролята на окислител, тъй като всички елементи са по-електрически положителни. Особено важно е да ги видите.
- Сірковуглец - CS 2. Prozora rіdina с характерен възприемчив аромат на efіru. Є токсичен, в пламъци и вибуха реч. Vikoristovuyutsya як razchinnik, както и за голям брой видове масла, мазнини, неметали, нитрати, смола и каучук. Има и важна част от виробността на шева на парчето - вискозна. Обещанията са синтезирани в голям брой.
- Воден сулфид или сулфидна вода - H 2 S. Газ, който не може да се втвърди и сладник за наслада. Миризмата е остра, в ръба неприемливо, развалено яйце. Otruyny, подкара dyshal центъра, така че yak po'yazu іoni mіdі. За това, когато той бъде отрязан, има дъх и смърт. Той се използва широко в медицината, органичния синтез, синтеза на органични киселини, а също и в качеството на енергийно видима сирувина.
- Сулфидът на металите се използва широко в медицината, в сулфатен алкохол, изхвърлени фармацевтични продукти, в приготвени луминофори и в други мишки. Първоначалната формула е Me x S y.

З'єднання Зі степен на окисление +4
Сполукс на сирки 4 - всички по-важни оксиди и свързани соли и киселина. Цялата смрад е да се запълни с широки шипове, които може да са по-значими в индустрията. Може да изглежда, че има окисляване и по-често да се прояви нова сила.
Формули с половин зърно със стъпка на окисление +4 стъпки:
- оксид - чист газ SO 2;
- киселина - чиста H2SO3;
- soli може да ми даде формулата Me x (SO 3) y.
Един от най-популярните є или анхидрид. Виното е безбарвина реч, с володя мирише на гърлен сирник. При страхотни покупки е лесно да се мирише, когато има вулкани.
Лесно се разлага във вода от разтвора на киселина и sirchistoy. Да се води, като типична сол, в която да се въведе при вигляди сулфит-йон SO 3 2-. Tsey анхидридът е основният газ, който се влива в препятствието на военноморската атмосфера. Самото вино се излива на светлината.
З'єднання, при което при сивите стъпала се окислява +6
Към такова признание, първото за всичко, е изразът на анхидрид и сирчанова киселина с нейните соли:
- сулфати;
- хидросулфати.
И така, тъй като атомът на сирка в тях се намира в превъзходно окислено състояние, тогава силата на cich е напълно нулева. Вонята е силно окисляваща.
Серки (VI) оксид - sirchaniy анхидрид - е летлив неплоден ридин. Характерно за ориза - силна влагопоглъщаща способност. Dimit на отворена основа. При дозиране във вода дайте една от най-силните минерални киселини – сирчан. Концентрации на разлики її важни мазни, леко дъвчащи rіdinoy. Ако в разтвора на сирханова киселина има анхидрид, той ще бъде особено известен, наречен олеум. Win vikorystvutsya в индустрията с virobnitstvі киселина.
Серни соли - сулфати - голяма стойност имат такива сполуки, яки:
- бедра CaSO 4 2H 2 O;
- барит BaSO 4;
- мирабилит;
- оловен сулфат и други.
Мирише на съхранение в бизнеса, химически синтез, медицина, готови оптични приставки и очила и за намиране на хранителна индустрия.
Известно е, че хидросулфатът се използва широко в металургията; А също и самата воня ще помогне за превръщането на много сгъваеми оксиди в различни сулфатни форми, така че да могат да бъдат намерени в различни видове.
Vivchennya sirki в училищния курс по химия
Ако е най-красиво да научиш знанието за тези, които също са сирка, като силата на силата, кое е делото на сирка? 9 клас - най-красивият период. Не е самото ухо, тъй като всичко е ново и тихо за децата. Средата е във вивченна химична наука, ако основите, положени по-рано, ще ми помогнат да разбера темата. Том, за да видите храната, вижте самия приятел на класа. В същото време цялата тема се простира до редица блокове, в някои отдели има урок "С'єднання сірки. 9 клас".
Ще бъде обяснено на броя на хората. Също така е добра идея да разгледате храненето за витамините и минералите в индустрията. Като цяло темата ще бъде въведена в средата на 3 години.
И оста на гроздето трябва да се настърже на vivchennya само в 10-ти клас, ако организмите гледат храна. По същия начин вонята на биологията в гимназията ще бъде разрушена. Адже сирка да влезе в склада на такива органични молекули, като:
- тиоспирти (Меркаптани);
- bіlki (третинова структура, върху която се показва формата на дисулфид mіstkіv);
- тиоалдегидив;
- тиофеноли;
- тиоефири;
- сулфонови киселини;
- сулфоксид и іnshі.
Виждат ги в специална група органосерни з'єднан. Миризмата може да е по-важна не само в биологичните процеси на живите същества, но и в индустрията. Например, сулфоновите киселини са в основата на много лекарства (аспирин, сулфаниламид или стрептоцид).
Освен това има постоянен компонент на такива неща като действия:
- аминокиселини;
- ферментира;
- витамини;
- хормони.
При стайна температура водата влиза в реакцията само с живак. С регулиране на температурата активността се увеличава значително. При нагряване сирка реагира без средата с прости фрази, зад винетка от вътрешни газове, азот, селен, телурий, злато, платина, иридий и йод. Сулфидният азот и златото се отстраняват по косвен начин.
Ангажимент с метали
Syrka viyavlya окислява мощност, в резултат на взаимодействието на сулфиди:
Взаемодия с вода работи при 150-200 ° С:
H 2 + S = H 2 S.
Vzaєmodiya z kisnem
Водата гори в киселина при 280 ° C, на завой при 360 ° C, при която се задава сума от оксиди:
S + O 2 = SO2;
2S + 3O 2 = 2SO 3.
Комбинация с фосфор и въглища
Когато се нагрява без достъп до захранване, водата реагира с фосфор, въглерод, показвайки окислителна сила:
2P + 3S = P 2 S 3;
Комбинация с флуор
В присъствието на силни окислители се проявява следната сила:
S + 3F 2 = SF 6.
Vzaєmodiya със сгъваеми думи
Когато се свързвате със сгъваеми думи на syrka, това е като оловото:
S + 2HNO 3 = 2NO + H 2 SO 4.
непропорционална реакция
Syrka е добра за непропорционални реакции, когато се установява взаимодействие с ливадата, сулфиди и сулфати:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. otrimannya sіrki
Самородни руди
При нагряване без достъп до храна
FeS 2 = FeS + S.
Окисляване на водата при липса на киселинност
2H 2 S + O 2 = 2S + 2H 2 O.
От газа да влезе в металургичните и коксовите пещи, когато се нагрява в присъствието на катализатора
H2S + SO2 = 2H2O + 3S.
1.8. sirvodden
Vodneve z'єdnannya sirki - sirvodden Х 2 С ... Sirevodn е ковалентна z'єdnannya. Молекулите са аналогични на тези на водните молекули, водният атом се намира в етапа на sp 3-хибридизация, но водните молекули не приемат водните молекули. Атомът на суркия е по-малко електрически отрицателен, колкото по-нисък е атомът кисел, колкото по-малък е размерът, толкова по-малък е зарядът, толкова по-малък е зарядът. Валентният разрез на HSH става 91,1 °, а лентата H - S става 0,133 nm.
Физическа сила
С екстравагантни умове, sirvodden е газ без газ, със силна характерна миризма на развалени яйца. T pl = -86 °C, Tбала = -60°C, изгнила във вода, при 20°C в 100 g вода се разтварят 2,58 ml H 2 S. Дори и да се вдишва, може да доведе до фатален резултат. В природата човек вижда в складовете на вулканични газове, утаява се в гръдта на растящи и живи организми. Добър разтвор във вода, когато работя, ще фиксирам слаба солна киселина.
Весели авторитети
Водният разтвор има слаба сила на двуосновна киселина:
H2S = HS - + H +;
HS - = S2 + H +.
Сире вода за горене в повитри blakitnym half'am. В случай на взаимосвързан достъп се установява валиден сертификат:
2H 2 S + O 2 = 2H 2 O + 2S.
С огромен достъп до огнището на огнището, водата трябва да бъде произведена преди одобрението на оксида на маслото (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
Сиркховен е в състояние да доставя енергия. Отлаганията на вода могат да се окислят във воден разтвор до суха вода, чист газ и сярна киселина.
Например, in vitro бромна вода:
H 2 S + Br 2 = 2HBr + S.
обмен с хлорна вода:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Поток от вода може да бъде изстрелян, використ и оловен оксид, така че реакцията на супер вода може да доведе до големи видове топлина:
3PbO 2 + 4H 2 S = 3PbS + SO2 + 4H2O.
Vzaєmodia sіrvodnyu sіrchistim газ vikoristovuyutsya за отстраняване на sirki от газове, за влизане в металургичната и сърханова киселина virobniztva:
SO2 + 2H2S = 3S + 2H2O.
Процесът zsim свързва осветяването на местната сирка по време на вулканични процеси.
С едночасов поток от чист газ и вода през ливадата се задава тиосулфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
При нормални умове водата е безпрецедентен и дори токсичен газ с характерна миризма на развалени яйца.
За yogo otrymannya в лабораторните умове призовават да се добави разредена солна киселина към сулфид:
Първият начин за отстраняване на водата от водата чрез добавяне на студена вода към алуминиев сулфид:
Сирводин, като е отрязан по този начин, е по-ясен.
Sirevodn е ковалентна z'єdnannya. Його молекулите могат да скрият структура, подобна на структурите на оловните молекули (Div. Rozd. 2.2). Въпреки това, с оглед на водните молекули, водните молекули не съвпадат с водните звуци. Вдясно в това, атомът на сивото е по-малко електрически отрицателен, долният атом е кисел, ейлът е с по-голям размер. Ето защо атомът на водата може да бъде по-малко мощен от заряда, а не атомът да е кисел. Чрез видимостта на водните връзки понижавам температурата на водата, понижавам водата. Видимостта на водните звуци във водата ще обясни същото на копелето разликата във водата.
Водният разтвор има слаба сила на двуосновна киселина:
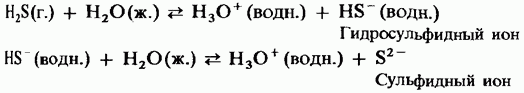
Водата ще изгори в тъмните полумаси. Когато има непрекъснат достъп до огъня, водата се наблюдава, за да се види визията на огъня, тъй като кондензира върху студената повърхност на корта:
С огромен достъп до пещта, водата трябва да се произвежда преди одобрението на серен диоксид:
Сиркховен е в състояние да доставя енергия. Например вино от бариево-бромна вода и възобновяемо от тях до йони
Хидрохлоридът е двуосновна киселина, която може да се използва за две серии соли - сулфидна и хидросулфидна (под. Vishche). С помощта на разтвори в близост до водата могат да се намерят сулфиди на чужди метали. Резултатът от хидролизата:
Неразрушителни сулфиди на други метали могат да бъдат утаени от водни разтвори на соли на тези метали, чрез преминаване през изход на вода. Например, ако водата премине през пролуката, тогава те могат да отмъстят за черна обсада на сулфида
Реакцията е победна в качеството на аналитичен тест за вода.
оксиди на сирки
Sierka одобри редица оксиди, от които най-значимите са два: Сирки диоксид и Сирка триоксид
Серният диоксид е безалкохолен газ с остра задушлива миризма. В лабораторните умове е възможно да се премахне, като се изгори в някакъв вид или в киселина, като се добавят топли разреждания на киселинни вариации към някаква несулфитна сол или се нагрява концентрирана киселина от средата:
Серумен диоксид-кисел оксид. Лесно се разпознава по водата, пълна със сърчиста киселина. Киселината йонизира по-рядко и освен това е слаба киселина:
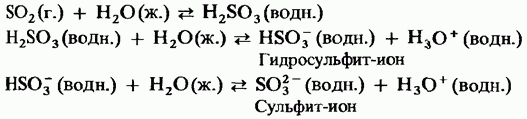
Когато газообразният серен диоксид се пропуска през разтвора на натриев хидроксид, се установява натриев сулфит. Натриевият сулфит, реагиращ с излишния серен диоксид, поставяйки натриевия хидросулфит в реакция, аналогична на въглеродния диоксид в газирана вода.
І газоподобен серен диоксид, і разтвори на водна основа са братовчеди. Например, газообразният натриев хидроксид е оксид от сулфатен разтвор и чиста киселина се получава от йон към йон
Серният диоксид в промишлени отпадъци се дестилира по време на vipalyuvanny на някои сулфидни руди и порочен като междинен продукт в процеса на отстраняване на sirchanoic киселина (Div. Глава 7). Пшеничният диоксид се съхранява в целулозната индустрия, за премахване на тъкани, а също и за преработка на плодове и зеленчуци в случай на тривиален збериганн.
Серният диоксид е много важен в запушената атмосфера и особено при осветяването на киселинни плочи. В атмосферата виното се окислява до серен триоксид:
При нормални умове процесът се противодейства от време на време, но в присъствието на катализатора е възможно да се отървем от него, може би преди да бъде използван в контактния процес за отстраняване на киселината. Малки количества сол и манган, които могат да се намерят в атмосферата, правят възможно катализирането на окисления серен диоксид. Поздрави триоксидът реагира с волого и затова се появяват престъпниците, тъй като са киселинни таблетки (Div. Soozh, гл. 12).
Твърдият серен триоксид е полиморфен. Две от тях са navazhlivіshі форми Първият от тях е тример с циклична структура (фиг. 15.24, а); кристали на проблясък. mє ациклична полимерна структура (фиг. 15.24, б); Прекрасен при вида на голите кристали. Температура на топене. При наличието на волога, стъпка по стъпка той се трансформира във форма на Obidvi, за да кипи при 45 ° C. Парите на триоксида на пара се съхраняват в изолирани симетрични равнинни молекули.
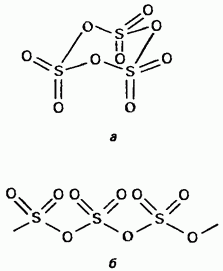
Малък. 15.24. Сирки триоксид, Ациклична структура, b - Ациклична структура.
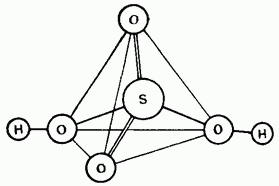
Малък. 15.25. Структурата на молекула на сирханова киселина.
В лабораторните мивки серен триоксид се разпределя с нагрят сулфат
Водният триоксид може да бъде силно кисел. Виното реагира екзотермично с вода, превръщайки киселината:
Syrka триоксидът е силен окислител. Например, виното окислява бромоводород до бромоводород.
Сирчана киселина
Сирчанската киселина е безплодна маслена киселина на ридина. Цената е един от най-важните промишлени химически продукти. Тяхното promislova іtrimannya за допълнителен контакт процес і stasosuvannya е описано в гл. 7.
Неразредената сирханова киселина е ковалентен разтвор. Молекулите могат да бъдат тетраедрични будов (фиг. 15.25).
Сирчанова киселина за кипене и разлагане при 340 ° С,
Температурата на точката на кипене е висока и вискозитетът на солната киселина е висок;
Сирчанската киселина е силна двуосновна киселина. Във водата водата ще се повиши и хидросулфат- и сулфат-йони са одобрени:
Сирчана киселина се грижи за съдбата на всички реакции, характерни за киселините. Vona реагира с метали, разтваряйки сулфати на метали и вода, в реакции с карбонати, разтварящи сулфати, диоксиди във въглерод и вода и при реакции със сплави и ливади, осигурявайки сулфати или хидросулфати.
Концентрираната сирханова киселина реагира по-бурно с вода. За целта трябва да добавите сирчан киселина, като я изсипете във вода, а не навпаки. Киселината е хигроскопична, т.е. Това її vikoristovuyut за сушене на газове, тъй като не реагират с него, преминавайки їkh през sіrchan киселина. Съотношението на сярната киселина към водата и покритието е голямо, но сярната киселина може да служи като дехидратиращ агент; за всяка концентрирана сърханова киселина:
бели кристали в пентахидрат сулфат превръщат безводен сулфат
във въглехидратите, например захарозата, са овъглени:
папията може да бъде карбонизирана с комбинация от концентрирана органична киселина, която се натрупва с доза киселина върху целулозни влакна;
етанолът се превръща в етилен:
(Обезводняване на етанол с помощта на органична киселина, което трябва да се извършва под контрол
умовете, да произвеждат етоксиетан (диетичен етер) до одобрението и реакцията да бъде победоносна за елиминиране на етоксиетана в промишлен мащаб);
сумата от хлоробензен и трихлоретанал (хлорал) претърпява дехидратация (раздел 16.3).
Концентрираната сирханова киселина е силен окислител. Спечелени окислителни метали и неметали. между другото
Yak іnshі дупе, как іnstruyuyut окислителната сила на концентрирана сърханова киселина, също окислени йони до йони, както и бромидни йони до вирусен бром в началните реакции:
Nareshty, sirchan acid викоризира като сулфониращ агент в органичната химия (раздел гл. 17).
Сулфати, сулфати и тиосполуци
Сулфатният йон има тетраедрична структура, подобна на структурата на молекула на сярна киселина.
Soli. Сулфатът се установява при реакциите на разредена сърханова киселина с метали, оксиди, хидроксиди и карбонати. За винен сулфат бар и іnshі сулфат roschinnі във водата. Калциевият сулфат не е много силен във вода. Преди загряване пържолите се разбъркват със сулфат. Vinnyts в цялото разнообразие от sulphati zaliza. Например, сулфатът, когато се нагрява, се отлага с одобрения оксид на физиологичен разтвор:
За възстановяване на сулфатни йони по какъвто и да е начин, добавете водно налягане към хлоридния бар. Ако има някакви доказателства за сулфатни йони в предварителните срещи, в резултат на това ще бъде установено установяването на обсада срещу сулфат бари:
Сулфатите може да са много важни в zasosuvan. Например, магнезиевият сулфат (английски sil, girka sil) се използва за виробничество на вибухови реки, за приготвяне на сирници и огнеупорни тъкани. Nasicheni razchin tsієї soli vikoristovutsya в медицинската практика като protivopalny zasіb.
Натриевият тиосулфат може да се разглежда като аналог на натриевия сулфат, в който един атом е заместен с един атом сяра. Сред децата на Tіospoluka те ще измислят едно нещо - tiocyanat kaliyu. Вин е аналог на цианат калий. Tіocianat kalіyu може да се изхвърли, като се слее cyanіd kalіyu със sіrkoyu:
Tiocianat kaliyu vikoristovuyutsya в yak_sіanіnіy kalіy за производство преди началото на криво
Отново, повторете отново!
1. При преминаване към долната част на VI категория качество елементите постепенно преминават от неметални към метални.
2. Елементите от VI група могат да прикрият сградата с вода и реакционни метали, създавайки сцената, в която може да има окислени стъпки -2.
3. Kisen е силно електроотрицателна и силна окисляваща сила.
4. Озонът е още по-силно окисляващ, по-малко киселинен.
5. Кисен има изключително важна роля в биологичните системи;
6. Кисен е одобрен с малки сполуки от бинарни сполука, различни видове оксиди:

7. Водният пероксид е силен окислител.
8. Syrka в viglyadi може да се намери в decilkoh енантиотропни форми.
9. За изхвърляне на вода от земните натоварвания, процесът на Frash е в застой, в този случай е трудно да се заби и прегрята пара.
10. Сирка ще създаде сполуки, в които има в лагерите с нива на окисление +2, +4, +6 и -2.
11. Sirwater е слаба двуосновна киселина и преобладаваща.
12. Газообразен серен диоксид и разтвори на водна основа.
13. Водният триоксид може да бъде силно кисел и окислен.
14. Syrchana киселина е силна двуосновна киселина, изсушаващ агент, дехидратиращ агент и силен окислител.
15. Молекулите на солна киселина и сулфат-йон могат да имат тетраедрична структура.