Kükürt. Hidrojen sülfit ve sülfitler
4.doc
240Kükürt. Hidrojen sülfit, sülfitler, hidrosülfitler. Kükürt oksitler (IV) ve (VI). Sülfürik asit ve sülfürik asit ve bunların tuzları. Sülfürik asit esterleri. Sodyum tiyosülfat
4.1. kükürt
Kükürt, insanların birkaç bin yıldır kullandığı az sayıdaki kimyasal elementten biridir. Doğada yaygın olarak dağılır ve hem serbest halde (doğal kükürt) hem de bileşiklerde bulunur. Kükürt içeren mineraller iki gruba ayrılabilir - sülfitler (piritler, pırıltılar, aptallar) ve sülfatlar. Yerli kükürt, İtalya (Sicilya Adası) ve ABD'de büyük miktarlarda bulunur. BDT'de, yerel kükürt yatakları Volga bölgesinde, Orta Asya eyaletlerinde, Kırım'da ve diğer bölgelerde bulunur.
Birinci grubun mineralleri kurşun parlaklığı PbS, bakır parlaklığı Cu2S, gümüş parlaklığı - Ag2S, çinko blende - ZnS, kadmiyum yapışma - CdS, pirit veya demir pirit - FeS2, kalkopirit - CuFeS2, zinober - HgS'yi içerir.
İkinci grubun mineralleri arasında alçı CaS04 2H20, mirabilit (Glauber tuzu) - Na2S0410H20 ve kizerit - MgS04H20 bulunur.
Kükürt hayvanlarda ve bitkilerde protein moleküllerinin bir parçası olarak bulunur. Petrolde organik kükürt bileşikleri bulunur.
resepsiyon
1. Sülfür doğal bileşiklerden, örneğin piritik sülfürden elde edildiğinde, yüksek sıcaklıklara ısıtılır. Sülfür piriti, demir (II) sülfür ve sülfür oluşturmak üzere ayrışır:
2. Sülfür, hidrojen sülfürün reaksiyonla oksijen eksikliği nedeniyle oksidasyonu ile elde edilebilir:
2H2SO2 = 2S2H2O
3. Günümüzde, kükürt dioksit S02'nin karbondioksit azaltımıyla kükürt geri kazanımı metallerin kükürt cevherlerinden eritilmesinde yaygın bir yan üründür:
S02C = C02S
4. Metalurjik ve kok fırınlarının atık gazları bir kükürt dioksit ve hidrojen sülfür karışımı içerir. Bu karışım katalizör üzerinde yüksek bir sıcaklıkta geçirilir:
H 2 S S02 = 2H203S
^ Fiziksel özellikleri
Kükürt sert, kırılgan bir limon sarısı rengindedir. Suda pratik olarak çözünmez, ancak karbon disülfid ve diğer bazı çözücülerde CS2 anilinde iyi çözünür.
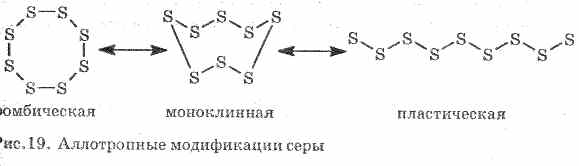
Zavallı ısı ve elektrik akımı iletir. Sülfür çeşitli allotropik modifikasyonlar oluşturur:
1 . ^ Rombik kükürt (en kararlı), kristaller oktahedra formundadır.
Sülfür ısıtıldığında rengi ve viskozitesi değişir: ilk önce açık sarı oluşur ve sonra sıcaklık arttıkça koyulaşır ve viskoz hale gelir, borunun dışına akmayacak şekilde viskoziteye dönüşür, daha fazla ısıtılarak viskozite tekrar düşer ve 444, 6 ° С sülfür kaynar .
2. ^ Monoklinik kükürt - erimiş kükürtün yavaşça soğutulmasıyla elde edilen koyu sarı iğneler biçiminde modifikasyon.
3. Plastik kükürtkaynamaya ısıtılan kükürt soğuk suya dökülürse oluşur. Kauçuk gibi kolayca gerilebilir (bkz. Şekil 19).
Doğal kükürt dört sabit izotoptan oluşur: 32 16 S, 33 16 S, 34 16 S, 36 16 S
^ Kimyasal özellikleri
Eksik bir dış enerji seviyesine sahip bir kükürt atomu iki elektron ekleyebilir ve bir derece sergileyebilir
Yükseltgenme -2. Kükürt, metaller ve hidrojen içeren bileşiklerde bu oksidasyon durumunu gösterir (Na2S, H2S). Elektronların daha elektronegatif elementin atomuna geri tepmesi veya tükenmesi durumunda, kükürt oksidasyon derecesi 2, 4, 6 olabilir.
Kükürt soğukta nispeten atıldır, ancak sıcaklık arttıkça reaktivitesi artar. 1. Metallerle kükürt oksitleyici özellikler gösterir. Bu reaksiyonlar sülfitler oluşturduğunda (altınla, platin ve iridyum reaksiyona girmez): Fe S = FeS
2. Normal koşullar altında, kükürt hidrojenle reaksiyona girmez ve 150–200 ° C'de geri dönüşümlü bir reaksiyon oluşur:
3. Metallerle ve hidrojenle reaksiyonlarda, kükürt tipik bir oksitleyici madde olarak davranır ve güçlü oksitleyici maddelerin mevcudiyetinde indirgeyici özellikler gösterir.
S 3F 2 = SF6 (iyot ile reaksiyona girmez)
4. Kükürtün oksijende yanması 280 ° C'de, havada ise 360 ° C'de gerçekleşir. Bu, S02 ve S03'ün bir karışımını oluşturur:
S02 = S022S3O2 = 2S03
5. Havasız ısıtıldığında, kükürt oksitleyici özellikleri gösteren, doğrudan fosfor, karbon ile birleşir:
2P 3S = P2S3 2S C = CS2
6. Karmaşık maddelerle etkileşime girdiğinde, kükürt temel olarak indirgeyici madde olarak davranır:
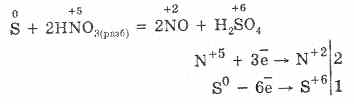
7. Kükürt orantısızlaşma reaksiyonları gösterebilir. Böylece, kükürt tozu alkalilerle kaynatırken, sülfitler ve sülfitler oluşur:
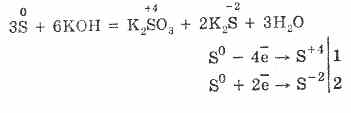
uygulama
Kükürt sanayi ve tarımda yaygın olarak kullanılır. Üretiminin yaklaşık yarısı sülfürik asit üretmek için tüketilir. Kauçuğun vulkanizasyonu için kükürt kullanılır: bu durumda kauçuk kauçuğa dönüştürülür.
Kükürt şeklinde (ince toz) kükürt bağ ve pamuk hastalıklarına karşı savaşmak için kullanılır. Barut, kibrit, aydınlık kompozisyonlar elde etmek için kullanılır. Tıpta, cilt hastalıklarının tedavisi için hazırlanan kükürt merhem.
4.2. Hidrojen sülfit, sülfitler, hidrosülfitler
Hidrojen sülfit, bir su analoğudur. Elektronik formülü
Kükürt atomunun dış seviyesindeki iki p-elektronun H - S - H bağlarının oluşumunda rol oynadığını göstermektedir. H2S molekülü açısal bir şekle sahiptir, bu yüzden kutupsaldır.
^ Doğada olmak
Hidrojen sülfit, doğada volkanik gazlarda ve Pyatigorsk, Matsesta gibi bazı mineral kaynaklarının sularında bulunur. Çeşitli hayvan ve bitki kalıntılarından kükürt içeren organik maddelerin çürümesi ile oluşur. Bu, karakteristik olarak tatsız lağım pisliği kokusu, fosseptik ve çöp depolama alanlarını açıklar.
resepsiyon
1. Hidrojen sülfit, sülfürün hidrojenle ısıtılarak doğrudan bağlanması yoluyla elde edilebilir:
2. Ancak genellikle seyreltik hidroklorik veya sülfürik asidin demir (III) sülfür üzerindeki etkisi ile elde edilir:
2HCl FeS = FeCl2H2S2H FeS = Fe2H2S Bu reaksiyon genellikle Kipp aparatında gerçekleştirilir.
^ Fiziksel özellikleri
Normal koşullar altında, hidrojen sülfit, çürük yumurtaların güçlü bir karakteristik kokusuna sahip renksiz bir gazdır. Çok zehirli olan solunum, hemoglobine bağlanır ve sağlıksız olan felce neden olur.
Ko ölüme yol açar. Düşük konsantrasyonlarda, daha az tehlikeli. Egzoz kabinlerinde veya hava geçirmez kapalı cihazlarla çalışmak gerekir. Üretim yerinde H2S'nin izin verilen içeriği, 1 litre hava için 0.01 mg'dır.
Hidrojen sülfit suda nispeten iyi çözünür (20 ° C'de 2.5 hacim hidrojen sülfit 1 hacim suda çözülür).
Sudaki bir hidrojen sülfit çözeltisine hidrojen sülfit suyu ya da hidrojen sülfit asidi denir (zayıf bir asidin özelliklerini tespit eder).
^ Kimyasal özellikleri
1, kuvvetli bir şekilde ısıtıldığında, hidrojen sülfit neredeyse tamamen tamamen sülfür ve hidrojen oluşturmak üzere ayrışır.
2. Gaz halindeki hidrojen sülfit, havada kükürt oksit (IV) ve su oluşumuyla mavi bir alevle yanar:
2H2S3O2 = 2SO2 2H2O
Oksijen eksikliği ile kükürt ve su oluşur: 2H2S02 = 2S2H20
3. Hidrojen sülfit oldukça güçlü bir indirgeyici maddedir. Bu önemli kimyasal özellik aşağıdaki gibi açıklanabilir. Bir H2S çözeltisinde, elektronları havadaki oksijen moleküllerine bağışlamak nispeten kolaydır:
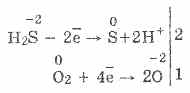
Aynı zamanda, havadaki oksijen hidrojen sülfürü bulanık hale getiren hidrojen sülfürü sülfüre okside eder:
2H2SO2 = 2S2H20
Bu, organik madde çürürken hidrojen sülfitin doğada çok büyük miktarlarda birikmediği gerçeğini açıklar - havadaki oksijen onu serbest sülfüre okside eder.
Şekil 4, Hidrojen sülfit, halojen çözeltileri ile kuvvetli şekilde reaksiyona girer, örneğin:
H 2 S I 2 = 2HI S Sülfür serbest bırakılır ve iyot çözeltisinin rengi artar.
5. Çeşitli oksitleyiciler hidrojen sülfürle kuvvetli şekilde reaksiyona girer: nitrik asit etkisiyle serbest sülfür oluşur.
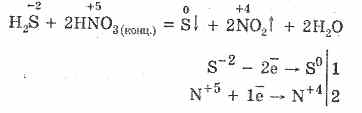
6. Bir hidrojen sülfid çözeltisi ayrışmaya bağlı asidiktir:
H 2 SH HS - HS - İH S -2
İlk aşama genellikle hüküm sürmektedir. Çok zayıf bir asittir: genellikle H2S'yi sülfitlerden ayıran kömür asidinden daha zayıftır.
Sülfitler ve hidrosülfitler
Hidroflorik asit, dibazik olarak, iki sıra tuz oluşturur:
Orta - sülfitler (Na2S);
Ekşi - hidrosülfitler (NaHS).
Bu tuzlar elde edilebilir: hidroksitlerin hidrojen sülfit ile etkileşimi: 2NaOHH2S = Na2S2H2O
Sülfürün metallerle doğrudan etkileşimi:
Tuzların H2S ile veya tuzlar arasında değişim reaksiyonu:
Pb (N03) 2 Na2S = PbS2NaNO3
CuS04H2S = CuSyH2S04 Cu2H2S = CuS2H
Hidrosülfitler, neredeyse hepsi suda çözünür.
Alkali ve toprak alkali metallerin sülfürleri de suda renksiz olarak kolayca çözünür.
Ağır metal sülfitler suda neredeyse hiç çözünmez veya biraz çözünür (FeS, MnS, ZnS); Bazıları seyreltik asitlerde (CuS, PbS, HgS) çözünmez.
Zayıf bir asidin tuzları olarak, sulu çözeltilerdeki sülfitler yüksek oranda hidrolize edilir. Örneğin, alkali metal sülfitler, suda çözüldüğünde alkalin reaksiyona girerler:
Na 2 S НОНNaHS NaOH
Hidrojen sülfitin kendisi gibi bütün sülfitler, kuvvetli indirgeyici ajanlardır:
3PbS -2 8HN5O3 (par.) = 3PbS6O4 4H2O8N2O
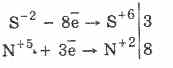
Bazı sülfidlerin karakteristik bir rengi vardır: CuS ve PbS - siyah, CdS - sarı, ZnS - beyaz, MnS - pembe, SnS - kahverengi, Al 2 S3 - turuncu. Katyonların kalitatif analizi, sülfürlerin farklı çözünürlüklerine ve çoğunun farklı renklerine dayanır.
^ 4.3. Sülfür Oksit (IV) ve Sülfürik Asit
Normal koşullar altında kükürt oksit (IV) veya kükürt dioksit keskin boğucu bir kokuya sahip renksiz bir gazdır. -10 ° C'ye soğutulduğunda renksiz bir sıvı halinde sıvılaştırılır.
resepsiyon
1. Laboratuvar koşullarında, kükürt oksit (IV), üzerlerindeki kuvvetli asitlerin etkisiyle sülfürik asit tuzlarından elde edilir:
Na2S03H2S04 = Na2S04S02H2O2NaHSO3H2S04 = Na2S042S02 22H2O2HSO - 3 2H = 2 SO2 2H2O
2. Ayrıca, düşük aktif metallerle ısıtıldığında konsantre sülfürik asidin etkileşimi ile kükürt dioksit oluşur:
Cu2H2S04 = CuS04S02 2H20
Cu 4H2S02-4 = Cu2S02-4S02 2H20
3. Kükürt hava veya oksijende yakıldığında kükürt oksit (IV) de oluşur:
4. Endüstriyel koşullarda S02, piritin FeS2 veya demir içermeyen metallerin kükürt cevherleri (çinko blende ZnS, kurşun parlak PbS, vb.) İle kavrulmasıyla elde edilir:
4FeS 2 11О 2 = 2Fe 2 O 3 8S02
S02 molekülünün yapısal formülü:
Dört sülfür atomu ve iki oksijen atomundan dört elektron, S02 molekülündeki bağların oluşumunda rol alır. Bağ elektron çiftlerinin ve yalnız elektron kükürt çiftinin karşılıklı olarak itilmesi, moleküle açısal bir şekil verir.
Kimyasal özellikleri
1. Sülfür oksit (IV) asit oksitlerin tüm özelliklerini gösterir:
Su etkileşimi
Alkalilerle etkileşim
Bazik oksitler ile etkileşimi.
2. Sülfür oksit (IV), özelliklerin azaltılması ile karakterize edilir:
S4O2O 0 2 2S 6 O -2 3 (ısıtıldığında, bir katalizör varlığında)
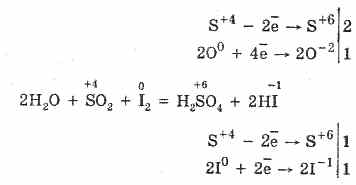
Ancak, güçlü indirgeyici ajanların varlığında, S02 bir oksitleyici ajan olarak davranır:
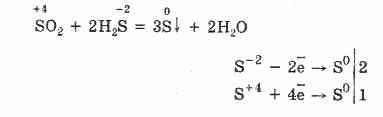
Sülfür (IV) oksidin redoks dualitesi, içinde sülfürün 4 oksidasyon durumuna sahip olması ve dolayısıyla 2 elektrondan vazgeçerek S6'ya oksitlenebilmesi ve 4 elektron alarak S ° 'ye indirgenebilmesi ile açıklanmaktadır. Bu veya diğer özelliklerin tezahürü reaktif bileşenin doğasına bağlıdır.
Sülfür oksit (IV) suda yüksek oranda çözünür (40 hacim SO2, 20 ° C'de 1 hacimde çözülür). Bu durumda, sadece sulu çözelti içinde bulunan sülfürik asit oluşur:
SO 2 H 2 H 2 SO 3
Reaksiyon geri dönüşümlüdür. Sulu çözeltide, kükürt oksit (IV) ve kükürtlü asit, kaydırılabilecek kimyasal dengededir. H2S03'ün bağlanmasıyla (asidin nötralizasyonu)
Sen) reaksiyon sülfürik asit oluşumu yönünde ilerler; SO2'yi çıkarırken (bir azot çözeltisi veya ısıtma çözeltisinden üfleme), reaksiyon başlangıç maddelerine doğru ilerler. Sülfürik asit çözeltisi her zaman keskin bir koku veren sülfür oksit (IV) içerir.
Sülfürik asit, asitlerin tüm özelliklerine sahiptir. Çözümde adım adım ayrışır:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Termal olarak kararsız, uçucu. Sülfürik asit, dibazik olarak, iki tür tuz oluşturur:
Orta - sülfitler (Na2S03);
Ekşi - hidrosülfit (NaHS03).
Alkaliler asit tarafından tamamen nötrleştirildiğinde sülfitler oluşur:
H2S03 2NaOH = Na2S03 2H20
Hidrosülfit, alkali eksikliği ile elde edilir:
H20S3NaOH = NaHSO3H20
Sülfürik asit ve bunun tuzları, reaksiyon ortağının doğası ile belirlenen hem oksitleyici hem de indirgeyici özelliklere sahiptir.
1. Böylece, oksijen sülfitlerin etkisi altında sülfatlara oksitlenir:
2Na 2 S403 O 0 2 = 2Na 2 S6O -24
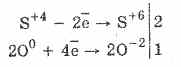
Brom ve potasyum permanganatın sülfüröz asit oksidasyonu daha da kolay bir şekilde ilerler:
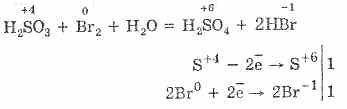
5H2S4O3 2KMn7O4 = 2H2S6O4 2Mn2S6O4K2S6O4 3H2O
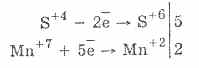
2. Daha kuvvetli indirgeyici ajanların varlığında, sülfitler oksidatif özellikler sergilerler:
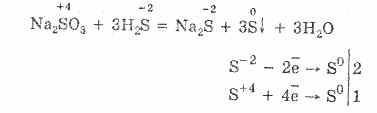
Hemen hemen tüm hidrosülfit ve alkali metal sülfit, sülfürik asit tuzlarından çözülür.
3. H2S03 zayıf bir asit olduğundan, asitlerin sülfit ve hidrosülfitlere etkisi S02'in salınmasına neden olur. Bu yöntem genellikle SO2 elde edilirken kullanılır laboratuar koşullarında:
NaHSO3H2S04 = Na2S04S04 H20
4. Suda çözünür sülfitler, çözeltide OH - iyonlarının konsantrasyonunun arttığı bir şekilde kolayca hidrolize uğrar:
Na2S03NONNaHSO3NaOH
uygulama
Sülfür oksit (IV) ve sülfürik asit, renksiz bileşikler oluşturarak birçok boyayı renklendirir. Sonuncusu, rengin geri kazanılmasının bir sonucu olarak ısıtıldığında veya ışığında yeniden ayrışabilir. Bu nedenle, S02 ve H2S03'ün beyazlatma etkisi, klorun beyazlatma etkisinden farklıdır. Genellikle, kükürt (IV) rxid yün, ipek ve samanı ağartır.
Sülfür oksit (IV) birçok mikroorganizmayı öldürür. Bu nedenle küf mantarlarını yok etmek için çiğ mahzenleri, mahzenleri, şarap fıçılarını vb. Büyük miktarlarda, sülfürik asit (IV) sülfürik asit üretmek için kullanılır.
Önemli bir uygulama, odun ve kağıt hamurunun işlenmesinde kullanılan kalsiyum hidrosülfit CaHS03 (sülfit likörü) çözeltisidir.
^ 4.4. Kükürt oksit (VI). Sülfürik asit
Sülfür oksit (VI) (bkz. Sekme 20), 16.8 ° C sıcaklıkta katı kristalli bir kütleye katılaşan renksiz bir sıvıdır. Nemi çok güçlü bir şekilde emerek sülfürik asit oluşturur: S03H20 = H2S04
Tablo 20. Kükürt oksitlerin özellikleri
Kükürt oksitlerin (VI) su içerisinde çözünmesine, kayda değer miktarda ısı salınımı eşlik eder.
Sülfür oksit (VI) konsantre sülfürik aside çok çözünür. Susuz bir asit içindeki bir S03 çözeltisine oleum denir. Oleumler% 70'e kadar SO3 içerebilir.
resepsiyon
1. Kükürt oksit (VI), katalizörlerin mevcudiyetinde 450 ° С sıcaklıkta kükürt dioksitin oksijene oksidasyonu ile elde edilir (bkz. Sülfürik asit üretimi):
2S02O2 = 2S03
2. S02 ila S03'ü oksitlemenin bir başka yolu, bir oksitleyici madde olarak nitrik (IV) oksit kullanmaktır:
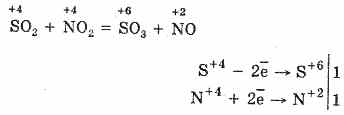
Atmosferik oksijen ile etkileşime girdiğinde oluşan nitrik oksit (II) kolayca ve hızlı bir şekilde nitrik okside dönüşür (IV): 2NO2 = 2N02
Yine SO 2 oksidasyonunda kullanılabilir. Bu nedenle, N02, bir oksijen taşıyıcı görevi görür. S02 ila S03'ün bu oksitlenmesi yöntemine nitröz denir. S03 molekülü, merkezinde bir üçgen şeklindedir.
Sülfür atomu bulunur:
Böyle bir yapı, bağ elektron çiftlerinin karşılıklı olarak itilmesinden kaynaklanmaktadır. Bir kükürt atomu oluşumu için altı dış elektron sağlamıştır.
Kimyasal özellikleri
S03, tipik bir asit oksittir.
2. Sülfür oksit (VI) güçlü bir oksitleyici ajanın özelliklerine sahiptir.
uygulama
Sülfürik asit (VI), sülfürik asidi üretmek için kullanılır. Bunlardan en önemlisi, edinme iletişim yöntemi
Sülfürik asit Bu yöntemle, herhangi bir konsantrasyonda H2S04 ve oleum elde edebilirsiniz. İşlem üç aşamadan oluşur: SO2 elde edilmesi; S02 ila S03'ün oksidasyonu; H2S04 elde edilir.
SO2 özel fırınlarda pirit FeS2'nin yanmasıyla elde edilir: 4FeS 2 11О 2 = 2Fe 2 O 3 8S02
Kavurma işlemini hızlandırmak için, pirit önceden öğütülür ve kükürtün tamamen yanması için reaksiyonun gerektirdiğinden çok daha fazla hava (oksijen) enjekte edilir. Fırından çıkan gaz kükürt (IV) oksit, oksijen, azot, arsenik bileşiklerden (piritlerdeki safsızlıklardan) ve su buharından oluşur. Buna kavurma gazı denir.
Kavurma gazı tamamen temizlenir, çünkü küçük bir arsenik bileşiği ve ayrıca toz ve nem içeriği katalizörü zehirler. Gaz, arsenik bileşiklerinden ve tozdan arındırılarak özel elektrostatik çökelticilerden ve yıkama kulesinden geçer; nem, bir kurutma kulesinde konsantre sülfürik asit tarafından emilir. Oksijen içeren saflaştırılmış gaz, 450 ° C'ye kadar bir ısı eşanjöründe ısıtılır ve temas cihazına girer. Temas aparatının içinde katalizörle doldurulmuş kafes rafları bulunur.
Daha önce, katalizör olarak ince parçalanmış metalik platin kullanıldı. Daha sonra, platinden daha ucuz ve daha yavaş zehirlenmiş olan vanadyum bileşikleri - vanadyum oksit (V) V205 veya vanadil sülfat VOSO4 ile değiştirildi.
S02'nin S03'e oksidasyon reaksiyonu geri dönüşümlüdür:
2S02O2 2S03
Kalsine edici gazdaki oksijen içeriğindeki bir artış, kükürt oksit (VI) verimini arttırır: 450 ° C'lik bir sıcaklıkta, genellikle% 95 veya daha fazlasına ulaşır.
Oluşan kükürt oksit (VI) daha sonra ters akım yöntemiyle konsantre sülfürik asit tarafından emildiği bir emme kulesine beslenir. Doygun hale geldikçe, susuz sülfürik asit önce oluşur, sonra oleum. Gelecekte, oleum% 98 sülfürik aside seyreltilir ve tüketicilere sunulur.
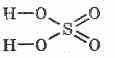
Sülfürik asidin yapısal formülü:
^ Fiziksel özellikleri
Sülfürik asit, 10.4 ° C'de neredeyse iki katı kristalleşen ağır, renksiz, yağlı bir sıvıdır. ( = 1.83 g / cm3) sudan daha ağır, kokusuz, uçucu olmayan. Son derece higroskopik. Nem, yüksek miktarda ısı açığa çıkmasıyla absorbe olur, böylece konsantre sülfürik aside su dökemezsiniz - asit sıçraması olacaktır. İçin
Küçük porsiyonlarda suya sülfürik asit ilave edilmelidir.
Susuz sülfürik asit,% 70'e kadar kükürt oksidi (VI) çözer. Isıtıldığında,% 98.3 H2S04 kütle fraksiyonuna sahip bir çözelti oluşana kadar S03'ü uzaklaştırır. Susuz H2S04 neredeyse elektrik akımı iletmiyor.
^ Kimyasal özellikleri
1. Herhangi bir oranda suyla karışır ve farklı bileşimdeki hidratları oluşturur:
H2S04H20, H20S04 2H20, H2S04 4H2O, H2S04 4H20, H2S04 6.5H20
2. Konsantre sülfürik asit organik maddeleri karbonize eder - şeker, kağıt, ahşap, lif, onlardan su elementlerini alarak:
C12H22O11H2S04 = 12CH2S04 11H20
Oluşan kömür kısmen asitle etkileşime girer:
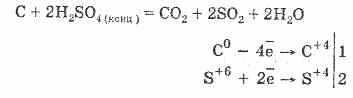
Gazın dehidrasyonu, sülfürik asit tarafından su emilimine dayanır.
Güçlü bir uçucu olmayan asit olarak, H2S04 diğer asitleri kuru tuzlardan uzaklaştırır:
NaNO3H2S04 = NaHSO4HNO3
Bununla birlikte, eğer H2 çözeltisine tuz çözeltileri eklenirse, asit yer değiştirmesi olmaz.
H 2 SO 4 - güçlü dibazik asit: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2- 4
Uçucu olmayan güçlü asitlerin tüm özelliklerine sahiptir.
Seyreltilmiş sülfürik asit, oksitleyici olmayan asitlerin tüm özellikleri ile karakterize edilir. Yani: metallerin hidrojene kadar gerilimlerinin elektrokimyasal serilerinde bulunan metallerle etkileşime girer:
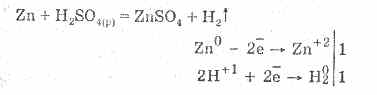
Metallerle etkileşim, hidrojen iyonlarının azalmasından kaynaklanmaktadır.
6. Konsantre edilmiş sülfürik asit, enerjik bir oksitleyici ajandır. Isıtıldığında, hidrojenden sonraki elektrokimyasal gerilme serileri dahil olmak üzere çoğu metalleri okside eder, sadece platin ve altın ile reaksiyona girmez. Metalin aktivitesine bağlı olarak, indirgeme ürünleri S -2, S ° ve S4 olabilir.
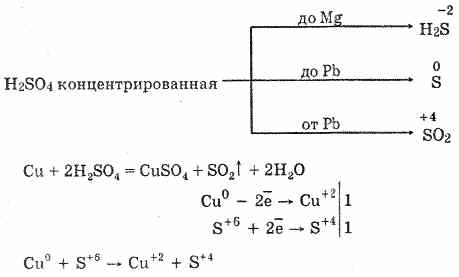
Soğukta, konsantre sülfürik asit, alüminyum, demir ve krom gibi güçlü metallerle etkileşime girmez. Bu, metallerin pasivasyonundan kaynaklanmaktadır. Bu özellik, demir bir kapta taşınırken yaygın olarak kullanılır.
Ancak, ısıtıldığında:
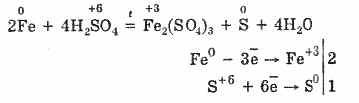
Böylece, konsantre sülfürik asit, asit oluşturucu atomların indirgenmesi nedeniyle metallerle etkileşime girer.
Sülfat iyonu SO 2-4'e kalitatif bir reaksiyon, BaS04'ün beyaz kristalli bir çökeltisinin, suda ve asitlerde çözünmeyen bir oluşumudur:
SO 2- 4 Ba 2 BaSO 4
uygulama
Sülfürik asit, kimyasal madde olmayan kimyasal madde üretimi yapan ana kimya endüstrisinin en önemli ürünüdür.
Organik asitler, alkaliler, tuzlar, mineral gübreler ve klor.
Çeşitli uygulamalar için, sülfürik asit asitler arasında ilk sıradadır. Fosfat ve azotlu gübreler elde etmek için en çok tüketilir. Uçucu olmayan sülfürik asit, diğer asitleri üretmek için kullanılır - hidroklorik, hidroflorik, fosforik ve asetik.
Birçoğu, petrol ürünlerinin - benzin, kerosen, yağlama yağlarının - zararlı safsızlıklardan arındırılmasını sağlar. Makine mühendisliğinde, sülfürik asit metal yüzeyi kaplamadan önce oksitlerden temizler (nikel kaplama, krom kaplama vb.). Sülfürik asit, patlayıcıların, yapay liflerin, boyaların, plastiklerin ve diğer birçoklarının imalatında kullanılır. Pilleri doldurmak için kullanılır.
Sülfürik asit tuzları önemlidir.
^ Sodyum SülfatNa2S04, sulu çözeltilerden, Glauber tuzu olarak adlandırılan bir Na2S0410H20 hidrat formunda kristalleşir. Tıpta müshil olarak kullanılır. Susuz sodyum sülfat soda ve cam üretiminde kullanılır.
^ Amonyum Sülfat(NH4) 2S04 - azotlu gübre.
Potasyum sülfatK 2 SO 4 - potas gübre.
Kalsiyum sülfat CaS04, doğada alçı minerali CaS04 2H2O formunda bulunur. 150 ° C'ye ısıtıldığında, suyun bir kısmını kaybeder ve yanmış alçı ya da kaymaktaşı olarak adlandırılan bir 2CaSO4H20 hidratına gider. Macunsu bir kütleye su ile karıştığında kaymaktaşı bir süre sonra tekrar sertleşerek CaSO4 2H 2 O.'ya dönüşür. Alçı yapımında yaygın olarak kullanılır (sıva).
^ Magnezyum sülfatMgS04, deniz suyunda bulunur ve acı tadına neden olur. Acı tuz olarak adlandırılan kristal hidrat, bir müshil olarak kullanılır.
kezzap- Metal sülfatların kristal hidratlarının teknik adı Fe, Cu, Zn, Ni, Co (kurutulmuş tuzlar vitriyal değildir). Bakır sülfatCuS04 5H20 mavi bir toksik maddedir. Bitkiler seyreltilmiş bir çözelti ile püskürtülür ve tohumlar ekmeden önce ekilir. Demir vitriolFeS04 7H20 açık yeşil bir maddedir. Bitki zararlılarını, mürekkepleri, mineral boyaları vb. Kontrol etmek için kullanılır. Çinko sülfatZnS04 7H20, mineral mürekkep üretiminde, sittoprechatanii'de, tıpta kullanılır.
^ 4.5. Sülfürik asit esterleri. Sodyum Tiyosülfat
Sülfürik asit esterleri dialkil sülfatları (RO2) S02 içerir. Bunlar yüksek kaynama sıvıları; suda daha az çözünür; alkali varlığında alkol ve sülfürik asit tuzları oluşur. Düşük dialkil sülfatlar alkilleme ajanlarıdır.
Dietil sülfat(C2H5) 2S04. Erime noktası -26 ° С, kaynama noktası 210 ° С, alkollerde çözünür, suda çözünmez. Sülfürik asidin etanol ile reaksiyona sokulması yoluyla elde edilir. Etilleme maddesi organik sentezdedir. Cildi nüfuz eder.
Dimetil sülfat(CH3) 2S04. Erime noktası -26.8 ° С, kaynama noktası 188.5 ° С. Suda, alkolde çözünür, kötü. Çözücü yokluğunda amonyakla reaksiyona girer (patlama ile); Kükürt fenol esterleri gibi bazı aromatik bileşikler. % 60 oleumun metanol ile 150 ° C'de etkileşimi ile elde edilir. Organik sentezde bir metilleme maddesidir. Kanserojen, gözleri, cildi, solunum organlarını etkiler.
^ Sodyum Tiyosülfat Na2S203
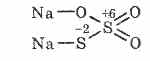
İki kükürt atomunun farklı oksidasyon durumlarına sahip olduğu tiyosülfürik asidin tuzu: 6 ve -2. Suda iyi çözünür kristal madde. Yaygın olarak hiposülfit olarak adlandırılan kristalimsi Na2S203 5H2O formunda bulunur. Sodyum sülfitin kaynama sırasında kükürt ile etkileşimi ile elde edilir:
Na2S03S = Na2S203
Tiyosülfürik asit gibi güçlü bir indirgeyici maddedir, klor ile sülfürik aside kolayca okside olur:
Na2S203 4Cl2 5H20 = 2H2S04 2NaCl6HCl
Sodyum tiosülfatın klor emilimi için kullanımı (ilk gaz maskelerinde) bu reaksiyona dayanıyordu.
Hafifçe farklı oksidasyon sodyum tiyosülfat zayıf oksitleyici ajanlar meydana getirir. Bu, tetrationik asit tuzlarını oluşturur, örneğin:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 0 6 2 Na
Sodyum tiyosülfat, NaHS03, kükürt boyalarının üretiminde, endüstriyel gazların kükürtten arıtılmasında bir yan üründür. Kumaşların ağartılmasından sonra klor izlerini çıkarmak, cevherlerden gümüş elde etmek için kullanılır; fotoğrafçılıkta fiksatif, iyodometride bir reaktif, arsenik bileşiklerle zehirlenmeye karşı bir panzehir, cıva, bir anti-enflamatuar ajandır.
Kimyasal element sülfür VIА grubunda, 3 PSCE periyodunda bulunur. Sülfür atomunun dış elektron katmanında 6 elektron vardır. Oksitleyici ajanın metal ve hidrojen içeren maddelerin oluşumundaki özelliklerini gösteren kükürt, oksidasyon halini -2 alır (2 elektron alır).
Oksijen içeren bileşiklerin bileşiminde, kükürt oksidasyon durumları +4 ve +6 gösterir. Böylece, kükürt oksidasyon durumları -2 ile karakterize edilir; 0; 4; 6.
Doğada, kükürt doğal haliyle ve minerallerin bileşiminde bulunur. Örneğin, sülfür kurşun parlatıcısı (ana bileşen kurşun sülfür PbS'dir) ve bakır parlatıcısı (ana bileşen bakır sülfür Cu2S'dir) içerir.
Sülfür birkaç basit madde oluşturur - allotropik modifikasyonlar. Rhombic sulfur, oda sıcaklığında en kararlıdır (Şekil 1). Bu madde S 8 moleküllerinden oluşur. Rhombic kükürt sarıdır ve + 112.8 ° C sıcaklıkta erir.
Şek. 1. Sülfürün eşkenar dörtgen değiştirilmesi
Isıtıldığında, eşkenar dörtgen kükürt, yavaş yavaş yapışkan koyu kahverengi bir kütleye dönüşür. Bu, kükürt - plastik kükürtün bir başka allotropik modifikasyonudur. Plastik kükürt S n lineer kükürt moleküllerinden oluşur.
Metaller ve hidrojen ile kimyasal reaksiyonlarda kükürt bir oksitleyici ajan rolünü oynar. Oksidasyon derecesi 0'dan -2'ye düşer. Oksijenle reaksiyonda, sülfür, oksidasyon derecesini 0'dan +4'e yükselterek bir indirgeyici madde olarak işlev görür.
Sülfür içeren etkileşimlerden örnekler düşünün.
Sülfür hidrojenle etkileşime girdiğinde, hidrojen sülfür oluşur:
Çinko kükürt ile etkileşime girdiğinde, çinko sülfür oluşur:
Kükürt oksijende kükürt oksit (IV) oluşumuyla yanar (Şek. 2):

Şek. 2. Oksijende yanan kükürt
"-2" oksidasyon durumuna sahip sülfür bileşiklerinin özelliklerini düşünün. Bu tür bileşikler arasında hidrojen sülfit ve sülfitler - hidrojen sülfit asidinin tuzları bulunur.
Hidrojen sülfit çürük yumurta kokusu ile bir gazdır. Havada yanıyor. Ayrıca, oksijen eksikliği ve fazlalığı ile birlikte, yanma farklı şekilde ilerler.
Aşırı oksijen durumunda, hidrojen sülfür yanar ve kükürt oksit (IV) ve su oluşur:
2H2S + 3O2 = 2S02 + 2H2O
Oksijen eksikliği durumunda, hidrojen sülfitin tam yanmaması, kükürtün serbest kalmasıyla oluşur: 2H2S + O2 = 2S + 2H2O
Hidrojen sülfit suda yüksek oranda çözünür. Oluşan çözelti zayıf bir hidrojen sülfür asididir. Hidrojen sülfit tuzları sülfitler olarak adlandırılır. Hidroflorik asit ve suda çözünür sülfitler değişim reaksiyonlarına girerler.
Hidrojen sülfit asit ve bakır (II) klorür etkileşimi, çözünmeyen bakır (II) sülfit ve hidroklorik asit oluşturur: H2S + CuCl2 = CuS + 2HCl.
Potasyum sülfit çinko nitrat ile etkileşime girdiğinde, çinko sülfit çökelir ve potasyum nitrat oluşur: K2S + Zn (N03) 2 = ZnS + 2 KNO3.
Referanslar
- Orzhekovsky P.A. Kimyadaki görev ve alıştırmaların toplanması: 9. sınıf: ders kitabına P.A. Orzhekovsky ve diğerleri. “Kimya. Derece 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M: AST: Astrel, 2007. (s. 91-97)
- Orzhekovsky P.A. Kimya: 9. sınıf: çalışmalar. genel görüntü için. kurdu. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - E: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kimya: 9. sınıf: genel çalışmalar. kurdu. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kimya: neorgan. kimyası. Yetki. Kimya: çalışmalar. 9 cl için. / G.E. Rudzitis, F.G. Feldman. - M: Eğitim, Moskova Ders Kitapları OJSC, 2009.
- Khomchenko kimliği. Lisede kimyadaki görev ve alıştırmaların toplanması. - M.: RIA "Yeni Dalga": Yayımcı Umerenkov, 2008.
- Çocuklar için ansiklopedi. Cilt 17. Kimya / Bölüm. Ed. VA Volodin, Ved. bilimsel. Ed. I. Leenson. - M: Avanta +, 2003.
- Tek bir dijital eğitim kaynakları koleksiyonu (konuyla ilgili video deneyimleri) ().
- "Kimya ve Yaşam" dergisinin elektronik versiyonu ().
ödev
- a. 136 No. 3; s.140 №№ 2-4 ders kitabı P.A. Orzhekovsky "Kimya: 9. sınıf" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M: Astrel, 2013.
sülfürler (lat. kükürt, kükürt - kükürt)
daha fazla elektropozitif elementli sülfür bileşikleri; Hidrojen sülfit asidinin tuzları olarak düşünülebilir (Bkz. Hidrojen sülfit asidi) H2 S. İki C serisi vardır: M 2 S genel formülünün ortalaması (normal) ve M'nin tek değerli bir metal olduğu MHS genel formülünün asidi (hidrosülfürler). C. Alkali metaller renksizdir, suda çözünür. Sulu çözeltileri yüksek oranda hidrolize ve alkalidir. Seyreltik asitlerin etkisiyle H2S yayar. C. Toprak alkali metaller renksizdir, suda az çözünür. H2S nemli havada yayılır Diğer özellikler S. alkali metallerine benzerdir. Hem bunlar hem de diğerleri S. kolayca sülfatlara oksitlenir. C. ağır metaller suda neredeyse çözünmezdir. Neredeyse tamamı siyah veya siyah-kahverengidir (beyaz ZnS, pembemsi MnS, sarı CdS, turuncu-kırmızı Sb 2 S3, sarı SnS2 hariç). C. asitlerin ve C. amonyum eşitsiz oranı kimyasal analizde kullanılır. I.K. Malina.
Büyük Sovyet Ansiklopedisi. - M.: Sovyet Ansiklopedisi. 1969-1978 .
"Sülfitler" in diğer sözlüklerde neler olduğuna bakın:
Metaller ve bazı metaller olmayan kükürt bileşikleri. Metal sülfitler, hidrojen sülfit asit H2S tuzlarıdır: ortam (örneğin, Na2S) ve asidik veya hidrosülfürler (NaHS). Doğal sülfitler yakılarak, demir dışı metaller ve S02 elde edilir. Fosfor sülfitler ve ... Büyük Ansiklopedik Sözlük
Modern Ansiklopedi
sülfürler - SULFIDES, metaller ve bazı metal olmayanlar ile kükürt bileşiklerinin inorganik sülfidleri. Sülfür cevherlerine dahil olanlar; fosfor olarak kullanılır (örneğin, CdS, ZnS). Molibden sülfit, titanyum katı kayganlaştırıcılar. Fosfor sülfitleri ... Resimli Ansiklopedik Sözlük
- (Latin kökenli yeni lat. kükürt sülfür). Oksitlere veya asitlere karşılık gelen, bir miktar kükürt içeren bileşikler. Rus dilinde bulunan yabancı kelimeler sözlüğü. Chudinov, AN, 1910. SULFIDES Novolatinsk., Lat. kükürt, kükürt. Bağlantı ... ... Rus dilinin yabancı kelimelerin sözlüğü
1. Doğal kükürt metalleri ve bazı metal olmayanlar. Kimyasal olarak İlişki, hidrojen sülfit asit H2S tuzları olarak kabul edilir. Çok sayıda element, poli sülfürik asit H2Sx'in tuzları olan sülfürlü polisülfürler oluşturur. Ana ... Jeolojik ansiklopedi
sülfürler - - metaller ve bazı metaller olmayan kükürt bileşikleri; hidrojen sülfit asit H2S'nin metal sülfid tuzları. Beton ve betonarme için terminoloji sözlük. FSUE “SIC“ İnşaat ”NIIZHB ve A. A. Gvozdeva metro istasyonu, Moskova, 2007. 110 s.] ...… Ansiklopedi terimleri, tanımları ve yapı malzemelerinin açıklamaları
SULPHES, s, u sülfür, bir, koca (Spek.). Metallerle ve bazı metal olmayanlarla kükürtün kimyasal bileşikleri. İle organik Doğal s. | adj. sülfit, oh. Sözlük Ozhegova. SI Ozhegov, N.Yu. Shvedova. 1949 1992 ... Sözlük Ozhegova
Sülfitler, R2S (R aromatik radikal), en kolay 6060'a damla damla diazo tuzları çözeltisi eklenerek elde edilir. Brockhaus ve Efron Ansiklopedisi
sülfürler - (1) inorganik kimyada, kükürt atomlarının 2 oksidasyon durumuna sahip olduğu kükürt içeren elementlerin bileşikleri. Kimyasal olarak. ilişki, zayıf hidrojen sülfit asidinin (sulu H2S çözeltisi) tuzları olarak kabul edilir. Birçok S. doğaldır ... ... Büyük Politeknik Ansiklopedisi
s; pl. (birimler sülfit ve; m.). [lat. kükürt kükürt] Chem. Metaller ve bazı metaller olmayan kükürt bileşikleri. C. titanyum. İle organik Doğal s. (mineral sınıfı). F Sülfür, th, oh. Karışık karışımlar ile. Cevher cevherinden. * * * kükürt bileşiklerinin sülfürleri ... Ansiklopedik sözlük
- (Latin kükürt sülfüründen) −2 oksidasyon durumuna sahip metal sülfür (S) ile metal bileşikleri (ve bir dizi metal olmayan B, Si, P, As) olan bir kimyasal bileşik sınıfı. Hidrojen sülfit tuzları olarak kabul edilebilir ... ... Wikipedia
kitaplar
- Phanerozoic, Andrei Borisovich Khalezov'da anlaşmazlık türünün Uranyum yatakları. Uranyum birikintilerinin yapısal ve stratigrafik anlaşmazlık yüzeylerinde paleo-vadisi yapılarına ait özellikleri, Ural bölgesinin üç bölgesinin farklı bölgelerinde…
kükürt - 3. periyodun elemanı ve Periyodik sistemin VIA grubu, seri numarası 16, kalkojenleri. Atomun elektronik formülü [10 Ne] 3s 2 3p 4, karakteristik oksidasyon durumları 0, ‑II, + IV ve + VI, S VI durumunun kararlı olduğu kabul edilir.
Kükürt oksidasyon ölçeği:
Sülfürün elektronegatifliği 2,60'tır, metalik olmayan özelliklerle tanımlanır. Hidrojen ve oksijen bileşiklerinde, çeşitli anyonlarda bulunur, oksijen içeren asitleri ve bunların tuzlarını, ikili bileşikleri oluşturur.
Doğada - onbeşinci kimyasal prevalans elemanı (metal olmayanlar arasında yedinci). Serbest (yerli) ve ilgili formda bulunur. Daha yüksek organizmalar için hayati bir unsur.
Kükürt S. Basit bir madde. Kristal sarı (α-rhombic ve β-monoklinik,
95.5 ° C'de) veya şekilsiz (plastik). Kafes bölgelerinde S 8 molekülleri vardır (düzlemsel olmayan “korona” tipi çevrimler), amorf kükürt Sn zincirlerinden oluşur. Düşük erime noktalı madde, sıvının viskozitesi 200 ° C'da maksimumdan geçer (S 8 moleküllerinin boşluğu, Sn zincirlerinin birbirine geçmesi). Bir çift - molekülde S8, S6, S4, S2. 1500 ° C'de, monoatomik kükürt görünür (basitlik için kimyasal denklemlerde, herhangi bir kükürt S olarak temsil edilir).
Sülfür suda çözülmez ve normal şartlarda onunla reaksiyona girmez, karbon disülfür CS 2 içinde iyi çözünür.
Özellikle toz haline getirilmiş olan kükürt, ısıtıldığında yüksek bir aktiviteye sahiptir. Metalleri ve metalleri olmayan bir oksitleyici madde olarak reaksiyona girer:
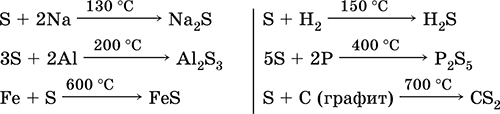
peki ya indirgeyici ajan - Flor, oksijen ve asitlerle (kaynarken):
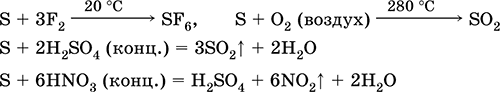
Sülfür alkali çözeltilerde bozulmaya uğrar:
3S 0 + 6KOH (kons.) = 2K2S‑II + K2S IVO3 + 3H2O
Yüksek sıcaklıklarda (400 ° C) kükürt iyotu hidrojen iyodüründen uzaklaştırır:
S + 2НI (g) = I2 + H2S,
fakat çözelti içerisinde reaksiyon tam tersi yönde gider:
I 2 + H 2 S (p) = 2 HI + S ↓
resepsiyon: içinde sanayi Kömür gazlaştırma ürünlerinin kükürt gidermesi sırasında salınan doğal kükürt birikintilerinden (su buharı kullanarak) eritilir.
Sülfür, karbon disülfit, sülfürik asit, sülfür (vat) boyalarının sentezlenmesi, kauçuğun vulkanizasyonunda, bitkilerin külleme karşı korunmasının bir aracı olarak ve cilt hastalıklarının tedavisinde kullanılmaktadır.
Hidrojen sülfit H 2 S. Oksijensiz asit. Boğucu bir kokuya sahip renksiz gaz, havadan ağırdır. Molekül, çift eksik bir tetrahedron yapısına sahiptir [:: S (H) 2]
(sp 3 - hibridizasyon, H - S - H jakı açısı tetrahedral olmaktan uzaktır). 400 ° C'nin üzerinde ısıtıldığında kararsız Suda az çözünür (20 ° C'de 2.6 l / 1 l H20), doymuş bir çözelti desimolardır (0.1 M, “hidrojen sülfit suyu”). Solüsyondaki çok zayıf bir asit, pratikte ikinci aşamada S 2‑ iyonlarına ayrılmaz (maksimum S 2 -1 konsantrasyonu 1-10 mol / l'e eşittir). Havada dururken çözelti bulanıklaşır (inhibitör - sukroz). Tamamen değil, alkaliler tarafından nötralize edilir - amonyak hidrat ile. Güçlü indirgeyici ajan. İyon değiştirme reaksiyonlarına girer. Sülfür ajanı, çok düşük çözünürlüğe sahip farklı renkli sülfidlerin bir çözeltisinden çökeltilir.
Nitel reaksiyonlar - Sülfürlerin tortullaşması, ayrıca H 2 S'nin yanmaması, aleve (soğuk porselen spatula) sokulan soğuk bir cisim üzerinde sarı bir kükürt birikintisinin oluşması. Rafine edilmiş petrol, doğal ve kok fırın gazının yan ürünü.
Analitik bir reaktif olarak kükürt, inorganik ve organik kükürt içeren bileşiklerin üretiminde kullanılır. Son derece zehirli. En önemli reaksiyonların denklemleri:
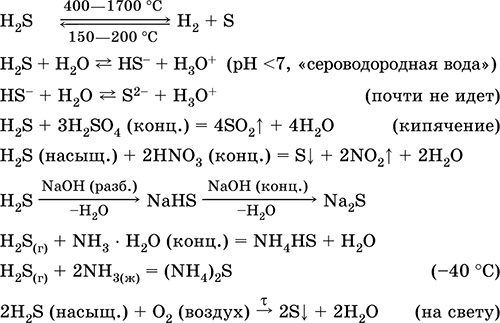

resepsiyon: içinde sanayi - doğrudan sentez:
H2 + S = H 2 S(150–200 ° C)
veya parafin ile kükürt ısıtılarak;
içinde laboratuvar - sülfidlerin güçlü asitlerle yer değiştirmesi
FeS + 2НCl (konsantre) = FeCl2 + H 2 S
veya ikili bileşiklerin tam hidrolizi:
Al 2 S3 + 6H20 = 2Al (OH) 3 ↓ + 3 H 2 S
Sodyum sülfit Na2S Oksijensiz tuz. Beyaz, çok higroskopik. Ayrışma olmadan erir, termal olarak kararlıdır. Anyon ile hidrolize edilmiş suda iyi çözünür, çözeltide oldukça alkali bir ortam oluşturur. Havada dururken çözelti bulanıklaşır (kolloidal kükürt) ve sararır (polisülfit boya). Tipik indirgeyici ajan. Sülfürü ekler. İyon değiştirme reaksiyonlarına girer.
Nitel reaksiyonlar iyonda S 2‑– MnS, FeS, ZnS'nin HC1 (ler) içine ayrıştırıldığı çeşitli renkli metal sülfidlerin biriktirilmesi.
Sülfür boyalarının ve selülozun üretiminde, deri tabaklama sırasında derideki tüylerin giderilmesi için, analitik kimyada bir reaktif olarak kullanılır.
En önemli reaksiyonların denklemleri:
Na2S + 2НCl (dec.) = 2NaCl + H2S
Na2S + 3H2S04 (konsantre) = S02 + S + + 2H20 + 2NaHS04 (50 ° C'ye kadar)
Na2S + 4HNO3 (kons.) = 2NO + S ↓ + 2H2O + 2NaNO3 (60 ° C)
Na2S + H2S (doygun) = 2NaHS
Na2S (t) + 2O2 = Na2S04 (400 ° C'nin üstünde)
Na2S + 4H2O2 (konsantre) = Na2S04 + 4H2O
S2‑ + M2 + = MnS (şirket) ↓; FeS (siyah) ↓; ZnS (beyaz) ↓
S 2‑ + 2Ag + = Ag 2 S (siyah) ↓
S2‑ + M2 + = CdS (sarı) 8; PbS, CuS, HgS (siyah) ↓
3S 2‑ + 2Bi 3+ = Bi 2 S3 (düzeltme - siyah) ↓
3S 2‑ + 6H20 + 2M 3+ = 3H2S + 2M (OH) 3 ↓ (M = Al, Cr)
resepsiyon içinde sanayi - mineral kalsinasyon mirabilit İndirgeyici ajanların varlığında Na2S0410H20:
Na2S04 + 4H2 = Na2S + 4H20 (500 ° C, kat. Fe203)
Na2S04 + 4C (kok) = Na2S + 4CO (800-1000 ° C)
Na2S04 + 4CO = Na2S + 4СO2 (600–700 ° C)
Alüminyum sülfit Al 2 S3. Oksijensiz tuz. Beyaz, Al - S bağı ağırlıklı olarak kovalenttir. N2'nin aşırı basıncı altında ayrışma olmadan erir, kolayca süblime edilir. Kalsine edildiğinde havada okside olur. Suyla tamamen hidrolize, çözeltiden çökelmez. Güçlü asitler tarafından ayrışır. Saf bir saf hidrojen sülfit kaynağı olarak kullanılır. En önemli reaksiyonların denklemleri:
Al 2 S3 + 6H20 = 2Al (OH) 3 ↓ + 3H2S (saf)
Al2S3 + 6НCl (bozunma) = 2AlCl3 + 3H2S
Al2S3 + 24HNO3 (kons.) = Al2 (S04) 3 + 24N02 + 12H20 (100 ° C)
2Al 2 S3 + 9O2 (hava) = 2Al 2 O3 + 6S02 (700–800 ° C)
resepsiyon: alüminyumun oksijen ve nem olmadığında erimiş kükürt ile etkileşimi:
2Al + 3S = AL 2 S 3(150–200 ° C)
Demir (II) sülfit FeS. Oksijensiz tuz. Refrakter, yeşil renk tonu olan siyah ve gri, vakumda ısıtıldığında ayrışır. Islak halde havadaki oksijene karşı hassastır. Suda çözünmez. Demir (II) tuz çözeltilerinin hidrojen sülfit ile doyması üzerine çökelmez. Asitlerle ayrışır. Katı bir hidrojen sülfür kaynağı olan demir üretiminde hammadde olarak kullanılır.
Fe2S3'ün demir (III) bileşimi bileşimi bilinmiyor (alınmadı).
En önemli reaksiyonların denklemleri:
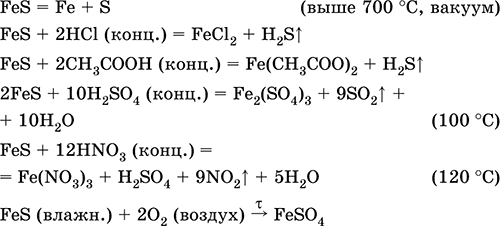
alma:
Fe + S = FeS (600 ° C)
Fe203 + H2 + 2H2S = 9 FeS + 3H20 (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = FeS ↓ + 2NH 4Cl + H2S
Demir disülfür FeS 2. İkili bağlantı Fe 2+ (–S - S–) 2‑ iyonik yapısına sahiptir. Koyu sarı, termal olarak kararlı, ateşleme sırasında ayrışır. Suda çözünmez, seyreltik asit, alkaliler ile reaksiyona girmez. Havada kavrulmuş asit oksitleyici maddeler tarafından ayrıştırılır. Organik sentezde katalizör olan demir, kükürt ve sülfürik asit üretiminde hammadde olarak kullanılır. Doğada - cevher mineralleri pirit ve markazit.
En önemli reaksiyonların denklemleri:
FeS 2 = FeS + S (1170 ° C'nin üstünde, vakum)
2FeS2 + 14H2S04 (konsantre, Dağlar) = Fe2 (SO4) 3 + 15S02 + 14Н20
FeS2 + 18HNO3 (kons.) = Fe (N03) 3 + 2H2S04 + 15NO2 + 7H20
4FeS2 + 11O2 (hava) = 8S02 + 2Fe2O3 (800 ° C, kavurma)
Amonyum hidrosülfür NH4 HS. Oksijensiz asit tuzu. Beyaz, basınç altında erimiş. Son derece uçucu, termal olarak kararsız. Havada okside olur. Suda iyi çözünür, katyon ve anyon ile hidrolize (baskın) bir alkali ortam oluşturur. Çözelti havada sararır. Asitler tarafından ayrıştırılır, doymuş bir çözelti halinde kükürt ekler. Alkaliler nötrleştirilmez, çözeltide orta tuz (NH4) 2S yoktur (orta tuzun elde edilmesi için şartlar için “H2S” başlığına bakın). Fotoğraf geliştiricilerin bir bileşeni olarak, analitik bir reaktif olarak (sülfür çökeltici) kullanılır.
En önemli reaksiyonların denklemleri:
NH4 HS = NH3 + H2S (20 ° C'nin üstünde)
NH4 HS + HC1 (dec.) = NH4CI + H2S
NH4 HS + 3HNO3 (kons.) = S ↓ + 2NO2 + NH4NO3 + 2H20
2NH4 HS (doymuş H2S) + 2CuS04 = (NH4) 2S04 + H2S04 + 2CuS ↓
resepsiyon: konsantre NH3 çözeltisinin hidrojen sülfit ile doygunluğu:
NH3H20 (konsantre) + H2S (g) = NH 4 HS + H20
Analitik kimyada, eşit miktarlarda NH4 HS ve NH3H20 içeren bir çözelti geleneksel olarak (NH4) 2S çözeltisi olarak kabul edilir ve reaksiyon denklemlerinin yazımında ortalama tuz formülü kullanılır, ancak amonyum sülfit suda tamamen NH4 HS ve NH'ye hidrolize edilmesine rağmen 3 H 2 O.
Sülfür dioksit. süifitler
Sülfür dioksit S02. Asit oksit Keskin bir koku ile renksiz gaz. Molekül tamamlanmamış bir üçgenin yapısına sahiptir [: S (0) 2] (sp2 - hibridizasyon), σ, π - S = O bağları içerir. Kolayca sıvılaştırılmış, termal olarak kararlı. Suda çözünür (20 ° C'de ~ 40 l / 1 l H20). Zayıf bir asit özelliklerine, ayrışma ürünlerinin HSO3 - ve S03 2− özelliklerine sahip bir polihidrat oluşturur. Ion HSO 3 - iki tautomerik form var - simetrik (asidik olmayan) karışım içinde baskın olan tetrahedron (sp 3 - hibridizasyon) yapısına sahip olan ve asimetrik (asidik) tamamlanmamış bir tetrahedron yapısı ile [: S (0) 2 (OH)] (sp3 - hibridizasyon). İyon S03-2, aynı zamanda tetrahedraldir [: S (0) 3].
Alkaliler, amonyak hidrat ile reaksiyona girer. Tipik indirgeyici ajan, zayıf oksitleyici ajan.
Nitel reaksiyon - sarı-kahverengi “iyot suyunun” renginin solması. Sülfit ve sülfürik asit üretiminde ara ürün.
Yün, ipek ve samanın ağartılması, meyvelerin saklanması ve saklanması için dezenfektan, antioksidan, soğutucu olarak kullanılır. Toksik.
H2S03 bileşiği (sülfürik asit) bilinmemektedir (mevcut değildir).
En önemli reaksiyonların denklemleri:
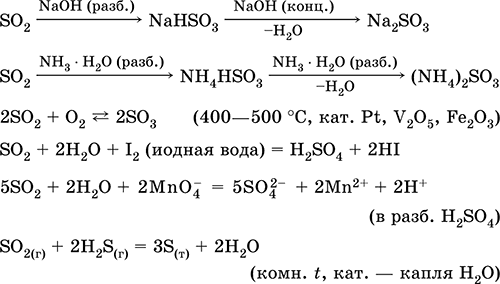
Suda çözünme ve asidik özellikler:
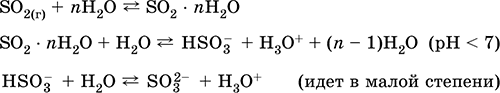
resepsiyonEndüstride - oksijenle zenginleştirilmiş havada sülfürün yakılması ve daha az miktarda sülfid cevherlerinin kavrulması (piritin kavrulması sırasında S02 ile ilişkili gaz):
S + O 2 = SO 2(280–360 ° C)
4FeS 2 + 11O2 = 2Fe2O3 + 8 SO 2(800 ° C, kavurma)
laboratuvarda - sülfitlerin sülfürik asit ile yer değiştirmesi:
BaS03 (t) + H2S04 (konsantre) = BaS04 ↓ + S02 + H20
Sodyum sülfit Na2S03. Oksosol. Beyaz. Havada ısıtıldığında, erime olmadan ayrışır, argon aşırı basıncı altında erir. Islak haldeki ve havadaki oksijene duyarlı çözeltide. Suda çözünür, anyon ile hidrolize edilir. Asitlerle ayrışır. Tipik indirgeyici ajan.
Nitel reaksiyon iyondaki S03-2 - güçlü asitlerle (HC1, HN03) çözeltiye aktarılan beyaz bir baryum sülfit çökeltisinin oluşumu.
Analitik kimyada, fotoğraf çözeltilerinin bir bileşeni, kumaşların ağartılmasında klorin nötrleştiricisi olarak reaktif olarak kullanılır.
En önemli reaksiyonların denklemleri:
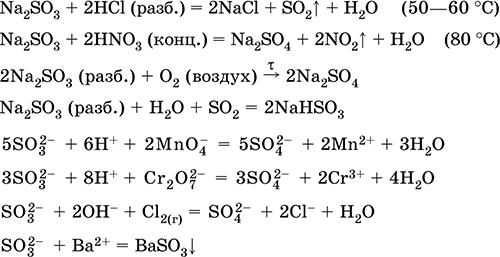
alma:
Na2C03 (konsantre) + S02 = Na2S03 + CO 2
Sülfürik asit sülfatlar
Sülfürik asit H2S04. Oksoik asit Renksiz sıvı, çok viskoz (yağlı), çok higroskopik. Molekül bozuk тет dörtgen yapıya (sp 3 гиб hibridizasyon) sahiptir, kovalent σ - S - OH bağları ve σπ - S = O bağlarını içerir. SO 4 2‑ iyonu doğru - tetrahedral bir yapıya sahiptir. Sıvı halinin geniş bir sıcaklık aralığına sahiptir (~ 300 derece). 296 ° C'nin üzerinde ısıtıldığında kısmen parçalanır. Su ile azeotropik bir karışım halinde damıtılır (asitin kütle oranı% 98,3, kaynama noktası 296–340 ° C'dir), tamamen daha güçlü bir ısıtma ile ayrışır. Su ile sınırsız karışımlar (güçlü exo-effect). Solüsyondaki güçlü asit, alkali ve amonyak hidrat ile nötralize edilir. Metalleri sülfatlara dönüştürür (normal koşullar altında fazla miktarda konsantre asit ile, çözünür hidrosülfatlar oluşur), fakat Be, Bi, Co, Fe, Mg ve Nb metalleri konsantre asitte pasifleştirilir ve bununla reaksiyona girmez. Bazik oksitler ve hidroksitlerle reaksiyona girer, zayıf asitlerin tuzlarını ayrıştırır. Seyreltilmiş bir çözelti içinde zayıf oksitleyici (H1 nedeniyle), güçlü - konsantre bir çözelti içinde (S VI nedeniyle). Kuyu S03'ü çözer ve onunla reaksiyona girer (ağır yağlı bir sıvı oluşur - oleum H20S207 içerir).
Nitel reaksiyon SO 4 2‑ iyon - beyaz baryum sülfat BaS04 çökeltmesi (çökelti, BaS3'ün beyaz çökeltisinin aksine, bir hidroklorik ve nitrik asit çözeltisine dönüştürülmez).
Sülfatlar ve diğer kükürt bileşiklerinin, mineral gübrelerin, patlayıcıların, boyaların ve ilaçların üretiminde, organik sentezde, endüstriyel açıdan önemli cevherlerin ve minerallerin “işlenmesinin ilk aşaması” için, kurşun pillerin elektrolizi olarak petrol ürünlerinin rafine edilmesinde (işlemenin ilk aşaması) kullanılır. . Zehirli, cilt yanmalarına neden olur. En önemli reaksiyonların denklemleri:
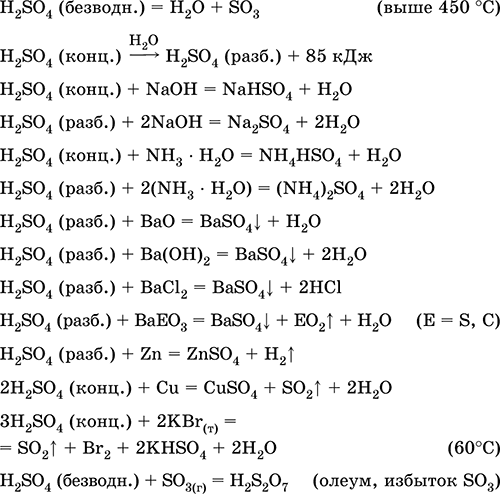
resepsiyon içinde sanayi:
a) S02'nin kükürt, sülfit cevherleri, hidrojen sülfat ve sülfat cevherlerinden sentezi:
S + O 2 (hava) = SO 2(280–360 ° C)
4FeS 2 + 11O2 (hava) = 8 SO 2 + 2Fe203 (800 ° C, kavurma)
2H2S + 3O2 (g) = 2 SO 2 + 2H20 (250–300 ° C)
CaS04 + (kok) = CaO + SO 2 + CO (1300–1500 ° C)
b) temas cihazında S02'nin S03'e dönüşümü:
c) konsantre ve susuz sülfürik asidin sentezi:
H20 (Coll. H2S04) + S03 = H 2 SO 4(konsantre, susuz)
(S02'nin, H2S04 üretimi ile saf su tarafından emilmesi, karışımın kuvvetli bir şekilde ısıtılması ve H2S04'ün ters ayrışması nedeniyle gerçekleştirilmez);
d) sentez oleum - susuz H2S04, disarik asit H2S207 ve aşırı S03 karışımı. Çözünmüş SO3, çelik tanklarda güvenli bir şekilde taşınmasını sağlayan, oleum susuzluğunu (H 2 SO 4 derhal oluşur) oluşturur.
Sodyum sülfat Na2S04. Oksosol. Beyaz, higroskopik. Ayrışma olmadan erir ve kaynar. Kristalimsi hidrat oluşturur (mineral mirabilit) kolayca su kaybetmek; teknik isim Glauber tuzu. Suda çözünür, hidrolize edilmez. H2S04 (konsantre), SO3 ile reaksiyona girer. Hidrojen tarafından restore edildiğinde, ısıtıldığında kokain. İyon değiştirme reaksiyonlarına girer.
İlaç olarak cam, selüloz ve mineral boya üretiminde kullanılır. Tuzlu su tuzlu sularında, özellikle de Hazar Denizi'nin Kara-Boğaz-Körfezi'nde bulunur.
En önemli reaksiyonların denklemleri:
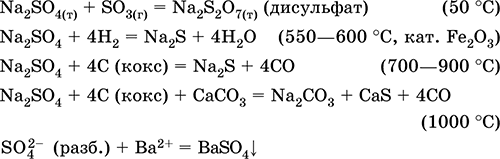
Potasyum hidrosülfat KHS04. Ekşi oksol tuzu. Beyaz, higroskopiktir, fakat kristalin hidratlar oluşturmaz. Isıtıldığında erir ve ayrışır. Suda iyi çözünür, anyon çözeltide ayrışmaya uğrar, çözelti ortamı kuvvetli asittir. Alkaliler tarafından nötralize edilir.
Mineral gübrelerin ayrılmaz bir parçası olan metalurjideki akıların bir bileşeni olarak kullanılır.
En önemli reaksiyonların denklemleri:
2KHS04 = K2S04 + H2S04 (240 ° C'ye kadar)
2KHS04 = K2S207 + H20 (320–340 ° C)
KHS04 (dil.) + KOH (kons.) = K2S04 + H20 KHS04 + KCl = K2S04 + HC1 (450–700 ° C)
6KHSO4 + M203 = 2KM (S04) 2 + 2K2S04 + 3H20 (350–500 ° C, M = Al, Cr)
resepsiyon: soğukta potasyum sülfatın işlenmesi (% 6'dan fazla) sülfürik asit
K2S04 + H2S04 (konsantre) = 2 KHSO 4
Kalsiyum sülfat CaS04. Oksosol. Beyaz, çok higroskopik, refrakter, kalsine edildiğinde ayrışır. Doğal CaSO 4 çok yaygın bir mineral şeklinde bulunur alçıtaşı CaSO 4 2H 2 O. 130 ° C'de, alçı suyun bir kısmını kaybeder ve içine girer. yanmış sıva2CaSO 4 H 2 O (teknik isim Alabaster). Tamamen dehidrate (200 ° C) alçıtaşı mineral cevabını verir anhidritCaS04. Suda az çözünür (20 ° C'de 0.206 g / 100 g H20), çözünürlük ısıtıldığında azalır. H2S04 ile reaksiyona girer (konsantre). Füzyon sırasında kokla kurtarıldı. Tatlı suyun "sabit" sertliğinin çoğunu tanımlar (daha fazla ayrıntı için, bkz. 9.2).
En önemli reaksiyonların denklemleri: 100–128 ° C
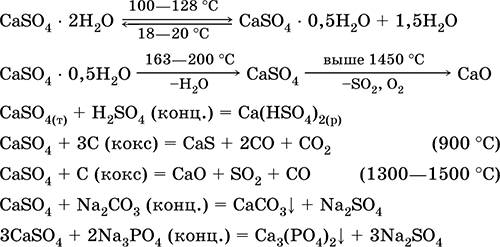
Metalurji akışında kağıt dolgu maddesi olarak SO 2, H2S04 ve (NH4) 2S04 üretiminde hammadde olarak kullanılır. Yanmış alçıdan hazırlanan bağlayıcı harç, Ca (OH) 2 esaslı karışımdan daha hızlı “ayarlanır”. Sertleşme, suyun bağlanması, taş kütlesi şeklinde alçı oluşumu ile sağlanır. Yanmış alçı sıva kalıpları, mimari ve dekoratif form ve ürünleri, bölme duvarları ve panelleri ve taş zeminleri yapmak için kullanılır.
Alüminyum potasyum sülfat KA1 (S04) 2. Çift oksol tuzu. Beyaz, higroskopik. Güçlü ısı ile ayrışır. Kristalimsi hidrat oluşturur - alumina potasyum alum. Suda orta derecede çözünür, alüminyum katyonuyla hidrolize edilir. Alkaliler, amonyak hidrat ile reaksiyona girer.
Boyama kumaşlarında, tabaklama derisinde, tatlı su arıtmasında pıhtılaştırıcı, kağıt boyutlandırma bileşimlerinin bir bileşeni ve tıpta ve kozmetikte dış hemostatik bir ajan olarak kullanılır. Alüminyum ve potasyum sülfatların birlikte kristalleştirilmesiyle oluşur.
En önemli reaksiyonların denklemleri:
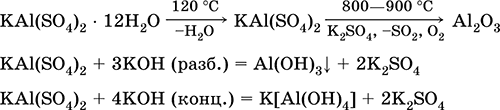
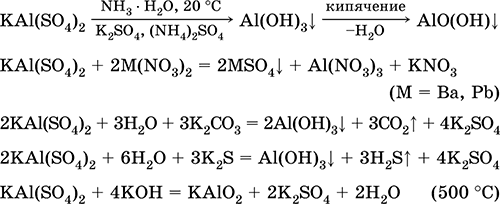
Krom (III) sülfat - potasyum KCr (S04) 2. Çift oksol tuzu. Kırmızı (koyu mor hidrat, teknik isim potasyum şap). Isıtıldığında erime olmadan ayrışır. Suda kolayca çözünür (çözeltinin gri-mavi rengi aquacomplex 3+'ye karşılık gelir), krom (III) katyonuyla hidrolize edilir. Alkaliler, amonyak hidrat ile reaksiyona girer. Zayıf oksitleyici ve indirgeyici ajan. İyon değiştirme reaksiyonlarına girer.
Nitel reaksiyonlar Cr3 + iyonuna - Cr2 + 'ya indirgenme veya sarı CrO4 2‑ ye oksidasyon.
Deride tabaklama maddesi olarak kullanılır, boyama kumaşlarında mordan, fotoğrafta reaktif olarak kullanılır. Krom (III) ve potasyum sülfatların birlikte kristalleştirilmesiyle oluşur. En önemli reaksiyonların denklemleri:
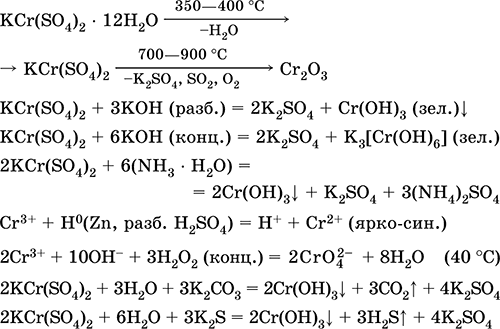
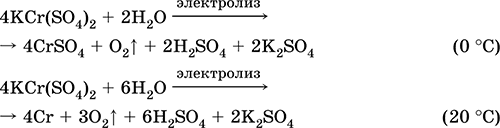
Manganez (II) sülfat MnS04. Oksosol. Beyaz, kalsine edildiğinde erir ve ayrışır. Kristal hidrat MnSO 4 5H20 - kırmızı - pembe, teknik isim manganez vitriol. Suda çözünür, çözeltinin açık pembe (neredeyse renksiz) rengi aquacomplex 2 + 'ya karşılık gelir; katyon ile hidrolize edilmiştir. Alkaliler, amonyak hidrat ile reaksiyona girer. Zayıf indirgeme ajanı, tipik (güçlü) oksitleyici ajanlarla reaksiyona girer.
Nitel reaksiyonlar Mn 2+ iyonuna - MnO4 iyonuna sahip bir iletkenlik ve ikincisinin menekşe renginin kaybolması, Mn2 + 'nin MnO4'e oksidasyonu ve menekşe renginin görünümü.
Mikro besin ve analitik reaktif olarak Mn, Mn02 ve diğer manganez bileşiklerini elde etmek için kullanılır.
En önemli reaksiyonların denklemleri:
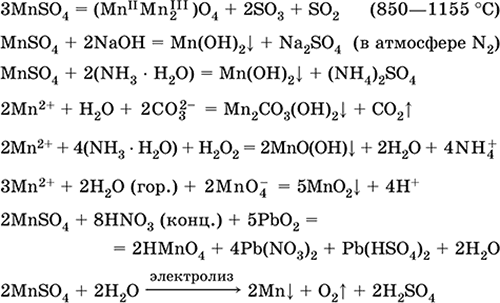
alma:
2Mn02 + 2H2S04 (konsantre) = 2 MnS04 + 02 + 2H2O (100 ° C)
Demir (II) sülfat FeS04. Oksosol. Beyaz (hidrat açık yeşil, teknik isim demir vitriol),higroskopik. Isıtıldığında ayrışır. Suda çözünür, az miktarda katyonla hidrolize edilir. Çözelti içerisinde havadaki oksijen ile hızlı bir şekilde oksitlenir (çözelti sararır ve bulanıklaşır). Asit oksitleyici maddeler, alkaliler, amonyak hidrat ile reaksiyona girer. Tipik indirgeyici ajan.
Mineral boyaların, elektrolizle elektrolitlerin, odun koruyucu, fungisit, anti-anemi ilaçlarının bir bileşeni olarak kullanılır. Laboratuvarda daha sık çift tuz olarak alınır Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( tuz mora) havaya daha dayanıklı.
En önemli reaksiyonların denklemleri:
![]()
alma:
Fe + H2S04 (dec) = FeS04+ H 2
FeCO3 + H2S04 (par.) = FeS04 + C02 + H20
7.4. VA grubu metal olmayan
Azot. amonyak
azot - 2. dönemin bir elemanı ve VA - Periyodik sistemin grubu, seri numarası 7. Atomik elektron formülü [2 He] 2s 2 2p 3, karakteristik oksidasyon durumları 0, –III, + III ve + V, daha az + II, + IV ve vb.; N v durumu nispeten kararlı olarak kabul edilir.
Azot oksidasyon ölçeği:
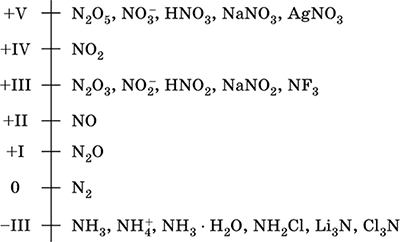
Azotun yüksek elektronegatifliği (3.07) vardır, F ve O'dan sonra üçüncü. Metalik olmayan (asidik) tipik özellikler gösterir. Amonyum katyon NH4 + ve bunun tuzlarının yanı sıra, çeşitli oksijen içeren asitleri, tuzları ve ikili bileşikleri oluşturur.
Doğada - on yedinci kimyasal prevalans elemanı (metal olmayanlar arasında dokuzuncu). Tüm organizmalar için hayati bir unsur.
Azot N2. Basit bir madde. Çok kararlı σππ - bağ N ≡ N olan polar olmayan moleküllerden oluşur, bu normal koşullar altında azotun kimyasal etkisizliğini açıklar. Renksiz bir sıvıda yoğunlaşan renksiz, kokusuz bir gaz (02'den farklı olarak).
Havanın ana bileşeni: hacimce% 78.09, ağırlıkça% 75.52. Sıvı havadan azot oksijen O 2 'nin üzerine kaynamaktadır. Suda az çözünür (20 ° C'de 15.4 ml / 1 H20), azotun çözünürlüğü oksijenden daha azdır.
Oda sıcaklığında, N2 sadece lityumla (nemli bir atmosferde) reaksiyona girerek, lityum nitrür Li3N'yi oluşturur, diğer elementlerin nitritleri güçlü ısıtma ile sentezlenir:
N2 + 3Mg = Mg3N2 (800 ° C)
Bir elektrik boşalmasında N 2, flor ile ve çok az miktarda oksijenle reaksiyona girer:
Amonyak üretmek için tersinir bir reaksiyon, 500 ° C'de, 350 atm'ye kadar basınç altında ve zorunlu olarak bir katalizör varlığında (Pt laboratuarında Fe / F203 / FeO) gerçekleştirilir:
Le Chatelier prensibine göre, basınçta bir artış ve sıcaklıkta bir düşüş ile amonyak veriminde bir artış meydana gelmelidir. Bununla birlikte, düşük sıcaklıklarda reaksiyon hızı çok düşüktür, bu yüzden işlem 450-500 ° C'de gerçekleştirilir ve% 15'lik bir amonyak verimine ulaşılır. Reaksiyona girmemiş N2 ve H2 reaktöre geri döner ve böylece reaksiyon derecesini arttırır.
Nitrojen asit ve bazlara göre kimyasal olarak pasiftir, yanmayı desteklemez.
resepsiyon içinde sanayi - sıvı havanın fraksiyonel damıtılması ya da oksijenin kimyasal yollarla, örneğin 2C (kok) + 02 = 2CO reaksiyonu ile ısıtılarak uzaklaştırılması. Bu durumlarda, asil gazların (çoğunlukla argon) safsızlıklarını içeren azot üretilir.
laboratuvar ılımlı ısıtma ile bir kombinasyon reaksiyonu ile az miktarda kimyasal olarak saf azot elde edilebilir:
N‑III H4N IIIO2 (t) = N2 0 + 2H2O (60–70 ° C)
NH4C1 (p) + KN02 (p) = N2 + + KCl + 2H20 (100 ° C)
Amonyak, nitrik asit ve diğer azot içeren ürünlerin sentezi için kimyasal ve metalurjik işlemler ve yanıcı maddelerin depolanması için atıl bir ortam olarak kullanılır.
Amonyak NH3. İkili bileşik, azotun oksidasyon derecesi - III. Keskin karakteristik kokulu renksiz gaz. Molekül, tamamlanmamış bir tetrahedron [: N (H) 3)] (sp 3 гиб-hibridizasyon) yapısına sahiptir. Bir sp3 - hibrit orbitalde bir elektron donör çiftinin NH3 molekülünde azot varlığı, bir katyon oluşumu ile hidrojen katyonunun karakteristik bir ilave reaksiyonuna neden olur amonyum NH4 +. Oda sıcaklığında basınç altında sıvılaştırıldı. Sıvı halde hidrojen bağları nedeniyle ilişkilidir. Termal olarak kararsız. Suda çözünür (20 ° C'de 700 l / 1 l H20); doymuş çözeltideki oran, kütle olarak =% 34 ve hacimce =% 99, pH = 11.8'dir.
Yüksek derecede reaktif, ilave reaksiyonlara meyillidir. Oksijende ortaya çıkar, asitlerle reaksiyona girer. İndirgeme (N ‑III nedeniyle) ve oksitleyici (H I nedeniyle) özellikleri gösterir. Sadece kalsiyum oksitle kurutulur.
Nitel reaksiyonlar - Gaz HC1 ile temas halinde beyaz "duman" oluşması, Hg 2 (NO 3) 2 çözeltisiyle nemlendirilmiş kağıdın kararması.
HN03 ve amonyum tuzlarının sentezinde ara ürün. Soda, azotlu gübreler, boyalar, patlayıcıların imalatında kullanılır; Sıvı amonyak bir soğutucudur. Toksik.
En önemli reaksiyonların denklemleri:
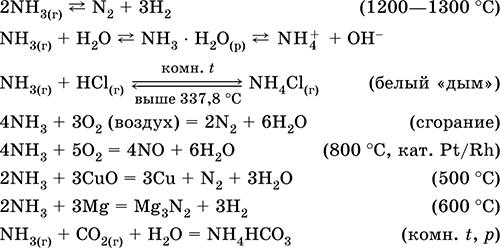
resepsiyon: içinde laboratuvar - amonyağın, soda kireçle (NaOH + CaO) ısıtıldığında amonyum tuzlarından ayrılması:
veya sulu bir amonyak çözeltisinin kaynatılması, ardından gazın kurutulması.
sanayi amonyak azottan (bakınız) hidrojen ile sentezlenir. Endüstri tarafından teknik olarak adlandırılmış bir şekilde sıvılaştırılmış biçimde veya konsantre bir sulu çözelti halinde üretilir amonyak suyu
Amonyak Hidrat NH3H2O Moleküller arası bileşik. Beyaz, kristal kafesinde NH3 ve H20 molekülleri olup, zayıf bir hidrojen bağı H3N ... HON ile bağlanır. Zayıf bir baz olan sulu bir amonyak çözeltisinde bulunur (ayrışma ürünleri - katyon NH4 - ve anyon OH -). Amonyum katyon düzenli olarak π-tetrahedral bir yapıya sahiptir (sp 3 - hibridizasyon). Termal olarak kararsız, tamamen çözelti kaynatılarak ayrıştırılır. Güçlü asitlerle nötralize edilir. Konsantre bir çözelti içerisinde indirgeme özelliklerini (N III nedeniyle) gösterir. İyon değişimi ve kompleksleşme reaksiyonuna girer.
Nitel reaksiyon - gaz HC1 ile temas halinde beyaz "duman" oluşumu.
Amfoterik hidroksitlerin çökeltilmesi sırasında çözeltide zayıf bir alkali ortam oluşturmak için kullanılır.
İM amonyak çözeltisi esas olarak NH3H20 hidratı ve sadece% 0.4 NH4 + ve OH iyonlarını içerir (hidratın ayrışmasından dolayı); bu nedenle, iyonik “amonyum hidroksit NH40H” pratik olarak çözeltide bulunmaz, katı hidratta böyle bir bileşik yoktur. En önemli reaksiyonların denklemleri:
NH3H20 (konsantre) = NH3 + H20 (NaOH ile kaynama)
NH3H20 + HC1 (bozunma) = NH4CI + H20
3 (NH3H20) (konsantre) + CrC13 = Cr (OH) 3 ↓ + 3NH4C1
8 (NH3H20) (konsantre) + ЗBr2 (p) = N2 + 6NH4Br + 8H20 (40–50 ° C)
2 (NH3H20) (konsantre) + 2KMnO4 = N2 + 2MnO2 ↓ + 4H2O + 2KON
4 (NH3H20) (konsantre) + Ag 2 O = 2OH + 3H20
4 (NH3H20) (konsantre) + Cu (OH) 2 + (OH) 2 + 4H20
6 (NH3H20) (konsantre) + NiCl2 = Cl2 + 6H20
Seyreltilmiş amonyak çözeltisine (% 3-10 - - süre) genellikle denir sıvı amonyak (isim simyacılar tarafından icat edildi) ve konsantre çözelti (% 18,5–25) amonyak suyu (sanayi tarafından üretilen).
