Spoluki sirki. Hapat e ujit të oksiduar në sfond. Formula me gjysmë-sirki. Syrka. Sirvoden. sulfide
Sirka, її autoritetet fizike dhe kimike. Kuptimi biologjik i syrki, її zasosuvannya (demerkurizimi).
Squfuri në natyrë
sirka amtare
PbS - blisk plumbi
Cu 2 S- mesnate blisk
ZnS - përzierje zinku
FeS 2 - pirit, pirit, ari kotya
H 2 S- ujë sir (në xherel mineral dhe gaz natyror)
CaSO 4 * 2H2 O- ijet
MgSO 4 * 7H2 O- girka sil (anglisht)
Na 2 SO 4 * 10 H 2 O- glauber's sil (mirabilite)
Fuqia fizike
Fjalimi i ngurtë kristalor me të njëjtën ngjyrë, i pathyeshëm pranë ujit, uji nuk laget (lundron në sipërfaqe), t ° bale = 445 ° С.
Një nga fuqitë e veçanta fizike të sirkës -flotacionMirësia e pluhurit që bashkon ujin, i cili është kristale të shkëlqyera për t'u fundosur pranë ujit. Në të djathtë, aty ku uji nuk zhytet në ujë, grimcat priten në sipërfaqen e ujit dhe llamba të tjera u ngjiten nga rakhunok.Fuqia e ligësisë kur shikon farat vendase nga shtëpitë. Xeherori është i cekët, i përmbytur me ujë dhe nga poshtë e nxjerrin erërat, një spërkatje uji dhe shtëpitë mbushen me ujë në fund.alotropia
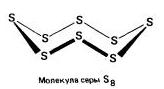
Për serki, ekziston një spërkatje karakteristike e modifikimeve alotropike, ale nibilsh vіdomі vidosmіni:rombike (kristalor) , monoklinë(Holchasta) і plastike .
Rombike (a - сірка) - S 8
t ° pl. = 113 ° C; ρ = 2,07 g / cm 3. Modifikimi më i mirë i mundshëm.
Monoclinna (b - sirka) - S 8
koka me ngjyrë të errët, t ° pl. = 119 ° C; ρ = 1,96 g / cm3. Biftek në temperatura deri në 96 ° С; me mendje të mprehta, do të shndërrohet në romb.
Plastike S n
masë si çamçakëz kafe (amorfe). Nestiyka, kur të ngurtësohet, do të kthehet në një diamant.
HEQJA E PLASTIKES
Budova atomi i sirkës
Shpërndarja e elektronikës sipas niveleve dhe nënniveleve
kampi kryesor
1s 2 2s 2 2p 6 3s 2 3p 4
Shpërndarja e elektronikës nga
orbitale (top pushimi)hap
të oksiduaravalencë
Në kampin kryesor
Perche zbujeniy stan
Një tjetër zbujeniy stan
otrimannya sіrki
1. Metoda Promisloviy - viplavlenya nga minerali për një bast shtesë uji.
2. Ujë i paoksiduar plotësisht (me aciditet jo acid).
2H 2 S + O 2 = 2S + 2H 2 O
3. Reagimi i Wackenroder
2H 2 S + SO 2 = 3S + 2H 2 O
Kimia e fuqisë së botës
Сірка - oksidues S 0 + 2ē→ S -2 | sirka - zyrtari kryesor: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Vzaєmodia sіrki sipërdorni me metale të harlisura dhe me tokëzim, të mesëm, merkuri, siblompa ngrohje: 2 Na + S→ Na 2 S DOSVID S + Hg = HgS Mërkuri është i paqëndrueshëm. Її bast otruynі. Reagimi Tsya qëndron në bazën e merkurit vizual dhe magnetik, për shembull, nga një termometër mjekësor i prishur. Mіstya, sepse nuk është e mundur të përdoret një grimcë merkur, të spërkatet me një pluhur sіrki. Syrka dhe merkuri hyjnë në një reagim kur mbyllen. Rezultati është një fjalim i pacipë, jo inteligjent dhe jo i mërzitshëm. I gjithë procesi quhet demerkurizim 2. Vzaєmodiya sіrkic me metalet më të vogla (krim Au, Pt) në t ° të rregullueshme: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS DOSVID Cu + S t
→
CuS DOSVID 3. Vzaєmodia sіrki zdeyakim jometalet për deklarata binarny spoluk: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Vzaєmodіya sіrki me kisnem: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Vzaєmodiya sіrkic halogjenet (me përjashtim të jodit): S + Cl 2→ S +2 Cl 2 ** Vzaєmodiya sirki zacide - agjentë oksidues: S + 2H 2 SO 4 (konc)→ 3S +4 O 2 + 2H 2 O S + 6HNO 3 (konc)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Reagime joproporcionale: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
gjiri
Vullkanizimi i gomës, refuzimi i ebonitit, fshirja e sirnikëve, baruti, në luftë me nxënësit e shkollës së qeverisë Silskoy, për qëllime mjekësore (pomada sirchan për eliminimin e fëmijëve nga sëmundjet, etj.), Për refuzimin e acideve.
Faqja zavdannyaparagrafi 21; ana e djathtë 1, 3, 4. 99-100.
dodatkovі zkhadanіya
Përfundoni reaksionet standarde, f Vendosni performancën duke përdorur metodën e bilancit elektronik, duke përfshirë një oksidues, një pararendës.
# 2. Zdіysnіt rishikim prapa skemës:
Tse tsikavo ...
- Në vend të sirki në trupin e njerëzve me peshë 70 kg - 140 g.
- Njerëzit Dobu kanë nevojë për 1 g sirka.
- Bizele të gjelbra bagati, maja, plastikë, grurë, mish, riba, fruta dhe mango sic.
- Syrka duhet të hyjë në magazinë e hormoneve, vitaminave, bilks, të fituar є në indet kërc, në flokë, të mprehta. Kur ka mungesë ndjesie në trup, mungon mprehtësia e netëve dhe kisteve, rënia e flokëve.
Gëzoni shëndetin tuaj!Chi ju e dini vi ..
- Spoluki sirki mund të shërbejë si drogë;
- Сірка është bazë e pomadës për trajtimin e sëmundjeve mykotike të shkirit, për luftimin e zgjebes. Tiosulfati i natriumit Na 2 S 2 O 3 fitimtar për të luftuar për të.
- Shumë kripëra të acidit klorhidrik dhe për të tretur ujin e kristalizimit: ZnSO 4 × 7H 2 O і CuSO 4 × 5H 2 O. Їх zasosovuyut jak përdoret antiseptik për zbutjen e roslin dhe shtypjen e grurit në luftën me nxënësit e shkollës së qeverisë Silskoy.
- Zalizny vitriol FeSO 4 × 7H 2 O vicoristov me anemi.
- BaSO 4 zasosovyat në doza roentgenografike të slunk і të zorrëve.
- Alumokalіevі galun KAI (SO 4) 2 × 12 H 2 O - rritje gjaku-kurrizore në porozitet.
- Minerali Na 2 SO 4 × 10 H 2 Unë do ta quaja "fuqia e Glauber" për nder të kimistit glaukoz të Glauber I.R. Aspak, por slunker ishte krijuar për t'u pranuar. Një nga banorët e qytetit e ka dërguar në Xherel. Yak tilki vin vipiv një shishe me ujë të kripur, menjëherë dheu po njomet. Glauber arriti në ujë, pastaj u kristalizua me Na 2 SO 4 × 10H 2 O. Infektimi її zasosovyat jak bartet në mjekësi, me pëlhura letre pambuku farbuvannі. Mund ta gjeni edhe në vyrobnitsvі skla.
- Pemët mund të lëvizin ndërtimin e tokës me gjelbërimin dhe të stimulojnë elementin argjilë me vesat e varura.
- Chasnik vidіlyaє rechovinu - albucid Fjalimi Tsya për t'u sëmurë, besimi për të moshuarit, mposhtja e zemrave për t'u sëmurë.
Grupi i kalkogjeneve përfshin sirka - një numër elementësh të tjerë, si një numër i madh i gjinive xeherore. Sulfatet, sulfidet, oksidet dhe spolucet janë edhe më të gjera, të rëndësishme në industri dhe natyrë. Për këtë, në të dhënat e statistikave, është e qartë, si era e keqe që troket, por është vetë sirka, dhe e folura është e thjeshtë.
Karakteristikat e Syrka dhe її
Elementi danez mund të gjendet edhe në sistemin periodik.
- Grupi Shosta, kreu i grupit.
- Periudha e tretë Maliy.
- Masa atomike - 32.064.
- Numri serial është 16, protonet dhe elektronet e stilit, neutronet janë gjithashtu 16.
- Pranohet te elementet jometalike.
- Formulat lexohen, jak "es", emri i elementit është sirka, latinisht squfur.
Në natyrë, ekzistojnë izotope të qëndrueshme chotiri me numra masiv 32.33.34 dhe 36. Danimarka është elementi më i mirë për zgjerim në natyrë. Prezantoni elementët biogjenë, në mënyrë që të hyjnë në depozitën e molekulave të rëndësishme organike.
Atomi i elektronës budova
Spoluks e craws janë të lidhur me shkathtësinë e tyre me veçoritë e buxhetit elektronik të atomit. Vono kthe formulën e konfigurimit fyes: 1s 2 2s 2 2p 6 3s 2 3p 4.
Renditja shfaqet kur instalohet mulliri i palëvizshëm. Megjithatë, duket se nëse atomi duket se ka fuqi shtesë, atëherë është e mundur që elektronet të ndahen në paralele 3p dhe 3s, me një kalim të mëtejshëm në 3d, i cili duket se është i vlefshëm. Si rezultat, ndryshimi nuk është vetëm në valencën e atomit, por në të gjitha fazat e mundshme të oksidimit. Është numri i kuptimeve që duhet rritur, pra është numri i fjalëve për pjesëmarrjen e syrkës.
Hapat e ujit të oksiduar gjatë ditës
Ju mund të shihni disa nga opsionet kryesore për këtë tregues. Për sіrki tse:
Ndër to, zhvillimi më i rrallë është S +2, dhe ato janë të kuq kudo. Nga faza e ujit të oksiduar në fund për të depozituar aktivitetin kimik dhe shëndetin oksidativ të të gjithë të folurit. Kështu, për shembull, z'єднання з -2 - tse sulfidi. Ata kanë një element tipik oksidues.
Chim është niveli i dukshëm i oksidimit në mjedis, me shëndet oksidativ më të rrotullueshëm si rezultat i volodya rechovina. Është e lehtë që një tsiom të kthehet, nëse jepen dy acide bazë, të cilët do të vendosin syrkën:
- H2SO3 - sirchista;
- H 2 SO 4 - sirchana.
Me sa duket, pjesa tjetër është më e qëndrueshme, më e fortë, sa më e lartë të jetë përqendrimi, edhe më serioz ndaj oksidimit.
bisedë e thjeshtë
Yak fjalim i thjeshtë sirka është një kristal i bukur i të njëjtit lloj forme të gjallë. Nëse dua vetëm një nga format, atëherë ekzistojnë dy parime themelore të të folurit. Persha, monoclinna ose rombike - tse і zhovte është e papërshtatshme për razchinyatsya pranë ujit, dhe privuar në shitësit organike. Shihni qartësinë dhe formën e bukur të strukturës, të paraqitur nga kurora. Temperatura e shkrirjes - afër 110 0 С.
Nëse nuk e humbisni momentin e ndërmjetëm kur ngarkohen modifikime të tilla, atëherë mund të evoluoni menjëherë kampin e turpshëm - sirku plastik. Vona është një ngjyrë kafe viskoze e ngjashme me çamçakëzin, e cila, kur nxehet ose ftohtë shumë ftohtë, do të kthehet përsëri në një formë diamanti.
Nëse flisni për sirkën e pastër kimikisht, me vonesën e filtrimit të bagatorazit, atëherë ja ku keni, ka kristale shumë të vogla, tendencë dhe parregullsi të pashpirt në ujë. Zdatnі kujdesuni për kontaktin me vologo dhe kisnіy povіtrya. Kam shumë aktivitet kimi.

Njohuri në natyrë
Në natyrë, ekziston një gjini natyrore, nga e cila ka gjysmakë, dhe në vetvete është një fjalë e thjeshtë. Përveç kësaj, nuk ka nevojë të hakmerret:
- në minerale, xehe dhe xehe;
- në organizmat e tvarin, roslin dhe njerëzit, kështu që si të hyni në depon e molekulave organike;
- në gazet natyrore, naftën dhe naftën;
- në shist argjilor nafte dhe ujëra natyrore.
Ju mund të emërtoni një numër të vogël minatorësh që janë në listë:
- kinovar;
- pirit;
- sfaleriti;
- kundër parasë;
- galena dhe іnshі.
Ekziston një pjesë e madhe e stinëve të fituara të vitit në sirchanokysl virobnitstvo. Një pjesë tjetër është fitimtare për qëllime mjekësore, qeveria Silskoe, proceset industriale dhe praktika e të folurit.
Fuqia fizike
Їх mund të përshkruhet në disa pika.
- Në ujë nuk është rozchinnaya, në disulfid karboni ose terpentinë - është mirë të shkosh.
- Me një grirë të parëndësishme, unë grumbulloj një ngarkesë negative.
- Temperatura e shkrirjes bëhet 110 0 С.
- Temperatura e vlimit 190 0 С.
- Kur arrin 300 0 C, ajo shkon në vijën e kurrizit, është e lehtë të shembet.
- Thjesht, karburantet e pushtetit që marrin vetë hua janë edhe më të mira.
- Në vetvete, era praktikisht nuk është e lehtë, megjithatë, uji dhe gjysmë ëmbëlsirat shohin një erë të mprehtë të vezëve të kalbura. Pra, vetë, si dhe përfaqësuesit binar të ngjashëm me gazin deyaki.
Fuqia fizike e fjalimit të dhënë të Bully është parë nga njerëzit për një kohë të gjatë. Vetë për djegshmërinë e saj sіrka і mori emrin kështu. Në vikorisovyvuvuyu avujt mbytës dhe avullues, pasi ato formohen në vapën e ditës, si kundër armiqve. Për më tepër, aciditeti është gjithashtu më i rëndësishëm se vlera e çuditshme për fatin e vajit.

Autoritetet e gëzuara
Tema: "Syrka dhe її spoluky" në kursin shkollor në kimi huazimi nuk është një mësim, por një kilka. Aje їkh duzhe bagato. Do të shpjegohet me kiminë e këtij fjalimi. Ju mund të tregoni fuqinë e oksidimit me më shumë të dyshuar të fortë (metal, bor dhe іnshі), si dhe me më shumë jometale.
Megjithatë, atyre nuk u intereson një aktivitet i tillë, vetëm me fluorin në lidhje me çdo lloj zgjuarsie. Kërkohet ngrohje për të gjitha. Është e mundur të identifikohen një sërë kategorish të të folurit, me të cilat ekziston një lidhje midis sa vijon:
- hodhi;
- jometale;
- livadhe;
- acide të forta oksiduese - syrkana dhe nitrik.
Spoluki sirki: raznovodi
Shkathtësia e tyre do të shpjegohet me vlerat e pabarabarta të fazës së oksidimit të elementit kryesor - sirka. Pra, ju mund të shihni disa nga llojet kryesore të fjalimeve për shumë familjaritet:
- z'єднання Зі faza e oksidimit -2;
Nëse shikoni klasën, dhe jo një tregues të valencës, atëherë elementi i dhënë do të rregullojë molekula të tilla, si:
- acid;
- oksid;
- kripë;
- binarni spoluces me jometale (sirkovuglets, kloride);
- të folurit organik.
Tani mund të shihni ato kryesore prej tyre dhe të vendosni gishtin mbi to.

Rekovini me hap oksidimi -2
Spoluki sirki 2 - tse її konformacione me metale, si dhe me:
- në qymyr;
- humbasim;
- fosfor;
- silikon;
- mish'yak;
- bor.
Në cich vipadkah, ato shfaqen në rolin e një agjenti oksidues, pasi të gjithë elementët janë më pozitiv elektrik. Është veçanërisht e rëndësishme t'i shohësh ato.
- Сірковуглец - CS 2. Prozora rіdina me një aromë karakteristike receptive të efіru. Є toksike, në flakë dhe të folur vibuhaє. Vikoristovuyutsya jak razchinnik, dhe për një numër të madh të llojeve të vajrave, yndyrave, jometaleve, nitrateve të mesme, rrëshirave dhe gomave. Ekziston gjithashtu një pjesë e rëndësishme e virobnitetit të shtresës së pjesës - viskoziteti. Premtimet sintetizohen në numër të madh.
- Uji sulfur ose sulfur ujë - H 2 S. Gaz, i cili nuk mund të ngurtësohet dhe jamball për shije. Era është e athët, në buzë e papranueshme, një vezë e kalbur. Otruyny, çoi qendrën dyshal, kështu jak po'yazu іoni mіdі. Për këtë, kur ai është i prerë, ka frymë dhe vdekje. Përdoret gjerësisht në mjekësi, sintezën organike, sintezën e acidit organik, si dhe në cilësinë e siruvinës së dukshme energjikisht.
- Sulfidi i metaleve përdoret gjerësisht në mjekësi, në alkoolin sulfat, farmaceutikët e hedhur poshtë, në luminoforet e përgatitura dhe në minj të tjerë. Formula fillestare është Me x S y.

Z'єднання Zі hapi i oksidimit +4
Spoluks e sirki 4 - oksidi më i rëndësishëm dhe kripërat dhe acidet e lidhura me to. E gjithë erë e keqe duhet të mbushet me thumba të gjera, të cilat mund të jenë më domethënëse në industri. Mund të duket se ka oksidim dhe më shpesh shfaq fuqi të re.
Formulat me gjysmë kokrrizë me një hap oksidimi +4 hapa:
- oksid - gaz i pastër SO 2;
- acid - H2SO3 i pastër;
- soli mund të më japë formulën Me x (SO 3) y.
Një nga є ose anhidridet më të njohura. Vera është një fjalim bezbarvina, me erë volodya të syrnik fytit. Në blerjet e mëdha, është e lehtë të nuhatet kur ka vullkane.
Është e lehtë të dekompozohet në ujë nga zgjidhja e acidit dhe sirchistoy. Për t'u udhëhequr, si një kripë tipike, në të cilën për të hyrë në viglyadi sulfit-jon SO 3 2-. Anhidridi Tsey është gazi kryesor, i cili futet në pengimin e atmosferës detare. Vetë vera derdhet në dritë.
З'єднання, në të cilën në hapat gri oksidohet +6
Për një pranim të tillë, i pari për gjithçka, është shprehja e anhidridit dhe acidit sirchana me kripërat e tij:
- sulfate;
- hidrosulfate.
Pra, pasi atomi i sirkës në to gjendet në një gjendje jashtëzakonisht të oksiduar, atëherë fuqia e ciçit është plotësisht zero. Erë e keqe është e fortë oksiduese.
Oksidi Serki (VI) - anhidridi sirchaniy - është një ridin i paqëndrueshëm jo shterpë. Karakteristikë e orizit - aftësia e fortë e thithjes së lagështirës. Dimit mbi një bazë të hapur. Kur shpërndahet në ujë, jepni një nga acidet minerale më të forta - sirchan. Përqendrimet e dallimeve її rіdinoy rëndësishme vajore, pak përtypëse. Nëse ka anhidrid në tretësirën e acidit sirkanoik, atëherë ai do të jetë veçanërisht i njohur, i quajtur oleum. Fitoni vikorystvutsya në industri me acid virobnitstvі.
Kripërat sered - sulfate - vlera e madhe maє tilla spoluki, jak:
- ijet CaSO 4 2H 2 O;
- barit BaSO 4;
- mirabilite;
- sulfat plumbi dhe inshі.
Ka erë si ruajtje në biznes, sinteza kimike, mjekësi, pajisje të përgatitura optike dhe syze dhe për të gjetur industrinë ushqimore.
Hidrosulfati dihet se përdoret gjerësisht në metalurgji; Dhe gjithashtu vetë era e keqe do të ndihmojë në shndërrimin e shumë oksideve të palosshme në forma të ndryshme sulfate, në mënyrë që të mund të gjenden në lloje të ndryshme.
Vivchennya sirki në kursin shkollor të kimisë
Nëse është më e bukur të mësosh njohuritë për ata që janë gjithashtu sirka, siç është fuqia e pushtetit, cila është vepra e sirkës? Klasa e 9-të - periudha më e bukur. Nuk është vetë veshi, pasi gjithçka është e re dhe e qetë për fëmijët. Mesi është në shkencën e kimisë vivchenna, nëse themelet, të hedhura më herët, do të më ndihmojnë të kuptoj temën. Tom, për të parë ushqimin, shih mikun e klasës. Në të njëjtën kohë, e gjithë tema shtrihet në një numër blloqesh, në disa okremos ka një mësim "С'єднання сірки. Klasa e 9-të".
Do t'i shpjegohet numrit të njerëzve. Është gjithashtu një ide e mirë të shikoni ushqimin në lidhje me vitaminat dhe mineralet në industri. Në përgjithësi, tema do të prezantohet në 3 vitet e mesme.
Dhe boshti i rrushit duhet të grihet në vivchennya vetëm në klasën e 10-të, nëse organizmat shikojnë ushqimin. Po kështu do të prishet era e keqe e biologjisë në gjimnaz. Adzhe sirka për të hyrë në magazinë e molekulave të tilla organike, të tilla si:
- thiospirti (Mercaptani);
- bіlki (struktura e tretinit, në të cilën shfaqet forma e disulfidit mіstkіv);
- tioaldegidiv;
- tiofenole;
- tioefiri;
- acidet sulfonike;
- sulfoksid dhe іnshі.
Їх shih në një grup të veçantë të organosulfurit z'єdnan. Era mund të jetë më e rëndësishme jo vetëm në proceset biologjike të gjallesave, por edhe në industri. Për shembull, acidet sulfonike janë baza e shumë ilaçeve (aspirina, sulfanilamid ose streptocidi).
Për më tepër, ekziston një komponent i përhershëm i gjërave të tilla si veprimet:
- aminoacidet;
- fermenton;
- vitamina;
- hormonet.
Në temperaturën e dhomës, uji hyn në reaksion vetëm me merkur. Me rregullimin e temperaturës, aktiviteti rritet ndjeshëm. Kur nxehet, sirka reagon pa mes me fraza të thjeshta, pas një vinite gazesh të brendshme, azotit, selenit, telurit, ari, platinit, iridiumit dhe jodit. Sulfidi azoti dhe ari hiqen në mënyrë indirekte.
Angazhimi me metalet
Fuqia e oksiduar e Syrka viyavlya, si rezultat i ndërveprimit të sulfiteve:
Vzaєmodia me ujë funksionon në 150-200 ° С:
H 2 + S = H 2 S.
Vzaєmodiya z kisnem
Uji digjet në acid në 280 ° C, në kthesë në 360 ° C, në të cilin vendoset një shumë e oksideve:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Kombinim me fosfor dhe qymyr
Kur nxehet pa akses në energji, uji reagon me fosfor, karbon, duke treguar fuqi oksidimi:
2P + 3S = P 2 S 3;
Kombinimi me fluorin
Në prani të agjentëve të fortë oksidues, manifestohet fuqia e mëposhtme:
S + 3F 2 = SF 6.
Vzaєmodiya me fjalë të palosshme
Kur ndërlidhet me fjalët e palosshme të syrkës, është si plumbi:
S + 2HNO 3 = 2NO + H 2 SO 4.
disproporcioni i reagimit
Syrka është e mirë për reaksione joproporcionale, kur vendosen ndërveprime me livadhin, sulfide dhe sulfate:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. otrimannya sіrki
Xeheroret vendase
Kur nxehet pa akses në ushqim
FeS 2 = FeS + S.
Oksidimi i ujit në rast të mungesës së aciditetit
2H 2 S + O 2 = 2S + 2H 2 O.
Nga gazi për të hyrë në furrat metalurgjike dhe të koksit, kur nxehet në prani të katalizatorit
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. sirvodden
Vodneve z'єdnannya sirki - sirvodden H 2 S ... Sirevodn është një z'єdnannya kovalente. Molekulat janë analoge me ato të molekulave të ujit, atomi i ujit ndodhet në fazën e hibridizimit sp 3, por molekulat e ujit nuk i pranojnë molekulat e ujit. Atomi i syrkut është më pak negativ elektrik, sa më i ulët të jetë atomi i thartë, sa më i vogël të jetë madhësia, aq më pak ngarkesa, aq më pak ngarkesa. Prerja e valencës HSH bëhet 91,1 °, dhe brezi H - S bëhet 0,133 nm.
Fuqia fizike
Me mendje ekstravagante, sirvodden është një gaz pa gaz, me një erë të fortë karakteristike të vezëve të kalbura. T pl = -86 ° C, T bale = -60 ° C, e kalbur në ujë, në 20 ° C në 100 g ujë, tretet 2,58 ml H 2 S. Edhe nëse thithet, mund të çojë në një rezultat fatal. Në natyrë, dikush sheh në magazinat e gazeve vullkanike, vendoset në gjirin e organizmave në rritje dhe të gjallë. Zgjidhje e mirë në ujë, kur punoj, do të rregulloj një acid klorhidrik të dobët.
Autoritetet e gëzuara
Zgjidhja e ujit ka një fuqi të dobët të acidit dibazik:
H2S = HS - + H +;
HS - = S 2 + H +.
Sire ujë për të djegur në povitri blakitnym gjysmë të mëngjesit. Në rast të aksesit të ndërlidhur, krijohet një certifikatë e vlefshme:
2H 2 S + O 2 = 2H 2 O + 2S.
Me akses dërrmues në vatrën e vatrës, uji duhet të prodhohet përpara miratimit të oksidit të vajit (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
Sirkhoven është në gjendje të japë fuqi. Depozitat e ujit mund të oksidohen në tretësirë uji në ujë të thatë, gaz të pastër dhe acid sulfurik.
Për shembull, uji me brom in vitro:
H 2 S + Br 2 = 2HBr + S.
shkëmbimi me ujin me klor:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Një rrjedhë uji mund të lëshohet, vikoriteti dhe oksidi i plumbit, kështu që reagimi i super ujit mund të çojë në lloje të mëdha të nxehtësisë:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Vzaєmodia sіrvodnyu sіrchistim gaz vikoristovuyutsya për heqjen e sirkut nga gazrat, për të hyrë në virobniztva të acidit metalurgjik dhe sirkanik:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Procesi zsim lidhi ndriçimin e sirkës vendase gjatë proceseve vullkanike.
Me një rrjedhë një-orëshe të gazit të pastër dhe ujit nëpër livadh, vendoset tiosulfati:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Me mendjen normale, uji është një gaz pa elemë dhe madje toksik me një erë karakteristike të vezëve të kalbura.
Për yogo otrymannya në mendjet laboratorike, duhet të shtoni acid klorhidrik të holluar në sulfide:
Mënyra e parë për të hequr ujin nga uji me shtimin e ujit të ftohtë në sulfur alumini:
Sirvodin, duke u prerë në këtë mënyrë, është më e qartë.
Sirevodn është një z'єdnannya kovalente. Molekulat Yogo mund të fshehin një strukturë, të ngjashme me strukturat e molekulave të plumbit (Div. Rozd. 2.2). Megjithatë, nga pamja e molekulave të ujit, molekulat e ujit nuk përputhen me tingujt ujorë. Në të djathtë në atë, atomi i gri është më pak negativ elektrik, atomi i poshtëm është i thartë, ale ka madhësi më të madhe. Kjo është arsyeja pse atomi i ujit mund të jetë më pak i fuqishëm se ngarkesa, jo atomi është i thartë. Përmes dukshmërisë së lidhjeve të ujit, ul temperaturën e ujit, ul ujin. Dukshmëria e tingujve të ujit në ujë do t'i shpjegojë të njëjtën gjë bastardit ndryshimin në ujë.
Zgjidhja e ujit ka një fuqi të dobët të acidit dibazik:
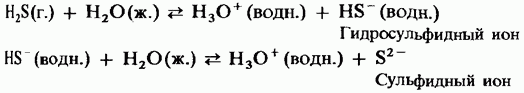
Uji do të digjet në gjysmë-masa të errëta. Kur ka një hyrje të afërt me zjarrin, uji mbikëqyret për të parë vizionin e zjarrit, pasi ai kondensohet në sipërfaqen e ftohtë të oborrit:
Me akses dërrmues në furrë, uji duhet të prodhohet përpara miratimit të dioksidit të squfurit:
Sirkhoven është në gjendje të japë fuqi. Për shembull, vera nga uji me barium brom dhe i rinovueshëm prej tyre në jone
Kloruri është një acid dybazik që mund të përdoret për dy seri kripërash - sulfide dhe hidrosulfide (div. Vishçe). Sulfidet e metaleve të huaja mund të gjenden pranë ujit me anë të tretësirave. Rezultati i hidrolizës:
Sulfidet jo shkatërruese të metaleve të tjera mund të precipitohen nga tretësirat ujore të kripërave të këtyre metaleve, duke kaluar nëpër një dalje uji. Për shembull, nëse uji kalon përmes hendekut, atëherë ata mund të hakmerren për një rrethim të zi ndaj sulfurit
Reagimi është fitimtar në cilësinë e një testi analitik për ujin.
oksidet e sirkit
Sierka miratoi një numër oksidesh, nga të cilat më të rëndësishmet janë dy: dioksidi i sirkut dhe trioksidi i sirkës.
Dioksidi i squfurit është një gaz pa alkool, pa alkool me një erë të fortë mbytëse. Në mendjet laboratorike, është e mundur të hiqet, duke e djegur në një lloj ose në acid, duke shtuar hollime të ngrohta të variacioneve të acidit në një kripë josulfite ose duke ngrohur acidin e koncentruar nga mesi:
Serum dioksid-oksid acid. Është e lehtë të dallohet nga uji, i mbushur me acid sirchisty. Acidi jonizohet më rrallë dhe, për më tepër, është një acid i dobët:
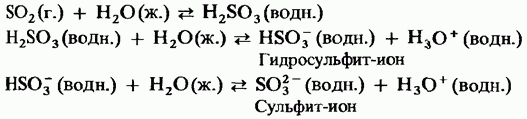
Kur dioksidi i squfurit i ngjashëm me gazin kalohet përmes tretësirës së hidroksidit të natriumit, krijohet sulfiti i natriumit. Sulfiti i natriumit, duke reaguar me dioksidin e tepërt të squfurit, duke vendosur hidrosulfitin e natriumit në një reagim analog me dioksidin e karbonit në ujin e gazuar.
І dioksidi i squfurit i ngjashëm me gazin, і tretësirat me bazë uji ¢ kushërinjtë. Për shembull, hidroksidi i gaztë i natriumit është një oksid nga një tretësirë sulfati dhe një acid i pastër shtohet-jon në një jon.
Dioksidi i squfurit në mbetjet industriale distilohet gjatë vipalyuvanny në disa xehe sulfide dhe vicioz si një produkt i ndërmjetëm në procesin e heqjes së acidit sirkanoik (Div. Kapitulli 7). Dioksidi i grurit ruhet në industrinë e celulozës, për heqjen e pëlhurave, si dhe për përpunimin e frutave dhe perimeve në rast të zberiganës së parëndësishme.
Dioksidi i squfurit është shumë i rëndësishëm në atmosferën e bllokuar dhe veçanërisht në ndriçimin e pllakave acidike. Në atmosferë, vera oksidohet në trioksid squfuri:
Me mendje normale, procesi kundërveprohet herë pas here, por në prani të katalizatorit është e mundur të largohet, ndoshta përpara se të përdoret në procesin e kontaktit të heqjes së acidit. Sasi të vogla kripe dhe mangani, të cilat mund të gjenden në atmosferë, bëjnë të mundur katalizimin e dioksidit të squfurit të oksiduar. Trioksidi gri reagon me ndihmën e alkoolit, dhe për këtë arsye shfaqen të kuqtë, pasi janë tableta acid (Div. Sozh Ch. 12).
Trioksidi i ngurtë i squfurit është polimorfik. Dy format navazhlivish E para prej tyre është një trimer me strukturë ciklike (Fig. 15.24, a); kristalet e shikimit. mє strukturë polimerike aciklike (Fig. 15.24, b); E mrekullueshme në pamjen e kristaleve të zhveshura. Temperatura e shkrirjes. Në prani të vologut, hap pas hapi shndërrohet në formë Obidvi për të zier në 45 ° C. Avulli i trioksidit të avullit ruhet në molekula planare të izoluara simetrike.
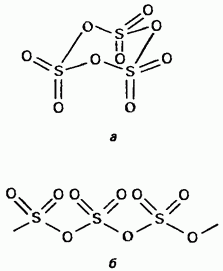
I vogël. 15.24. Syrky trioxide, Struktura aciklike, b - Struktura aciklike.
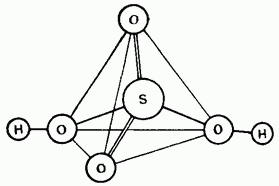
I vogël. 15.25. Struktura e një molekule të acidit sirkanoik.
Në lavamanet laboratorike, trioksidi i squfurit shpërndahet me sulfat të nxehtë
Trioksidi i ujit mund të jetë shumë acid. Vera reagon në mënyrë ekzotermike me ujin, duke e kthyer acidin:
Trioksidi Syrka është një agjent i fortë oksidues. Për shembull, vera oksidon hidrogjen bromin në hidrogjen brom.
Acidi Sircana
Acidi Sirchana është një acid vajor shterpë i ridinës. Çmimi është një nga produktet kimike industriale më të rëndësishme. Її promislova іtrimannya për procesin e kontaktit shtesë і stasosuvannya përshkruhet në kap. 7.
Acidi sirkan i paholluar është një zgjidhje kovalente. Molekulat mund të jenë budov tetraedral (Fig. 15.25).
Acidi Syrchana të ziejë dhe dekompozohet në 340 ° С,
Temperatura e pikës së vlimit është e lartë dhe viskoziteti i acidit klorhidrik është i lartë;
Acidi Syrchana është një acid dibazik i fortë. Në ujë, uji do të rritet, dhe jonet hidrosulfate dhe sulfate janë miratuar:
Acidi Syrchana kujdeset për fatin e të gjitha reaksioneve karakteristike të acideve. Vona reagon me metale, duke tretur sulfatet e metaleve dhe të ujit, në reaksionet me karbonate, duke tretur sulfatet, dioksidet në karbon dhe ujë, dhe në reaksionet me lidhjet dhe livadhet, duke siguruar sulfate ose hidrosulfate.
Acidi i koncentruar i syrkanit reagon më dhunshëm me ujin. Për hir të arsyes, duhet të shtoni acid sirchan duke e derdhur në ujë, jo navpaki. Acidi është higroskopik, d.m.th. Kjo її vikoristovuyut për tharjen e gazrave, pasi nuk reagojnë me të, duke kaluar їkh përmes acidit sіrchan. Përqindja e acidit sulfurik ndaj ujit dhe veshjes është e madhe, por acidi sulfurik mund të shërbejë si një agjent dehidratues; për çdo acid sirkanoik të koncentruar:
Kristalet e bardha në sulfat pentahidrat konvertojnë sulfat anhidër
në karbohidratet, për shembull saharoza, karbonizohen:
Papieri mund të karbonizohet me një kombinim të acidit organik të përqendruar, i cili grumbullohet me një dozë acidi në fibra celuloze;
etanoli shndërrohet në etilen:
(Dehidratimi i etanolit me ndihmën e acidit organik, i cili duhet të kryhet nën kontroll
mendjet, për të prodhuar etoksietan (eter dietik) deri në miratim, dhe reagimi të jetë fitimtar për eliminimin e etoksietanit në shkallë industriale);
shuma e klorobenzenit dhe trikloretanalit (kloral) i nënshtrohet dehidrimit (ndarja 16.3).
Acidi i koncentruar sirkan është një agjent i fortë oksidues. Fitoi metale oksiduese dhe jometale. meqe ra fjala
Yak іnshі prapanicë, si іnstruyuyut fuqia e oksidimit të acidit sіrkanoik të përqendruar, gjithashtu jonet e oksiduar në ionіv, si dhe bromid-ionіv deri në brom në reaksionet e fillimit:
Nareshty, acidi sirchan vikorizohet si një agjent sulfonues në kiminë organike (div. Ch. 17).
Sulfatet, sulfatet dhe tiospolucet
Sulfati-jon ka një strukturë tetraedrale, të ngjashme me strukturën e një molekule të acidit sulfurik.
Soli. Sulfati pranohet në reaksionet e acidit sirkanoik të holluar me metale, okside, hidrokside dhe karbonate. Për një bar sulfat vere dhe іnshі sulfat roschinnі në ujë. Sulfati i kalciumit nuk është shumë i fortë në ujë. Sulfati trazojini biftekët përpara ngrohjes. Vinnyts në të gjithë shumëllojshmërinë e zaliza sulfati. Për shembull, sulfati, kur nxehet, depozitohet me oksidin e aprovuar të kripës:
Për rikuperimin e joneve sulfate në çfarëdo mënyre, shtoni presionin e ujit në barin e klorurit. Nëse ka prova të joneve sulfate në paraprakisht, si rezultat, vendosja e një rrethimi kundër sulfat bari do të bëhet:
Sulfati mund të jetë shumë i rëndësishëm në zasosuvan. Për shembull, sulfati i magnezit (anglisht sil, girka sil) përdoret për gërryerjen e lumenjve Vibukhovy, për përgatitjen e sirnikëve dhe pëlhurave të papërshkueshme nga zjarri. Nasicheni razchin tsієї soli vikoristovutsya në praktikën mjekësore si një protivopalny zasіb.
Tiosulfati i natriumit mund të shihet si një analog i sulfatit të natriumit, në të cilin një atom zëvendësohet me një atom squfuri. Midis fëmijëve të Tіospoluka, ata do të dalin me një gjë - tiocyanat kaliyu. Vin është një analog i kaliumit cianat. Tіocyanat kalіyu mund të hidhet, duke bashkuar cyanіd kalіyu me sіrkoyu:
Tiocyanat kaliyu vikoristovuyutsya në yak_sіanіnіy kalіy për të prodhuar para fillimit të shtrembër
Përsëri, përsërisni përsëri!
1. Kur kaloni në pjesën e poshtme të kategorisë VI të cilësisë, elementët gradualisht ndryshojnë nga jometalike në metalike.
2. Elementet e grupit VI mund të fshehin ndërtesën me ujë dhe metale reaksionare, duke krijuar skenën në të cilën erë e keqe mund të ketë hapa të oksiduar -2.
3. Kisen është shumë elektronegativ dhe fuqi oksiduese e fortë.
4. Ozoni është edhe më fort oksidues, më pak acid.
5. Kisen ka një rol jashtëzakonisht të rëndësishëm në sistemet biologjike;
6. Kisen miratohet me spoluk të vegjël të spolocave binarny, okside të llojeve të ndryshme:

7. Peroksidi i ujit është një agjent i fortë oksidues.
8. Syrka në viglyadi gjendet në forma decilkohe enantiotropike.
9. Për refuzimin e ujit nga ngarkesat e tokës, procesi i Frashit ngec, në këtë rast është e vështirë të ngecesh dhe të nxehet avulli.
10. Сірка do të vendosë spoluks, në të cilat ka në kampe me nivele oksidimi +2, +4, +6 dhe -2.
11. Sirwater është një acid dibazik i dobët dhe mbizotërues.
12. Dioksidi i gaztë i squfurit dhe tretësirat me bazë uji.
13. Trioksidi i ujit mund të jetë fort acid dhe i oksiduar.
14. Acidi Syrchana është një acid dibazik i fortë, agjent tharës, agjent dehidratues dhe agjent i fortë oksidues.
15. Molekulat e acidit klorhidrik dhe sulfat-jonit mund të kenë një strukturë tetraedrale.