Хүхрийн нэгдэл. Химийн нэгдлүүдийн исэлдлийн зэрэг. Хүхрийн нэгдлүүдийн томъёо. Хүхрийн. Устөрөгчийн сульфид. Сульфид
Хүхэр, түүний бие махбодь химийн шинж чанар. Хүхрийн биологийн үнэ цэнэ, түүний хэрэглээ (диплуршуулалт).
Кера байгалийн шинж чанар
Байгалийн хүхэр
PbS - Хар тугалга
Cu 2 сек - зэсийн гэрэл гэгээ
ZnS - цайрын хольц
Fes 2 - пирит, хүхрийн пирит, муурны алт
H 2 сек - хүхэрт сульфид (ашигт малтмалын эх үүсвэр ба байгалийн хий)
CaSO 4 * 2H2 О- гипс
MgSO 4 * 7H2 О - гашуун давс (англи хэл дээр)
Na 2 SO 4 * 10 H 2 O - Glauber-ийн давс (mirabilite)
Физик шинж чанар
Хатуу талст бодис нь шар өнгөтэй, усанд уусдаггүй, усаар (гадаргуу дээр хөвж), t ° kip = 445 ° С байна.
Онцгой нэг физик шинж чанар хүхрийн -флотаци, нарийн ширхэгтэй хүхрийн нунтаг нь хөвөх чадвартай, дараа нь том талстууд нь усанд живж байдаг. Үнэндээ бол хүхэр усаар норгохгүй бөгөөд тэдгээрийн дагалдсан жижиг бөмбөлгүүдийн улмаас усны гадаргууд наалддаг байна.Энэ өмч нь уугуул хүхрийн хольцоос бохирдоход ашиглагддаг. Хүдрийг усаар дүүргээд усаар дүүргээд агаараас хүхрийг хөвж, доромжилж үлдэх болно.Allotropy
Хүхэрт хэд хэдэн янзаар өөрчлөгдөж байдаг., Гэхдээ хамгийн алдартай өөрчлөлтүүд нь:rhombic (талст) , monoclinic (зүү) болон хуванцар .
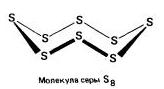
Rhombic (а - хүхэр) - S 8
t ° pl. = 113 ° C; ρ = 2.07 г / см3. Хамгийн тогтвортой өөрчлөлт.
Моноклиник (б - хүхэр) - S 8
хар шар өнгийн зүүt ° pl. = 119 ° C; ρ = 1.96 г / см3. 96 ° С-ийн температурт тогтвортой байх; хэвийн нөхцөлд ромбой болж хувирдаг.
Хуванцар S n
хүрэн гөлгөр (аморф) масс. Хатуулгийг римбо болгон хувиргахад тогтворгүй болдог.
PLASTIC SULFUR үйлдвэрлэл
Хүхрийн атомын бүтэц
Электроныг түвшин ба дэд түвшинд байрлуулах
Газрын төлөв байдал
1s 2 2s 2 2p 6 3s 2 3p 4
Электрон байрлалаар
тойрог зам (сүүлчийн давхарга)Зэрэг
исэлдэлтВаленс
Үндсэн нөхцөлд
Эхний сэтгэл хөдөлсөн байдал
Хоёр дахь сэтгэл догдлом байдал
Хүхрийн үйлдвэрлэл
1. Аж үйлдвэрийн арга - Усны уураар хүдрээс хайлуулах.
2. Устөрөгчийн сульфидын дутуу исэлдүүлэлт (хүчилтөрөгч дутагдалтай).
2H 2 S + O 2 = 2S + 2H 2 O
3. Wackenroder-ийн урвал
2H 2 S + SO 2 = 3S + 2H 2 O
Хүхрийн химийн шинж чанарууд
Хүхрийн хүч нь исэлдүүлэгч бодис юм S 0 + 2ē→ S -2 | Хүхрийн - бууруулах агент: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Хүхрийн харилцан үйлчлэл хамтбүх шүлтийн болон шүлтийн газрын металл, зэс, мөнгөн ус, мөнгө Халаалтгүй бол: 2 Na + S→ Na 2 S Туршлага S + Hg = HgS Мөнгөн ус өндөр хэлбэлзэлтэй байдаг. Түүний хосууд хортой байдаг. Энэ урвал нь мөнгөн усыг зайлуулах, устгах, жишээ нь, эвдэрсэн эмнэлгийн термометрээс хамаарна. Мөнгөн усны дуслыг олборлох боломжгүй газрууд нь хүхрийн нунтагаар бүрхэгдсэн байдаг. Хүхрийн ба мөнгөн ус нь хүрэхэд хариу үйлдэл үзүүлдэг. Үүний үр дүнд химийн идэвхгүй, хоргүй бодис үүсдэг. Энэ процессыг устгалт гэж нэрлэдэг. 2. Хүхрийн харилцан үйлчлэлc бусад метал (бусадAu, Pt) дээш өргөгдсөн: 2Ал + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS EXPERIENCE Cu + S t
→
CuS туршлага 3. Сульфурын харилцан үйлчлэл үүсэх зарим металл бус хоёртын нэгдлүүд: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Хүчилтөрөгч хүхрийн харилцан үйлчлэл: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Хүхрийн харилцан үйлчлэлc halogens (иодоос бусад): S + Cl 2→ S +2 Cl 2 ** Хүхрийн харилцан үйлчлэл Хүчиллэгүүд - исэлдүүлэгч бодисууд: S + 2H 2 SO 4 (conc)→ 3S + 4 O 2 + 2H 2 O S + 6HNO 3 (conc)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Хувь нэмэр болох урвал: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
Програм
Резин вулканжих, ebonite авах, тэмцээн, буу нунтаглах, хөдөө аж ахуйн хортон шавьжтай тэмцэхэд эрүүл мэндийн зорилгоор (арьсны өвчний эмчилгээний хүхрийн тос), хүхрийн хүчил авах гэх мэт.
Гэрийн даалгавардогол мөр 21; дасгал 1, 3, 4 х. 99-100.
Нэмэлт дүнгүүд
Урвалын тэгшитгэлийг бөглөнө, х коэффициентыг электрон балансын аргаар тохируулах, исэлдүүлэгч бодис, бууруулагч бодисыг зааж өгнө.
№2. Схемийн дагуу шилжүүлгийг хийх:
Энэ бол сонирхолтой ...
- Хүний биеийн хүхрийн агууламж 70 кг жинтэй - 140 гр.
- Хүнд өдөрт 1 г хүхэр хэрэгтэй.
- Цавуул, шош, овъёос, улаан буудай, мах, загас, жимс жимсгэнэ, манго жимсний шүүс нь хүхэр ихтэй байдаг.
- Хүхэр нь гормон, витамин, уураг, мөгөөрсний эд, үс, хадаасны нэг хэсэг юм. Хүний биед хүхэрлэг дутагдалтай тул хадаас, яс, үс унах нь эмзэг байдаг.
Эрүүл мэндээ ажигла!Та мэдэх үү ..
- Хүхрийн нэгдэл нь мансууруулах үйлчилгээтэй байж болно;
- Хүхрийн - мөөгөнцрийн арьсны өвчнийг эмчлэхэд зориулж тосыг хусах, хамуутай өвчнийг эмчлэхэд хэрэглэдэг. Натрийн тиосульфат Na 2 S 2 O 3 Үүнтэй тэмцэхийн тулд ашигладаг.
- Хүхрийн хүчилд агуулагдах олон давс нь талсжсан ус агуулдаг: ZnSO 4 × 7H 2 О, CuSO 4 × 5H 2 А. Эдгээр нь шүрших, таримал ургамлын эсрэг бодис болгон ашиглаж, хөдөө аж ахуйн хортон шавьжтай тэмцэхэд үр тариа тарихад хэрэглэдэг.
- Төмрийн vitriol FeSO 4 × 7H 2 O нь цус багадалтанд ашиглагддаг.
- BaSO 4 ходоод, гэдэсний шинжилгээнд ашигладаг.
- Хөнгөн цагаан калийн хөнгөн KAI (SO 4) 2 × 12H 2 O - зүсэлттэйгээр hemostatic.
- Ашигт малтмал Na 2 SO 4 × 10H 2 А.Глауберерийн давс гэж нэрлэгддэг Германы химич Гладубер И. Гладуберийг VIII зууны үед олж илрүүлсэн бөгөөд гэнэтийн аялалаа алджээ. Тэр юу ч идэж чадахгүй, гэдэс нь идэхээс татгалзав. Орон нутгийн нэг нь түүнийг эх сурвалж руу илгээсэн. Тэрбээр гашуун давстай усыг уучихаад тэр даруй идэж эхлэв. Glauber энэ усыг судлав. 2 SO 4 × 10H 2 А. Одоо энэ нь анагаах ухаанд хэрэглэдэг laxative, хөвөн даавуугаар будахад ашиглагддаг. Давс нь шил үйлдвэрлэхэд ашигладаг.
- Yarrow хөрсөөс хүхрийг гаргаж авах чадвартай, хөрсний ургамлуудтай энэ элементийг шингээх чадварыг нэмэгдүүлдэг.
- Сармис нь бодисын солилцоо, идэмхий хүхэр үүсгэдэг бодис юм. Энэ бодис нь хорт хавдраас урьдчилан сэргийлж, хөгшрөлтийг удаашруулдаг.
Чалкогений дэд бүлэг нь хүхрийн агууламжтай байдаг. Энэ нь хүдрийн ордуудаас бүрдэх элементүүдийн хоёр дахь нь юм. Сульфат, сульфид, исэл болон бусад хүхрийн нэгдлүүд нь үйлдвэрлэл, байгаль орчинд чухал ач холбогдолтой. Тиймээс энэ зүйлд бид юу байна, хүхэр гэж юу вэ, энгийн бодис гэж үздэг.
Хүхэр ба түүний шинж чанар
Энэ элемент нь үечилсэн систем дэх дараах байрлалыг агуулна.
- Зургаа дахь бүлгийн гол хэсэг.
- Гурав дахь жижиг хугацаа.
- Атомын масс 32.064 байна.
- Дарааллын дугаар 16, протон ба электронуудын тоо ижил, 16 нейтрон байна.
- Метал бус элементүүдийг харуулдаг.
- Томъёо "элемент", элементийн хүхрийн нэр, латины хүхэр гэсэн нэрийг уншдаг.
Байгаль дээр 32,33,34 ба 36-р масстай дөрвөн тогтвортой изотопууд байдаг. Энэ элемент нь байгальд хамгийн элбэг зургаа дахь нь юм. Гэж үзнэ шим тэжээл, чухал органик молекулуудын нэг хэсэг юм.
Атомын электрон бүтэц
Хүхрийн нэгдэл нь атомын цахим бүтцийн онцлог шинж чанарыг өөртөө агуулдаг. Энэ нь дараах тохируулгын томъёогоор илэрхийлнэ: 1s 2 2s 2 2p 6 3s 2 3p 4.
Дээрх процедур нь зөвхөн элементийн тогтмол төлөвийг тусгадаг. Хэдий тийм боловч хэрэв атом нь нэмэлт энергитэй болбол электронууд нь 3p, 3-р дэд хэсгүүдэд хуваагдаж, дараа нь дараагийн шилжилтийн 3d, дараа нь үнэгүй үлдсэн гэдгийг мэддэг. Үүний үр дүнд, зөвхөн атомын хэмжээ өөрчлөгдөх төдийгүй бүх боломжит исэлдэлтийн мужууд юм. Тэдгээрийн тоо нь хүхрийн хүчилтэй өөр өөр бодисуудын тоог ихээхэн нэмэгдүүлдэг.
Химийн нэгдлүүд дэх хүхрийн исэлдэлт
Энэ үзүүлэлтийн хэд хэдэн үндсэн сонголт байна. Хүхрийн хувьд:
Эдгээрээс S +2 хамгийн ховор, бусад нь хаа сайгүй тархдаг. Химийн бодисын исэлдлийн зэрэг нь бүхэлдээ бодисын исэлдэлт чадвараас хамаарна. Жишээ нь, -2 гэсэн нэгдэл нь сульфид юм. Тэдгээрийн дотроос бидний авч үзэх элемент нь ердийн исэлдүүлэгч бодис юм.
Нийлмэлийн исэлдлийн зэрэг нь бодисын исэлдүүлэх чадварыг илтгэнэ. Хэрэв бид хүхрийн хэлбэртэй хоёр үндсэн хүчлийг дурьдвал:
- H 2 SO 3 - хүхрийн агууламж;
- H 2 SO 4 - хүхэр.
Энэ нь сүүлийнх нь илүү тогтвортой, хүчтэй нэгдэл бөгөөд өндөр концентрацитай байх нь маш ноцтой исэлдэх чадвартай гэдгийг мэддэг.
Энгийн бодис
Энгийн бодисын хувьд хүхэр нь тогтмол урт хэлбэрийн шар өнгийн талстыг төлөөлдөг. Хэдийгээр энэ нь зөвхөн түүний нэг хэлбэр боловч, хоёр үндсэн бодис байдаг. Эхний нэг, моноклин эсвэл rhombic нь шар өнгөтэй бөгөөд уусмалд уусдаггүй шар өнгөтэй, харин зөвхөн органик уусгагч бодис юм. Торгоны хэлбэрээр танилцуулсан эмзэг байдал, бүтцийн үзэсгэлэнт хэлбэрийг ялгаатай болгодог. Хайлуулах цэг - ойролцоогоор 110 0 С.
Хэрэв та ийм өөрчлөлтийг халаах үед завсрын цагийг өнгөрөөхгүй бол та цаг хугацааны явцад өөр мужийг илрүүлж болно - хуванцар хүхэр. Энэ нь хүрэн өнгөний наалдамхай уусмал юм. Энэ нь халаалт эсвэл түргэн хөргөлтөнд дахин ромбын хэлбэр болж хувирдаг.
Хэрэв бид химийн цэвэр хүхэртэй тухай дахин давтан шүүлтүүрээр олж авбал энэ нь усанд уусдаггүй шар өнгийн жижиг талстууд юм. Агаар дахь чийг ба хүчилтөрөгчтэй холбогдох үед гал авалцдаг. Химийн бодисын агууламж маш өндөр байдаг.

Байгаль дээр байх
Байгальд, хүхрийн нэгдлүүд нь олборлож байгаа байгалийн ордууд бөгөөд энэ нь өөрөө энгийн бодис юм. Үүнээс гадна дараахь зүйлсийг агуулна:
- эрдэс, хүдэр ба чулуулагт;
- олон тооны органик молекулуудын нэг хэсэг болох амьтан, ургамал, хүний биед;
- байгалийн хий, газрын тос, нүүрс;
- шатамхай чанар ба байгалийн ус.
Хүхрийн баялаг ихтэй зарим эрдэс бодисууд нь:
- cinnabar;
- пирит;
- sphalerite;
- антимонит;
- галена болон бусад.
Өнөөдөр үйлдвэрлэсэн ихэнх хүхрийн хүхэр нь сульфатын үйлдвэрлэлд хүргэдэг. Өөр нэг хэсэг нь эмнэлгийн зориулалтаар, хөдөө аж ахуй, бодисын үйлдвэрлэлийн процессуудад ашиглагддаг.
Физик шинж чанар
Тэдгээрийг хэд хэдэн хэсэгт тайлбарлаж болно.
- Энэ нь ус, нүүрстөрөгчийн дисульфид эсвэл turpentine-д уусдаггүй - энэ нь сайн уусдаг.
- Уртассаар үрэлтийн улмаас сөрөг төлбөр хуримтлагддаг.
- Хайлмал цэг нь 110 0 С.
- Буцалгах цэг 190 0 С.
- 300 0С хүрэхэд шингэн нь хялбар, хөдөлгөөнтэй болдог.
- Цэвэр бодис нь шатамхай шинж чанарыг маш сайн шатдаг.
- Энэ үнэр өөрөө бараг нөлөө үзүүлдэггүй, харин хүхэрт устөрөгчийн нэгдэл нь ялзарсан өндөгний хурц үнэрийг гаргадаг. Зарим хий хоосон хоёр төлөөлөгчтэй адил.
Тухайн бодисын физик шинж чанар эртний хүмүүсээс хойш мэдэгдэж байсан. Энэ нь яг ийм нэртэй хүхрийн хүчил хүлээн авдаг шатамхай чанар юм. Дайны үед тэд энэхүү хорт бодисыг шатаах үед дайсантай зэвсэг болгон нийлүүлэх хорт утаа гаргаж байсан. Үүнээс гадна хүхрийг хамарсан хүчил нь аж үйлдвэрийн чухал ач холбогдолтой байдаг.

Химийн шинж чанар
Сургуулийн химийн хичээлд "Хүхэр ба түүний нэгдлүүд" гэсэн сэдвээр хичээл заахгүй, гэхдээ хэд хэдэн хичээлүүд ордоггүй. Эцсийн эцэст тэдний олон нь. Энэ нь бодисын химийн үйл ажиллагаатай холбоотой. Энэ нь исэлдүүлэгч шинж чанаруудыг хүчтэй бууруулдаг агентууд (метал, боррон, г.м.), металлын ихэнх металлыг багасгаж чаддаг.
Гэсэн хэдий ч энэ үйл ажиллагаа нь зөвхөн фторын хувьд ч гэсэн харилцан үйлчлэл нь хэвийн нөхцөлд явагддаг. Бусад нь халаалт шаарддаг. Хүхрийн харилцан үйлчлэх хэд хэдэн төрлийн бодис байдаг.
- металл;
- метал бус;
- шүлтлэг;
- хүчтэй исэлдүүлэгч хүчил - хүхрийн болон азотын хүчил.
Хүхрийн нэгдэл: сорт
Тэдгээрийн олон янз байдлыг гол элементийн исэлдлийн зэргээс тэгш бус утгатай тайлбарлах болно. Иймээс та хэд хэдэн гол зүйлүүдийг сонгож болно:
- исэлдэлтийн төлөвтэй нэгдэл -2;
Хэрвээ бид үнэлгээг биш, заагч биш гэж үзвэл энэ элемент нь ийм молекулуудыг бүрдүүлдэг:
- хүчлүүд;
- исэл;
- давс;
- метал бус (нүүрсхүчлийн дисульфид, хлорид) -тай хоёртын нэгдлүүд;
- органик бодис.
Одоо гол зүйлүүдийг авч үзээд жишээнүүдийг өгнө үү.

Исэлдэлтийн төлөвт бодисууд -2
2-р хүхрийн нэгдлүүд нь металуудтай, түүнчлэн:
- нүүрстөрөгч;
- устөрөгч;
- фосфор;
- цахиур;
- хүнцэл;
- борон.
Эдгээр тохиолдолд энэ нь исэлдүүлэгч бодисын үүрэг гүйцэтгэдэг. Учир нь бүх элементүүд нь электрофотометр юм. Тэдний хамгийн чухал гэж үзье.
- Нүүрстөрөгчийн дисульфид - CS 2. Эфирийн онцлог сайхан үнэртэй шингэнийг цэвэрлэнэ. Энэ бол хортой, шатамхай, тэсрэх бодис юм. Тос, тос, металлын бус, мөнгөний нитрат, давирхай, резин зэрэг олон төрлийн тосолгооны зориулалтаар ашигладаг. Энэ нь мөн rayon - rayon үйлдвэрлэлд чухал үүрэг гүйцэтгэдэг. Үйлдвэрт их хэмжээгээр нэгтгэсэн.
- Устөрөгчийн сульфид эсвэл устөрөгчийн сульфид - H 2 С. Хэмжээ, амтгүй амтгүй хий юм. Үнэр нь хурц, маш тааламжгүй, ялзарсан өндөгийг сануулдаг. Амьтдын төв нь хорт хий, амьсгалын төвийг сулруулдаг. Тиймээс хэрэв тэр хорт хавдартай бол амь насаа алдаж үхнэ. Энэ нь анагаах ухаан, органик синтез, хүхрийн хүчил үйлдвэрлэл, эрчим хүчний хэмнэлттэй түүхий эдэд өргөн хэрэглэгддэг.
- Металл сульфидууд нь анагаах ухаанд, сульфатын үйлдвэрлэл, будаг үйлдвэрлэх, фосфор болон бусад газар үйлдвэрлэхэд өргөн хэрэглэгддэг. Ерөнхий томъёо нь Me x S y.

Исэлдэлтийн төлөвт +4
4-р хүхрийн нэгдлүүд нь ихэвчлэн исэлдэлт ба холбогдох давс, хүчил юм. Тэд бүгдээрээ аж үйлдвэрийн салбарт тодорхой үнэ цэнэтэй нэгдэл юм. Тэд исэлдүүлэгч бодисууд болох боловч шинж чанарыг бууруулдаг.
Исэлдэлтийн төлөвтэй +4 хүхрийн нэгдлүүдийн томъёо нь дараах байдалтай байна:
- оксид - хүхрийн давхар исэл SO 2;
- хүчил - хүхрийн H 2 SO 3;
- давсууд нь ерөнхий томъёо Me x (SO 3) y байна.
Хамгийн нийтлэг нэг бол аниидрид юм. Энэ нь шатсан тэмцээний үнэртэй өнгөгүй бодис юм. Галт уулын дэлбэрэлтийн үеэр үүссэн том кластеруудад энэ мөчид үнэрлэхэд хялбар байдаг.
Энэ нь амархан задардаг хүчил, хүхрийн хүчил үүсэх хэлбэрээр усаар уусдаг. SO 3-2 төрлийн сульфит ион гэж нэрлэдэг энгийн давсны хэлбэрүүд байдаг. Энэ аниидрид нь хүрээлэн буй орчны бохирдолд нөлөөлдөг гол хий юм. Боловсролд нөлөөлдөг энэ зүйл нь аж үйлдвэрт сульфатын үйлдвэрлэлд ашиглагддаг.
Хүхрийн хүчил исэлдэлтийн төлөв +6
Эдгээрт, хүхрийн ангидрид, хүхрийн хүчил давстай байдаг.
- сульфат;
- hydrosulphates.
Тэдний хүхрийн агууламж маш исэлдсэн учраас эдгээр нэгдлүүдийн шинж чанар нь маш тодорхой юм. Эдгээр нь хүчтэй исэлдүүлэгч бодисууд юм.
Хүхрийн исэл (VI) -усульфурын ангидрид нь дэгдэмхий, өнгөгүй шингэн юм. Чанарын шинж чанар нь чийг шингээгч чадвар юм. Гадаа тамхи татдаг. Усанд ууссан үед хамгийн хүчтэй эрдэс хүчил нь хүхрийн хүчил үүсгэдэг. Төвлөрсөн уусмал нь тослог багатай шаргал өнгөтэй байдаг. Хэрвээ хүчилтөрөгч хүхрийн хүчилд ууссан бол та тусгайлсан нэгдэл, oleum гэж нэрлэдэг. Энэ нь хүчил үйлдвэрлэх салбарт ашиглагддаг.
Үүнд: сульфатууд - нэгдлүүд:
- гипс CaSO 4 · 2H 2 O;
- баарит BaSO 4;
- mirabilite;
- сульфат болон бусад тугалга.
Тэд барилгын, химийн синтез, анагаах ухаан, оптик төхөөрөмж, нүдний шил үйлдвэрлэх, тэр ч байтугай хүнсний үйлдвэрлэлд ашиглагддаг.
Гидросульфатыг төмөрлөг судлалаар өргөнөөр ашигладаг бөгөөд тэдгээр нь урсгал хэлбэрээр ашиглагддаг. Мөн тэд олон нарийн төвөгтэй оксидыг холбогдох салбарт хэрэглэгддэг уусдаг сульфатын хэлбэрт хөрвүүлэхэд тусалдаг.
Сургуулийн химийн хичээлд хүхрийн судалгаа хийх
Оюутнуудад хүхэр гэж юу болох, түүний шинж чанар юу вэ, хүхрийн нэгдэл гэж юу вэ? 9-р анги - хамгийн сайн хугацаа. Бүх зүйл шинэ бөгөөд ойлгомжгүй үед энэ нь эхлэл биш юм. Энэ бол химийн шинжлэх ухааны судалгааны гол цэг юм. Өмнөх тавьсан суурь нь энэ сэдвийг бүрэн ойлгоход туслах болно. Тиймээс эдгээр асуудлыг авч үзэхийн тулд ахлах ангийн хоёр дахь хагас нь юм. Үүний зэрэгцээ нийт сэдэв нь хэд хэдэн блокод хуваагдаж, "Хүхрийн нэгдэл" 9-р анги нь тус тусдаа зогсож байна.
Энэ нь тэдний олон тооны шинж чанартай холбоотой юм. Мөн тус салбарт үйлдвэрлэсэн хүхрийн хүчил үйлдвэрлэх асуудлыг тусад нь авч үзсэн болно. Ерөнхийдөө 3 цаг дунджаар энэ сэдэвт зориулагдсан байдаг.
Харин хүдрийг зөвхөн 10-р ангид оруулан, органик асуудлуудыг авч үздэг. Тэд ахлах сургуульд биологийн хичээлд өртдөг. Эцсийн эцэст хүхэр нь ийм органик молекулуудын нэг хэсэг юм:
- титэм;
- уургууд (дисульфид гүүр үүсэх гуравдагч бүтэц);
- thioaldehydes;
- тиофенол;
- тамирчид;
- сульфоник хүчил;
- сульфоксид болон бусад.
Тэдгээр нь organo-хүхрийн нэгдлийн тусгай бүлэгт хамаардаг. Эдгээр нь амьд организмын биологийн процессуудад төдийгүй аж үйлдвэрт чухал ач холбогдолтой юм. Жишээлбэл, сульфоник хүчлүүд нь олон хүний суурь болдог эм (аспирин, сульфонамид эсвэл стрептокид).
Түүнчлэн, хүхэр нь зарим нэг төрлийн нэгдлүүдийн байнгын бүрдэл хэсэг юм. Үүнд:
- амин хүчил;
- энзим;
- витамин;
- даавар.
Өрөөний температурт хүхэр зөвхөн мөнгөн усаар урвалд ордог. Температурыг нэмэгдүүлснээр түүний үйл ажиллагаа ихээхэн нэмэгддэг. Хүхрийн хүчил, азот, селени, теллури, алт, цагаан алт, изиди, иод зэрэг бусад энгийн бодисуудтай шууд урвалд ордог. Азот ба алтны хүчиллэгүүд шууд бусаар олддог.
Металлуудтай харилцах
Хүхрийн хүчил нь харилцан үйлчлэлийн үр дүнд исэлдүүлэх шинж чанарыг харуулсан бөгөөд сульфидууд үүсдэг.
Устөрөгчийн харилцан үйлчлэл 150-200 ° С байна:
H 2 + S = H 2 S.
Хүчилтөрөгчтэй харилцах
Хүхэрт 280 градусын хүчилтөрөгчийг 360 ° C-д агаарт шатаадаг ба исэлдлийн холимог үүсдэг:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Фосфор ба нүүрстөрөгчийн харилцан үйлчлэл
Агааргүй халааж, хүхэр нь фосфортой нүүрстөрөгчтэй урвалд ордог.
2P + 3S = P 2 S 3;
Фторын харилцан үйлчлэл
Хүчтэй исэлдүүлэгч бодисууд байгаа тохиолдолд шинж чанарыг бууруулдаг.
S + 3F 2 = SF 6.
Нарийн төвөгтэй бодисуудтай харилцан үйлчлэлцэх
Нарийн төвөгтэй бодисуудтай харилцан үйлчлэлцэх үед хүхэр нь багасгагч бодис болж хувирдаг.
S + 2HNO 3 = 2NO + H 2 SO 4.
Хувь тэнцвэртэй байдал
Хүхэр нь шүлтийн сульфид болон сульфиттай харилцан үйлчлэлцэж байх үед тэнцвэргүйжүүлэгдэх урвалын чадвартай байдаг.
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Хүхрийн үйлдвэрлэл
Орлогийн хүдрээс
Агааргүй пирит халаах үед
FeS 2 = FeS + S.
Хүчилтөрөгч дутагдалтай хүхэрт устөрөгчийг исэлдүүлэх
2H 2 S + O 2 = 2S + 2H 2 O.
Металлурги, коксын зуухны хаягдал хийнээс катализаторын үед халсан үед
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. Устөрөгчийн сульфид
Устөрөгчийн хүхрийн нэгдэл - устөрөгчийн сульфид H 2 S . Устөрөгчийн сульфид бол ковалентын нэгдэл юм. Молекулын бүтэц нь усны молекулын бүтэцтэй төстэй, хүхрийн атом нь sp 3 гибридизацийн байдалд байгаа боловч уснаас ялгаатай нь устөрөгчийн сульфидын молекулууд нь хоорондоо устөрөгчийн холбоо үүсгэдэггүй. Хүхрийн атом нь хүчилтөрөгчийн атомаас илүү электрон хэмжил хийх чадвартай, том хэмжээтэй, үр дүн нь бага цэнэгийн нягтрал юм. HSH-ийн үнийн өнцөг 91.1 хэм, H-S бондын урт 0.133 нм байна.
Физик шинж чанар
Хэвийн нөхцөлд устөрөгчийн сульфид нь ялзарсан өндөгний хүчтэй шинж чанар бүхий өнгөгүй хий юм. Т pl = -86 ° C Т kip = -60 ° C, 20 ° С, 2.58 мл H2 S-д 100 г ус уусдаггүй, маш хортой бөгөөд үхэлд хүргэж болзошгүй амьсгалсан тохиолдолд саажилт үүсгэдэг. Байгальд энэ нь ургамлын болон амьтны бие махбодийн задралаар бий болсон галт уулын хийцийн найрлагад чөлөөлөгддөг. Устөрөгч сульфидийн хүчлийг сулруулсан үед ус уусдаг.
Химийн шинж чанар
Усан уусмалаар устөрөгчийн сульфид нь доройтсон хүчилтэй шинж чанартай байдаг.
H 2 S = HS - + H +;
HS - = S 2- + H +.
Устөрөгчийн сульфид нь агаарт шатдаг цэнхэр дөл. Хязгаарлагдмал агаар нэвтрэхгүйгээр, хүхрийн чөлөөт бүрдэнэ.
2 H 2 S + O 2 = 2H 2 O + 2S.
Агаарын хэт их ачаалалтай үед устөрөгчийн сульфидийн шаталт нь хүхрийн исэл (IV) үүсгэнэ:
2H 2 S + 3O 2 = 2H 2 O + 2 SO 2.
Устөрөгчийн сульфид нь шинж чанарыг бууруулдаг. Нөхцөл байдлаас хамаарч устөрөгчийн сульфид нь хүхэр, хүхрийн давхар исэл, хүхрийн хүчилд усан уусмалаар исэлдэж болно.
Жишээ нь, бромын усыг задална:
H 2 S + Br 2 = 2HBr + S.
хлор устай харилцдаг:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Хар тугалганы диоксидыг ашиглан устөрөгчийн сульфидийн тийрэлтэтийг асааж болно. Учир нь урвал их хэмжээний халалт үүсдэг.
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Устөрөгчийн сульфидын хүхрийн диоксидын харилцан үйлчлэл төмөрлөг болон сульфатын үйлдвэрлэлийн хаягдал хийээс хүхрийг үйлдвэрлэхэд ашигладаг:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Галт уулын үйл явц дахь унаган хүхэр үүсэх нь энэ үйл явцтай холбоотой.
Шүлтийн уусмалаар хүхэрт диоксид ба устөрөгчийн сульфидыг нэгэн зэрэг дамжуулах замаар тиосульфатыг үүсгэнэ.
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Хэвийн нөхцөлд устөрөгч сульфид нь ялзарсан өндөгний онцгой үнэртэй өнгөгүй бөгөөд маш хортой хий юм.
Лабораторид үүнийг авахын тулд шингэлсэн давсны хүчил ихэвчлэн сульфидид нэмнэ:
Устөрөгчийн сульфидийг үйлдвэрлэх өөр нэг арга бол хөнгөн цагааныг сульфидын усаар нэмж өгнө.
Энэ аргаар устөрөгчтэй сульфид нь цэвэрлэгч юм.
Устөрөгчийн сульфид бол ковалентын нэгдэл юм. Түүний молекулууд усны молекулын бүтэцтэй төстэй муруй бүтэцтэй байдаг (бүлгийн 2.2-ийг үз). Гэсэн хэдий ч, уснаас ялгаатай нь устөрөгчийн сульфидийн молекулууд нь хоорондоо холбогддог устөрөгчийн холбоог үүсгэдэггүй. Хүхрийн атом нь хүчилтөрөгчийн атомаас илүү электрон засаглалын хувьд бага боловч том хэмжээтэй байдаг. Тиймээс хүхрийн атом нь хүчилтөрөгчийн атомаас бага цэнэгийн нягттай байдаг. Устөрөгчийн бондын дутагдалтай учир устөрөгчийн сульфид нь уснаас бага буцлах цэгтэй байдаг. Устөрөгчийн сульфид дахь устөрөгчийн бонд байхгүй ч усан дахь дутагдалтай талыг тайлбарладаг.
Усан уусмалаар устөрөгчийн сульфид нь доройтсон хүчилтэй шинж чанартай байдаг.
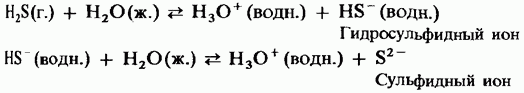
Устөрөгчийн сульфид нь цэнхэр дөлөөр агаарт шатдаг. Хязгаарлагдмал агаар нэвтрэхгүйгээр устөрөгчийн сульфидийг шатаахдаа хүхрийн хүйтэн гадаргуу дээр төвлөрдөг чөлөөт хүхрийн ангижралыг дагалдаж болно:
Агаарын хэт их ачаалалтай үед устөрөгчийн сульфидийн шаталт нь хүхрийн давхар ислийг үүсгэдэг.
Устөрөгчийн сульфид нь шинж чанарыг бууруулдаг. Жишээ нь, энэ нь бромын усыг ялгаж, ион руу ионоор багасгадаг.
Дакасын хүчлээр хүхэрт устөрөгч нь хоёр эгнээ үүсгэдэг - сульфид болон гидросульфид (дээрхийг үз). Шүлтийн металлын сульфидууд шүлтлэг уусмал үүсгэхийн тулд усанд уусгана. Энэ нь гидролизийн үр дүнд үүсдэг:
Бусад металлуудын уусдаггүй сульфидууд нь эдгээр металлын давсны уусмалаас уусмалаар дамжин устөрөгчийн сульфидийг дамжин уусгаж болно. Жишээ нь, ионуудтай уусмалаар устөрөгчийн сульфидийг гаргаж авснаар хар сульфидын тунадас үүсгэнэ
Энэ урвалыг устөрөгчийн сульфидын шинжилгээний дээж болгон ашигладаг.
Хүхрийн ислүүд
Хүхэр нь хэд хэдэн исэл үүсгэдэг бөгөөд үүнээс хоёр нь хамгийн чухал нь: хүхрийн давхар исэл, хүхрийн триоксид.
Хүхрийн давхар исэл нь хурц үнэртэй, өтгөн, өнгөгүй хий юм. Лабораторийн нөхцөлд агаарыг хүчилтөрөгч эсвэл хүчилтөрөгч шатаах замаар хүхрийг шатаах замаар гаргаж авч болно. Зарим сульфитийн давс руу халуун уусмалд хүчлийн уусмал нэмж, эсвэл хүхэртэй хүхрийн хүчлийг халаана.
Хүхрийн давхар исэл хүчил исэл. Энэ нь амархан уусдаг бөгөөд хүхрийн хүчил үүсгэдэг. Энэ хүчил нь зөвхөн хэсэгчлэн ионжуулсан учраас, энэ нь сул хүчил юм:
Натрийн гидроксидын уусмалаар хүхрийн давхар ислийг хийснээр натрийн сульфид үүснэ. Натрийн сульфат нь хүхрийн давхар ислээс илүүдэлтэй урвалд ордог бөгөөд энэ нь натрийн гидросульфит хэлбэртэй бөгөөд эдгээр урвал нь шохойн устай нүүрстөрөгчийн давхар исэлийн урвалтай төстэй байдаг.
Хийн хүхрийн давхар исэл ба түүний усан уусмал хоёулаа бодисыг багасгадаг. Жишээлбэл, хийн хүхрийн давхар исэл нь исэлдэлтийг сулруулж а хүхрийн хүчил ионы ионыг сэргээх
Аж үйлдвэрийн нөхцөлд хүхрийн давхар исэл нь агаар дахь хүхрийн болон сульфидын хүдрийг халааж, хүхрийн хүчил хуримтлуулах явцад завсрын бүтээгдэхүүн болгон ашигладаг (Бүлэг 7-г үзнэ үү). Хүхрийн давхар исэл нь целлюлозын үйлдвэрт, цайруулах бөс даавуу, жимс жимсгэнэ, хүнсний ногоо боловсруулахад ашиглагддаг.
Хүхрийн давхар исэл нь агаар мандлын бохирдол, ялангуяа хүчиллэг бороо үүсэхэд чухал үүрэг гүйцэтгэдэг. Агаар мандалд хүхрийн триоксид исэлддэг.
Хэвийн нөхцөлд энэ явц удаан биш боловч катализаторын үед энэ нь хүхрийн хүчил үйлдвэрлэхэд харилцан адилгүй хурдасч болно. Агаар мандалд төмрийн болон манганы нэгдэл бага хэмжээний хүхрийн давхар ислийг исэлдүүлдэг. Үүний үр дүнд хүхрийн триоксид нь агаар дахь чийгтэй урвалд орж, хүчиллэг бороо оруулдаг (ишлэл 12-ыг үз).
Хатуу хүхэрт гурвалжин бол полиморфийн нэгдэл юм. Хамгийн чухал хоёр хэлбэр нь эхнийх нь циклтэй бүтэцтэй гурвалжин (Зураг 15.24, а); талст нь ил тод байна. астиксик полимер бүтэцтэй байна (зураг 15.24, б); Энэ нь зүү хэлбэртэй байдаг. Хайлах цэг Чийгтэй байх үед аажим аажмаар 45 ° С-д буцалгасны хэлбэртэй байна. Хүхрийн гурвалжин уур нь тусгаарлагдсан тэгш хэмтэй хавтгай молекулаас тогтоно.
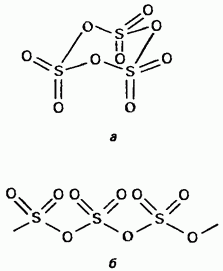
Зураг. 15.24. Хүхрийн гурвалжин, циклийн бүтэц, б - цахиурын бүтэц.
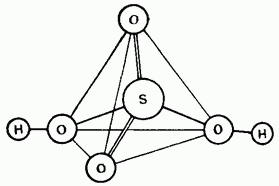
Зураг. 15.25. Хүхрийн хүчлийн молекулын бүтэц.
Лабораторийн нөхцөлд хүхрийн триоксидыг халаалтын сульфатаар гаргаж авдаг
Хүхрийн гурвалжин нь хүчтэй хүчиллэг шинж чанартай байдаг. Энэ нь усаар экзотик урвалд орж хүхрийн хүчил үүсгэнэ.
Хүхрийн гурвалжин бол хүчтэй исэлдүүлэгч бодис юм. Жишээлбэл, энэ нь устөрөгчийн бромидийг исэлдүүлэхэд бром болох юм.
Хүхрийн хүчил
Хүхрийн хүчил - өнгөгүй тостой тослог шингэн. Энэ нь аж үйлдвэрийн хамгийн чухал химийн бүтээгдэхүүнүүдийн нэг юм. Холбоо барих үйл явц, хэрэглээг ашиглан үйлдвэрлэлийн үйлдвэрлэлийг Ч. 7
Хүлэргүй хүхрийн хүчил нь ковалентын нэгдэл юм. Түүний молекулууд нь тетраэдрийн бүтэцтэй байдаг (Зураг 15.25).
Хүхрийн хүчил нь 340 ° С-д задарч, хүхэрт гурвалжин, ус үүсгэдэг
Хүхрийн хүчил нь өндөр буцлах цэг, хүхрийн хүчлийн өндөр зуурамтгай чанар нь устөрөгчийн атомууд болон хөрш зэргэлдээ молекулын хүчилтөрөгчийн атомуудын хоорондын устөрөгчийн холбоо байдагтай холбоотой.
Хүхрийн хүчил нь хүчтэй шингэрүүлсэн хүчил юм. Усан дотор бүрэн ионжуулж, гидросульфат болон сульфат ион үүсгэнэ.
Хүхрийн хүчил нь хүчлүүдийн онцлог шинж тэмдгүүдэд хамаардаг. Энэ металлууд нь эдгээр металлууд ба устөрөгч дэх сульфатуудыг үүсгэдэг бөгөөд карбонатууд нь сульфат, нүүрстөрөгчийн давхар исэл, устай урвалд ордог бөгөөд суурьтай урвалууд нь шүлтлэг буюу гидросульфатыг үүсгэдэг.
Хүхрийн хүчил нь концентрацитай маш хүчтэй урвалд ордог. Энэ шалтгааны улмаас хүхрийн хүчил нь түүнийг ус руу юүлж, харин эсрэгээр нь шингэлэх хэрэгтэй. Энэ хүчил нь гигроскопик, жишээ нь агаараас чийг шингээх чадалтай. Тиймээс энэ нь хүхрийн хүчилээр дамжуулан тэдгээрийг дамжуулдаггүй хуурай бодисыг хуурай болгодог. Ус руу хүхрийн хүчлийн давтамж ойртсон нь хүхрийн хүчил нь усгүйжүүлэгч бодис болж үйлчилдэг. төвлөрсөн хүхрийн хүчил:
сульфатын пентагидын цэнхэр талстууд нь усгүй сульфат үүсгэдэг
сахароз гэх мэт нүүрс ус нь шатдаг.
цаас нь целлюлозын утас дээр хүчил үүссэнээс болж төвлөрсөн хүхрийн хүчлээр үйлдэгддэг.
этилийн спиртийг этилен болгон хувиргадаг:
(этилийн спиртийн усгүйжүүлэлт нь хяналтанд явуулсан хүхрийн хүчилтэй хамт)
нөхцлүүд нь этоксилэтан (диэтилийн эфир) үүсгэх ба энэ урвал нь үйлдвэрлэлийн хэмжээнд этоксетаныг үйлдвэрлэхэд ашиглагддаг);
хлоробензен, трихлорэтанал (хлорпор) холимог нь усгүйжүүлсэн (16.3-р бүлгийг үзнэ үү).
Концентрацитай хүхрийн хүчил нь хүчтэй исэлдүүлэгч бодис юм. Энэ нь метал болон металлыг исэлдүүлдэг. Жишээ нь
Төвлөрсөн хүхрийн хүчил дэх исэлдэлтийн шинж чанарыг харуулсан бусад жишээнүүдийн дагуу бид ионууд ионоор ионоор, түүнчлэн бромид ионыг дараахь урвалаар чөлөөт бром агуулсан ионоор илэрхийлнэ. Үүнд:
Эцэст нь, хүхрийн хүчил нь органик химид сульфатын бодис болж ашиглагддаг (Бүлэг 17-ийг үзнэ үү).
Сульфат, сульфит, цианидын нэгдлүүд
Хүхрийн хүчлийн молекулын бүтэцтэй адил сульфатын ион нь тетраэдрийн бүтэцтэй байдаг.
Давс Хүхрийн хүхэр нь хүхрийн хүчил, түүний исэл, гидроксид, карбонатаар шингэлэх урвалаар үүсдэг. Барийн сульфат болон үлдсэн сульфатаас бусад нь усанд уусдаг. Кальцийн сульфат нь ус багатай байдаг. Сульфат нь ихэвчлэн дулаанд тэсвэртэй байдаг. Зөвхөн үл хамаарах зүйл нь төмрийн сульфат юм. Жишээлбэл, сульфат нь төмрийн оксид үүсгэх үед халах үед задардаг:
Аливаа уусмал дахь сульфат ионыг илрүүлэхийн тулд барийн хлоридын усан уусмал тэнд нэмнэ. Хэрэв шинжилгээний уусмалд сульфатын ион байгаа бол барийн сульфатын цагаан тунадас үүснэ.
Сульфат нь олон чухал ач холбогдолтой. Жишээлбэл, магнийн сульфат (Британийн давс, гашуун давс) нь тэсрэх бодис үйлдвэрлэхэд ашиглаж, тэмцээн болон галд тэсвэртэй даавуу үйлдвэрлэхэд ашиглагддаг. Энэ давсны ханасан уусмалыг анагаах ухаанд үрэвслийн эсрэг эм болгон ашигладаг.
Натрийн тиосульфатыг натрийн сульфатын аналог гэж үздэг бөгөөд нэг хүчилтөрөгчийн атомыг хүхрийн атомаар солино. Ийм хиоцитийн нэгдлүүдийн дотор өөр нэгийг дурдах ёстой - калийн тиоцианат. Энэ нь калийн кианатын хүхрийн аналог юм. Калийн цианидыг хүхэртэй хольж калийн тиоцианатыг авч болно.
Ионыг илрүүлэхийн тулд калийн тиоцианатыг чанарын шинжилгээнд ашиглана. Хэрэв эдгээр ионууд нь шинжилгээний уусмалд байгаа бол калийн тиоцианатын уусмалыг иж бүрдэл нь ионы
Тиймээс дахин давтаарай!
1. VI бүлгийн ёроолд шилжихдээ элементүүдийн шинж чанар нь металл бус металаас аажмаар өөрчлөгддөг.
2. VI бүлгийн элементүүд нь устөрөгч, реактив металлтай хослуулах чадвартай, исэлдэлтийн мужид хамаарах нэгдлүүдийг бүрдүүлдэг.
3. Хүчилтөрөгч нь электроноор хүчтэй исэлдүүлэгч шинж чанартай байдаг.
4. Озон нь хүчилтөрөгчөөс илүү хүчтэй исэлдүүлэгч юм.
5. Хүчилтөрөгч нь биологийн тогтолцоонд маш чухал үүрэг гүйцэтгэдэг бөгөөд амьсгалын болон бодисын солилцооны процесс (бодисын солилцоо) үйл ажиллагаанд оролцдог.
6. Хүчилтөрөгч нь бусад нэгдлүүдтэй хоёр төрлийн исэлдүүлэгч бодисууд юм.

7. Устөрөгчийн хэт исэл нь хүчтэй исэлдүүлэгч бодис юм.
8. Хүхрийн чөлөөт хэлбэрт органототик хэд хэдэн хэлбэрүүд байдаг.
9. Газар доорх хүдрээс хүхрийг гаргаж авахын тулд Фраш процессыг ашиглан шахсан агаар болон хэт халсан уур хэрэглэдэг.
10. Хүхрийн хүчил нь исэлдүүлэх төлөвт +2, +4, +6 ба -2 мужид ордог.
11. Устөрөгчийн сульфид - сул задралын хүчил ба буурах бодис.
12. Хийн хүхрийн давхар исэл ба түүний усан уусмалыг багасгах агентууд.
13. Хүхрийн гурвалжин нь хүчил ба исэлдүүлэх шинж чанарыг хүчтэй илэрхийлдэг.
14. Хүхрийн хүчил нь хүчтэй шингэрүүлсэн хүчил, хатаагч, усгүйжүүлэгч бодис, хүчтэй исэлдүүлэгч бодис юм.
15. Хүхрийн хүчил молекул болон сульфат ион нь тетраэдрийн бүтэцтэй байдаг.