Quando si collegano 28 g di silicio con ossigeno. Composti dell'ossigeno del silicio
Silicio.Caratteristica generale La principale differenza dal carbonio: l'assenza di legami p nei composti Siliciuri Composti con idrogeno (silani), ossidazione e idrolisi Tetrafluoruro e silicio tetracloruro, idrolisi Esafluorosilicati Composti di ossigeno Ossido di silicio (IV) Gel di silice Kremnev. Acidi Silicati Solubilità e idrolisi Silicati naturali e alluminosilicati, zeoliti Composti organosilicidi Siliconi e silossani Uso di composti di silicio in medicina.
silicio (lat Silicium), Si, elemento chimico del Gruppo IV del Sistema Periodico; numero atomico 14, massa atomica 28.086. Il silicio esibisce anche l'ibridazione sp3 di elettronica
orbitali. Sullo strato di elettroni esterni dell'atomo di silicio ci sono valenza 3d-
orbitali (Si: 3s23p23d0),
Il silicio dopo l'ossigeno è l'elemento più comune nella crosta. A differenza del carbonio in uno stato libero, il silicio non si trova in natura. I suoi composti più comuni sono ossido di silicio (IV) SiO2 e sali di acido silicico, silicati. Formano il guscio della crosta terrestre. I composti di silicio si trovano nelle piante e negli animali. Per proprietà chimiche, il silicio, come il carbonio, è un non-metallo, ma la sua non-metallicità è meno pronunciata, poiché ha un raggio atomico più ampio
Silicon. forma composti con quasi tutti i metalli - con ilitsidy (composti non trovati solo con Bi, Tl, Pb, Hg). Sono stati ottenuti oltre 250 siliciuri, la cui composizione (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, ecc.) Di solito non corrisponde alle valenze classiche. I siliciuri differiscono per refrattarietà e durezza; il ferrosilicio (agente riducente nella fusione di leghe speciali, vedi Ferroleghe) e il molibdeno silicuro MoSi2 (riscaldatori di forni elettrici, pale di turbine a gas, ecc.) sono di massima importanza pratica.
Silano. Sotto l'azione dell'acido cloridrico sui siliciuri, il più semplice composto di idrogeno del silicio è Silano SiH4:
Silane è un gas velenoso con un odore sgradevole che si accende spontaneamente. l'aria
Sono reattivi e sono forti agenti riducenti.
reagire con acqua a temperatura ambiente:
SiH4 + 2H2O → SiO2 + 4H2,:
tetrafluoruro Il silicio è prodotto dalla fluorurazione del biossido di silicio con fluoro elementare.
Il processo di fluorurazione viene effettuato in due fasi in un reattore a fiamma, dirigendo l'eccesso di fluoro elementare dal 1 ° stadio al 2 ° stadio.
Il risultato tecnico è la produzione di silicio in modalità continua con alta resa e qualità del prodotto.
Tetrafluoruro di silicio SiF4 è formato dall'azione di acido fluoridrico (fluoridrico) su vetro:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Composti dell'ossigeno del silicio
Il più importante composto di ossigeno del silicio è il biossido di silicio SiO2 (silice), che ha diverse modificazioni cristalline.
La modifica a bassa temperatura (fino a 1143 K) si chiama quarzo. Il quarzo ha proprietà piezoelettriche. Varietà naturali di quarzo: cristallo di rocca, topazio, ametista. Le varietà di silice sono calcedonio, opale, agata,. Jasper, sabbia.
Il silice è chimicamente resistente; è influenzato solo da fluoro, acido fluoridrico e soluzioni alcaline. Va facilmente in uno stato vetroso (vetro al quarzo). Il vetro al quarzo è fragile, molto chimicamente e termicamente resistente. L'acido silicico SiO2 corrispondente non ha una composizione specifica. Tipicamente, l'acido silicico è registrato come xH2O-ySiO2. Sono stati selezionati acidi silici: H2SiO3 (H2O-SiO2) - meta-silicio (tre-ossi-silicio), H4Si04 (2H20-Si02) - orto-silicio (tetra-oxo-silicio), H2Si2O5 (H2O * SiO2) - silicio dimetico.
Gli acidi silicici sono sostanze scarsamente solubili. In accordo con la natura meno metallica del silicio rispetto al carbonio, H2SiO3 come elettrolita è più debole di H2CO3.
Corrispondente agli acidi silici i sali-silicati in acqua sono insolubili (eccetto i silicati di metalli alcalini). I silicati solubili sono idrolizzati dall'equazione
2SiO3 - + H20 = Si2O52- + 20H-.
Le soluzioni concentrate di silicati solubili sono chiamate vetro liquido. Il solito silicato vetroso di sodio e calcio ha una composizione di Na20-CaO-6Si02. È ottenuto per reazione
È nota un'ampia varietà di silicati (più precisamente ossosilicati). Una certa regolarità è osservata nella struttura degli oxosilicati: tutti consistono in tetraedri di Si04, che sono collegati l'un l'altro attraverso un atomo di ossigeno. Le combinazioni più comuni di tetraedri sono (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), che, come unità strutturali, possono essere combinate in catene, nastri, reti e scheletri (Fig. 4).
I silicati naturali più importanti sono, ad esempio, talco (3MgO * H20-4Si02) e amianto (SmgO * H2O * SiO2). Come con SiO2, lo stato vetroso (amorfo) è caratteristico dei silicati. Con la cristallizzazione controllata del vetro, è possibile ottenere uno stato cristallino (sit-in). Le sit-in sono caratterizzate da una maggiore forza.
Oltre ai silicati, gli alluminosilicati sono molto diffusi in natura. Alluminosilicati - ossidi silicati, in cui una parte di atomi di silicio è sostituita da trivalente Al; es. Na12 [(Si, Al) 04] 12.
Per l'acido silicico, uno stato colloidale è caratteristico quando i sali dell'acido H2SiO3 non sono influenzati immediatamente. Soluzioni colloidali di acido silicico (sol) in determinate condizioni (ad esempio, quando riscaldate) possono essere convertite in un gel di massa di acido silicico trasparente, omogeneo e simile al gel. I gel sono composti altamente molecolari con una struttura spaziale molto ampia formata da molecole di SiO2, i cui vuoti sono riempiti con molecole di H2O. Quando si disidrata il gel di silice, si ottiene il gel di silice, un prodotto poroso con elevata capacità di assorbimento.
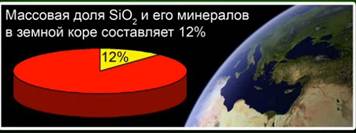
Ossido di silicio (IV) (silice) - il composto più comune nella crosta terrestre, che costituisce il 12% della sua massa sotto forma di vari minerali. Distinguere tra silice cristallina e amorfa. La formula più semplice per l'ossido di silicio (IV) è SiO2. Si cristallizza nel reticolo atomico.
1) Silice cristallina - sotto forma di un minerale di quarzo e sue varietà (cristallo di rocca, calcedonio, agata, diaspro, pietra focaia); il quarzo costituisce la base delle sabbie di quarzo ampiamente utilizzate nella costruzione e nell'industria dei silicati.
2) silice amorfa - nella forma della composizione minerale opalina SiO2 nH2O; le forme terrene di silice amorfa sono diatomite, Tripoli (terra infusoriale); Un esempio di silice amorfa artificiale amorfa è il gel di silice, che è ottenuto dal metasilicato di sodio:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Il gel di silice ha una superficie sviluppata, motivo per cui assorbe bene l'umidità.
Gel di silice è un gel essiccato formato da soluzioni supersature di acido silicico (nSiO2 · mH2O) a pH\u003e 5-6. Solido assorbente idrofilo.
reception
Si ottiene dall'acidificazione di soluzioni di silicato di metalli alcalini, seguita dal lavaggio e dall'asciugatura del gel formato:
Acido silicico SiO2 è l'anidride di un certo numero di acidi silici
L'acido silicico è costruito con unità strutturali tetraedriche (in ciascuna di queste unità l'atomo di silicio si trova al centro del tetraedro e gli atomi di ossigeno si trovano nella parte superiore). I collegamenti strutturali, uniti in catene, formano acidi polisilicici più stabili:
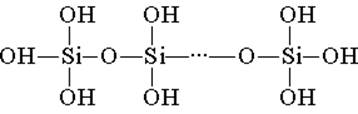
La composizione di un tale composto può essere espressa dalla formula (H2SiO3) n. Tuttavia, l'acido silicico è solitamente rappresentato dalla formula H2SiO3. H2SiO3 - l'acido è molto debole, poco solubile in acqua. Quando riscaldato, si decompone facilmente allo stesso modo dell'acido carbonico:
Tutti gli acidi silicici sono molto deboli (più deboli del carbone).
silicati. I sali di tutti gli acidi silici sono chiamati silicati, sebbene, di regola, nella letteratura educativa i silicati implichino sali dell'acido metacrilallino. La loro composizione è solitamente rappresentata dalla formula sotto forma di composti di ossidi di elementi. Ad esempio, il silicato di calcio CaSiO3 può essere espresso come: CaO × SiO2.
I silicati di composizione R2O × nSiO2, dove R2O è ossidi di sodio o di potassio, sono chiamati vetro solubile e le loro soluzioni acquose concentrate sono chiamate vetro liquido. Il più importante è il vetro solubile nel sodio.
Quando si trovano in aria, le soluzioni dei silicati si sviluppano torbide, poiché l'anidride carbonica (IV) nell'aria allontana l'acido silicico dai suoi sali:
L'acido silicico è praticamente insolubile in acqua - questa proprietà viene utilizzata come reazione qualitativa allo ione SiO32-.
I silicati si ottengono fondendo la silice con alcali o carbonati:
Solubilità dell'acido silicico e la velocità della sua dissoluzione dipende da diversi fattori, tra cui i più importanti sono la modifica del biossido di silicio assunto, il suo grado di dispersione e la temperatura. Quando si agita il gel di silice con acqua, l'equilibrio di solubilità si stabilisce in poche ore, nel caso del quarzo occorrono molti mesi e persino anni.
SILICATI NATURALI (Dal latino silex, morti genere Silicis - selce * a silicati naturali; ... N Naturliche Silikate; f silicati naturels; ... E silicatos Naturales) - classe di minerali, sali di silicio, iso e acidi geteropolikremnievyh. La quota di silicati naturali rappresenta fino al 75% della massa della crosta terrestre e circa il 25% delle specie minerali. In natura, ci sono più di 700 silicati naturali, tra cui i principali minerali che formano le rocce (feldspati, pirosseni, anfiboli, mica, ecc.)
alluminosilicati - un gruppo di silicati naturali e sintetici, i cui anioni complessi contengono silicio e alluminio. Esempi di anioni complessi: -, -, 2 -. Na +, K +, Mg2 +, Ca2 + e talvolta Ba2 + e Li + agiscono come cationi.
Gli alluminosilicati naturali sono i minerali più comuni, rappresentano fino al 50% della massa della crosta terrestre. Questi includono feldspati (albite, ortoclasio, anortite), minerali argillosi e mica.
zeoliti - Questi sono alluminosilicati acquosi di calcio, sodio, potassio, bario e alcuni altri elementi. Il gruppo zeoliti comprende più di quaranta minerali, che differiscono per composizione (in particolare nel numero di molecole d'acqua nel cristallino idrato), e naturalmente sulle proprietà fisiche e chimiche. Ma quasi tutti di questo gruppo di minerali è una proprietà comune - sono buone sorbenti possiedono proprietà di scambio ionico, in grado di cambiare la mobilità dei singoli ioni e lavoro setacci molecolari. E relativamente recentemente, questi minerali hanno trovato un uso completamente inaspettato - hanno cominciato ad essere utilizzati in agricoltura.
Composti di organosilicio - composti nelle cui molecole esiste un legame tra silicio e atomi di carbonio. I composti di organosilicio sono a volte chiamati siliconi, dal nome in silicio latino "silicio". I composti di organosilicio sono usati per produrre lubrificanti, polimeri, gomme, gomme, fluidi siliconici ed emulsioni. Composti di organosilicio sono utilizzati in cosmetici, prodotti chimici per la casa, vernici e vernici, detergenti. Una caratteristica distintiva dei prodotti a base di composti di organosilicio derivati da prodotti a base di composti organici comuni sono, di norma, caratteristiche e caratteristiche di prestazione più elevate, nonché la sicurezza dell'uso umano. I polimeri siliconici possono essere utilizzati per realizzare stampi in cucina. La polimerizzazione di composti di organosilicio e sigillanti è sicura per l'uomo e non richiede l'estrazione.
silossano - composti contenenti atomi di silicio e ossigeno alternati in una molecola. I più alti hanno silossani ad alto peso molecolare - poliorganosilossani; vedi polimeri siliconici.
siliconi (poliorganosilossani) - composti di composti dell'organosilicio ad alto peso molecolare ossigenati con la formula chimica n, dove R = gruppo organico (metile, etile o fenile). Ora questo aderiscono definizione già estremamente raro, in "Siliconi" sono combinati come poliorganosilossani (ad esempio oli di silicone come ICP, idrorepellente tipo di NGL oa basso peso molecolare gomme SKTN) e anche monomeri organosilicio (diversi silani), offuscando la distinzione tra i termini "silicone" e " silicone. "
Silicio metallico  Crystal Silicon
Crystal Silicon
silicio (Si). Questo elemento chimico è 1/4 della composizione della crosta terrestre. Quarzo, cristallo di rocca, sabbia, argilla, granito, mica, amianto - tutto questo composti chimici di silicio
Il silicio è un elemento intermedio (anfotero) e può mostrare proprietà sia metalliche che non metalliche. Può formare composti chimici, sia con metalli che non metalli.
Silicio puro - una sostanza chimicamente semplice di colore grigio, dura, refrattaria e fragile. Crystal Silicon Ha una lucentezza metallica ed è ampiamente utilizzato nell'industria dei semiconduttori (è un semiconduttore).
Il silicio può allungarsi come in uno stato cristallino ( silicio cristallino), e nello stato amorfo ( silicio amorfo). Il silicio cristallino si forma raffreddando una soluzione di silicio amorfo in un metallo fuso. A sua volta, il silicio cristallino è un materiale molto fragile ed è facilmente schiacciato in una polvere amorfa. Così, silicio amorfo è un frammento di cristalli di silicio cristallino.
Nello stato libero, il silicio è piuttosto difficile da ottenere. La sua produzione industriale è associata al recupero del quarzo, la cui formula chimica è SiO 2, la reazione di riduzione è prodotta da coke caldo (carbone).
SiO 2 + C → CO 2 + Si
In laboratorio, il silicio puro viene ridotto dalla sabbia silicea con magnesio metallico usando la seguente reazione:
SiO 2 + 2Mg → Si + 2MgO.
Durante questa reazione si forma una polvere marrone di silicio amorfo. Una volta riscaldata, la polvere può reagire lentamente con soluzioni concentrate di alcali (ad esempio, sodio idrossido NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - la sostanza complessa risultante - detta anche vetro liquido.
È interessante notare che l'attività chimica del silicio dipende dalla dimensione dei suoi cristalli. Il silicio policristallino è meno chimicamente attivo di quello amorfo. Quest'ultimo reagisce facilmente con il fluoro anche a temperatura normale, e ad una temperatura di 400 - 600 0 C reagisce con ossigeno, cloro, bromo, zolfo per formare i corrispondenti composti chimici. A temperature molto elevate, il silicio reagisce con azoto e carbonio per formare, rispettivamente, nitruro e carburo di silicio.
Se si tenta di dissolvere il silicio in una miscela di acido fluoridrico HF (idrofluorico) e acido nitrico HNO 3, la reazione non proseguirà. Ma se conduci una reazione chimica con un alcali, ad esempio, con idrossido di potassio, allora la reazione avverrà con la formazione di un sale di acido silicico
Si + KOH → K 2 SiO 3 + H 2
Se calcinato nella fornace silice (sabbia) con coke, si scopre una sostanza cristallina molto solida. carborundo SiC
SiO 2 + 3C → SiC + 2CO
carborundo - sostanza molto dura e refrattaria. Nell'industria, è prodotto in grandi quantità a causa di queste proprietà. È interessante notare che il reticolo cristallino carburo di silicio simile al reticolo cristallino della sostanza solida - il diamante, ma alcuni atomi di carbonio sono sostituiti da atomi di silicio uniformemente in esso.
A temperature elevate, nonché durante reazioni chimiche sotto l'azione di acidi su composti metallici con silicio, silano SiH 4.
Spighetto - è un gas incolore autoincendiario. Può infiammarsi in aria per formare silice e acqua.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Se l'ossido di silicio SiO 2 viene riscaldato in presenza di carbonio in una corrente di cloro, si verifica una reazione chimica con la formazione di cloruro di silicio
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Cloruro di silicio - è un liquido la cui temperatura di ebollizione è solo di 54 ° C. Il cloruro di silicio si scioglie facilmente in acqua con la formazione di una soluzione di due acidi: silicico e cloridrico
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Se questa reazione chimica procede in un'atmosfera di aria umida, durante la formazione di due acidi comparirà del fumo denso.
Fluoruro di silicio SiF 4 - formato come risultato di una reazione chimica dell'acido fluoridrico e dell'ossido di silicio
SiO 2 + 4HF → SiF 4 + 2H 2 O
Il fluoruro di silicio è un gas incolore con un odore "forte". Oltre al cloruro di silicio, in acqua questo gas forma due acidi: il silicio e l'idrofluorico. Ma interessante, il fluoruro di silicio può interagire con l'acido fluoridrico per formare acido esafluorosilicico la cui formula chimica è H 2 SiF 6. I suoi sali e l'acido stesso sono velenosi.
silicio
Metalli di base e non metalli
In questa lezione studierai il tema del "Silicio". Considerare le informazioni sul silicio: la sua struttura elettronica, dove il silicio è in natura, studia l'allotropia del silicio, spiega le sue proprietà fisiche e chimiche. Scopri dove viene utilizzato il silicio nell'industria e in altre aree, come viene prodotto. Conoscerai la silice, l'acido silicico e i suoi sali, i silicati.
Argomento: metalli di base e non metalli
Lezione: silicio. Gas nobili
Il silicio è uno degli elementi chimici più comuni nella crosta terrestre. Il suo contenuto è quasi del 30%. In natura, si trova principalmente sotto forma di varie forme di biossido di silicio, silicati e alluminosilicati.
Il silicio è tetravalente in quasi tutti i suoi composti. In questo caso, gli atomi di silicio si trovano nello stato eccitato. Fig. 1.
Per entrare in questo stato, uno degli elettroni 3s occupa un posto libero sugli orbitali 3p. In questo caso, invece di 2 elettroni spaiati nello stato fondamentale, l'atomo di silicio nello stato eccitato avrà 4 elettroni spaiati. Sarà in grado di formare 4 legami covalenti con il meccanismo di scambio.


Gli atomi di silicio non sono soggetti alla formazione di legami multipli, ma formano composti con legami singoli-Si-O-. Il silicio, a differenza del carbonio, non è tipico di allotropia.
Uno di la modificazione allotropica è il silicio cristallinoin cui ogni atomo di silicio è in ibridazione sp 3. Fig. 2, 3. Il silicio cristallino è una sostanza cristallina solida, refrattaria e durevole di colore grigio scuro con una lucentezza metallica. In condizioni normali - un semiconduttore. A volte il silicio amorfo viene anche emesso come un'altra modifica allotropica del silicio. È una polvere marrone scuro, più chimicamente attiva del silicio cristallino. Che si tratti di una modifica allotropica è un punto controverso.
Proprietà chimiche del silicio
1. Interazione con alogeni
Si + 2F 2 → SiF 4
2. Una volta riscaldato, il silicio brucia in ossigeno, si forma la silice (IV).
Si + O 2 → SiO 2
3. A temperature elevate, il silicio interagisce con azoto o carbonio.
3Si + 2N 2 → Si 3 N 4
4. Il silicio non reagisce con soluzioni acquose di acidi. Ma si dissolve in alcali.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Quando il silicio viene fuso con i metalli, si formano siliciuri.
Si + 2Mg → Mg 2 Si
6. Il silicio non interagisce direttamente con l'idrogeno, ma i composti di idrogeno del silicio possono essere ottenuti dall'interazione dei siliciuri con l'acqua.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silano)
I silani sono simili nella struttura agli alcani, ma sono notevolmente reattivi. Il monosilano più stabile è infiammabile nell'aria.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Ottenere silicio
Il silicio è ottenuto per riduzione dall'ossido di silicio (IV)
SiO 2 + 2Mg → Si + 2MgO
Uno dei compiti è ottenere silicio di elevata purezza. A tale scopo, il silicio tecnico viene trasferito al tetracloruro di silicio. Il tetracloruro risultante viene ridotto a silano e il silano si decompone in silicio e idrogeno quando riscaldato.
Il silicio è in grado di formare due ossidi: SiO 2 - ossido di silicio (IV) e SiO - ossido di silicio (II).
SiO - ossido di silicio (II) - questa è una sostanza amorfa marrone scuro, che è formata dall'interazione del silicio con l'ossido di silicio (IV)
Si + SiO 2 → 2 SiO.
Nonostante la sua stabilità, questa sostanza non viene quasi mai usata.
SiO 2 - ossido di silicio (IV)


Questa sostanza rappresenta il 12% della crosta terrestre. Fig. 4. È rappresentato da minerali come cristallo di rocca, quarzo, ametista, citrino, diaspro, calcedonio. Fig. 5.
SiO 2 - ossido di silicio (IV) - una sostanza di struttura non molecolare.
Il suo reticolo cristallino è atomico. Fig. 6. I cristalli di SiO 2 hanno la forma di un tetraedro, che sono interconnessi da atomi di ossigeno. La formula della molecola (SiO 2) n sarebbe più corretta. Poiché il SiO 2 costituisce una sostanza della struttura atomica e CO 2 - di una struttura molecolare, la differenza nelle loro proprietà è ovvia. La CO 2 è un gas e SiO 2 è una sostanza cristallina trasparente solida, insolubile in acqua e refrattaria.
Proprietà chimicheSiCirca 2
1. L'ossido di silicio (IV) SiO 2 è un ossido acido. Non reagisce con l'acqua. L'acido silicico non può essere ottenuto con l'idratazione di SiO 2. I suoi sali, silicati, possono essere ottenuti facendo reagire SiO 2 con soluzioni alcaline calde.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Reagisce con i carbonati di metalli alcalini e alcalino-terrosi.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Interagisce con i metalli.
SiO 2 + 2Mg → Si + 2MgO
4. Reazione con acido fluoridrico.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Proprietà chimiche dell'acido silicico e silicati
Ottenere acido silicico
L'acido silicico precipita come composto polimerico. Formule di acido silicico -
H 2 SiO 3 (meta forma) e H 4 SiO 4 (forma orto) - riflettono il rapporto degli elementi, ma non la vera composizione. Convenzionalmente, sul piano, la composizione di acido silicico è rappresentata come Fig. 7.
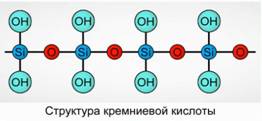
Per l'acido silicico si usa sempre la formula H 2 SiO 3.
1. H 2 SiO 3 si decompone quando riscaldato
H 2 SiO 3 H 2 O + SiO 2 (gel di silice)
2. Interagisce con soluzioni alcaline
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Sali di acido silicico - silicati - Fare riferimento a composti ionici. Queste sono sostanze solide incolori. Solo i silicati di metalli alcalini, ad eccezione del litio, sono solubili in acqua.
1. I silicati solubili sono idrolizzati dall'anione
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. I silicati solubili interagiscono con acidi forti.
Na 2 SiO 3 + 2 HCl → H 2 SiO 3 ↓ + 2NaCl
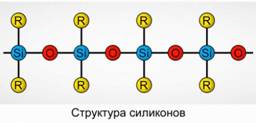
Poliorganosilossani (siliconi)
I poliorganosilossani (siliconi) sono ossigenati, composti di organosilicio ad alto peso molecolare.
R 2 [ SiO] n
R è un gruppo organico (metile, etile o fenile). La base della struttura dei silossani è una catena di atomi di silicio e ossigeno alternati. Figura 8. Variando la lunghezza della catena e i gruppi organici, si possono ottenere siliconi con proprietà diverse. Modificando le condizioni di polimerizzazione, è possibile ottenere molecole di diversa lunghezza.


I polimeri a catena corta sono liquidi, quelli più lunghi sono lubrificanti preziosi. Fig. 9, che mantengono le loro proprietà in un enorme intervallo di temperature da
100 0 С a + 300 0 С. Le molecole più lunghe formano gomme che non perdono la loro elasticità a basse temperature. Possiedono un'alta resistenza all'attrito, sono chimicamente inerti. Fig. 10. Provoca varie varianti della loro applicazione. Possono essere utilizzati per creare macchine artificiali a cuore o rene e possono essere utilizzate come scarpe per scarpe. I polimeri silossanici sono usati in medicina per creare vari impianti di tessuti molli, poiché tali polimeri sono chimicamente inerti e non vengono rigettati dal corpo. Non sono inumiditi con acqua. È usato nelle creme. Quando applica questa crema sulle sue mani, sostituirà i guanti di gomma.
Giardino inorganico
In un becher trasparente riempito con silicato di sodio, immergere i cristalli di sali colorati, ad esempio il solfato di rame. Dopo qualche tempo, si può vedere che sottili tubi cavi formati dai cristalli, che consistono di silicati insolubili. Fig. 11.

Ottenere stucco "stupido"
Uguali volumi di silicato di sodio e alcool medico sono mescolati. Il precipitato viene filtrato e schiacciato in modo da non gocciolare l'alcol. Questo è mastice. Fig. 12. Si chiama così perché è stato pianificato di usarlo come stucco per Windows. Ma si è scoperto che ha tali proprietà che non può essere utilizzato per lo scopo previsto. Se tiri la palla e la butti sul pavimento, rimbalza come una palla di gomma. Se messo sul tavolo, si diffonderà come un liquido. Se colpisci un oggetto solido, si frantumerà come un corpo solido. Dopo un po ', quando l'alcol si asciuga, questo mastice si sbriciolerà.
![]()
Riassumendo la lezione
In questa lezione, hai studiato l'argomento "Silicio". Abbiamo esaminato le informazioni sul silicio: la sua struttura elettronica, dove il silicio si trova in natura, ha studiato l'allotropia del silicio, ha spiegato le sue proprietà fisiche e chimiche. Hanno imparato a sapere dove viene utilizzato il silicio nell'industria e in altre aree, come viene prodotto. Hai incontrato la silice, l'acido silicico e i suoi sali - silicati.
riferimenti
1. Rudzitis G.E. Chimica. Nozioni di base di chimica generale. Grade 11: libro di testo per istituzioni educative: livello base / G.E. Rudzitis, F.G. Feldman. - 14 ed. - M.: Illuminismo, 2012.
2. Popel P.P. Chimica: 8 cl .: libro di testo per scuole secondarie / PP. Popel, L.S. - К.: ИЦ "Accademia", 2008. - 240 p .: Ill.
3. Gabrielyan O.S. Chimica. 11 ° grado. Livello base 2a ed., Sr. - M.: Drofa, 2007. - 220 p.
compito
1. №№2-4 (p 138) Rudzitis G.E. Chimica. Nozioni di base di chimica generale. Grade 11: libro di testo per istituzioni educative: livello base / G.E. Rudzitis, F.G. Feldman. - 14 ed. - M.: Illuminismo, 2012.
2. Quali sono le applicazioni dei poliorganosilossani.
3. Confronta le proprietà delle modifiche allotropiche del silicio.
