Composti di zolfo Il grado di ossidazione dello zolfo nei composti. Formule di composti di zolfo. Zolfo. Acido solfidrico. solfuri
Zolfo, le sue proprietà fisiche e chimiche. Il valore biologico dello zolfo, la sua applicazione (demercurazione).
Cera in natura
Zolfo nativo
PbS - piombo brillare
Cu 2 s - lucentezza del rame
ZnS - blenda di zinco
FeS 2 - pirite, pirite di zolfo, oro di gatto
H 2 s - idrogeno solforato (in fonti minerali e gas naturale)
CaSO 4 * 2H2 O- gesso
MgSO 4 * 7H2 O - sale amaro (inglese)
Na 2 SO 4 * 10 H 2 O - Sale di Glauber (mirabilite)
Proprietà fisiche
La sostanza cristallina solida è gialla, insolubile in acqua, non si bagna con acqua (galleggia sulla superficie), t ° kip = 445 ° С.
Una delle proprietà fisiche speciali dello zolfo ègalleggiamento, la capacità della polvere sottile di zolfo di galleggiare, quindi, mentre i suoi grandi cristalli affondano nell'acqua. Il fatto è che lo zolfo non è bagnato dall'acqua e le sue particelle sono trattenute sulla superficie dell'acqua a causa delle piccole bolle d'aria che vi aderiscono.Questa proprietà viene utilizzata nella separazione dello zolfo nativo dalle impurità. Macina il minerale, riempilo d'acqua e soffialo dal basso con l'aria, lo zolfo galleggia e le impurità rimangono sul fondo.allotropia
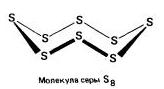
Lo zolfo è caratterizzato da diverse modifiche allotropiche., ma le modifiche più famose sono:rombico (Cristallino) , monoclino (Ago) e plastica .
Rombico (a - zolfo) - S 8
t ° pl. = 113 ° C; ρ = 2,07 g / cm 3. La modifica più stabile.
Monoclino (b - zolfo) - S 8
aghi giallo scurot ° pl. = 119 ° C; ρ = 1,96 g / cm3. Stabile a temperature superiori a 96 ° C; in condizioni normali si trasforma in rombico.
plastica S n
massa gommosa (amorfa) marrone. Instabile, quando solidificato si trasforma in rombico.
PRODUZIONE DI ZOLFO DI PLASTICA
La struttura dell'atomo di zolfo
Posizionamento di elettroni per livelli e sottolivelli
Stato fondamentale
1s 2 2s 2 2p 6 3s 2 3p 4
Posizionamento di elettroni di
orbitali (ultimo strato)grado di
ossidazionevalenza
In condizioni di base
Primo stato eccitato
Secondo stato eccitato
Produzione di zolfo
1. Metodo industriale: fusione dal minerale usando vapore acqueo.
2. Ossidazione incompleta dell'idrogeno solforato (con mancanza di ossigeno).
2H 2 S + O 2 = 2S + 2H 2 O
3. La reazione di Wackenroder
2H 2 S + SO 2 = 3S + 2H 2 O
Proprietà chimiche dello zolfo
Lo zolfo è un agente ossidante S 0 + 2ē→ S -2 | zolfo - agente riducente: S - 4ē→ S +4; S - 6ē→ S +6 |
1. L'interazione di zolfo contutti i metalli alcalini e alcalino-terrosi, rame, mercurio, argento senza riscaldamento: 2 Na + S→ Na 2 S ESPERIENZA S + Hg = HgS Mercurio ha un'alta volatilità. Le sue coppie sono velenose. Questa reazione è alla base della rimozione e smaltimento del mercurio, ad esempio, da un termometro medico rotto. Luoghi dai quali è impossibile estrarre goccioline di mercurio sono ricoperti di polvere di zolfo. Lo zolfo e il mercurio reagiscono quando vengono toccati. Di conseguenza, si forma una sostanza chimicamente inerte e innocua. Questo processo è chiamato demercurazione. 2. L'interazione di zolfoc altri metalli (eccettoAu, Pt) a t ° elevato: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS ESPERIENZA Cu + S t
→
ESPERIENZA DI CUS 3. Interazione zolfo con alcuni non metalli da formare composti binari: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. L'interazione dello zolfo con l'ossigeno: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. L'interazione di zolfoc alogeni (eccetto iodio): S + Cl 2→ S + 2 Cl 2 ** Interazione zolfo con acidi - agenti ossidanti: S + 2H 2 SO 4 (conc)→ 3S + 4 O 2 + 2H 2 O S + 6HNO 3 (conc)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Reazioni sproporzionate: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
applicazione
Vulcanizzazione della gomma, ottenimento di ebanite, produzione di fiammiferi, polvere da sparo, lotta contro i parassiti dell'agricoltura, per uso medico (unguento sulfureo per il trattamento delle malattie della pelle), per ottenere acido solforico, ecc.
compitoparagrafo 21; esercizi 1, 3, 4 pp. 99-100.
Voti aggiuntivi
Completa le equazioni di reazione, p disporre i coefficienti mediante il metodo del bilanciamento elettronico, specificare l'agente ossidante, l'agente riducente.
№2. Effettuare la trasformazione secondo lo schema:
Questo è interessante ...
- Il contenuto di zolfo nel corpo umano del peso di 70 kg - 140 g.
- Una persona ha bisogno di 1 g di zolfo al giorno.
- Piselli, fagioli, farina d'avena, grano, carne, pesce, frutta e succo di mango sono ricchi di zolfo.
- Lo zolfo fa parte di ormoni, vitamine, proteine, è nel tessuto cartilagineo, nei capelli, nelle unghie. Con una mancanza di zolfo nel corpo, c'è una fragilità delle unghie e delle ossa, perdita di capelli.
Guarda la tua salute!Lo sai ..
- I composti di zolfo possono servire come farmaci;
- Zolfo - la base dell'unguento per il trattamento delle malattie della pelle fungine, per combattere la scabbia. Tiosolfato di sodio Na 2 S 2 O 3 usato per combatterlo.
- Molti sali di acido solforico contengono acqua di cristallizzazione: ZnSO 4 × 7H 2 O e CuSO 4 × 5H 2 A. Sono usati come antisettici per la spruzzatura di piante e per la cura del grano nella lotta contro i parassiti dell'agricoltura.
- Ferro vetriolo FeSO 4 × 7H 2 O è usato per l'anemia.
- BaSO 4 utilizzato per l'esame radiografico dello stomaco e dell'intestino.
- Allume di alluminio di potassio KAI (SO 4) 2 × 12H 2 O - emostatico con tagli.
- Mineral Na 2 SO 4 × 10H 2 O è chiamato "sale di Glauber" in onore del chimico tedesco Glauber I.R. Glauber che lo scoprì nell'VIII secolo e si ammalò improvvisamente durante il suo viaggio. Non poteva mangiare nulla, il suo stomaco si rifiutava di mangiare. Uno dei locali lo ha mandato alla fonte. Appena ha bevuto l'amara acqua salata, ha immediatamente iniziato a mangiare. Glauber ha studiato quest'acqua, il sale Na cristallizzato da esso. 2 SO 4 × 10H 2 A. Ora è usato come lassativo in medicina, nella tintura di tessuti di cotone. Il sale trova anche uso nella produzione di vetro.
- Yarrow ha una maggiore capacità di estrarre lo zolfo dal terreno e di stimolare l'assorbimento di questo elemento con le piante vicine.
- L'aglio rilascia una sostanza - albucide, composto di zolfo caustico. Questa sostanza previene il cancro, rallenta l'invecchiamento, previene le malattie cardiache.
Il sottogruppo calcogeno include zolfo - questo è il secondo degli elementi che è in grado di formare un gran numero di depositi di minerali. Solfati, solfuri, ossidi e altri composti dello zolfo sono molto diffusi, importanti nell'industria e nella natura. Pertanto, in questo articolo consideriamo ciò che sono, ciò che è lo zolfo stesso, la sua sostanza semplice.
Zolfo e le sue caratteristiche
Questo elemento ha la seguente posizione nel sistema periodico.
- Il sesto gruppo, il sottogruppo principale.
- Il terzo piccolo periodo.
- La massa atomica è 32.064.
- Il numero di sequenza è 16, il numero di protoni ed elettroni è lo stesso, e ci sono anche 16 neutroni.
- Si riferisce a elementi non metallici.
- La formula recita "es", il nome dell'elemento zolfo, zolfo latino.
In natura, ci sono quattro isotopi stabili con numeri di massa 32,33,34 e 36. Questo elemento è il sesto più abbondante in natura. Appartiene ai nutrienti, come parte delle importanti molecole organiche.
Struttura elettronica dell'atomo
I composti di zolfo devono la loro diversità alle caratteristiche della struttura elettronica dell'atomo. È espresso dalla seguente formula di configurazione: 1s 2 2s 2 2p 6 3s 2 3p 4.
La procedura sopra riportata riflette solo lo stato stazionario dell'elemento. Tuttavia, è noto che se un atomo viene informato di energia aggiuntiva, allora gli elettroni possono essere separati dai sottolivelli 3p e 3s, con la successiva successiva transizione a 3d, che rimane libera. Di conseguenza, non solo la valenza dell'atomo cambia, ma anche tutti i possibili stati di ossidazione. Il loro numero aumenta in modo significativo, così come il numero di diverse sostanze con zolfo.
Gradi di ossidazione dello zolfo nei composti
Ci sono diverse opzioni principali per questo indicatore. Per lo zolfo è:
Di questi, S +2 è più raro, il resto è disperso ovunque. Il grado di ossidazione dello zolfo nei composti dipende dall'attività chimica e dalla capacità ossidativa dell'intera sostanza. Ad esempio, composti con -2 sono solfuri. In essi, l'elemento da noi considerato è un tipico agente ossidante.
Più alto è il grado di ossidazione nel composto, più pronunciata la capacità ossidante della sostanza. Questo è facilmente visibile se ricordiamo i due acidi basici che lo zolfo forma:
- H 2 SO 3 - solforoso;
- H 2 SO 4 - zolfo.
È noto che quest'ultimo è un composto molto più stabile e forte, che possiede in alta concentrazione una capacità di ossidazione molto grave.
Sostanza semplice
Come sostanza semplice, lo zolfo rappresenta dei bellissimi cristalli gialli di una forma regolare regolare e allungata. Anche se questa è solo una delle sue forme, perché ci sono due sostanze principali. Il primo, monoclino o rombico, è giallo che non può essere dissolto in acqua, ma solo in solventi organici. Differisce in fragilità e una bella forma della struttura, presentata sotto forma di corona. Punto di fusione - circa 110 0 С.
Se non si dimentica il tempo intermedio durante il riscaldamento di tale modifica, è possibile rilevare un altro stato nel tempo - zolfo di plastica. È una soluzione viscosa gommosa, di un colore marrone, che, dopo un ulteriore riscaldamento o raffreddamento rapido, si trasforma nuovamente in una forma rombica.
Se parliamo di zolfo chimicamente puro, ottenuto per filtrazione ripetuta, allora si tratta di piccoli cristalli gialli brillanti, fragili e completamente insolubili in acqua. In grado di accendersi al contatto con umidità e ossigeno nell'aria. Differiscono in un'attività chimica piuttosto alta.

Essere nella natura
In natura esistono depositi naturali dai quali vengono estratti composti di zolfo e si tratta di una sostanza semplice. Inoltre, è contenuto:
- in minerali, minerali e rocce;
- nel corpo di animali, piante ed esseri umani, come parte di molte molecole organiche;
- nei gas naturali, petrolio e carbone;
- in scisti combustibili e acque naturali.
Alcuni dei minerali più ricchi di zolfo sono:
- cinabro;
- pirite;
- sfalerite;
- stibnite;
- galena e altri.
La maggior parte dello zolfo prodotto oggi va alla produzione di solfati. Un'altra parte è utilizzata per scopi medici, agricoltura, processi industriali per la produzione di sostanze.
Proprietà fisiche
Possono essere descritti in diversi punti.
- È insolubile in acqua, in disolfuro di carbonio o trementina - è ben sciolto.
- Con l'attrito prolungato si accumula una carica negativa.
- Il punto di fusione è 110 0 С.
- Punto di ebollizione 190 0 C.
- Quando raggiunge 300 0 C, diventa liquido, facilmente mobile.
- La sostanza pura può accendere molto bene le proprietà combustibili.
- L'odore in sé non ha quasi alcun effetto, ma i composti di idrogeno dello zolfo emanano un forte odore di uova marce. Proprio come alcuni rappresentanti binari gassosi.
Le proprietà fisiche della sostanza in questione sono note alle persone sin dall'antichità. È proprio per la sua infiammabilità che lo zolfo ha ricevuto un tale nome. Nelle guerre, hanno usato fumi soffocanti e velenosi, che si formano durante la combustione di questo composto, come un'arma contro i nemici. Inoltre, anche gli acidi che coinvolgono lo zolfo hanno sempre avuto un'importanza industriale importante.

Proprietà chimiche
Oggetto: "Lo zolfo e le sue sostanze" in un corso di chimica scolastica non richiede una lezione, ma diverse. Dopo tutto, molti di loro. Ciò è dovuto all'attività chimica della sostanza. Può esibire sia proprietà ossidanti con agenti riducenti più forti (metalli, boro, ecc.), Sia proprietà riducenti con la maggior parte dei non metalli.
Tuttavia, nonostante questa attività, solo con fluoro, l'interazione procede in condizioni normali. Tutti gli altri richiedono il riscaldamento. Esistono diverse categorie di sostanze con le quali lo zolfo può interagire:
- metalli;
- non metalli;
- alcali;
- acidi forti ossidanti - solforico e nitrico.
Composti di zolfo: varietà
La loro diversità sarà spiegata dal valore ineguale del grado di ossidazione dell'elemento principale: lo zolfo. Pertanto, puoi selezionare diversi tipi principali di sostanze per questa funzione:
- composti con stato di ossidazione -2;
Se consideriamo le classi, e non un indicatore di valenza, allora questo elemento forma molecole come:
- acido;
- ossidi;
- sale;
- composti binari con non-metalli (disolfuro di carbonio, cloruri);
- materia organica.
Ora considera i principali e fornisci esempi.

Sostanze con stato di ossidazione -2
I composti di zolfo 2 sono le sue conformazioni con i metalli, così come con:
- di carbonio;
- idrogeno;
- fosforo;
- silicio;
- arsenico;
- boro.
In questi casi, agisce come un agente ossidante, dal momento che tutti gli elementi elencati sono più elettropositivi. Consideri il più importante di loro
- Disolfuro di carbonio - CS 2. Liquido limpido con un caratteristico aroma gradevole di etere. È tossico, infiammabile ed esplosivo. Utilizzato come solvente e per la maggior parte dei tipi di oli, grassi, non metalli, nitrati d'argento, resine e gomme. È anche una parte importante nella produzione di rayon - rayon. Nell'industria, è sintetizzato in grandi quantità.
- Idrogeno solforato o idrogeno solforato - H 2 S. Il gas, che non ha colore e sapore dolce. L'odore è forte, estremamente sgradevole, ricorda un uovo marcio. Velenoso, deprime il centro respiratorio, poiché lega gli ioni di rame. Pertanto, se è avvelenato, soffoca e muore. È ampiamente usato nella medicina, nelle sintesi organiche, nella produzione di acido solforico e anche come materia prima efficiente dal punto di vista energetico.
- I solfuri metallici sono ampiamente usati in medicina, nella produzione di solfati, nella produzione di vernici, nella fabbricazione di fosfori e in altri luoghi. La formula generale è Me x S y.

Composti con stato di ossidazione +4
I composti di zolfo 4 sono principalmente ossido e i corrispondenti sali e acido. Tutti loro sono composti abbastanza comuni che hanno un certo valore nell'industria. Possono agire come agenti ossidanti, ma più spesso mostrano proprietà riducenti.
Le formule per composti di zolfo con stato di ossidazione +4 sono le seguenti:
- ossido - diossido di zolfo SO 2;
- acido - solforoso H 2 SO 3;
- i sali hanno la formula generale Me x (SO 3) y.
Uno dei più comuni è o anidride. È una sostanza incolore con l'odore di un fiammifero bruciato. Nei grandi gruppi formati durante l'eruzione dei vulcani, è in questo momento facile da determinare dall'odore.
Si scioglie in acqua con la formazione di un acido facilmente solubile in decomposizione, acido solforoso. Si comporta come una tipica forma di sale, che si presenta sotto forma di ione solfito SO 3 2-. Questa anidride è il gas principale che influenza l'inquinamento dell'atmosfera circostante. Colpisce la formazione dell'industria utilizzata nella produzione di solfati.
Composti in cui lo zolfo ha uno stato di ossidazione di +6
Questi includono, soprattutto, anidride solforica e acido solforico con i loro sali:
- solfati;
- solfato di idrogeno.
Poiché l'atomo di zolfo in essi è altamente ossidato, le proprietà di questi composti sono abbastanza esplicabili. Sono forti agenti ossidanti.
Ossido di zolfo (VI) - anidride solforosa - è un liquido volatile incolore. Una caratteristica caratteristica è una forte capacità disseccante. All'aperto fuma. Quando sciolto in acqua dà uno degli acidi minerali più forti - solforico. La sua soluzione concentrata è un liquido oleoso, leggermente giallastro. Se l'anidride viene sciolta nell'acido solforico, si ottiene un composto speciale, chiamato oleum. È usato nell'industria per la produzione di acido.
Tra i sali - solfati - composti come:
- gesso CaSO 4 · 2H 2 O;
- barite BaSO 4;
- i sali;
- solfato di piombo e altri
Sono utilizzati nell'edilizia, nella sintesi chimica, nella medicina, nella fabbricazione di dispositivi e occhiali ottici e persino nell'industria alimentare.
Gli idrosolfati sono ampiamente usati nella metallurgia, dove sono usati come flusso. Inoltre, aiutano a tradurre molti ossidi complessi in solfati solubili, che vengono utilizzati nelle industrie pertinenti.
Lo studio dello zolfo nel corso di chimica scolastica
Quando è meglio che gli studenti apprendano cos'è lo zolfo, quali sono le sue proprietà, cos'è un composto di zolfo? Grado 9 - il periodo migliore. Questo non è l'inizio quando tutto è nuovo e incomprensibile per i bambini. Questo è il punto centrale nello studio della scienza chimica, quando le basi poste in precedenza aiuteranno a comprendere appieno l'argomento. Pertanto, è la seconda metà della classe senior ad essere allocata per la considerazione di questi problemi. Allo stesso tempo, l'intero argomento è diviso in diversi blocchi, in cui la lezione "Composti di zolfo - Grado 9" si trova separatamente.
Questo è dovuto alla loro molteplicità. Anche separatamente affrontato il problema della produzione di acido solforico nel settore. In generale, una media di 3 ore è dedicata a questo argomento.
Ma lo zolfo viene portato fuori per studiare solo nel 10 ° grado, quando vengono prese in considerazione le questioni organiche. Sono anche influenzati dalla biologia al liceo. Dopotutto, lo zolfo fa parte di tali molecole organiche come:
- thyspirits (tioli);
- proteine (struttura terziaria, su cui si formano i ponti disolfuro);
- tioaldeidi;
- tiofenoli;
- tioesteri;
- acidi solfonici;
- solfossidi e altro.
Si distinguono in un gruppo speciale di composti organo-solforati. Sono importanti non solo nei processi biologici degli esseri viventi, ma anche nell'industria. Ad esempio, gli acidi solfonici sono la base di molti farmaci (aspirina, sulfonamide o streptocide).
Inoltre, lo zolfo è un componente permanente di composti come alcuni:
- amminoacidi;
- enzimi;
- vitamine;
- ormoni.
A temperatura ambiente, lo zolfo reagisce solo con il mercurio. Con l'aumentare della temperatura, la sua attività aumenta in modo significativo. Quando riscaldato, lo zolfo reagisce direttamente con molte sostanze semplici, ad eccezione di gas inerti, azoto, selenio, tellurio, oro, platino, iridio e iodio. Solfuri di azoto e oro sono ottenuti indirettamente.
Interazione con metalli
Lo zolfo presenta proprietà ossidanti, in seguito all'interazione si formano solfuri:
Interazione con idrogeno si verifica a 150-200 ° С:
H 2 + S = H 2 S.
Interazione con ossigeno
Lo zolfo brucia in ossigeno a 280 ° C, in aria a 360 ° C e si forma una miscela di ossidi:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Interazione con fosforo e carbonio
Se riscaldato senza aria, lo zolfo reagisce con fosforo, carbonio, mostrando proprietà ossidanti:
2P + 3S = P 2 S 3;
Interazione di fluoro
In presenza di forti agenti ossidanti presenta proprietà riducenti:
S + 3F 2 = SF 6.
Interazione con sostanze complesse
Quando si interagisce con sostanze complesse, lo zolfo si comporta come un agente riducente:
S + 2HNO 3 = 2NO + H 2 SO 4.
Reazione sproporzionata
Lo zolfo è capace di reazioni sproporzionate, quando si interagisce con solfuri alcalini e solfiti si formano:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Produzione di zolfo
Dai minerali nativi
Quando si riscalda la pirite senza accesso all'aria
FeS 2 = FeS + S.
L'ossidazione dell'idrogeno solforato con mancanza di ossigeno
2H 2 S + O 2 = 2S + 2H 2 O.
Dai gas di scarico dei forni metallurgici e di cokeria, quando riscaldati in presenza di un catalizzatore
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. Acido solfidrico
Composto di zolfo idrogeno - idrogeno solforato H 2 S . L'idrogeno solforato è un composto covalente. La struttura della molecola è simile alla struttura della molecola d'acqua, l'atomo di zolfo è nello stato di ibridazione sp 3, tuttavia, a differenza dell'acqua, le molecole di idrogeno solforato non formano legami idrogeno tra loro. L'atomo di zolfo è meno elettronegativo dell'atomo di ossigeno, ha una dimensione maggiore e, di conseguenza, una densità di carica inferiore. L'angolo di valenza HSH è 91,1 °, la lunghezza del legame H-S è 0,133 nm.
Proprietà fisiche
In condizioni normali, l'idrogeno solforato è un gas incolore, con un forte odore caratteristico di uova marce. T pl = -86 ° C T kip = -60 ° C, scarsamente solubile in acqua, a 20 ° C, 2,55 ml di H 2 S si scioglie in 100 g di acqua Molto tossico, causa la paralisi se inalato, che può essere fatale. In natura, viene rilasciato nella composizione di gas vulcanici, formato dal decadimento di organismi vegetali e animali. È solubile in acqua, quando disciolto forma un acido acido solfidrico debole.
Proprietà chimiche
In soluzione acquosa, l'idrogeno solforato ha le proprietà di un debole acido bibasico:
H 2 S = HS - + H +;
HS - = S 2- + H +.
L'acido solfidrico brucia nell'aria fiamma blu. Con accesso limitato all'aria, si forma zolfo libero:
2H 2 S + O 2 = 2H 2 O + 2S.
Con un eccesso di accesso all'aria, la combustione dell'idrogeno solforato porta alla formazione dell'ossido di zolfo (IV):
2H 2 S + 3O 2 = 2H 2 O + 2 SO 2.
L'idrogeno solforato ha proprietà riducenti. A seconda delle condizioni, l'idrogeno solforato può essere ossidato in soluzione acquosa a zolfo, anidride solforosa e acido solforico.
Ad esempio, scolora l'acqua del bromo:
H 2 S + Br 2 = 2HBr + S.
interagisce con l'acqua di cloro:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Un getto di idrogeno solforato può essere infiammato usando diossido di piombo, poiché la reazione è accompagnata da un ampio rilascio di calore:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
L'interazione dell'idrogeno solforato con biossido di zolfo utilizzato per produrre zolfo dai gas di scarico della produzione metallurgica e solfatica:
SO 2 + 2H 2 S = 3S + 2H 2 O.
La formazione di zolfo nativo nei processi vulcanici è associata a questo processo.
Con la trasmissione simultanea di anidride solforosa e idrogeno solforato attraverso la soluzione alcalina, si forma tiosolfato:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
L'idrogeno solforato in condizioni normali è un gas incolore e molto tossico con un odore caratteristico di uova marce.
Per ottenerlo in laboratorio, l'acido cloridrico diluito viene solitamente aggiunto al solfuro:
Un altro modo per produrre acido solfidrico è aggiungere acqua fredda al solfuro di alluminio:
L'idrogeno solforato ottenuto in questo modo è più pulito.
L'idrogeno solforato è un composto covalente. Le sue molecole hanno una struttura curva simile alla struttura delle molecole d'acqua (vedi la sezione 2.2). Tuttavia, a differenza dell'acqua, le molecole di idrogeno solforato non formano legami di idrogeno l'uno con l'altro. Il fatto è che l'atomo di zolfo è meno elettronegativo dell'atomo di ossigeno, ma ha una dimensione maggiore. Pertanto, l'atomo di zolfo ha una densità di carica molto più bassa dell'atomo di ossigeno. A causa della mancanza di legami idrogeno, l'idrogeno solforato ha un punto di ebollizione inferiore rispetto all'acqua. L'assenza di legami idrogeno nell'idrogeno solforato spiega anche la sua scarsa solubilità in acqua.
In soluzione acquosa, l'idrogeno solforato ha le proprietà di un debole acido bibasico:
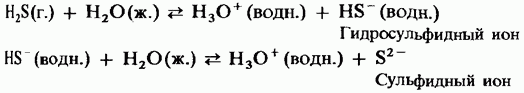
L'idrogeno solforato brucia nell'aria con una fiamma blu. Con un limitato accesso all'aria, la combustione dell'idrogeno solforato è accompagnata dal rilascio di zolfo libero, che si condensa sulla superficie fredda della nave:
Con un eccesso di accesso all'aria, la combustione dell'idrogeno solforato porta alla formazione di anidride solforosa:
L'idrogeno solforato ha proprietà riducenti. Ad esempio, scolora l'acqua del bromo e riduce gli ioni agli ioni.
L'idrogeno solforato come acido dibasico può formare due file di sali: solfuri e idrosolfuri (vedi sopra). I solfuri di metalli alcalini si sciolgono in acqua per formare soluzioni alcaline. Ciò si verifica a seguito di idrolisi:
Solfuri insolubili di altri metalli possono essere precipitati da soluzioni acquose di sali di questi metalli facendo passare idrogeno solforato attraverso la soluzione. Per esempio, facendo passare idrogeno solforato attraverso una soluzione contenente ioni, si forma un precipitato di solfuro nero
Questa reazione viene utilizzata come campione analitico per l'idrogeno solforato.
Ossidi di zolfo
Lo zolfo forma diversi ossidi, di cui due sono i più importanti: anidride solforosa e triossido di zolfo.
Il diossido di zolfo è un gas denso e incolore con un odore acuto e soffocante. In condizioni di laboratorio, può essere ottenuto bruciando zolfo in aria o ossigeno, aggiungendo una soluzione acida diluita calda ad un po 'di sale solfito o riscaldando l'acido solforico concentrato con il rame:
Ossido acido diossido di zolfo. Si scioglie facilmente in acqua, formando acido solforoso. Questo acido è solo parzialmente ionizzato e, quindi, è un acido debole:
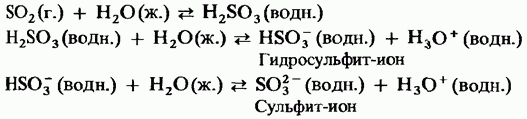
Facendo passare il biossido di zolfo attraverso la soluzione di idrossido di sodio, si forma solfito di sodio. Solfito di sodio, reagendo con un eccesso di anidride solforosa, forma idrosolfito di sodio.Queste reazioni sono simili alla reazione di biossido di carbonio con acqua di calce.
Sia l'anidride solforosa gassosa che la sua soluzione acquosa sono agenti riducenti. Ad esempio, l'anidride solforosa gassosa riduce l'ossido per formare solfato e l'acido solforico riduce l'ione allo ione
Il biossido di zolfo in condizioni industriali si ottiene arrostendo zolfo o minerali di solfuro nell'aria e viene utilizzato come prodotto intermedio nel processo di ottenimento dell'acido solforico (vedi capitolo 7). L'anidride solforosa viene utilizzata nell'industria della cellulosa, per la sbiancatura dei tessuti e per la lavorazione di frutta e verdura durante la conservazione a lungo termine.
L'anidride solforosa svolge un ruolo significativo nell'inquinamento atmosferico e specialmente nella formazione di piogge acide. Nell'atmosfera, è ossidato a triossido di zolfo:
In condizioni normali, questo processo procede piuttosto lentamente, ma in presenza di un catalizzatore, può essere notevolmente accelerato, proprio come accade nel processo di contatto per la produzione di acido solforico. Piccole quantità di composti di ferro e manganese nell'atmosfera sembrano catalizzare l'ossidazione del biossido di zolfo. Il triossido di zolfo risultante reagisce con l'umidità presente nell'aria e quindi appaiono nubi che trasportano piogge acide (vedi anche cap. 12).
Il triossido di zolfo solido è un composto polimorfico. Le sue due forme più importanti: il primo è un trimero a struttura ciclica (Fig. 15.24, a); i cristalli sono trasparenti ha una struttura polimerica aciclica (Fig. 15.24, b); esiste sotto forma di aghi. Punto di fusione In presenza di umidità, si trasforma gradualmente in entrambe le forme bollire a 45 ° C. Il vapore di triossido di zolfo è costituito da molecole piatte simmetriche isolate.
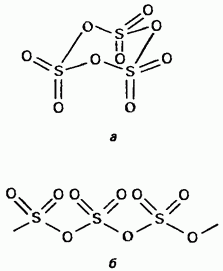
Fig. 15.24. Triossido di zolfo, struttura a - ciclica, struttura b - aciclica.
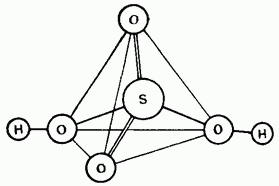
Fig. 15.25. La struttura della molecola di acido solforico.
In condizioni di laboratorio, il triossido di zolfo si ottiene riscaldando il solfato
Il triossido di zolfo ha forti proprietà acide. Reagisce esotermicamente con l'acqua per formare acido solforico:
Il triossido di zolfo è un forte agente ossidante. Ad esempio, ossida l'idrogeno bromuro per liberare il bromo.
Acido solforico
L'acido solforico è un liquido caustico oleoso incolore. È uno dei più importanti prodotti chimici industriali. La sua produzione industriale utilizzando il processo di contatto e l'applicazione sono descritti nel cap. 7.
L'acido solforico non diluito è un composto covalente. Le sue molecole hanno una struttura tetraedrica (Fig. 15.25).
L'acido solforico bolle e si decompone a 340 ° C formando triossido di zolfo e acqua
L'alto punto di ebollizione e l'alta viscosità dell'acido solforico, apparentemente, sono dovuti alla presenza di legami idrogeno tra gli atomi di idrogeno e gli atomi di ossigeno delle molecole vicine.
L'acido solforico è un forte acido bibasico. In acqua, è completamente ionizzato, formando ioni idrosolfato e solfato:
L'acido solforico è coinvolto in tutte le reazioni caratteristiche degli acidi. Reagisce con i metalli, formando solfati di questi metalli e idrogeno, nelle reazioni con i carbonati forma solfati, anidride carbonica e acqua, e nelle reazioni con basi e alcali si formano solfati o idrosolfati.
L'acido solforico concentrato reagisce molto violentemente con l'acqua. Per questo motivo, l'acido solforico deve essere sempre diluito versandolo nell'acqua e non viceversa. Questo acido è igroscopico, cioè è in grado di assorbire umidità dall'aria. Pertanto, è usato per asciugare gas che non reagiscono con esso, facendoli passare attraverso l'acido solforico. L'affinità dell'acido solforico con l'acqua è così grande che l'acido solforico può fungere da agente disidratante; sotto l'azione dell'acido solforico concentrato:
cristalli blu di solfato pentaidrato formano solfato anidro
i carboidrati, come il saccarosio, sono carbonizzati:
la carta è anche carbonizzata dall'azione dell'acido solforico concentrato, che è causato dall'azione dell'acido sulle fibre di cellulosa;
l'etanolo viene convertito in etilene:
(disidratazione con etanolo con acido solforico, effettuata in controllo
condizioni, porta alla formazione di etossietano (dietil etere), e questa reazione è usata per produrre etossietano su scala industriale);
una miscela di clorobenzene e tricloroetanico (cloruro) è disidratata (vedi sezione 16.3).
L'acido solforico concentrato è un forte agente ossidante. Ossida metalli e non metalli. Per esempio
Come altri esempi che illustrano le proprietà ossidative dell'acido solforico concentrato, indichiamo l'ossidazione degli ioni agli ioni, così come gli ioni bromuro al bromo libero nelle seguenti reazioni:
Infine, l'acido solforico è usato come agente solfatante in chimica organica (vedi capitolo 17).
Solfati, solfiti e composti del tio
Lo ione solfato ha una struttura tetraedrica simile alla struttura della molecola di acido solforico.
Salt. I solfati si formano nelle reazioni dell'acido solforico diluito con metalli, i loro ossidi, idrossidi o carbonati. Ad eccezione del solfato di bario e i solfati rimanenti sono solubili in acqua. Il solfato di calcio ha una bassa solubilità in acqua. I solfati sono solitamente resistenti al calore. Le uniche eccezioni sono i solfati di ferro. Ad esempio, il solfato si decompone quando riscaldato per formare ossido di ferro:
Per rilevare ioni solfato in qualsiasi soluzione, viene aggiunta una soluzione acquosa di cloruro di bario. Se nella soluzione di prova sono presenti ioni solfati, si forma un precipitato bianco di solfato di bario:
I solfati hanno molti usi importanti. Ad esempio, il solfato di magnesio (sale britannico, sale amaro) viene utilizzato nella produzione di esplosivi, per la produzione di fiammiferi e tessuti ignifughi. Una soluzione satura di questo sale viene utilizzata nella pratica medica come agente antinfiammatorio.
Il tiosolfato di sodio può essere considerato un analogo del solfato di sodio, in cui un atomo di ossigeno viene sostituito da un atomo di zolfo. Tra questi composti thioso, un altro dovrebbe essere menzionato - tiocianato di potassio. È un analogo dello zolfo del cianato di potassio. Tiocianato di potassio può essere ottenuto fondendo il cianuro di potassio con lo zolfo:
Il tiocianato di potassio viene utilizzato in analisi qualitativa per rilevare gli ioni.Se questi ioni sono presenti nella soluzione di prova, l'aggiunta di una soluzione di tiocianato di potassio porta a un aspetto di colore rosso sangue dovuto alla formazione di uno ione complesso.
Quindi, ripeti!
1. Quando ci si sposta verso il fondo del gruppo VI, le proprietà dei suoi elementi passano gradualmente da non metalliche a metalliche.
2. Gli elementi del gruppo VI hanno la capacità di combinarsi con l'idrogeno e i metalli reattivi, formando composti in cui hanno uno stato di ossidazione di -2.
3. L'ossigeno ha un'elevata elettronegatività e le proprietà di un forte ossidante.
4. L'ozono è un ossidante ancora più forte dell'ossigeno.
5. L'ossigeno svolge un ruolo estremamente importante nei sistemi biologici, partecipando ai processi di respirazione e ai processi metabolici (metabolismo).
6. L'ossigeno forma composti binari, ossidi di vario tipo con altri composti:

7. Il perossido di idrogeno è un forte agente ossidante.
8. Lo zolfo in forma libera può esistere in diverse forme enantiotropiche.
9. Per estrarre lo zolfo dai depositi sotterranei, viene utilizzato il processo Frash, che utilizza aria compressa e vapore surriscaldato.
10. Lo zolfo forma composti in cui si trova in stati con stati di ossidazione +2, +4, +6 e -2.
11. Acido solfidrico - acido dibasico debole e agente riducente.
12. Anidride solforosa gassosa e suoi agenti riducenti in soluzione acquosa.
13. Il triossido di zolfo ha proprietà fortemente acide e ossidanti.
14. L'acido solforico è un forte acido bibasico, disidratante, disidratante e un forte agente ossidante.
15. Le molecole di acido solforico e gli ioni solfato hanno una struttura tetraedrica.