Composti di calcio e magnesio
Quindi, dopo aver determinato ieri la quantità di calcio contenuta nel guscio d'uovo schiacciato, è nata la domanda "bere o non bere?". Come la maggior parte degli uomini, mi viene in mente tutto da un punto di vista scientifico e finché non lo vedo io stesso, scopri, controlla, prova una parola per una donna. Pertanto, condividerò i miei pensieri sulla base delle informazioni trovate sul guscio d'uovo e sul calcio.
Raccogliere su Internet informazioni sull'uso del guscio d'uovo come additivo alimentare più di una volta ha rilevato le osservazioni critiche dei medici che il carbonato di calcio contenuto nel guscio d'uovo è insolubile in acqua e quindi non può essere assorbito dall'organismo.
Inoltre, la storia della moglie del mio amico fu ricordata che durante la gravidanza disse al suo dottore, che aveva osservato che stava assumendo gusci d'uovo schiacciati - il dottore la dissuase e prescrisse una specie di complesso contenente calcio.
Dov'è la verità?
Infatti, il carbonato di calcio ССО3 (precisamente in questo tipo, il calcio si trova nel guscio delle uova) è insolubile in acqua e alcool.
Una precondizione davvero necessaria per l'assorbimento del calcio è la sua solubilità in acqua.
Ma ricorda che la base della nostra digestione è l'acido cloridrico escreto nello stomaco.
E questo è quello che succede nel nostro stomaco:
СaCO3 + 2HCl (acido cloridrico) = СaCl2 (cloruro di calcio) + Co2 + H20
Ma il cloruro di calcio è perfettamente solubile in acqua !!! È in questa forma che il calcio viene assorbito!
Non conosci i dottori? Oppure sono semplicemente furbi e vendono medicine!
Inoltre, durante questa reazione, si verifica una diminuzione dell'acidità gastrica. Ciò che è importante per le persone che soffrono di alta acidità.
Un esempio è mia moglie, ha un'alta acidità e ogni giorno prende un piccolo guscio schiacciato e questo risolve due problemi contemporaneamente e compensa la mancanza di calcio e diminuisce la sua acidità. Ma la polvere di guscio d'uovo si è estinta succo di limone non posso bere - c'è la nausea! E ora capisco perché.
Come abbiamo visto sopra, per l'assorbimento del calcio dal carbonato di calcio richiede succo gastrico ad alta acidità.
Nella vita reale, molto spesso si verifica una situazione in cui l'acidità dello stomaco è bassa o pari a zero. Questa situazione è particolarmente caratteristica delle persone anziane, quando il bisogno di calcio è particolarmente alto per prevenire l'osteoporosi. Ad esempio, dopo 50 anni, bassa acidità si verifica in circa il 40% delle persone. In queste condizioni, l'assorbimento del carbonato di calcio, che richiede la dissoluzione dell'acido cloridrico nello stomaco, scende al 2%.
Forse questa è la risposta per cui le persone anziane hanno maggiori probabilità di soffrire di malattie associate alla mancanza di calcio - semplicemente non riescono ad assimilarlo nella sua forma abituale.
Ora considera perché molte ricette per ricevere il guscio d'uovo schiacciato si consiglia di spegnerlo con succo di limone.
Quando aggiungiamo il succo di limone all'acido citrico frantumato, il carbonato di calcio (CaCo3) reagisce con l'acido citrico (C6H8O7) e otteniamo citrato di calcio (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Eccolo. E l'assorbimento del citrato di calcio, che non richiede acido cloridrico nello stomaco, è del 44%. Di conseguenza, in condizioni di bassa acidità, il citrato di calcio entra nell'organismo in 11 volte più calcio che non in carbonato!
E il citrato di calcio è già una medicina ben conosciuta che ci viene venduta per soldi! E lo fanno, solo loro non usano succo di limone, ma acido citrico!
A proposito, il carbonato di calcio (il nostro guscio d'uovo a brandelli) è un additivo alimentare registrato. E170e il citrato di calcio (il nostro guscio d'uovo a pezzetti versato con succo di limone) è un additivo alimentare registrato. E333! E vengono aggiunti a molti prodotti alimentari, in particolare prodotti lattiero-caseari, compreso il latte, per aumentare la percentuale di calcio!
Quindi, perché pagare di più!
Conclusione, se si dispone di alta acidità - probabilmente è meglio usare solo gusci d'uovo triturati, se l'acidità è inferiore, è probabilmente meglio estinguere la polvere di guscio d'uovo con succo di limone.
E ancora,
Di notte, c'è un rilascio accelerato di sali minerali dal corpo (accelerazione circadiana dei processi di riassorbimento nell'osso). Pertanto, i preparati di calcio devono essere assunti dopo pranzo e alla sera.Ciò impedirà la perdita accelerata di calcio nella seconda metà della notte, in particolare con il suo livello ridotto (o assenza) nell'intestino. Si nota anche l'effetto dose-dipendente negativo dell'attività farmacoterapeutica del calcio: a basse dosi questo biometall è assorbito meglio che in alto.
In relazione a questo più razionale prendere il farmaco più volte al giorno.
Leggiamo, discutiamo. Di seguito sono riportati alcuni articoli su questo argomento.
__________________________________________________________________________________________________________
Citrato di calcio contro carbonato di calcio
Fonte di< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Citrato di calcio
Il citrato di calcio è un'eccellente fonte di calcio assorbito, che svolge un ruolo molto importante nel corpo, poiché influenza molti processi enzimatici e la coagulazione del sangue. La carenza di calcio porta alla fragilità ossea e all'osteoporosi. Per i bambini piccoli, è buono per la salute dentale, gli adulti hanno bisogno di regolare assunzione di calcio per stabilizzare la pressione sanguigna.
Secondo il National Cancer Institute (USA), il supplemento E-333 può potenzialmente prevenire il cancro al colon e altri tumori. Inoltre, i citrati di calcio sono utilizzati in medicina per rimuovere i metalli pesanti dal corpo.
Poiché il citrato di calcio è una delle più importanti forme di trasporto del calcio nel corpo umano, è usato in medicina insieme a carbonato di calcio meno efficace (additivo E-170) per ricostituire le riserve di calcio nel corpo. Per lo stesso motivo, il citrato di calcio viene utilizzato sotto forma di integratori alimentari (integratori alimentari).
Nell'industria alimentare, l'additivo E-333 è usato come stabilizzatore, conservante, regolatore di acidità, fissativo del colore.
Come stabilizzante, l'additivo alimentare E-333 viene utilizzato nella produzione di latte condensato, panna, crema di formaggio. In marmellate, gelatina e frutta in scatola, l'additivo E-333 viene utilizzato come regolatore di acidità. I citrati di calcio sono anche ampiamente utilizzati per arricchire il calcio nel latte e prodotti lattiero-caseari, prodotti da forno e farina e bevande analcoliche.
In apparenza, il citrato di calcio è una polvere bianca con un sapore aspro pronunciato. Solubile in acqua. Formula molecolare del citrato di calcio: Ca3 (C6H5O7) 2. Ottieni E-333 dall'interazione di acido citrico con idrossido di calcio.
Proprietà e funzioni tecnologiche:
Possibili nomi di integratori alimentari:
- E-333
- E-333
- Citrato di calcio
- Citrati di calcio
- Citrato monocalcico
- Citrato dicalcico
- Citrato tricalcico
_____________________________________________________________________________________________
Citrato di calcio
A metà del XX secolo. Cominciò una specie di "boom": biochimici, fisiologi, biofisici, farmacologi e clinici iniziarono a mostrare un maggiore interesse nello studio del ruolo del calcio nella regolazione dell'attività degli organi e dei sistemi corporei. È stato scoperto che gli ioni di calcio sono coinvolti nell'eccitazione e nella contrazione delle cellule muscolari, nella regolazione della permeabilità della membrana cellulare, nelle interazioni intercellulari, nella coagulazione del sangue, nella secrezione di ormoni, nei mediatori, negli enzimi; svolgere la funzione di un trasduttore di segnale che entra nella cellula, partecipare ai processi di regolazione del metabolismo intracellulare, compresa l'energia. Sulla superficie della membrana di cardiomiociti e vasi di ioni di calcio liberi è 1000 volte più rispetto al citosol delle cellule. Dallo spazio extracellulare penetrano nel citoplasma attraverso speciali canali del calcio, influenzando i vari processi fisiologici e le funzioni delle cellule di tutti gli organi, il tono vascolare, l'intensità della sistole, la diastole.
Il calcio svolge un ruolo importante nella formazione del tessuto osseo e nella conservazione della sua normale struttura e funzione. Insieme a proteine speciali, gli ioni di calcio forniscono durezza ed elasticità alle ossa.
Tutto ciò è servito come fondamento teorico per lo sviluppo e l'introduzione di preparati di calcio basati sui suoi sali nella pratica medica. Attualmente, nella pratica medica, vengono usati tali sali di calcio come glicerofosfato, gluconato, carbonato, lattato, citrato, cloruro, fosfato e molti altri.
La farmacocinetica del farmaco CITRATO DI CALCIO ha le sue caratteristiche. Il calcio viene assorbito dall'intestino in una forma solubile e ionizzata. La dissoluzione del farmaco avviene meglio nell'ambiente acido dello stomaco. Il calcio ionizzato disciolto penetra bene in tutti i tessuti, penetra nella barriera placentare, passa nel latte materno. Excreted principalmente nelle feci, circa il 20% - con l'urina. Una caratteristica importante del citrato di calcio è la bassa capacità di formare calcoli renali, che è importante con l'uso a lungo termine di questo sale. Ciò è dovuto al fatto che il sale citrato riduce la quantità di ossalato nelle urine.
La biodisponibilità è determinata dalla velocità e dalla misura a cui principio attivo assorbito dalla forma di dosaggio, diventa disponibile nel sito dell'azione terapeutica prevista.
Di notte, c'è un rilascio accelerato di sali minerali dal corpo (accelerazione circadiana dei processi di riassorbimento nell'osso). Pertanto, i preparati di calcio devono essere assunti dopo pranzo e alla sera, il che impedisce l'accelerazione della perdita di calcio nella seconda metà della notte, in particolare con il suo livello ridotto (o assenza) nell'intestino. Si nota l'effetto dose-dipendente negativo dell'attività farmacoterapeutica del calcio: questo biometal viene assorbito meglio a basse dosi che a dosi elevate. A questo proposito, è più razionale assumere il farmaco più volte al giorno. Per i diversi gruppi di età ci sono diverse norme fisiologiche di assunzione di calcio (tabella).
tavolo
Il tasso raccomandato di assunzione di calcio nelle persone di diverse età
(secondo la società canadese per l'osteoporosi)
La vitamina D, l'acido cloridrico, il lattosio, l'acido citrico, la presenza di proteine nel cibo, il fosforo, il magnesio, così come alcuni alimenti come burro, uova, latte, pesce, grasso di merluzzo, cavolo, ecc., Contribuiscono all'assorbimento degli ioni calcio.
L'assorbimento del calcio sta peggiorando: mancanza di proteine nel cibo, stretta osservanza di una dieta vegetariana, mancanza di magnesio, fosforo, cibi ricchi di acido ossalico (acetosa, rabarbaro, spinaci).
L'assorbimento del calcio rallenta nelle malattie degli organi digestivi (gastrite, enterite, colite, ulcera peptica), pancreas (diabete, pancreatite), patologie di altri organi endocrini.
Va sottolineato che alcuni farmaci, in particolare i glucocorticoidi, i farmaci anticoncezionali ormonali per uso sistemico, la levotiroxina peggiorano anche l'assorbimento degli ioni calcio.
Secondo i risultati della ricerca scientifica (dati della Canadian Society for Osteoporosis), non ci sono prove convincenti sulla base del quale il consumo aggiuntivo di altri minerali (magnesio, zinco, rame, ecc.) Può essere raccomandato per la prevenzione o il trattamento dell'osteoporosi.
I risultati di studi clinici condotti in Ucraina e in altri paesi hanno confermato l'elevata efficacia di questo farmaco nel trattamento di molte malattie. Il citrato di calcio viene anche usato per scopi profilattici in varie malattie.
Con l'osteoporosi negli anziani, l'osteomalacia CALCIO CITRATO è prescritto da 2 a 6 compresse al giorno, dividendo la dose giornaliera in 3-4 dosi. Il farmaco viene assunto prima dei pasti o 1-1,5 ore dopo un pasto, per 3 mesi. Tali pazienti dovrebbero anche prescrivere vitamina D3 di 400-800 UI al giorno e includere anche olio, latte, pesce e uova nella dieta.
Il citrato di calcio è la forma di dosaggio ottimale per fornire calcio non solo per gli adulti, ma anche per i bambini, così come per gli adolescenti, in quanto contribuisce ad aumentare la densità minerale ossea, aumentare la massa ossea, rafforzare la dentina e lo smalto dei denti. I bambini di età inferiore ai 6 mesi sono prescritti 1/2 compresse (250 mg) (schiacciati, sciolti in una piccola quantità di latte), all'età di 6-12 mesi - anche 1/2 compresse 2 volte al giorno, all'età di 1 anno - 10 anni - 1-2 compresse, 10-18 anni - 2-3 compresse al giorno.
Indicazioni per il citrato di calcio sono:
ipocalcemia dovuta a sanguinamento di varia origine, così come durante la gravidanza e l'allattamento, con ferite - per soddisfare il maggior bisogno di ioni calcio nel corpo;
violazione dell'assorbimento di calcio nelle malattie dell'apparato digerente e aumento del livello di escrezione di calcio attraverso i reni e l'intestino;
ipoparatiroidismo, disidratazione di un organismo di varia genesi, malattie allergiche e complicanze allergiche durante l'assunzione di farmaci, aumento della permeabilità della parete vascolare, ridotta coagulazione del sangue.
CALCIO CITRATO deve essere prescritto quando si assumono glucocorticoidi, contraccettivi orali, levotiroxina. Negli ultimi tre casi, il farmaco viene assunto 1 compressa 6 volte al giorno dopo i pasti.
Il citrato di calcio, di regola, è ben tollerato, a volte i sintomi dispeptici (stitichezza o diarrea, nausea, vomito, perdita di appetito, dolore addominale), può verificarsi poliuria.
L'uso simultaneo di CALCIO CITRATO con antiacidi contenenti alluminio non è raccomandato a causa di una diminuzione della loro efficacia. Non è consigliabile prescriverlo contemporaneamente ad altri preparati di calcio.
In conclusione, possiamo notare le proprietà farmacologiche positive del CITRATO DI CALCIO:
il sale di calcio citrato è ben disciolto e assorbito nel tratto digestivo, che porta ad un buon assorbimento del calcio nel corpo e, di conseguenza, l'efficacia del farmaco nella sua profilassi o applicazione terapeuticaciò è confermato dai risultati di molti studi clinici.
Il basso rischio di formazione di calcoli nei reni durante l'assunzione del farmaco aumenta il valore del solfato di calcio con l'uso prolungato.
IS Chekman, Capo del Dipartimento di Farmacologia con il corso di Farmacologia Clinica dell'Università Nazionale di Medicina, Membro Corrispondente dell'Accademia Nazionale delle Scienze e dell'Accademia delle Scienze Mediche dell'Ucraina, Onorato Lavoratore di Scienza e Tecnologia, Professore
Pagina 1
La reazione di carbonati con acidi può essere utilizzata come campione per i carbonati. L'acido carbonico è un acido molto debole e instabile. Può essere spremuto dai suoi sali grazie all'azione di acidi meno volatili e più forti.
Allo stesso modo, le reazioni del carbonato di calcio con acidi procedono.
Come risultato della reazione del carbonato con acido cloridrico si ottengono cloruro di calcio e magnesio, che si dissolvono bene in acqua e rimangono sotto forma di una soluzione di diverse concentrazioni. La velocità di reazione nei collettori di questo tipo dipende principalmente dalla pressione e dalla temperatura.
Come risultato della reazione di carbonato con acido cloridrico cloruro di calcio e magnesio, ben solubile in acqua e che rimane sotto forma di una soluzione di diverse concentrazioni.
L'introduzione alla reazione del carbonato di sodio non essiccato provoca la necessità di applicare una pressione più elevata e aumentare la quantità di catalizzatore.
Spiegazione dei fenomeni elencati o osservati: perché la reazione del carbonato di calcio con acido solforico inizia prima violentemente e poi si ferma. Perché quando una sostanza secca riscaldata di carbonato di ammonio scompare dal tubo.
L'effetto benefico del carbonato di calcio sulla stabilità del cemento Portland può essere spiegato dalla reazione del carbonato con i minerali del clinker contenenti alluminio. Pertanto, il componente alluminato della pietra cementata è legato chimicamente prima che entri in contatto con i solfati dell'ambiente.
Alcune applicazioni del carbonato di bario si basano sulla pratica insolubilità del solfato di bario, che è formato dalla reazione del carbonato di bario con sostanze contenenti ioni solfato. Quindi, quando si asciuga un mattone prima della combustione, sulla sua superficie appare una fioritura bianca, causata dalla cristallizzazione del gesso o del solfato di magnesio contenuto nell'argilla. Per evitare che ciò accada, il carbonato di bario viene aggiunto all'argilla, che causa la precipitazione dello ione solfato.
Nella sua introduzione alla chimica dei solidi, Hedwal, come esempio di una reazione teoricamente possibile, risulta nella reazione del carbonato di calcio con SiO2, che si traduce nella formazione di silicato di calcio. Accompagna questo esempio osservando che con le cosiddette metamorfosi geotermiche, la temperatura abituale non è sufficiente, poiché la reazione tra carbonato di calcio e acido silicico può essere osservata in condizioni di laboratorio solo a temperature di 500 ° C.
Per ridurre il costo della formazione del catarro in questo processo, Klima e Ward hanno suggerito di utilizzare la soluzione di carbonato di ammonio (anziché il nitrato di ammonio) e di creare catarro a causa della reazione di carbonato di ammonio arricchito con calce.
All'aumentare della temperatura, la reazione si sposta verso la formazione di un silicato più alcalino. Gibson e Ward11 sulla reazione di carbonato di sodio con quarzo ad una temperatura da 726 a 805 C in una corrente di azoto hanno mostrato che l'orto-silicato è formato in presenza di una quantità sufficiente di carbonato di sodio. La velocità di reazione dipende dal tempo, dalla dimensione del campione, dalla portata del gas e dalla composizione della miscela di reazione. Gibson e Ward sostengono che ci sono silicati di sodio di grado intermedio.
L'eccesso di carbonato di sodio è titolato con acido cloridrico. La quantità di zolfo nel prodotto analizzato è calcolata in base alla quantità di carbonato di sodio reagito.
E carbonato di calcio e come questi composti chimici interagiscono.
Carbonato di calcio
CaCO₃ reticolo di carbonato di calcioIl CaCO₃ è un composto molto comune nel mondo: consiste in: gesso, pietra calcarea, marmo, ecc. Pertanto, vale la pena notare che il ruolo di questa sostanza per l'uomo è molto significativo, in quanto il carbonato di calcio è ampiamente utilizzato nell'industria alimentare, come un colorante bianco naturale. Il CaCO₃ viene anche utilizzato nella produzione di carta, plastica, edilizia e in molte altre aree.
Il carbonato di calcio è una sostanza bianca (cristalli solidi) in polvere o in forma solida. È in grado di reagire con l'acqua, ma non completamente dissolto in esso. Pertanto, l'acqua diventa torbida e vi è un precipitato bianco. Ma se la reazione con l'acqua avrà luogo in presenza, allora otterremo un sale acido solubile, bicarbonato di calcio:
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
Considera come viene fatto il carbonato di calcio.
La maggior parte del carbonato di calcio è ottenuto da fonti naturali. Quindi, per ottenere il carbonato di calcio, di regola, utilizzare una fonte pulita, spesso di marmo.
 La statua in marmo di David di Michelangelo Buonarroti
La statua in marmo di David di Michelangelo Buonarroti
Ma in condizioni di laboratorio, il calcio carbonato può essere ottenuto calcolando l'ossido di calcio. La calcinazione si riferisce alla nozione generalizzata di combustione, a seguito della quale le sostanze chimiche acquisiscono nuove proprietà. La cottura viene eseguita ad una temperatura sufficientemente elevata, non raggiungendo la fusione.
L'acqua è mescolata con l'ossido di calcio risultante, la reazione produce idrossido. Quindi i tecnici ottengono il biossido di carbonio, che viene passato attraverso la soluzione ottenuta in precedenza. Il precipitato formato è carbonato di calcio:
CaO + H₂O = Ca (OH);
Ca (OH) + CO₂ = CaCO₃ + H₂O
Se riscaldiamo il sale dell'acido carbonico e del calcio ad alta temperatura (900 - 1000 ° C), allora come risultato del processo chimico otterremo anidride carbonica (anidride carbonica), così come l'ossido di calcio CaO - calce viva usata nella costruzione:
CaCO₃ = CaO + CO₂
Se la temperatura è ancora più elevata (1500 ° C), i prodotti di reazione saranno carburo di calcio e monossido di carbonio.
Acido cloridrico
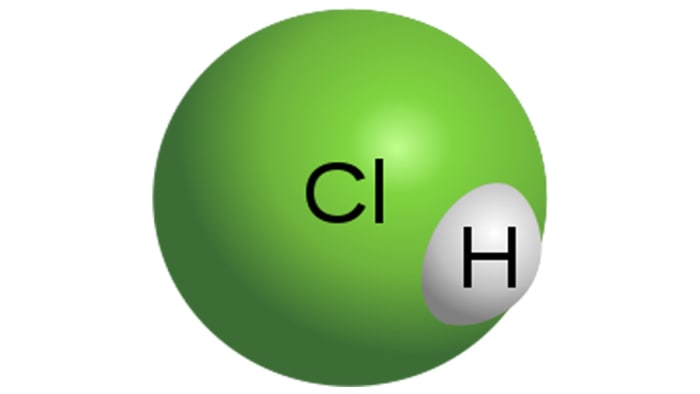 Molecola di acido cloridrico
Molecola di acido cloridrico
HCl è un acido monobasico forte, che si ottiene sciogliendo acido cloridrico in acqua. È un liquido incolore, sebbene l'acido tecnico possa avere una tonalità gialla, ad esempio, a causa dell'impurità del ferro. Le proprietà di HCl dipenderanno direttamente dalla concentrazione di acido cloridrico nella soluzione.
I sali di acido cloridrico sono chiamati cloruri. Questa sostanza è molto caustica, pertanto richiede un'attenta manipolazione: anche se una piccola goccia cade sulla pelle, non si può evitare una forte ustione chimica. Pertanto, quando si lavora con acidi forti, è consigliabile portare sempre con sé i neutralizzatori: soluzioni alcaline deboli, (bicarbonato di sodio), ecc. Vale la pena ricordare che quando si apre un contenitore con un acido concentrato si formano vapori di HCl, che influiscono negativamente sugli occhi e sul sistema respiratorio. Pertanto, negli esperimenti chimici, sarebbe meglio utilizzare un respiratore e occhiali di protezione.
Ottenere l'acido cloridrico
Il gas cloridrico viene dissolto in acqua. L'acido cloridrico si ottiene come segue: l'idrogeno viene bruciato in cloro, ottenendo così un acido sintetico. Alternativamente, l'acido cloridrico può essere ottenuto usando gas laterali, che sono ottenuti in un certo numero di esperimenti chimici, per esempio, quando gli idrocarburi clorurati sono clorurati. L'acido ottenuto in questo modo si chiama abgasic.
Applicare acido cloridrico in medicina, nell'industria e anche per reazioni chimiche.
L'acido incolore con un odore pungente di acido cloridrico reagisce bene con i metalli. La reazione redox si verifica. Gli agenti riducenti nel processo di reazione sono atomi di metallo e gli agenti ossidanti sono cationi di idrogeno.
Principalmente le reazioni chimiche con i metalli sono accompagnate dal rilascio di idrogeno. L'intensità dell'interazione dipende dall'attività del metallo, ad esempio il litio di metallo alcalino reagisce violentemente, mentre la reazione con l'alluminio è debole a causa del forte film di ossido di questo elemento.
Acido cloridrico e zinco:
2HCl + Zn = ZnCl₂ + H₂
Acido cloridrico e ferro:
2HCl + Fe = FeCl₂ + H₂
Acido cloridrico e magnesio:
2HCl + Mg = MgCl₂ + H₂
 Cloruro di magnesio, utilizzato per pulire le strade dal ghiaccio
Cloruro di magnesio, utilizzato per pulire le strade dal ghiaccio
Con gli ossidi metallici, l'acido forma acqua e sale:
CuO + 2HCl = CuCl₂ + H₂O
Reazione di acido cloridrico e carbonato di calcio
Per l'esperimento sarà necessario:
provetta;
pipetta chimica;
carbonato di calcio solido (marmo);
acido cloridrico;
guanti;
respiratore.
Attenzione! Non provare questa esperienza tu stesso!
Condurre l'esperimento in un'area ben ventilata, usare cautela quando si lavora con acido cloridrico.
Aggiungere alcuni pezzi di marmo alla nave e pipettare un po 'di acido cloridrico. Di conseguenza, ci sarà una reazione istantanea con la formazione di bolle - il diossido di carbonio viene rilasciato. Questa è una reazione di scambio, i cui prodotti sono: un composto debole e instabile, l'acido carbonico, che si decompone in anidride carbonica e acqua. L'equazione della reazione di dissoluzione del carbonato di calcio nell'acido cloridrico:
CaCO₃ + 2HCl (dil.) → CaCl₂ + CO₂ + H₂O
- caratteristica dell'elemento di magnesio: struttura elettronica, possibili stati di ossidazione, composti basici: ossido, idrossido, sali. Cos'è la carbonizzazione e qual è il suo ruolo nella costruzione.
MgCO 3 = MgO + CO 2
Applicazione.
Nell'industria viene utilizzato per la produzione di refrattari, cementi e purificazione di prodotti petroliferi, come riempitivo nella produzione di gomma. L'ossido di magnesio ultraleggero viene utilizzato come abrasivo molto fine per la pulizia delle superfici, in particolare nell'industria elettronica.
In medicina, è usato in caso di aumento dell'acidità del succo gastrico, poiché è causato da un eccessivo contenuto di acido cloridrico. La magnesia bruciata viene anche presa quando l'acido viene accidentalmente rilasciato nello stomaco.
Nell'industria alimentare è registrato come additivo alimentare E530.
È un riflettore assoluto - una sostanza con un coefficiente di riflessione uguale a uno in un'ampia banda spettrale. Può essere usato come standard bianco disponibile.
Idrossido di magnesio - L'idrossido di metallo principale è il magnesio. Base insolubile debole.
In condizioni standard, l'idrossido di magnesio è un reticolo esagonale incolore. A temperature superiori a 350 ° C si decompone in ossido di magnesio e acqua. Assorbe l'anidride carbonica e l'acqua dall'aria per formare il carbonato di magnesio principale. L'idrossido di magnesio è praticamente insolubile in acqua, ma solubile nei sali di ammonio. È una base debole. Si presenta in natura sotto forma di brucite minerale.
Ottenere.
Interazione di sali solubili di magnesio con alcali:
In generale:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
esempi:
MgCl 2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
L'interazione della soluzione di cloruro di magnesio con dolomite bruciata:
MgCl 2 + CaO × MgO + 2H 2 O = 2 Mg (OH) 2 ¯ + CaCl 2
Interazione del magnesio metallico con vapore acqueo:
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Proprietà chimiche
Come tutte le basi deboli, l'idrossido di magnesio è termicamente instabile. Si decompone se riscaldato a 350 ° C:
Interagisce con gli acidi per formare sale e acqua (reazione di neutralizzazione):
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
Interazione con ossidi acidi per formare sale e acqua:
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
Interazione con soluzioni concentrate calde di alcali con formazione di idrossimagnesati:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
Applicazione.
L'idrossido di magnesio è usato per legare il biossido di zolfo, come flocculante per il trattamento delle acque reflue, come ritardante di fiamma in polimeri termoplastici (poliolefine, PVC), come additivo nei detergenti, per produrre ossido di magnesio, raffinazione dello zucchero, come componente dei dentifrici.
In medicina, è usato come medicinale per neutralizzare l'acido nello stomaco, nonché un lassativo molto forte.
Nell'Unione Europea, l'idrossido di magnesio è registrato come additivo alimentare E528.
Sali di magnesio
La maggior parte dei sali di magnesio sono altamente solubili in acqua. Ion Mg 2+ dà alle soluzioni un sapore amaro. Gli alogenuri di magnesio, ad eccezione di MgF2, sono altamente igroscopici: sanguinano nell'aria.
Cloruro di magnesio MgCl 2 (cloruro di magnesio) anidro si scioglie a 718 °. In presenza di tracce d'acqua "fuma" nell'aria - si decompone in HCl e MgO. Gli idrati cristallini incolori con 1, 2, 4, 6, 8 e 12 molecole d'acqua vengono rilasciati dalla soluzione acquosa. Nell'intervallo di temperatura da -3,4 a 116,7 °, l'idrato cristallino MgCl 2 × 6H 2 0 è stabile, che si presenta naturalmente come minerale di bischofite e in grandi quantità è ottenuto per evaporazione di salamoie marine. Il cloruro di magnesio forma doppi sali, di cui la carnallite minerale KCl × MgCl 2 × 6H 2 O - la fonte di magnesio e cloruro di potassio - è estremamente importante.
Applicazione.
1. Il cloruro di magnesio è utilizzato principalmente nella produzione di magnesio metallico, MgCl 2 × 6H 2 0 viene utilizzato per ottenere cementi magnesiaci.
2. Utilizzato per la lavorazione di ghiaccio e manto nevoso come additivo. Come risultato della reazione con la neve, provoca la fusione. Ha una terza classe di pericolo (sostanze moderatamente pericolose) e proprietà corrosive aggressive.
Bicarbonato di magnesio - sale acido di magnesio e acido carbonico con la formula Mg (HCO 3) 2, esiste solo in soluzioni acquose.
Ottenere.
Trasmissione di biossido di carbonio attraverso una sospensione di carbonato di magnesio:
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
Proprietà fisiche
Il bicarbonato di magnesio esiste solo in soluzioni acquose.
La presenza di bicarbonato di magnesio in acqua causa la sua temporanea rigidità.
Proprietà chimiche
Quando si concentra la soluzione, il bicarbonato di magnesio si decompone:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
Idrofosfato di magnesio (fosfato di magnesio disostituito) - un sale acido di magnesio e acido fosforico con la formula MgHPO 4, leggermente solubile in acqua, forma idrati cristallini.
Ottenere.
L'effetto dell'acido ortofosforico sull'ossido di magnesio o sul carbonato di magnesio:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
L'azione dell'ortofosfato di sodio disostituito su cloruro di magnesio:
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
La decomposizione del diidrogeno fosfato di magnesio:
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
Proprietà fisiche.
Il fosfato di idrogeno di magnesio forma cristalli bianchi, che sono idrati cristallini: a temperature fino a 225 ° C, si forma MgHPO4 monoidrato. H 2 O, densità di 2,32 g / cm³, alla temperatura di 36 ° С, si forma MgHPO4 triidrato. 3H 2 O, densità 2,10 g / cm³, con temperatura ambiente Si forma eptaidrato di MgHPO4. 7H 2 O.
Proprietà chimiche.
Quando riscaldato va in pirofosfato:
Applicazione.
Utilizzato nel supplemento alimentare E343.
Magnesio diidrogeno fosfato - sale acido del metallo di magnesio e acido ortofosforico con formula Mg (H 2 PO 4) 2, cristalli igroscopici incolori, solubili in acqua, forma idrati cristallini.
Ottenere.
Dissoluzione dell'idrossido o dell'ossido di magnesio nell'acido ortofosforico:
Proprietà fisiche.
Il magnesio diidrogeno fosfato forma cristalli incolori.
Composizione di idrato cristallino formata da Mg (H 2 PO 4) 2. nH 2 O, dove n = 2, 4, 6.
Carburo di magnesio - composto inorganico binario di magnesio e carbonio con la formula MgС 2. Inoltre noto carburo di magnesio con la formula Mg 2 C.
Ottenere.
Sinterizzazione di fluoruro di magnesio e carburo di calcio:
Acetilene scorrevole su polvere di magnesio:
Ripristinando pentano con polvere di magnesio a 650 ° C, si ottiene un metallo duro più complesso Mg 2 C 3.
Proprietà chimiche.
Quando riscaldato si decompone con la formazione di carburo intermedio Mg2C3:
Interagisce con l'acqua:
Carbonato di magnesio, carbonato di magnesio, MgCO 3 - sale di magnesio dell'acido carbonico.
Proprietà.
Cristalli bianchi, densità 3.037 g / cm³. A 500 ° C è evidente e a 650 ° C è completamente decomposto in MgO e CO2. La solubilità del carbonato di magnesio nell'acqua è insignificante (22 mg / l a 25 ° C) e diminuisce all'aumentare della temperatura. Quando la CO2 viene saturata con una sospensione acquosa di MgCO 3, quest'ultima si dissolve a causa della formazione di bicarbonato di Mg (HCO 3) 2. Da soluzioni acquose in assenza di un eccesso di CO 2, vengono emessi carbonati di magnesio basici. Con carbonati di un certo numero di metalli, il carbonato di magnesio forma doppi sali, tra cui la dolomite minerale naturale MgCO 3 · CaCO 3.
Prevalenza in natura.
Il carbonato di magnesio è ampiamente distribuito in natura sotto forma di magnesite minerale.
Applicazione.
Il carbonato di magnesio di base 3MgCO 3 · Mg (OH) 2 · 3H 2 O (la cosiddetta magnesia bianca) viene utilizzato come riempitivo in mescole di gomma per la produzione di materiali isolanti termici.
Il carbonato di magnesio è necessario nella produzione di vetro, cemento, mattoni.
Nitrato di magnesio Mg (NO 3) 2 - cristalli igroscopici incolori con reticolo cubico; punto di fusione 426 ° C (con decomposizione). Solubilità in acqua (g per 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Solubile anche in etanolo, metanolo, NH3 liquido. A seconda della concentrazione, non-, esa- e diidrati si cristallizzano da soluzioni acquose.
Componente di fertilizzanti complessi, dal momento che il magnesio è parte della clorofilla, che è necessaria per la fotosintesi, aumenta l'attività di molti enzimi e agisce come un trasportatore di fosforo. L'alta solubilità e la bassa conduttività elettrica rendono il prodotto estremamente adatto per l'alimentazione fogliare e la fertirrigazione, soprattutto quando si usano acque di irrigazione con un'alta concentrazione di sale. Il fertilizzante è utilizzato per la nutrizione radicale e fogliare di verdure, bacche, colture da frutto, uva; ossidante in composizioni pirotecniche.
carbonizzazione- saturazione di qualsiasi soluzione con anidride carbonica. Usato nella costruzione.
Carbonazione minerale: l'acido silicico nei silicati viene sostituito dall'acido carbonico per formare i carbonati. Di carbonati, il minerale che forma roccia nelle rocce sedimentarie è calcite (calcare sparso) CaCO3. Magnesite - MgCO3 e dolomite - CaMg (CO3) 2 sono meno comuni. il acqua pulita, non contenente acido carbonico, la calcite viene sciolta in una piccola quantità (0,03 g per litro di acqua); la magnesite è praticamente insolubile. Se l'acqua contiene anidride carbonica, la calcite si scioglie facilmente con la formazione di carbonato di calcio acido, solubile in acqua - Ca (HCO3) 2.
La carbonizzazione è un cambiamento che si verifica nel calcestruzzo sul cemento Portland quando esposto all'aria C0 2. L'idrossido di calcio Ca (OH) 2 in presenza di umidità è particolarmente colpito. L'idrossido di calcio viene convertito in carbonato di calcio quando assorbe l'anidride carbonica. Il carbonato di calcio è scarsamente solubile in acqua e, di conseguenza, tende a chiudere ermeticamente i pori sulla superficie del calcestruzzo (che significa calcestruzzo denso e impermeabile).
Tipicamente, il pH dell'acqua interstiziale nel calcestruzzo varia tra 10,5 e 11,5. Se a causa della carbonizzazione si riduce a 9 e sotto, è possibile la corrosione del rinforzo. Pertanto, lo spessore dello strato carbonizzato è un fattore importante nella protezione del rinforzo: più profonda è la carbonizzazione, maggiore è il pericolo di corrosione dell'acciaio. La profondità della carbonatazione può essere determinata trattando il calcestruzzo con fenolftaleina. La presenza di proprietà alcaline sotto l'azione della fenolftaleina è indicata dall'aspetto di un colore rosa, mentre il calcestruzzo gassoso mantiene il suo colore originale.
Il calcestruzzo denso di alta qualità subisce molto lentamente la carbonizzazione. È improbabile che la carbonizzazione venga osservata a una profondità superiore a 5-10 mm anche dopo 50 anni di funzionamento. D'altra parte, la profondità di carbonizzazione del calcestruzzo permeabile a bassa resistenza può raggiungere 25 mm in meno di 10 anni. L'esperienza dimostra che i prodotti in calcestruzzo di bassa qualità sono particolarmente sensibili alla carbonizzazione.
- caratteristica dell'elemento calcio: struttura elettronica, possibili stati di ossidazione, composti principali: ossido, idrossido, sali.
calcio - un elemento del sottogruppo principale del secondo gruppo, il quarto periodo della tavola periodica degli elementi chimici DI Mendeleev, con numero atomico 20. È denotato dal simbolo Ca (lat. Calcium). Struttura elettronica 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, stato di ossidazione +2, 0. Fa riferimento ai metalli alcalino terrosi.
La sostanza semplice calcio è un metallo alcalino terroso morbido, chimicamente attivo di colore bianco-argento. Produzione industriale: elettrolisi del cloruro di calcio fuso.
Ossido di calcio CaO - ossido basico, calce viva. Bianco, igroscopico. Refrattario, termicamente instabile, volatile durante l'accensione. Reagisce vigorosamente con acqua (con un elevato effetto esofago), forma una soluzione fortemente alcalina, il processo è chiamato calce. Reagisce con acidi, ossidi metallici, non metalli. È usato per sintetizzare altri composti del calcio, un componente dei materiali leganti nella costruzione.
Produzione nell'industria - cottura di calcare (900 - 1200 o C)
Idrossido di calcio Ca (OH) 2 - calce idrata, idrossido di base. Scomposto con riscaldamento moderato. Bianco, igroscopico. Assorbe umidità e anidride carbonica dall'aria. Leggermente solubile al freddo. acqua, anche meno - in acqua bollente. Una soluzione limpida (acqua di calce) diventa rapidamente torbida a causa della precipitazione di idrossido (la sospensione viene chiamata latte di calce). La reazione qualitativa è la trasmissione del biossido di carbonio attraverso l'acqua di calce con la comparsa del sedimento di CaCO3 e la sua transizione in soluzione. Reagisce con acidi e ossidi acidi, entra in reazioni di scambio ionico.
È utilizzato nella costruzione per la preparazione di malta di calce (sabbia + calce spenta + acqua), che funge da materiale legante per pietra e mattoni, per la finitura (intonacatura) di pareti e altri scopi di costruzione. La solidificazione di tali soluzioni è dovuta all'assorbimento di CO2 dall'aria.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H 2 SO 4 → CaSO 4 + 2H 2 O,
Reagisce con i sali se si forma un precipitato:
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 ↓ + 2NaOH
Sali di calcio
Solfato di calcio (CaSO 4) - composto inorganico, sale di calcio dell'acido solforico.
Si trova in natura come un CaSO 4 diidrato? 2H 2 O (gesso, selenite) e allo stato anidro - anidrite.
Cloruro di calcio, CaCl2 - sale di calcio dell'acido cloridrico.
Possiede elevate proprietà igroscopiche. Solubilità (g per 100 g di H2O): 74 (20 ° C) e 159 (100 ° C). Le soluzioni acquose di cloruro di calcio si congelano a basse temperature (20% a -18,57 ° C, 30% a -48 ° C).
Forma un idrato di CaCl2 · 6H2O, stabile fino a 29,8 ° C; a temperature più elevate, gli idrati cristallini con 4, 2 e 1 molecole di H2O cadono dalla soluzione satura. Quando CaCl2 * 6H2O (58,8%) viene miscelato con neve o ghiaccio (41,2%), la temperatura scende a -55 ° C (punto criidrato).
Il cloruro di calcio è ottenuto come sottoprodotto nella produzione di soda.
Nel laboratorio chimico, il cloruro di calcio viene utilizzato come riempitivo per asciugare i tubi, chiamato anche cloruro di calcio, destinato a isolare le sostanze presenti nel recipiente dal vapore acqueo atmosferico e per essiccare i gas.
Il cloruro di calcio è anche usato come acceleratore per l'impostazione del cemento;
Carbonato di calcio (carbonato di calcio) - composto chimico inorganico, sale di acido carbonico e calcio. Formula chimica -CaCO 3. In natura, si trova sotto forma di minerali - calcite, aragonite e vaterite, è il componente principale del calcare, il marmo, il gesso, fa parte del guscio delle uova. Insolubile in acqua ed etanolo.
Stucco, vari sigillanti - tutti contengono carbonato di calcio in quantità significative. Inoltre, il carbonato di calcio è un componente essenziale nella produzione di prodotti chimici domestici.
Il carbonato di calcio è anche ampiamente utilizzato nei sistemi di pulizia, come mezzo per combattere l'inquinamento ambientale, e con l'aiuto del carbonato di calcio, l'equilibrio acido-base del suolo viene ripristinato.
- Esempi che illustrano l'uso di ossidi e idrossidi di calcio e magnesio nella costruzione.
Ossido di calcio e idrossido
Quando si imbiancano le stanze.
Quando imbianca le staccionate di legno e le travi per sbavature - per proteggersi da marciume e fuoco.
Per la preparazione di malta di calce. La calce è stata utilizzata per la costruzione di opere murarie fin dall'antichità. La miscela viene solitamente preparata in questa proporzione: tre o quattro parti di sabbia (in peso) vengono aggiunte a una parte di una miscela di idrossido di calcio (calce idrata) e acqua. Quando ciò accade, la miscela si indurisce per la reazione: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Questa è una reazione esotermica, il rilascio di energia è 27 kcal (113 kJ).
Come si può vedere dalla reazione, l'acqua viene rilasciata durante la reazione. Questo è un fattore negativo, poiché nelle stanze costruite con malta di calce, l'umidità alta persiste per lungo tempo. A questo proposito, oltre a numerosi altri vantaggi rispetto all'idrossido di calcio, il cemento lo ha praticamente sostituito come legante per le soluzioni costruttive. Inoltre, è inaccettabile per l'uso durante la posa di stufe, perché sotto l'influenza di alte temperature, viene rilasciato biossido di carbonio soffocante.
Per la preparazione del calcestruzzo ai silicati. La composizione del calcestruzzo ai silicati è identica alla composizione della malta di calce, tuttavia viene preparata con un altro metodo: una miscela di ossido di calcio e sabbia di quarzo non viene trattata con acqua, ma con vapore acqueo surriscaldato (174,5-197,4 ° C) in un'autoclave ad una pressione di 9-15 atmosfere.
Nella produzione di mattoni di silicato.
Ossido e idrossido di magnesio:
per la produzione di sistemi combinati di materiali refrattari (pannelli magnesite), per la produzione di cementi. L'ossido di magnesio (magnesite caustica) viene utilizzato come legante, che, se miscelato con la soluzione di MgCl2, è in grado di indurire rapidamente e guadagnare forza nell'aria.
- durezza delle acque naturali: definizione, tipi di durezza, metodi per eliminare la durezza dell'acqua: fisica, chimica (equazioni di reazione), fisico-chimica.
L'acqua naturale contenente una grande quantità di sali di calcio o di magnesio in una soluzione è chiamata acqua dura anziché acqua dolce contenente poco o nessun sale di calcio e magnesio.
Il primo di questi è dovuto alla presenza di bicarbonati di calcio e magnesio, il secondo alla presenza di sali di acidi forti, solfati o cloruri di calcio e magnesio. Con l'ebollizione prolungata dell'acqua con durezza carbonatica, appare un precipitato, costituito principalmente da CaCO3, e allo stesso tempo viene rilasciata CO2.
Entrambe queste sostanze appaiono come risultato della decomposizione del carbonato di calcio:
Pertanto, la rigidità del carbonato è anche definita rigidità temporanea. Quantitativamente, la rigidità temporanea è caratterizzata dal contenuto di bicarbonati rimossi dall'acqua quando viene bollito per un'ora. La rigidità residua dopo tale bollitura si chiama rigidità costante.
La durezza dell'acqua è espressa dalla somma dei milliequivalenti di ioni di calcio e magnesio contenuti nell'acqua. Un milliequivalente di rigidità corrisponde a un contenuto di 20,04 mg / le 12,16 mg / l.
La durezza delle acque naturali varia ampiamente. È diverso in diversi bacini e nello stesso fiume varia durante l'anno (minimo durante l'alluvione). La durezza delle acque dei mari è molto più alta di fiumi e laghi. Pertanto, l'acqua del Mar Nero ha una durezza totale di 65,5 meq / l. Il valore medio della durezza dell'acqua dell'oceano mondiale è 130,5 meq / l (compresi 22,5 meq / l per meq / l).
La presenza in acqua di una quantità significativa di sali di calcio o di magnesio rende l'acqua inadatta per molti scopi tecnici. Così, con l'alimentazione prolungata delle caldaie a vapore con acqua dura, le loro pareti si ricoprono gradualmente di una densa crosta di nakiii. Una tale crosta già ad uno spessore di strato riduce notevolmente il trasferimento di calore dalle pareti della caldaia e, conseguentemente, porta ad un aumento del consumo di carburante. Inoltre, può causare vesciche e screpolature sia nei tubi di riscaldamento che sulle pareti della caldaia stessa.
L'acqua dura non rilascia schiuma con sapone, poiché i sali solubili di sodio degli acidi grassi - palmitici e stearici - contenuti nel sapone vengono trasformati in sali di calcio insolubili degli stessi acidi:
L'acqua dura non può essere utilizzata quando si eseguono alcuni processi tecnologici, ad esempio durante la tintura.
La durezza costante dell'acqua è dovuta alla presenza in esso principalmente di solfati e cloruri di calcio e magnesio e non viene eliminata mediante ebollizione. La somma della durezza temporanea (rimovibile) e della durezza costante è la durezza totale dell'acqua.
Ci sono vari modi per determinare la rigidità.
Considera due di loro:
1) determinazione della rigidità temporale utilizzando una soluzione titolata di acido cloridrico
2) metodo complessometrico per determinare la rigidità totale.
Durante la titolazione di un campione di acqua con acido cloridrico in presenza di metil arancione, si verifica la decomposizione dei bicarbonati, causando una temporanea rigidità:
Metodo di determinazione. 100 ml dell'acqua di prova vengono prelevati in un matraccio conico con una pipetta o un cilindro graduato, si aggiungono 2-3 gocce di arancia metilica e si titola con 0,1 e. Soluzione di HCl fino a quando non appare il colore arancione.
Analisi dei risultati del calcolo. 1 ml 0,1 n. La soluzione di HCl corrisponde a 0,1 / 1000 g-eq o 0,1 mg-eq Ca 2+. V (HCl) corrisponde a 0,1 V (HCl) / 1000 g-eq o 0,1 V (HCl) mg-eq Ca 2+. Il mEq di 0,1 V (HCl) è nel volume di V A. Per esprimere la rigidità in equivalenti di milligrammi per 1 l di acqua, è necessario dividere il valore rilevato da V A e moltiplicarlo per 1000, cioè la durezza dell'acqua in studio è uguale a:
![]()
Metodi di eliminazione.
Ammorbidimento termico A base di acqua bollente, a causa di calcio termicamente instabile e bicarbonati di magnesio si decompongono con la formazione di incrostazioni:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
L'ebollizione rimuove solo la durezza temporanea (carbonatica). Trova applicazione nella vita.
Reagente ammorbidente. Il metodo si basa sull'aggiunta di carbonato di sodio Na2CO3 o di calce idrata Ca (OH) 2 all'acqua. Allo stesso tempo, i sali di calcio e magnesio passano in composti insolubili e, di conseguenza, precipitano.
Ad esempio, l'aggiunta di calce idrata porta alla conversione dei sali di calcio in carbonato insolubile:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Il miglior reagente per eliminare la durezza complessiva dell'acqua è l'ortofosfato di sodio Na3PO4, che fa parte della maggior parte dei prodotti domestici e industriali:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Gli ortofosfati di calcio e magnesio sono molto poco solubili in acqua e quindi facilmente separabili mediante filtrazione meccanica. Questo metodo è giustificato con un consumo di acqua relativamente elevato, poiché comporta la risoluzione di una serie di problemi specifici: filtrazione dei sedimenti, dosaggio accurato dei reagenti.
scambio cationico. Il metodo si basa sull'uso del carico granulare a scambio ionico (più spesso resine a scambio ionico). Tale carico a contatto con l'acqua assorbe i cationi dei sali di durezza (calcio e magnesio, ferro e manganese). Invece, a seconda della forma ionica, emette ioni di sodio o idrogeno. Questi metodi sono chiamati rispettivamente Na-cationization e H-cationization. Con un carico di scambio ionico opportunamente selezionato, la durezza dell'acqua diminuisce con cationizzazione del sodio monostadio a 0,05-0,1 ° W, con carico a due stadi - a 0,01 ° W. Nell'industria, i filtri a scambio ionico sostituiscono ioni di calcio e magnesio con ioni sodio e potassio, producendo acqua dolce.
Osmosi inversa. Il metodo si basa sul passaggio dell'acqua attraverso una membrana semipermeabile (solitamente poliammide). Insieme ai sali di durezza, la maggior parte degli altri sali viene rimossa. L'efficienza di pulizia può raggiungere il 99,9%.
Esistono nanofiltrazioni (il diametro nominale dei fori della membrana è uguale alle unità di nanometri) e la picofiltrazione (il diametro nominale dei fori della membrana è uguale alle unità dei picometri).
Come svantaggi di questo metodo dovrebbe essere notato:
La necessità di pre-trattamento dell'acqua fornita alla membrana ad osmosi inversa;
Il costo relativamente elevato di 1 litro di acqua prodotta (attrezzature costose, membrane costose);
Bassa mineralizzazione dell'acqua prodotta (specialmente quando la picofiltrazione). L'acqua diventa quasi distillata.
Elettrodialisi. Si basa sulla rimozione di sali dall'acqua sotto l'azione di un campo elettrico. La rimozione di ioni di sostanze disciolte si verifica a causa di membrane speciali. Proprio come con l'uso della tecnologia ad osmosi inversa, si verifica la rimozione di altri sali, oltre agli ioni di durezza.
L'acqua completamente pulita dai sali di durezza può essere distillata.
