Skema struktur silikon. Struktur kulit elektron
Posisi struktur atom dalam PS: Periode III; kelompok IV, memimpin; Biaya kernel: +14 Si; Massa atom relatif: Ar (Si) = 28 Struktur atom: p = 14, e = 14, n = = 14 Rumus elektronik: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
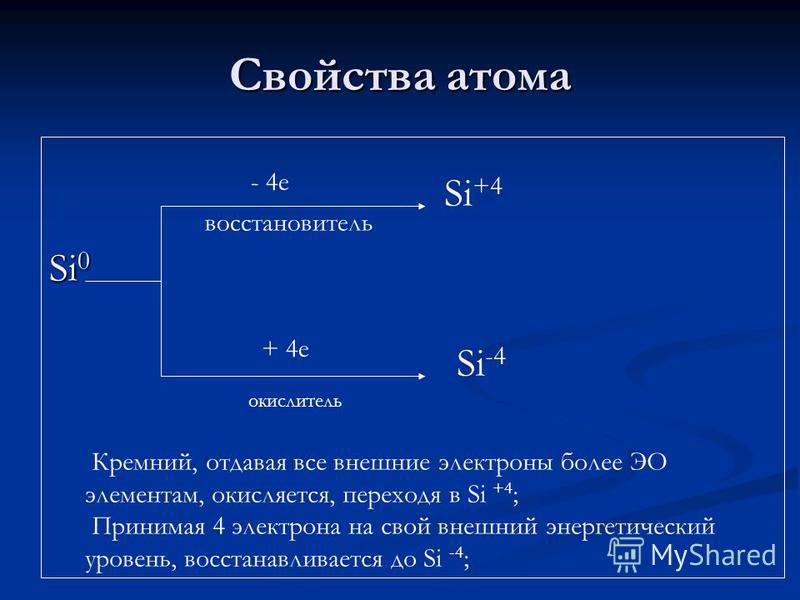
Sifat-sifat atomik agen pereduksi Si + 4 e oksidator Si + 4 Si -4 Silikon, yang memberikan semua elektron eksternal ke lebih banyak elemen EO, dioksidasi, mengalir ke Si + 4; Mengambil 4 elektron ke tingkat energi eksternal, itu berkurang menjadi Si-4;

Sifat fisik silikon Silikon adalah non-logam, ia ada dalam keadaan kristal dan amorf. Silikon kristal adalah zat baja keabu-abuan dengan kilau logam, sangat keras tetapi rapuh. Silikon amorf - coklat bubuk. p = 2,33 g / cm 3; t pl. = C; t kip. = C;

Struktur kristal silikon Kisi kristal silikon adalah jenis berlian yang berpusat pada wajah kubik. Tetapi karena panjang ikatan yang lebih panjang antara Si - Si, kekerasan silikon secara signifikan lebih kecil dari pada berlian. Silikon rapuh, hanya jika dipanaskan di atas C.

Sifat elektrofisika Silikon elemental Silikon elemental adalah semikonduktor yang khas. semikonduktor khas. Sifat elektrofisika silikon kristal sangat dipengaruhi oleh jejak pengotor yang terkandung di dalamnya. Untuk mendapatkan kristal silikon tunggal dengan konduktivitas lubang, aditif elemen dari kelompok ke-3 boron, aluminium, galium dan indium dimasukkan ke dalam silikon, dengan konduktivitas elektronik dari penambahan unsur-unsur kelompok ke-5 dari fosfor, arsenik atau antimon.


Flint Flint, Flint ini, batu ini jelek dan sangat jelek dan sangat tahan lama, batu tahan lama, meletakkan fondasi untuk batu mulai dari zaman batu - abad - abad alat kerja batu api. alat batu. Ada dua alasan: - prevalensi dan ketersediaan silikon; - prevalensi dan ketersediaan silikon; - kemampuan untuk membentuk ujung tajam saat dikupas; - kemampuan untuk membentuk ujung tajam saat dikupas;




Tahukah Anda .. Metode untuk mendapatkan silikon dalam bentuk murni dikembangkan oleh Nikolai Nikolayevich Beketov. Silikon di Rusia diproduksi di pabrik: Kamensk - Uralsky (Wilayah Sverdlovsk) Kamensk - Uralsky (Wilayah Sverdlovsk) Shelekh (Wilayah Irkutsk). Shelekh (wilayah Irkutsk).

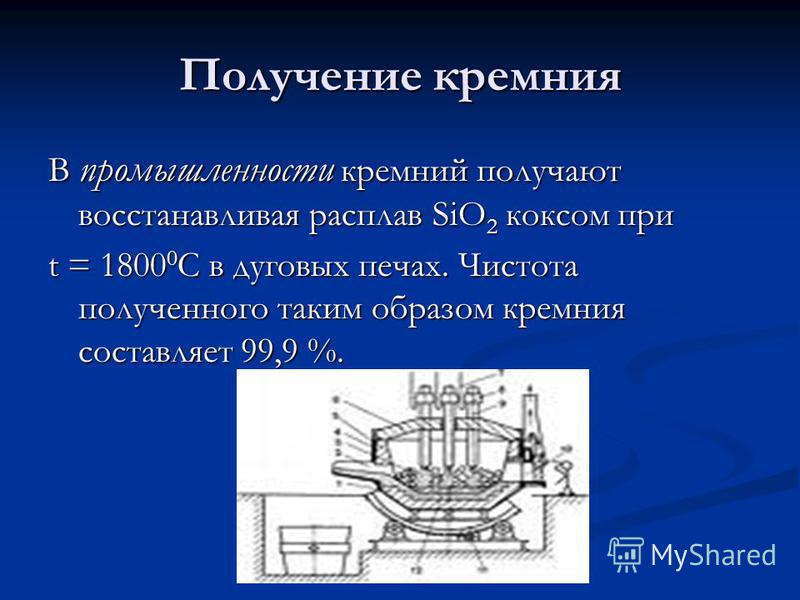
Produksi silikon Dalam industri, silikon diperoleh dengan mengurangi leburan SiO 2 dengan kokas pada t = C dalam tungku busur. Kemurnian silikon yang diperoleh adalah 99,9%.
Memperoleh metode produksi silikon laboratorium: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Sifat kimia silikon Ketika dipanaskan hingga 400 - C, silikon bereaksi dengan oksigen untuk membentuk silikon dioksida: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
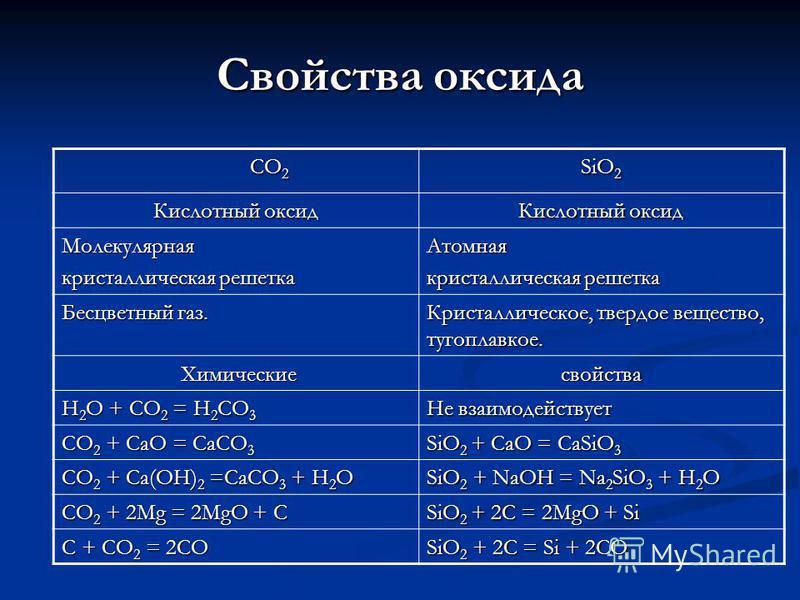
Sifat CO 2 CO 2 SiO 2 oksida Asam oksida Kisi kristal molekuler Atom Gas yang tidak berwarna. Kristal, padat, tahan api. Sifat Kimia Kimia H 2 O + CO 2 = H 2 CO 3 Tidak bereaksi CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Sifat-sifat asam H 2 CO 3 H 2 SiO 3 Dibasic, mengandung oksigen, lemah, rapuh terbang. Dibasic, mengandung oksigen, lemah, tidak larut dalam air. Menerima: CO 2 + H 2 O = H 2 CO 3 Menerima: SiO 2 + H 2 O = tidak dapat tidak stabil, rapuh, terurai ketika berdiri atau dipanaskan: H 2 CO 3 = CO 2 + H 2 O Tidak dapat dipilih dalam bentuk murni, karena terurai ketika dipanaskan: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Evolusi gas minor __________

Asam Karbonat Asam Silikat - Karbonat; - hidrokarbon; - silikat; - silikat; Karbonat memiliki semua sifat garam, adalah elektrolit yang kuat, sepenuhnya terdisosiasi menjadi ion (larut dalam air). Hanya garam logam alkali yang larut, yang lain membentuk tidak larut atau tidak membentuk garam sama sekali (Al +3, Cr +3, Ag +).
![]()



Peran biologis Senyawa silikon paling penting, SiO 2, sangat penting untuk kehidupan tanaman dan hewan. Berkat dia, alang-alang, alang-alang. Berkat dia, alang-alang, alang-alang dan ekor kuda berdiri kokoh seperti bayonet. dan ekor kuda berdiri tegak, seperti bayonet. Daun sedimen tajam memotong seperti Daun sedimen tajam memotong seperti pisau, tunggul pada pisau bidang yang dipangkas, tunggul pada bidang yang dipangkas menusuk seperti jarum, dan tangkai sereal menempel seperti jarum, dan batang sereal sangat kuat sehingga tidak memungkinkan begitu kuat sehingga jangan biarkan ladang di ladang jatuh dari hujan dan ladang angin di ladang pergi dari hujan dan angin


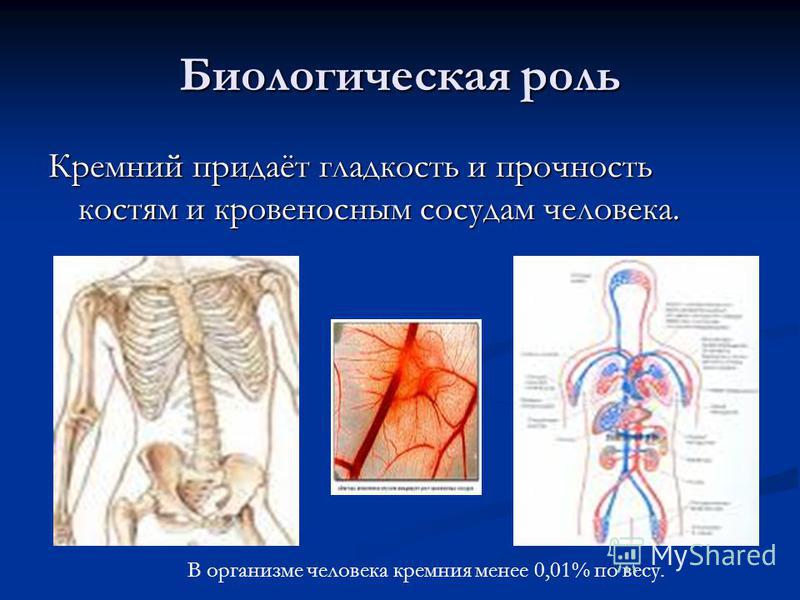
Silikon adalah elemen jejak yang terus-menerus terkandung dalam tubuh manusia. Jumlah terbesarnya terkandung dalam kelenjar getah bening, jaringan ikat aorta, trakea, rambut, dan kulit. Silikon diperlukan untuk membangun sel-sel epitel. Silikon adalah elemen jejak yang terus-menerus terkandung dalam tubuh manusia. Jumlah terbesarnya terkandung dalam kelenjar getah bening, jaringan ikat aorta, trakea, rambut, dan kulit. Silikon diperlukan untuk membangun sel-sel epitel. Silikon memainkan peran penting dalam proses mineralisasi tulang; diperlukan untuk menjaga elastisitas dinding arteri, memiliki efek positif pada sistem kekebalan tubuh dan memperlambat proses penuaan pada jaringan tubuh manusia. Kandungan rata-rata silikon dalam darah adalah 8,25 mg / hari. Seiring bertambahnya usia, levelnya dalam tubuh menurun, sehingga pada orang lanjut usia, kebutuhan silikon cenderung meningkat. Tingkatkan penyerapan silikon oleh tubuh dengan adanya kalsium, magnesium, mangan, dan kalium. Silikon memainkan peran penting dalam proses mineralisasi tulang; diperlukan untuk menjaga elastisitas dinding arteri, memiliki efek positif pada sistem kekebalan tubuh dan memperlambat proses penuaan pada jaringan tubuh manusia. Kandungan rata-rata silikon dalam darah adalah 8,25 mg / hari. Seiring bertambahnya usia, levelnya dalam tubuh menurun, sehingga pada orang lanjut usia, kebutuhan silikon cenderung meningkat. Tingkatkan penyerapan silikon oleh tubuh dengan adanya kalsium, magnesium, mangan, dan kalium.

Peran biologis silikon juga termasuk dalam komposisi organisme hidup yang lebih rendah - diatom dan radiolaria - benjolan yang paling halus dari materi hidup, yang menciptakan kerangka kecantikan tak tertandingi yang terbuat dari silika. Silikon juga merupakan bagian dari organisme hidup yang lebih rendah - diatom dan radiolaria - benjolan yang paling halus dari materi hidup, yang menciptakan keindahan kerangka silika yang tak tertandingi. Diatoms Radiolaria Self-control 1. Apa tempat silikon dalam sistem periodik: a) 2 periode, 4 og. b) 3 periode, 3 gr. bab. c) 3 periode, 4 gr. bab) 2 periode, 4 gr. b) 3 periode, 3 gr. bab. c) 3 periode, 4 gr. bab. 2. Kisi silikon: a) ionik; b) atomik; c) molekul; a) ionik; b) atomik; c) molekul; 3. Menurut prevalensi di alam silikon ... elemen: a) pertama; b) yang kedua; c) yang ketiga; a) yang pertama; b) yang kedua; c) yang ketiga; 4. Silikon bereaksi dengan: a) logam, hidrogen, halogen; a) logam, hidrogen, halogen; b) logam, halogen, mudah larut dalam alkali; b) logam, halogen, mudah larut dalam alkali; c) oksida, asam, bukan logam. c) oksida, asam, bukan logam. 5. Garam asam silikat: a) silikida; b) hidrosilikat; c) silikat; a) silikida; b) hidrosilikat; c) silikat;

Silikon.
Silikon - sebuah elemen dari kelompok subkelompok IV utama periode ke-3 dari sistem periodik unsur-unsur kimia DI Mendeleev, dengan nomor atom 14, massa atom: 28.0855. Dalam senyawa, biasanya menunjukkan tingkat oksidasi +4 (valensi IV) dan sangat jarang +3, +2, dan +1 (masing-masing valensi, III, II, dan I). Dalam tabel periodik, silikon Mendeleev terletak di grup IVA (A-menunjukkan bahwa ini adalah subkelompok utama) (dalam kelompok karbon), pada periode ketiga. Nemetall . Dilambangkan dengan simbol Si(lat Silikonium). Dalam bentuk bebas - bubuk cokelat atau bahan padat abu-abu muda dengan kilau logam. Struktur kisi: kubik, berlian.
Status utama: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Sifat fisik.
Silikon kristal adalah zat abu-abu gelap dengan kilau baja. Struktur silikon mirip dengan struktur berlian. Dalam kristalnya, masing-masing atom dikelilingi oleh tetrahedral empat lainnya dan dihubungkan dengan mereka oleh ikatan kovalen, yang jauh lebih lemah daripada antara atom karbon dalam berlian. Dalam kristal silikon, bahkan dalam kondisi normal, beberapa ikatan kovalen dihancurkan. Oleh karena itu, ia memiliki elektron bebas, yang menyebabkan konduktivitas listrik kecil. Ketika penerangan dan pemanasan meningkatkan jumlah ikatan yang putus, yang berarti bahwa jumlah elektron bebas meningkat dan konduktivitas listrik meningkat. Jadi harus menjelaskan sifat semikonduktor silikon.
Silikon sangat rapuh, densitasnya adalah 2,33 g / cm3. Seperti halnya batu bara, mengacu pada bahan tahan api.
Silikon terdiri dari tiga isotop stabil: 2814Si (92,27%), 2914Si (4,68%), dan 3014Si (3,05%).
3. Berada di alam.
Paling sering di alam, silikon ditemukan dalam bentuk silika - senyawa berdasarkan silikon dioksida (IV) SiO2 (sekitar 12% dari massa kerak bumi). Mineral dan batuan utama yang dibentuk oleh silikon dioksida adalah pasir (sungai dan kuarsa), kuarsa dan kuarsit, batu api, dan feldspar. Silikat alami memiliki komposisi dan struktur yang kompleks. Berikut adalah komposisi beberapa silikat alami:
ü feldspar K 2 O × Al 2 O 3 × 6 Si 2,
ü asbes 3MgO × 2SiO 2 × 2H 2 O,
ü mika K 2 O × 3Al 2 O 3 × 6 Si 2 2 2 2 2 O,
ü kaolinit 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Kelompok kedua yang paling umum dalam sifat senyawa silikon adalah silikat dan aluminosilikat
Fakta tunggal menemukan silikon murni dalam bentuk asli dicatat.
4. Sifat kimia silikon dan senyawanya.
Dengan sifat kimia, silikon, seperti karbon, adalah non-logam, tetapi non-logamnya kurang jelas, karena memiliki jari-jari atom yang lebih besar. Karena atom silikon memiliki 4 elektron pada tingkat energi luar, keadaan oksidasi -4 dan +4 adalah karakteristik silikon (senyawa silikon diketahui, di mana derajat oksidasi adalah +2).
Silikon dalam kondisi normal agak lembam, yang harus dijelaskan oleh kekuatan kisi kristalnya. Langsung berinteraksi hanya dengan fluorin:
Asam (kecuali campuran hidrofluorik HF dan nitrat HNO 3)silikon tidak bekerja. Namun, itu larut dalam hidroksida logam alkali, membentuk silikat dan hidrogen:
Dari dua modifikasi alotropik silikon, kristal dan amorf, silikon amorf lebih aktif secara kimia. Dia bereaksi dengan dengan oksigen ketika dipanaskan, membentuk SiO 2:
dan juga dengan semua halogenmisalnya:
![]()
Pada suhu tinggi silikon terhubung dengan karbonmembentuk carborundum SiC:
Carborundum memiliki kisi kristal mirip berlian, di mana setiap atom silikon dikelilingi oleh empat atom karbon dan sebaliknya, dan ikatan kovalen sangat kuat, seperti pada berlian. Karena itu, dalam kekerasan itu dekat dengan berlian. Batu gerinda dan roda gerinda terbuat dari silikon karbida.
Magnesium silisida. Dalam reaksi dengan logam aktif, terjadi dengan pembentukan silikida, Silikon bertindak sebagai agen pengoksidasi:
Pada suhu tinggi, silikon memulihkan banyak logam dari oksida mereka. (!!!)
Silane Di bawah aksi asam klorida pada silisida, senyawa hidrogen paling sederhana dari silikon adalah silan SiH 4:
Silane adalah gas beracun dengan bau yang tidak menyenangkan, self-igniting in air (!!!):
Silikon oksida (IV).Silikon oksida (IV) juga disebut silika. Ini adalah zat tahan api yang solid. (titik leleh 1700 ° C) tersebar luas di alam dalam dua bentuk:
1) silika kristal - dalam bentuk mineral kuarsa dan varietasnya (kristal batu, kalsedon, batu akik, jasper, batu api); kuarsa membentuk dasar pasir kuarsa yang banyak digunakan dalam konstruksi dan industri silikat;
2) silika amorf - dalam bentuk komposisi mineral opal SiO 2 × n H 2 O; bentuk silika amorf yang bersahaja adalah diatomit, tripoli (tanah infusorial); contoh dari silika anhidrat amorf buatan adalah silika gel, yang diperoleh dari natrium metasilikat:
Silica gel memiliki permukaan yang berkembang dan karena itu menyerap kelembaban dengan baik. .
Pada 1710 ° kuarsa mencair. Dengan pendinginan cepat massa leleh terbentuk gelas kuarsa . Ini memiliki koefisien ekspansi yang sangat rendah, sehingga kaca kuarsa panas tidak pecah ketika air didinginkan dengan cepat. Peralatan gelas laboratorium dan instrumen untuk penelitian ilmiah terbuat dari kaca kuarsa.
Formula paling sederhana dari silikon oksida (IV) SO 2 mirip dengan rumus karbon monoksida (IV) CO 2. Sementara itu, sifat fisik mereka sangat berbeda (SiO 2 - solid, CO 2 - gas). Perbedaan ini dijelaskan oleh struktur kisi kristal. C0 2 mengkristal dalam kisi molekuler, SiO 2 - dalam atom. Struktur SiO 2 dalam gambar planar dapat direpresentasikan sebagai berikut:
Jumlah koordinasi atom karbon dalam CO 2 padat adalah 2, dan silikon dalam SiO 2 adalah 4. Setiap atom silikon tertutup dalam tetrahedron 4 atom oksigen. Pada saat yang sama, atom silikon berada di tengah, dan atom oksigen terletak di simpul tetrahedron . Seluruh potongan silika dapat dianggap sebagai kristal dengan rumusnya (SiO 2) n. Struktur silikon oksida (IV) ini menentukan kekerasan dan refraktorinya yang tinggi .
Sifat kimia silikon oksida (IV) SiO 2 mengacu pada asam oksida. Ketika menggabungkannya dengan alkali padat, oksida basa dan karbonat, garam asam silikat terbentuk:
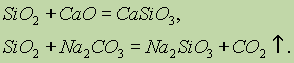
Hanya asam hidrofluorik yang berinteraksi dengan silikon oksida (IV):
Reaksi ini digunakan untuk mengetsa kaca. .
Silikon (IV) tidak larut dalam air dan tidak berinteraksi secara kimia dengannya. (!!!) Oleh karena itu, asam silikat diperoleh secara tidak langsung dengan bertindak dengan asam pada larutan kalium atau natrium silikat:
Dalam hal ini, asam silikat (tergantung pada konsentrasi larutan awal garam dan asam) dapat diperoleh baik dalam bentuk massa yang mengandung air agar-agar, dan dalam bentuk larutan koloid (sol).
Asam silikat. SiO 2 adalah anhidrida dari sejumlah asam silikat, yang komposisinya dapat dinyatakan dengan rumus umum: xSiO 2 × yH 2 O, di mana x dan y - bilangan bulat:
1) x = 1, y = 1: SiO 2 × H 2 O, mis. H 2 SiO 3 - asam metasilat;
2) x = 1, y = 2: SiO 2 × 2H 2 O, mis. H 4 SiO 4 - asam ortosilikat;
3) x = 2, y = 1: 2SiO 2 × H 2 O, mis. H 2 Si 2 O 5 - asam bimetacrynic.
Asam silikat dibangun dari unit struktural tetrahedral (di setiap unit tersebut, atom silikon berada di tengah tetrahedron, dan ada atom oksigen di bagian atas). Tautan struktural, menyatukan dalam rantai, membentuk asam polisilikon yang lebih stabil:
Komposisi senyawa tersebut dapat dinyatakan dengan rumus (H 2 SiO 3) n. Namun, biasanya asam silikat diwakili oleh rumus H 2 SiO 3. H 2 SiO 3 - asam sangat lemah, sedikit larut dalam air. Ketika dipanaskan dengan mudah terurai seperti asam karbonat:
Semua asam silikat sangat lemah (lebih lemah dari batubara).
Silikat. Garam dari semua asam silikat disebutsilikat, meskipun, sebagai suatu peraturan, dalam literatur pendidikan, silikat menyiratkan garam asam metasilat. Komposisi mereka biasanya diwakili oleh formula dalam bentuk senyawa oksida unsur. Misalnya, kalsium silikat CaSiO 3 dapat dinyatakan sebagai: CaO × SiO 2.
Silikat komposisi R 2 O × nSiO 2, di mana R 2 O - oksida natrium atau kalium , disebut gelas larut , a solusi air terkonsentrasi mereka - gelas cair . Gelas natrium soda adalah yang paling penting..
Ketika berdiri di udara, larutan silikat tumbuh keruh, karena karbon dioksida (IV) di udara menggantikan asam silikat dari garamnya:
Asam silikat praktis tidak larut dalam air - sifat ini digunakan sebagai reaksi kualitatif terhadap ion SiO 3 2-.
Silikat diperoleh dengan menggabungkan silika dengan alkali atau karbonat:
5. Penemuan ion SiO 3 2. (Saya tidak dapat menemukan apa-apa ...)
6. Peran senyawa silikon dalam pembentukan tanah dan kehutanan.
Batuan beku memiliki komposisi yang cukup stabil dan terutama mengandung senyawa silikon, aluminium, besi, alkali, magnesium, dan kalsium. Menurut kandungan Si02, batuan beku dibagi menjadi empat kelompok: asam (\u003e 65%), sedang (52-65%), basa (40-52%) dan ultrabasa (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Batuan beku asam- granit, pegmatit, riolit, dasit dan lain-lain - biasanya memiliki warna terang dan kecoklatan dengan kristal kuarsa, feldspar, mika. Kandungan SiO2 di dalamnya tinggi (lebih dari 65%) dengan jumlah kalium dan natrium yang signifikan. Pada saat yang sama, sedikit zat besi, dan kalsium dan magnesium dapat diabaikan. Tanah pada batuan beku asam, misalnya, pada granit, berbeda pada tahap awal pelapukan karena kerapuhan, karakter kerikil dari bahan sumber. Ketika cuaca dalam kondisi lembab, mereka dengan mudah kehilangan unsur-unsur tanah-basa, akibatnya tanah pada substrat yang lapuk seperti itu (eluvium batu) sangat buruk, kurang subur.
Batuan beku utama -basalt, gabbro, dll., biasanya, memiliki warna gelap (menjadi hitam). Mereka dicirikan oleh kandungan SiO 2 yang lebih rendah dibandingkan dengan batuan asam. Batuan beku utama relatif kaya akan senyawa besi, mangan, kromium, kobalt, seng, titanium, nikel, tembaga. Produk dari pelapukan mereka dengan cepat memperoleh karakter tanah liat, mempertahankan reaksi alkali dan netral untuk waktu yang lama, dan dibedakan oleh peningkatan kandungan mineral humus dan tanah liat. Tanah di bebatuan seperti itu lebih subur.
Selain spesies asam dan basa sering ditemukan batuan beku jenis transisi(sedang) - batuan intrusi dari kelompok diorit dan pasangannya yang efusif - andesit. Dengan demikian, tanah pada batuan ini memperoleh fitur yang mirip dengan yang terbatas pada batuan asam atau basa. Jauh lebih jarang trah ultrabasic:peridotites dan picrites, yang memiliki konten SiO 2 terendah.
Batuan metamorf -transisi antara kristal besar dan batuan sedimen. Batuan sedimen kuno di bawah penyelaman, tekanan tinggi dan suhu bermetamorfosis, membentuk gneisses, serpentinit, marmer, kuarsit, serpih. Gneisses memiliki komposisi yang hampir sama dengan granit. Tanah yang terbentuk pada batuan tersebut memiliki fitur yang mirip dengan tanah pada batuan beku asam itu sendiri.
Klorin.
1. Posisi aluminium dalam tabel DI Mendeleev. Struktur atom, derajat oksidasi yang dimanifestasikan.
Klorin - sebuah elemen dari subkelompok utama dari kelompok VII, periode ke-3, dengan nomor atom 17. Ini dilambangkan dengan simbol Cl (lat. Chlorum). Aktif secara kimia non-logam . Termasuk dalam kelompok halogen .
Zat klorin sederhana dalam kondisi normal - gas beracun warna hijau kekuningan lebih berat daripada udara, dengan bau yang kuat . Molekul klor diatomik (rumus Cl 2).
Status utama: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Art.: -1 +1 +3 +5 +7.
Struktur kulit elektron.
Pada tingkat valensi atom klor mengandung 1 elektron tidak berpasangan : 1s 2 2s 2 2p 6 3s 2 3p 5, jadi valensi 1 untuk atom klor sangat stabil. Karena keberadaan dalam atom klor dari orbital d-sublevel kosong, atom klor dapat menunjukkan tingkat oksidasi lainnya. Skema pembentukan keadaan tereksitasi atom:
Senyawa klorin juga dikenal dimana atom klor secara formal menunjukkan valensi 4 dan 6, misalnya ClO 2 dan Cl 2 O 6. Namun, senyawa-senyawa ini radikal, artinya mereka memiliki satu elektron yang tidak berpasangan.
2. Sifat fisik.
Dalam kondisi normal, klorin adalah gas berwarna kuning-hijau dengan bau yang mencekik. Beberapa sifat fisiknya disajikan di bawah ini.
Kepadatan: 3,214 g / l, liq. - pada -35 ° C - 1,557, TV. pada -105 0 С 1,9 g / cm 3.
Titik lebur: 172.2 K
Titik didih: 238,6 K
Panas fusi: 6,41 kJ / mol
Panas penguapan: 20,41 kJ / mol.
Gas klorin relatif mudah dicairkan. Dimulai dengan tekanan 0,8 MPa (8 atmosfer), klorin sudah cair pada suhu kamar. Ketika didinginkan hingga suhu −34 ° C, klorin juga menjadi cair pada tekanan atmosfer normal. Liquid chlorine adalah cairan kuning-hijau dengan efek korosif yang sangat tinggi (karena konsentrasi molekul yang tinggi). Meningkatkan tekanan, Anda dapat mencapai keberadaan klorin cair hingga suhu +144 ° C (suhu kritis) pada tekanan kritis 7,6 MPa. Dalam hal konduktivitas listrik, klorin cair terjadi di antara isolator terkuat: kondisinya saat ini hampir satu miliar kali lebih buruk daripada air suling, dan 10 22 kali lebih buruk daripada perak. Kecepatan suara dalam klorin sekitar satu setengah kali lebih rendah daripada di udara.
3. Berada di alam.
Di alam, ada dua isotop klorin 35 Cl dan 37 Cl. Klorin adalah halogen paling umum di kerak bumi. . Klorin sangat aktif - secara langsung terhubung dengan hampir semua elemen dari sistem periodik. Oleh karena itu, di alam, hanya ditemukan dalam bentuk senyawa dalam komposisi mineral:
ü halit NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl 2 · 6H 2 O,
ü carnallite KCl · MgCl 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Cadangan klorin terbesar terkandung dalam garam, air, laut, dan lautan (kandungan dalam air laut adalah 19 g / l). Klorin menyumbang 0,024% dari total jumlah atom di kerak bumi; nomor clarke (angka yang menyatakan kandungan rata-rata unsur kimia dalam kerak bumi, hidrosfer, Bumi, badan antariksa, sistem geokimia atau kosmokimia, dll., relatif terhadap massa total sistem ini. Angka ini dinyatakan dalam% atau g / kg.) klorin - 0,017%. Tubuh manusia mengandung 0,25% ion klorin menurut beratnya. Pada manusia dan hewan, klorin ditemukan terutama dalam cairan antar sel (termasuk darah) dan memainkan peran penting dalam pengaturan proses osmotik, serta dalam proses yang terkait dengan kerja sel saraf.
4. Sifat kimia klorin dan senyawanya. Mendapatkan klorin.
Struktur atom silikon. Si. +14. Keadaan gembira. E. 3d. 3 p. 3s E. 3d. 3 p. 3s 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Gambar 3 dari presentasi "Silicon" untuk pelajaran kimia dengan topik "silikon"Dimensi: 960 x 720 piksel, format: jpg. Untuk mengunduh gambar gratis untuk pelajaran kimia, klik kanan pada gambar dan klik "Simpan gambar sebagai ...". Untuk menunjukkan gambar dalam pelajaran, Anda juga dapat mengunduh presentasi "Silicon.ppt" secara gratis dengan semua gambar dalam arsip zip. Ukuran arsip - 562 KB.
Unduh presentasiSilikon
"Silikon dan senyawanya" - Struktur dan sifat atom. Semikonduktor. t melt (Si) = 1415? C, t melt (berlian) = 3730? C. Mendapatkan silikon. Penemuan silikon. Termasuk juga dalam komposisi tumbuhan dan hewan. Sifat fisik silikon. Oleh karena itu, batunya adalah keramik, dan ubin serta fragmen-fragmen amphora Yunani kuno juga keramik. Tujuan: Sifat kimia silikon.
"Senyawa silikon" - Silikon dan senyawanya. Sifat kimia dari SiO2. Silane Mendapatkan asam silikat. Sifat silikon. Silikon oksida. Silikat alami. Keadaan oksidasi Berlian imitasi Topas. Mendapatkan silikon di laboratorium. Berada di alam. Kisi kristal. Penemuan silikon. Batu kecubung. Mendapatkan silikon.
"Silicon isotop" - Pemisahan isotop silikon. Produksi silikon polikristalin. Prospek untuk penggunaan silikon monoisotop. Pengenceran isotop ketika menumbuhkan kristal tunggal dari wadah kuarsa. Produksi biji kristal tunggal. Ketergantungan posisi maksimum dari pita Raman pada massa atom.
"Silicon Lesson" - Manakah dari unsur kimia paling penting dalam alam yang hidup dan yang tidak hidup? Oksida karbon dan silikon. Zatnya transparan. Pada manifestasi sifat non-logam dan logam. Menyimpulkan refleksi. Pengujian akhir. Oksida karbon dan silikon hidroksida? Keadaan agregasi: a) cair, b) gas, c) padat.
"Silikon" - Silikon adalah zat sederhana. Sifat fisik. Silikon oksida (IV). Silisida Berarti untuk organisme hidup. Interaksi dengan logam. Interaksi dengan non-logam. Silikon karbida. Silikon di alam. Silikon. Produk industri silikat. Salah satu jenis senyawa silikon alami adalah silikat.
"Karbon dan silikon" - Silikon oksida (IV). Elemen kelompok IV dari subkelompok utama. Toksisitas. 7. Menarik tentang karbon. Silikat. Selipkan ke sentuhan. Berlian adalah zat alami yang paling sulit. Sifat kimia Lebih dari 99% karbon di atmosfer adalah dalam bentuk karbon dioksida. Karbida. 6. Aplikasi. Salah satu yang paling lembut di antara padatan.
Ada total 6 presentasi.
