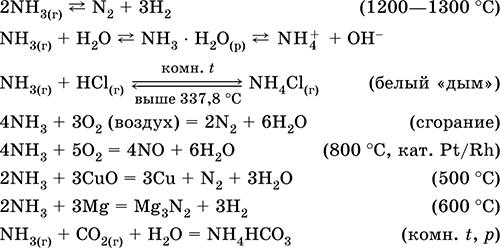
Ծծումբ: Ջրածին սուլֆիդ եւ սուլֆիդներ
4. դոկտ
240Ծծումբ: Ջրածին սուլֆիդ, սուլֆիդներ, հիդրոֆիլդիդներ: Ծծմբի օքսիդները (IV) եւ (VI): Ծծմբաթթու եւ ծծմբաթթու եւ դրանց աղեր: Էսթրեսային ծծմբի էներ: Նատրիումի թիոսուլֆատ
4.1. Ծծումբ
Ծծումբը քիմիական տարրերից մեկն է, որ մարդիկ մի քանի հազարամյակների ընթացքում օգտագործել են: Այն լայնորեն տարածվում է բնության մեջ եւ հայտնվում է ինչպես ազատ պետության, այնպես էլ միացությունների մեջ: Ծծմբի պարունակող օգտակար հանածոները կարող են բաժանվել երկու խմբի `սուլֆիդներ (պիրիտներ, փայլեր, կողոպտիչներ) եւ սուլֆատներ: Ներքին ծծումբը մեծ քանակությամբ է հայտնաբերվել Իտալիայում (Սիցիլիա կղզի) եւ ԱՄՆ-ում: ԱՊՀ-ում ծագած ծծմբային հանքավայրերը գտնվում են Վոլգայի շրջանում, Կենտրոնական Ասիայի երկրներում, Ղրիմում եւ այլ շրջաններում:
Առաջին խմբի հանքանյութերը ներառում են կապարի փայլը PbS, պղնձի փայլը Cu 2 S, արծաթագույն փայլը `Ag 2 S, ցինկը, ZnS, Cadmium snag - CdS, պիրիտ կամ երկաթե պիրիտ - FeS 2, calcopyrite - CuFeS 2, cinnabar - HgS:
Երկրորդ խմբի հանքանյութերը ներառում են CaSO 4 2H 2 O գիպսը, mirabilite (Glauber's salt) - Na 2 SO 4 10H 2 O եւ kizerite - MgSO 4 H 2 O.
Ծծումբը հայտնաբերվում է կենդանիների եւ բույսերի մեջ, որպես սպիտակուցի մոլեկուլների մի մասը: Նավթում հայտնաբերված օրգանական ծծմբի միացությունները:
Ստանալով
1. Երբ ծծումբը ձեռք է բերվում բնական միացություններից, օրինակ, պիրիտից ծծմբից, այն ջեռուցվում է բարձր ջերմաստիճանի պայմաններում: Ծծմբի պիրիտը տարանջատում է երկաթի (II) սուլֆիդ եւ ծծմբ:
2. Ծծումբը կարելի է ձեռք բերել ռեակցիայի միջոցով թթվածնի բացակայությամբ ջրածնի սուլֆիդի օքսիդացումով.
2H 2 S O 2 = 2S 2H 2 O
3. Ներկայումս, ծծմբի երկօքսիդի SO2- ի ածխածնի երկօքսիդի կրճատման արդյունքում ծծմբի վերականգնումը սովորական արտադրանք է մետաղների մածուցիկում, ծծմբի հանքաքարերից.
SO 2 C = CO 2 S
4. Մետաղագործական եւ կոկաօդային ջեռոցների թափոնների գազերը պարունակում են ծծմբի երկօքսիդի եւ ջրածնի սուլֆիդի խառնուրդ: Այս խառնուրդն անցնում է բարձր ջերմաստիճանի վրա կատալիզատորի վրա.
H 2 S SO 2 = 2H 2 O 3S
^ Ֆիզիկական հատկություններ
Ծծմբը ծանր, փխրուն կիտրոնի դեղին գույն է: Այն գրեթե անլուծելի է ջրի մեջ, սակայն շատ հեշտ լուծվում է ածխածնի դիսֆրիֆում եւ որոշ այլ լուծիչների մեջ:
Վատը վարում է ջերմություն եւ էլեկտրական հոսանք: Ծծումբը ձեւավորում է մի քանի allotropic փոփոխություններ:
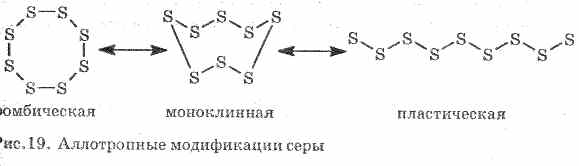
1 . ^ Ռոմբիկ ծծումբը (առավել կայուն), բյուրեղները ունեն octahedra ձեւը:
Երբ ծծումբը ջերմացվում է, նրա գույնը եւ փխրունությունը փոխվում են, առաջինը `բաց դեղին, ձեւավորվում է, իսկ հետո, երբ ջերմաստիճանը մեծանում է, այն մթնում է եւ դառնում է այնքան խիտ, որ խողովակի մեջ չի հոսում, հետագա ջեռուցման դեպքում, փխրունությունը կրկին կաթված է, եւ 444, 6 ° .
2. ^ Մոնոկլինիկ ծծումբ - մոդիֆիկացիա `մուգ շղթայական ասեղի տեսքով, որը ստացվել է հալեցվող ծծմբի դանդաղ սառեցմամբ:
3. Պլաստիկ ծծումբձեւավորվում է, եթե եռացող եռացող ծծմբը լցվի սառը ջրով: Հեշտությամբ ձգվում է ռետինե (տես, 19-րդ էջը):
Բնական ծծումբը բաղկացած է չորս կայուն изотоптардың խառնուրդից. 32 16 Ս, 33 16 Ս, 34 16 Ս, 36 16 Ս
^ Քիմիական հատկություններ
Ածխածնի ատոմը, ունենալով ոչ լիարժեք արտաքին էներգետիկ մակարդակ, կարող է կցել երկու էլեկտրոն եւ ցուցադրել մի աստիճան
Օքսիդացում -2: Ծծումբը նման է օքսիդացման վիճակին, մետաղների եւ ջրածնի (Na 2 S, H 2 S) միացություններով: Երբ էլեկտրոնները վերադարձնում կամ էլեկտրոնների կորուստը ավելի էլեկտրիկային տարրերի ատոմին, ծծմբի օքսիդացման աստիճանը կարող է լինել 2, 4, 6:
Սուլֆուրը համեմատաբար աներկ է սառնարանում, սակայն աճող ջերմաստիճանը աճում է նրա ռեակցիան: 1. Մետաղներով, ծծումբը օքսիդացնում է հատկությունները: Երբ այդ ռեակցիաները ձեւավորում են սուլֆիդներ (ոսկով, պլատինով եւ րիդիդիով չեն արձագանքում). Fe S = FeS
2. Նորմալ պայմաններում, ծծմբը չի արձագանքում ջրածնի հետ, եւ 150-200 ° C- ում փոխադարձ ռեակցիա է տեղի ունենում.
3. Մետաղների հետ ռեակցիաների եւ ջրածնի հետ, ծծմբը պահպանում է որպես տիպիկ օքսիդացնող նյութ, եւ ուժեղ օքսիդացող նյութերի առկայությամբ ցուցադրվում է նվազեցնող հատկություններ:
S 3F 2 = SF 6 (չի արձագանքում յոդի հետ)
4. Թթվածնի ծծմբի այրումը հասնում է 280 ° C, իսկ օդում `360 ° C: Սա ձեւավորում է SO 2 եւ SO 3 խառնուրդներ.
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Երբ առանց օդի ջեռուցվում է, ծծումբը ուղղակիորեն համատեղում է ֆոսֆորով, ածխածնի միջոցով `ցուցադրելով օքսիդացող հատկություններ.
2P 3S = P 2 S 3 2S C = CS 2
6. Բարդ նյութերի հետ փոխազդեցության դեպքում, ծծմբը հիմնականում գործում է որպես նվազեցնող նյութ:
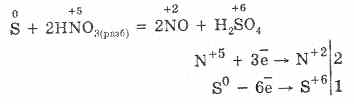
7. Ծծումբը կարող է անհամաչափություն առաջացնել: Այսպիսով, երբ ձեւավորվում են խմորիչ խառնուրդ, ծծմբի փոշի, սուլֆիտներ եւ սուլֆիդներ.
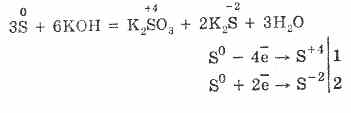
Դիմում
Ծծումբը լայնորեն օգտագործվում է արդյունաբերության եւ գյուղատնտեսության մեջ: Արտադրության մոտ կեսը սպառվում է ծծմբաթթու արտադրելու համար: Ծծումբը օգտագործվում է ռետինե խառնուրդի համար. Այս դեպքում ռետինը վերածվում է ռետին:
Ծծմբի (նուրբ փոշի) տեսքով ծծումբը օգտագործվում է խաղողի այգիների եւ բամբակի հիվանդությունների դեմ: Այն օգտագործվում է ատրճանակի, համընկնումների, լուսաշող կոմպոզիցիաներ ձեռք բերելու համար: Բժշկության մեջ պատրաստված ծծմբային քսուք մաշկի հիվանդությունների բուժման համար:
4.2. Ջրածին սուլֆիդ, սուլֆիդներ, հիդրոֆիլդիդներ
Ջրածին սուլֆիդը ջրի անալոգային է: Իր էլեկտրոնային բանաձեւը
Այն ցույց է տալիս, որ H - S - H պարտատոմսերի ձեւավորման մեջ ներգրավված են ծծմբի ատոմի արտաքին մակարդակի երկու պ-էլեկտրոնները: H 2 S մոլեկուլը անկյունային ձեւ է, ուստի այն բեւեռային է:
^ Լինելով բնության մեջ
Ջրածին սուլֆիդը բնության մեջ հայտնաբերվում է հրաբխային գազերի եւ որոշ հանքային աղբյուրների ջրերում, ինչպիսիք են Պյատիգորսկը, Մացեստան: Այն ձեւավորվում է տարբեր կենդանական եւ բուսական մնացորդներից ծծմբի պարունակող օրգանական նյութերի քայքայմամբ: Սա բացատրում է կոյուղու, ջրահեռացման եւ աղբավայրերի բնորոշ տհաճ հոտը:
Ստանալով
1. Ջրածին սուլֆիդը կարելի է ձեռք բերել ջերմության միջոցով ծծմբի հետ ուղղակի կապակցությամբ ջրածնի հետ:
2. Այնուամենայնիվ, սովորաբար այն ձեռք է բերվում երկաթի (III) սուլֆիդի մեջ ցրված հիդրոքլորի կամ ծծմբաթթուի ակցիայի միջոցով.
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Այս ռեակցիան հաճախ իրականացվում է Kipp ապարատի մեջ:
^ Ֆիզիկական հատկություններ
Նորմալ պայմաններում ջրածնի սուլֆիդը անգույն գազ է, որը փչացած ձվի հզոր բնորոշ հոտ է: Շատ թունավոր, ներխուժում է հեմոգլոբին, պատճառելով կաթված, որն անառողջ է:
Koը հանգեցնում է մահվան: Ցածր կոնցենտրացիաներում, ավելի քիչ վտանգավոր է: Անհրաժեշտ է դրա հետ աշխատել արտանետվող կաբինետներում կամ հերմետիկ փակ սարքերի միջոցով: Արտադրամասի H 2 S- ի թույլատրելի բովանդակությունը կազմում է 0.01 մգ 1 լիտր օդ:
Ջրածին սուլֆիդը համեմատաբար լավ լուծելի է ջրի մեջ (20 ° C- ի 2.5 ծավալը ջրածնի սուլֆիդի լուծարման դեպքում, 1 հատ ջրով):
Ջրի մեջ ջրածնի սուլֆիդի լուծույթը կոչվում է ջրածնի սուլֆիդային ջուր կամ ջրածնի սուլֆիդի թթու (այն թույլ է տալիս թույլ թթվի հատկությունները):
^ Քիմիական հատկություններ
1, երբ խիստ ջեռուցվում է, ջրածնային սուլֆիդը գրեթե ամբողջությամբ տարանջատում է ծծումբը եւ ջրածինը:
2. Գազային ջրածնի սուլֆիդը այրվում է օդում `կապույտ բոցով` ծծմբի օքսիդի (IV) եւ ջրի ձեւավորման հետ `
2H 2 S 3O 2 = 2SO 2 2H 2 O
Թթվածքի պակասի արդյունքում ձեւավորվում է ծծմբի եւ ջրի քանակը `2H 2 S O 2 = 2S 2H 2 O
3. Ջրածին սուլֆիդը բավականին ուժեղ նվազեցնող նյութ է: Այս կարեւոր քիմիական գույքը կարելի է բացատրել հետեւյալ կերպ. H 2 S- ի լուծույթում համեմատաբար հեշտ է նվիրաբերել էլեկտրոնները օդի թթվածնի մոլեկուլներին.
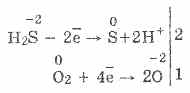
Միեւնույն ժամանակ, օդում թթվածինը օքսիդացնում է ջրածնի սուլֆիդին մինչեւ ծծմբ, ինչը կազմում է ջրածնի սուլֆիդի ջրի աղտոտումը.
2H 2 S O 2 = 2S 2H 2 O
Սա բացատրում է այն փաստը, որ ջրածնի սուլֆիդը կուտակվում է բնության մեջ շատ մեծ քանակությամբ, երբ օրգանական նյութը տատանվում է, օդի թթվածինը օքսիդացնում է այն անվճար ծծմբի:
4, ջրածնի սուլֆիդը ակտիվորեն արձագանքում է հալոգեն լուծումների հետ, օրինակ `
H 2 S I 2 = 2HI S Ծծումբ ազատ է, եւ յոդի լուծումը դառնում է գունաթափված:
5. Տարբեր օքսիդիզատորներ ակտիվորեն արձագանքում են ջրածնի սուլֆիդի հետ. Ազոտաթթվի գործողության արդյունքում ձեւավորվում է ազատ ծծմբ:
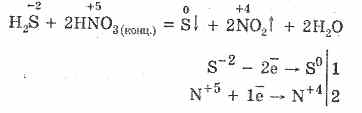
6. Հիդրոէներգետիկ սուլֆիդի լուծույթը թթվածային է դեզիացիայի պատճառով.
H 2 SH HS - HS - H S -2
Առաջին փուլը սովորաբար գերակայում է: Դա շատ թույլ թթու է, ավելի թույլ, քան ածխաթթու, որը սովորաբար տեղադրում է H 2 S սուլֆիդներից:
Սուլֆիդներ եւ հիդրոգլիֆիդներ
Հիդրֆֆուորային թթու, որպես երկբեւեռ, կազմում է երկու տող աղ:
Միջին - սուլֆիդներ (Na 2 S);
Թթու - հիդրոֆիլդիդներ (NaHS):
Այս աղերը կարելի է ձեռք բերել `հիդրոկիդների փոխազդեցությամբ ջրածնի սուլֆիդի հետ` 2NaOHH 2 S = Na 2 S 2H 2 O
Ծծմբի ուղղակի փոխազդեցությունը մետաղների հետ.
Աղերի փոխանակման արձագանքը H 2 S կամ աղի միջեւ:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Հիդրոօլֆիդները գրեթե բոլոր լուծվող ջրերում են:
Ալկալի եւ ալկալային մետաղների սուլֆիդները նույնպես հեշտությամբ լուծելի են ջրում, անգույն:
Ծանր մետաղական սուլֆիդները գրեթե լուծելի են կամ ջրի մի փոքր լուծելի են (FeS, MnS, ZnS); Նրանցից ոմանք չեն լուծարվում լուծելի թթուներ (CuS, PbS, HgS):
Որպես թույլ թթու աղեր, ջրային լուծույթներում սուլֆիդները բարձր հիդրոդլիզացված են: Օրինակ, ալկալիային մետաղական սուլֆիդները, որոնք լուծարված են ջրի մեջ, ունեն ալկալային ռեակցիա.
Na 2 S NONNNaHS NaOH
Բոլոր սուլֆիդները, ինչպիսիք են ջրածնի սուլֆիդը, ուժեղ նվազեցնող նյութեր են.
3PbS -2 8HN 5 O 3 (պար.) = 3PbS 6 O 4 4H 2 O 8N 2 O
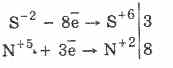
Որոշ սուլֆիդներ ունեն բնորոշ գույն: CuS եւ PbS - սեւ, CdS - դեղին, ZnS - սպիտակ, MnS - վարդագույն, SnS - շագանակագույն, Al 2 S 3 - նարնջագույն: Կալիումների որակական վերլուծությունը հիմնված է սուլֆիդների տարբեր լուծույթների եւ նրանցից շատերի տարբեր գույների վրա:
^ 4.3. Ծծմբի օքսիդ (IV) եւ ծծմբական թթու
Ծծմբի օքսիդը (IV) կամ ծծմբի երկօքսիդը, նորմալ պայմաններում, աննկատ գազ է սուր տհաճ հոտով: Երբ սառչում է -10 ° C, այն հեղուկացնում է անգույն հեղուկ:
Ստանալով
1. Լաբորատոր պայմաններում, ծծմբի օքսիդը (IV) ստանում է ծծմբաթթուների աղերից `նրանց վրա ուժեղ թթուների գործողությամբ.
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. Այնուամենայնիվ, ծծմբի երկօքսիդը ձեւավորվում է ցածր ակտիվ մետաղներով տաքացվող խտացված ծծմբաթթվի փոխազդեցությամբ.
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. Ծծմբի օքսիդը (IV) նույնպես ձեւավորվում է այն ժամանակ, երբ ծծմբի այրումը օդում կամ թթվածինում.
4. Արդյունաբերական պայմաններում SO2- ը ձեռք է բերում պիրիտի տապալման միջոցով FeS 2 կամ գունավոր մետաղների ծծմբային հանքաքարեր (ցինկը blend ZnS, կապարաձեւ փայլ PbS եւ այլն):
4FeS 2 11Ո 2 = 2Fe 2 O 3 8SO 2
SO 2-ի մոլեկուլի կառուցվածքային բանաձեւը.
SO 2 մոլեկուլում պարտատոմսերի ձեւավորմանը մասնակցում են երկու ծագում ունեցող ծծմբի ատոմներ եւ երկու թթվածնային ատոմներից չորս էլեկտրոն: Խառնուրդային էլեկտրոնների զույգերի փոխադարձ ցնցումը եւ ծծմբի միայնակ էլեկտրոնային զույգը մոլեկուլին տալիս են անկյունային ձեւ:
Քիմիական հատկություններ
1. Ծծմբի օքսիդը (IV) պարունակում է թթվային օքսիդների բոլոր հատկությունները.
Ջրի փոխազդեցություն
Ալկալիների հետ փոխազդեցություն
Հիմնական օքսիդների հետ փոխազդեցություն:
2. Ծծմբի օքսիդը (IV) բնութագրվում է նվազեցնող հատկություններով.
S 4 O 2 O 0 2 2S 6 O -2 3 (կատալիզատորի ներկայությամբ, երբ ջեռուցվում է)
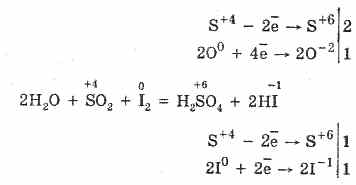
Սակայն ուժեղ նվազեցնող նյութերի առկայության դեպքում SO 2 վարվում է որպես օքսիդացող նյութ:
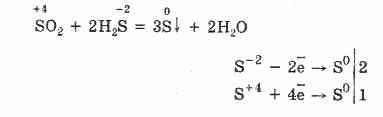
Ծծմբի (IV) օքսիդի redox երկօքսիդությունը բացատրվում է այն փաստով, որ ծծմբում կա 4 օքսիդացման վիճակ, եւ այնուամենայնիվ, այն կարող է թողնել մինչեւ 2 Էլեկտրոն, օքսիդացնել S 6, եւ 4 էլեկտրոն վերցնել, այն կարող է կրճատվել S0- ի: Այս կամ այլ հատկությունների դրսեւորումը կախված է ռեակտիվ բաղադրիչի բնույթից:
Ծծմբի օքսիդը (IV) խիստ լուծելի է ջրի մեջ (SO2- ի 40 հատ հատվածը 20 սմ 1 ծավալով լուծվող): Այս դեպքում ձեւավորվում է միայն ջրային լուծույթում առկա ծծմբային թթու:
SO 2 H 2 ՕH 2 SO 3
Ռեակցիան անխուսափելի է: Ջրի լուծույթում, ծծմբի օքսիդը (IV) եւ ծծմբաթթունքը քիմիական հավասարակշռության մեջ են, որոնք կարող են տեղափոխվել: Հ 2 SO 3- ի կապակցությամբ (թթվի չեզոքացում
Դուք) ռեակցիան առաջանում է ծծմբաթթվի ձեւավորման ուղղությամբ. երբ SO 2- ի (փչում է ազոտի կամ ջեռուցման միջոցով) հեռացումը, ռեակցիան առաջանում է դեպի սկզբնական նյութերի նկատմամբ: Ծծմբաթթվի լուծույթը միշտ պարունակում է ծծմբի օքսիդ (IV), որը այն տալիս է սուր հոտ:
Ծծմբաթթունն ունի թթուների բոլոր հատկությունները: Լուծման մեջ այն բաժանվում է քայլերով.
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Ջերմային անկայուն, անկայուն: Ծծմբաթթու, ինչպես dibasic, ձեւավորում է երկու տեսակի աղեր.
Միջին - սուլիտներ (Na 2 SO 3);
Թթու - հիդրոֆիլիտ (NaHSO 3):
Սուլֆիտները ձեւավորվում են, երբ ալկալը լիովին չեզոքացնում է թթու:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
Հիդրոֆիլդիտները ձեռք են բերվում ալկալիների պակասով.
H 2 SO 3 NaOH = NaHSO 3 H 2 O
Ծծմբաթթու եւ դրա աղերը ունենում են ինչպես օքսիդացնող, այնպես էլ նվազեցնող հատկություններ, որոնք որոշվում են ռեակցիայի գործընկերոջ բնույթով:
1. Այսպիսով, թթվածնի սուլֆիտների ակցիայի ընթացքում օքսիդացված են սուլֆատներ.
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
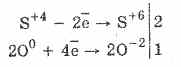
Բուլոնի եւ կալիումի պերմանգանատների ծծմբային թթվի օքսիդացումն ավելի հեշտ է ընթանում.
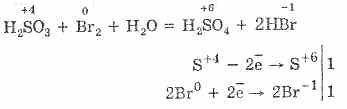
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
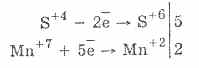
2. Ավելի խիստ նվազեցնող նյութերի առկայության դեպքում սուլֆիտները ցուցաբերում են օքսիդատիվ հատկություններ.
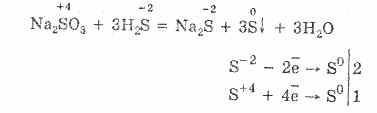
Գրեթե բոլոր hydrosulfites եւ ալկալիական մետաղական sulphites լուծարվում են աղերի ծծմբային թթու.
3. Հ 2 SO 3- ը թույլ թթու է, քանի որ սուլֆիտների եւ hydrosulfites- ի թթուների ակցիան հանգեցնում է SO2- ի թողարկմանը: Այս մեթոդը սովորաբար օգտագործվում է SO2- ի ձեռքբերման ժամանակ լաբորատոր պայմաններում.
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Ջրի լուծելի սուլֆիտները հեշտությամբ անցնում են հիդրոիզիայից, որի արդյունքում լուծույթում ավելանում են OH- իոնների կոնցենտրացիան.
Na 2 SO 3 NONNaHSO 3 NaOH
Դիմում
Ծծմբի օքսիդը (IV) եւ ծծմբային թթունները գունաթափվում են բազմաթիվ ներկերի հետ, կազմելով նրանց անգույն միացություններ: Վերջինս կարող է կրկին ջնջել, երբ ջեռուցվում կամ լույսի ներքո, որի արդյունքում գույնը վերականգնվում է: Հետեւաբար SO 2 եւ H 2 SO 3- ի սպիտակեցնող ազդեցությունը տարբերվում է քլորի սպիտակեցնող ազդեցությունից: Սովորաբար, ծծմբի (IV) rxid bleaches բուրդ, մետաքս եւ ծղոտե:
Ծծմբի օքսիդը (IV) սպանում է բազմաթիվ միկրոօրգանիզմների: Հետեւաբար, կաղապարների սնկերը ոչնչացնելու համար նրանք խթանում են հումքային նկուղները, նկուղները, գինու բարելները եւ այլն: Այն նաեւ օգտագործվում է մրգերի եւ հատապտուղների տրանսպորտում եւ պահեստում: Մեծ քանակությամբ, ծծմբի օքսիդ IV) օգտագործվում է ծծմբաթթու արտադրելու համար:
Կարեւոր ծրագիրն է CaHSO 3 (սուլֆիտային լիկյոր) կալցիումի հիդրոֆիլիտի լուծում, որն օգտագործվում է փայտի եւ թղթի պղպեղի բուժման համար:
^ 4.4. Ծծմբի օքսիդ (VI): Ծծմբաթթու
Ծծմբի օքսիդը (VI) (տես ներդիրը 20) անգույն հեղուկ է, որը ամրացնում է 16.8 ° С ջերմաստիճանում ամուր բյուրեղային զանգվածին: Այն խոնավության մեջ ներծծում է շատ խոշոր, ձեւավորելով ծծմբաթթու `SO 3 H 2 O = H 2 SO 4
Աղյուսակ 20. Ծծմբի օքսիդի հատկությունները
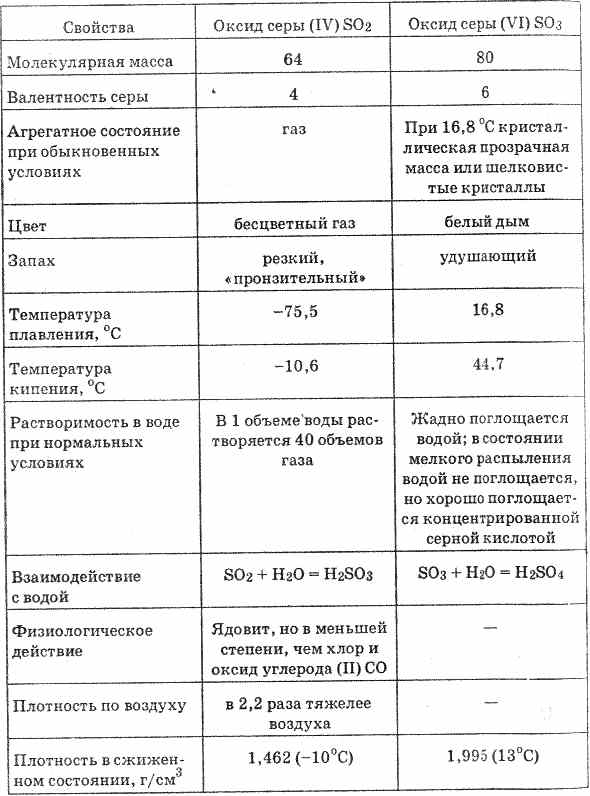
Ջրի մեջ ծծմբի օքսիդների (VI) լուծարումը ուղեկցվում է զգալի քանակությամբ ջերմության շնորհիվ:
Ծծմբի օքսիդը (VI) շատ լուծելի է խտացված ծծմբաթթվի մեջ: ՍՆ 3-ի լուծույթը անջուր թթվի մեջ կոչվում է օլում: Oleums- ը կարող է պարունակել մինչեւ 70% SO 3:
Ստանալով
1. Ծծմբի օքսիդը (VI) ստացվում է թթվածինով ծծմբի երկօքսիդի օքսիդացումով, 450 ° C ջերմաստիճանի դեպքում, կատալիզատորների ներկայությամբ: Ծծմբաթթու արտադրությունը).
2SO 2 O 2 = 2SO 3
2. SO 2-ից SO 3-ը օքսիդացնելու այլ միջոց է ազոտ (IV) օքսիդը օգտագործել որպես օքսիդացող նյութ:
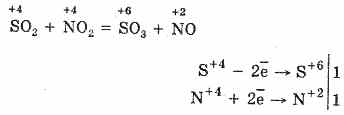
Արդյունքում նիտրիկ օքսիդը (II) մթնոլորտային թթվածնի հետ շփման ժամանակ հեշտությամբ եւ արագ փոխակերպվում է ազոտական օքսիդի (IV): 2NO O 2 = 2NO 2
Այն կարող է կրկին օգտագործվել SO 2 օքսիդացման մեջ: Հետեւաբար, NO 2- ը հանդես է գալիս որպես թթվածնի կրող: SO2- ից SO 3-ի օքսիդացման այս մեթոդը կոչվում է ազոտային: SO 3-ի մոլեկուլը ունի եռանկյունի ձեւ, որի կենտրոնում
Ծծմբի ատոմը գտնվում է `
Նման կառույցը պայմանավորված է կապող էլեկտրոնային զույգերի փոխադարձ ցնցմամբ: Ծծմբի ատոմն ապահովում է վեց արտաքին էլեկտրոններ դրանց ձեւավորման համար:
Քիմիական հատկություններ
1. SO 3 - բնորոշ թթվի օքսիդ:
2. Ծծմբի օքսիդը (VI) ունի ուժեղ օքսիդացող նյութի հատկություններ:
Դիմում
Ծծմբի օքսիդը (VI) օգտագործվում է ծծմբաթթու արտադրելու համար: Ամենակարեւորը շփման մեթոդն է
Ծծմբաթթու: Այս մեթոդով դուք կարող եք ստանալ H 2 SO 4 ցանկացած կոնցենտրացիայի, ինչպես նաեւ oleum. Գործընթացը բաղկացած է երեք փուլից `SO2 ստանալու; SO 2-ից SO 3-ի օքսիդացում; ստանալով H 2 SO 4:
SO 2- ը ձեռք է բերվում այրվող պիրիտ FeS 2 հատուկ վառարաններում `4FeS 2 11O 2 = 2Fe 2O 3 8SO 2
Խտացրած տապալման համար պիրիտը նախածանց է, իսկ ծծմբից ամբողջությամբ այրելու համար զգալիորեն ավելի շատ օդի (թթվածին) ներարկվում է, քան պահանջվում է ռեակցիան: Կաթը հեռացնում է գազը, կազմված է ծծմբի (IV) օքսիդի, թթվածնի, ազոտի, մկնդեղի միացությունների (պիրիտի խառնուրդներից) եւ ջրի գոլորշիներից: Այն կոչվում է աղացած գազ:
Տապակած գազը մանրակրկիտ մաքրում է, քանի որ մկնդեղի միացությունների նույնիսկ փոքրաթիվ բովանդակությունը, ինչպես նաեւ փոշին եւ խոնավությունը, թույնի կատալիզատորը: Գազը մաքրվում է մկնդեղի միացություններից եւ փոշուց, անցնում է հատուկ էլեկտրաստատիկ հաստոցների եւ լվացքի աշտարակի միջոցով: խոնավությունը կլանում է չորացման աշտարակի մեջ կենտրոնացված ծծմբաթթուով: Թթվածին պարունակվող մաքրված գազը ջերմափոխանակում է մինչեւ 450 ° C եւ մտնում շփման ապարատներ: Շփման սարքերում ներգրավված են կատալիզատորով լցված վանդակաճաղեր:
Նախկինում որպես կատալիզատոր օգտագործվում էր խիտ մանրացված մետաղական պլատին: Այնուհետեւ այն փոխարինվեց վանադիումային միացություններով `վանադիումի օքսիդ (V) V 2 O 5 կամ վանադիլ սուլֆատ VOSO 4, որն ավելի էժան է, քան պլատինինը եւ ավելի դանդաղ թունավորվել:
SO2- ից SO 3-ի օքսիդացման արձագանքը անխուսափելի է.
2SO 2 O 2 2SO 3
Կալցիման գազի թթվածնի պարունակության բարձրացումը մեծացնում է ծծմբի օքսիդի (VI) բերքը `450 ° C ջերմաստիճանի դեպքում, սովորաբար հասնում է 95% կամ ավելի:
Ձեւածված ծծմբի օքսիդը (VI) այնուհետեւ սնուցվում է հակատանկային մեթոդով կլանման աշտարակի վրա, որտեղ այն կլանում է կենտրոնացված ծծմբաթթուով: Քանի որ հագեցած է, առաջին անգամ ձեւավորվում է անջուր ծծմբաթթու, ապա օլեում: Հետագայում oleum- ը զտվում է 98% ծծմբաթթու եւ սպառողներին:
Ծծմբաթթվի կառուցվածքային բանաձեւը.
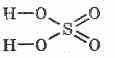
^ Ֆիզիկական հատկություններ
Ծծմբաթթունքը ծանր, անգույն, յուղոտ հեղուկ է, որը crystallizes է 10.4 ° C, գրեթե կրկնակի ( = 1.83 գ / սմ 3) ավելի ծանր է, քան ջուրը, հոտավետ, անկայուն: Ծայրահեղ hygroscopic. Խոնավությունը ներծծվում է մեծ քանակությամբ ջերմության շնորհիվ, այնպես որ դուք չեք կարող ջուր լցնել ջերմոցային աղտոտվածքին `կլինեն թթվային շերտ: Համար
Ծծմբաթթուդը պետք է ավելացվի ջրի փոքր մասերում:
Անհագեցած ծծմբաթթուը լուծարվում է մինչեւ 70% ծծմբի օքսիդի (VI): Երբ ջեռուցվում է, այն վերացնում է SO 3-ը, մինչեւ 98.3% H 2 SO 4 զանգվածի մասնիկի լուծույթը: Անջրանցիկ H 2 SO 4 գրեթե չի կատարում էլեկտրական հոսանք:
^ Քիմիական հատկություններ
1. Այն ջրի հետ խառնվում է ցանկացած չափաքանակում եւ ձեւավորում է տարբեր կազմի hydrates:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6.5H 2 O
2. Խտացված ծծմբաթթու գազը ածխաջրածին է ածխածնի, շաքարավազի, թղթի, փայտի, մանրաթելային, ջուրի տարրերը հեռացնելով `
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Ձուլված ածուխը մասնակիորեն համագործակցում է թթվով.
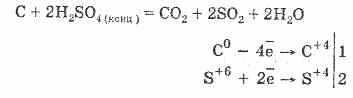
Գազի ջրազրկումը հիմնված է ծծմբաթթվի կողմից ջրի կլանման վրա:
Որպես ուժեղ չեզոք թթու, H 2 SO 4- ը այլ թթուներ չոր աղերից հեռացնում է.
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Այնուամենայնիվ, եթե H 2 SO 4 ավելացված է աղ լուծույթների, ոչ մի թթվային տեղաշարժ չի առաջանում:
H 2 SO 4 - ուժեղ dibasic թթու: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2-4
Այն ունի անկայուն ուժեղ թթուների բոլոր հատկությունները:
Խտացված ծծմբաթթուը բնորոշվում է ոչ օքսիդացող թթուների բոլոր հատկություններով: Մասնավորապես, այն համագործակցում է մետաղների հետ, որոնք մետաղների լարման էլեկտրաքիմիական շարքում են ջրածին.
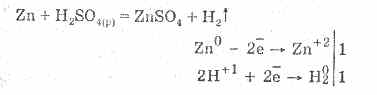
Մետաղների հետ փոխազդեցությունը պայմանավորված է ջրածնի իոնների կրճատմամբ:
6. Խտացված ծծմբաթթունը էներգետիկ օքսիդացնող նյութ է: Երբ ջերմացվում է, օքսիդացնում է մետաղների մեծ մասը, այդ թվում `ջրածնից հետո սթրեսների էլեկտրաքիմիական շարքում, չի արձագանքում միայն պլատինե եւ ոսկի: Կախված մետաղի ակտիվությունից, նվազեցման արտադրանքը կարող է լինել S -2, S ° եւ S 4:
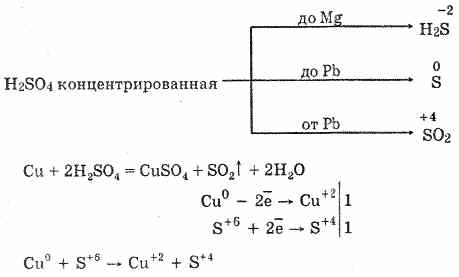
Սառը, խտացված ծծմբային թթուն չի փոխազդում այնպիսի ուժեղ մետաղների հետ, ինչպիսիք են ալյումինը, երկաթը եւ քրոմը: Դա պայմանավորված է մետաղների պասիվացման պատճառով: Այս հատկությունը լայնորեն կիրառվում է այն ժամանակ, երբ այն տեղափոխվում է երկաթյա կոնտեյներով:
Այնուամենայնիվ, երբ ջեռուցվում է.
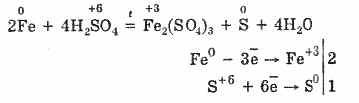
Այսպիսով, խտացված ծծմբաթթունը մետաղների հետ շփվում է թթու կազմող ատոմների կրճատման շնորհիվ:
Սուլֆատ իոն SO 2-4-ի որակական արձագանքը BaSO 4 սպիտակ բյուրեղային նստվածքների ձեւավորմանն է, որը լուծելի չէ ջրի եւ թթուների մեջ:
SO 2- 4 Ba 2 BaSO 4
Դիմում
Ծծմբաթթունքը հիմնական քիմիական արդյունաբերության կարեւորագույն արդյունքն է, որը զբաղվում է ոչ-
Օրգանական թթուներ, ալկալներ, աղեր, հանքային պարարտանյութեր եւ քլոր:
Տարբեր դիմումների համար ծծմբաթթունն առաջինն է թթուներից: Դրա մեծամասնությունը սպառվում է ֆոսֆատ եւ ազոտային պարարտանյութեր ձեռք բերելու համար: Լինելով անկայուն, ծծմբաթթուն օգտագործվում է այլ թթուներ արտադրելու համար `հիդրոքլորիդ, հիդրոֆլորոր, ֆոսֆորային եւ քացախ:
Բենզինի, կերոսինի, յուղի յուղերի մաքրման համար շատ բան է կատարվում վնասակար նյութերից: Մեքենայի մեխանիզմում ծծմբաթթունքը մետաղի մակերեսը մաքրում է օքսիդներից մինչեւ ծածկույթը (նիկելային ոսկուց, քրոմապատում եւ այլն): Ծծմբաթթու օգտագործվում է պայթուցիկ նյութերի, արհեստական մանրաթելերի, ներկերի, պլաստմասսաների եւ այլնի արտադրության մեջ: Այն օգտագործվում է մարտկոցները լրացնելու համար:
Ծծմբաթթուների աղերը կարեւոր են:
^ Նատրիումի սուլֆատNa 2 SO 4- ը բյուրեղացնում է Na 2 SO 4 10H 2 O- ի հիդրոյի տեսքով ջրային լուծույթներից, որը կոչվում է Գլաուբերի աղ: Այն օգտագործվում է բժշկության մեջ, որպես լակատիվ: Անզգայացուցիչ նատրիումի սուլֆատ օգտագործվում է սոդայի եւ ապակիների արտադրության մեջ:
^ Ամոնիումի սուլֆատ(NH 4) 2 SO 4 - ազոտի պարարտանյութ:
Կալիումի սուլֆատK 2 SO 4 - կալիումի պարարտանյութ:
Կալցիումի սուլֆատ CaSO 4 բնութագրվում է գիպսային հանքային CaSO 4 2H 2 O ձեւով: Երբ 150 ° C ջեռուցվում է, այն կորցնում է որոշակի ջուր եւ գնում է 2CaSO 4 H 2 O հիդրատ, որը կոչվում է այրված գիպս կամ ալաբաստեր: Երբ խառնվում է ջրի խառնուրդի զանգվածին, ալաբաստորը կարծես կարծրացնում է որոշ ժամանակ անց, վերածվում CaSO 4 2H 2 O. Գիպսը լայնորեն կիրառվում է շինարարությունում (գիպս):
Մագնեզիումի սուլֆատMgSO 4- ը հայտնաբերվել է ծովային ջրով, որի պատճառով դառը դուր է գալիս: Բյուրեղային հիդրատ, որը կոչվում է դառը աղ, օգտագործվում է որպես շնչառական:
Վիտրիոլ- Fe, Cu, Zn, Ni, Co- ի մետաղական սուլֆատների բյուրեղային հիդրոդերի տեխնիկական անունը (ջրազրկված աղերը չեն ծածկում): Պղնձի սուլֆատCuSO 4 5H 2 O- ը կապույտ թունավոր նյութ է: Բույսերը ցրված են լուծված լուծումով, իսկ սերմերը ցանվում են ցանքից առաջ: Iron ցիկլոլըFeSO 4 7H 2 O- ը թեթեւ կանաչ նյութ է: Օգտագործվում է բույսերի, թանաքների, հանքային ներկերի եւ այլ վնասատուների դեմ պայքարի համար: Ցինկի սուլֆատZnSO 4 7H 2 O- ն օգտագործվում է հանքային թանաքների արտադրության մեջ, sittoprechatanii, բժշկության մեջ:
^ 4.5. Էսթրեսային ծծմբի էներ: Նատրիումի թիոսուլֆատ
Ծծմբաթթուների եթերները ներառում են dialkyl sulfates (RO 2) SO 2: Սրանք բարձր եռացող հեղուկներ են. ցածր լուծելի ջրի մեջ; ալկոհոլի, ալկոհոլի եւ ծծմբաթթուների աղերի առկայության դեպքում: Ստորին dialkyl sulfates են ալկոհոլային նյութեր:
Դիետիկ սուլֆատ(C 2 H 5) 2 SO 4: Հալման կետ -26 ° С, եռման կետ 210 ° С, լուծելի է ալկոհոլի մեջ, լուծելի ջրի մեջ: Ստացված ծծմբաթթվի փոխազդեցությունը էթանոլով: Էթիլացնող նյութը օրգանական սինթեզում է: Ներթափանցում է մաշկը:
Դեմետիլ սուլֆատ(CH 3) 2 SO 4: Հալման կետ `-26.8 ° С, եռման կետ 188.5 ° С: Լուծեք ալկոհոլի մեջ, վատ, ջրում: Ամոնիակով արձագանքում է լուծիչի բացակայության դեպքում (պայթյունով); Ծծմբի որոշ արական բաղադրիչներ, ինչպիսիք են ֆենոլային էթերը: Այն ստանում է 60% oleum- ի փոխազդեցությունը մեթանոլի հետ `150 ° C- ում: Դա մեթիլացնող նյութ է օրգանական սինթեզում: Կարկինոգեն, ազդում է աչքերի, մաշկի, շնչառական օրգանների վրա:
^ Նատրիումի թիոսուլֆատ Na 2 S 2 O 3
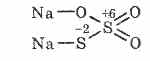
Թիոսուլֆրիկաթթվի աղը, որտեղ երկու ծծմբի ատոմներ ունեն տարբեր օքսիդացում: 6 եւ -2: Բյուրեղային նյութ, լավ լուծվող ջրի մեջ: Ներկայացված է բյուրեղային Na 2 S 2 O 3 5H 2 O ձեւով, որը սովորաբար կոչվում է հիպոսուլֆիտ: Ձգվում է նատրիումի սուլֆիտի փոխազդեցության արդյունքում ծծմբի մեջ:
Na 2 SO 3 S = Na 2 S 2 O 3
Ինչպես thiosulfuric թթվային, դա ուժեղ նվազեցնող նյութ է, հեշտ է օքսիդացված է քլորի կողմից ծծմբաթթվի:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
Քլորի ներծծման համար նատրիումի թիոսուլֆատի օգտագործումը (առաջին գազի դիմակների մեջ) հիմնված էր այդ ռեակցիայի վրա:
Միանգամայն տարբեր օքսիդացում տեղի է ունենում նատրիումի թիոսուլֆատով թույլ օքսիդացող նյութեր: Սա ձեւավորում է թթատրիումային թթվի աղեր, օրինակ.
2 Նա 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2 Նա
Նատրիումի թիոսուլֆատը հանդիսանում է NFSR 3, ծծմբի ներկերի արտադրության արտադրանք, ծծմբի արդյունաբերական գազերի մաքրման համար: Այն օգտագործվում է հյուսվածքների սպիտակեցումից հետո քլորի հետքերը հեռացնելու, հանքաքարի արծաթը հանելու համար: ֆոտոգալիզմը, լուսանկարչական ապարատը, iodometry- ի ռեակտիվը, մկնդեղի միացությունների, սնդիկի, հակաբորբոքային նյութերի հետ թունավորման համար հակատիտը:
Քիմիական տարրերի ծծումբը գտնվում է VIA- խմբի մեջ, 3-րդ պարբերություն: Ծծմբի ատոմի արտաքին էլեկտրոնային շերտում կա 6 էլեկտրոն: Ցուցադրելով օքսիդացող նյութի հատկությունները մետաղների եւ ջրածնի հետ նյութերի ձեւավորման մեջ, ծծումբը ստանում է օքսիդացման վիճակ -2 (տանում է 2 էլեկտրոն):
Թթվածին պարունակող միացությունների կազմի մեջ ծծումբը օքսիդացում է պարունակում +4 եւ +6: Այսպիսով, ծծումբը բնութագրվում է օքսիդացման վիճակներով -2; 0; +4; +6.
Բնականաբար, ծծմբը հայտնաբերվում է իր հայրենի երկրում եւ հանքանյութերի կազմի մեջ: Օրինակ, ծծմբի պարունակությունը պարունակում է կապարաձեւ փայլ (հիմնական բաղադրիչը, PbS- ի հիմնական սուլֆիդ) եւ պղնձի փայլ (հիմնական բաղադրիչը `Cu 2 S պղնձի սուլֆիդ):
Ծծումբը ձեւավորում է մի քանի պարզ նյութ `ալոտոպային փոփոխություններ: Ռոմբիկ ծծումբը առավել կայուն է սենյակային ջերմաստիճանում (Նկար 1): Այս նյութը բաղկացած է S8 մոլեկուլներից: Ռոմբիկ ծծումբը դեղին է եւ հալեցնում է + 112.8 ° C ջերմաստիճանի պայմաններում:
Նկար. 1. Ծծմբի ռոմանտիկ փոփոխություն
Երբ ջերմացվում է, ռոմբի ծծումբը աստիճանաբար վերածվում է մուգ շագանակագույն զանգվածի: Սա ծծմբի պլաստիկ ծծմբի մեկ այլ ալմատիկ փոփոխություն է: Պլաստիկ ծծումբը բաղկացած է խիտ ծծմբի մոլեկուլների S n- ից:
Մետաղների եւ ջրածնի հետ քիմիական ռեակցիաների ծծումբը խաղում է օքսիդացող նյութի դերը: Օքսիդացման աստիճանը նվազում է 0-ից -2: Թթվածնի հետ արձագանքում ծծմբը հանդես է գալիս որպես նվազեցնող նյութ, բարձրացնելով օքսիդացման աստիճանը 0-ից +4:
Քննարկեք ծծմբի ներգործության օրինակներ:
Երբ ծծումբը համագործակցում է ջրածնի հետ, ձեւավորվում է ջրածնի սուլֆիդ:
Երբ ցինկը համագործակցում է ծծմբի հետ, ձեւավորվում է ցինկ սուլֆիդ:
Ծծումբը այրվում է թթվածնի մեջ `ծծմբի օքսիդի (IV) ձեւավորմամբ` (նկ. 2):

Նկար. 2. Այրվող ծծումբը թթվածնի մեջ
Դիտարկեք ծծմբային միացությունների հատկությունները `օքսիդացման վիճակի հետ -2: Նման միացությունները ներառում են ջրածնի սուլֆիդ եւ սուլֆիդներ `ջրածնի սուլֆիդի թթվի աղեր:
Ջրածին սուլֆիդը գազ է, փտած ձվի հոտով: Այն այրվում է օդում: Ավելին, թթվածնի պակասի եւ գերազանցման դեպքում այրումը այլ կերպ է ընթանում:
Թթվածնի ավելցուկում ջրածնի սուլֆիդը այրվում է ծծմբի օքսիդի (IV) եւ ջրի համար.
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Թթվածնի պակասի դեպքում ջրածնի սուլֆիդի ոչ լիարժեք այրումը տեղի է ունենում ծծմբի թողարկումով. 2H 2 S + O 2 = 2S + 2H 2 O.
Ջրածին սուլֆիդը շատ լուծելի է ջրի մեջ: Արդյունքում լուծումը թույլ ջրածնի սուլֆիդաթթու է: Ջրածին սուլֆիդային աղերը կոչվում են սուլֆիդներ: Հիդրֆֆուորիկ թթու եւ ջրային լուծվող սուլֆիդներ մտնում են փոխանակման ռեակցիաներ:
Հիդրոէներգետիկ սուլֆիդի թթու եւ պղնձի (II) քլորիդի փոխազդեցությունը լուծելի պղնձի (II) սուլֆիդի եւ հիդրոքլորիդային թթու է `H 2 S + CuCl 2 = CuS + 2HCl:
Երբ կալիումի սուլֆիդը համագործակցում է ցինկի նիտրատի հետ, ձեւավորվում է ցինկի սուլֆիդի եւ կալիումի նիտրատ `K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3:
Հղումներ
- Օրժեկովսկի Պ.Ա. Քիմիայի գծով առաջադրանքների եւ վարժությունների ժողովածու. 9-րդ դասարան, P.A. դասագիրք: Օզեկովսկին եւ ուրիշներ: Դասարան 9 / Պ.Ա. Օրժեկովսկի, Ն. Տիտով, Ֆ.Ֆ. Հեգել - Մ: ԱՍՏ. Աստրելի, 2007 թ. (Էջ 91-97)
- Օրժեկովսկի Պ.Ա. Քիմիա 9-րդ դասարան. ընդհանուր պատկերի համար: հաստատություն / P.A. Օրժեկովսկի, Լ.Մ. Մեշչերյակովա, Լ.Ս. Պոնտակ - Մ: ԱՍՏ. Աստրելի, 2007 թ. (§ 34)
- Օրժեկովսկի Պ.Ա. Քիմիա 9-րդ դասարան, ընդհանուրի ուսումնասիրություն: հաստատություն / P.A. Օրժեկովսկի, Լ.Մ. Մեշչերյակովա, Մ.Մ. Շալաշով. - M: Astrel, 2013. (§§ 20, 21)
- Ռուդզիտ Գ.Է. Քիմիա. Նեորգան: քիմիա Օրգան Քիմիա. Ուսումնասիրություններ: 9 լ. / Գ.Է. Ռուդզիտ, Ֆ.Գ. Ֆելդման. - Մ: Կրթությունը, Մոսկվայի «Դասագրքեր» ԲԲԸ, 2009 թ .:
- Խոմչենկո Ի.Դ. Միջնակարգ դպրոցում քիմիայի գծով առաջադրանքների եւ վարժությունների հավաքագրում: - M: RIA «Նոր ալիք». Հրատարակիչ Ումերենկով, 2008 թ.
- Հանրագիտարան երեխաների համար: Volume 17. Քիմիա / Գլուխ: ed. Վ.Ա. Վոլոդին, Վեդ. գիտական ed. I. Լենսոն. - Մ: Ավանթա +, 2003 թ.
- Թվային կրթական ռեսուրսների մեկ հավաքածու (թեմայի վերաբերյալ տեսանյութեր) ():
- «Քիմիա եւ կյանք» ամսագրի էլեկտրոնային տարբերակը ():
Տնային աշխատանք
- գ. 136 թիվ 3; p.140 №№ 2-4 դասագրքից P.A. Օրժեկովսկի "Քիմիա. 9-րդ դասարան" / Պ.Ա. Օրժեկովսկի, Լ.Մ. Մեշչերյակովա, Մ.Մ. Շալաշով. - Մ.: Աստրելի, 2013 թ .:
Սուլֆիդներ (ծծմբից, ծծմբից ծծմբից)
ծծմբային միացություններ, ավելի էլեկտրաէներգետիկ տարրերով; կարելի է համարել որպես ջրածնի սուլֆիդի թթվի աղեր (տես Ջրածին սուլֆիդի թթու) H 2 S: Գոյություն ունեն երկու C սերիա `M 2 S ընդհանուր բանաձեւի միջին (նորմալ) եւ MHS ընդհանուր բանաձեւի թթու (hydrosulfides), որտեղ M- ը միանվագ մետաղ է: C. ալկալիային մետաղները անգույն են, լուծելի են ջրի մեջ: Նրանց ջրային լուծումները բարձր հիդրոդլիզացված եւ ալկալային են: Հալած թթուների ազդեցության տակ թողարկվում է H 2 S. C. ալկալային հանքային մետաղները անգույն են, մի փոքր լուծվող ջրի մեջ: H 2 S- ն արտացոլվում է խոնավ օդի մեջ: Այլ հատկությունները նման են Ս. Թե այդ եւ թե մյուսները S. հեշտությամբ օքսիդացված են սուլֆատների համար: C. ծանր մետաղները գրեթե անլուծելի են ջրի մեջ: Նրանց գրեթե բոլորը սեւ կամ սեւ շագանակագույն են (բացառությամբ սպիտակ ZnS, pinkish MnS, դեղին CdS, նարնջագույն-կարմիր Sb 2 S 3, դեղին SnS 2): Քիմիական վերլուծության մեջ օգտագործվում է թթուների եւ C. ammonium- ի անհավասար հարաբերակցությունը: ԻԿ Մալինան:
Մեծ Սովետական հանրագիտարան: - Մ.: Խորհրդային հանրագիտարան. 1969-1978 .
Տեսեք, թե ինչ «Սուլֆիդս» են այլ բառարաններ:
Ծծմբի միացություններ մետաղների եւ որոշ ոչ մետաղների հետ: Մետաղական սուլֆիդներ են ջրածնի սուլֆիդային թթվից H2S- ի աղեր `միջին (օրինակ, Na2S) եւ acidic կամ hydrosulfides (NaHS): Ձուլելով բնական սուլֆիդները, ձեռք են բերվել գունավոր մետաղներ եւ SO2: Ֆոսֆորի սուլֆիդները եւ ... Մեծ հանրագիտարանային բառարան
Ժամանակակից հանրագիտարան
Սուլֆիդներ - SULFIDES, ծծմբի միացությունների անօրգանական սուլֆիդները մետաղների եւ որոշ ոչ մետաղների հետ: Ներառված են սուլֆիդ հանքաքարերի մեջ. օգտագործվում են որպես ֆոսֆորներ (օրինակ, CdS, ZnS): Մոլիբդենի սուլֆիդ, տիտանի կոշտ քսանյութեր: Ֆոսֆորի սուլֆիդները ... Illustrated հանրագիտարանային բառարան
- (նոր լատ., լատիներենից, ծծմբի ծծմբից): Որոշ մարմնի բաղադրիչներ ծծմբով, համապատասխան օքսիդների կամ թթուների: Ռուսերեն լեզվով օտար բառերի բառարան: Chudinov, AN, 1910. SULFIDES Novolatins, Lat. Ից: ծծումբ, ծծումբ: Միացման ... ... Ռուսաց լեզվի օտար բառերի բառարան
1. Մետաղների եւ որոշ ոչ մետաղների բնական ծծմբի միացություններ: Քիմիական նյութերում հարաբերությունները համարվում են որպես ջրածնի սուլֆիդային թթվային H2S- ի աղեր: Մի շարք տարրեր ձեւավորում են խառնուրդի պոլիուլֆիդներ, որոնք հանդիսանում են պոլի ծծմբաթթուի H2Sx աղեր: Հիմնական ... ... Երկրաբանական հանրագիտարան
Սուլֆիդներ - ծծմբային միացություններ մետաղների եւ որոշ ոչ մետաղների հետ; մետաղական սուլֆիդներ, ջրածնի սուլֆիդային թթվի H2S աղեր: [Բետոնային բառեր եւ երկաթբետոնե տերմինաբանական բառարան: FSUE "SIC" Construction "NIIZHB եւ A. A. Gvozdeva metro station, Մոսկվա, 2007. 110 p.] ... ... Շինանյութերի պայմանների, սահմանումների եւ բացատրությունների հանրագիտարան
SULPHES, s, u սուլֆիդ, ա, ամուսին (առանձնահատկություններ) Մետաղների եւ որոշ ոչ մետաղների հետ ծծմբի քիմիական միացություններ: Օրգանական է Բնական s. | | adj sulphide, oh, oh. Բառարան ozhegova Հայերէն. Ս.Ի. Օզեգովով, Նյու Յու. Շվեդով. 1949 թ. Բառարան ozhegova Հայերէն
Սուլֆիդները, R2S (R արոմատիկ արմատական), հեշտությամբ կարելի է ձեռք բերել կաթիլային դիազո աղերի լուծույթը մինչեւ 60 70 ... Բրոքհաուսի եւ Էֆրոնի հանրագիտարանը
SULFIDES- ը - (1) անօրգանական քիմիայի մեջ, ծծմբի տարրերի նման միացություններ, որոնցում ծծմբի ատոմները ունեն օքսիդացման վիճակ 2. Քիմիական նյութերում: հարաբերությունները համարվում են որպես թույլ ջրածնի սուլֆիդի թթու (H2S ջրային լուծույթ) աղեր: Շատերը Ս ... Մեծ պոլիտեխնիկական հանրագիտարան
Օհ; մ (միավոր սուլֆիդ, եւ մ): [սկսած լատ. ծծմբի ծծումբ] Քիմ. Ծծմբի միացություններ մետաղների եւ որոշ ոչ մետաղների հետ: C. տիտան. Օրգանական է Բնական s. (օգտակար հանածոների դաս): ◁ Sulfide, th, oh. Խառը խառնուրդներով: Հանքաքարից: * * * ծծմբային միացությունների սուլֆիդներ ... Հանրագիտարանային բառարան
- (լատինական ծծմբի ծծմբից) քիմիական միացությունների դասը, որոնք մետաղական միացություններ են (ինչպես նաեւ մի շարք ոչ մետաղներ B, Si, P, As), ծծմբի (S) հետ, որտեղ այն ունի օքսիդացման վիճակ -2: Կարելի է համարվել որպես ջրածնի սուլֆիդի աղ ... ... Wikipedia
Գրքեր
- Ֆրաներոզոիկի, Անդրեյ Բորիսովիչ Խալեզովի անհամաձայնության տեսակի ուրանի հանքավայրերը: Ուրալյան տարածաշրջանի երեք շրջանների օրինակով դիտարկվում են ուրանի հանքավայրերի կառուցվածքներում կառուցվող կառուցվածքային եւ stratigraphic անհամաձայնության մակերեւույթներում գետի պալեօղի կառուցվածքների առանձնահատկությունները ...
Ծծումբ - 3-րդ շրջանի տարրը եւ պարբերական համակարգի VIA խումբը, սերիական թիվ 16, վերաբերում է քալկոգեններ: Ատոմի էլեկտրոնային բանաձեւը [10 Ne] 3s 2 3p 4, բնութագրական օքսիդացման վիճակներ 0, -II, + IV եւ + VI, պետությունը S VI համարվում է կայուն:
Ծծմբի օքսիդացման մասշտաբ:
Ծծմբի էլեկտրաեգատիվությունը 2.60 է, այն բնորոշվում է ոչ մետաղական հատկություններով: Ջրածնի եւ թթվածնի միացությունների մեջ այն պարունակում է տարբեր անիոններ, այն կազմում է թթվածին պարունակող թթուներ եւ դրանց աղեր, երկուական միացություններ:
Բնության մեջ ` տասնհինգերորդը քիմիական տարածման տարրը (ոչ մետաղների յոթերորդ մասը): Այն հայտնաբերված է ազատ (հայրենի) եւ հարակից ձեւով: Ավելի բարձր օրգանիզմների կենսական տարր:
Սուլֆուր Ս. Պարզ նյութ: Բյուրեղային դեղին (α-rhombic եւ β-monoclinic,
95.5 ° C) կամ ամորֆ (պլաստիկ): Գեղարվեստի վայրերում կան S8 մոլեկուլներ (ոչ պլանային «կորոնա» տիպի ցիկլեր), ամորֆ ծծումբը բաղկացած է S n շղթաներից: Հանգիստ հալեցնող նյութ, հեղուկի խառնուրդն անցնում է առավելագույնը 200 ° C- ի սահմաններում (S 8 մոլեկուլների բացը, S n- ի շղթաների փոխանակումը): Մի զույգ - S 8, S 6, S 4, S 2 մոլեկուլները: 1500 ° C- ում մոնատոմիկ ծծումբ է հայտնվում (քիմիական հավասարումների համար պարզության համար, ցանկացած ծծումբը ներկայացված է S):
Ծծումբը ջրի մեջ չի լուծվում եւ նորմալ պայմաններում չի արձագանքում դրա հետ, այն լավ լուծելի է ածխածնի դիսֆիդիֆում CS 2:
Ծծումբը, հատկապես փոշոտ, ունի բարձր ակտիվություն, երբ ջեռուցվում է: Reacts որպես օքսիդացող նյութ մետաղների եւ ոչ մետաղների հետ:
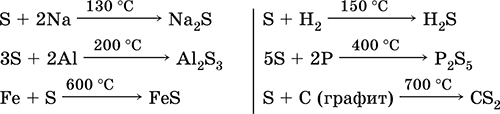
ինչ վերաբերում է նվազեցնող գործակալ - ֆտորինի, թթվածնի եւ թթուների հետ (երբ եռացող).
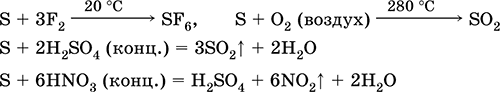
Ծծումբը ենթարկվում է ալկալիների լուծույթների դիմանալու:
3S 0 + 6KOH (համակ.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
Բարձր ջերմաստիճանով (400 ° C) ծծմբի մեջ ջրոդը ջրի հոդից տեղափոխում է յոդ:
S + 2НI (g) = I 2 + H 2 S,
բայց լուծման մեջ արձագանքը հակառակ ձեւով է ընթանում.
I 2 + H 2 S (p) = 2 HI + S ↓
Ստանալովին արդյունաբերություն ածխի գազիֆիկացման արտադրանքի ծծմբի աղտոտման ժամանակ արձակված ծագած ծծմբի բնական հանքերից (ջրի գոլորշի օգտագործմամբ) smelted.
Սուլֆուրը օգտագործվում է ածխածնի դդուլֆիդի, ծծմբաթթուի, սուլֆրուկի (կաթի) ներկերի սինթեզավորման համար `ռետինե խոցելիության մեջ, որպես բորբոքումների փոշու բորբոսից պաշտպանելու եւ մաշկի հիվանդությունների բուժման միջոց:
Ջրածին սուլֆիդ H 2 S. Թթվածնի ազատ թթու: Անգույն գազ, որը ցնցող հոտով է, ավելի ծանր է օդից: Մոլեկուլը կրկնակի անբավարար tetrahedron կառուցվածքն է [:: S (H) 2]
(sp 3 - հիբրիդացում, H - S - H կցորդի անկյունը հեռու է tetrahedral): Անկայուն, երբ 400 ° C ջեռուցվում է: Այն ջրի մի փոքր լուծելի է (2.6 լ / 1 լ H 2 O 20 ° C), հագեցած լուծույթն է տասնորդյակ (0.1 M, «ջրածնի ջրածնի ջուր»): Շատ թույլ թթու լուծույթում գործնականում երկրորդ փուլի մեջ չի հայտնվում S 2- իոնների (S 2 -1 առավելագույն կոնցենտրացիան հավասար է 1 10 -13 մոլ / լ): Օդի մեջ կանգնած ժամանակ լուծումը դառնում է ամպամած (արգելիչ - սահրոսկա): Այն չեզոքացվում է ալկալիների կողմից, ոչ թե ամբողջությամբ `ամոնիակ հիդրատով: Ուժեղ կրճատող գործակալ: Այն ներառում է ion փոխանակման ռեակցիաները: Սուլֆիդիդացող նյութը, ցրված է տարբեր գունավոր սուլֆիդների լուծույթից, որոնք շատ ցածր լուծելի են:
Որակական ռեակցիաները - սուլֆիդների նստվածքավորում, ինչպես նաեւ H 2 S- ի թերի այրումը, բոցավառվող սառը օբյեկտի վրա դեղին ծծմբի հանքավայրի ձեւավորման հետ (ճենապակյա սպաթուլա): Նավթային, բնական եւ կոկոլային վառարանով գազի արտանետման արտադրանք:
Այն օգտագործվում է ծծմբի, անօրգանական եւ օրգանական ծծմբի պարունակող միացությունների արտադրության մեջ որպես վերլուծական ռեագենտ: Չափազանց թունավոր: Ամենակարեւոր ռեակցիաների հավասարումները.
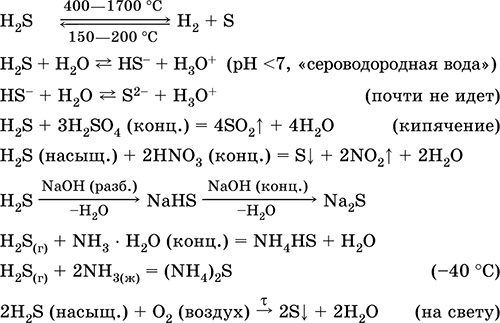

Ստանալովին արդյունաբերություն - ուղղակի սինթեզ:
H 2 + S = Հ 2 Ս(150-200 ° C)
կամ պարաֆինով ծծմբի ջեռուցման միջոցով.
ին լաբորատորիաներ - ուժեղ թթուներով սուլֆիդների տեղաշարժը
FeS + 2NCl (կոնց.) = FeCl 2 + Հ 2 Ս
կամ երկուական միացությունների ամբողջական հիդրոիզացում.
Ալ 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 Հ 2 Ս
Նատրիումի սուլֆիդ Na2S: Թթվածին ազատ աղ: Սպիտակ, շատ higgroscopic. Հալվածք `առանց տարրալուծման, ջերմային կայուն: Այն լավ լուծելի է ջրի մեջ, որը հիդրոգլիոլով է հոսում, ստեղծում է լուծույթում բարձր ալկալային միջավայր: Օդի մեջ կանգնած ժամանակ լուծումը դառնում է ամպամած (կոլոիդային ծծումբ) եւ վերածվում է դեղին (polysulfide ներկ): Տիպիկ նվազեցնող նյութ: Կցվում է ծծումբ: Այն ներառում է ion փոխանակման ռեակցիաները:
Որակական ռեակցիաները ion S 2- ի վրա `տարբեր գունավոր մետաղական սուլֆիդների տեղադրումը, որոնցից MnS, FeS, ZnS- ը decomposed into HCl (s):
Այն օգտագործվում է ծծմբի ներկերի եւ ցելյուլոզայի արտադրության մեջ, կաշվի օծանելիքի ժամանակ մաքրող մազերի հեռացման համար, որպես վերլուծական քիմիայի ռեագենտ:
Ամենակարեւոր ռեակցիաների հավասարումները.
Na 2 S + 2NCl (dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (կոնց.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (մինչեւ 50 ° C)
Na 2 S + 4HNO 3 (կոնց.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (նստած) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (400 ° C- ից բարձր)
Na 2 S + 4H 2 O 2 (կոնց.) = Na 2 SO 4 + 4H 2 O
S 2- + M 2+ = MnS (մարմնական) ↓; FeS (սեւ) ↓; ZnS (սպիտակ) ↓
S 2- + 2Ag + = Ag 2 S (սեւ) ↓
S 2- + M 2+ = CdS (դեղին) ↓; PbS, CuS, HgS (սեւ) ↓
3S 2- + 2Bi 3+ = Bi 2 S 3 (Corr. - սեւ) ↓
3S 2- + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Ստանալով ին արդյունաբերություն - հանքանյութի կալինացում mirabilite Na 2 SO 4 10H 2 O նվազեցնող նյութերի առկայության դեպքում.
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, cat Fe 2 O 3)
Na 2 SO 4 + 4C (կոկա) = Na 2 S + 4CO (800-1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600-700 ° C)
Ալյումինի սուլֆիդ Al 2 S 3. Թթվածին ազատ աղ: Սպիտակ, Ալ - Ս պարտատոմսը հիմնականում գագաթնակետ է: Այն հալեցնում է առանց N2- ի ավելորդ ճնշման տակ տարրալուծման, այն հեշտ sublimated. Այն օքսիդացված է օդում, երբ կեղեւվում է: Լիովին հիդրոգլիոլացված ջրով, չի լուծվում լուծումներից: Ձգվող թթուներով: Այն օգտագործվում է որպես մաքուր ջրածնի սուլֆիդի ամուր աղբյուր: Ամենակարեւոր ռեակցիաների հավասարումները.
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (մաքուր)
Al 2 S 3 + 6NCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (կոնց.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (օդ) = 2Al 2 O 3 + 6SO 2 (700-800 ° C)
Ստանալովթթվածնի եւ խոնավության բացակայության դեպքում ալյումինի փոխազդեցությունը մուլացված ծծմբի հետ.
2Al + 3S = AL 2 S 3(150-200 ° C)
Iron (II) սուլֆիդ FeS. Թթվածին ազատ աղ: Սեւ եւ մոխրագույն կանաչ տոնով, հալածող, քայքայվում է, երբ վակուումում ջեռուցվում է: Թաց վիճակում օդում թթվածին զգայուն է: Ջրի մեջ չլուծված: Չի թունավորվում ջրածնի սուլֆիդով երկաթի (II) աղերի լուծույթների հագեցման վրա: Քայքայված թթուներով: Այն օգտագործվում է որպես հումք, երկաթի արտադրության մեջ, կոշտ ջրածնի սուլֆիդի աղբյուր:
Fe 2 S 3- ի երկաթի (III) կազմի բարդույթը հայտնի չէ (ստացված չէ):
Ամենակարեւոր ռեակցիաների հավասարումները.
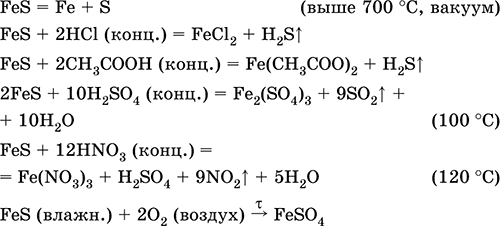
Ստանալով `
Fe + S = Ֆես (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 Ֆես + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = Ֆես ↓ + 2NH 4 Cl + H 2 Ս
Iron disulfide FeS 2: Երկուական կապ. Այն ունի Fe 2+ ի-ի (-S-S-) 2 իոնային կառուցվածքը: Մուգ դեղին, ջերմային կայուն է, տատանումների վրա: Ջրի մեջ չլուծվողը չի արձագանքում զտված թթուների, ալկալների հետ: Այն քայքայվում է օդում աղացած թթու-օքսիդացող նյութերով: Այն օգտագործվում է որպես հումք, երկաթի, ծծմբի եւ ծծմբաթթվի արտադրության մեջ, օրգանական սինթեզի կատալիզատոր: Բնության մեջ `հանքային հանքանյութեր պիրիտ եւ մարկասիտ:
Ամենակարեւոր ռեակցիաների հավասարումները.
FeS 2 = FeS + S (1170 ° C- ից բարձր, վակուում)
2FeS 2 + 14H 2 SO 4 (կոնց., Լեռներ) = Fe 2 (SO 4) 3 + 15SO 2 + 14Ն 2 Օ
FeS 2 + 18HNO 3 (կոնց.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (օդային) = 8SO 2 + 2Fe 2 O 3 (800 ° C, roasting)
Ammonium hydrosulfide NH 4 HS: Թթվածին ազատ թթու աղ: Սպիտակ, ճնշման տակ հալված: Չափազանց ցնդող, ջերմային անկայուն: Այն օքսիդացնում է օդում: Այն լավ լուծելի է ջրի մեջ, որը հիդրոօքսիդով եւ կատիոնով հենվում է (գերակայում է), ստեղծում է ալկալային միջավայր: Լուծումը օդում վերածվում է դեղին: Այն քայքայվում է թթուներով, հագեցած լուծույթում ավելացնում է ծծումբ: Ալկալիները չեզոքացվում են, լուծույթում չկա միջին աղը (NH 4) 2 S (միջին աղի ստացման պայմանների համար տես «H 2 S» վերնագիր): Այն օգտագործվում է որպես լուսանկարչական մշակողների բաղադրիչ, որպես անալիտիկ ռեագենտ (sulphide precipitator):
Ամենակարեւոր ռեակցիաների հավասարումները.
NH 4 HS = NH 3 + H 2 S (բարձր 20 ° C)
NH 4 HS + HCl (որոշում) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (համ.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (նստած H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
ՍտանալովNH3- ի կոնցենտրացված լուծույթի հագեցում, ջրածնի սուլֆիդի հետ.
NH 3 H 2 O (համ.) + H 2 S (g) = NH 4 HS- ը + H 2 O
Վերլուծական քիմիայի մեջ հավասար քանակությամբ NH 4 HS եւ NH 3 H 2 O պարունակող լուծույթը սովորաբար համարվում է (NH 4) 2 S- ի լուծույթ եւ միջին աղի բանաձեւը օգտագործվում է ռեակցիայի հավասարումների գրելու համար, թեեւ ամոնիումի սուլֆիդն ամբողջությամբ հիդրոդլված է ջրի NH 4 HS եւ NH 3 Հ 2 Օ.
Ծծմբի երկօքսիդը: Սուլֆիտներ
Ծծմբի երկօքսիդ SO 2: Թթվային օքսիդ: Անգույն գազ `խիստ հոտով: Մոլեկուլն ունի անավարտ եռանկյունի կառուցվածքը [S (O) 2] (sp 2 - հիբրիդիզացիա), պարունակում է σ, π - պարտատոմսեր S = O: Հեշտորեն հեղուկացված, ջերմային կայուն: Այն լուծելի է ջրում (~ 40 լ / 1 լ H 2 O 20 ° C): Ստեղծում է պոլիհրատա `թույլ թթվային հատկություններով, լուծույթի արտադրանք` HSO 3 եւ SO 3 2- իոններով: Ion HSO 3-ը ունի երկու tautomeric ձեւեր, սիմետրիկ (ոչ-acidic), tetrahedron կառուցվածքի հետ (sp 3 - hybridization), որը գերակշռում է խառնուրդում, եւ ասիմետրիկ (acidic) `անբավարար tetrahedron [[S (O) 2 (OH)] կառուցվածքի հետ (sp 3 - հիբրիդացում): Իոն SO 3 2-ը նաեւ tetrahedral [: S (O) 3].
Reacts հետ alkalis, ամոնիակ hydrate. Տիպիկ նվազեցնող նյութ, թույլ օքսիդացող նյութ:
Որակական արձագանքը - դեղնավուն շագանակագույն «յոդի ջրի» գունաթափում: Intermediate է sulfites եւ ծծմբաթթու արտադրության.
Այն օգտագործվում է բրդի, մետաքսի եւ ծղոտե հացահատիկի, մրգերի պահպանման եւ պահպանման համար, որպես ախտահանիչ, հակաօքսիդիչ, հովացուցիչ նյութ: Թունավոր:
Հ 2 SO 3 բաղադրիչը (ծծմբային թթու) հայտնի չէ (գոյություն չունի):
Ամենակարեւոր ռեակցիաների հավասարումները.
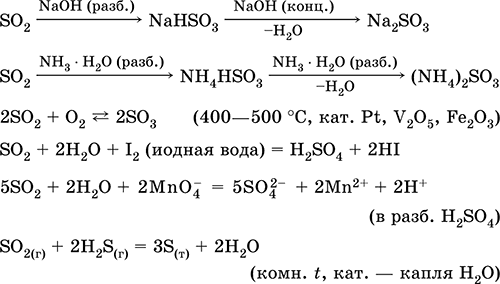
Ջրի լուծույթում եւ թթվային հատկություններով.
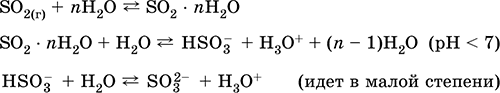
Ստանալովարդյունաբերությունում `թթվածնի օքսիդով օժտված օդում ծծմբի այրումը, իսկ ավելի փոքր չափով` սուլֆիդ հանքաքարի խտացումը (SO 2-ը `գազի պղնձի քաղցկեղի ժամանակ):
S + O 2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, աղացած)
լաբորատորիայում `ծծմբաթթվի հետ սուլֆիտների տեղաշարժը.
BaSO 3 (t) + H 2 SO 4 (համակ.) = BaSO 4 ↓ + SO 2 + H 2 O
Նատրիումի սուլֆիտ Na2 SO 3: Սալին Սպիտակ Օդի մեջ ջերմացվում է առանց հալման, զիջում է արգոնյան ճնշման տակ: Թաց վիճակում եւ օդի մեջ թթվածին զգայուն լուծման մեջ: Այն լուծելի է ջրի մեջ, որը hydionised by anion. Քայքայված թթուներով: Տիպիկ նվազեցնող նյութ:
Որակական արձագանքը ion SO 3 2-ում `բարիումի սուլֆիտի սպիտակ աղբի ձեւավորումը, որը ուժեղ թթուներով (HCl, HNO 3) տեղափոխվում է լուծույթ:
Այն օգտագործվում է որպես վերլուծական քիմիայի ռեագենտ, լուսանկարչական լուծումների բաղադրիչ, գործվածքների սպիտակեցում քլորի չեզոքացուցիչ:
Ամենակարեւոր ռեակցիաների հավասարումները.
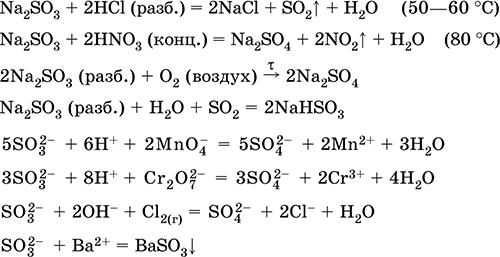
Ստանալով `
Na 2 CO 3 (համ.) + SO 2 = Na 2 SO 3 + CO 2
Ծծմբաթթու: Սուլֆատներ
Sulfuric acid H 2 SO 4: Oxoic թթու: Անգույն հեղուկ, շատ խիտ (յուղոտ), շատ higgroscopic: Մոլեկուլը ունի աղավաղված տետային եռանկյունաձեւ կառուցվածք (sp 3 gib hybridization), պարունակում է covalent σ - պարտատոմսեր S - OH եւ σπ - պարտատոմսեր S = O: Իոն SO4 2- ը ունի ճիշտ - tetrahedral կառուցվածքը: Այն ունի հեղուկ վիճակի լայն ջերմաստիճան (~ 300 աստիճան): Երբ 296 ° C- ից բարձր ջերմություն է նկատվում, դա մասամբ կլանում է: Այն թորված է ջրի հետ azeotropic խառնուրդ (թթվի զանգվածային մասնաբաժինը 98.3%, եռման կետ 296-340 ° C), ամբողջությամբ decomposes հետ ուժեղ ջեռուցման. Անսահմանափակ խառնուրդներ ջրի հետ (ուժեղ exo-Եփեք): Ամրացվում է հզոր լուծույթով, չեզոքացվում է ալկալիների եւ ամոնիակի հիդրատով: Մետաղները սուլֆատներին փոխակերպում են (սովորական պայմաններում ավելցուկային կենտրոնացված թթվի ավելացումով, ձեւավորվում են լուծվող հիդրոֆիլդիտներ), սակայն Be, Bi, Co, Fe, Mg եւ Nb մետաղները պասիվացնում են կենտրոնացված թթու մեջ եւ չեն արձագանքում դրա հետ: Reacts հիմնական օքսիդների եւ հիդրօքսիդների, deciposes թթու թթուների աղեր: Թեթեւ օքսիդացնող մի լուծվող լուծույթով (H I- ի շնորհիվ), ուժեղ `կենտրոնացված լուծույթով (S VI- ի շնորհիվ): Լավ լուծում է SO 3-ը եւ արձագանքում դրա հետ (ծանր յուղային հեղուկ է ձեւավորվում, օլում պարունակում է H 2 S 2 O 7):
Որակական արձագանքը SO 4-ի 2- իոնում `BaSO 4 սպիտակ բարիումի սուլֆատի տեղակայումը (չաղացումը չի փոխակերպվում հիդրոքլորի եւ ազոտաթթուների լուծույթին, ի տարբերություն BaSO 3-ի սպիտակ աղբի):
Այն օգտագործվում է սուլֆատների եւ այլ ծծմբային միացությունների, հանքային պարարտանյութերի, պայթուցիկ նյութերի, ներկերի եւ թմրանյութերի արտադրության մեջ, օրգանական սինթեզի մեջ, արդյունաբերական նշանակության հանքաքարերի եւ հանքանյութերի բացման համար, նավթամթերքի մշակում, ջրի էլեկտրոլիզացում, որպես էլեկտրական լարման մարտկոցներ . Թունավոր, առաջացնում է մաշկի այրվածքներ: Ամենակարեւոր ռեակցիաների հավասարումները.
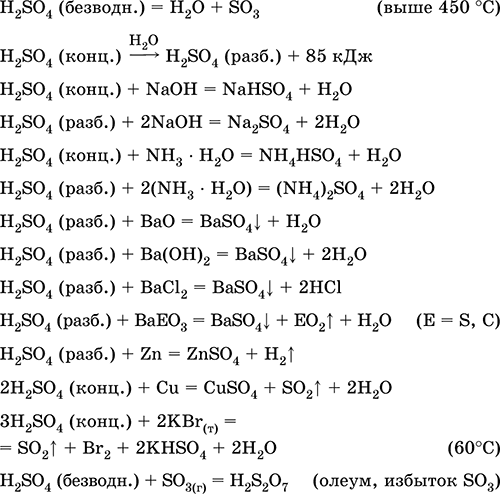
Ստանալով ին արդյունաբերություն:
ա) SO 2 սինթեզը ծծմբի, սուլֆիդ հանքաքարի, ջրածնի սուլֆիդի եւ սուլֆատային հանքաքարերից.
S + O 2 (օդ) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (air) = 8 SO 2 + 2 Fe 2 O 3 (800 ° C, խորոված)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 ° C)
CaSO 4 + С (կոկա) = CaO + SO 2 + CO (1300-1500 ° C)
բ) շփման ապարատի մեջ SO2-SO3- ի փոխակերպումը.
գ) խտացված եւ անջուր ծծմբաթթվի սինթեզ:
H 2 O (Coll H 2 SO 4) + SO 3 = H 2 SO 4(համանախագահ, անհանգիստ):
(Հ 2 SO 4-ի մաքուր ջրով SO 3-ի կլանումը չի կատարվում խառնուրդի հզոր ջեռուցման եւ Հ 2 SO 4-ի հակառակ տարաձայնությունների պատճառով, տես վերը);
դ) սինթեզ օլում - խառնուրդ H 2 SO 4, disaric acid H 2 S 2 O 7 եւ ավելցուկ SO 3: Հալված SO 3- ը ապահովում է oleum waterlessness- ը (H 2 SO 4 անմիջապես ձեւավորվում է ջրի մեջ), ինչը թույլ է տալիս անվտանգ տեղափոխել պողպատե տանկ:
Նատրիումի սուլֆատ Na2 SO 4: Սալին Սպիտակ, hygroscopic. Մեղիկներ եւ եռում են առանց տարրալուծման: Ձեւավորվում է բյուրեղային հիդրատ (հանքային mirabilite) հեշտությամբ կորցնում ջուրը; տեխնիկական անունը Գլաուբի աղը: Այն լուծելի է ջրի մեջ, այլ ոչ թե hydrolyzed: Reacts հետ H 2 SO 4 (conc.), SO 3. Վերականգնվել է ջրածնի, կոկոլային ջեռուցման ժամանակ: Այն ներառում է ion փոխանակման ռեակցիաները:
Այն օգտագործվում է ապակու, բջջանյութի եւ հանքային ներկերի արտադրության մեջ `որպես դեղամիջոց: Ապահովված է աղի լճերում, մասնավորապես `Կասպից ծովի Կարա-Բոգազ-Գոլի ծոցում:
Ամենակարեւոր ռեակցիաների հավասարումները.
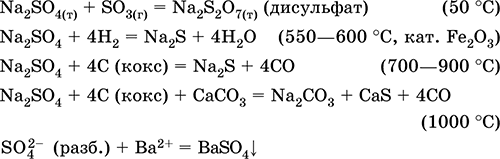
Կալիումի հիդրոուլֆատ KHSO 4: Աղի օքոլի աղը: Սպիտակ, hygroscopic, բայց չի ձեւավորում բյուրեղային hydrates. Երբ ջեռուցվում է հալեցնում եւ քայքայվում: Այն լավ լուծելի է ջրային համակարգում, որին միանում է լուծույթի լուծույթը, լուծման միջոցը խիստ թթու է: Այն չեզոքացվում է ալկալիների կողմից:
Այն օգտագործվում է որպես մետաղագործության հոսքերի բաղադրիչ, հանքային պարարտանյութերի անբաժանելի մասը:
Ամենակարեւոր ռեակցիաների հավասարումները.
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (մինչեւ 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 ° C)
KHSO 4 (լեզու) + KOH (կոնց.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450-700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
Ստանալով: կալիումի սուլֆատի բուժումը սառը (ավելի քան 6O%) ծծմբաթթու
K 2 SO 4 + H 2 SO 4 (համ:) = 2 KHSO 4
Կալցիումի սուլֆատ CaSO 4: Սալին Սպիտակ, շատ higgroscopic, հուսահատ, decomposes երբ calcined. Բնական CaSO 4-ը հայտնաբերվում է շատ տարածված հանքային տեսքով գիպս CaSO 4 2H 2 O. 130 ° C- ում գիպսը կորցնում է որոշակի ջուր եւ գնում այրված գիպս2CaSO 4 H 2 O (տեխնիկական անուն ալաբաստեռ): Ամբողջովին ջրազրկված (200 ° C) գիպսը պատասխանում է հանքին անհիդիտրCaSO 4. Այն ջրի մի փոքր լուծելի է (0.206 գ / 100 գ H 2 O 20 ° C), ջերմաստիճանում նվազում է լուծունակությունը: Reacts հետ H 2 SO 4 (համաձուլվածք). Վերականգնվում է կույտով միաձուլման ժամանակ: Սահմանում է քաղցրահամ ջրի «մշտական» կարծրության մեծ մասը (մանրամասն մանրամասների համար տես 9.2):
Ամենակարեւոր ռեակցիաների հավասարումները `100-128 ° C
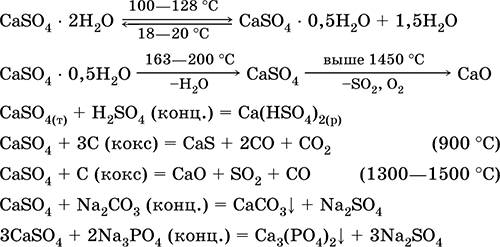
Այն օգտագործվում է որպես SO 2, H 2 SO 4 եւ (NH 4) 2 SO 4 արտադրության հումք, որպես մետաղագործության հոսք, թղթի լցահարթիչ: Հղի հավկիթը պատրաստված այրված գիպսից պատրաստված «սարքերից» ավելի արագ է, քան Ca (OH) 2 հիման վրա խառնուրդը: Կերտումն ապահովում է ջրի միացումը, գիպսի ձեւավորումը քարի զանգվածի տեսքով: Այրված գիպսը օգտագործվում է գիպսային քարեր, ճարտարապետական եւ դեկորատիվ ձեւեր եւ ապրանքներ, միջնորմ պատերի եւ վահանակների եւ քարե հատակների համար:
Ալյումինի կալիումի սուլֆատ KAl (SO 4) 2: Կրկնակի օշարակ աղ: Սպիտակ, hygroscopic. Հզոր ջերմությամբ տատանվում է: Բյուրեղային հիդրատ - կալիումի կալիումի գդալ: Միջին չափով լուծելի է ջրի մեջ, որը հիդրոգլիտն է ալյումինի կաթի միջոցով: Reacts հետ alkalis, ամոնիակ hydrate.
Այն օգտագործվում է որպես մորթտ, ներկերի ներկման, կաշվե կոմբինատը, քաղցրահամ ջրի մաքրման կոագուլենտը, թղթի չափման բաղադրիչների բաղադրիչը եւ բժշկության եւ կոսմետոլոգիայի արտաքին հեմոստատիկ նյութը: Այն ձեւավորվում է ալյումինի եւ կալիումի սուլֆատի միասնական բյուրեղացումով:
Ամենակարեւոր ռեակցիաների հավասարումները.
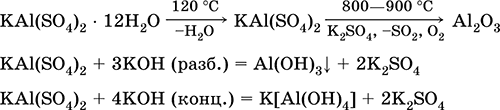
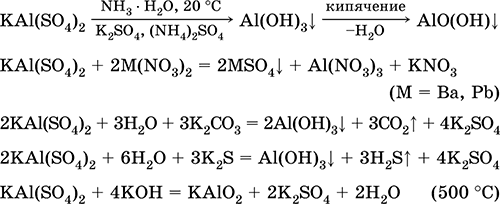
Chromium (III) սուլֆատ - կալիումի KCr (SO 4) 2: Կրկնակի օշարակ աղ: Կարմիր (մուգ մանուշակագույն հիդրատ, տեխնիկական անուն կալիումի սինուս): Երբ ջեռուցվում է տատանումները առանց հալման: Այն հեշտությամբ լուծելի է ջրի մեջ (լուծույթի մոխրագույն կապույտ գույնը համապատասխանում է aquacomplex 3+), այն հիդրոօքսիդ է քրոմի (III) կատիոնի կողմից: Reacts հետ alkalis, ամոնիակ hydrate. Թեթեւ օքսիդացնող եւ նվազեցնող նյութ: Այն ներառում է ion փոխանակման ռեակցիաները:
Որակական ռեակցիաները Cr 3+ իոն - կրճատման Cr2 + կամ օքսիդացում մինչեւ դեղին CrO 4 2-
Այն օգտագործվում է որպես կաշվե նյութի ներծծող նյութ, ներկերի ներկում մորթթ, լուսանկարում ռեագենտ: Այն ձեւավորվում է քրոմի (III) եւ կալիումի սուլֆատների միասնական բյուրեղացումով: Ամենակարեւոր ռեակցիաների հավասարումները.
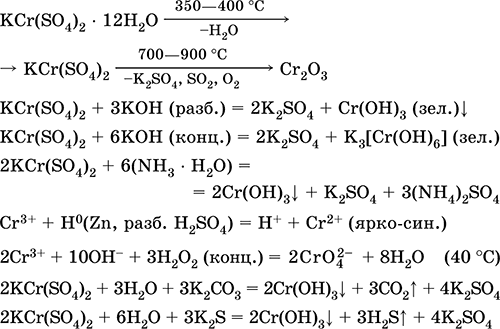
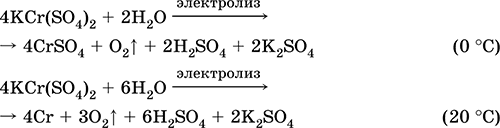
Մանգան (II) սուլֆատ MnSO 4. Սալին Սպիտակ, երբ կեղտոտվում է, հալեցնում եւ քայքայվում: Բյուրեղային հիդրավլիկ MnSO 4 5H 2 O - կարմիր - վարդագույն, տեխնիկական անուն մանգանի ցիկլուալ: Այն լուծելի է ջրի մեջ, լուծակի բաց վարդագույն (գրեթե անգույն) գույնը համապատասխանում է aquacomplex 2+; հիդրոօքսիդի կողմից: Reacts հետ alkalis, ամոնիակ hydrate. Թույլ կրճատող նյութը արձագանքում է բնորոշ (ուժեղ) օքսիդացող նյութերի հետ:
Որակական ռեակցիաները Mn 2+ իոնին `MnO 4 իոնով փոխանցում եւ վերջինիս մանուշակագույն գույնի անհետացում, Mn 2+- ի օքսիդացում MnO 4 եւ մանուշակագույն գույնի տեսք:
Այն օգտագործվում է ձեռք բերելու Mn, MnO 2 եւ մանգանի այլ միացություններ, որպես միկրոշրջանի եւ վերլուծական ռեագենտ:
Ամենակարեւոր ռեակցիաների հավասարումները.
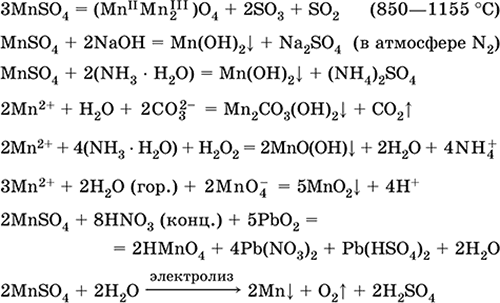
Ստանալով `
2MnO 2 + 2H 2 SO 4 (համ.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Iron (II) սուլֆատ FeSO 4: Սալին Սպիտակ (խավար գունավոր կանաչ, տեխնիկական անուն երկաթի ցիտուրոլ),hygroscopic. Այն տատանում է, երբ ջեռուցվում է: Այն լուծելի է ջրի մեջ, փոքր չափով, որը hydlyzed է cation. Այն արագորեն օքսիդացված է օդի մեջ թթվածնի լուծույթում (լուծումը վերածվում է դեղին եւ դառնում ամպամած): Reacts է թթու-օքսիդացող նյութերի, alkalis, ammonia hydrate. Տիպիկ նվազեցնող նյութ:
Այն օգտագործվում է որպես հանքային ներկերի բաղադրիչ, էլեկտրոլիտներ, էլեկտրոլլաստներ, փայտային կոնսերվանտներ, ֆունգիցիդներ, հակամարմիններ: Լաբորատորիայում, ավելի հաճախ, այն ընդունվում է որպես կրկնակի աղ Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( աղի մորա) ավելի դիմացկուն օդով:
Ամենակարեւոր ռեակցիաների հավասարումները.
![]()
Ստանալով `
Fe + H 2 SO 4 (որոշում) = FeSO 4+ Հ 2
FeCO 3 + H 2 SO 4 (պար.) = FeSO 4 + CO 2 + H 2 O
7.4. VA- խմբի ոչ մետաղներ
Ազոտ Ամոնիակ
Ազոտ - 2-րդ շրջանի տարրը եւ պարբերական համակարգի VA-խումբը, սերիան թիվ 7. Ատոմային էլեկտրոնի բանաձեւը [2 He] 2s 2 2p 3, բնութագրական օքսիդացման վիճակներ 0, -III, + III եւ + V, պակաս հաճախ + II, + IV եւ մյուսները; N v պետությունը համարվում է համեմատաբար կայուն:
Ազոտի օքսիդացման մասշտաբ:
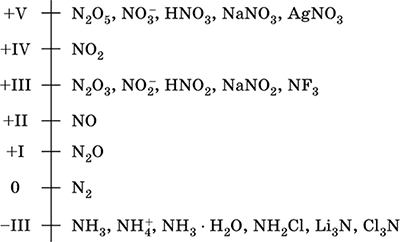
Ազոտը ունի բարձր էլեկտրայգեգատություն (3.07), երրորդը, F եւ O- ից հետո: Ցուցադրվում է բնորոշ ոչ մետալիկ (թթվային) հատկություններ: Forms տարբեր թթվածնի պարունակող թթուներ, աղեր եւ երկուական միացություններ, ինչպես նաեւ ամոնիումի NH 4 + եւ դրա աղեր:
Բնության մեջ ` տասնյոթերորդը քիմիական տարածման տարրը (ոչ մետաղների մեջ իններորդը): Կենսական տարր բոլոր օրգանիզմների համար:
Ազոտ N 2: Պարզ նյութ: Այն բաղկացած է ոչ բեւեռային մոլեկուլներից `շատ կայուն σππ - կապ N ≡ N, ինչը բացատրվում է նորմալ պայմաններում ազոտի քիմիական անդեմ: Անգույն, անուշless գազ, որը condensing մեջ անգույն հեղուկ (ի տարբերություն O 2).
Օդի հիմնական բաղադրիչը `78.09%, ծավալի 75.52%: Հեղուկ օդի միջոցով ազոտը եռում է O 2 թթվի վրա: Այն ջրի մի փոքր լուծելի է (15.4 մլ / 1 լ H 2 O 20 ° C), ազոտի լուծույթն ավելի քիչ է, քան թթվածինը:
Սենյակային ջերմաստիճանում N 2- ը արձագանքում է միայն լիտիումով (խոնավ մթնոլորտում), ձեւավորելով lithium nitride Li 3 N, այլ տարրերի նիտրիտներ `
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
Էլեկտրական լիցքաթափման ժամանակ N 2- ը ֆտորինով եւ շատ փոքր չափով արձագանքում է թթվածինով.
Ամոնիակ արտադրելու համար հակադարձ ռեակցիան տեղի է ունենում 500 ° C- ում, մինչեւ 350 ատոմի ճնշման տակ եւ պարտադիր է կատալիզատորի (Fe / F 2 O 3 / FeO, Pt լաբորատորիա) ներկայությամբ:
Le Chatelier- ի համաձայն, ամոնիակի բերքատվության բարձրացումը պետք է տեղի ունենա ճնշման բարձրացման եւ ջերմաստիճանի նվազման հետ: Այնուամենայնիվ, ցածր ջերմաստիճանների ռեակցիաները շատ ցածր են, հետեւաբար գործընթացը կատարվում է 450-500 ° C, հասնելով 15% ամոնիակի հասույթի: Չբացահայտված N 2 եւ H 2 վերադարձը ռեակտորին եւ դրանով իսկ բարձրացնում է ռեակցիայի աստիճանը:
Ազոտը քիմիապես պասիվ է թթուների եւ ալկալների նկատմամբ, չի օգնում այրումը:
Ստանալով ին արդյունաբերություն - հեղուկ օդի խմբաքանակային տարանջատումը կամ օդից թթվածնի հեռացումը քիմիական միջոցներով, օրինակ `2C (կոկա) + O 2 = 2CO- ի ջերմության միջոցով: Այդ դեպքերում արտադրվում է ազոտ, որը նույնպես պարունակում է ազնիվ գազերի խառնուրդներ (հիմնականում արգոն):
Ի լաբորատորիաներ քիմիապես մաքուր ազոտի փոքր քանակությունները կարելի է ձեռք բերել միջին ջեռուցման հետ համակցված արձագանքով.
N -III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60-70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
Այն օգտագործվում է ամոնիակի, ազոտաթթվի եւ այլ ազոտի պարունակող նյութերի սինթեզի համար, որպես քիմիական եւ մետալուրգիական գործընթացների աներեւակայելի միջավայր եւ այրվող նյութերի պահպանում:
Ամոնիակ NH 3: Երկուական բարդ, ազոտի օքսիդացման աստիճանը `III: Անգույն գազ `սուր բնորոշ հոտով: Մոլեկուլը ունի անբավարար tetrahedron [N (H) 3)] (sp 3 gib-hybridization) կառուցվածքը: Էլեկտրական դոնորների զույգի NH 3 մոլեկուլում ազոտի առկայությունը sp 3-ի հիբրիդային ուղեծրի մեջ առաջացնում է ջրածնի կատիոնի բնորոշ հավելումային ռեակցիա, ամոնիում NH 4 +. Լվացվում են ճնշման տակ սենյակային ջերմաստիճանում: Հեղուկի վիճակը կապված է ջրածնի կապի շնորհիվ: Ջերմային անկայուն: Այն ջրի մեջ լուծելի է (ավելի քան 700 լ / 1 լ H 2 O 20 ° C); հագեցած լուծույթի համամասնությունը = 34% զանգվածով եւ = 99% `ծավալով, pH = 11.8:
Բարձր ռեակտիվ, հակված են ավելացման ռեակցիաներին: Ծագում է թթվածին, արձագանքում է թթուների: Այն պարունակում է նվազեցում (N-III- ի շնորհիվ) եւ օքսիդացում (ըստ Հ 1-ի) հատկությունների: Չորացրած է միայն կալցիումի օքսիդով:
Որակական ռեակցիաները - սպիտակ «ծխի» ձեւավորումը գազային HCl- ի հետ կապակցությամբ, Hg 2 (NO 3) 2 լուծույթով խառնված թղթի սեւացում:
Միջանկյալ արտադրանքը HNO 3 եւ ամոնիումի աղերի սինթեզում: Օգտագործվում է սոդայի, ազոտի պարարտանյութերի, ներկերի, պայթուցիկ նյութերի արտադրության մեջ. հեղուկ ամոնիակը սառեցնող է: Թունավոր:
Ամենակարեւոր ռեակցիաների հավասարումները.
Ստանալովին լաբորատորիաներ - ամոնիումի ամոնիումի աղերից տեղաշարժումը, երբ ջերմաստիճանը սոդա լայմի հետ (NaOH + CaO):
կամ եռացող ամոնիակի ջրային լուծույթը, այնուհետեւ գազը չորացնելը:
Ի արդյունաբերություն ամոնիակը սինթեզվում է ազոտից (տես) ջրածնի հետ: Արդյունաբերության կողմից արտադրվել կամ հեղուկացված ձեւով կամ տեխնիկական անունով կենտրոնացված ջրային լուծույթի ձեւով ամոնիակ ջուր:
Ammonia Hydrate NH 3 H 2 O. Միջմոլորակային բարդույթ: Սպիտակ, բյուրեղյա վանդակում են NH 3 եւ H 2 O մոլեկուլները, որոնք կապված են թույլ ջրածնային կապի H 3 N ... HON. Ներկայացրեք ամոնիակի ջրային լուծույթին, թույլ բազային (լուծույթի արտադրանք `NH 4-ի եւ անիոն OH-): Ամոնիումի բորբոքումը պարունակում է պարբերաբար π-tetrahedral կառուցվածքը (sp 3 - հիբրիդացում): Thermally անկայուն, ամբողջությամբ decomposed է եռացող լուծումը. Չեզոքացնել ուժեղ թթուներով: Ցույց է տալիս նվազեցնող հատկությունները (N III- ի պատճառով) կենտրոնացված լուծույթում: Այն ներառում է ion փոխանակման եւ բարդացման արձագանքը:
Որակական արձագանքը սպիտակ «ծխի» ձեւավորումը գազային HCl- ի հետ կապակցությամբ:
Այն օգտագործվում է թույլ լուծվող լուծիչի ստեղծման համար, ամֆֆթատորային հիդրոկիդների տեղադրման ժամանակ:
1M ամոնիակային լուծույթը հիմնականում պարունակում է NH 3 H 2 O հիդրատ, եւ NH 4 + եւ OH- իոնների միայն 0,4% -ը (հիդրատի կլանման պատճառով); Այսպիսով, ionic "ammonium hydroxide NH 4 OH" պրակտիկորեն չի պարունակում լուծման մեջ, չկա նման բարդ պինդ խոնավության մեջ: Ամենակարեւոր ռեակցիաների հավասարումները.
NH 3 H 2 O (կոնց.) = NH 3 + H 2 O (եռացող NaOH- ով)
NH 3 H 2 O + HCl (dec.) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (կոնց.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (կոնց.) + ZBr 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40-50 ° C)
2 (NH 3 H 2 O) (համ.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (համ.) + Ag 2 O = 2OH + 3H 2 O
4 (NH 3 H 2 O) (կոնց.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH 3 H 2 O) (համ.) + NiCl 2 = Cl 2 + 6H 2 O
Պարզվում է ամոնիակ լուծույթը (3-10% - ժամանակ) հեղուկ ամոնիակ (անունը հորինել է ալքիմիկոսների կողմից) եւ կենտրոնացված լուծումը (18.5-25%), ամոնիակ ջուր (արտադրված արդյունաբերության):
