Neodlučan. Faze oksidacije sumpora u biljkama. Formule polukruga. Sirka. Kružna plovidba. sulfid
Sirka, njena fizikalna i kemijska snaga. Biološki značaj sirka, í̈zastosuvannya (demerkurizacija).
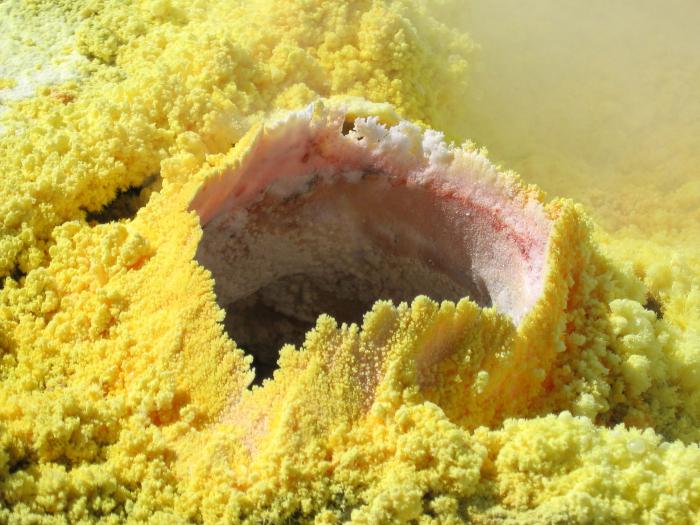
Sumpor u prirodi
rodna sirka
PbS - olovni blisk
Cu 2S- midny blisk
ZnS - mješavina cinka
FeS 2 - pirit, sirčanski pirit, mačje zlato
H 2S- optočna voda (u mineralnim vodama i prirodnom plinu)
CaSO 4*2H20- gips
MgSO 4*7H20- gírka síl (engleski)
Na 2 SO 4 * 10 H 2 O- Glauberova snaga (mirabilit)
Fizička snaga
Čvrsti kristalni govor žute boje, nejasan u vodi, voda ne mokri (pluta na površini), t ° kip = 445 ° S.
Jedna od posebnih fizičkih moći sirke -flotacija, Građevina zrnastog praha sirke se rasprši, a zatim, poput njezinih velikih kristala, tone u vodi. Na desnoj strani, u činjenici da sirka ne mokri vodom, a njene čestice su obrezane na površini vode za rahunke zalijepljene suhe lukovice oko njih.Tse vlastivist vikoristovuyut i víddílenní native írki víd domíshok. Ruda se zgnječi, zalije vodom, a odozdo se svako malo produva, sirka se ocijedi, a kuće ostave na dan.alotropija
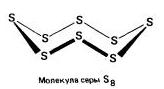
Za sirku je karakteristična papalina alotropnih modifikacija, i najčešći pogledi:rombičan (Kristal) , monoklinika(Golchasta) і plastične .
romb (a - sirka) - S8
t ° pl. = 113°C; str \u003d 2,07 g / cm 3. Najveća modifikacija.
monoklinika (b - sírka) - S8
tamno žute glave, t ° pl. = 119°C; str = 1,96 g/cm3. Stajati na temperaturi od preko 96°C; kod divljih umova pretvara se u romb.
Plastični S n
smeđa humanoidna (amorfna) masa. Nestle, kada se stvrdne, pretvara se u romb.
UKLANJANJE PLASTIČNE CIRCA
Budova atom Sirki
Distribucija elektronike po razinama i podrazinama
glavni mlin
1s 2 2s 2 2p 6 3s 2 3p 4
Distribucija elektronike po
orbitale (preostala lopta)korake
oksidacijavalencija
Uglavnom
Prvi kamp za buđenje
Još jedan kamp buđenja
otrimannya sirki
1. Promissory metoda - topljenje rude za dodatnu vodenu paru.
2. Nepotpuno oksidirani sírkovodnya (kada nije dovoljno kiselo).
2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Wakenroderova reakcija
2H 2 S + SO 2 \u003d 3S + 2H 2 O
Kemija moći svijeta
Sirka - oksidant S 0 + 2→S-2 | Sirka - vodič: S - 4 g→ S+4; S - 6 g→ S+6 |
1. Međusobna suradnja zíusima s kositrom i luzhnozemelnym metalima, middu, živa, sríblombez grijanja: 2 Na+S→ Na 2 S DOSVID S + Hg = HgS Živa je vrlo hlapljiva. Nemojte se kladiti. Ova reakcija temelji se na korištenju žive, na primjer, iz slomljenog medicinskog termometra. Mjesto, iz kojeg je nemoguće izvući kapljice žive, da cvrči vrtlog praha. Sirka i živa ulaze u reakciju kada su zatvoreni. Kao rezultat, uspostavlja se kemijski inertan i neštedi govor. Taj se proces naziva demerkurizacija 2. Međusobna suradnjac ostali metali (krim Au, Pt) pri kretanju t °: 2Al + 3S t → Al2S3 Zn+S t
°
→
ZnS DOSVID Cu+S t
→
CuS DOSVID 3. Interakcija Sirkija sasa pravim nemetalima binarni spoluk: H2+S→ H 2 S 2P+3S→ P 2 S 3 C+2S→ CS2 | 1. Interakcija sirka s kiselim: S+O2 t ° → S +4 O 2 2 S + 3 O 2 t°; pt → 2 S +6 O 3 2. Međusobna suradnjac halogeni (krema do joda): S + Cl2→ S +2 Cl 2 ** Međusobna suradnjakiseline - oksidanti: S + 2H 2 SO 4 (konc)→ 3S +4 O2 + 2H2O S + 6HNO 3 (konc)→ H 2 S + 6 O 4 + 6NO 2 + 2H 2 O ** Disproporcionalne reakcije: 4. 3S0 + 6KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
zastosuvannya
Vulkanizacija gume, uklanjanje ebonita, tretman sumporne kiseline, baruta, u borbi protiv shkidnika poljoprivrednog stanja, u medicinske svrhe (sirchani mast za liječenje kožnih bolesti), za liječenje sumporne kiseline itd.
Domaća zadaćastavak 21.; desno 1, 3, 4 strane. 99-100 (prikaz, stručni).
dopunska gradnja
Završi izjednačenje reakcija, r Postavite koeficijente metodom elektronske ravnoteže, označite oksid, vodu.
broj 2. Napravite transformaciju za shemu:
Tse tsikavo...
- Količina mlijeka u tijelu osobe težine 70 kg - 140 g.
- Dobu ljudima treba 1 g sirka.
- Siroy bogati grašak, kvasola, bijela plastika, pšenica, meso, riba, voće i mango.
- Sirka za ulazak u skladište hormona, vitamina, proteina, vode u hrskavičnom tkivu, u kosi, noktima. Kada u organizmu nedostaje sirka, javlja se plač noktiju i četkica, ispadanje kose.
Pazite na svoje zdravlje!Znaš..
- Polovica sirke može poslužiti kao ljekoviti pripravci;
- Sirka - osnova masti za liječenje gljivičnih oboljenja kože, za borbu protiv krasta. Natrijev tiosulfat Na 2S2O3 boriti se protiv nje.
- Bogate soli sumporne kiseline i vode koja usporava kristalizaciju: ZnSO 4 × 7H 2 O i CuSO 4 × 5H 2 O. Njih zastosovuyt poput antiseptika zasobi za obraskuvannya roslin i izbočenje zrna u borbi protiv skídnikov ruralne države.
- Zimski vitriol FeSO 4×7H2 O vikorist s anemijom.
- BaSO4 zastosovuyt s radiografskim nalazima kanala i crijeva.
- Aluminij kalij galon KAI (SO 4) 2×12H2 O - krvožilni zasib u poroznosti.
- Mineral Na 2 SO 4 × 10H 2 O nosite naziv "Glauberova snaga" u čast otkrića njemačkog kemičara Glaubera I.R. Nisam imao trenutak da jedem ništa; Jedan od stanovnika grada pokazuje jogom na džerel. Kao samo nekoliko vina, popivši girku slane vode, odmah sam je posadio. Glauber je završio vodu, iz nje je kristalizirala snaga Na 2 SO 4 × 10H 2 O. Infekcija í̈í zastosovuyut poput ručne prtljage u medicini, kada se puni pamučno-papirne tkanine. Također je jako dobro znati stagnaciju u skladišnom skladištu.
- Stablo može promicati gradnju od tla do tla i stimulirati glinenje elementa iz susidnih rosa.
- Urar je vidio govor - albucid, í̈dke z'êdnanny sirki. Tsya govor se bori protiv bolesti raka, podiže stare, ispred bolesti srca.
Podskupina halkogena uključuje sirku - drugi element koji izgrađuje veliki broj rodova rude. Sulfati, sulfidi, oksidi i druge poluboje također su široko rasprostranjeni, važni u industriji i prirodi. Stoga u ovom članku možemo vidjeti kakav je smrad, što je sama sirka, to je samo govor.
Sirka i njena karakteristika
Ovaj element može imati istu poziciju u periodnom sustavu.
- Shosta grupa, glavna podskupina.
- Treće malo razdoblje.
- Atomska masa - 32,064.
- Redni broj je 16, protoni i elektroni su također 16.
- Uspon na nemetalne elemente.
- U formulama se čita, kao "eu", naziv elementa je sirka, latinski sumpor.
U prirodi postoji niz stabilnih izotopa s masenim brojevima 32,33,34 i 36. Danski element je najrašireniji u prirodi. Doći do biogenih elemenata, pa kako ući u skladište važnih organskih molekula.
Elektronski Budova atom
Pola tuceta gušavosti objašnjavaju svoje razlike u značajkama elektronskog života atoma. Izražava se formulom uvredljive konfiguracije: 1s 2 2s 2 2p 6 3s 2 3p 4.
Dovođenje stvari u red više je od stacionarne stanice elementa. Međutim, očito, da bi se atomu donijela dodatna energija, tada je moguće raspršiti elektrone na 3p i 3s-pogonima, s udaljenim chervish prijelazom u 3d, koji ostaje slobodan. Kao rezultat toga, ne mijenja se samo valencija atoma, već i svi mogući stupnjevi oksidacije. Broj govora se značajno povećava, kao i broj različitih govora za sudjelovanje sirka.
Faze oksidacije sumpora u biljkama
Možete vidjeti kopiju glavnih opcija za ovaj zaslon. Za sirka tse:
Od njih se S+2 najrjeđe viđa, a ostale ruže su posvuda. Stupanj oksidacije sirke u tlu je kemijska aktivnost i oksidirajuća izgradnja cijelog govora. Tako, na primjer, z'ednannya s -2 - ce sulfid. Na njih gledamo kao na tipičan oksidacijski element.
Što je veća vrijednost stupnja oksidacije u tlu, to će oksidacijska svojstva biti izraženija u govoru. Lako se netko zbuni, pa da pogodite dvije bazične kiseline od kojih je sirka:
- H 2 SO 3 - sirchist;
- H 2 SO 4 - Sirčan.
Čini se da ostaje bogato stabilna, jača, da energija u visokoj koncentraciji još ozbiljnije gradi na oksidaciju.
jednostavan govor
Koliko god da je govor sirke jednostavan, to je žuti, lijepi kristal jednakog, pravilnog, ljubaznog oblika. Ako želite samo jedan od tri oblika, onda postoje dvije glavne linije govora. Persha, monoclinic i rombic - ce i zhovte nemoguće je uzgajati u blizini vode, ali samo u organskim prodavačima. Krykhkistyu i lijep oblik strukture, predstavljen izgledom krune, oduzimaju dah. Talište je blizu 110 0 C.
Ako ne propustite sljedeći trenutak prilikom zagrijavanja takve modifikacije, tada možete odmah pokazati još jedan mlin - plastični prsten. Vaughn je humana, viskozna boja smeđe boje, koja pri daljnjem zagrijavanju ili oštrom hlađenju ponovno prelazi u rombični oblik.
Ako govorite o kemijski čistom sirki, odsječenom putem bagatorasis filtracije, onda je to jarko žuti mali kristali, tenditní i zovsím nerazchinní u vodi. Zdatni okupirani kontaktom s vodom i kiselim vremenom. Vídríznyayutsya za postizanje visoke kemijske aktivnosti.

Znanje u prirodi
U prirodi rastu prirodni rodovi iz kojih se vidi polovično i s puta kao na jednostavan govor. Štoviše, ona će se osvetiti:
- u mineralima, rudama i planinskim stijenama;
- u organizmima stvorenja, roslina i ljudi, kako bi ušli u skladište bogatih organskih molekula;
- u prirodnim plinovima, nafti i vugill;
- u uljnim škriljcima i prirodnim vodama.
Možete li navesti neke od najbogatijih minerala na svijetu:
- cinober;
- pirit;
- sfalerit;
- antimonit;
- galena i drugi.
Veliki dio začinjene sirke je na sumpornoj kiselini virobnitstvo. Još jedan dio pobjeđuje za medicinske svrhe, stanje u zemlji, industrijske procese za proizvodnju govora.
Fizička snaga
Možete opisati koliko bodova.
- U vodi nije drugačije, u ugljičnom disulfidu ili terpentinu – dobro je biti drugačiji.
- Uz trivijalno trljanje, nakuplja se negativan naboj.
- Talište postaje 110 0 C.
- Temperatura vrenja 190 0 C.
- Kada dostigne 300 0 C, prelazi u selo, lako se mrvi.
- Čisti govor još bolje izgrađuje samozapaljivu snagu.
- Sam po sebi, miris praktički nije moguć, međutim, tijekom dana sirkovi vide oštar miris pokvarenih jaja. Tako to ide, poput i deyakí plina poput binarnih predstavnika.
Fizička snaga ovog govora bila je poznata ljudima od davnina. Zbog svoje zapaljivosti sirka je skinula takav naziv. U ratovima su pobjeđivale zagušljive i plamteće viparske pobjede, kao da su nastale pri paljenju biljke, kao da ću se boriti protiv neprijatelja. Osim toga, kiselina za sudbinu sirka je i predvodnik malog važnog zadužničkog značenja.

Kemijska snaga
Tema: "Sirka i íí̈ spoluky" u školskom tečaju kemije ne traje jedna lekcija, već kílka. Adzhe ih još bogatiji. To se objašnjava kemijskom aktivnošću ovog govora. Može pokazati kako okside snage s snažnijim agensima (metali, bor i drugi), tako i s više nemetala.
Međutim, bez obzira na takvu aktivnost, samo s fluorom interakcije idu s velikim umovima. Za sve ostale potrebno je grijanje. Možete identificirati nekoliko kategorija govora, s nekom vrstom kreativne interakcije:
- metal;
- nebacači;
- livade;
- jake oksidirajuće kiseline – sirčan i dušik.
Pola sirka: drugačije
Njihova raznolikost objasnit će se nejednakim vrijednostima stupnja oksidacije glavnog elementa - sirka. Dakle, možete vidjeti papalinu glavnih vrsta govora za ovaj znak:
- z'ednannya zí stupanj oksidacije -2;
Pa, ako pogledate klasu, a ne pokazatelj valencije, onda ovaj element stvara takve molekule, kao što su:
- kiseline;
- oksid;
- sol;
- binarne ploče s nemetalima (sulfid ugljena, kloridi);
- organski govori.
Pogledajmo sada glavne i dobro ih iskoristimo.

Govor sa stupnjem oksidacije -2
Odredi kruga 2 - sve konformacije s metalima, kao i sa:
- ugljen;
- voda;
- fosfor;
- silicij;
- mish'yak;
- bor.
U takvim raspoloženjima djeluje kao oksidacijsko sredstvo, tako da su svi elementi prezaštićeni i elektropozitivniji. Pogledajmo najvažnije od njih.
- Sirkovooglets - CS 2. Prozora domovina s karakterističnim primanjem arome etera. Ê otrovan, zapaljiv i vibuhaê s govorom. Vykoristovuetsya kao trgovac na malo, štoviše, za više vrsta ulja, masti, nemetala, srebrnog nitrata, smole i gume. Također je važan dio izrade komadnog šava - viskoze. U zanatstvu se sintetizira u velikim kulturama.
- Sirkovoden ili sulfidna voda - H 2 S. Plin, koji ne može biti zabarvlennya i sladić za užitak. Miris je oštar, vrlo neprihvatljiv, podsjeća na pokvareno jaje. Otruyny, ignorirajući dichal centar, pa se čini da su midi. Do toga, kad se slomi, dolazi do gušenja i smrti. Široko se koristi u medicini, u organskoj sintezi, u proizvodnji sumporne kiseline, a također i u kvaliteti energetski bogatog sirovina.
- Metalni sulfidi imaju široku primjenu u medicini, u proizvodnji sumporne kiseline, otrimann farb, u pripremi luminofora i drugim primjenama. Formula je Me x S y.

Z'ednannya sa stupnjem oksidacije +4
Spoki sirki 4 - tse važan oksid i vídpovídní yomu saltí i kiselina. Sav smrad treba završiti širokim pločama, koje u industriji mogu imati jedno značenje. Mogu djelovati kao oksidanti, ali češće pokazuju moć autoriteta.
Formule s poluživotom sa stadijem oksidacije +4 napreduju:
- oksid - sumporni plin SO 2;
- kiselina - sumpor H 2 SO 3;
- soli mogu dati opću formulu Me x (SO 3) y.
Jedan od najčešće korištenih je anhidrid. Vin je govor bez bara koji miriše na zapaljenu sirenu. U velikim okupljanjima nastaje tijekom erupcija vulkana, jogu je trenutno lako prepoznati po mirisu.
Otapa se u vodi s otopinom lako raspršuje kiselinu - sumpornu kiselinu. Ponašanje, poput tipičnog utvoryuê soli, u yakí ući na vidiku sulfit-iona SO 3 2-. Zei anhidrid je glavni plin, koji se ulijeva u gadnu atmosferu. Isto vino se ulijeva u svjetlo
Z'ednannya, u kojoj sirka ima razine oksidacije +6
Prije toga može se vidjeti, prije svega, sirčanin anhidrid i sirhanska kiselina s njenim solima:
- sulfati;
- hidrosulfati.
Budući da je atom sirke u njima u nadjezičnoj oksidaciji, onda je snaga ovih u potpunosti shvaćena. Smradovi su jaki oksidanti.
Oksid sumpora (VI) - sirchany anhidrid - je leteći bezbarvnu domovinu. Rižu karakterizira jaka građevina koja upija vlagu. Dimit na otvorenom. Kada se razrijedi u vodi, dajte jednu od najjačih mineralnih kiselina – sirchan. Koncentracija rozchins ê ê važna masna blago žućkasta matica. Ako se anhidrid nalazi u sumpornoj kiselini, onda će to biti posebno z'ednannya, zvano oleum. Vín vikoristovuêtsya u trgovini s proizvodnjom kiseline.
Među solima - sulfatima - velika vrijednost može biti ista, kao:
- gips CaSO4 2H2O;
- barit BaSO 4;
- mirabilit;
- olovni sulfat i drugi.
Smrad poznaje zastosuvannya u svakodnevnom životu, kemijskoj sintezi, medicini, u pripremi optičkih uređaja i naočala i nadahnjuje prehrambenu industriju.
Hidrosulfati se široko koriste u metalurgiji, a kao fluks su devikorati. I sam smrad pomaže u prevođenju bogato složenih oksida u različite oblike sulfata, koji su pobjednički u različitim varijantama.
Vivchennya sirka u školskom tečaju kemije
Ako je vjerojatnije da će znanstvenici steći znanje o onima koji su takvi sirka, yakí íí̈ autoriteti, što sirka predstavlja? 9. stupanj - najgore razdoblje. Nije sam klip, ako je djeci sve novo i nepoznato. Ovo je središnja točka u razvoju kemijske znanosti, ako će temelji, postavljeni ranije, pomoći boljem razumijevanju teme. Zato se, na prvi pogled, ova jela sami po sebi vide kao prijatelj maturantskog razreda pivrichchya. Time je cijela tema podijeljena u nekoliko blokova, a u tom slučaju je u nekim slučajevima lekcija "Z'ednannya sirki. 9. razred".
To se objašnjava njihovim brojem. Također, gledamo i hranu o proizvodnji sumporne kiseline u industriji. Općenito, ova će tema biti predstavljena sredinom 3. godine.
A os sirka je kriva za obrazovanje samo u 10. razredu, ako se gleda ishrana organskom tvari. Muči se i smrad biologije u starijim razredima. Stare Sirku da uđe u skladište takvih organskih molekula kao što su:
- tioalkohol (Merkaptani);
- proteini (struktura retine, na kojoj možete formirati disulfidne mrlje);
- tioaldehid;
- tiofenoli;
- thiopheri;
- sulfonske kiseline;
- sulfoksid i drugi.
Oni se vide kao posebna skupina organskih sumpornih spojeva. Smrad može biti važan ne samo u biološkim procesima živih bića, već iu industriji. Na primjer, sulfonske kiseline su osnova mnogih ljekovitih pripravaka (aspirin, sulfanamid ili streptocid).
Osim toga, brza sirka komponenta takvog z'ednana, kao što je deyak:
- aminokiseline;
- fermentira;
- vitamini;
- hormoni.
Na sobnoj temperaturi sumpor ulazi u reakcije samo sa živom. S porastom temperature aktivnost se značajno povećava. Kad se zagrije, sirka neselektivno reagira bagatmom jednostavnih govora, s malo vina inertnih plinova, dušika, selena, telurija, zlata, platine, iridija i joda. Sulfid u dušik i zlato odvodi se neizravnim putem.
Interakcija s metalima
Sirka pokazuje okside snage, kao rezultat toga, sulfidi se uspostavljaju u međusobnoj igri:
Interakcija s vodom vídbuvaetsya na 150-200 ° S:
H 2 + S = H 2 S.
Interakcija s Kisnemom
Gori na kiselo na 280 °C, na vatri na 360 °C, pri čemu se uspostavlja zbroj oksida:
S + O 2 \u003d SO 2;
2S + 3O 2 \u003d 2SO 3.
Interakcije s fosforom i ugljenom
Kada se zagrije bez pristupa, sirka reagira s fosforom, ugljikom, pokazujući snagu oksida:
2P + 3S = P 2 S 3;
Interakcije s fluorom
Prisutnost jakih oksidatora pokazuje značajnu snagu:
S + 3F 2 = SF 6.
Interakcija s preklopnim govorima
Kada se sučeljava sa preklopnim govorima, sirka se koristi kao vodič:
S + 2HNO 3 \u003d 2NO + H 2 SO 4.
reakcija disproporcionalnosti
Sirka zdatna prije reakcije nesrazmjera, pri interakciji s livadom, talože se sulfidi i sulfiti:
3S + 6KOH \u003d K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. otrimannya sirki
Z autohtone rude
Pri zagrijavanju pirita bez pristupa zraka
FeS 2 \u003d FeS + S.
Oksidirani sirvodnya s ne-zamrljanim kiselim
2H 2 S + O 2 \u003d 2S + 2H 2 O.
3 plina koji ulaze u metalurške i koksne peći, kada se zagrijavaju u prisutnosti katalizatora
H 2 S + SO 2 \u003d 2H 2 O + 3S.
1.8. dan cirkusa
Vodnev z'ednannya sirka - dan cirkusa H 2 S . Plovidba je kovalentna veza. Molekula vode je slična molekuli vode, atom sirke je u stanju sp 3-hibridizacije, protein na vodi u molekuli vode ne stvara vodene veze između sebe. Atom sirke je manje elektronegativan, niži atom je kisel, to je veće širenje i, kao rezultat, manji naboj. Valentni rez HSH postaje 91,1 °, duljina veze H - S doseže 0,133 nm.
Fizička snaga
U slučaju normalnih umova, cirkulacijski dan je plin bez bačve, s jakim karakterističnim mirisom pokvarenih jaja. T pl \u003d -86 ° C, T kip \u003d -60 ° C, truli u vodi, na 20 ° C 2,58 ml H 2 S se distribuira u 100 g vode. U prirodi se vidi u skladištima vulkanskih plinova, taloži se propadanjem rastućih i živih organizama. Ljubazno se razmazuje po vodi, dok se razmazuje, pravim slabu sirkovodnu kiselinu.
Kemijska snaga
U vodi kruženje vode može imati snagu slabe dvobazne kiseline:
H 2 S \u003d HS - + H +;
HS - \u003d S 2 + H +.
Sirkovoden gori na nebu blakytnym polum'yam. Uz posrednički pristup, ponovno će se besplatno uspostaviti:
2H 2 S + O 2 \u003d 2H 2 O + 2S.
U slučaju pristupa preko svijeta, potrebno je donijeti planinu sirkovodnya dok se ne otopi sumpornim oksidom (IV):
2H 2 S + 3O 2 \u003d 2H 2 O + 2SO 2.
Obilazak može donijeti moć. Voda se može oksidirati u vodi u sumpor, sumporni plin i sumpornu kiselinu.
Na primjer, vino ne sadrži bromsku vodu:
H 2 S + Br 2 \u003d 2HBr + S.
interakcija s klornom vodom:
H2S + 4Cl2 + 4H2O \u003d H2SO4 + 8HCl.
Strumine se mogu ispaliti zamjenskim olovnim dioksidom, jer je reakcija popraćena velikim vizijama topline:
3PbO 2 + 4H 2 S \u003d 3PbS + SO 2 + 4H 2 O.
Međusobna suradnja sa sumpornim plinom vikoristovuetsya za ekstrakciju sumpornog plina, što uključuje metaluršku i proizvodnju sumporne kiseline:
SO 2 + 2H 2 S \u003d 3S + 2H 2 O.
S tim procesom je bio povezan s osvjetljavanjem zavičajnih sirka tijekom vulkanskih procesa.
Jednosatnim prolazom sumpornog plina i cirkulirajuće vode uspostavlja se tiosulfat kroz otvor livade:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Obilazak s normalnim umovima je jalov, pa čak i otrovan plin s karakterističnim mirisom pokvarenih jaja.
Za jogu, u laboratorijskim mislima, počnite dodavati razrijeđenu klorovodičnu kiselinu u sulfid:
Drugi način uklanjanja sir-vode je dodavanje hladne vode aluminijevom sulfidu:
Ovako uzeta plovidba čini se čišćom.
Plovidba je kovalentna veza. Ove molekule imaju zakrivljenu strukturu, sličnu strukturi molekula vode (razd. odjeljak 2.2). Međutim, na površini vode molekule vode ne stvaraju vodene veze između sebe. S desne strane, u tome što je atom sirke manje električno negativan, niži atom je kisel, ali je atom veći. Zato atom sirke može biti bogato manje nabijen, atom je kisel. Kroz prisutnost vode zv'yazkív sirkovodny može sniziti temperaturu ključanja, niže vode. Prisutnost vodenih zvukova u sirkovodnom objašnjava se na isti način kao i trulež u vodi.
U vodi kruženje vode može imati snagu slabe dvobazne kiseline:
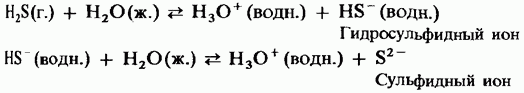
Kružna plovidba gori usred crnog polusvjetla. Uz posredni pristup, planinski zrak popraćen je vizijama slobodnog zraka, koji se kondenzira na hladnoj površini plovila:
U slučaju pristupa preko svijeta, ponovite planinski dan u danu kako biste proizveli sumporov dioksid dok se ne otopi:
Obilazak može donijeti moć. Na primjer, vino pretvara bromsku vodu i mijenja ione u ione
Plovidba kao dvobazna kiselina može sadržavati dvije serije soli - sulfidnu i hidrosulfidnu (razd. Vishche). Sulfidi lokvastih metala nalaze se u vodama lokvastih metala. Tse vydbuvaetsya kao rezultat hidrolize:
Nerafinirani sulfidi drugih metala mogu se istaložiti iz vodeno dispergiranih soli ovih metala, prolazeći kroz sulfid drugih metala. Na primjer, kada sirkovodnya prolaze kroz pukotine, da im se osvete, rješavaju crnu opsadu sulfida
Tsya reakcija vikoristovuêtsya u obliku analitičkog testa za dan.
kisikov oksid
Sirka utvoryu klica oksida, među njima najznačajnija mogu biti dva: sirka dioksid i sirka trioksid
Sirka dioksid je alkalni plin bez bureta oštrog, zagušljivog mirisa. U laboratorijskim mislima, yogo se može oduzeti, spaljivanjem sumpora u prahu ili kiselini, dodavanjem toplih razrijeđenih kiselina nekoj vrsti sulfitne soli ili zagrijavanjem koncentrirane sumporne kiseline u sredini:
Dioksid oksida sumporne kiseline. Vin se lako raspršuje u vodi, čineći ga sumpornom kiselinom. Tsya kiselina rjeđe ionizira i tada je slaba kiselina:
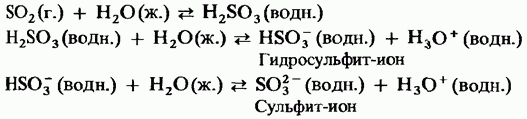
Kada se plinoviti sumpordioksid propušta kroz natrijev hidroksid, natrijev sulfit se otapa. Natrijev sulfit, reagirajući s viškom sumpor-dioksida, otapa natrijev hidrosulfit i reagira slično reakciji ugljičnog dioksida s vodom iz sjemena pamuka.
Í plinolik dioksid sirka, i yogo vode rozchin ê vídnovnikami. Na primjer, plinoviti sumporni dioksid je oksid s otopljenim sulfatom, a sumporna kiselina je spoj od -iona do iona
Sumporov dioksid se u industrijskim umovima uklanja kada je zamjenski na površini sumpornih ili sulfidnih ruda, a vikorist je međuproizvod u procesu uklanjanja sumporne kiseline (div. Ch. 7). Sirka dioksid se koristi u industriji celuloze, za proizvodnju tekstila, kao i za preradu voća i povrća s trivijalnom berbom.
Sumpor dioksid igra važnu ulogu u fermentiranoj atmosferi, a posebno u osvjetljenju kiselih šuma. U atmosferi se vina oksidiraju u sumporov trioksid:
S normalnim umom, ovaj proces se odvija ispravno, ali u prisutnosti vinskog katalizatora može se značajno smanjiti, slično kao što se koristi u kontaktnom procesu za uklanjanje sumporne kiseline. Mala količina soli i mangana, koji su prisutni u atmosferi, mogu katalizirati oksidaciju sumporovog dioksida. Otopina trioksida ponovno reagira s vodom i zato se očituje mrak, jer nosi kiselo drvo (div. Također pogl. 12).
Čvrsti sumpor trioksid je polimorfni spoj. Dva najvažnija oblika Persha među njima su trimeri s cikličkom strukturom (slika 15.24, a); prozirni kristali. može imati acikličku polimernu strukturu (slika 15.24, b); nalazi se na vidiku golchastih kristala. temperatura taljenja. U prisutnosti vode, korak po korak, prelazi u Obidvi oblike i vrije na 45 ° C. Pare sumporovog trioksida nastaju iz izoliranih simetričnih ravnih molekula.
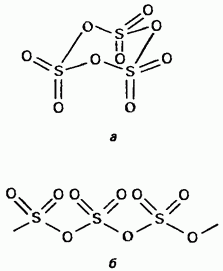
Mal. 15.24. Cirkazijev trioksid, Aciklička struktura, b - Aciklička struktura.
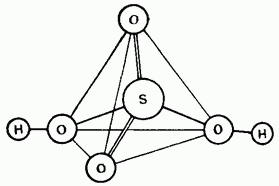
Mal. 15.25. Struktura molekule sumporne kiseline.
U laboratorijskim umovima, sumpor trioksid se eliminira zagrijavanjem sulfata
Sírky trioksid može imati snažno izraženu kiselost. Vino egzotermno reagira s vodom, gaseći sumpornu kiselinu:
Sirka trioksid je jako oksidacijsko sredstvo. Na primjer, vino oksidira bromovodik u slobodni brom.
Sirkanska kiselina
Sumporna kiselina je bezbarvna uljana kiselina. Ovo je jedan od najvažnijih industrijskih kemijskih proizvoda. Njeno promyslové otrimannya za dodatni kontaktni proces i zastosuvannya opisano u Ch. 7.
Nerazrijeđena sumporna kiselina je kovalentni spoj. Njene molekule mogu biti tetraedarske Budov (slika 15.25).
Sumporna kiselina vrije i razgrađuje se na 340 °C, gaseći sumporov trioksid i vodu
Temperatura vrenja je visoka, a viskoznost sumporne kiseline je visoka, vjerojatno zbog prisutnosti vodenih veza između atoma vode i atoma kiseline susidníh molekula.
Sumporna kiselina je jaka dvobazna kiselina. U vodi će sve više ionizirati, zadovoljavajući hidrosulfatne i sulfatne ione:
Sumporna kiselina sudjeluje u svim reakcijama karakterističnim za kiseline. Reagira s metalima, otapa sulfatne metale i vodu, u reakcijama s karbonatima otapa sulfate, ugljični dioksid i vodu, a u reakcijama sa supstratima i livadama otapa sulfate ili hidrosulfate.
Koncentrirana sumporna kiselina burno reagira s vodom. Iz tog razloga trebate razrijediti sumpornu kiselinu tako da je ulijete u vodu, a ne u rinfuzi. Tsya kiselina je higroskopna, tj. dobra glina za ponavljanje vologa. Stoga se vicor koristi za sušenje plinova, jer oni ne reagiraju s njim, prolazeći ih kroz sumpornu kiselinu. Sporidnost sumporne kiseline prema vodenim podovima je velika, a sumporna kiselina može poslužiti kao sredstvo za dehidraciju; pod utjecajem koncentrirane sumporne kiseline:
crni kristali pentahidrat sulfat otapaju bezvodni sulfat
ugljikohidrati, na primjer saharoza, su ugljenisani:
papir je također premazan koncentriranom sumpornom kiselinom, koja je premazana kiselinom na celuloznim vlaknima;
etanol se pretvara u etilen:
(Dehidracija etanola dodatnom sumpornom kiselinom, koja se provodi u kontroli
umovi, proizvode do usvajanja etoksietana (dietil etera), a reakcija pobjeđuje za eliminaciju etoksietana u industrijskoj mjeri);
zbroj klorobenzena i trikloretanala (kloral) podliježe dehidraciji (razd. odjeljak 16.3).
Koncentrirana sumporna kiselina je jako oksidacijsko sredstvo. Vaughn oksidira metale i nemetale. na primjer
Kao drugi primjer, koji ilustrira oksidacijsku moć koncentrirane sumporne kiseline, na primjer, oksidaciju iona u ione, kao i bromidnih iona u slobodni brom u napadnim reakcijama:
Nareshti, zamjenska sumporna kiselina kao sumporno sredstvo u organskoj kemiji (div. Ch. 17).
Sulfati, sulfiti i Tiospoluki
Sulfatni ion ima tetraedarsku strukturu, sličnu strukturi molekule sumporne kiseline.
Sol. Sulfati se otapaju u reakcijama razrijeđene sumporne kiseline s metalima, njihovim oksidima, hidroksidima i karbonatima. Za malo barijevog sulfata i drugih sulfata u vodi. Kalcijev sulfat može imati malu količinu u vodi. Sulfati prsten na štapiće dok se ne zagrije. Vinyatki u tsomu vídnoshení ê ílki sulfatizalíza. Na primjer, kada se zagrije, sulfat se širi u otopljeni oksid soli:
Za detekciju sulfatnih iona, u svakom slučaju, dodajte vodenu otopinu barijevog klorida. Uz prisutnost sulfatnih iona u sljedećem rasponu, kao rezultat toga, uočava se bijela precipitacija barijevog sulfata:
Sulfati mogu biti mnogo važni zastosuvan. Na primjer, magnezijev sulfat (engleski síl, gírka síl) vikorist za proizvodnju vibukhovyh govora, za pripremu syrniki i vognestíy tkanina. Broj rozchins tsíêí̈ sol vikoristovuêtsya u medicinskoj praksi kao anti-sol zasíb.
Natrijev tiosulfat se može smatrati analogom natrijevog sulfata, s jednim atomom supstitucije po atomu sumpora. Među sličnim Thiospoluki, postojala je još jedna pretpostavka - kalijev tiocijanat. Vino je jak analog kalijevog cijanata. Kalijev tiocijanat se može ukloniti spajanjem kalijevog cijanida sa sumporom:
Kalijev tiocijanat vikorira u kiselinskoj analizi za detekciju iona
Oh, učinimo to opet!
1. Prilikom prelaska u niži dio VI kategorije, čvrstoća njenih elemenata se progresivno mijenja od nemetala do metala.
2. Elementi VI skupine mogu zdatníst zadnívatsya s vodom i reakcionarnim metalima, utavlyayuschie z'êdnannya, u kojem smrad može stupíníní oksidacije -2.
3. Kisen ima visoku elektronegativnost i moć jakog oksidacijskog sredstva.
4. Ozon je snažnije oksidacijsko sredstvo, manje kisika.
5. Kisen ima iznimno važnu ulogu u biološkim sustavima, sudjelujući u respiratornim i metaboličkim procesima (razmjena govora).
6. Oksid zadovoljava s drugim puževima binarnih puževa, oksidima raznih vrsta:

7. Vodeni peroksid je jak oksidant.
8. Sirka se može koristiti u dekalnim enantiotropnim oblicima.
9. Za vađenje sirka iz podzemnih naslaga uspostavlja se Frache proces u kojem se istiskuje ponavljanje i pregrijavanje pare.
10. Sirka utvoryu spoluchy, u kojoj se nalaze u logorima s razinama oksidacije +2, +4, +6 i -2.
11. Sirkovoden - slaba dvobazna kiselina i voda.
12. Plinoviti dioksid sirka i jodna voda rozchin-vdnovniki.
13. Serica trioksid ima jaku kiselinsku i oksidnu moć.
14. Sumporna kiselina je jaka dvobazna kiselina, sredstvo za sušenje, sredstvo za dehidrataciju i jako oksidacijsko sredstvo.
15. Molekule sumporne kiseline i sulfat-iona imaju tetraedarsku strukturu.